Document
Werbung

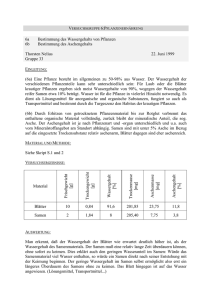
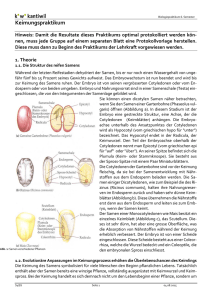
E1a Biochemische Keimprüfung Einleitung: Die Definitionen für die Keimung sind, dass die Radicula durch die Samenschale bricht (Testa) oder dass Reduktionsakivität im Samen nachgewiesen werden kann. Die Definition nach der Radicula ist nur bedingt zuverlässig, da nicht alle Samen gleichzeitig keimen und es dadurch zu ungenauen Ergebnissen kommen kann. Als Test auf Reduktionsaktivität wird als Reduktionsäquivalent farbloses, wasserlösliches TTC (Triphenyltetrazoliumchlorid) zugesetzt. Dieses wird über die pflanzlichen Dehydrogenasen mit NADH+H+ zur rot gefärbten, wasserunlöslichen Triphenylformazan-Form reduziert. Dadurch sind lebende Zellen (da sie immer Reduktionsaktivität aufweisen) rot gefärbt. Material, Methoden: Versuch wurde wie im Skript beschrieben ausgeführt. Ergebnisse: Ea1: Scutellum und Embryo der Maiskörner färben sich rot. Ea2: Embryo und Aleuronschicht der Weizenkörner färben sich rot, das Endosperm bleibt farblos. Diskussion: Ea1: Die lebenden, reduktionsauweisende Gewebe werden durch TTC rot gefärbt. Die dadurch ermittelte Keimfähigkeit lag bei 33 von 50 Samen, also bei 66%. Ea2: Außer Embryo und Scutellum ist auch die Aleuronschicht als lebendes Gewebe identifiziert, das Endosperm ist nicht gefärbt, also tot. Die Aleuronschicht schüttet bei der Keimung die notwendigen Enzyme in das tote Endosperm aus. Literaturhinweise: Pflanzenphys.skript E1b Induktion der α-Amylase durch Gibberellinsäure Einleitung: Bei der Keimung sendet der Embryo das Phytohormon Gibberellinsäure in die Aleuronschicht aus. Diese induziert durch mRNA-Bildung eine Synthese von Phosphorylasen, Lipidasen, Nucleasen, Proteasen und vor allem Hydrolasen wie die α-Amylase oder die β-Amylase, welche die Stärke (Amylose und Amylopectin) mit Hilfe der Maltose zu Glucose abbauen. Die Enzyme dringen in das Endosperm ein, bauen die dort gelagerten Reservestoffe ab und führen sie dem Embryo zu. Durch Cycloheximidin wird die Proteinbiosynthese gehemmt, es kommt zu keiner Bildung von abbauenden Enzymen. Material, Methoden: Versuch wurde wie im Skript beschrieben ausgeführt. Ergebnisse: E1b-1: Das Reagenzglas mit der Stärke und Wasser zeigt einen positiven Stärkenachweis (blau) mit Jod, das Reagenzglas mit Stärke und Darmalz zeigt einen negativen Stärkenachweis mit Jod (braun). Die anschließende Fehlingprobe ergab ein negatives Ergebnis bei Stärke+Wasser (blaufärbung) und eine deutliche, unheimlich intensive, und außergewöhnlich aussagekräftige Farbreaktion (die Lösung war rot). E1b-2: -In Medium 1 mit Embryo kam es zu einem Abbau des Nährbodens, erkennbar an den großen, hell verfärbten Höfen um die Samenhälften. -In Medium 1 ohne Embryo kam es zu einem sehr geringen Abbau des Nährbodens, erkennbar an den sehr kleinen, leicht verfärbten Höfen um die Samenhälften. -In Medium 2 (mit Gibberellinsäure) kam es zu einem Abbau des Nährbodens um die Samen herum, trotz dem Fehlen der Embryos. -In Medium 3 (mit Gibberellinsäure und Cycloheximidin) kam es zu fast keinem Abbau des Nährbodens um die embryolosen Samenhälften herum. Diskussion: E1b-1:Beim Jodtest lagern sich die Jodmoleküle in der Struktur der spiralförmigen Stärke ein. Dies verändert die Lichtbrechung, die Stärke erscheint blau. Die im Darmalz enthaltene αAmylase setzt die Stärke zu Glucose um, dadurch kann es zu keiner Reaktion mit Jod kommen. Beim Fehlingtest wird die Aldehyd-Gruppe der offenen Form von Glucose zur Zuckersäure oxidiert. Dabei wird Cu2+ zu Cu1+ reduziert, es bildet sich rotes Kupferoxid (bei diesem Versuch sehr schön zu sehen). Stärke kann mangels einer Aldehyd-Gruppe (Vollketal) nicht mit dem Kupfer der Fehling-Lösung reagieren, die Lösung bleibt blau. Halbketale Zucker (Monossacharide wie Glucose, Fructose usw) haben die Möglichkeit, sich zur offenen Form mit Aldehyd-Gruppe umzuwandeln, die mit Kupfer reagiert. Aldosen besitzen in ihrer Grundstruktur diese Aldehyd-Gruppe, Ketosen können sich über die Loby de Bruyn van Eckenstein-Umlagerung zu Aldosen umwandeln. Polysaccharide besitzen als Vollketale nicht mehr die Möglichkeit sich zur offenen Form umzuwandeln. Gruppe 6, E1b-2 Disskusion: Bei der Keimung wandert die Gibberellinsäure vom Embryo zur Aleuronschicht und aktiviert dort die Synthese von u.a. stärkeabbauenden Enzymen (α-Amylase). Diese wandern in das Endosperm und setzen dort die Reservestärke zu Maltose um, welche von weiteren Enzymen (Maltasen) Kohlenhydraten umgesetzt werden, welche vom Embryo genutzt werden können. In Medium 1 mit Embryo aktivierte die Gibberellinsäure die Synthese der α-Amylase, welche dann die Stärke im Nährboden um den Samen herum abbaute. Der Abbaubereich war im durch Jod blaugefärbten Medium als heller Hof erkennbar. In Medium 1 ohne Embryo kam es trotz fehlen des Embryos zu einem schwachen Stärkeabbau. Dies deutet auf das Vorhandensein von stärkeabbauenden Enzymen in der embryofreien Samenhälfte hin.Wahrscheinlich gibt es ein kleinen Teil von Enzymen, der schon vor der Gibberellin-Aktivierung im Samen in einer inaktiven Form vorliegt und durch das Quellen aktiviert wird. In Medium 2 wurde das endogen gebildete durch exogen zugesetzte Gibberellinsäure ersetzt. Der Stärkeabbau im Nährboden beweist, dass auch durch künstlich zugesetzte Gibberellinsäure die Aktivierung der α-Amylase-Synthese in der Aleuronschicht induziert werden kann. In Medium 3 wurde der Proteinbiosynthesen-Hemmstoff Cycloheximid zugesetzt. Dadurch wurde die von Gibberellinsäure angeregte α-Amylasen-Synthese gehemmt. Der sehr geringe Nährbodenabbau lässt sich wahrscheinlich auf das schon erwähnte Vorhandensein von wenigen stärkeabbauenden Enzymen zurückführen. Literatur: Pflanzenphys.skript E1c: Modellversuch zur Hemmung der Samenkeimung in fleischigen Früchten Einleitung: In fleischigen Früchten verhindern Hemmstoffe (insbesondere Abscisinsäure) und oft ein hoher osmotische Wert im Außenmedium ein vorzeitiges Keimen der Samen in den Früchten. ABS wirkt in geringer Konzentration keimungshemmend, der hohe osmotische Wert des Außenmediums verhinder eine Wasseraufnahme des Keimes. Als keimungshemmend wirkt sich von mehreren Isomeren nur die (+)-ABS aus. Material, Methoden: Versuch wurde wie im Skript beschrieben ausgeführt. Ergebnisse: Am ersten Tag kommt es bei den mit H2O behandelten Samen zur Keimung. Die mit Abscisinsäure behandelten Samen keimten ebenfalls, aber weniger ausgeprägt. Bei beiden Zucker enthaltenden Lösungen kam es zu keiner Keimung. Am zweiten Tag ergrünen die Keimlinge im Medium 1 (Wasser), sämtliche Samen sind gekeimt. Im Medium 2 (Abscisinsäure) sind nun fast alle Samen gekeimt, die Anfänge einer Chlorophyllsynthese in den Keimblättern ist erkennbar. In Medium 3 (Zucker) sind 1/3 der Samen gekeimt, dies ist am Durchbruch der Radicula durch die Testa erkennbar. In Medium 4 (Zucker+ABS) sind nur wenige Samen gekeimt. Am dritten Tag sind in Medium 1 und 2 grüne Kotyledonen erkennbar, in Medium 3 sind nun fast alle Samen gekeimt. In Medium 4 ist weniger als die Hälfte gekeimt. Medium 3 und 4 befinden sich noch im Anfangsstadium der Keimung (Radiculadurchbruch). Diskussion: Im Kontrollmedium kam es zu einer vollständigen, statistisch abgesicherten Keimung. Nach 2 Tagen kam es zur Photosyntheseaktivität der Kotyledonen. Das Hypokotyl wurde ca 3cm lang Der Hemmstoff Abscisinsäure löst im Samen eine Embryoruhe aus. In seiner geringen Konzentration wirkte er teilweise keimverzögernd. Die Samen sind nach 2 Tagen alle gekeimt, nach 3 Tagen nahmen die Kotyledonen Photosynthesetätigkeit auf. Das Hypokotyl wurde ca 2cm lang. Die Zuckerlösung entzieht dem Embryo durch ihren hohen osmotischen Wert das für die Keimung benötigte Wasser. Dies wirkt sich auf den Embryo keimungsverzögernd aus, da die Quellung und Aktivierung der Enzyme und Proteine so einen längeren Zeitraum benötigen. Dies spiegelt sich in der anfangs geringen Keimungsrate und der sehr langsamen Keimentwicklung. Am dritten Tag ist die durchgebrochene Radiculaspitze höchstens 3mm groß. Die Zucker-ABS-Lösung besitzt einen sehr effektiven, additiven Hemmeffekt auf den Embryo. Erst am dritten Tag keimt ein nennenswerter Prozentsatz, die durchgebrochene Radiculaspitze höchstens 1,7-2,2mm groß. Literatur: Pflanzenphys.skript E1d Keimungshemmung durch Entfernen von Sauerstoff Einleitung: Samen benötigen zum Keimen Sauerstoff. In der Anfangsphase der Keimung wird Energie über die Glykolyse (Gärung) gewonnen. Samen die in sauerstoffarmen Medium keimen (zB Reis) besitzen eine besonders effektive Glykolyse. Mit einer Hydratisierung des Embryos kommt es zu einer zunehmenden Aktivierung der Mitochondrien, und dadurch zu einem höheren Sauerstoffverbrauch (Citratzyklus und Atmungskette). Reduktionsäquivalente werden bis zur Bildung des Photosyntheseapparates über den Pentosephosphatzyklus gebildet. Sobald die Radicula die Testa (Samenschale) durchbricht, können die Mitochondrien optimal mit Sauerstoff versorgt werden. Bei mangelndem Sauerstoff kommt es zum Abbruch der Keimung. Material, Methoden: Versuch wurde wie im Skript beschrieben ausgeführt. Ergebnisse: Im Kolben mit Wasser ist die Keimung der Samen deutlich zu erkennen, im Kolben ohne Sauerstoff unterbleibt die Keimung vollständig. Diskussion: Sauerstoff ist eine der essentiellen Umweltbedingungen, die zur Keimung notwendig ist. Ein fehlen des Sauerstoffs führt zu einer völligen Keimungshemmung. Weitere Faktoren die die Keimung auch hemmen könnten wären Wassermangel, Lichtmangel und ungünstige Keimungstemperatur. Die Samen im Kontroll-Kolben keimen, da sämtliche Umweltfaktoren optimal für eine Keimung sind. Literatur: Pflanzenphys.skript