Leseprobe - beck
Werbung

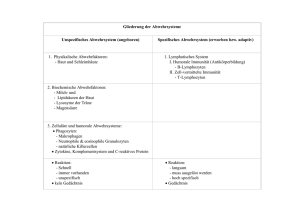
Duale Reihe Medizinische Mikrobiologie von Herbert Hof, Rüdiger Dörries erweitert, überarbeitet Duale Reihe Medizinische Mikrobiologie – Hof / Dörries schnell und portofrei erhältlich bei beck-shop.de DIE FACHBUCHHANDLUNG Thieme 2004 Verlag C.H. Beck im Internet: www.beck.de ISBN 978 3 13 125313 2 56 B 2 Strukturelemente des Immunsystems 2.1.2 Sekundäre lymphatische Organe 2.1.2 Sekundäre lymphatische Organe n Synonym n Synonym: Periphere lymphatische Organe. n Definition n Definition: Unter sekundären lymphatischen Organen werden alle lymphatischen Organe zusammengefasst, in denen die adaptive Immunantwort organisiert wird. Dazu zählen Milz, Lymphknoten und Mukosa-assoziiertes lymphatisches Gewebe (MALT). Aufbau: Prinzipiell gibt es in allen sekundären lymphatischen Organen morphologisch abgrenzbare Bereiche, die bevorzugt B- oder T-Lymphozyten beherbergen. In den peripheren lymphatischen Organen wird die spezifische Immunantwort durch Lymphozyten ausgelöst (Abb. B-2.2). Funktion: Funktionell entsprechen die sekundären lymphatischen Organe einem großen Marktplatz, auf dem Antigene aus Organen und dem Blutkreislauf präsentiert werden. Bei Erkennen dieser Antigene durch rezirkulierende Lymphozyten wird in mehreren Schritten die spezifische Immunantwort ausgelöst (Abb. B-2.2): B-2.2 B-2.2 Rezirkulation von Lymphozyten afferente Lymphbahn 2 1 peripherer Lmyphknoten 3 4 efferente Lymphbahn 6 Organ Milz Schleimhaut MALT Blutkreislauf Antigen naiver Lymphozyt Effektorzelle 5 Bei Eindringen eines Infektionserregers (Antigen) in ein Organ werden Bruchstücke davon über afferente Lymphbahnen in die nächsten regionalen Lymphknoten verbracht (1). Im Lymphknoten treten rezirkulierende naive Lymphozyten aus dem Blutkreislauf aus und durchwandern das lymphatische Gewebe (2). Erkennen sie erregerspezifische Strukturen, werden sie aktiviert und differenzieren zu Effektorzellen, die das lymphatische Gewebe in der efferenten Lymphbahn verlassen (3) und über den Ductus thoracicus in den Blutkreislauf eintreten. An aktivierten Endothelzellen verlassen Effektorlymphozyten wieder den Blutkreislauf, treten in das Gewebe ein und vernichten den eingedrungenen Infektionserreger (4). Antigene, die in den Schleimhäuten lokalisiert sind, werden im Mukosa-assoziierten lymphatischen Gewebe (MALT) den extravasierten naiven Lymphozyten präsentiert (5). Auch hier fließen differenzierte Effektorzellen über efferente Bahnen ab und treten wieder in den Blutkreislauf ein. In der Milz treffen naive Lymphozyten auf Antigene, die sich im Blutkreislauf befinden und in die periarteriellen Ansammlungen von Lymphozyten verbracht werden (6). Antigenspezifische Lymphozyten werden zu Effektorzellen differenziert, die über die abführende Vene wieder in den Blutkreislauf eintreten. Hof/Dörries, Duale Reihe: Medizinische Mikrobiologie (ISBN 3-13-125313-4), c 2005 Georg Thieme Verlag 57 B 2.1 Organe des Immunsystems Extravasation naiver Lymphozyten: Naive Lymphozyten (s. o.) verlassen in den sekundären lymphatischen Organen den Blutkreislauf. Differenzierung zu Effektorzellen: Erkennt ihr Antigenrezeptor das angebotene Antigen, kommt es zu einer Phase massiver Zellteilung mit nachfolgender Differenzierung zu Effektorzellen. adaptive Immunantwort: Diese Effektorzellen verlassen die Organe über die abführenden Gefäßbahnen und erreichen über den Blutkreislauf die Orte, an denen das Antigen in den Organismus eingedrungen ist. Hier üben sie die während ihrer antigenabhängigen Differenzierungsphase erworbenen Effektorfunktionen aus. n Definition: Effektorzellen der adaptiven Immunreaktion sind differenzierte Lymphozyten, die ihre Fähigkeit zur Abwehr von Infektionserregern und zur Eliminierung von Antigenen ausüben, ohne dass eine weitere Stimulierung notwendig ist. n Merke: Die sekundären lymphatischen Organe sind die Orte der Präsentation von Antigenen und deren Erkennung durch naive Lymphozyten. Dieses löst die Differenzierung der Lymphozyten zu Effektorzellen und somit die spezifische Immunantwort aus. m Definition m Merke Lymphozyten, die keinen passenden Antigenrezeptor besitzen und daher nicht in eine Immunantwort verwickelt sind, erhalten Signale zum weiteren Überleben und zum Rezirkulieren, damit ihre Chancen auf ein Zusammentreffen mit „ihrem“ Antigen erhöht werden. Die Milz Die Milz Anatomie: Die Milz liegt als größtes sekundäres lymphatisches Organ unterhalb des Zwerchfells mit Kontakt zu Niere und Magen. Von ihrer Bindegewebskapsel ausgehende Trabekel bilden das Gerüst für das dazwischenliegende retikuläre Bindegewebe. Dessen größter Anteil wird von der roten Pulpa gebildet. Innerhalb der roten Pulpa lassen sich helle Punkte ausmachen, die durch Leukozyten gebildete weiße Pulpa. Äste der A. lienalis verlaufen nach Durchtritt durch die Milzkapsel zunächst entlang der Trabekel. Auf ihrem weiteren Weg zweigen sie sich auf und treten in die Pulpa ein. Dort werden sie von Lymphozyten umgeben, die sich in Form einer länglichen oder kugeligen Hülle anordnen. In dieser periarteriolen Hülle teilt sich die zentrale Arterie pinselartig in Arteriolen auf, die nachfolgend im Gewebe Kapillaren ausbilden. Der venöse Abfluss erfolgt über venöse Sinus und Pulpa- bzw. Trabekelvenen in die V. lienalis. Feinbau: In den periarteriolen Hüllen findet sich eine sehr charakteristische Anordnung der T- und B-Lymphozyten (Abb. B-2.3). Während die T-Zellen die zentrale Arteriole direkt umgeben (periarteriolar lymphoid sheath, PALS), bilden B-Zellen Follikel aus, die auf der PALS angeordnet sind. PALS und B-ZellFollikel werden von einer Rand- oder Mantelzone umgeben, die T- und B-Lymphozyten enthält. An den Kontaktstellen zwischen PALS und B-Zell-Follikeln lassen sich Zonen aufgelockerter Zelldichte mit großen Lymphozyten erkennen (Keimzentrum). In der weißen Pulpa der Milz bilden T-Lymphozyten eine periarterielle Hülle (PALS) aus, auf der B-Lymphozyten in Follikeln angeordnet sind (Abb. B-2.3). Funktion: Da die Milz keine afferenten Lymphbahnen hat, werden die Antigene über die zuführende Arterie von dendritischen Zellen herangebracht und den Lymphozyten präsentiert. n Exkurs: Nach Verlust der Milz (Splenektomie) besteht eine erhöhte Infektanfälligkeit, die zu einer oft tödlichen Sepsis führen kann („overwhelming post splenectomy infection“, OPSI; s. S. 316). m Exkurs Hof/Dörries, Duale Reihe: Medizinische Mikrobiologie (ISBN 3-13-125313-4), c 2005 Georg Thieme Verlag 58 B 2 Strukturelemente des Immunsystems Struktur und Funktion der Milz B-2.3 venöse Sinus Kapsel Weiße Pulpa: Follikel und PALS lymphatisches Follikel (überwiegend B-Lymphozyten) Rote Pulpa 3 5 Trabekel zentrale Arterie periarteriole Scheide (PALS) (überwiegend T-Lymphozyten) 2 6 Vene Randzone 1 Arterie 4 Keimzentrum (B-Lymphozyten 70 - 90% T-Lymphozyten 10 - 30%) Die Milz wird von einer Bindegewebskapsel umgeben, die durch Fortsätze (Trabekel) in das Organ ein Gerüst für das retikuläre Bindegewebe ausbildet. Der größte Anteil dieses Bindegewebes stellt die rote Pulpa dar, in der sich Ansammlungen von Leukozyten in Form der weißen Pulpa befinden. Lymphozyten treten über die zuführende Arterie in die Milz ein (1). T-Lymphozyten lagern sich als periarteriole Scheide (PALS) um fein verästelte Arteriolen ab (2), B-Lymphozyten sind als lymphatische Follikel auf der PALS angeordnet (3) und stellen einen großen Teil der Lymphozyten dar, die sich in der Randzone der weißen Pulpa befinden. Bei Erkennung eines Antigens in der PALS bildet sich in den Follikeln ein Keimzentrum aus, in dem B-Lymphozyten mit der Hilfe von T-Lymphozyten in antikörperproduzierende Plasmazellen differenzieren (4). Effektor-Lymphozyten werden über venöse Sinus (5) der abführenden Vene zugeführt und verlassen so die Milz (6). Histologisches Bild: Ein Gefrierschnitt von der Milz einer Ratte wurde mit einem spezifischen Antikörper für B-Lymphozyten gefärbt. Der rote Farbniederschlag kennzeichnet die Lokalisation der B-Zellen. Neben ihrer Rolle als Organ des Immunsystems hat die Milz auch die Funktion, in der roten Pulpa gealterte rote Blutkörperchen abzubauen. Die Lymphknoten Die Lymphknoten Anatomie: Der Aufbau der Lymphknoten ähnelt mit Kapsel und Trabekeln dem der Milz. Zwischen retikulärem Gewebe und der Bindegewebskapsel liegt der Randsinus, über welchen die Lymphe aus den afferenten Lymphbahnen den Lymphknoten erreicht. In den Lymphknoten (Abb. B-2.4) siedeln sich T-Lymphozyten unterhalb der Rindenregion (parakortikal) an. Follikel von B-Lymphozyten finden sich in der Rindenregion (kortikal). Feinbau: Das retikuläre Bindegewebe ist mit Lymphozyten durchsetzt, welche typischerweise in den Randbereichen (Kortex) eine höhere Dichte als im Zentrum (Medulla) aufweisen (Abb. B-2.4). Kortikal finden sich überwiegend B-Lymphozyten, die sich in Follikeln organisieren. Hier liegen – ähnlich wie in den B-Zellfollikeln der Milz – Keimzentren (S. 57). Von den kortikalen B-Zellbereichen werden Markstränge in die Medulla fortgesetzt. T-Lymphozyten halten sich gemeinsam mit antigenpräsentierenden dendritischen Zellen parakortikal Richtung Medulla auf. Funktion: Mit der Lymphe werden Antigene aus den Geweben bzw. antigenpräsentierende dendritische Zellen oder Makrophagen herangeführt (S. 107). Die dendritischen Zellen lokalisieren sich in den parakortikalen T-Zellbereichen. Hof/Dörries, Duale Reihe: Medizinische Mikrobiologie (ISBN 3-13-125313-4), c 2005 Georg Thieme Verlag 59 B 2.1 Organe des Immunsystems B-2.4 Struktur und Funktion eines Lymphknotens B-2.4 efferente Lymphbahn afferente Lymphbahn Vene Arterie 5 Randsinus Marksinus Bindgewebshülle 1 4 Keimzentrum Markstränge (Plasmazellen, Makrophagen) afferente Lymphbahn 2 3 kortikale lymphatische Follikel (B-Lymphozyten) Parakortex (T-Lymphozyten) afferente Lymphbahn Ähnlich der Milz wird auch ein Lymphknoten von einer Bindegewebshülle umgeben, die Trabekel in das Organ vortreibt. Zwischen dem retikulären Gewebe und der Kapsel liegt der Randsinus, in den die afferenten Lymphbahnen aus den Organen münden. Rezirkulierende Lymphozyten treten über die zuführende Arterie in den Lymphknoten ein (1) und verlassen an besonderen venösen Epithelien den Blutkreislauf (2). T-Lymphozyten wandern in die parakortikalen Bereiche, während B-Lymphozyten sich in den kortikalen lymphatischen Follikeln ansiedeln. Über die afferenten Lymphbahnen werden Antigene aus den Organen herangeführt (3) und nachfolgend den extravasierten Lymphozyten präsentiert. Bei Erkennung eines Antigens wird eine spezifische Immunantwort ausgelöst, in deren Verlauf es zur Ausbildung eines Keimzentrums kommt, in dem B-Lymphozyten mit Hilfe von T-Lymphozyten differenzieren (4). Differenzierte Effektorlymphozyten werden über den Marksinus und die efferente Lymphbahn wieder dem Blutkreislauf zugeführt (5). Das schleimhautassoziierte lymphatische Gewebe Das schleimhautassoziierte lymphatische Gewebe n Synonym: mucosa-associated lymphoid tissue (MALT). m Synonym n Definition: Zum schleimhautassoziierten lymphatischen Gewebe (MALT) zählen das bronchienassoziierte (BALT) und das darmassoziierte (gut-associated, GALT) lymphatische Gewebe mit Tonsillen, Blinddarm und den PeyerPlaques des Dünndarms. m Definition Anatomie und Feinbau: Da die Gesamtheit der Schleimhäute eine riesige Oberfläche darstellt, die von Infektionserregern überwunden werden kann, enthält das MALT so viele Lymphozyten wie alle anderen lymphatischen Gewebe des Körpers zusammen. Das MALT zeigt, wenn auch in abgewandelter Form, den typischen Aufbau eines sekundären lymphatischen Organs. Am Beispiel der Peyer-Plaques des Dünndarms wird dies deutlich (Abb. B-2.5): Ein großer B-Zellfollikel liegt innerhalb der Darmwand und wird zur luminalen Seite des Darms durch eine Schicht von speziellen Epithelzellen abgegrenzt. Diesen fehlt im Gegensatz zu anderen Darmepithelzellen der typische Bürstensaum. Sie bilden eine Kuppel über dem lymphatischen Gewebe (Dome) und sind in der Lage, Antigene aus dem Darmlumen transzellulär zu den PeyerPlaques zu transportieren. Im lymphatischen Gewebe des Darmes bilden B-Lymphozyten große Follikel in der Darmwand, zwischen denen kleinere Ansiedlungen von T-Lymphozyten angeordnet sind (Abb. B-2.5). Hof/Dörries, Duale Reihe: Medizinische Mikrobiologie (ISBN 3-13-125313-4), c 2005 Georg Thieme Verlag