Biochemische Reaktionen (im Citrat
Werbung

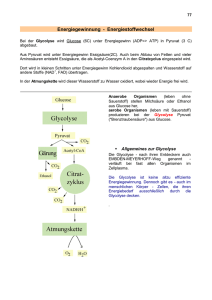
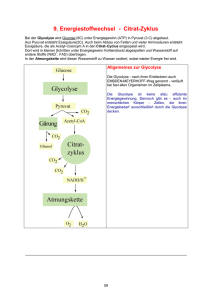
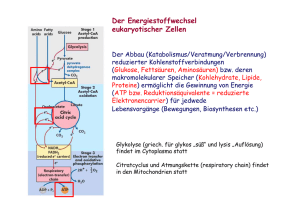
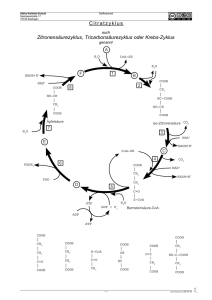
11 Biochemische Reaktionen (im Citrat-Zyklus) Transaminierung Bei diesem Prozess wird die -Aminogruppe auf eine -Ketosäure (2-Oxosäure) übertragen, wobei aus der Aminosäure eine -Ketosäure wird und aus der vorherigen -Ketosäure eine Aminosäure. Da die Transaminierung reversibel ist, kann der Körper auch umgekehrt aus Ketosäuren -Aminosäuren herstellen. Durch diesen Prozess können nicht essentielle Aminosäuren für die Proteinbiosynthese werden. Beispiele: Alanin Pyruvat (Brenztraubensäure) NH2 C O C C COOH Phenylalanin C COOH Phenylpyruvat (Phenylbrenztraubensäure) O NH2 C C C C COOH COOH http://www2.chemie.uni-erlangen.de/projects/vsc/chemie-mediziner-neu/aminosaeuren/transam-d.html Decarboxylierung Als Decarboxylierung bezeichnet man eine chemische Reaktion, bei der aus einem Molekül Kohlenstoffdioxid CO 2 abgespalten wird. Durch Enzyme (Decarboxylasen) kann eine Decarboxylierung besonders leicht bei Carbonsäuren (bevorzugt: β-Ketosäuren und Aminosäuren) erfolgen. O O C C C COOH Decarboxylase C C -Ketobuttersäure wird zu Aceton decarboxyliert. C 12 Hydrierung/Dehydrierung Als Hydrierung bezeichnet man eine chemische Reaktion, bei der an eine Doppelbindung 2 HAtome angelagert werden. Bei einer Dehydrierung werden aus einem Molekül 2H-Atome eliminiert. Enzyme: Hydrogenasen/Dehydrogenasen (reversible Reaktion) Beispiel: Lactat Pyruvat OH C COOH C LactatDehydrogenase LDH -2H + O C C COOH + NAD /NADH-H H Beispiel: Succinat Fumarat HOOC H H C C H H SuccinatDehydrogenase -2H H HOOC COOH FAD/FADH2 C C COOH H http://de.wikipedia.org/wiki/Nicotinamidadenindinukleotid http://de.wikipedia.org/wiki/FADH2 Hydratisierung/Dehydratisierung Als Hydratisierung bezeichnet man eine chemische Reaktion, bei der (an ein Molekül) Wasser angelagert wird. Bei der Dehydratisierung wird ein Wassermolekül abgespalten. Enzyme: Hydratasen/Dehydratasen (reversible Reaktion) Beispiel: Fumarat Malat H HOOC C C COOH FumaratHydratase* + H2O - H 2O HOOC H oder/bzw. *: Fumarase HOOC OH H C C H H H H C C H OH COOH COOH 13 Oxidative Decarboxylierung Die aus der Glycolyse stammende BTS diffundiert in die Mitochondrien und wird durch den Multienzymkomplex Pyruvatdehydrogenase zu Acetyl-CoA umgebaut. Diesen sehr komplizierten Prozess bewerkstelligen die im Enzymkomplex zusammengeschlossenen 3 Enzyme und 5 Koenzyme. Die Koenzyme sind: Coenzym A, Liponsäure, Thiaminpyrophosphat, NAD (Nicotinsäureamid-Adenin-Dinukleotid) und FAD (= Flavinadenindinukleotid). Bilanzmäßig sind jedoch nur Coenzym A und NAD wichtig. Die Carboxylgruppe der Brenztraubensäure wird als CO2 abgespalten. Der ebenfalls freiwerdende Wasserstoff und die Elektronen werden von NAD aufgenommen. Der übrigbleibende Essigsäurerest wird an das Coenzym A über die reaktive -SH-Gruppe gebunden. Man spricht deshalb auch von aktivierter Essigsäure. Die Reaktion ist wegen der Freisetzung großer Mengen freier Enthalpie irreversibel ( G= - 33,6 KJ/Mol). Coenzym A wird in der Zelle aus dem Vitamin der B2-Gruppe Pantothensäure gebildet. Acetyl-CoA FAD Klicken Sie hier zur 3D-Darstellung! Klicken Sie hier zur 3D-Darstellung! In Abb. 21 ist die genaue Struktur des Coenzyms A abgebildet. Thiaminpyrophosphat, das ebenfalls an der Decarboxylierung beteiligt ist, wird aus dem Vitamin B1 gebildet, FAD aus B2. 14 Citrat-Zyklus (Zitronensäure-Zyklus) http://de.wikipedia.org/wiki/Citratzyklus http://www.zum.de/Faecher/Materialien/beck/12/bs12d.htm?bs12-22.htm Was ist das Ziel des Citrat-Zyklus ? Die Glycolyse lieferte ja bereits etwas Energie. Glucose wurde gespalten, und aus jedem Glucosemolekül konnten im Endeffekt 2 ATP gewonnen werden. Wenn den Zellen allerdings Sauerstoff zur Verfügung steht, ist eine wesentlich effektivere Oxidation der Glucose möglich, so dass viel mehr ATP gebildet werden kann. In den Zellen findet eine Knallgasreaktion statt, in der Wasserstoff und Sauerstoff zu Wasser reagieren. Natürlich wird hier kein gasförmiger Wasserstoff eingesetzt, sondern chemisch gebundenen Wasserstoff, z.B. in Form von NADH/H + oder FADH 2 (Co-Enzyme bei der Dehydrierung bzw. Oxidation). Dieser chemisch gebundene Wasserstoff muss aber erst einm al gewonnen werden. Organische Verbindungen wie Glucose enthalten jede Menge Wasserstoff (ein Glucose-Moleküle besitzt z.B. 12 H-Atome), und die Zelle muss es irgendwie schaffen, den organischen Molekülen möglichst viel von diesem Wasserstoff zu entziehen. Um dies zu schaffen, hat die Natur den Citratzyklus (Zitronensäurezyklus) "erfunden". Das Ziel dieses zyklischen Prozesses kann wie folgt formuliert werden: Aus dem Endprodukt der Glycolyse (dem Pyruvat) sollen möglichst viele H-Atome gewonnen werden (in Form von Form von NADH/H + oder FADH2), damit diese dann unter ATP-Bildung mit Sauerstoff reagieren können. Ziel des Citratzyklus Die Abbildung hier zeigt, wie ein Teilschritt des Citratzyklus ein + NAD -Teilchen reduziert, und wie + das so gewonnene NADH/H anschließend unter ATP-Bildung mit Sauerstoff zu Wasser reagiert. Grundprinzip und Übersicht Der in den Mitochondrien ablaufende Citratzyklus (Zitronensäurezyklus) ist einer der wichtigsten Stoffwechselwege überhaupt. Er nimmt eine zentrale Stellung im Rahmen der aeroben Dissimilation ein In einem vorgeschalteten Schritt reagiert das Pyruvat aus der Glycolyse mit dem Coenzym A. Das Pyruvat gibt eine COOH-Gruppe in Form von CO2 ab, und die beiden restlichen C-Gruppen werden an das Coenzym A angelagert, es entsteht das sogenannte Acetyl-Coenzym A. Da diese Reaktion gleichzeitig eine Oxidation ist, kann der freigesetzte Wasserstoff auf NAD+ übertragen werden. Bereits bei dieser vorbereitenden Reaktion entsteht also ein NADH/H + pro Pyruvat-Molekül, also zwei pro Glucose-Molekül. Das Acetyl-Coenzym A überträgt den Acetyl-Rest dann auf eine Verbindung namens Oxalacetat, welche aus 4 C-Gruppen besteht. Es ensteht dabei das Citrat (6 C-Gruppen). Nach dieser organischen Verbindung hat der ganze Zyklus seinen Namen: Citratzyklus oder Zitronensäurezyklus. 15 Und jetzt passiert etwas Eigenartiges. Das Citrat wird in mehreren Schritten abgebaut, bis am Ende wieder Oxalacetat vorliegt. Dabei wird zweimal Kohlendioxid abgegeben, welches aber nur als Abfallprodukt anzusehen ist (obwohl da die grünen Pflanzen anderer Meinung sind, sie leben schließlich vom Kohlendioxid) Viel wichtiger aber: während dieser vielen Abbauschritte wird fleißig NADH/H+ gewonnen. Die meisten Abbauschritte sind nämlich Oxidationsreaktionen, die Wasserstoff freisetzen, der dann vom NAD+ aufgenommen wird. 16 Citrat – Zyklus im Detail http://www.u-helmich.de/bio/stw/reihe3/citrat1.htm; http://www.u-helmich.de/bio/zell/4/index.html Vorbereitung: Herstellung von Acetyl-CoA aus Coenzym A und Pyruvat Enzym: Pyruvat-Dehydrogenase Diese Reaktion gehört eigentlich nicht zum Zyklus selbst, sondern wird als letzter Schritt der Glycolyse bzw. des Fettsäure-Abbaus angesehen. Das Coenzym A tritt bei dieser Reaktion als Überträger eines C2-Körpers auf. + + Pyruvat + NAD + CoA ----> Acetyl-CoA + NADH/H + CO2 Diese Reaktion wird durch den Multi-Enzym-Komplex Pyruvat-Dehydrogenase katalysiert. Die Reaktion verläuft exotherm. Wie man der Reaktionsgleichung entnehmen kann, findet nicht nur eine Decarboxylierung statt (Abspaltung von Kohlendioxid), sondern das Pyruvat wird auch noch oxidiert (Reduktion von NAD). Schritt 1: (nicht reversibel) Bildung von Citrat Im diesem ersten Schritt des Citratzyklus entsteht aus dem Oxalacetat und dem Acetyl-Coenzym A der C6Körper Citrat: Acetyl-CoA + Oxalacetat + H2 O ----> CoA + Citrat Diese exotherme Kondensation wird durch das Enzym Citrat-Synthase katalysiert. Der 1. Schritt ist geschwindigkeitsbestimmend für den gesamten Citrat-Zyklus. Wird die Citrat-Synthetase gehemmt, so läuft quasi nichts mehr. Enzym: Citrat-Synthetase Die Geschwindigkeit des 1. Schrittes hängt im wesentlichen von drei Faktoren ab: 1. Konzentration des Acetyl-Coenzym A 2. Konzentration des Oxalacetats 3. Konzentration der Verbindung Succinyl-Coenzym A Dass die Geschwindigkeit von den beiden ersten Faktoren abhängt, dürfte klar sein (Motto: wo nichts ist, kann auch nichts reagieren). Bei Punkt 3 handelt es sich um eine kompetitive Hemmung; das Succinyl-Coenzym A hat eine ähnliche Struktur wie das Acetyl-Coenzym A und konkurriert mit diesem um die Citrat-Synthetase. Je mehr nun SuccinylCoA vorhanden ist, desto geringer wird die Umsetzungsgeschwindigkeit. Liegt genug energiereiches ATP und NADH vor, wird die Citrat-Synthetase ebenfalls gehemmt (allosterische Hemmung). 17 Schritt 2: (reversibel) Isomerisierung: Citrat - Isocitrat Hier handelt es sich um eine typische Isomerisierung, wie wir sie bereits beim 2. Schritt der Glycolyse kennengelernt haben. Die Strukturformel des Citrats wird nur geringförmig geändert, indem eine OH-Gruppe und ein H-Atom ihren Platz tauschen. Dadurch gelangt die OH-Gruppe an das zweite C-Atom von unten und kann anschließend im dritten Schritt oxidiert werden. Würde diese OH-Gruppe noch an der alten Position sitzen, so wäre keine Oxidation zur Carbonylgruppe C=O möglich (das dritte C-Atom von unten müsste dann fünfbindig sein). Enzym: Aconitase Interessant ist, dass das Gleichgewicht dieser Reaktion stark auf der Seite des Citrats liegt (93%). Durch die nachfolgenden Reaktionsschritte wird dem Zyklus jedoch ständig Isocitrat entzogen, so dass auch ständig neues Citrat zu Isocitrat umgesetzt wird. Info für Chemiker: Zunächst wird ein Wassermolekül abgespalten. Es bildet sich eine C=C-Doppelbindung. (die Verbindung heißt Aconitat). Dann wird ein Wassermolekül addiert. Dabei erhält das andere C-Atom die OH-Gruppe. Schritt 3: (reversibel) Oxidation (Dehydrierung) von Isocitrat Das Isocitrat gibt zwei Wasserstoff-Atome ab und wird dadurch oxidiert. Die Wasserstoffatome werden durch NAD aufgenommen. Das Oxalsuccinat (Oxalbernsteinsäure) wird nicht freigesetzt, sondern bleibt an das Enzym gebunden und wird vom gleichen Enzym sofort zu Ketoglutarat umgesetzt (Schritt 4). Enzym: Isocitrat-Dehydrogenase IDH Schritt 4: (reversibel) Decarboxylierung von Oxalsuccinat Enzym: Isocitrat-Dehydrogenase IDH Aus Oxalsuccinat (Oxalbernsteinsäure) bildet sich in einer exothermen Reaktion Ketoglutarat. Dabei wird Kohlendioxid abgespalten. Insgesamt wurden zu diesem Zeitpunkt bereits zwei Kohlendioxidmoleküle abgespalten: das erste bei der Bildung des Acetyl-Coenzym A, das zweite bei der Bildung von Ketoglutarat. Man bedenke, dass es das im Citratzyklus gebildete Kohlendioxid ist, welches wir beim normalen Atmen ausatmen. Die Isocitrat-Dehydrogenase ist für die beiden Schritte 3 und 4 verantwortlich. Es handelt sich um ein allosterisches Enzym, welches durch ADP aktiviert und durch ATP und NADH gehemmt wird. 18 Schritt 5: (nicht reversibel) Bildung von Succinat Enzyme: Ketoglutarat-Dehydrogenase (-KGDH) Succinyl-CoenzymA Dieser Schritt ist sehr kompliziert, weil eine Vielzahl chemischer Reaktionen gleichzeitig ablaufen. Ein einzelnes Enzym reicht zur Beschleunigung der Reaktion nicht aus, es werden mehrere Enzyme benötigt, die Hand in Hand arbeiten, ein so genannter Multienzymkomplex. Der erste Teilschritt ähnelt in vieler Hinsicht der Einstiegsreaktion in den Citratzyklus. Dort wurde Pyruvat auf CoA übertragen, verlor dabei eine Carboxylgruppe in Form von CO 2, und wurde gleichzeitig oxidiert, so dass Reduktionsprodukte in Form von NADH freiwurden. Genauso ist es hier: Es wird Ketoglutarat auf CoA übertragen, auch hier wird Kohlendioxid freigesetzt, und das Substrat wird ebenfalls oxidiert, so dass NADH gebildet werden kann. Das Endprodukt des ersten Teilschrittes heißt SuccinylCoenzym A. Ketoglutarat + CoA + NAD+ ---> Succinyl-CoA + NADH/H+ + CO 2 Diese Oxidation und Decarboxylierung ist sehr exotherm. Die Aufgabe des Coenzym A ist es, den bei der Decarboxylierung des Ketoglutarats entstandenen C4-Körper (Succinat) zu binden und zum nächsten Enzym des Citratzyklus zu übertragen. Nach dieser Übertragung wird das Coenzym A wieder freigesetzt: Succinyl-CoA + GDP/Pi ---> Succinat + CoA + GTP Wie man sofort sieht, ist auch diese Reaktion exotherm, sonst könnte kein energiereiches GTP gebildet werden. Schritt 6: (nicht reversibel) Dehydrierung (Oxidation) von Succinat Bildung von Fumarat Enzym: Succinat-Dehydrogenase Die Succinat-Dehydrogenase oxidiert das Succinat zu Fumarat. Hauptzweck dieses Schritts ist die Gewinnung von Wasserstoff in Form von FADH2 . Gleichzeitig wird aber auch der 8. Schritt vorbereitet, bei dem ebenfalls Wasserstoff gewonnen wird - wir erinnern uns: Der eigentliche Sinn des Zitratzyklus ist die Bereitstellung von möglichst viel Wasserstoff, damit die Atmungskette angetrieben werden kann. 19 Schritt 7: (reversibel) Hydratisierung von Fumarat Bildung von Malat Es wird ein Wassermolekül an die Doppelbildung addiert. Sinn und Zweck dieses Schrittes ist es, den nächsten zu ermöglichen, bei dem dann die neue OH-Gruppe oxidiert + wird, um wieder NADH/H zu gewinnen. Enzym: Fumarase (Fumarat-Hydratase) Schritt 8: (reversibel) Dehydrierung (Oxidation) von Malat Bildung von Oxalacetat In diesem letzten Schritt des Citratzyklus wird nun endlich das Oxalacetat regeneriert. Die soeben angelagerte OH+ Gruppe wird oxidiert, es entsteht noch einmal NADH/H . Interessanterweise ist diese Reaktion ziemlich endotherm, und das chemische Gleichgewicht liegt stark auf der linken Seite. Die Reaktion kann daher nur ablaufen, wenn die Malat-Konzentration hoch und die Oxalacetat-Konzentration niedrig ist. Enzym: Malat-Dehydrogenase MDH http://www.uni-koeln.de/med-fak/biochemie/biomed/wisspro/martin_kuder.html http://de.wikipedia.org/wiki/Citratzyklus http://pharm1.pharmazie.uni-greifswald.de/biochem/4_2.htm http://www.zum.de/Faecher/Materialien/beck/12/bs12d.htm?bs12-22.htm http://www.vetbio.unizh.ch/teaching/multimedia/istw-i/S098/S098.swf http://www.uni-leipzig.de/~biochem/V2006/F12.pdf 20 Citrat-Zyklus im Überblick 21 Aminosäure-Synthese im Citrat-Zyklus http://www.biologie.uni-hamburg.de/b-online/d19/19e.htm#13 http://de.wikipedia.org/wiki/Alanin-Aminotransferase http://www.med-school.de/skripte/open/o-biochemie-referat-leber.pdf http://www.med4you.at/laborbefunde/laborbefunde.htm Alanin-Aminotransferase(ALT,ALAT) wird auch als Glutamat-pyruvat-Transaminase (GPT) bezeichnet und ist ein Enzym, das vor allem im Zytoplasma von Leberzellen vorkommt. Es benötigt für seine Funktion das Coenzym Pyridoxalphosphat (Vitamin B6). Es katalysiert die Reaktion L-Alanin + α-Ketoglutarat Pyruvat + L-Glutamat Labordiagnostik: In der Labordiagnostik wird die Aktivität der ALT aus Plasma oder Serum bestimmt um abzuklären, ob eine Leber- oder Gallenwegserkrankung vorliegt Aspartat-Aminotransferase (AST,ASAT) wurde früher auch als Glutamat-OxalacetatTransaminase (GOT) bezeichnet und ist ein Enzym, das in Leber, Niere, Herz, Skelettmuskulatur, Pankreas, Milz, Lunge und in den Erythrozyten vorkommt. Es benötigt für seine Funktion das Coenzym Pyridoxalphosphat (Vitamin B6). Es katalysiert die Reaktion L-Aspartat + α-Ketoglutarat Oxalacetat + L-Glutamat Labordiagnostik In der Labordiagnostik wird die Aktivität der AST aus Plasma oder Serum bestimmt um abzuklären, ob eine Leber- oder Gallenwegserkrankung vorliegt.