MHC-II
Werbung

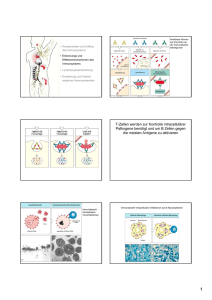
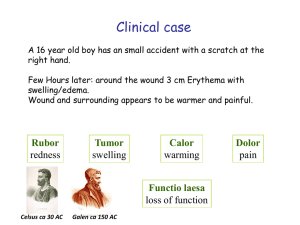
Antigenpräsentation 01. April 2009 Elfriede Nößner HelmholtzZentrum München-Institut für Molekulare Immunologie München-Großhadern E-Mail: [email protected] Tel. 089/7099 303 Zur Erinnerung MHC-Klasse I MHC-Klasse II MHC-schwere Kette + ß2m MHC-IIα + MHC-IIß TCR-MHCPeptid CDR3 α/ß Das Peptid ist ein integraler Bestandteil des MHCProteins. Das MHC-Protein erhält dadurch Stabilität. Antigen Æ Peptid - Entfaltung - Abbau T-Zellen erkennen im MHC-Protein eingelagerte Antigenfragmente (Peptide) T-Zelle zwei TCR zur Erkennung von MHC und Antigen ? TCR 1975: Nobelpreis MHC-Restriktion 1989: Kristallstruktur pMHC MHC Prozessierung Entfaltung Antigen Antigenpräsentierende Zelle Zwei Klassen von T-Zellen CD4-positiv CD8-positiv TCR CD8 MHC-I TCR CD4 Zwei Arten von PeptidAntigen MHC-II β α MHC-Klasse I MHC-Klasse II Zwei Klassen von Antigenpräsentationsmolekülen Warum MHC-I und MHC-II ? Helfer TH Zytotoxische T-Zelle B-Zelle Zytokine TCR MHC-I TNFα IFNγ TCR MHC-II MHC-II BCR Viren Mutationen infizierte Zelle Präsentationsmolekül muss von allen Zellen exprimiert werden (MHC-I) Plasmazelle Makrophage Bakterien, Toxine Präsentationsmolekül darf nur von Zellen des Immunsystems exprimiert werden (MHC-II) Lokalisation des Antigens bestimmt den Präsentationsweg T-Zellen CD8 Antigen CD4 Lyse Bakterien, bakterielle Toxine Intrazelluläre Bakterien Viren Mutationen Lokalisation des Antigens Zytosol Vesikel Extrazelluläre Flüssigkeit MHC MHC-I MHC-II MHC-II endogener Präsentationsweg exogener Präsentationsweg Biologischer Sinn der Zweiteilung bei T-Zellen und MHC: Antigenlokalisation und T-Effektorfunktion T-Zelle CD8 Killerzellen CD4 Helfer TH1 Helfer TH2 IL-2, IFNγ Antigen TNFα IFNγ IL-4 Bakterien, bakterielle Toxine Intrazelluläre Bakterien Viren Mutationen Effektor funktion Zielzelle Zelllyse Aktivierung der Mф; Lyse der intrazell. Bakterien Jede Körperzelle Makrophage MHC MHC-I MHC-II Lokalisation des Antigens Zytosol Vesikel endogene Antigenpräsentation Antikörpersezernierende Plasmazelle B-Zelle MHC-II Extrazelluläre Flüssigkeit exogene Antigenpräsentation T-Zelle CD8 Der endogene (zytosolische) Präsentationsweg Antigen Viren Mutationen Effektor funktion Zielzelle Die MHC-Klasse Irestringierte Antigenpräsentation Zelllyse Jede Körperzelle MHC MHC-I Lokalisation des Antigens Zytosol Die MHC-Klasse Irestringierte Antigenpräsentation Der endogene (zytosolische) Präsentationsweg Antigenprozessierung 26S Proteasom multikatalytischer Proteinkomplex (700kD) α1 - α7 β1 - β7 β1 - β7 α1 - α7 β β katalytische Zentren Regulation der Proteasom-Aktivität Substratbindung 19S Regulator Öffnen der Core-Einheit 26S Proteasom ubiquitinierte Proteine ATP Aminosäuren 20S Proteasom TOP (Thimet Oligoendopeptidase) Peptide Antigenpräsentation IFN-γ PA28 α/β (11S Aktivator) Peptid-Substrate ohne Ubiquitin (8-12 Aminosäuren) Chimäre Proteasomen Ubiquitin markiert Proteine für den proteasomalen Abbau ATP Ubaktivierendes Enzym (E1) Ub-KonjugationsEnzym (E2) Ub Ub Ub Ub-Ligase (E3) UbU b Ub Ub Ub Ub Ub Ub Ub Polyubiquitiniertes Protein ATP TOP (Thimet Oligoendopeptidase) Aminosäuren Peptide Peptide (8-12 Aminosäuren) Antigenpräsentation Core Entzündungsprozesse (Interferon-γ) verändern die proteolytische Aktivität des Proteasoms α β β α IFN-γ Delta MB1 LMP2 LMP7 (Entzündung) MB1 Delta LMP7 LMP2 Delta MB1 LMP2 LMP7 Housekeeping Proteasom Immunoproteasom Hydrolyse nach aromatischen, aliphatischen, basischen AA und Glutaminsäure Hydrolyse nach basischen und hydrophoben AA, Bevorzugt 5-15 AA lange Peptide TOP Aminosäuren korrekter C-Terminus für die MHC-Klasse I-Bindung Das Immunoproteasom fördert die Peptidbereitstellung für die MHC-I-Präsentation Ovalbuminabbau Proteolytische Abbaumechanismen mit Bedeutung für die Antigenpräsentation Das Proteasom spielt die zentrale Rolle bei der Prozessierung des Peptids für MHC-Klasse I-Präsentation. Es generiert den C-Terminus des Epitops. Weitere proteolytische Enzyme: • Tripeptidylpeptidase (TPP II): Zytosol. In einigen Tumoren gegenüber dem Proteasom bevorzugt und wird zur Herstellung bestimmter HIV-Epitope benötigt. • Aminopeptidasen im ER (ERA(A)Ps verkürzen Peptide ausgehend vom NTerminus jeweils um eine Aminosäure („Trimming“). IFN-γ induziert die ERAPExpression. • Signalpeptidase: spaltet die Signalsequenz von Proteinen beim Eintritt ins ER. Peptide aus der Signalsequenz von MHC-I sind wichtig für die HLA-E Expression und NK-Regulation. Protektive CTL-Antwort gegen Nef benötigt Tripeptidyl-Peptidase II (TPP II) Der Peptidtransport ins ER TAP1/TAP2 Heterodimer 6 Transmembrandomänen NukleotidbindeDomäne Transport - ATP-abhängig - Peptide mit C-terminalen hydrophoben oder basischen Aminosäuren Sechs TAP1 Allele, vier TAP2 Allele kein Unterschied in der Peptid-Selektion ER-Abbaumechanismen (ERAP) xPxxxx DRIPs Ubiquitinierung Hinweis auf ERAP: TAP transportiert keine „xPxxx“-Peptide. Diese werden aber aus MHC-Klasse I-Proteinen isoliert. ÆVermutung: Transport als längere Vorläufer und N-terminales Trimming im ER. Maus: ERAAP-1 Mensch: ERAP-1 und ERAP-2 (L-RAP: leukocyte-derived aminopeptidase) ERAP BiP Calnexin - nicht redundant; kooperatives Trimming (ERAP-1 spaltet hydrophobe Reste, ERAP-2 basische Reste) - Homo/Heterodimere IFN-γ induziert ERAP Antigenprozessierung für die MHCKlasse I-Präsentation Pro Sekunde werden 2 Millionen Peptide generiert. Davon werden 150 von MHC-Klasse I präsentiert 26S Proteasom TPP II AP AP TOP AP TOP Thimet Oligoendopeptidase HLA-E NK -Inhibition Signalpeptidase ERA(A)Ps CD8 - Aktivierung - Toleranz MHC-Zusammenbau & Peptidbeladung (ER) Chaperone & Peptidbeladungskomplex (PLC) Chaperone sind Proteine, die mit anderen Proteinen Komplexe bilden, um deren Stabilität, weitere Faltung, Tertiärstrukturbildung, etc. zu unterstützen, dann aber wieder abdissoziieren. Wichtige Chaperone des MHC-Klasse IBiogenesewegs sind: DRIPs Ubiquitinierung Calnexin, Calretikulin, ERp57, Tapasin, PDI Biologische Notwendigkeit: Qualitätskontrolle Nur MHC/ß2m/Peptid-Komplexe sollen auf die Zelloberfläche gelangen. BiP Calnexin Nur komplett assemblierte trimäre MHC/ß2m/Peptid-Komplexe sind strukturell stabil; nur trimäre Komplexe erfüllen die Funktion der Antigenpräsentierung; nur trimäre Komplexe können NK-Zellen inhibieren MHC-Zusammenbau & Peptidbeladung (ER) Chaperone & Peptidbeladungskomplex (PLC) PDI optimal Peptid suboptimal DRIPs Ubiquitinierung PLC: TAP1/2: Peptidtransport Tapasin: Interaktion MHC/ß2m mit TAP BiP Calnexin ERp57: Thiol-Oxidoreduktase (s-s Brücke) Calreticulin: Peptid-Editing PDI: Protein-disulphid-Isomerase MHC-Zusammenbau & Peptidbeladung (ER) Chaperone & Peptidbeladungskomplex (PLC) Tapasin: Stabilisiert TAP-MHC PDI Interaktion. Zwei Allele (kein Unterschied in der Funktion) Nicht alle MHC-Klasse I-Allotypen binden gleich gut an Tapasin (FTasche ist ausschlaggebend) B*4402, B8, B*1510 brauchen Tapasin; B*2705, B*1501, B*1518 werden auch ohne PLC mit Peptid beladen (Æ Resistenz gegenüber viraler Interferenz) ERp57, PDI: Umorganisation der S-SBindung In ERp57-/- Mäusen befinden sich weniger MHC-I-Proteine im PLC. MHC-I-Proteine werden schneller zur Zelloberfläche transportiert, sind aber dort nicht stabil. ERp57 hält MHC-I im PLC bis es mit optimalen Peptiden beladen ist. PLC: TAP1/2: Peptidtransport Tapasin: Interaktion MHC/ß2m mit TAP ERp57: Thiol-Oxidoreduktase (s-s Brücke) Calreticulin: Peptid-Editing (COH-Bindung) PDI: Protein-disulphid-Isomerase Der PLC: die zentrale Kontrolleinheit der MHC-Klasse I-Peptidbeladung • Angeborene TAP-Defizienz Æ schwere Immundefekte (BLS) • Mutationen/Verlust von TAP sind häufig in Tumoren (Melanom, Retinoblastom, Fibrosarkom) ÆImmun-Escape • ERp57-Deletion (Maus) führt zu schnellerem MHC-Klasse ITransport. Allerdings geringe Stabilität auf der Zelloberfläche. Æ gebundene Peptide sind suboptimal. Æ ERp57 beeinflusst die Qualität des Peptid-Pools • Viren intervenieren mit TAP/Tapasin-Funktion: MHC-Klasse IAllelvarianten, deren Peptidbeladung von PLC unabhängig ist, sind resistent gegenüber viraler Subversion. Virale Immun-Evasion Störung der MHC-Klasse I Biogenese, bevorzugt PCL-Angriff PDImK3 X optimal Peptid suboptimal K5 UL83 K3 E19 US3 US10 US6 ICP47 Internalisierung Inhibition des Peptidabbaus (UL83) ICP47 US6 BiP Calnexin US2 US11 ERAD Nef Fehlsortierung Inhibition des Peptidtransports (CMV-US6, HSV-ICP47 ) Degradation von MHC-I (US2, US11) Störung des PLC (MHV68-mK3, US3, US10, AdE19) Fehlsortierung (HIV-Nef, KSHV-K5, K3) Kreuzpräsentation Präsentation exogener Antigene über MHC-I MHC-I: der endogene Weg Antigenfreisetzung & Aufnahme X AntigenTransfer K5 UL83 K3 Gap-Junctions Internalisierung MHC-I Recycling Abgabe ins Zytosol Endosom Nef Missorting BiP Calnexin US2 US11 ERAD zytosolische Antigene & CD8 T-Zellen extrazelluläre Antigene & CD4 T-Zellen MHC-I: der endogene Weg MHC-II: der exogene Weg Trennung endogener/exogener Weg MHC-II Trafficking Die invariante Kette (Ii) MHC-II: der exogene Weg Sequenzieller Abbau durch Cath S/L, AEP Æ CLIP (class II associated invariant chain peptide) Sortingsignal zum Golgi und Endosom Blockiert Peptidbindungsgrube Æ keine Bindung endogener Peptide im ER (Spezifität des exogenen bzw. endogenen Präsentationswegs ist gesichert). ER Ii αβ Nonamerkomplex Ii3(α/β)3 Æ verleiht dem MHC-II Dimer Stabilität und Schutz vor Abbau. Peptidbeladung Trennung endogener/exogener Weg Proteolytische Aktivitäten MHC-II: der exogene Weg Proteasen: Lokalisation in Endosomen/Lysosomen Endo-, Exo- und PeptidylProteasen; Cysteinyl (Cathepsine)und Non-Cysteinyl-Proteasen. Funktion Abbau des Antigens und der Invarianten Kette. Regulation durch • Absenken des pH (Acidifizierung der Endosomen) (posttranskriptional) • Interferon-γ (transkriptional) Proteasen der MHC-II-Präsentation Endoproteasen Substratspezifität Cathepsine D E L S AEP (AsparaginEndopeptidase Leucin/aromatisch vor Prolin Leucin, aromatisch Aliphatisch, Methionin Abbau der Ii- Kette nein ? Ja, im Thymusepithel Ja, in APC Ja, initiiert den Abbau Exoproteasen Cathepsine A B H Carboxypeptidase Carboxypeptidase Aminopeptidase nein nein nein Aminopeptidase Prolyl-Carboxypeptidase Pro/ala-Aminopeptidase nein nein nein Peptidyldipetidasen I (Cathepsin C) II IV Exonuklease-Aktivität zeigt sich an den „ragged ends“ der MHCKlasse II-Peptide. Prolyl-Carboxypeptidase Aktivität zeigt sich daran, dass viele MHC-II-Peptide am N-terminalen Ende Proline haben. MHC-II Allel MHC-II Allel 2 HLA-DM: Peptidbeladung im MIIC Entfernen von CLIP und Editieren der Peptidbeladung des MHC-II MHC-II: der exogene Weg Peptidbeladung DP DQ DR βα β β α ββ α α αβ BC 6p21.31 Proteine der Antigenpräsentation sind im MHC kodiert und über IFN-γ ko-reguliert A β DN DM DO TAP/LMP TAP Klassische MHC-Klasse Ia und II-Gene. Präsentation von Peptiden an CD8- und CD4-T-Zellen Gene mit Funktion bei der Antigenpräsentation TAP/LMP (MHC-Klasse I-Präsentation) DM (MHC-Klasse II-Präsentation) DN/DO Biologischer Sinn: Koordinierte Expression und Regulation der Antigenprozessierungsmaschinerie bei Bedarf. HLA-DO: Regulator des HLA-DM • • • • Heterodimer aus DNα und DOβ Strukturell dem HLA-Klasse II ähnlich, aber keine Peptidbindung Expression in B-Zellen HLA-DO bildet Komplexe mit HLA-DM. Im Komplex mit DO kann HLA-DM seine Funktion als Peptidaustausch-Vermittler weniger gut ausführen. • Die Stabilität des DM-DO-Komplexes ist pH-abhängig. -- niedriger pH (pH4.5-5.0, spätes Endosom): DO bindet schlecht an DM Æ DM ist aktiv und fördert die Peptidbeladung. -- basischer pH (pH6.0-6.5, frühes Endosom): DM-DO-Komplex stabil Æ DM ist funktionell blockiert Æ HLA-Klasse II wird nicht/schlecht mit Peptiden beladen. • Versuche deuten darauf hin, dass DO die Selektion von hochaffinen Antikörpern begünstigt. HLA-DO begünstigt Antikörperproduktion von B-Zellen mit hochaffinen B-ZellRezeptoren Antigen wird im EE verdaut. Weil dort DM nicht aktiv ist, wird MHC-II nicht mit exogenem Peptid beladen. Unterschiede zwischen MHC-I- und MHC-IIrestringierter Antigenpräsentation Expression des MHC Effektorzellen immunologischer Effekt Antigenstruktur Art des Antigens Herkunft des Antigens Antigenlokalisation Antigenprozessierung Inhibition MHC-I MHC-II alle Zellen; Ausnahmen: Erythrozyten, Nervenzellen Zellen des Immunsystems (Makrophagen; B-Zellen, dendritische Zellen) CD8-positive T-Zellen CD4-positive T (Helfer) -Zellen zellgerichtet; Zerstörung infizierter Zellen Aktivierung von infizierten Makrophagen (Abtöten intrazell. Bakterien), und B-Zellen (AK-Produktion) 8-11 AA-lang, N + C-terminal verankert 12-24 AA-lang, Verankerung über die ganze Länge der Grube, überhängende Enden Intrazelluläre Pathogene (Viren, intrazell. Bakterien i.e. Listeria), Mutationen, zellulärer Proteine etc. intrazelluläre Bakterien (Mycobakterien, Leishmania), Bakterien, Toxine endogene Synthese (Genexpression) extrazelluläre Aufnahme durch Endozytose, Makropinozytose, Pinozytose Zytosol Mф-Vesikeln, extrazelluläre Flüssigkeiten Zytosol-Proteasom (Trimming im ER) Endosom; Lysosom (Cathepsine, Exo-/Endopeptidasen) Brefeldin A (ER/Golgi-Transport) Lactacystin, etc (Proteasomeninhibitoren) Chloroquin (pH-Erhöhung im Endosom) Leupeptin (Cathepsin-Inhibition) Weitere Antigenpräsentationsmoleküle Zur Erinnerung MHC-I MHC-II Peptid-Antigene CD1a-d Lipid-Antigene CD1: Cluster of differentiation-1 differentiation Zur Erinnerung Strukturell dem MHC-Klasse I ähnlich, assoziiert mit ß2-m nicht im MHC kodiert nicht polymorph CD1a, CD1b, CD1c und CD1d (CD1e) an unterschiedlichen Genloci kodiert Maus hat nur Gruppe II-CD1 (CD1d) Präsentation von Lipid-Antigenen Zur Erinnerung CD1-Epitope Lipidantigene (z.B. von Mycobakterien, Sphingomonas, Borellia) – Glycosphingolipide (CD1a,b,c,d) – Phospholipide (CD1c,d) – Sulfoglycolipide (CD1b,c) – Mycolsäuren (CD1b) – Lipopeptide (CD1a) – Galactosyl/Glucosylceramide (CD1d) α-Gal-Cer Lipopeptide Mycolsäure Diacylglycerol Dideoxymycobactin Phosphatidyl -inositol CD1-Struktur ÅÆ Funktion Zur Erinnerung MHC-Klasse I CD1a Peptidbindungsgrube - 2-4 Taschen - Taschen enger und tiefer als bei MHC Trafficking und Lipidbeladung des CD1 Recycling zum EE 1 Schneller Transport zur Oberflächen Synthese und Zusammenbau im ER ß2m, Calnexin, ERp57, Calreticulin Endogene SelbstLipide (PtdIns), MTP 2 (AP-2, bzw. ARF6 für CD1a) Transport zum LE, Lysosom (AP-3) (nicht CD1a) 5 Oberflächenexpression 3 4 Lipidbeladung (SAP, apoE) CHOProzessierung (Hex, CD1e) Mögliche Funktionsweise der Saposine SAP A-D: lysosomale Sphingolipid-Aktivator-Proteine. Funktionsweise unklar, vermutlich Aufbrechen der Membranordnung durch Interaktion mit dem hydrophilen Kopf. SAPs werden als inaktive Vorstufen produziert (Prosaposine). Chaperon-Funktion analog zu DM bei MHC-Klasse II Viraler Eingriff in die Lipid-Präsentation HIV1-Nef KSHV-Mir HIV1-Nef Schneller Transport zur Oberflächen Synthese und Zusammenbau im ER ß2m, Calnexin, ERp57, Calreticulin Endogene SelbstLipide (PtdIns), MTP 1 HSV-1 Recycling zum EE 2 (AP-2, bzw. ARF6 für CD1a) Transport zum LE, Lysosom (AP-3) (nicht CD1a) 5 Oberflächenexpression 3 4 HSV-1 Lipidbeladung (SAP, apoE) CHOProzessierung (Hex, CD1e) CD1 hat Eigenschaften von MHC-I und MHC-II MHC-Klasse I Struktur Expression T-ZellPopulation/ Funktion Art des Antigens Trafficking MHC-Klasse II α-Kette + ß2m α- und ß-Kette α-Kette polymorph beide Ketten polymorph auf allen Zellen APC CD4/Zytokine CD8/ Th1: IL-4, IL-13; zytotoxisch Th2: IFNγ/TNFα) Peptid, zytosolisch Peptid; endosomal Gruppe I a b c Gruppe II d α-Kette + ß2m nicht polymorph APC Diverse TCR NKT lipid-reaktiv Zytokine, zytotox. IFNγ;TNFα autoreaktiv IL-4 +GMCSF Lipid, endosomal Polar, Lange Selbstlipide, hydrophobe Lipopeptide mit Ketten kurzer Kette ER, Golgi EE, LE/MIIC, Lysosom Dileucin-Motif Chaperone CD1 Calnexin, ERp57, Calretikulin, Tapasin, TAP Prozessierung Proteasom, TPP II, ERAAP, Signalpeptidase α-galcer iGb3 Endosomen/MIIC, Lysosom EE, LE, Recycling E. Lysosom (ARF6) (AP-2/-3) Alle Endosomen (Nicht AP-3) (AP-2/-3) Ii, DM, DO Calnexin, ERp57, Calretikulin; nicht TAP; Ii, Saposine (SAP), PtdIns Cathepsine, AEP CathL, ß-Hexosaminidase (CHO-Prozessierung) Beladung von CD1 mit Lipidantigen Lipidtransfersysteme: Selbst-Lipid (Phosphatidylinosit, PtdIns) wird im ER vermutlich mithilfe von MTP (microsomal triglyceride transfer protein) geladen. PtdInsFunktion ist vergleichbar mit Ii (Besetzen der Bindegrube für Stabilität) ApoE (apolipoprotein E) ist an Aufnahme und Transfer von exogenen Lipiden auf CD1d im endosomalen Kompartiment beteiligt. SAP A-D: lysosomale Sphingolipid-Aktivator-Proteine. Funktionsweise unklar, vermutlich Aufbrechen der Membranordnung durch Interaktion mit dem hydrophilen Kopf. SAPs werden als inaktive Vorstufen produziert (Prosaposine) Chaperon-Funktion analog zu DM bei MHC-Klasse II SAP-C Æ CD1b; ob CD1a und c auch SAPs benutzen ist unbekannt Chaperone: Calnexin, Calretikulin, ERp57, nicht TAP/Tapasin, spielen eine Rolle beim Zusammenbau im ER ß-Hexosaminidasen: CHO-Prozessierung nötig für NKT-Entwicklung (CD1d). ß-Hexosaminidasen sind Dimere. ß-Hexosaminidase A ist Heterodimer aus α- und ßUntereinheiten. ß-Hexosaminidase B ist Homodimer aus ß-UE, ß-Hexosaminidase S ist αUE Homodimer Mutation in α-UE (Tay Sachs Disease) ÆDefekt in ß-Hex und Hex S Mutation in ß-UE (Sandhoff Disease) Æ Defekt in both α-Hex und ß-Hex Cathepsin L: CD1 - Biogenese (nur für CD1d bekannt) CD1 a-d, MHC-I und MHC-II unterscheiden sich im Trafficking (zytoplasmatische Motife, Adaptorproteine) CD1-Proteine erscheinen innerhalb weniger Stunden auf der Zelloberfläche (ER-Golgi Transit wie MHC-I), MHC-II braucht wesentlich länger. CD1a wird über Clathrin-coated Pits von der Oberfläche in EE internalisiert (ARF6: ADP ribosylation factor 6), unabhängig von AP-2 (CD1a hat kein Y-Motif), keine Lokalisation zum LE oder Lysosom (kein AP-3 Motif) CD1b, c und d und MHC-II finden sich im LE und Lysosom, gelangen aber auf unterschiedlichem Weg dort hin: • MHC-II gelangt über Golgi zu LE und MIIC (Dileucin-Motif); • CD1b gelangt durch Recycling von der Zelloberfläche zum LE und Lysosom (Y-Motif, AP-2 und AP-3) • CD1c und d werden von der Zelloberfläche internalisiert und gelangen zum LE über einen AP-3 unabhängigen Weg. Kompartiment-Lokalisation bestimmt die Art des präsentierten Lipidantigens: • Lipide mit langer hydrophober Kette sind im LEÆ Präsentation durch CD1b • Polare Selbstlipide und Lipopeptide mit kurzer Kette sind in EE, auf der Zelloberfläche, und im Recycling-Endosom Æ Präsentation durch CD1a AP-2: Recycling von der Zelloberfläche, clathrin-abhängig, Y-Motif EE: early endosome; LE: late endosome AP-3: Transport vom EE zum LE und Lysosom. Hermansky-Pudlak-Syndrom: AP-3 Defekt Æ veränderte CD1b-Lokalisation und Lipidpräsentation MHC-Klasse I PeptidbindeDomäne α2 α1 MHC-Klasse II β1 α1 (~90 aa) (~90 aa) COH-Kette ImmunglobulinDomäne β2- α3 (~90 aa) Mikroglobulin TransmembranDomäne ~25 Aminosäuren Zytoplasmatische Domäne ~30 Aminosäuren β2 α2 ~25 Aminosäuren (~90 aa) ~25 Aminosäuren variable Länge Tyrosin-Motif Ii Dileucin-Motif Trafficking-Signale CD1 MHC-II ARF6 AP-2 AP-2 AP-3 MHC-I Cross-Präsentation AP-2 TraffickingSignale Entzündung (IFN-γ) • Gene für die MHC-Klasse I- restringierte Antigenpräsentation werden hochreguliert (MHC-Klasse I, TAP1 und TAP2, LMP2 und LMP7, PA28-Aktivator). • Zusammensetzung des Proteasoms ändert sich (ÆIMMUNOPROTEASOM). • Die proteolytische Aktivität des Proteasoms verändert sich: - restringierte Hydrolyse (Æ 5-15 AA) - bevorzugte Hydrolyse nach hydrophoben Aminosäuren Æ Peptide mit hydrophoben C-Termini = optimal für die Cterminale Verankerung im MHC-Klasse I-Protein • HLA-DM wird induziert • CIITA wird induziert Testfragen - Antigenpräsentation Virale (intrazelluläre) Antigene können auf der Zelloberfläche einer Antigen-präsentierenden Zelle präsentiert werden (nur eine Aussage ist richtig) A) nach Degradierung im Lysosom und Bindung an MHC-Klasse II B) können nicht präsentiert werden C) nach Degradierung durch das Proteasom und Bindung an MHC-Klasse I D) können nicht degradiert werden und gelangen intakt auf die Zelloberfläche E) werden von Toll-like Rezeptoren auf die Zelloberfläche transportiert. Wie beeinflusst Interferon-gamma die Antigenpräsentation? Was sind die zugrunde liegenden Mechanismen? Was sind Chaperone? Welche Funktion haben sie? Welchen biologischen Sinn haben die Chaperone beim MHC-Präsentationsweg? Gibt es Gemeinsamkeiten zwischen CD1 und MHC-I (mit JA oder NEIN antworten) in - Struktur: - Art des präsentierten Antigens: - Lokalisation des Antigens: - beteiligte Chaperone: - Proteasen zur Antigenprozessierung: . Welche Signalmotife steuern die intrazelluläre Lokalisation der MHC-Klasse I- und MHC-Klasse II-Proteine? Wo im Protein sind die Signalmotife kodiert? Antigene, die von MHC-Klasse I oder MHC-Klasse II präsentiert werden, stimulieren unterschiedliche T-Zellpopulationen und führen zu unterschiedlichen biologischen Reaktionen. Welche T-Zellpopulationen werden stimuliert und welcher biologische Effekt wird damit erzielt? Testfragen - Antigenpräsentation Weisen Sie jedem der nachfolgenden Begriffe zu, ob er beim MHC-Klasse I-restringierten endogenen Antigenpräsentationsweg (en), dem MHC-Klasse II-restringierten exogenen Antigenpräsentationsweg (ex), der CD1vermittelten Lipid-Präsentation (lip) oder bei alle Wegen (en, ex, lip) eine Rolle spielt. Geben Sie jeweils für jeden Begriff eine kurze Erklärung zur Funktion. _____________________________________________Funktion___________ _____ Invariante Kette _____ Cathepsine _____ TAP1 und TAP2 _____ Saposine _____ vesikulärer Transport vom ER zum Golgi _____ CLIP _____ Proteasom _____ Calnexin Eine Komponente des 26S Proteasomes ist die 19S Regulatoreinheit. Was ist seine Funktion? Nennen Sie die Unterschiede zwischen dem 26S-Standard-Proteasom und dem 26S Immunoproteasom, hinsichtlich Aufbau und Funktion. Was sind die Funktionen der Invarianten Kette? A) Wie viele Wege der Antigenpräsentation gibt es? Wie heißen sie? B) Warum gibt es diese unterschiedlichen Wege? C) Wodurch wird der Präsentationsweg bestimmt? A) Welche Proteasen spielen bei der endogenen Antigenpräsentation über MHC-Klasse I eine Rolle? B) Beschreiben Sie die zelluläre Lokalisation und zwei Eigenschaften jeder Protease Testfragen - Antigenpräsentation Was sind die Komponenten des MHC-Klasse I-Peptidbeladungskomplexes? Welche Funktion hat jedes Protein? Welchen biologischen Sinn hat die Aufteilung der Antigenpräsentation über zwei verschiedene MHC-MolekülKlassen? Wodurch wird die Aufteilung bestimmt? Wie wird die Aktivität des Proteasoms für die Antigenpräsentation optimiert? A) Wie viele Wege der Antigenpräsentation gibt es? Wie heißen sie? B) Warum gibt es diese unterschiedlichen Wege? C) Wodurch wird der Präsentationsweg bestimmt? Was ist Kreuspräsentation? Welche Zellen sind Kreuzpräsentation fähig? Welche Wege werden diskutiert? Warum ist Kreuzpräsentation biologisch notwendig? Welche Möglichkeiten gibt es, damit trotz viraler Abregulation des MHC-Klasse-I eine virale CD8-T-Zellantwort entstehen kann? Was sind die Funktionen der Invarianten Kette? Nennen sind die Funktionen von HLA-DM? A) Welche Proteasen spielen bei der endogenen Antigenpräsentation über MHC-Klasse I eine Rolle? B) Beschreiben Sie die zelluläre Lokalisation und zwei Eigenschaften jeder Protease