Falk Gastro-Kolleg Oberer GI-Trakt
Werbung
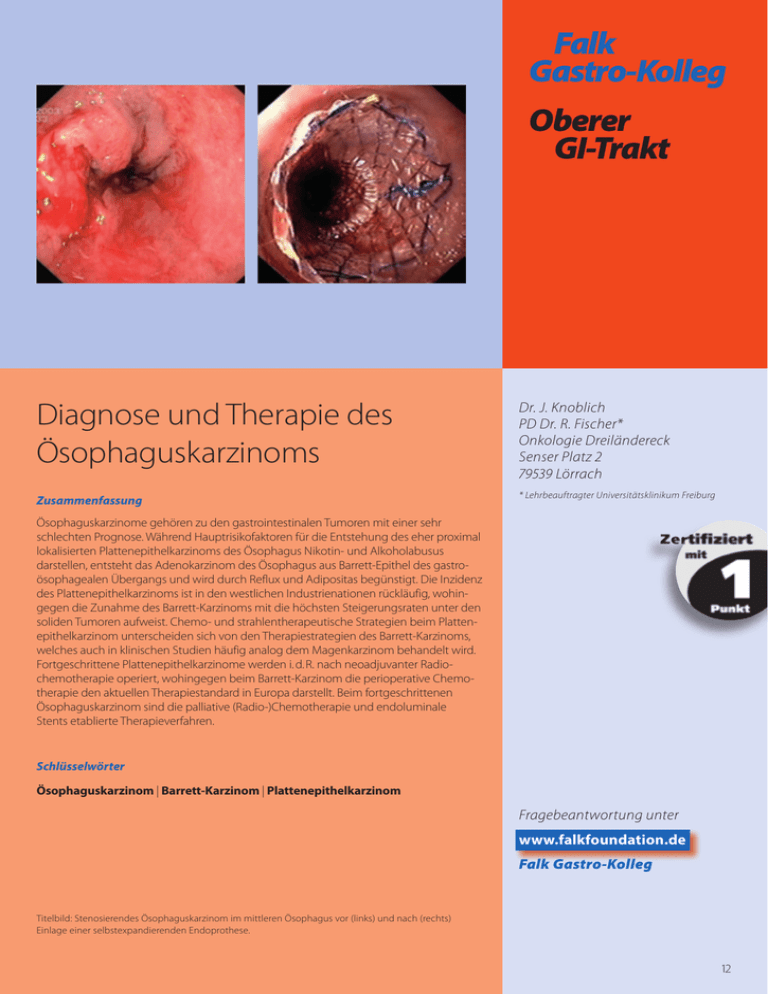
Falk Gastro-Kolleg Oberer GI-Trakt Diagnose und Therapie des Ösophaguskarzinoms Dr. J. Knoblich PD Dr. R. Fischer* Onkologie Dreiländereck Senser Platz Lörrach Zusammenfassung * Lehrbeauftragter Universitätsklinikum Freiburg Ösophaguskarzinome gehören zu den gastrointestinalen Tumoren mit einer sehr schlechten Prognose. Während Hauptrisikofaktoren für die Entstehung des eher proximal lokalisierten Plattenepithelkarzinoms des Ösophagus Nikotin­ und Alkoholabusus darstellen, entsteht das Adenokarzinom des Ösophagus aus Barrett­Epithel des gastro­ ösophagealen Übergangs und wird durch Reflux und Adipositas begünstigt. Die Inzidenz des Plattenepithelkarzinoms ist in den westlichen Industrienationen rückläufig, wohin­ gegen die Zunahme des Barrett­Karzinoms mit die höchsten Steigerungsraten unter den soliden Tumoren aufweist. Chemo­ und strahlentherapeutische Strategien beim Platten­ epithelkarzinom unterscheiden sich von den Therapiestrategien des Barrett­Karzinoms, welches auch in klinischen Studien häufig analog dem Magenkarzinom behandelt wird. Fortgeschrittene Plattenepithelkarzinome werden i. d. R. nach neoadjuvanter Radio­ chemotherapie operiert, wohingegen beim Barrett­Karzinom die perioperative Chemo­ therapie den aktuellen Therapiestandard in Europa darstellt. Beim fortgeschrittenen Ösophaguskarzinom sind die palliative (Radio­)Chemotherapie und endoluminale Stents etablierte Therapieverfahren. Schlüsselwörter Ösophaguskarzinom | Barrett-Karzinom | Plattenepithelkarzinom Fragebeantwortung unter www.falkfoundation.de Falk Gastro-Kolleg Titelbild: Stenosierendes Ösophaguskarzinom im mittleren Ösophagus vor (links) und nach (rechts) Einlage einer selbstexpandierenden Endoprothese. 12 Diagnose und Therapie des Ösophaguskarzinoms Epidemiologie und histologische Subtypen von Ösophaguskarzinomen Der Anteil des Ösophaguskarzinoms an den Malignomen beträgt in Deutschland etwa 1% mit einer Inzidenz von 4,5/100.000. Die häufigsten histologischen Malignome des Ösophagus stellen das Plattenepithelkarzinom und das Adenokarzinom dar; kleinzellige Karzinome, Stromatumoren und andere Entitäten haben einen Anteil von weniger als 3%. Die Häufigkeit des Plattenepithelkarzinoms des Ösophagus ist in den westlichen Industrienationen abnehmend, der Anteil der Barrett-Karzinome an den Ösophaguskarzinomen beträgt in Deutschland etwa 50% und ist stark ansteigend. P Plattenepithelkarzinome des Ösophagus sind seltener als die zunehmend häufigeren Adenokarzinome. Das Plattenepithelkarzinom des Ösophagus ist zu 90% im mittleren und distalen Öso­ phagus lokalisiert, wohingegen das Adenokarzinom praktisch ausschließlich auf dem Boden einer Barrett-Epitheldysplasie im distalen Ösophagus im Bereich des ösopha­ gogastralen Übergangs auftritt. Die wichtigsten Risikofaktoren des Plattenepithelkar­ zinoms stellen Nikotin- und Alkoholabusus (insbesondere hochprozentiger A ­ lkohol) dar, und beim proximalen Ösophaguskarzinom liegen in ca. 15% synchrone Hypo-/ Oropharynxkarzinome oder Bronchialkarzinome vor. Das Plattenepithelkarzinom wächst z. T. unterminierend in der Submukosa und kann endoskopisch daher in der Ausdehnung unterschätzt werden. Die Patienten sind häufig multimorbide, stammen aus unterprivilegierten Bevölkerungsschichten, und das Durchschnittsalter b ­ eträgt 55 Jahre. Das Plattenepithelkarzinom metastasiert am häufigsten in die regionären Lymphknoten; bei auf die Mukosa begrenzten Karzinomen beträgt die lymphogene Metastasierungsrate etwa 5%, bei Infiltration der Submukosa bereits etwa 30%. Karzi­ nome des oberen Ösophagusdrittels metastasieren in zervikale und mediastinale Lymphknoten, ab dem mittleren Drittel sind zunehmend mediastinale und obere gas­ trische Lymphknoten betroffen. Die häufigsten hämatogenen Metastasen erfolgen in die Lunge und in die Leber, seltener in die Nebennieren, das Gehirn und die Knochen. P Risikofaktoren für Plattenepithel­ karzinome sind Nikotin und Alkohol, für Adenokarzinome Reflux. Beim Barrett-Karzinom stellen Adipositas und Reflux die wichtigsten Risikofaktoren dar, und möglicherweise aufgrund der deutlich ansteigenden Inzidenz von Adipositas in der westlichen Welt gehört das Barrett-Karzinom zu den Tumorentitäten mit der deutlichsten Inzidenzsteigerung von 5–10% pro Jahr. Männer sind deutlich häufiger betroffen als Frauen, das durchschnittliche Alter bei Erstdiagnose beträgt 63 Jahre. Das Adenokarzinom des Ösophagus entsteht aus Barrett-Schleimhaut (intestinaler Meta­ plasie) und ist überwiegend mäßig bis hochdifferenziert mit papillärem oder tubulä­ rem Wachstumsmuster; Siegelringkarzinome oder Karzinome vom diffusen Typ sind eher selten. Die Ausbreitung ist ähnlich dem Plattenepithelkarzinom häufig submu­ kös proximal, jedoch auch mit möglicher Ausbreitung in den Magen. Die Metastasie­ rung erfolgt kleinkurvaturseitig in die paragastrischen Lymphknoten und paraöso­ phageal, z. T. auch zervikal. Die Adenokarzinome des ösophagogastralen Übergangs metastasieren lymphogen bevorzugt im ösophagogastrischen Winkel und entlang der Arteria gastrica sinistra sowie z. T. parazervikal und paraaortal. Hämatogene Meta­ stasen treten deutlich später auf als beim Plattenepithelkarzinom. P Ösophaguskarzinome metastasieren sehr frühzeitig lymphogen und werden daher häufig im fortgeschrittenen Stadium diagnostiziert. P Plattenepithelkarzinome sind vor allem im mittleren/distalen Ösophagus, Adenokarzinome fast ausschließlich distal zu finden. 13 Klinik Symptome treten häufig erst im fortgeschrittenen Tumorstadium auf. Dysphagie und retrosternale Schmerzen werden oft erst bei einer Verlegung des Ösophaguslumens von mehr als 50% angegeben. Fortgeschrittene Erkrankungen werden durch Allge­ meinsymptome wie Müdigkeit, Appetitlosigkeit, Übelkeit, Vomitus und Anämie sym­ ptomatisch. P Symptome treten erst spät auf. Diagnose Endoskopie und bildgebende Verfahren Die Diagnose wird histologisch gestellt und die wichtigste nicht-invasive Methode zur Histologiegewinnung ist die endoskopische Untersuchung, verbunden mit der Endo­ sonografie. Es sollten etwa 10 Biopsien aus tumorverdächtigen Arealen entnommen werden. Das Ausmaß der maximalen bzw. primären Tumorformation in Beziehung zur Z-Linie muss nach der Siewert-Klassifikation angegeben werden: Etwa 1–5 cm proxi­ mal der Z-Linie liegende Tumoren werden als „AEG I/Siewert I“ bezeichnet und ent­ sprechen den typischen Barrett-Karzinomen. Karzinome im Bereich der Z-Linie ent­ sprechen AEG II (auch „Kardiakarzinom“) und AEG III sind Tumoren ab 2 cm distal der Z-Linie (auch „subkardiale/Funduskarzinome“). Je nach Siewert-Klassifikation unter­ scheidet sich das operative Vorgehen. Die AEG-Tumoren wurden in der neuen TNMKlassifikation als „Tumoren des gastroösophagealen Übergangs“ zu einer von den Plattenepithelkarzinomen des Ösophagus unabhängigen Entität zusammengefasst (Tab. 1 und 2). Der Barrett-Ösophagus sollte regelmäßig leitlinienkonform kontrolliert werden. Für das T-Stadium und das lokoregionäre Lymphknotenstadium ist die Endosonografie den CT- und MRT-Bildgebungen in Sensitivität und Spezifität überlegen, vor allem für die Entscheidung für lokal-ablative Verfahren bei Frühkarzinomen ist die Endosono­ grafie unabdingbar. Sollte eine Lymphknotenmetastasierung entscheidend für das Therapieverfahren sein, ist die endosonografische Punktion das Verfahren der ersten Wahl. Für die Detektion von Metastasen ist die Computertomografie (CT) von Thorax und Abdomen notwendig, für die Leber kontrastverstärkt. Die MRT-Untersuchung ­ergibt i. d. R. keinen höheren Benefit und ist für fragliche Läsionen evtl. sinnvoll, in die­ sen Fällen ist jedoch oft das PET-CT sensitiver. P Beim lokalen Lymphknotenstaging und T-Stadium ist die Endosonografie dem CT und MRT überlegen. Das PET-CT ist auch signifikant sensitiver als EUS und konventionelles CT bei der ­ etektion nicht-regionärer Lymphknoten- und Fernmetastasen, und das histologi­ D sche Ansprechen auf neoadjuvante Radiochemotherapie kann mit 80% diagnosti­ scher Präzision angegeben werden. Patienten mit Plattenepithelkarzinom und NichtAnsprechen auf eine neoadjuvante Radiochemotherapie weisen auch eine sehr schlechte Prognose nach Operation auf. Die Laparoskopie hat vor allem beim fortge­ schrittenen distalen Karzinom des gastroösophagealen Übergangs einen möglichen Stellenwert als die sensitivste Methode zum Nachweis einer Peritonealkarzinose, die der konventionellen Bildgebung häufig entgehen kann. Tumormarker sind nur für Verlaufsbeobachtungen sinnvoll. Bei Erstdiagnose sind die Tumormarker CEA und CA 19-9 beim Adenokarzinom bzw. CEA und SCC beim Plattenepithelkarzinom nur in ca. 10–15% der Fälle erhöht. P Mittels diagnostischer Laparoskopie kann beim fortgeschrittenen distalen Adenokarzinom eine Peritoneal­ karzinose ausgeschlossen werden. P Für das Staging vor allem von Fernmetastasen ist ein CT von Thorax und Abdomen sinnvoll. 14 TNM-Klassifikation TNM-Klassifikation von Plattenepithelkarzinomen des Ösophagus Tab. 1 15 TNM-Klassifikation von Adenokarzinomen des gastroösophagealen Übergangs Tab. 2 16 Prognose des Ösophaguskarzinoms Aufgrund der frühen lymphogenen Metastasierung und späten Klinik werden mehr als 50% der Patienten in lokal fortgeschrittenen (N+)-Stadien diagnostiziert. Beim Plattenepithelkarzinom des Ösophagus sind die wichtigsten unabhängigen Pro­ gnoseparameter die T-Klassifikation und Metastasen, insbesondere das Ausmaß der Lymphknotenmetastasierung, ferner Lymphangiosis und Hämangiosis carcinomato­ sa. Hingegen ist in den meisten Studien das Tumorgrading oder der Proliferations­ index (MIB-1/Ki-67-Index) ohne Einfluss auf das Gesamtüberleben. Insgesamt beträgt die 5-Jahres-Überlebensrate des Plattenepithelkarzinoms etwa 10%. P Die Prognose des Plattenepithel­ karzinoms ist deutlich schlechter als die des Adenokarzinoms und hängt nicht vom Tumorgrading ab. Die Prognose des Adenokarzinoms ist deutlich besser als beim Plattenepithelkarzi­ nom mit 5-Jahres-Überlebensraten von bis zu 20%. Die wichtigsten Prognoseparame­ ter sind auch hier Lymphknoten- und Fernmetastasen, im Gegensatz zum Plattenepi­ thelkarzinom ist jedoch auch das Grading ein unabhängiger Prognosemarker. Bei einem G3-Karzinom beträgt die 5-Jahres-Überlebensrate etwa 17% im Vergleich zu 31% bei G1/G2-Karzinomen. Sowohl für das Plattenepithel- als auch das Adenokarzinom des Ösophagus wurden molekulare Prognosemarker beschrieben, die jedoch in der klinischen Routine noch nicht verwendet werden. Stadiengerechte Therapie der Ösophaguskarzinome Lokalisierte Erkrankung Läsionen, die auf die Mukosa beschränkt sind (oder allenfalls auf das obere Drittel der Submukosa [sm1], < 2 cm, weniger als ein Drittel der Zirkumferenz), können kurativ mittels endoskopischer Mukosaresektion (EMR) behandelt werden, mit der gleichen Sicherheit wie bei einer Operation, aber weniger Komplikationen. Tumoren mit der Tiefenausdehnung m3 weisen allerdings in ca. 5% der Fälle bereits Lymphknoten­ metastasen auf, bei Infiltration sm1 ist bereits in 8–19% der Fälle mit Lymphknoten­ metastasen zu rechnen. Diese sollten daher nur beim Grading G1/G2 ohne Lymph­ gefäß- oder vaskuläre Invasion mittels EMR therapiert werden. Allerdings tritt das Barrett-Karzinom häufig multifokal auf, sodass hier sehr engmaschige endoskopische Kontrollen unabdingbar sind. P Auf die Mukosa beschränkte Karzinome (sm1–3) können lokal-ablativ statt operativ behandelt werden. Fortgeschrittene Erkrankung Plattenepithelkarzinome proximal der Trachealbifurkation haben nach Operation eine hohe Rate an Anastomoseninsuffizienzen und eine enge embryogenetische und ana­ tomische Beziehung zum Trachealsystem, daher werden diese i. d. R. nur in Ausnah­ mefällen und im T1 N0-Stadium operiert. Plattenepithelkarzinome des mittleren und distalen Ösophagus können im Stadium T1–2 N0 primär operiert werden, allerdings ist im histologischen Präparat häufig eine Lymphknoteninvasion nachzuweisen. Im Sta­ dium T3 (T4) N+ wird überwiegend neoadjuvant eine Radiochemotherapie durchge­ führt. Vor allem auch aufgrund der häufigen Begleiterkrankungen der Patienten be­ trägt die Morbidität der Operation des Plattenepithelkarzinoms des Ösophagus bis zu 30% mit z. T. nicht unerheblicher Mortalität. P Proximale Ösophaguskarzinome werden i. d. R. nur in frühen Stadien operiert. Bei fortgeschrittenen Plattenepithelkarzinomen wird eine neoadjuvante Radiochemotherapie durchgeführt. Der Stellenwert einer neoadjuvanten Radiochemotherapie beim Plattenepithelkarzi­ nom des Ösophagus wurde in 2 Metaanalysen aus mehreren randomisierten Phase-IIIStudien belegt, der Überlebensvorteil nach 2 Jahren betrug ca. 13–18%, wobei Plat­ tenepithel- und Adenokarzinome in den Studien gemeinsam untersucht wurden. 2 randomisierte Phase-II-Studien zeigten außerdem ein gleiches Überleben von Ope­ rationen nach neoadjuvanter Radiochemotherapie vs. definitiver Radiochemothera­ pie. Den wichtigsten Prognosefaktor stellte das Ansprechen auf die neoadjuvante Therapie dar. Wesentlich für das Gesamtüberleben der Patienten ist jedoch vor allem die Erfahrung des operativen Zentrums. 17 Mehrere randomisierte prospektive Phase-III-Studien zeigten einen deutlichen Über­ lebensvorteil der Radiochemotherapie im Vergleich zur alleinigen Radiotherapie von etwa 20%, i. d. R. wurde eine Cisplatin- und 5-FU-haltige Chemotherapie parallel zur Bestrahlung verwandt, z. T. nach Induktionschemotherapie. Die Bestrahlungsdosis be­ trägt dabei neoadjuvant etwa 40 Gy, bei definitiver Radiochemotherapie etwa 50 Gy, z. T. mit zusätzlicher Boost-Bestrahlung von 10 Gy. Für das Adenokarzinom des gastroösophagealen Übergangs zeigten mehrere rando­ misierte prospektive Phase-III-Studien einen Überlebensvorteil von etwa 13–15% nach 5 Jahren für eine perioperative, Cisplatin/5-FU-haltige Chemotherapie. In den Studien wurden die distalen Adenokarzinome des Ösophagus und Magenkarzinome gemein­ sam untersucht. In einem japanischen Patientengut wurde in einer Phase-III-Studie ferner ein deutlicher Überlebensvorteil für eine Oxaliplatin/5-FU-haltige adjuvante Therapie gezeigt. Als Standard hat sich in den europäischen Ländern eine periopera­ tive Cisplatin/5-FU-haltige Chemotherapie für Tumorstadien ab uT3 oder N+ etabliert. Neoadjuvante Kombinationschemotherapien mit Docetaxel, 5-Fluorouracil (5-FU) und Oxaliplatin („FLOT“) zeigten beim Adenokarzinom bisher unerreichte Raten an patho­ logischen Komplettremissionen und werden in Phase-III-Studien untersucht. P Adenokarzinome AEG II–III werden in Europa analog den Magenkarzinomen perioperativ chemotherapiert, z. T. (v. a. AEG I) auch neoadjuvant mit Radiochemotherapie behandelt. Valide Daten aus randomisierten Studien, die die neoadjuvante Radiochemotherapie mit einer alleinigen perioperativen Chemotherapie vergleichen, liegen aktuell nicht vor. Palliative Therapie Grundlegendes Ziel der palliativen Therapie ist die Verbesserung oder Erhaltung der Lebensqualität noch vor der möglichen Lebenszeitverlängerung. Dabei ist der Stel­ lenwert der Erhaltung einer oralen Nahrungsaufnahme auch als Grundlage für Sozial­ funktionen sehr hoch. Ein endoskopisch platzierter ösophagealer Stent führt zu einer raschen Wiederherstellung der Nahrungspassage. Die Anlage der heute verfügbaren selbstexpandierenden Metallendoprothesen ist einfach, ambulant in Analgosedie­ rung möglich und wird von den Patienten sehr gut toleriert, Ausnahme hiervon sind hochproximale Ösophagusstenosen. Auch für ösophagotracheale tumorbedingte Fis­ teln sind Endoprothesen sinnvoll. Bougierungen führen nur zu inakzeptabel kurz an­ dauernden Besserungen. Für die regelmäßige Nahrungszufuhr kann dennoch – oder im Verlauf der Erkrankung – die Anlage einer PEG sinnvoll sein. Im Vergleich zur endo­ luminalen Protheseneinlage führt die transluminale Brachytherapie zu einer verzöger­ ten Beschwerdebesserung, jedoch wahrscheinlich für eine längere Zeitdauer. Die transkutane Radiochemotherapie, evtl. in Kombination mit einer Brachytherapie, er­ laubt z. T. über Jahre eine effektive ösophageale Tumorkontrolle. P Ambulant endoskopisch implantierte Ösophagusstents erlauben bei Tumor­ stenosen eine rasche Wiederherstellung der oralen Nahrungspassage. Endo­ luminale und transkutane Bestrahlung, z. T. kombiniert mit Chemotherapie, führt teilweise zu lang andauernder lokaler Tumorkontrolle. Der Stellenwert der alleinigen Chemotherapie ist beim metastasierten Plattenepithelund beim Adenokarzinom des Ösophagus unterschiedlich. Für die palliative Chemo­ therapie beim metastasierten oder fortgeschrittenen Plattenepithelkarzinom ist kein Überlebensvorteil belegt worden, wohingegen beim Adenokarzinom durch eine Kombinationschemotherapie die mittlere Überlebenszeit von 4–5 Monaten auf fast 11 Monate verlängert werden konnte. Beim fortgeschrittenen Adenokarzinom des Öso­ phagus ist auch für eine Zweitlinienchemotherapie ein Überlebensvorteil gezeigt worden. Beim Plattenepithelkarzinom des Ösophagus werden durch Einzelsubstan­ zen Ansprechraten um 20% erzielt und mit Kombinationstherapien bis zu etwa 45%, jedoch betrug das mittlere Überleben selten mehr als 6–7 Monate bei Remissionsdau­ ern von 3–6 Monaten (Tab. 3 und 4). P Die palliative Chemotherapie führt beim Plattenepithelkarzinom im Gegensatz zum Adenokarzinom nicht zu einer Verlängerung des Gesamtüberlebens. Beim metastasierten Adeno­ karzinom ist auch die Zweitlinien­ therapie etabliert. 18 Wirksamkeit von Einzelsubstanzen beim Ösophaguskarzinom Substanz Verabreichung Patientenzahl Ansprechrate 5-Fluorouracil (5-FU) 500 mg/m2 d1–5 119 22% Mitomycin 20 mg/m2 d1 q35 31 35% Cisplatin 100 mg/m2 d1 q21 75 19% Paclitaxel 250 mg/m2 24h 92 25% Docetaxel 75–100 mg/m2 q21 96 21% Irinotecan 125 mg/m2 d1,8,15,21 q36 55 15% Vinorelbin 25 mg/m2 q8 30 20% Bleomycin 10–20 mg/m2 2 x/Woche 80 15% Wirksamkeit von Kombinationstherapien beim Ösophaguskarzinom Substanzen Patientenzahl Ansprechrate Medianes Überleben (Monate) Cisplatin/5-FU 34 35% 7,6 Cisplatin/5-FU/ Folsäure (FA) 30 27% 6 Cisplatin/5-FU/ Paclitaxel 118 55% 7–13 Cisplatin/Paclitaxel 167 47% 7 Cisplatin/Etoposid 73 48% 7 Cisplatin/Irinotecan 35 57% 14 Cisplatin/Vinorelbin 71 34% 6,8 Cisplatin/Bleomycin 99 24% 4–7 Tab. 3 Tab. 4 19 Therapiekonzepte mit Kombinationschemotherapien analog zum Plattenepithelkar­ zinom des Oro-/Hypopharynx mit den EGF-Rezeptorantikörpern Cetuximab/Panitu­ mumab und Taxanen zeigen höhere Ansprechraten und ein deutlich verlängertes progressionsfreies Überleben, Ergebnisse aus randomisierten prospektiven Phase-IIIStudien stehen jedoch aus (Tab. 5). Mögliche Kombinationschemotherapien beim Plattenepithelkarzinom des Ösophagus Substanzen Verabreichung Wiederholung Referenz Cisplatin/ 5-FU 100 mg/m2 d1 1000 mg/m2 d1–5 d29 Bleiberg 1997 Cisplatin/ 5-FU/ 50 mg/m2 d1,15,29 2000 mg/m2 d1,8,15,22,29,36 500 mg/m2 d1,8,15,22,29,36 d50 Lutz 2007 Cisplatin/ 5-FU/ Paclitaxel 20 mg/m2 d1–5 750–1000 mg/m2 d1–5 175 mg/m2 d1 d29 Ilson 1998 Cisplatin/ Irinotecan 30 mg/m2 d1–4 65 mg/m2 d1–4 d42 Ilson 1999 Cisplatin/ Vinorelbin 80 mg/m2 d1 25 mg/m2 d1,8 d21 Conroy 2002 1000 mg/m2 d1–14 75 mg/m2 d1 d21 Lutz 2007 Docetaxel mono 35 mg/m2 d1,8,15,22,29,36 d50 Abbrederis 2008 Vinorelbin mono 25 mg/m2 wöchentlich kont. Conroy 1996 AUC 5–6 80 mg/m2 wöchentlich d21 Fury 2011 Cisplatin/ 5-FU/ Cetuximab 50 mg/m2 d1+2 1000 mg/m2 d1–5 400/250 mg/m2 wöchentlich d21 Andreadis 2003, Vermorken 2008 Carboplatin/ 5-FU AUC 5–6 1000 mg/m2 d1–5 d21 Jassem 1993, Kaasa 1991 75 mg/m2 75 mg/m2 d21 Dreyfuss 1996 FA Capecitabin/ Docetaxel Tab. 5 Analog HNO-SCC: Carboplatin/ Paclitaxel Docetaxel/ Cisplatin 20 Auch beim Adenokarzinom wurde in Phase-II-Studien eine Wirksamkeit von Cetu­ ximab belegt, jedoch wurde bisher im Gegensatz zu kolorektalen Karzinomen keine klinisch relevante Korrelation des Ansprechens auf Cetuximab mit dem k-Ras-Mutati­ onsstatus belegt. Hingegen werden beim Adenokarzinom des Ösophagus länger an­ haltende Remissionen beobachtet und die Verlängerung des Gesamtüberlebens durch Trastuzumab wurde bei Her2-überexprimierenden Adenokarzinomen des gast­ roösophagealen Übergangs in einer großen Phase-III-Studie gezeigt. Kombinations­ chemotherapien mit Docetaxel, 5-FU und Oxaliplatin zeigten beim Adenokarzinom bei guter Verträglichkeit hohe pathologische Remissionsraten und werden in weite­ ren Phase-III-Studien untersucht (Tab. 6). Mögliche Kombinationschemotherapien beim Adenokarzinom des Ösophagus analog dem Magenkarzinom Substanzen Verabreichung Wiederholung Referenz Epirubicin/ Cisplatin/ 5-FU 50 mg/m2 d1 60 mg/m2 d1 1400 mg/m2 kont./Woche d21 Cunningham 2006 Epirubicin/ Oxaliplatin/ Capecitabin 50 mg/m2 d1 130 mg/m2 d1 1250 mg/m2 kont. d21 Cunningham 2006 Docetaxel/ Oxaliplatin/ 5-FU/ FA 50 mg/m2 d1 85 mg/m2 d1 2600 mg/m2 24h 200 mg/m2 d14 Al-Batran 2008 2400 mg/m2 48h, 400 mg/m2 Bolus d1 200 mg/m2 d1 180 mg/m2 d1 d14 Lorizzo 2009 d14 Kim 2011 FA/ Oxaliplatin 1200 mg/m2 48h, 400 mg/m2 Bolus d1+2 200 mg/m2 d1+2 85 mg/m2 d1 Trastuzumab/ Capecitabin/ Cisplatin* 8/6 mg/kg d1 1000 mg/m2 tid d1–14 80 mg/m2 d1 d21 Bang 2010 5-FU/ FA/ Irinotecan 5-FU/ P Gut wirksame Substanzen beim Adenokarzinom sind 5-FU, Cisplatin, Oxaliplatin, Docetaxel, Irinotecan und bei Her2-überexprimierenden Adeno­ karzinomen Trastuzumab. Tab. 6 * nur histologisch Her2/Neu 3+ Magenkarzinome 21 Zu empfehlende Literatur Literatur 1 Blot WJ, Devesa SS, Kneller RW, Fraumeni JF Jr. Rising incidence of adenocarcinoma of the esophagus and gastric cardia. JAMA 1991; 265: 1287–1289. 2 Fury MG, Pfister DG. Current recommendations for systemic therapy of recurrent and/or metastatic head and neck squamous cell cancer. J Natl Compr Canc Netw 2011; 9: 681–689. 3 Moehler M, Al-Batran SE, Andus T, Anthuber M, Arends J, Arnold D, et al. S3-Leitlinie Magenkarzinom – Diagnostik und Therapie der Adenokarzinome des Magens und ösophagogastralen Übergangs. Z Gastroenterol 2011; 49: 461–531. 4 Moehler M, Mueller A, Trarbach T, Lordick F, Seufferlein T, Kubicka S, Geissler M, Schwarz S, Galle PR, Kanzler S; German Arbeitsgemeinschaft Internistische Onkologie. Cetuximab with irinotecan, folinic acid and 5-fluorouracil as first-line treatment in advanced gastroesophageal cancer: a prospective multi-center biomarker-­ oriented phase II study. Ann Oncol 2011; 22: 1358–1366. 5 Okines AFC, Cunningham D. Multimodality treatment for localized gastro-oesophageal cancer. Ann Oncol 2010; 21: vii286–293. 6 Stahl M, Budach W, Meyer HJ, Cervantes A; ESMO Guidelines Working Group. Esophageal cancer: Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2010; 21: v46–49. 7 Stahl M. Is there any role for surgery in the multidisciplinary treatment of esophageal cancer? Ann Oncol 2010; 21: vii283–285. 8 Thallinger CM, Raderer M, Hejna M. Esophageal cancer: a critical evaluation of systemic second-line therapy. J Clin Oncol 2011; 29: 4709–4714. 9 Wagner AD, Grothe W, Haerting J, Kleber G, Grothey A, Fleig WE. Chemotherapy in advanced gastric cancer: a systematic review and meta-analysis based on aggregate data. J Clin Oncol 2006; 24: 2903–2909. 10 Wijnhoven BP, Siersema PD, Hop WC, van Dekken H, Tilanus HW. Adenocarcinomas of the distal oesophagus and gastric cardia are one clinical entity. Rotterdam Oesophageal Tumour Study Group. Br J Surg 1999; 86: 529–535. 22 Fragen zur Diagnose und Therapie des Ösophaguskarzinoms Frage 1: Welche Aussage ist richtig? Das Plattenepithelkarzinom des Ösophagus EE EE EE EE EE Oberer GI-Trakt hat eine steigende Inzidenz in Deutschland ist ein sehr chemosensibler Tumor ist am häufigsten hochproximal metastasiert sehr früh lymphogen weist eine enge Korrelation mit dem Body­Mass­Index (BMI) auf Frage 2: Welche Aussage ist richtig? Das Adenokarzinom des Ösophagus EE EE EE EE EE Falk Gastro-Kolleg ist der solide Tumor mit dem stärksten Inzidenzanstieg in Europa hat in den USA (noch) eine niedrigere Inzidenz als das Ösophaguskarzinom entsteht häufig auf dem Boden einer gastralen Heterotopie des Ösophagus hat als Risikofaktoren vor allem Nikotin­ und Alkoholabusus wird in der aktuellen TNM­Klassifikation gemeinsam mit dem Plattenepithel­ karzinom aufgeführt Frage 3: Welche Aussage ist richtig? Fortgeschrittene (lymphogen metastasierte) Plattenepithelkarzinome des Ösophagus Bitte beachten Sie: Bei der Beantwortung der Fragen ist immer nur 1 Antwort möglich. Die Beantwortung der Fragen und Erlangung des Fortbildungszertifikats ist nur online möglich. Bitte gehen Sie dazu auf unsere Homepage www.falkfoundation.de. Unter dem Menüpunkt Falk Gastro­Kolleg können Sie sich anmelden und die Fragen beantworten. Bitte diesen Fragebogen nicht per Post oder Fax schicken! EE werden mit einer neoadjuvanten Therapie mit Cisplatin/Cetuximab und Bestrahlung behandelt EE sind mit niedriger Morbidität und Mortalität zu operieren, wenn sie hochproximal liegen EE werden i. d. R. primär operiert EE weisen eine z. T. Jahre anhaltende lokale Tumorkontrolle nach definitiver Radiochemotherapie auf EE weisen bei Frauen im Vergleich zu Männern eine höhere Inzidenz auf Frage 4: Welche Aussage ist richtig? Patienten mit metastasiertem Plattenepithelkarzinom des Ösophagus EE werden in Abhängigkeit vom k­Ras­Mutationsstatus mit Cetuximab und Kombinationschemotherapien behandelt EE überleben durch Kombinationschemotherapien fast doppelt so lang EE sind chemotherapierefraktär EE werden z. T. analog Chemotherapieprotokollen von Plattenepithelkarzinomen des Oro­ und Hypopharynx behandelt EE sollten in jedem Fall eine Kombinationschemotherapie statt Einzelsubstanzen erhalten Wichtig: Fragebeantwortung unter www.falkfoundation.de Falk Gastro-Kolleg Frage 5: Welche Aussage ist richtig? Für die Diagnose und das Staging des Ösophaguskarzinoms EE sind ein Röntgen­Thorax mit Abdomensonografie und eine Ösophago­Gastro­ Duodenoskopie ausreichend EE ist eine Endosonografie immer notwendig EE führt eine PET­CT nicht selten zu einer Veränderung der Therapiestrategie EE ist bei bildmorphologisch eindeutigem Befund keine bioptische Sicherung notwendig EE ist beim Barrett­Karzinom die diagnostische Laparoskopie fester Bestandteil 23 Frage 6: Welche Aussage ist falsch? Effektive Kombinationschemotherapien beim Plattenepithelkarzinom beinhalten EE EE EE EE EE 5-FU und Cisplatin 5-FU und Carboplatin Cetuximab und Cisplatin Paclitaxel Pemetrexed Falk Gastro-Kolleg Oberer GI-Trakt Frage 7: Welche Aussage ist falsch? Patienten mit metastasiertem Adenokarzinom des Ösophagus EE werden häufig analog dem Magenkarzinom behandelt EE erreichen durch Kombinationschemotherapien eine deutliche Überlebens­ verlängerung EE profitieren im Gesamtüberleben von einer Zweitlinienchemotherapie EE werden beim k-Ras-Wildtyp des Tumors mit Cetuximab-Kombinationschemo­ therapien behandelt EE weisen mit optimaler Therapie ein durchschnittliches Überleben von weniger als 1 Jahr auf Frage 8: Welche Aussage ist falsch? Die Prognose des Plattenepithel­ karzinoms des Ösophagus EE EE EE EE EE hängt stark vom Grading des Tumors ab wird deutlich von den Grunderkrankungen des Patienten bestimmt ist abhängig von der betroffenen Höhe des Ösophagus ist schlechter als beim Adenokarzinom wird vor allem durch die Metastasierung bestimmt Frage 9: Welche Aussage ist falsch? Risikofaktoren beim Ösophagus­ karzinom sind EE für die Pathogenese des Adenokarzinoms Reflux und BMI EE für die Pathogenese des Plattenepithelkarzinoms Nikotinabusus EE für die Operation des Plattenepithelkarzinoms häufiger Begleiterkrankungen als beim Adenokarzinom EE molekulargenetisch keine bekannt EE das Ausmaß der Lymphknotenmetastasierung Frage 10: Welche Aussage ist falsch? Für das Staging des Ösophagus­ karzinoms EE ist die Endosonografie für die Detektion des T-Stadiums sensitiver als eine Computertomografie (CT) EE führt eine PET-CT im Vergleich zur CT und MRT zu signifikanten Veränderungen von Therapieentscheidungen EE ist die CT für die Detektion von Fernmetastasen das Verfahren der ersten Wahl EE ist bei fortgeschrittenen und tief sitzenden Barrett-Karzinomen für die Detektion einer Peritonealkarzinose die Laparoskopie das sensitivste Verfahren EE ist ein Barium-Breischluck fester Bestandteil der Diagnostik 24