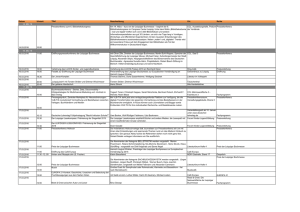
Expression von Minichromosome Maintenance
Werbung

Aus der Klinik für Dermatologie und Allergologie des St. Josef-Hospital Bochum -Universitätsklinikder Ruhr-Universität Bochum Direktor: Prof. Dr. med. P. Altmeyer Expression von Minichromosome Maintenance-Proteinen im Merkelzellkarzinom und deren Verwendung als Proliferationsmarker Inaugural-Dissertation zur Erlangung des Doktorgrades der Medizin einer Hohen Medizinischen Fakultät der Ruhr-Universität Bochum vorgelegt von Annika Breininger aus Zweibrücken 2010 Dekan: Referent: Koreferent: Prof. Dr. med. Klaus Überla PD Dr. med. Thilo Gambichler PD Dr. med. Christian Teschendorf Tag der mündlichen Prüfung: 30.06.2011 Abstract Breininger, Annika Expression von Minichromosome Maintenance-Proteinen im Merkelzellkarzinom und deren Verwendung als Proliferationsmarker Problem: Das Merkelzellkarzinom ist ein aggressiver Hauttumor und gewinnt in den letzten Jahren wegen seiner steigenden Inzidenz an klinischer Bedeutung. Seine eindeutige Diagnose ist noch immer nicht in allen Fällen gewährleistet und histologische Überschneidungen mit anderen kleinzelligen Hauttumoren sind häufig. Minichromosome maintenance (MCM)-Proteine sind in anderen Tumoren schon als proliferative Marker beschrieben, fanden jedoch bisher in der Diagnostik von Hauttumoren kaum Beachtung. Die Untersuchung von MCM-Proteinen im Merkelzellkarzinom war Gegenstand dieser Arbeit und stellt eine wichtige Neuerung in der immunhistochemischen Tumordiagnostik und dar. Methode: Es wurden Proben aus läsionaler Haut von acht Merkelzellkarzinom-Patienten mittels immunhistochemischer Färbungen untersucht. Als Vergleichsgruppe wurden Proben von neun Melanompatienten eingeschlossen. Es wurden immunhistochemische Färbungen mit den Markern CK20, Ki-67, p53, p21 und MCM4, MCM6 und MCM7 hergestellt und die Fluoreszenzsignale der beiden Tumorgruppen verglichen. Ergebnis: Die mikroskopische Auswertung der fluoreszenzmarkierten Schnittpräparate ergab für das Merkelzellkarzinom im Vergleich zum Malignen Melanom eine signifikante Erhöhung von MCM4 (66,0 ± 26,5% vs. 33,9 ± 22,4%; P = 0,017), MCM6 (70,9 ± 11,9% vs. 31,7 ± 22,7%; P = 0,0031) und MCM7 (76,5 ± 16,4% vs. 34,9 ± 25,5%; P = 0,0013). Auch die Ki-67-Positivität war im Merkelzellkarzinom gegenüber dem Melanom deutlich erhöht (28,7 ± 7,9% vs. 11,0 ± 9,2%; P = 0,0012). Die Rate positiver Zellen in der Färbung mit p53 und p21 war im Vergleich zu gesunder Haut relativ hoch, jedoch bestand kein signifikanter Unterschied zwischen Merkelzellkarzinom und Melanom. Diskussion: Die Arbeit zeigt, dass die immunhistochemische MCM-Färbung als Proliferationsmarker im Merkelzellkarzinom angewandt werden kann. Die Markierung von MCM4, MCM6 und MCM7 könnte eine Abgrenzung des klinisch unspezifischen Merkelzellkarzinoms gegenüber dem Malignen Melanom ermöglichen. Des Weiteren erbringt sie Vorteile gegenüber der gängigen Ki-67-Färbung, da die MCM-Färbung die Gesamtheit der teilungsfähigen Zellen darstellt und somit eine genauere Beurteilung der Proliferationsfraktion ermöglicht. Hierdurch kann über die Form und Intensität der Therapie beim einzelnen Patienten genauer entschieden werden. Die Evaluation der Expression von MCM-Proteinen im Merkelzellkarzinom stellt eine Erweiterung der differentialdiagnostischen Verfahren dar und ermöglicht neue Einblicke in zelluläre Abläufe um MCM-Proteine. 1 Inhaltsverzeichnis Seite I. Einleitung 6 1.1 Das Merkelzellkarzinom (Merkel cell carcinoma, MCC) 6 1.2 Ätiologie des Merkelzellkarzinoms 7 1.3 Epidemiologie des Merkelzellkarzinoms 9 1.4 Diagnostik des Merkelzellkarzinoms 10 1.4.1 Klinik des Merkelzellkarzinoms 10 1.4.2 Histologie des Merkelzellkarzinoms 13 1.4.3 Differentialdiagnose des Merkelzellkarzinoms 14 Immunhistochemische Marker im Merkelzellkarzinom 16 1.5.1 Minichromosome maintenance Proteine 16 1.5.2 p21 18 1.5.3 p53 18 1.5.4 CK 20 20 1.5.5 Ki-67 21 1.5.6 Differentialdiagnostische Marker des Merkelzellkarzinoms 21 1.6 Ausbreitungsdiagnostik (Staging) des Merkelzellkarzinoms 23 1.7 Stadieneinteilung und Prognose des Merkelzellkarzinoms 23 1.8 Therapie des Merkelzellkarzinoms 24 1.8.1 Operative Therapie des Merkelzellkarzinoms 24 1.8.2 Strahlentherapie des Merkelzellkarzinoms 25 1.8.3 Chemotherapie des Merkelzellkarzinoms 25 1.8.4 Nachsorge des Merkelzellkarzinoms 26 1.5 2 Seite 1.9 Das Maligne Melanom 27 1.10 Klassifikation des Malignen Melanoms 27 1.11 Ätiologie und Risikofaktoren des Malignen Melanoms 27 1.12 Diagnostik des Malignen Melanoms 28 1.12.1 Klinik und Histologie des Malignen Melanoms 28 1.12.2 Immunhistochemie des Malignen Melanoms 30 1.12.3 Differentialdiagnose des Malignen Melanoms 30 1.12.4 Ausbreitungsdiagnostik des Malignen Melanoms 31 1.13 Prognose und Stadieneinteilung des Malignen Melanoms 31 1.14 Fragestellung 33 II. Material und Methoden 34 2.1 Gewebeproben 34 2.2 Herstellung von Paraffinschnitten 35 2.3 Entparaffinierung und Gewebevorbehandlung 36 2.4 Immunhistochemische Färbung der Schnitte 37 2.5 Auswertung der histologischen Schnitte 38 2.6 Statistik 38 III. Ergebnisse 40 3.1 Patienten 40 3.2 Zytokeratin 20 41 3.3 p21 und p53 42 3.4 Ki-67 43 3.5 Minichromosome Maintenance Proteine: MCM4, MCM6, MCM7 44 3 Seite IV. Diskussion 46 4.1 Onkogenese des MCCs 46 4.1.1 Merkelzellkarzinom und MCV 46 4.2 Histologie der Merkelzelle und des Merkelzellkarzinoms 49 4.3 Immunhistochemische Marker des Merkelzellkarzinoms 49 4.4 Perspektiven 55 V. Zusammenfassung 57 VI. Literaturverzeichnis 58 Danksagung Lebenslauf 4 Tabellenverzeichnis Seite Tabelle 1: Stadieneinteilung von Merkelzellkarzinomen nach Yiengpruksawan 24 Tabelle 2: Tumordicke nach Breslow und empfohlener Sicherheitsabstand für 31 die chirurgische Exzision des Malignen Melanoms Tabelle 3: Invasionslevel des Malignen Melanoms nach Clark 32 Tabelle 4: Patientengruppe Merkelzellkarzinom 34 Tabelle 5: Patientengruppe Malignes Melanom 35 Tabelle 6: Verwendete Marker, deren Herkunft und Verdünnung 37 Tabelle 7: Expressionsunterschiede verschiedener fluoreszenzmarkierter 40 Zellzyklusproteine und CK20 zwischen Merkelzellkarzinom und Malignem Melanom 5 Abbildungsverzeichnis Seite Abbildung 1: Schematische Darstellung einer Merkelzelle 7 Abbildung 2: Klinisches Bild eines Merkelzellkarzinom-Rezidivs im Gesicht 11 Abbildung 3: Klinisches Bild eines Merkelzellkarzinoms im Gesicht. 11 Abbildung 4: Detailaufnahme eines Merkelzellkarzinoms 12 Abbildung 5: HE-Färbung eines Merkelzellkarzinoms in 100facher 13 Vergrößerung Abbildung 6: Adenom-Karzinom-Sequenz 19 Abbildung 7: Klinisches Bild eines primär nodulären Melanoms 29 Abbildung 8: CK20-Färbung im MCC-Präparat in 20-facher und 40-facher 41 Vergrößerung Abbildung 9: Immunhistochemische Färbung mit den Markern p21 und 42 p53 bei MCC und MM in 200facher Vergrößerung Abbildung 10: Expressionsunterschiede von Ki-67 zwischen MCC und MM 43 Abbildung 11: Mikroskopische Aufnahmen immunhistochemischer Färbungen 45 in läsionaler Haut von Patienten mit Merkelzellkarzinom und Malignem Melanom in 200facher Vergrößerung 6 I. Einleitung 1.1 Das Merkelzellkarzinom (Merkel cell carcinoma, MCC) Das Merkelzellkarzinom (Merkel cell carcinoma = MCC) ist ein seltenes, aggressives Malignom der Haut mit neuroendokriner Differenzierung. Es wurde erstmalig von Cyril Toker im Jahre 1972 als „trabekuläres Karzinom“ der Haut beschrieben (Toker, 1972). Das auch als kutanes neuroendokrines Karzinom bezeichnete Malignom tritt ca. doppelt so oft bei Männern wie bei Frauen auf und entsteht vorwiegend im höheren Lebensalter aus der Merkelzelle der Haut (Pectasides et al., 2006). Der Krankheitsverlauf ist in ca. 30% der Fälle letal. Lokalrezidive sind sehr häufig und lokale oder regionäre Metastasen treten bei 50% der Patienten innerhalb eines Jahres auf (Fritsch, 2008). Die von den meisten Autoren als Ursprung des MCCs angesehene Merkelzelle wurde nach dem Göttinger Anatomen Friedrich Merkel (1845–1919) benannt (Merkel, 1875). Der histologische Fachterminus der Merkelzelle ist Epitheliocytus tactilis, im Englischen bezeichnet man sie als „sensory epithelial cell“ oder „Merkel cell“. Merkelzellen sind in der Basalschicht der Epidermis ansässige, neuroendokrine Zellen mit Mechanorezeptorfunktion. Lichtmikroskopisch erscheinen sie als runde, etwas größere und hellere Zellen mit gelapptem Kern und sind nur schwer von Basalzellen und Langerhans-Zellen zu unterscheiden. Im Elektronenmikroskop finden sich typische membranständige, elektronendichte Granula (Camisa and Weissmann, 1982). Man findet Merkelzellen einzeln in der unbehaarten Haut oder in Gruppen in der behaarten Haut, wo sie auch als Pinkus-Iggo-Tastscheiben bezeichnet werden (Iggo and Muir, 1962). Sie sind zwischen den Basalzellen von mehrschichtigem Epithel der Haut oder Schleimhaut und im basalen Epithel von Haarzwiebeln lokalisiert. Von dort reichen sie mit kurzen fingerförmigen Ausläufern nach oben ins Epithel hinein. Merkelzellen entstammen der Neuralleiste und enthalten neuropeptidhaltige Granula sowie Zytokeratine. Sie werden im Allgemeinen dem APUD-System („Amine Precursor Uptake and Decarboxylation System“) zugeordnet, das auch neuroendokrin wirksame Zellen des gastrointestinalen und bronchopulmonalen Trakts umfasst. In ihrer Funktion als sekundäre Sinneszellen leiten Merkelzellen sensorische Reize über Synapsen an die zugehörigen weit entfernten pseudounipolaren Spinalganglienzellen weiter, wo die Tastempfindungen zentralnervös verarbeitet werden. Die dendritischen 7 Abb. 1: Schematische Darstellung einer Merkelzelle (aus: Iggo, 1977). Die Zelle sitzt direkt der Basallamina (BM) auf, Desmosomen (D) verbinden sie mit den benachbarten Basalzellen und am unteren Pol befinden sich sekretorische Granula (G). Unter der Merkel-Zelle ist die Nervenendplatte (NP) erkennbar, die aus einem ummarkten Axon (A) hervorgeht. GY = Glykogen, GO = Golgi-Apparat, E = Keratinozyt, N = Zellkern. Endigungen dieser Spinalganglienzellen befinden sich in der Dermis und bilden gemeinsam mit der Merkelzelle einen als Merkel-Scheibe bezeichneten Komplex. Merkelzellen zählen zu den langsam adaptierenden Mechanorezeptoren und reagieren auf statische und dynamische Reize sowie Vibration, wobei sie hauptsächlich als Druckrezeptoren dienen. Ein adäquater Reiz ist das Eindrücken der Haut. 1.2 Ätiologie des Merkelzellkarzinoms Obwohl die Ätiologie des MCCs bisher nicht vollständig geklärt ist, kennt man bereits mehrere Risikofaktoren, die zur Pathogenese beitragen. Diese umfassen hauptsächlich Immunsuppression, UV-Licht Plattenepithelkarzinome, und UV-Licht-assoziierte Basalzellkarzinome oder deren Hauttumore Vorläufer. Die wie UV- Karzinogenese wird besonders deutlich durch die hauptsächliche Tumorlokalisation in sonnenexponierten Hautarealen (Medina-Franco et al., 2001) und den regionalen Inzidenzunterschieden, die mit dem UV-B-Index korrelieren (Miller and Rabkin, 1999). 8 Bei Psoriasis-Patienten, die mit Methoxsalen und UV-A behandelt wurden, trat eine 100fache Steigerung der MCC-Inzidenz auf (Lunder and Stern, 1998). Der Risikofaktor Immunsuppression spielt beim MCC anscheinend eine entscheidende Rolle. So kommen MCC beispielsweise bei organtransplantierten Patienten oder HIV-Infizierten viel häufiger und in deutlich jüngerem Alter vor (Engels et al., 2002; Buell et al., 2002). Das Verhältnis von MM zu MCC beträgt nach Transplantation 6:1 verglichen mit 65:1 in der Allgemeinbevölkerung. Beachtlich ist, dass die Hälfte der organtransplantierten Patienten mit MCC jünger als 50 Jahre sind (Buell et al., 2002). Bei HIV-Patienten oder Patienten mit erworbener Immundefizienz ist das relative MCC-Risiko 13,4 im Vergleich zur Allgemeinbevölkerung (Engels et al., 2002). Ebenso haben medikamentös immunsupprimierte Patienten ein erhöhtes Risiko, an MCC zu erkranken (Goessling et al., 2002). In einer retrospektiven Analyse von über 1000 Fällen wurden 14,5% der MCC-Patienten während oder vor der MCC-Therapie immunsuppressiv behandelt (Medina-Franco et al., 2001). Auch bei Patienten mit Multiplem Myelom, Chronisch Lymphatischer Leukämie, Non Hodgkin-Lymphom und Malignem Melanom wurde ein erhöhtes Risiko für die Erkrankung an MCC festgestellt (Vlad and Woodlock, 2003). Ionisierende Strahlung als MCC-Auslöser wird gelegentlich in der Literatur diskutiert (Lardy et al., 1996). Erste Hinweise auf genetische Faktoren lassen einen Zusammenhang mit der Entstehung des MCC vermuten. Auf dem kurzen Arm von Chromosom 1 (1p) wurde in 40% der untersuchten MCC-Fälle eine Aberration gefunden, was eine Rolle von Tumorsuppressorgenen auf 1p im Prozess der Tumorgenese wahrscheinlich macht. Ein ähnlicher Zusammenhang ist schon bei anderen der Neuralleiste entstammenden Tumoren wie Neuroblastomen und Melanomen belegt (Bichakjian et al., 2007). Mehrere andere Mutationen wurden von Houben et al. in MCC-Zellen beschrieben. So fand sich in 33% der Proben der heterozygote Austausch einer Base in dem für den Platelet-derived growth factor (PDGF)-Rezeptor kodierenden Gen, was zur Expression einer anderen Aminosäure in dem Rezeptor führt. Die Relevanz der Mutation ist noch nicht geklärt, jedoch wird PDGF als Wachstumsfaktor mit Onkogenese in Zusammenhang gebracht. Für diverse Wachstumsfaktoren ist der Phosphatidylinositol 3,4,5-Triphosphat (PIP3)-Weg ein wichtiger Signalweg. Das PIP3-dephosphorylierende Phosphatase and Tensin Homolog (PTEN) konnte in MCC-Gewebe kaum nachgewiesen werden. Da es normalerweise den Übertragungsweg hemmt, muss von einer gesteigerten Übertragung im MCC ausgegangen werden. Zwar konnte in vielen 9 Fällen der Verlust der für PTEN kodierenden Region (Chromosom 10q) nachgewiesen werden, jedoch nur für ein Allel. Die Inaktivierung des zweiten Allels scheint durch verschiedene andere Mechanismen statt zu finden, z. B. durch epigenetisches silencing (Houben et al., 2009). Des Weiteren beschrieben Houben et al. in drei Vierteln der untersuchten MCC-Fälle eine Überexpression der anti-apoptotisch wirkenden Bcl-2-Proteine. Die Apoptose ist ein wichtiger Faktor in der Tumorgenese und wird sowohl extrinsisch als auch intrinsisch reguliert. Die intrinsische Regulation geschieht hauptsächlich durch Proteine der Bcl-2-Familie. In Versuchen an Mäusen in vivo bewirkte die Inhibition der Bcl-2Expression einen Rückgang der Tumormasse. Im Versuch an Menschen konnte diese Wirkung jedoch nicht bestätigt werden. Auch das anti-apoptotische Survivin, das in differenziertem Gewebe normalerweise nicht nachweisbar ist, konnte in allen 19 untersuchten MCCs gefunden werden. Dabei konnte, anders als bei der Bcl-2Expression, ein Zusammenhang zwischen der Survivin-Verteilung innerhalb der Zellen und einem aggressiven klinischen Verlauf nachgewiesen werden (Houben et al., 2009). Interessanterweise wurde kürzlich ein bislang noch nicht beschriebenes Polyomavirus in MCC gefunden (Merkel cell polyomavirus = MCV), dessen klonale Integration in die DNA der Tumorzellen einen kausalen Zusammenhang mit der Entstehung des MCC sehr wahrscheinlich werden lässt (Feng et al., 2008). 1.3 Epidemiologie des Merkelzellkarzinoms Das MCC ist ein Karzinom des höheren Alters mit einem mittleren Lebensalter der Patienten bei Erstdiagnose von 69 Jahren (mit einer Spanne von 7-104 Jahren). Bei über 65-jährigen ist das MCC 24mal häufiger zu finden als bei unter 65-jährigen, und nur 5% der Fälle treten vor dem 50. Lebensjahr auf (Pectasides et al., 2006; Bichakjian et al., 2007). Laut dem „U.S. Surveillance, Epidemiology, and End Results Program“ des amerikanischen „National Cancer Institute“ hat sich die altersstandardisierte MCCInzidenz von 0,15 pro 100.000 im Jahre 1986 auf 0,44 pro 100.000 im Jahr 2001 verdreifacht (Bichakjian et al., 2007). Das entspricht einem jährlichen Zuwachs von 8% für MCC im Vergleich zum 3%igen Zuwachs beim Melanom während dieser Zeit 10 (Hodgson, 2005). Die Mehrzahl (94%) der Patienten mit MCC-Diagnose gehört zum hellen Hauttyp (Bichakjian et al., 2007). Die Inzidenz ist aus bislang ungeklärten Gründen insgesamt stark steigend. Der Tumor tritt bei beiden Geschlechtern auf, scheint aber häufiger bei Männern aufzutreten. Die männliche Prädominanz wird mit 2,3:1 (Pectasides et al., 2006) bzw. 1,4:1 (MedinaFranco et al., 2001) beschrieben. 1.4 Diagnostik des Merkelzellkarzinoms 1.4.1 Klinik des Merkelzellkarzinoms MCCs erscheinen in der Regel als rötliche oder livide, solide, indolente, intrakutane Tumoren mit meist glatter und glänzender Oberfläche. Neben den häufigen halbkugeligen oder knotigen Formen kommen insbesondere am Stamm auch plaqueartige Varianten vor. Ulzerationen sind sehr selten und werden erst im Spätstadium beobachtet. Die Mehrheit der MCCs ist im Kopf- und Halsbereich und an den Extremitäten lokalisiert (je ca. 40%), seltener tritt das Karzinom am Körperstamm auf (ca. 10%) (Pectasides et al., 2006). Im Gesicht sind oft die Augenlider betroffen, wobei der Durchmesser der Läsion bei ärztlicher Vorstellung meist weniger als 2 cm beträgt (Goessling et al., 2002). Trotzdem weisen bereits bis zu einem Drittel der Betroffenen zum Zeitpunkt der Erstdiagnose eine lokoregionäre Lymphknotenbeteiligung auf; im Verlauf der Erkrankung erhöht sich dieser Anteil auf über 60% (Mehrany et al., 2002). 11 Abb. 2.: Klinisches Bild eines Merkelzellkarzinom-Rezidivs im Gesicht. Man sieht die typische glatte Oberfläche und den rötlich-lividen Aspekt. Abb. 3: Klinisches Bild eines Merkelzellkarzinoms im Gesicht. 12 Auffällig ist das sehr rasche Wachstum des MCCs. Fernmetastasen manifestieren sich in absteigender Häufigkeit vorwiegend in Lymphknoten (27-60%), Haut (9-30%), Lunge (10-23%), zentralem Nervensystem (18%), Skelett (10-15%) und Leber (13%) (Bichakjian et al., 2007). Von knapp 900 ausgewerteten Fällen in der Literatur entwickelten insgesamt 30% der Patienten Fernmetastasen, und nach chirurgischer Exzision des Primärtumors kam es bei 30% der Patienten im Stadium I und II zu Lokalrezidiven (Medina-Franco et al., 2001). Seltene Fälle von inguinalen Lymphknotenmetastasen ohne auffindbaren kutanen Primärtumor sind bekannt (Kim et al., 2009). Da die Klinik des MCCs nicht eindeutig ist, muss die Diagnose immer immunhistologisch bestätigt werden. Abb. 4: Detailaufnahme eines Merkelzellkarzinoms. Deutlich zu sehen ist die halbkugelige Form und die glatte, glänzende Oberfläche. 13 1.4.2 Histologie des Merkelzellkarzinoms Die klinischen Merkmale lassen oft bereits die Malignität der Läsion vermuten, die genaue Diagnose wird jedoch in den meisten Fällen erst anhand einer Exzisionsbiopsie und des nachfolgenden feingeweblichen Befundes gestellt. Histologisch breitet sich das MCC meistens in der retikulären Dermis und Subkutis aus, die papilläre Dermis, Epidermis und Adnexen sind selten betroffen. In Einzelfällen wächst das MCC bis in das subkutane Fettgewebe ein. In der Routinefärbung mit Hämatoxylin-Eosin (HE) erscheinen die Zellen typischerweise klein, blau, rund und monomorph, mit schmalem Zytoplasmasaum und einer sogenannten „salt and pepper“-Anordnung des Chromatins (Calder et al., 2007). Man sieht verwaschen-basophile Tumorstränge mit vielen Mitosen in trabekulärer bis solid-kleinzelliger Anordnung; letzteres gilt als prognostisch ungünstig. (Fritsch, 2008). Abb. 5: HE-Färbung eines Merkelzellkarzinoms in 100facher Vergrößerung. Man sieht die monomorphen, kleinen, runden Zellen im gelappten Tumorgewebe. E=Epidermis, D=Dermis, MCC=Merkelzellkarzinom-Gewebe. 14 Es werden im Allgemeinen drei histologische Typen unterschieden, wobei der intermediäre Typ am häufigsten (ca. 80%) vorkommt. Die Tumorzellen sind hier mittelgroß, zeigen große, gelappte Zellkerne und einen schmalen, schwach gefärbten Zytoplasmasaum. Die Mitoserate ist meist hoch, Nekrosen sind selten. Beim seltenen, klassischen, ursprünglich trabekulären Typ (ca. 10%) sind die großen, monomorphen Zellen trabekulär in der Dermis angeordnet. Der kleinzellige Typ mit kleinen Zellen, stark hyperchromatischen Zellkernen und gelegentlich vorkommenden Nekrosen macht ebenfalls ca. 10% aus. Misch- und Übergangsformen zwischen den drei Typen sind häufig. Wegen der großen Ähnlichkeit zu anderen malignen kleinzelligen Tumoren der Haut bzw. Metastasen innerer Malignome erfolgt zur Differentialdiagnose die immunhistochemische Aufarbeitung der Präparate. 1.4.3 Differentialdiagnose des Merkelzellkarzinoms Klinisch erscheint das MCC recht unspezifisch und ist leicht zu verwechseln mit zahlreichen anderen benignen und malignen Hautläsionen wie Basalzellkarzinomen, Plattenepithelkarzinomen, Zysten, Granuloma pyogenicum, Melanomen, Lymphomen oder Lipomen. Selbst nach der histologischen Untersuchung kann die Differentialdiagnose zwischen MCC und anderen kleinzelligen Neoplasien wie Basalzellkarzinomen, Plattenepithelkarzinomen, Lymphomen, manchen MelanomTypen und primär extrakutanen kleinen rundzelligen Tumoren wegen der morphologischen Ähnlichkeit schwierig sein. Für eine definitive Diagnose ist in diesen Fällen die immunhistochemische Analyse der Präparate notwendig. Wie auch normale, nicht maligne veränderte Merkelzellen exprimieren Merkelzell-Karzinome sowohl epitheliale als auch neuroendokrine Antigene. Eine Identifizierung von MCC ist durch den immunhistochemischen Nachweis der Proteine Neurofilament, Zytokeratin (CK) -8, -18, -19 und -20, Synaptophysin, Chromogranin, „epithelial membrane antigen“ (EMA/MUC1) und neuronenspezifische Enolase (NSE) möglich (Fritsch, 2008; Calder et al., 2007). Die derzeit benutzten Marker in der dermatohistopathologischen Praxis sind Zytokeratin 20 (CK20) und Neurofilament. Neurofilamente und Zytokeratine gehören, wie auch (die in 1.5.6 beschriebenen Marker) Desmin, Vimentin und saures Gliafaser-Protein, zu den Intermediärfilamenten. Intermediärfilamente werden in fast allen epithelialen Zellen exprimiert und bilden gemeinsam mit vielen anderen Proteinen 15 das Zytoskelett. Dieses komplexe Zellgerüst spannt sich zwischen Nukleusoberfläche und Zellmembran aus und hat Auswirkungen auf Kommunikationsmechanismen, Bewegung, Differenzierung, Adhäsion und Stabilität der Zelle. Intermediärfilamente besitzen eine Länge von 10 nm und liegen somit in der Größenordnung zwischen den ebenso an der Bildung des Zytoskeletts beteiligten Aktinfilamenten und den Mikrotubuli. Synaptophysin ist ein membranständiges Glykoprotein, das in der Synapse von Neuronen vorkommt und an der Übertragung am synaptischen Spalt beteiligt, aber scheinbar nicht essentiell ist (McMahon et al., 1996). Synaptophysin wird als Marker für neuroendokrine Zellen verwendet und kann zur Quantifizierung von Synapsen eingesetzt werden (Calhoun et al., 1996). Chromogranin ist ein typischer und spezifischer neuroendokriner Marker, der jedoch stark variiert und deshalb in der pathologischen Praxis selten verwendet wird (Weiler et al., 1988). Das „epithelial membrane antigen“ (EMA/MUC1) ist ein stark glycosyliertes Transmembranprotein, dass in sekretorischem Epithel, den meisten Adenokarzinomen, Plattenepithelkarzinomen und anderen Geweben nachweisbar ist. Die neuronenspezifische Enolase (NSE) ist ein Enzym des Glucosestoffwechsels in Nervenzellen und neuroendokrinen Zellen, besonders den APUD-Zellen. Es wird, wie S100, im Serum als Marker für neuronale Zellschädigung beispielsweise im Rahmen von Schädel-Hirn-Traumata eingesetzt (Berger et al., 2006). Als Tumormarker wird NSE beim Neuroblastom und kleinzelligem Bronchialkarzinom eingesetzt und findet auch Verwendung bei der Färbung von Merkelzellen und MCC (Drijkoningen et al., 1986). Ein weiterer relevanter Marker ist Tenascin-C (Tn-C), dessen Expression in vielen Tumoren mit der Prognose korreliert, z. B. bei Tumoren der Brust, des Magens und des Gehirns. Tn-C ist ein großes Glykoprotein der extrazellulären Matrix und wird während vieler benigner und maligner Prozesse exprimiert. Koljonen et al zeigten im Jahre 2005, dass die Tn-C-Expression in MCCs mit der Tumorgröße, dem malignen Charakter und der Proliferation steigt. Die Expression war am höchsten in Gebieten mit invasivem Wachstum und ähnelt so dem Verhalten bei anderen Tumoren (Koljonen et al., 2005). CD56 („neural cell adhesion molecule“ = NCAM) ist ein neuroendokriner Marker und kann zur Markierung kleinzelliger Bronchialkarzinome, MCCs und natürlicher 16 Killerzellen im Lymphom verwendet werden. Die Spezifität dieses Markers wird allerdings kontrovers diskutiert (Kurokawa et al., 2003; McNiff et al., 2005). 1.5 Immunhistochemische Marker des Merkelzellkarzinoms In der Tumorgenese ist die aus einer Fehlregulation des Zellzyklus resultierende anormale Zellproliferation grundlegend. Die für die Regulation der korrekten DNAReplikation und Zellteilung verantwortlichen Mechanismen sind somit höchst wichtig im neoplastischen Prozess. Am sehr komplexen Vorgang von Proliferation und Regulation des Zellzyklus sind viele Gene und Proteine beteiligt, unter anderem auch Ki-67, p21, p53 und die „minichromosome maintenance“ (MCM) Kernproteine (Quinn and Wright, 1990; Tachibana et al., 2005). CK20 ist ein meistens in MCC exprimiertes Protein und dient in der dermatopathologischen Routine zur Identifizierung des Tumors. Im Folgenden werden die in dieser Studie untersuchten Markerproteine näher beschrieben. 1.5.1 Minichromosome Maintenance Proteine (MCM4, MCM6, MCM7) Erstmalig in den Hefezellen Saccharomyces cerevisiae beschrieben, wurden MCMProteine als Tumormarker in der Humanmedizin seit dem Jahre 1998 verwendet (Todorov et al., 1998). Wie in zahlreichen Arbeiten gezeigt werden konnte, sind MCMProteine eng mit dem hochgradig koordinierten Prozess der Zellproliferation verknüpft (Ha et al., 2004; Freeman et al., 1999; Padmanabhan et al., 2004; Schrader et al., 2005). Aufgrund ihrer Schlüsselrolle in der Zellproliferation könnten MCMs eventuell in der Diagnostik von Hauttumoren von großem Nutzen sein, jedoch werden sie bisher kaum als Marker genutzt (Gambichler et al., 2008; Boyd et al., 2008; Winnepenninckx et al., 2006). Die hoch konservierte MCM Protein-Familie besteht aus den sechs großen, durch alternatives Spleißen entstehenden Isoformen MCM2-7, die ihrerseits wieder in Isoformen vorliegen. Alle MCMs haben sehr ähnliche biochemische Funktionen und sind essenziell für die Kontinuität der Chromosomen-Replikation nach der Aktivierung der Origins (Replikationsursprünge). Die 6 MCM-Proteine bilden einen Teil des hexamerischen Prä-Replikationskomplexes, welcher nach erfolgter Replikation am 17 Ende der Mitose, also beim Eintritt der Zelle in einen neuen Replikationszyklus, an Origins bindet und damit die Replikation zulässt (Prasanth et al., 2004). Nachdem dies durch eine Reihe anderer Proteine vorbereitet worden ist, binden MCM-Proteine in der G1-Phase in einer ringförmigen Formation an das Chromatin. Im Verlauf der S-Phase leiten sie dann sehr präzise die Öffnung der Replikationsgabel ein, was zur Verdoppelung der DNA führt (Prasanth et al., 2004; Alexandrow et al., 2002). Komponenten der Prä-Replikationskomplexe werden daraufhin inaktiviert und degradiert. Somit wirken MCM-Proteine als DNA-Replikationsregulatoren, welche die Replikation auf nur einmal pro Zellzyklus limitieren (Prasanth et al., 2004). Die Regulation der MCM-Proteine geschieht durch E2F Transkriptionsfaktoren, welche die MCM-Expression induzieren, und Proteinkinasen („cyclin dependent kinases“ = CDK), welche die MCM-Proteine phosphorylieren, um den postreplikativen Zustand der Zelle zu erhalten (Arata et al., 2000). In menschlichen Zellen reguliert das Protein Geminin die Bindung der MCM-Proteine an die DNA (Gonzalez et al., 2004). Eine ATPBindungsstelle scheint für die Funktion der sechs MCM-Proteine essentiell zu sein, denn auf jedem der MCM-Gene ist eine für sie kodierende Region mit 240 Aminosäuren vorhanden (Nishitani and Lygerou, 2002). MCM2/MCM4-Komplexe fungieren in vitro als Substrate für Cdc2/Cyclin B („maturation promoting factor“) (Hendrickson et al., 1996). MCM2 ist außerdem am Mechanismus der Transkription beteiligt. MCM5 wird für die RNA-Polymerase II-vermittelte Transkription und Elongation benötigt (Snyder et al., 2009). Während der Apoptose bewirkt die Caspaseabhängige Spaltung von MCM3 (91 kDa) die Inaktivierung des MCM-Komplexes, welcher mindestens die MCM-Proteine 2-6 umfasst (Schwab et al., 1998). Ein aus MCM4, MCM6 und MCM7 bestehender Komplex ist an der Aktivität der DNAHelikase, also dem Entwinden der DNA, beteiligt (Lee and Hurwitz, 2001). Die Phosphorylierung durch die CDC2-Kinase mindert die Helikase-Aktivität und Chromatinaffinität der MCM-Proteine (Hendrickson et al., 1996). Die für die verschiedenen MCM-Proteine kodierenden Gene liegen auf unterschiedlichen Chromosomen. Zum Beispiel liegt das kodierende Gen für das 97 kDa große MCM4 beim Menschen auf Chromosom 8q11.2, dagegen befindet sich das MCM6-Gen auf dem Chromosom 2q21. Das stark exprimierte MCM6-Gen enthält 18 Introns und 2 alternative letzte Exons. Durch alternatives Spleißen entstehen drei MCM6-Isoformen (93 kDa). Zwei MCM6-Introns beinhalten jeweils eine Laktase-regulierende Region, deren Mutationen mit einer Form der Laktoseintoleranz des Erwachsenenalters 18 assoziiert sind (Enattah et al., 2002). Das für das 81 kDa schwere MCM7 kodierende Gen hat die Lokalisation 7q21.3-q22.1 im menschlichen Genom. 1.5.2 p21 p21, auch bekannt als „cyclin-dependent kinase (CDK)-interacting protein 1“, ist ein 21 kDa schweres Protein, das zur Cip/Kip-Familie der Inhibitoren der Cyclin-Abhängigen Kinase (CDK) gehört. Cyclin-/CDK-Komplexe erleichtern über unterschiedliche Stufen hinweg den Übergang des Zellzyklus von der G1-auf die S-Phase, während p21 in der Lage ist, den Zellzyklus durch eine Interaktion mit Cyclin-/CDK-Komplexen zu regulieren und anzuhalten. Zusätzlich kann p21 durch Bindung des nukleären Antigens proliferierender Zellen („proliferating cell nuclear antigen“, PCNA) die DNAReplikation hemmen. Auch an einer Reihe weiterer spezifischer Protein-ProteinInteraktionen ist p21 beteiligt, von denen einige mit der Steuerung des Zellzyklus in Verbindung stehen. Die Expression von p21 wird durch den p53-Wildtyp induziert, kann jedoch auch unabhängig von p53 auftreten. Eine erhöhte Expression von p21 steht nicht notwendigerweise mit einem Wachstumsstopp in Verbindung, da dieses Protein eine doppelte Funktion besitzt: es ist Inhibitor der Cyclin-/CDK-Aktivität und gleichzeitig positiver Modulator der Bildung des Cyclin-/CDK-Komplexes und der nukleären Lokalisation. Mutationen von p21 kommen, anders als die von p53, auch in Tumoren extrem selten vor (Shiohara et al., 1997). Versuche an p21-knockout-Mäusen zeigten aber, dass die Tiere zwar zunächst normal erschienen, doch im Alter von durchschnittlich 16 Monaten eine Vielzahl verschiedener Neoplasien entwickelten (Martín-Caballero et al., 2001). 1.5.3 p53 p53 erhielt seinen Namen aufgrund der apparenten Molekularmasse von 53 kDa in der Elektrophorese. Das in der Literatur auch als „Wächter des Genoms“ bezeichnete Tumorsuppressor-Protein p53 (Lane, 1992) reguliert als Transkriptionsfaktor nach DNA-Schädigung die Expression von Genen, die an der Kontrolle des Zellzyklus, an der Apoptoseinduktion oder an der DNA-Reparatur beteiligt sind. Im für p53 19 kodierenden TP53-Tumorsuppressor-Gen (Chromosom 17p13) treten jedoch regelmäßig Punktmutationen auf, was zur posttranslationalen Stabilisierung und Akkumulation von mutiertem p53-Protein führt. Die Akkumulation von p53 setzt DNAReparatur-Mechanismen in Gang und stoppt gleichzeitig den Zellzyklus, indem die Expression des Proteins p21 induziert wird. p21 hemmt Cyclin/CDK-Komplexe, welche normalerweise den Transkriptionsfaktor E2F freisetzen, der zur Fortführung des Zellzyklus nötig ist. Die Zelle bekommt also durch p53 Zeit zur Reparatur ihrer DNA, bevor sie sich teilt. Ist die DNA wieder in Ordnung, so sinkt der p53-Spiegel, p21 wird nicht mehr transkribiert und nach einer Weile wird der Zellzyklus fortgesetzt. Kommt es zu einer zu starken Akkumulation von p53 und kommen weitere Faktoren hinzu, so werden von p53 Gene der Bcl2-Familie (insbesondere der Apoptose-Regulator BAX) aktiviert und führen durch Aktivierung der Caspase-Signalkaskade zur Apoptose. Die p53-Mutation ist nur eine Komponente im multifaktoriellen Mechanismus der Tumorgenese, allerdings entwickeln Menschen mit einer heterozygoten Mutation des p53-Gens meist frühzeitig und in mehreren verschiedenen Geweben kanzerogene Entartungen (Li-Fraumeni-Syndrom). Da das p53-Protein von Natur aus instabil ist, liegt die Konzentration des nativen Proteins in der gesunden Zelle meist unterhalb der Nachweisgrenze immunhistochemischer Methoden. In der Hälfte aller menschlichen Tumoren liegt p53 in veränderter Form vor (Pietsch et al., 2008). Im Kolonkarzinom ist in der Entwicklung vom Adenom zum Karzinom eine Adenom-Karzinom-Sequenz belegt, in der die Mutation von p53 einer von vier Faktoren ist (Abb. 7). Mutation/Verlust des Mutation Mutation/Verlust Mutation/Verlust APC-Tumor- des K-ras- des DCC- des p53- suppressorgens Onkogens Tumorsuppressorgens Tumorsuppressorgens Normalepithel Adenom I, Adenom II, Adenom III, geringgradige mäßiggradige hochgradige Dysplasie Dysplasie Dysplasie Karzinom Abb. 6: Adenom-Karzinom-Sequenz. Die p53-Mutation ist einer von vier notwendigen Schritten auf dem Weg zur malignen Entartung der Darmzelle. 20 Des Weiteren ist p53 an der Regulation von ca. 100 Proteinen beteiligt. Auch der Pigmentierungsprozess geschieht p53-vermittelt (Benjamin et al., 2008). Erst kürzlich wurde eine in fast der Hälfte der untersuchten MCC-Fälle vorliegende epigenetische Suppression des Tumorsuppressors p14ARF beschrieben. Da p14ARF normalerweise den Abbau von p53 verhindert, hat dies eine verminderte Funktion von p53 zur Folge (Houben et al., 2009). 1.5.4 CK20 Zytokeratin 20 (CK20) gehört zu den an der Bildung des Zytoskeletts beteiligten intermediären Filamentproteinen, die in unterschiedlicher Zusammensetzung in fast allen epithelialen Zellen vorkommen. Jeweils vier Zytokeratingruppen lagern sich zu einem Tetramer zusammen; diese Tetramere bilden durch Kopf-zu-Schwanz-Bindung Protofilamente, die wiederum in 4er-Gruppen zu einem Zytokeratin-Filament werden. Die stark Wasser-unlöslichen Zytokeratine (CKs) bestehen aus einer hoch komplexen Multigenfamilie von Polypeptiden mit Molekülmassen von 40 bis 68 kDa. Man teilt die 20 bisher gefundenen CK-Polypeptide, die sich deutlich voneinander unterscheiden, in zwei Unterfamilien ein. Die leichteren CKs vom Typ I (CK 9-20) sind azidisch, während die schwereren CKs (CK1-8) vom Typ II neutral oder basisch sind. CK20, ein 46 kDa Protein, ist weniger azidisch als die anderen Zytokeratine vom Typ I. In unterschiedlicher Zusammensetzung je nach epithelialem Zelltyp liegen jeweils ein Typ I und ein Typ II CK als Heterodimer vor, sodass mit einem Antikörpernachweis gegen die Subtypen CK1–CK20 ein Tumor differentialdiagnostisch beurteilt oder die Herkunft metastatischer Zellen eingegrenzt werden kann. CK20 wird hauptsächlich im Gastrointestinaltrakt, in Urothel und in Merkelzellen exprimiert. So wurde eine CK20Positivität (≥ 5% CK20-positive Tumorzellen) bei der großen Mehrheit von Adenokarzinomen des Kolons und bei MCCs, häufig auch bei Adenokarzinomen des Magens, des Gallensystems und des Pankreas, muzinösen Ovarialtumoren und Übergangszelltumoren beschrieben (Moll et al., 1992). Die Analyse von knapp 200 MCC-Fällen zeigte eine CK20-Positivität bei 87% der Tumore (Bobos et al., 2006). In CK20-gefärbten Gewebepräparaten zeigt sich typischer Weise eine punktförmige paranukleäre Positivität („dot-like“). 21 1.5.5 Ki-67 Das Ki-67-Antigen ist ein Kernprotein, welches mit 395 kDa eine enorme Größe aufweist. Das für die Proliferation der Zelle essentielle Protein ist in seiner Lokalisation abhängig vom Zellzyklus. In der Interphase (=G1-, S-, G2-Phase) befindet es sich ausschließlich innerhalb des Nucleolus, während sich im Verlauf der Mitose der Hauptanteil des Proteins zur Chromosomen-Oberfläche bewegt. Ki-67 wird in seiner Expression durch Phosphorylierung und Dephosphorylierung exakt reguliert und schnell degradiert, sobald die Zelle den nicht-proliferativen Status erreicht. Wenngleich man viel über Struktur, Regulation und Lokalisation von Ki-67 weiß, konnte dessen genaue Funktion noch nicht beschrieben werden (Brown and Gatter, 2002). Das Ki-67Antigen wird während aller Phasen des Zellzyklus (G1, S, G2 und M-Phase) exprimiert, in ruhenden Zellen (G0-Phase) ist es jedoch nicht vorhanden. Auch während DNAReparaturprozessen scheint keine Ki-67-Expression statt zu finden. Somit ist es ein Proliferationsmarker und zeigt die sogenannte Wachstumsfraktion eines Gewebes. Es besteht eine Korrelation der Ki-67-Expression mit dem klinischen Verlauf von Krebserkrankungen, welche am besten für das Mammakarzinom belegt ist (Brown and Gatter, 2002). 1.5.6 Differentialdiagnostische Marker des Merkelzellkarzinoms Im MCC negativ und zur Abgrenzung des Karzinoms zu anderen Tumoren geeignet sind der thyroidale Transkriptionsfaktor 1 (TTF-1), HMB 45, S100, Vimentin, saures Gliafaser-Protein und Desmin. Im Folgenden werden diese zur Differentialdiagnose wichtigen Marker jeweils näher beschrieben. TTF-1 ist essenziell für die Entwicklung und Differenzierung von Schilddrüse, Lunge und ZNS. In der Lunge kontrolliert TTF-1 die Expression von Surfactantprotein, das für die pulmonale Stabilität und Keimabwehr wichtig ist. TTF-1 wird wegen seiner Positivität im kleinzelligen Lungenkarzinomen zur Differenzierung zwischen deren Hautmetastasen und MCC eingesetzt. HMB 45 („Human Melanoma Black“) ist ein Antigen, das in melanozytären Tumoren wie dem Malignen Melanom vorkommt und deren Abgrenzung vom MCC dient. 22 Die 19 verschiedenen Proteine der Multigen-Familie S100 sind multifunktionale Calcium-bindende Proteine mit niedriger Molekülmasse (9-13 kDa) und kommen in vielen Zellen vor. Verschiedene S100-Formen findet man in Gliazellen, Adipozyten, Melanozyten und Chondrozyten, in Speicheldrüse und Niere, in Kardiomyozyten, Nervenzellen, Muskel- und Bindegewebe. S-100-Antikörper können, zum Teil in Unterformen differenziert, im Blut, Liquor oder Gewebe diagnostisch eingesetzt werden. So kann das S100-negative MCC von S100-positiven Tumoren wie Melanomen, chondroidalen Tumoren, Gliomen und Nervenscheidentumoren abgegrenzt werden. Des Weiteren wird S100 als Marker neuronaler Schädigungen nach SchädelHirn-Traumata (Berger et al., 2006) und S100A9 als Screeningparameter für den Prostatakrebs sowie S100B zur Verlaufskontrolle des Melanoms genutzt (Garbe et al., 2003). Humanes Vimentin gehört zu den Intermediärfilamenten (s.o.) und kommt mit einer Molekülmasse von 54 kDa im Zytoplasma und teilweise auch im Nucleus aller Zellen mesenchymaler Herkunft vor, beispielsweise in Fibroblasten, Endothelzellen und glatten Muskelzellen. Die genaue Funktion von Vimentin ist unbekannt. Immunhistochemisch gelingt mit Hilfe von Vimentin die Unterscheidung zwischen MCCs und Weichgewebstumoren. Das Intermediärfilament Desmin kommt im Zytoplasma von Skelett-, Herz- und glatter Muskulatur vor und fasst in der quergestreiften Muskulatur die einzelnen Myofibrillen zu Fibrillenbündeln zusammen. Rhabdomyosarkome und Leiomyosarkome sind Desmin-positive Tumore und können somit immunhistochemisch von anderen Weichteiltumoren und vom MCC abgegrenzt werden. Das saure Gliafaser-Protein („Glial fibrillary acidic protein“, GFAP) kommt als Intermediärfilament im Zytoplasma von Gliazellen des Zentralnervensystems sowie in Schwannzellen des peripheren Nervensystems vor. Vermutlich ist das etwa 50 kDa schwere Protein wichtig für Zellform und Beweglichkeit der Astrozyten. GFAP ist immunhistochemisch positiv im Astrozytom, Glioblastom, Ependymom und anderen glialen Tumoren und erlaubt deren Abgrenzung vom MCC. 23 1.6 Ausbreitungsdiagnostik (Staging) des Merkelzellkarzinoms Um die Ausbreitung der Erkrankung zu erfassen, sollte nach der Erstdiagnose des Primärtumors eine radiologische Diagnostik gemäß den aktuellen Leitlinien erfolgen (AWMF, 2007). Dazu gehören eine Abdomen-Sonographie und eine Röntgen-ThoraxUntersuchung sowie die Sonographie der drainierenden Lymphknotenstation, d.h. der ersten Gruppe von Lymphknoten auf dem Lymphabflussweg des Tumors. Bei ungefähr einem Drittel der Patienten liegt zum Zeitpunkt der Erstdiagnose schon eine makroskopische Lymphknotenmetastasierung vor. Die Zahl der Mikrometastasierungen scheint jedoch weit höher zu liegen, da im weiteren Verlauf der Erkrankung ein weiteres Drittel der Patienten eine lymphogene Metastasierung entwickelt (Mehrany et al., 2002). Deshalb wird in der Regel eine Wächterlymphknotenbiopsie durchgeführt (Wächterlymphknoten oder Sentinel = erster Lymphknoten im Lymphabflussgebiet des Tumors). Systematische Auswertungen bezüglich dieses diagnostischen Eingriffes beim MCC liegen bislang nicht vor. Erfahrungen mit dieser Methode beim MM, Fallberichte und Studien mit kleinen Fallzahlen deuten jedoch darauf hin, dass die Präsenz von Mikrometastasen im Wächterlymphknoten hinsichtlich Lokalrezidiven und Metastasierung prognostisch ungünstig ist (Mehrany et al., 2002). Anders als beim MM gibt es beim MCC keine klinischen Hinweise auf eine schlechte Prognose, die die für eine Sentinelbiopsie in Frage kommende Patientengruppe eingrenzen kann, und auch der therapeutische Nutzen des Eingriffs ist umstritten. Bei klinischem Verdacht auf Fernmetastasierung sind zusätzlich die entsprechenden bildgebenden Verfahren der Organe durchzuführen, wie beispielsweise eine Magnetresonanztomographie des Gehirns, eine Computertomographie des Thorax bzw. des Abdomens oder eine Positronenemissionstomographie mit dem radioaktiven Isotop 18 FDG (Fluordesoxyglucose). 1.7 Stadieneinteilung und Prognose des Merkelzellkarzinoms Obwohl ein allgemein gültiger Konsensus zur Stadieneinteilung des MerkelzellKarzinoms bisher fehlt, wird meist die Einteilung nach Yiengpruksawan et al. verwendet (Yiengpruksawan et al., 1991). 24 Tab. 1: Stadieneinteilung von Merkelzellkarzinomen nach Yiengpruksawan a) größer als 2 cm Stadium I Primärtumor allein b) kleiner als 2 cm Stadium II lokoregionäre Metastasen Stadium III Fernmetastasen Die durchschnittliche Fünfjahresüberlebensrate von Patienten mit MCC beträgt 81% bzw. 67% für Primärtumore (Stadium Ia/b), 52% bei zusätzlich vorliegenden Lymphknotenmetastasen und/oder Lokalrezidiven (Stadium II) (Bichakjian et al., 2007). Im Stadium III ist die Prognose mit einer mittleren Überlebenszeit von 8 Monaten ausgesprochen schlecht (Medina-Francoet al., 2001). Die meisten Rezidive treten während der ersten 2 Jahre auf (Bichakjian et al., 2007). Laut retrospektiver Studien beträgt die mittlere lokalrezidivfreie Zeit 7,4 Monate (von 4-10 Monaten) (Medina-Franco et al., 2001). Retrospektive Studien zeigten folgende ungünstige prognostische Faktoren auf: fortgeschrittenes Tumorstadium, männliches Geschlecht, Immunsuppression (Medina-Franco et al., 2001) und Lokalisation des Primärtumors in der Kopf-Hals-Region oder am Rumpf (Bichakjian et al., 2007). 1.8 Therapie des Merkelzellkarzinoms 1.8.1 Operative Therapie des Merkelzellkarzinoms Bei Primärtumoren ohne Hinweise auf das Vorliegen von Organmetastasen ist die vollständige chirurgische Exzision als Basistherapie anzusehen und in jedem Fall unerlässlich. Wegen der hohen Rate von Lokalrezidiven, die in der Regel auf subklinische Satellitenmetastasen zurückzuführen sind, sollte ein Sicherheitsabstand von 3 cm eingehalten werden. Dies wird empfohlen, um eine R0-Resektion, d.h. die Entfernung des Tumors ohne mikroskopische Residuen, zu garantieren und zusätzlich eventuell verstreute einzelne entartete Zellen zu entfernen. In besonderer Lokalisation, wo in Abwägung der Gesamtsituation nur ein geringerer Sicherheitsabstand möglich ist, 25 sollte eine lückenlose histologische Aufarbeitung der Exzidatschnittränder einschließlich einer Immunhistologie zur Darstellung von Zytokeratin 20 angestrebt und gegebenenfalls eine Strahlentherapie durchgeführt werden. Beim Nachweis einer Mikrometastasierung im Wächterlymphknoten und bei makroskopischem Lymphknotenbefall sollte eine radikale Lymphadenektomie erfolgen. Auch bei Lokalrezidiven ist die chirurgische Sanierung mit kurativer Intention nach wie vor die Therapie der Wahl (AWMF, 2007). 1.8.2 Strahlentherapie des Merkelzellkarzinoms MCCs sind in aller Regel radiosensitiv. Retrospektive Analysen zeigen, dass die lokale Rezidivrate nach alleiniger R0-Operation des Primärtumors durch eine kombinierte lokoregionäre adjuvante Strahlenbehandlung deutlich gesenkt wird. Eine Verlängerung der Gesamtüberlebenszeit ist in der Literatur nicht belegt (Medina-Franco et al., 2001). Die Radiatio sollte die Haut 3 cm um die Exzisionsnarbe und die regionäre Lymphknotenstation mit einschließen. Daten aus prospektiven Studien liegen allerdings nicht vor. Für Primärtumoren, lokoregionäre Rezidive und Lymphknoten-metastasen wird daher die adjuvante Strahlentherapie der Tumorregion und der regionären Lymphknotenstationen empfohlen. Als erforderliche Gesamtdosis werden in der adjuvanten Situation 50 Gray (Gy) mit einer Einzeldosis von 2 Gy fünf Mal wöchentlich betrachtet. Bei metastasierendem MCC wird die Bestrahlung häufig im Rahmen multimodaler Therapiekonzepte neben der chirurgischen Exzision und/oder einer systemischen Chemotherapie eingesetzt. 1.8.3 Chemotherapie des Merkelzellkarzinoms Zwar ist das MCC ein chemosensitiver Tumor, jedoch bestehen bislang keine StandardChemotherapie-Schemata. Wegen der morphologischen Ähnlichkeiten wurden oft Schemata gewählt, die bei kleinzelligen Lungenkarzinomen etabliert sind. Zu diesen gehören u.a. Anthrazykline, Antimetabolite, Bleomycin, Cyclophosphamid, Etoposid, Platinderivate allein oder in Kombination. Bei Einsatz dieser zum Teil hochtoxischen Schemata werden zwar relativ hohe Remissionsraten von bis zu 70% erzielt, wegen der 26 im Allgemeinen kurzen Remissionsdauer führt dies aber zu keiner wesentlichen Verlängerung des Überlebens (Bichakjian et al., 2007). Eine Korrelation zwischen Therapieintensität und Ansprechen der Therapie findet sich nicht und es wurde eine therapiegebundene Mortalität von 7,7% beobachtet. Prospektive Studien zur Chemotherapie des MCC fehlen bisher. Deshalb ist eine systemische Chemotherapie als Palliativmaßnahme bei Vorliegen von Fernmetastasen zwar indiziert, sollte aber wegen der hohen Toxizität der meisten Chemotherapeutika an den individuellen Fall angepasst werden. Dies gilt insbesondere für alte Patienten aufgrund der eingeschränkten Funktion von Leber, Niere und Hämatopoese. Als gut verträgliche Monotherapeutika gelten Etoposid oder Anthrazykline, z. B. liposomal verkapseltes Doxorubicin. Die Therapie mit neuen Immuntherapeutika (z. B. monoklonalen Antikörpern gegen Ep-CAM oder MUC-1), Signaltransduktionsinhibitoren oder epigenetischen Modulatoren befindet sich in der Entwicklung, kann aufgrund der geringen Fallzahlen derzeit jedoch noch nicht beurteilt werden (Kurzen et al., 2003). 1.8.4 Nachsorge des Merkelzellkarzinoms Bisher liegen keine wissenschaftlich abgesicherten Studien zur Nachsorge des MCCs vor. An den meisten deutschen dermatologischen Kliniken erfolgt wegen der großen Gefahr von Lokalrezidiven oder regionären Lymphknotenmetastasen insbesondere während der ersten zwei Jahre eine engmaschige Kontrolle. Innerhalb des ersten Jahres nach Entfernung des Primärtumors findet diese in sechswöchigen Abständen statt, danach wird auf eine Nachsorge in vierteljährlichen und später halbjährlichen Abständen übergegangen. Im Rahmen dieser Nachsorgeuntersuchung erfolgt neben der klinischen Untersuchung mit Lymphknotenpalpation eine Lymphknotensonographie mit Schwerpunkt auf den regionären Lymphknotenstationen. Einmal jährlich werden eine Oberbauchsonographie und eine Röntgen-Thorax-Untersuchung vorgenommen. Der Nachsorgezeitraum umfasst insgesamt mindestens 5 Jahre. 27 1.9 Das Maligne Melanom Für unsere immunhistochemischen Untersuchungen des MCCs wählten wir als Vergleichsgruppe Gewebeproben des Malignen Melanoms. Das Maligne Melanom (MM) ist ein von den Melanozyten der Haut, seltener der Schleimhaut, der Aderhaut und den Leptomeningen ausgehender neuroektodermaler Tumor. Melanozyten sind Zellen der epidermalen Basalschicht, die das dunkle Hautpigment Melanin bilden. So erscheint der Tumor in der Regel stark pigmentiert, selten finden sich jedoch auch amelanotische Melanome. Im Verhältnis zur Tumormasse besteht beim Melanom eine frühe Tendenz zur Metastasierung und damit eine ungünstige Prognose. Im Gesundheitssystem nimmt der dritthäufigste Tumor der Haut einen wichtigen Stellenwert ein, denn er ist an 90% der Todesfälle aufgrund von Hautkrebs verantwortlich. Die Inzidenz des Melanoms verdoppelt sich weltweit etwa alle 10 Jahre. 1.10 Klassifikation des Malignen Melanoms Entsprechend der klinischen und histologischen Morphologie wird das MM im Hautbereich üblicher Weise in fünf Typen eingeteilt: superfiziell spreitendes MM (SSM), noduläres MM (NMM), akrolentiginöses MM (ALM), Lentigo-maligna-MM (LMM) und nicht klassifizierbares MM (siehe Punkt 1.12.1 Klinik und Histologie). Sonderformen wie Schleimhaut- und Aderhautmelanome oder amelanotische Melanome machen etwa 5% aller MMs aus. 1.11 Ätiologie und Risikofaktoren des Malignen Melanoms Besonders gefährdet für die Entwicklung eines MMs sind Individuen mit hellem Hauttyp, hoher Nävus-Zahl oder Melanomvorläufern (sog. dysplastischen Nävi) (Tucker, 2009). Auch große kongenitale melanozytäre Nävi erhöhen das Risiko (Watt et al., 2004). Bis zu 10% der Melanome treten in erblich belasteten Familien auf, wofür polygene Erbfaktoren verantwortlich gemacht werden (Tucker, 2009). Unter den exogenen Einflussgrößen spielt die UV-Belastung eine zentrale Rolle, und zwar scheinbar eher die Zahl der durchgemachten schweren Sonnenbrände als die kumulative 28 UV-Dosis (Tucker, 2009). Zahlreiche Beispiele von Spontanremissionen oder aggressiven Verläufen bei Immunsupprimierten belegen außerdem die Bedeutung immunologischer Faktoren im Verlauf der Tumorprogression Über die Bedeutung toxischer, medikamentöser, traumatischer oder endokriner Einflüsse (z.B. Gravidität, Kontrazeptiva) wird noch kontrovers diskutiert (Rockley et al., 1994; Lens and Bataille, 2008). 1.12 Diagnostik des Malignen Melanoms 1.12.1 Klinik und Histologie des Malignen Melanoms Die vier klassifizierbaren Wuchstypen sind morphologisch gut unterscheidbar und im Wesentlichen Ausdruck der unterschiedlichen Aggressivität der ursächlichen Klone. Alle Melanomtypen haben morphologisch einen „chaotischen Aspekt“ gemein, eine charakteristische Unregelmäßigkeit und eine Heterogenität in Aufbau und Farbe (Fritsch, 2008). Zur klinischen Beurteilung der Pigmentierung ist die Auflichtmikroskopie gut geeignet. Klinisch-histologisch unterscheidet man die fünf Haupttypen SSM, NMM, ALM, LMM und nicht klassifizierbares Melanom. Außerdem bestehen zahlreiche seltene Sonderformen, u. a. das amelanotische Melanom, Melanom der Uvea oder der Schleimhäute und der Animaltyp. Das SSM beginnt fleckförmig mit einer intraepidermalen horizontalen Ausbreitung, ist zunächst flach mit leicht erhabenem Rand, scharf begrenzt, häufig vielfarbig und mit hellen Regressionszonen. Mit fortschreitender Krankheitsdauer treten sekundäre knotige Anteile auf und das Wachstum wird invasiv. Histologisch charakteristisch ist ein pagetoides Muster der intraepidermalen Tumorkomponente im Randbereich. Das NMM imponiert als primär knotiger, exophytischer, überwiegend schwarzbrauner, häufig erosiv-blutiger Tumor. Es findet keine initiale horizontale Wachstumsphase statt, wodurch eine frühe Diagnose selten ist. Histologisch zeigen sich spindelige, epitheloide und polymorphe Melanmonzellen in der Epidermis und der Dermis, die bis ins subkutane Fettgewebe hineinreichen. Das ALM ist vorwiegend palmoplantar, aber auch an den Phalangen, sub- oder periungual lokalisiert. In der intraepidermalen Frühphase liegen meist unscharf begrenzte, inkohärente Pigmentierungen vor, bevor die knotigen Anteile das invasive 29 Wachstum signalisieren. Histologisch fallen zahlreiche atypische, die Epidermis nestförmig durchsetzende, in die Tiefe vordringende Melanozyten auf. Das Lentigo-maligna-Melanom entsteht oft erst nach vielen Jahren aus einer Lentigo maligna (in-situ Melanom) und tritt nahezu ausschließlich im Gesichtsbereich älterer Patienten auf. In der Histologie sieht man nestförmige Aggregate atypischer, pigmentierter Melanozyten, die die Basalmembran durchbrochen und die Dermis infiltriert haben. Abb. 7: Klinisches Bild eines primär nodulären Melanoms. Erkennbar ist die unregelmäßige Pigmentierung und Begrenzung sowie die zentrale Erosion. Das Melanom vom Animaltyp, das erstmals bei Pferden beschrieben wurde, ist eine seltene histologisch abzugrenzende Variante des MM. Es ist tiefschwarz und besteht aus konfluierenden Proliferationen von Melanozyten, die eine starke Melaninsynthese aufweisen. Melanome mit horizontaler Ausbreitungsrichtung zeigen eine geringere Wachstumstendenz als solche mit vorwiegend vertikaler Ausbreitung. Innerhalb des Krankheitsverlaufs kann jedoch die horizontale Wachstumsphase in vertikales invasives 30 Wachstum übergehen. Metastasen treten meist innerhalb von zwei Jahren nach Entfernung des Primärtumors auf, doch wurden auch Latenzzeiten von weit über 20 Jahren beobachtet (Fritsch, 2008). Das Melanom metastasiert in der Regel lymphogen, nur in 10% ist die Verbreitung primär hämatogen. Hauptsächliche Organe der Metastasierung sind Haut, Lunge, zentrales Nervensystem und Skelett. (Fritsch, 2008) Die durch Melanome verursachte starke Immunreaktion zeigt sich durch eine histologisch sichtbare ausgeprägte entzündliche Reaktion, die häufig beobachtete partielle Regression, sowie die gelegentlich vorkommende völlige Rückbildung des Primärtumors bei schon bestehender Metastasierung. (Fritsch, 2008). 1.12.2 Immunhistologie des Malignen Melanoms Die histopathologische Diagnose primärer Melanome und Melanommetastasen ist für gewöhnlich ohne große Probleme möglich. Jedoch erfordern die variable histologische Erscheinung dieses Malignoms und Situationen, in denen undifferenzierte maligne Tumore vorhanden sind, oft die Anwendung immunhistologischer Färbungen, um Melanome genau zu diagnostizieren oder auszuschließen. Die zu diesem Zweck meistgenutzten Antikörper sind HMB-45 und anti-S100 (siehe Kapitel 1.5.6). Weiterhin kommen die Antikörper T311, A103, anti-MAGE1 und ANTI-MAGE-3 zur Anwendung. 1.12.3 Differentialdiagnose des Malignen Melanoms Prinzipiell kann Hautveränderungen sich ein hinter allen malignes pigmentierten Melanom benignen verbergen. Zu und den malignen häufigsten Differentialdiagnosen gehören nävoide, melanozytische, vaskuläre und dermale Veränderungen. Ein AMM kann klinisch einem Spinaliom, mesenchymalen Tumoren und Hautmetastasen eines Karzinoms gleichen (Herz, 2005). 31 1.12.4 Ausbreitungsdiagnostik des Malignen Melanoms Nach der histologisch gestellten Melanomdiagnose sollte immer eine eingehende klinische Untersuchung des gesamten Integuments sowie der ableitenden Lymphwege durchgeführt werden. Bei Melanomen mit einer Dicke von ≥ 1mm nach Breslow (Breslow, 1970), bei Vorliegen weiterer ungünstiger Prognoseparameter eventuell auch bei geringeren Tumordicken, sollte immer eine Lymphknotensonographie sowie eine Biopsie des Wächterlymphknotens zur Prognoseeinschätzung erfolgen. Bei Lokalisation des Tumors im Kopf/Halsbereich kann alternativ auch eine selektive „Neck dissection“ und/oder Parotidektomie erwogen werden. Des Weiteren sollten bei Melanomen mit einer Dicke von ≥ 1mm eine laborchemische Untersuchung inklusive BSG, Blutbild, LDH, alkalische Phosphatase und dem Tumormarker Protein S100 angefordert werden. Zur Erfassung eventueller Fernmetastasen sind eine Röntgen-Thoraxaufnahme in zwei Ebenen, sowie eine Sonographie des Abdomens einschließlich Becken und Retroperitoneum unverzichtbar. Im Einzelfall kann ein hochauflösender Ultraschall zur Dickenabschätzung des Tumors, CT, MRT oder Positronenemissionstomografie-Diagnostik als Alternative oder zusätzlich zu den obengenannten Untersuchungen von Nutzen sein. 1.13 Prognose und Stadieneinteilung des Malignen Melanoms Die wichtigsten prognostischen Faktoren beim primären malignen Melanom ohne Metastasen sind die vertikale Tumordicke nach Breslow (Tab. 2) am histologischen Präparat, das Vorhandensein einer histologisch erkennbaren Ulzeration und das Invasionslevel nach Clark (Tab. 3). Tab. 2: Tumordicke nach Breslow und empfohlener Sicherheitsabstand für die chirurgische Exzision des Malignen Melanoms Tumordicke nach Breslow Sicherheitsabstand in situ 0,5 cm ≤ 2 mm 1 cm < 2 mm 2 cm 32 Tab. 3: Invasionslevel des Malignen Melanoms nach Clark Level I Tumorzellen ausschließlich in der Epidermis Level II Tumorzellen durch Basalmembran bis in das Stratum papillare Level III Tumorzellen im oberen Korium (gesamtes Stratum papillare) bis zur Grenzzone vom Stratum reticulare Level IV Tumorzellen im mittleren und unteren Korium Level V Tumorzellen im subkutanen Fettgewebe Die tumorspezifische 10-Jahres-Überlebensrate beträgt ca. 75-80%. Etwa 90% aller Patienten mit malignem Melanom weisen zum Zeitpunkt der Erstdiagnose keine erkennbare Metastasierung auf. Das maligne Melanom kann sowohl primär lymphogen als auch primär hämatogen metastasieren, wobei etwa 2/3 aller Erstmetastasierungen im regionären Lymphabflußgebiet auftreten. Als regionäre Metastasierung gelten Satelliten-Metastasen (bis 2 cm um den Primärtumor) und lokale Rezidive nach Entfernung des Primärtumors, In-transit-Metastasen (in der Haut bis zur ersten Lymphknoten-Station) und regionäre Lymphknotenmetastasen. Für die Klassifikation des malignen Melanoms wird die im Jahre 2001 vom AJCC (American Joint Committee on Cancer) vorgeschlagene und von der UICC (Union Internationale Contre le Cancer) akzeptierte TNM-Klassifikation und Stadieneinteilung zugrundegelegt. 33 1.14 Die Fragestellung histologische Differentialdiagnose zwischen verschiedenen kleinzelligen Hauttumoren bzw. Hautmetastasen ist immer noch ein schwieriges Feld und gelingt manchmal nicht eindeutig. Für eine eindeutige Diagnose ist es hilfreich und oft notwendig, spezifische Marker für die einzelnen Tumorentitäten zu nutzen. Die Diagnose des MCCs basiert bisher hauptsächlich auf der histologischen Morphologie und der charakteristischen CK20-Färbung. 10-15% der MCCs sind jedoch CK20negativ und ungefähr weitere 10-20% der Präparate weisen nur eine fokale CK20Positivität auf (Calder et al., 2007; Beer, 2009). Die Evaluierung neuer Tumormarker zur sicheren Differentialdiagnostik des MCCs steht im Mittelpunkt dieser Arbeit. Aufgrund der Seltenheit des Tumors konnte zu diesem Zweck nur ein recht kleines Kollektiv von acht MCC-Biopsien untersucht werden. Es wurde die Regulation und Proliferation in MCCs analysiert, wobei die immunhistologischen Marker MCM4, MCM6 und MCM7 (MCM = minichromosome maintenance proteins), CK20, Ki-67, p53 und p21 Verwendung fanden. Es liegen bislang keine Daten zu MCM-Proteinen und ihrer Expression im MCC vor. Da MCM-Proteine jedoch als limitierender Faktor der DNA-Replikation eine tragende Rolle in der Regulation des Zellzyklus spielen, könnten sie in der Tumorgenese des MCC von Bedeutung sein. Als Vergleichsgruppe wählten wir das ebenfalls kleinzellige Maligne Melanom. Klinisch und histologisch ähnelt dieses in einigen Fällen dem MCC und stellt eine wichtige Differentialdiagnose mit deutlich höherer Inzidenz als dem MCC dar. Ziel dieser kleinen explorativen Studie war es, das Expressionsmuster von MCM-Proteinen im MCC zu untersuchen, um Informationen über die Tauglichkeit dieser Proteine allein oder in Verbindung mit anderen Proliferationsmarkern bei der immunhistologischen Differentialdiagnostik des MCCs zu erhalten. 34 II. Material und Methoden 2.1 Gewebeproben Wir untersuchten Hautproben von acht Patienten mit MCC, welche zwischen 1998 und 2007 im St. Josef-Hospital Bochum behandelt wurden. Die Patientengruppe MCC bestand aus fünf Männern und drei Frauen im Alter zwischen 59 und 86 Jahren. Alle Patienten waren immunkompetent und von hellem Hauttyp. Zum Zeitpunkt der Tumorresektion bestand die Erkrankung bei allen Patienten nicht länger als ein halbes Jahr. Die Kategorisierung der Patienten erfolgte gemäß des von Yiengpruksawan et al. (Yiengpruksawan et al., 1991) beschriebenen Staging-Systems in drei Stadien (Tab. 1). Das Patientenkollektiv MCC ist in Tabelle 4 aufgeführt. Tab. 4: Patientengruppe Merkelzellkarzinom Patient Alter/ Geschlecht Tumordurchmesser (cm) Stadium Lokalisation 1 2 3 4 5 6 7 8 86/m 85/m 83/f 61/f 81/f 74/m 83/m 59/m 1,5 0,7 2 3 3 2 6 4 II II I I I I II II Handgelenk Wange Handgelenk Unterarm Kapillitium Oberarm Schläfe Wange Als Vergleichsgruppe wurden neun Hautproben aus läsionaler Haut von Patienten mit MM (minimale Tumordicke nach Breslow 1,5 mm) in die Studie eingeschlossen, davon fünf Männer und vier Frauen im Alter zwischen 20 und 85 Jahren (Breslow, 1970). Es waren jeweils drei Melanome vom nodulären und vom superfiziell spreitenden Typ vertreten, außerdem zwei superfiziell spreitende Melanome mit sekundär nodulären Anteilen und ein Animaltyp-Melanom. Tabelle 5 zeigt die Daten der Patientengruppe MM. Bei allen Patienten Dermatohistopathologen klinischer, wurde die Diagnose durch zwei erfahrene nach den aktuellen Standards gestellt, einschließlich histopathologischer, immunhistochemischer (z.B. Cytokeration 20, 35 Cytokeratin 7, S100, Melan-A/MART-1), Ultraschall- und computertomographischer Untersuchungen. Bei allen Patienten wurde ein Staging gemäß Leitlinien durchgeführt, d.h. Röntgen des Thorax, Sonographie der Bauchorgane und CT. Diese Studie entsprach der Deklaration von Helsinki, den vom Weltärztebund verabschiedeten ethischen Grundsätzen für die medizinische Forschung am Menschen. Die Studie erfolgte mit Zustimmung der Ethikkomission der Ruhr-Universität Bochum. Von allen in die Studie eingeschlossenen Patienten wurde ein Einwilligungsformular unterschrieben. Tab. 5: Patientengruppe Malignes Melanom Patient Alter/ Geschlecht 1 2 3 4 5 6 7 8 9 67/w 68/m 62/m 85/w 81/m 61/m 20/w 30/m 32/w 2.2 Tu-Dicke nach Breslow (mm) 1,75 1,7 2 10 3 3 4 4 2,2 Histologischer Typ SSM SSM/NMM SSM NMM SSM/NMM SSM NMM Animaltyp NMM AJCCStadium IV IV Ib/IIIa IV IIb IIa IIIc IIb IIIb Clark Level Lokalisation IV IV IV IV IV IV IV IV IV Schläfe Schulter Oberbauch Schläfe Fußrücken Rücken Vertex Kinn Unterarm Herstellung von Paraffinschnitten Um Gewebe färben und mikroskopisch beurteilen zu können, muss man es in dünnen Schnitten auf Objektträger aufbringen. Zur Herstellung von Schnittpräparaten werden die Gewebeproben in ein Medium eingebettet, das dem Gewebe die für den Schnittvorgang notwendige Festigkeit gibt, ohne jedoch die Struktur wesentlich zu verändern. Dabei soll das Gewebe möglichst gut konserviert werden. Hierzu wurden die in der pathologischen Praxis bewährten Paraffinpräparate hergestellt. Nach der routinemäßigen Fixierung der Proben in Formalin wurde das Gewebe in einer aufsteigenden Alkoholreihe (70%, 96%, 100% Ethanol) entwässert, mit Hilfe von Xylol von Alkohol befreit und anschließend in einer Gießform in warmes Paraffin eingebettet. 36 Nach der Erkaltung und Aushärtung wurden mittels eines Mikrotoms 4 µm dünne Paraffinschnitte hergestellt, im warmen Wasserbad auf silanisierte Objektträger aufgebracht und für 20 min im Brutschrank bei 60°C inkubiert (Heitz et al., 2008). 2.3 Entparaffinierung und Gewebevorbehandlung Vor dem Färbevorgang ist die vollständige Entfernung des Einbettungsmediums zur Vermeidung von Hintergrundfärbung und Überdeckung positiv gefärbter Zellen wichtig. Die Schnitte wurden deshalb in Xylol zweimal 10 Minuten entparaffiniert, für jeweils 5 Minuten mit 99%, 96%, 70% und 50% Ethanol gewaschen und mit destilliertem Wasser abgespült. 2.4 Immunhistochemische Färbung der Schnitte Die Methoden der Immunhistochemie, auch Immunhistologie genannt, haben in den letzten Jahren in Diagnostik und Forschung eine wesentliche Verbesserung bezüglich der Genauigkeit und Effizienz der Differentialdiagnose von Tumoren ermöglicht. Die Immunhistologie macht sich immunologische Reaktionen zur präzisen Lokalisation von Antigenen zunutze. Dafür werden Antikörper eingesetzt, die gegen eine Sequenz von 5-10 Aminosäuren (Epitop) des gesuchten Antigens gerichtet sind. Immunhistound -zytochemische Techniken basieren prinzipiell auf zwei Schritten. Im ersten Schritt werden die Zellen bzw. das Gewebe mit einem Primärantikörper behandelt, der sich spezifisch an das Epitop eines gesuchten Antigens bindet. Die entstandenen AntigenAntikörper-Bindungen werden dann in einem zweiten Schritt mit einer direkten oder indirekten Markierung detektiert (Heitz et al., 2008). Das für die immunhistochemischen Färbungen der von uns untersuchten Präparate verwendete indirekte Streptavidin-Biotin-Verfahren weist im Vergleich zu analogen Färbemethoden durch eine Signalverstärkung eine höhere Empfindlichkeit auf. An den primären Antikörper bindet der mit Biotin markierte sekundäre Antikörper. Jedes biotinylierte Antikörper-Molekül kann mit mehreren Streptavidin-Molekülen reagieren. Diese Streptavidin-Moleküle sind jeweils mit alkalischer Phosphatase konjugiert, 37 welche die Reaktion mit dem Farbstoff Chromogen Red vermittelt. Somit wird die Intensität des Fluoreszenzsignals erhöht. Für die Färbung der Schnitte wurde das REAL Detection System (Alkaline Phosphatase/Chromogen RED, rabbit/mouse, DAKO, Hamburg) verwendet, ein System zur Färbung im indirekten Streptavidin-Biotin-Verfahren. Nachdem die Schnitte für 20 Minuten mit der Demaskierungslösung „Target Retrieval Solution“ gespült worden waren, wurden sie 20 Minuten lang in einem Wasserbad bei 96°C inkubiert (sogenannte hitzeinduzierte Epitopdemaskierung). Die Schnitte wurden für 30 Minuten bei 25°C in einem DAKO Autostainer mit 200 µl Biotin-markiertem Kaninchen-Antikörper bedeckt. Die an die jeweiligen Marker angepassten optimalen Verdünnungen betrugen 1:100 für MCM4, MCM6 und MCM7 (Cytomed, Berlin), 1:50 für p53 und Ki67, 1:25 für p21 und 1:10 für CK20 (DAKO, Hamburg). Der biotingekoppelte Sekundärantikörper war ein Maus-anti-Kaninchen-Antikörper der Firma DAKO. Nach dem zweiminütigen Waschen mit Waschpuffer (DAKO) wurden die Präparate mit Streptavidin-alkalische Phosphatase (DAKO) für 30 Minuten markiert. Zur Visualisierung wurde Chromogen Red (Red permanent, DAKO) verwendet. Dann wurden die Schnitte mit Hämatoxylin gegengefärbt (nukleäre Blaufärbung) und schließlich in Mowiol (Polyvinylalkohol, Roche Molecular Biochemicals, Mannheim) eingebettet. Tab. 6: Verwendete Marker, deren Herkunft und Verdünnung Marker Herkunft Verdünnung MCM4 Cytomed, Berlin 1:100 MCM6 Cytomed, Berlin 1:100 MCM7 Cytomed, Berlin 1:100 Ki-67 DAKO, Hamburg 1:50 CK20 DAKO, Hamburg 1:10 P21 DAKO, Hamburg 1:25 P53 DAKO, Hamburg 1:50 38 2.5 Auswertung der histologischen Schnitte Alle immunhistochemischen Färbungen wurden von derselben Person (A.B.) bezüglich der Ausprägung der Fluoreszenzmarkierung ausgewertet. Die mikroskopische Auswertung bei 400facher Vergrößerung wurde als verblindete Analyse in einer zufälligen Reihenfolge der verschiedenen Tumorgewebspräparate durchgeführt. Hierzu wurden innerhalb der geschädigten Dermis willkürlich drei Gesichtsfelder der Präparate ausgewählt und die positiven sowie negativen Zellen gezählt. Bei einer unregelmäßigen Verteilung der Positivität wurden drei repräsentative Felder ausgewählt. Mit einer mäanderförmigen Durchmusterung der Zellen wurde das gesamte Gesichtsfeld ausgewertet. Um alle positiven Zellen zu erfassen, wurde jeweils in zwei Focusebenen gezählt. Die quantitativen Ergebnisse der drei Zählungen wurden gemittelt und als Prozentsatz der positiv gefärbten Zellen bzw. Nuclei in Bezug auf die Gesamtheit der Zellen innerhalb des Gesichtsfeldes angegeben. Für MCM4, MCM6, MCM7, Ki-67, p53 und p21 wurde nur eine deutliche Färbung des Nucleus als positiv gewertet, in der CK20-Färbung nur eine deutliche punktförmige perinukleäre Färbung. In der immunhistochemischen MCM-Färbung sieht man typischerweise eine starke Kernfärbung mit gelegentlich schwach positivem Zytoplasma (Boyd et al., 2008). Die Färbungssensitivität wurde durch Auszählung von je drei Ausschnitten aus gesunder Haut verifiziert. 2.6 Statistik Die Datenanalyse wurde mit Hilfe des Statistikprogramms MedCalc Software (Mariakerke, Belgien) durchgeführt. Normal verteilte Werte wurden als Mittelwerte ± Standardabweichung (SD) ausgedrückt. Für parametrisch gepaarte Werte wurde der zweiseitige Student´s t-Test verwendet. Ebenso wurde eine Analyse des Pearson´s Korrelationskoeffizienten (r) durchgeführt. Ein P-Wert < 0,05 wurde als statistisch signifikant angesehen. Die Verteilung der Werte wurde mit dem D‘Agostino-Pearson-Test untersucht. Dieser Test prüft die Normalverteilung der Residuen, indem er zunächst die Schiefe und Wölbung der Gauss‘schen Kurve berechnet, um die Abweichung der Verteilung von der Kurve bezüglich Asymmetrie und Form zu quantifizieren. Mit diesem Test wird 39 berechnet, wie stark jeder dieser Werte von dem Wert abweicht, welchen man bei einer Gauss‘schen Normalverteilung erwarten würde. Aus der Summe dieser Abweichungen wird ein einzelner P-Wert berechnet. Kleine P-Werte zeigen an, dass die Annahme der Normalverteilung nicht korrekt ist. 40 III. Ergebnisse 3.1 Patienten Die MCC-Gruppe der acht Patienten im Alter zwischen 59 und 86 Jahre (Mittel 76,5±10,8 Jahre) wiesen einen mittleren Tumordurchmesser bei Erstdiagnose von 2,8 cm mit einer Standardabweichung von 1,7 cm auf (bei einer Spanne von 0,7 bis 5,1 cm). Vier Patienten befanden sich im Stadium I, die anderen vier im Stadium II. Die Ergebnisse wurden verglichen mit der MM-Gruppe aus neun Patienten mit fünf Männern und vier Frauen im Alter zwischen 20 und 85 Jahren, Mittel 56,2±23,3 Jahre, die eine mittlere Tumordicke von 3,6 mm nach Breslow mit einer Standardabweichung von 2,6 mm (Spanne von 1,7 bis 10 mm) aufwiesen (Breslow, 1970). Alle MMs gehörten dem Clark Level IV an. Bezüglich der AJCC-Klassifikation von 2002 wies ein Patient das Stadium IIa auf, zwei Patienten das Stadium IIb, jeweils ein Patient die Stadien IIIa, IIIb, und IIIc und drei Patienten befanden sich im Stadium IV. Tab. 7: Expressionsunterschiede verschiedener fluoreszenzmarkierter Zellzyklusproteine und CK20 zwischen Merkelzellkarzinom (MCC) und Melanom (MM). Die Ergebnisse sind angegeben als Mittelwerte± Standardabweichung in Prozent. Zur Signifikanztestung wurde der Student‘s t-Test verwendet, P-Werte < 0,05 wurden als signifikant angesehen (*). Marker MCC CK20 P53 P21 Ki-67 MCM4 MCM6 MCM7 15,2±22,7 68,6±26,2 40,1±38,8 28,7±7,9 66,0±26,5 70,9±11,9 76,5±16,4 58,4±28,8 25,8±16,1 11,0±9,2 33,9±22,4 31,7±22,7 34,9±25,5 MM 0±0 P-Wert 0,061 0,46 0,35 0,0012* 0,017* 0,0031* 0,0013* 41 3.2 Zytokeratin 20 Die Markierung mit CK20 zeigten in allen MM-Präparate einen negativen Befund, während in den Färbungen des MCC eine deutliche Positivität mit 15,2+-22,7% zu messen war (Abb. 8). Da im Allgemeinen nur P-Werte < 0,05 als signifikant gewertet werden, war die CK20-Expression zwischen den beiden Tumoren aufgrund des hohen Fehlers jedoch nicht signifikant verschieden. Abb. 8: CK20-Färbung im MCC-Präparat in 20-facher (A) und 40-facher Vergrößerung (B). Man sieht die deutliche charakteristische perinukleäre punktförmige Positivität der Zellen. 42 3.3 p21 und p53 Die Ergebnisse der Auszählung von p21 und p53 ergaben, dass die Präparate zwar gegenüber gesunder Haut relativ stark positiv für beide Marker waren, jedoch kein signifikanter Unterschied zwischen den Werten der zwei Tumorentitäten bestand. In der p21-Färbung stellte sich eine verstreute Expression der Keratinozyten in der Epidermis dar, die allerdings mehrheitlich auf die suprabasale Schicht beschränkt blieb (Abb. 9 A, B). Die Fluoreszenzmarkierung von p53 zeigte 68,6±26,2% positive Zellen bei MCC und 58,4±28,8% bei MM bei einem P-Wert von 0,46 (Abb. 9 C, D). Ebenso waren in den Färbungen mit p21 die Werte sowohl bei MCC mit 40,1±38,8% als auch bei MM mit 25,8±16,1% erhöht, aber dennoch nicht signifikant unterschiedlich (P = 0,35). MCC MM p21 p53 Abb. 9: Immunhistochemische Färbung mit den Markern p21 (A, B) und p53 (C, D) bei MCC (A, C) und MM (B, D) in 200facher Vergrößerung. Man sieht eine deutliche rote Kernfärbung im Tumorgewebe und eine verstreute suprabasale Positivität der Keratinozyten innerhalb der Epidermis. Besonders gut sichtbar ist dies im p21-gefärbten MM (B). 43 3.4 Ki-67 In der Färbung mit Ki-67-Antikörpern ergab sich ein signifikanter Unterschied zwischen MCC und MM (Abb. 10). Die Ki-67-Immunreaktivität war mit 28,7±7,9% mehr als doppelt so hoch in MCC wie in MM mit 11,0±9,2%. Der P-Wert betrug 0,0012. Im Präparat fiel eine sehr deutliche und klar abgegrenzte rote Färbung der regelmäßig im Tumorgewebe verteilten positiven Nuclei auf. Wie bei den MCMPräparaten bestand eine suprabasale vereinzelte Positivität der gesunden Epidermis. MCC MM Ki-67 Abb. 10: Expressionsunterschiede von Ki-67 zwischen MCC (links) und MM (rechts). Man sieht die deutliche rote Kernfärbung und ein signifikantes Überwiegen der Positivität im MCC-Präparat. 44 3.5 Minichromosome Maintenance Proteine: MCM4, MCM6, MCM7 In den MCM-Färbungen war die Kernfärbung der Tumorzellen deutlich unter dem Mikroskop sichtbar. Auch hier zeigte die periläsionale gesunde Haut eine milde Positivität, die jedoch im Wesentlichen auf die Nuclei der basalen und peribasalen Zellen beschränkt war. Die Expression aller untersuchten MCM-Proteine im Tumorgewebe war im MCC im Vergleich zum MM signifikant erhöht. Die mikroskopische Zählung ergab für MCM4 66,0±26,5% Positivität der MCCTumorzellen und 33,9±22,4% der MM-Tumorzellen (P = 0,017). Für MCM6 betrug die Anzahl positiv gezählter Zellen 70,9±11,9% bei MCC und 31,7±22,7% bei MM (P = 0,0031). Die MCM7-Positivität belief sich auf 76,5±16,4% bei MCC und 34,9±25,5% bei MM (P = 0,0013). Damit waren alle untersuchten MCM-Marker in Zellen des MCC mehr als doppelt so stark positiv wie in MM-Zellen. Repräsentative immunhistochemische Bilder von MCM4, MCM6 und MCM7 in läsionaler Haut von MCC und MM sind in Abb. 11 im Vergleich dargestellt. Es bestand keine signifikante Korrelation zwischen der Expression der untersuchten Marker (Spanne der r-Werte: 0,03 – 0,15; P > 0,05). 45 MCC MM MCM4 MCM6 MCM7 Abb. 11: Mikroskopische Aufnahmen immunhistochemischer Färbungen in läsionaler Haut von Patienten mit Merkelzellkarzinom und Malignem Melanom in 200facher Vergrößerung. Die Epidermis ist im Bild oben zu sehen (bzw. bei (A) und (B) nach oben ausgerichtet). Färbungen von MCM4, MCM6 und MCM7 an Präparaten von MCC und MM sind jeweils gegenübergestellt. Die Expression in MCC von MCM4 (A), MCM6 (C) und MCM7 (E) war signifikant höher als die in MM von MCM4 (B), MCM6 (D) und MCM7 (F). Es ist die deutliche Rotfärbung der Zellkerne innerhalb des Tumorgewebes zu sehen. In der Epidermis fällt eine vereinzelte Expression auch suprabasal auf, was bei MCM6 besonders stark ausgeprägt ist. 46 IV. Diskussion In der vorliegenden Arbeit wurden repräsentative Marker des Zellzyklus und der Zellproliferation ausgewählt, um die Mechanismen der Tumorgenese und die Expression verschiedener Proteine im MCC näher zu untersuchen. Im besonderen Interesse stand hierbei die Untersuchung der MCM-Proteine sowie deren Vergleich mit bekannten Markern und der MCM-Expression im MM. Als ein seltener Tumor ist das MCC noch nicht grundlegend erforscht, gewinnt aber in letzter Zeit zunehmend an Bedeutung. Besonders aufgrund der stetig steigenden Tumorinzidenz und der kürzlich von Feng et al. publizierten Studie über die klonale Integration des Merkel cell polyomavirus (MCV) in die DNA von MCC-Zellen rückt das MCC mehr und mehr in den Fokus der Wissenschaft (Feng et al., 2008). 4.1 Onkogenese des Merkelzellkarzinoms Warum die Inzidenz des MCC seit Jahren steigt, ist noch unklar und wahrscheinlich Folge eines multifaktoriellen Prozesses. Die Ursachen sind unter Anderem das wachsende Durchschnittsalter der Bevölkerung, eine steigende Anzahl immunsupprimierter Patienten und die vermehrte Sonnenexposition. Ob es weitere Faktoren für die steigende Inzidenz gibt und inwieweit das MCV eine Rolle in der Tumorgenese spielt, bedarf noch weiterer Untersuchungen. 4.1.1 Merkelzellkarzinom und MCV Die mögliche virale Genese des MCC durch MCV ist ein Schwerpunkt der aktuellen Forschung am MCC. Im Tiermodell ist die kanzerogene Wirkung einiger Polyomaviren bereits beschrieben (Houben et al., 2009). Epidemiologische Daten sprechen für eine infektiöse Genese des MCC. Das MCC betrifft vor allem ältere und immunsupprimierte Patienten, und bei Immunsupprimierten ist die krankheitsspezifische Letalität auf bis zu 56% erhöht. Auch die Mortalität anderer viral induzierter Tumore ist unter 47 Immunsuppression stark erhöht. Bei nicht viral bedingten Tumorentitäten hingegen tritt nur ein moderater Anstieg der Mortalität auf (Houben et al., 2009). Feng et al. wiesen in 80% der MCC-Präparate integrierte MCV-DNA nach. Auch in gesunder Haut konnte man MCV finden, jedoch mit deutlich seltenerem Auftreten (10:1) (Feng et al., 2008). Da das MCV in der Bevölkerung stark verbreitet scheint, ist die weitere Forschung an dem Virus als ein Risikofaktor für die Entstehung des MCC von Bedeutung. Tolstov et al. untersuchten die Prävalenz und Altersabhängigkeit von MCV in den USA anhand von IgG-Antikörper (IgG-Ak) gegen MCV im Blut der Probanden. Säuglinge unter einem Jahr wiesen keine IgG-Ak gegen MCV auf, bei Kindern zwischen zwei und fünf Jahren fanden sich dagegen bei 45% MCV-IgG. Bei Erwachsenen lag die Positivität für MCV-IgG bei 70%. IgM-Ak konnten nicht nachgewiesen werden. Auch bei der Hälfte der Patienten mit MCV-negativem MCC konnte im Blut IgG-Ak gefunden werden, sodass selbst in diesen Fällen eine Verbindung mit einer MCV-Infektion möglich erscheint (Tostov et al., 2009). Die Tatsache jedoch, dass es auch MCV-negative MCCs gibt, lässt zwei oder mehrere Ätiologien des MCCs vermuten. Der Zusammenhang zwischen integrierender Virus-DNA und einer nachfolgenden Tumorgenese ist seit der Entdeckung des Epstein-Barr-Virus in Burkitt-LymphomZellen bekannt, aber erst bei wenigen Tumoren belegt (Epstein et al., 1964). Im Jahre 2008 wurde dem Heidelberger Wissenschaftler Harald zur Hausen für die erstmalige Beschreibung dieses Mechanismus bei Zervixkarzinom und Papillomaviren (human papilloma virus = HPV) der Nobelpreis für Medizin verliehen. Genau wie HPV sind auch die DNA-Viren EBV (Epstein-Barr-Virus, Herpesvirus 4) HHV8 (Herpesvirus 8), und HBV (Hepatitis B-Virus) durch verschiedene Mechanismen an der Genese verschiedener Tumore beteiligt (Elgui de Oliveira, 2007). So ist das EBV mit dem endemischen Burkitt-Lymphom assoziiert, das HHV8 mit dem Kaposi-Sarkom und eine chronische Hepatitis B-Infektion kann zu Leberkarzinomen führen (Elgui de Oliveira, 2007). Alle diese Viren integrieren zumindest zum Teil in die Wirts-DNA. Eine erregerbedingte Tumorgenese wird mit verschiedenen Pathomechanismen auch für andere Keime diskutiert. Meist scheint allerdings eine chronische Entzündung des Gewebes ein indirekter kanzerogener Faktor zu sein und somit die Tumorgenese keine direkte Folge der Infektion. Gut belegt ist dies z. B. beim humanpathogenen Bakterium Helicobacter pylori, das durch die Abgabe von bakteriellen Toxinen eine chronische 48 Gastritis induziert und mit der Entstehung maligner MALT-Lymphome assoziiert ist (Stolte, 1992). Shuda et al. zeigten in sechs von acht untersuchten MCV-infizierten MCCs eine Mutation der integrierten Virus-DNA (Shuda et al., 2008). Das von der Mutation betroffene sogenannte „large T antigen“ (LTA) ist ein von MCV exprimiertes multifunktionales Protein, das normalerweise sowohl den Replikationszyklus der Viren reguliert als auch an Wirtsproteine binden kann. So wird die Wirtszelle nach der Infektion in die S-Phase des Zellzyklus gezwungen und das Virus kann sich mit Hilfe des zellulären Replikationsapparates replizieren. Durch die beschriebene Mutation ist die in Wildtyp-LTA-Proteinen vorhandene Helikase-Funktion nicht mehr vorhanden und damit keine autonome Virusreplikation möglich. In MCV-Isolaten aus gesundem Gewebe sind diese Mutationen nicht zu finden. Man nimmt an, dass die Integration des MCV-Genoms mit intaktem LTA inkompatibel mit der Proliferation der infizierten Zelle ist. Entweder würde sich das Virus fortwährend replizieren und eine Lyse der Zelle verursachen, oder es käme zu einer Kollision der Replikationsgabeln und somit zu einer DNA-Fragmentierung mit einer darauf folgenden Apoptoseinduktion. Durch die LTA-Mutation wird die Wirtszelle erhalten und das Virus kann sich zusammen mit ihr replizieren. Das Vorliegen dieser Mutation und die Monoklonalität des Virus weisen darauf hin, dass dessen Integration ins Genom vor der Tumorgenese und der klonalen Replikation der Merkelzelle stattgefunden haben muss. Das wiederum macht eine Beteiligung des Virus an der Tumorgenese wahrscheinlich (Feng et al., 2008). Die Autoren nehmen an, dass sich der Nachweis der von ihnen gefundenen LTA-Mutation eventuell zur Differenzierung zwischen kanzerogenen und nicht-kanzerogenen MCVStämmen nutzen lässt. Zusätzlich kann LTA an p53 binden und dieses inaktivieren, sodass im Falle einer DNA-Schädigung ein Anhalten des Zellzyklus, die Einleitung von DNA- Reparaturvorgängen und die Apoptose verhindert werden. Damit wird die ungehinderte Proliferation entarteter Zellen induziert (Houben et al., 2009). Ebenso ist das Retinoblastoma Tumorsuppressorprotein, das einen Übergang beschädigter Zellen von der G1- in die S-Phase verhindert, eine Zielstruktur des LTA (Shuda et al., 2008) Eine Zellzyklus-Induktion findet man somit über verschiedene Mechanismen in allen MCV-positiven MCCs. Interessanterweise finden sich in unseren Daten die Zellzyklusmarker MCM4, MCM6 und MCM7 erhöht, was für weitere Untersuchungen der molekularen Onkogenese des MCCs von Bedeutung sein könnte. 49 4.2 Histogenese der Merkelzelle und des Merkelzellkarzinoms Über die Histogenese des MCC wird in der Literatur noch kontrovers diskutiert. Obwohl die meisten Autoren einen Ursprung des MCC aus der Merkelzelle annehmen, gibt es berechtigte Zweifel an dieser Theorie. Das MCC ist zumeist in der Dermis lokalisiert, die Merkelzelle dagegen findet man in der Epidermis. Die Lokalisation der Tumore ist hauptsächlich an Kopf, Hals, und Extremitäten. Die Dichte der Merkelzellen ist jedoch am höchsten an Hand- und Fußinnenflächen sowie an den Fingerbeeren. Auch werden einige Antigene wie beispielsweise Neurofilamente zwar in MCC-Zellen, aber nicht in gesunden Merkelzellen exprimiert (Merot, 1990). Wegen dieser Unstimmigkeiten sind einige Autoren der Meinung, dass das MCC sich nicht aus Merkelzellen, sondern aus derselben Vorläuferzelle wie Keratinozyten entwickelt (Dancey et al., 2006; Merot, 1990). Auch die Merkelzelle selbst wird teilweise in ihrer Herkunft angezweifelt und ihr Ursprung statt der Neuralleiste einer Vorläuferzelle von Keratinozyten zugeordnet (Camisa and Weissmann, 1982). Möglicher Weise kann eine weitere Evaluation der Proteinexpression in MCC-Zellen zum Verständnis der Histogenese dieses Tumors beitragen. Auch die Homogenität des MCC wird in der Literatur diskutiert. So gibt es Merkelzellpopulationen, die in vitro Suspensionen bilden und solche, die zusammenhängend wachsen (Feng et al., 2008). Außerdem gibt es starke Schwankungen in der Proteinexpression, z. B. in der CK20-Positivität (Calder et al., 2007). Die Vermutung, dass die Diagnose MCC verschiedene Erkrankungen mit einer ähnlichen klinischen und biologischen Erscheinungsform subsummiert, kann nur durch weitere molekulare Untersuchungen näher beleuchtet werden. 4.3 Immunhistochemische Marker des Merkelzellkarzinoms Die Differentialdiagnose zwischen MCC und anderen kleinzelligen Hauttumoren bzw. Hautmetastasen ist immer noch ein schwieriges Feld und gelingt manchmal nicht eindeutig. Deshalb sind die Etablierung und der Einsatz zusätzlicher Marker, die eine eindeutige Diagnose des MCCs ermöglichen, von großer klinischer Bedeutung. Bisher stützt sich die Diagnose von MCC hauptsächlich auf Zytokeratin 20 und Neurofilamente, jedoch sind diese Marker nicht in jedem Fall verlässlich. Daneben existieren eine Vielzahl weiterer Marker (siehe Einleitung), die aber entweder für die 50 pathologische Routine nicht geeignet sind oder eine zu geringe Sensitivität und Spezifität aufweisen. Bei der Auswahl der untersuchten Marker ging es darum, für das MCC validierte (CK20, Ki67, p53, p21) mit noch nicht untersuchten Markern (MCM4, MCM6, MCM7) zu kombinieren, um einerseits die Relevanz der neuen Marker für die Diagnostik des MCCs zu prüfen, aber auch deren Vergleichbarkeit und Beziehung mit anderen bereits etablierten Markern zu untersuchen. Des Weiteren sollte der Unterschied des Protein-Expressionsmusters zu der Vergleichsgruppe Melanom herausgearbeitet werden. Die Ergebnisse der vorliegenden Arbeit zeigten, dass die Expression von MCM-Proteinen eine Abgrenzung des MCCs vom Malignen Melanom ermöglicht. Dies ist insbesondere wichtig, da sich die Therapie der beiden Tumore unterscheidet. Falls MCM-Proteine einen prognostischen Wert für das MCC haben, kann dies eine Hilfestellung zur Entscheidung über die Aggressivität der Therapie, also die Intensität der Radiatio oder die Anwendung einer Chemotherapie sein. Ki-67 ist als ein Maß für die Proliferationsfraktion ein wichtiger Marker in der Tumordiagnostik. Da Ki-67 während aller Phasen des Zellzyklus außer in der G0-Phase exprimiert wird, besitzt dieser Marker unabhängigen prognostischen Wert für viele Tumore wie Brustkrebs, Weichteilsarkom, Meningiom, Prostatakarzinom und NonHodgkin-Lymphom (Endl et al., 2001). Die Daten in der Literatur belegen, dass die von Ki-67 in MCC gemessene Positivität zwischen 5% und 70% liegt (Mittelwert 52,8%) und dass die Überexpression von Ki-67 signifikant mit der Tumorprogression korreliert ist (Llombart et al., 2005; Fernández-Figueras et al., 2007; Bickle et al., 2004). Auch für das MCC wurde eine prognostische Bedeutung gezeigt (Koljonen et al., 2006). Die von uns beobachtete moderate mittlere Expression von Ki-67 in MCC liegt im Mittelfeld dieser weiten Spanne und ist nicht überraschend. Als ein schnell wachsender Tumor besitzt das MCC eine relativ hohe Wachstumsfraktion. Das im Vergleich zum MCC nicht so rasch proliferierende MM wies demzufolge eine weniger als halb so hohe Ki67-Expression auf. Da sich die Basalzellen ständig teilen, um eine intakte Epidermis zu gewährleisten, war die in den Präparaten suprabasal auffallende Positivität der Proliferationsmarker Ki-67 und auch MCM in gesunder Epidermis zu erwarten. Eine Verfeinerung der Diagnostik würde hinsichtlich der prognostischen Genauigkeit eine Verbesserung der Therapie und Patientenversorgung ermöglichen. Da durch die Färbung von MCM-Proteinen, anders als bei Ki-67 und anderen Proliferationsmarkern, auch teilungsfähige Zellen in der Ruhephase (G0) markiert werden, spiegelt die MCMFärbung die Proliferationskraft des Tumors besser wider als die gängige Ki-67-Färbung. 51 In diffusen großzelligen B-Zell-Lymphomen wurde beispielsweise gezeigt, dass die Bestimmung der MCM6-Expression genutzt werden kann, um die Tumorproliferation abzuschätzen (Schrader et al., 2005). Somit könnte MCM6 als zusätzlicher prognostischer Marker nützlich sein, um die Voraussage des Verlaufs in diffusen großzelligen B-Zell-Lymphomen zu verfeinern (Schrader et al., 2005). Wahrscheinlich ist dies auch beim MCC möglich. Da allgemein aufgrund der geringen Inzidenz wenig klinische Erfahrung vorliegt und sich die evidenzbasierte Therapie der Erkrankung noch in der Entwicklung befindet, hängt vieles von der richtigen Einschätzung des behandelnden Arztes ab. Die Höhe der Wachstumsfraktion kann in der Therapieplanung einen wesentlichen Entscheidungsvorteil bieten. So kann z.B. ein Patient mit hoher Proliferationsfraktion von einer aggressiven therapeutischen Intervention wie einer Chemotherapie profitieren. Einen Patienten mit niedriger Proliferationsfraktion würde man hingegen, unter Erhaltung der höchstmöglichen Lebensqualität, eher konservativ behandeln. Vermutlich können auf lange Sicht durch eine genauere Kenntnis der regulatorischen Vorgänge in der MCC-Zelle neue Therapieansätze entwickelt und damit Lebensqualität und Überlebenszeit der MCC-Patienten erhöht werden. CK20 ist der gängigste Marker zur Identifizierung von MCCs und deren Abgrenzung von anderen kleinzelligen Karzinomen wie beispielsweise dem MM. In der Sensitivität der Detektion von Mikrometastasierung in Sentinel-Lymphknoten konnte mit Hilfe von CK20 eine maßgebliche Verbesserung im Vergleich zur reinen HE-Färbung erreicht werden (Su et al., 2002). In dieser Arbeit bildete CK20 die Grundlage der eindeutigen Diagnose der untersuchten Präparate. Erwartungsgemäß war CK20 in den MMPräparaten durchgehend negativ und zeigte eine mäßige Positivität in den MCCFärbungen. Unsere Daten ergaben, dass sowohl die Proteinexpression von p53 als auch die von p21 in beiden untersuchten Tumorentitäten stark gesteigert waren. Allerdings bestand kein signifikanter Unterschied zwischen MCC und MM im Hinblick auf deren p53- und p21Expressionslevels. Der Tumorsuppressor p53 spielt eine zentrale Rolle in zellulären Antworten auf Stressstimuli, indem er den Zellzyklus anhalten oder die Apoptose einleiten kann. In menschlichen Krebszellen ist p53 oft mutiert, was zu genetischer Instabilität und einer Apoptosedefizienz der Tumorzellen führt (Benjamin et al., 2008; Nigro et al., 1989). Die Zellen beginnen sich auch mit Schäden in der DNA unkontrolliert zu teilen und es kommt zur Tumorbildung. 52 Einige Viren beeinflussen p53 über verschiedene Mechanismen und fördern so die Onkogenese. Das Hepatitis-B-Virus (HBV) fördert die Lebertumorgenese u.a. dadurch, dass sein Kernprotein das p53-Level erniedrigt. Mehrere Viren sind in der Lage, p53 direkt zu binden und zu degradieren, z. B. der HBV-Virustyp NS5A (Majumder et al., 2001), der Humane Papillomavirus Typ E6 (Münger et al., 2004) und das oben erwähnte MCV-LTA. Aktuelle Studien lassen eine verminderte Funktionalität von p53 in MM-Zellen vermuten, da deren Überexpression von p53 keine Apoptose induzierte (Benjamin et al., 2008). Eine Bestrahlung der veränderten Zellen führte zwar zu einer p53-Akkumulation, jedoch nicht zu Apoptoseinduktion (Benjamin et al., 2008). Da das nicht mutierte p53-Protein, der sogenannte Wildtyp, eine kurze Halbwertszeit hat und immunhistochemisch normalerweise nicht nachweisbar ist, spiegelt die von uns gemessene recht hohe Positivität wahrscheinlich die Anwesenheit mutierten p53Proteins (Benjamin et al., 2008). Auch das oben erwähnte LTA-Protein des MC-Virus hat die Fähigkeit, an p53 zu binden und es zu inaktivieren, was ebenso eine hohe p53Akkumulation ohne Hemmung der Proliferation erklären könnte. Das Kernprotein p21 ist maßgeblich in die Mechanismen von Differenzierung, Apoptose und Anhalten des Zellzyklus eingebunden (Gartel and Radhakrishnan, 2005). Damit besitzt p21 eine Schlüsselrolle in der Tumorgenese, da normalerweise durch das Protein die DNA geschädigter Zellen entweder vor der Vollendung ihres Teilungsvorganges repariert werden kann oder bei unzureichender Funktion der Zelle deren Apoptose eingeleitet wird. Das Protein ist in seiner Expression stark von der Anwesenheit von p53 abhängig. Alle Mechanismen, die die Funktion von p53-Spiegel mindern, senken auch die p21-Bildung (Gartel and Radhakrishnan, 2005). Die in der Literatur vorliegenden Daten bezüglich der Expression von p53 und p21 im MCC sind variabel. Zum Beispiel fanden Feinmesser et al. 25% der Fälle positiv für p53Antikörper (Feinmesser et al., 1999), während Tucci et al. p53-Immunoreaktivität in ca. 36% der Fälle ohne prognostischen Wert fanden (Tucci et al., 2006). Llombart et al. fanden eine moderate bis starke Immunreaktivität für p53 von 75% in MCC (Llombart et al., 2005). Fernández-Figueras et al. beobachteten eine Überexpression von p53 in MCC. Der Prozentsatz der positiven Zellen für p21 lag zwischen 5% und 50%, wobei in den meisten Fällen 25% der Zellen p21-positiv waren (Fernández-Figueras et al., 2007). Anders als die p53-Expression scheint das Ausmaß der p21-Expression im MCC mit einer schlechten Prognose assoziiert zu sein (Fernández-Figueras et al., 2007). Die Ergebnisse der vorliegenden Arbeit für die Expression von p53 und p21 in MCC decken 53 sich mit denen von Llombart et al. und Fernández-Figueras et al., was die Auswertung unserer Daten validiert (Llombart et al., 2005; Fernández-Figueras et al., 2007). Durch eine Korrelation der einzelnen p21-Werte mit dem klinischen Verlauf könnte man die von Fernandez-Figueras et al. gefundene prognostische Aussage weiter auf ihre Gültigkeit untersuchen. Wenngleich die meisten der vorliegenden MCM-Studien an Hauttumoren mit antiMCM2, MCM5 und MCM6-Antikörpern durchgeführt wurden, scheinen alle MCMProteine eine ähnliche Verteilung zu haben (Ha et al., 2004; Lei, 2005). Bisherige Publikationen zeigen, dass diese Proteingruppe auf zahlreichen Gebieten vielversprechende Ergebnisse liefert. Die klinische Relevanz verschiedener MCMProteine als Proliferationsmarker ist bereits für viele maligne Tumore immunhistochemisch belegt (Freeman et al., 1999), z. B. im nicht-kleinzelligen Lungenkarzinom (Ramnath et al., 2001), Prostatakarzinom (Meng et al., 2001; Padmanabhan et al., 2004), oralen Plattenepithelkarzinom (Kodani et al., 2003), Chondrosarkom (Helfenstein et al., 2004), Brustkrebs (Gonzalez et al., 2004), endometrialen Karzinom (Li et al., 2005), Schilddrüsenkarzinom (Guida et al., 2005), in oligodendroglialen Tumoren (Wharton et al., 2001) und ösophagealen Tumoren (Going et al., 2002). Die meisten dieser Studien untersuchten MCM2, einige wenige Studien betrachten auch die MCM6-Expression, wie z.B. beim Hodgkin‘s-Lymphom (Karimi et al., 2008). MCM7 als unabhängiger prognostischer Marker scheint beim Adenokarzinom der Lunge im Stadium I verlässlicher als Ki-67 zu sein (Fujioka et al., 2009). Auch im kolorektalem Karzinom ist MCM7 ein unabhängiger prognostischer Faktor und MCM7-positive aber Ki-67-negative Tumorzellen sind mit Tumormetastasen korreliert (Nishihara et al., 2008). In einer Studie über kutane lymphoproliferative Erkrankungen zeigten Mycosis fungoides im Stadium I-IIA und Parapsoriasis en Plaques signifikant erhöhte MCM7-Positivät in der immunhistochemischen Färbung im Vergleich zu der MCM7-Expression von Mycosis fungoides im Stadium IIB-IV und Lymphomatoider Papulose (Gambichler et al., 2008). In diffusen großzelligen B-Zell-Lymphomen wurde gezeigt, dass die Bestimmung der MCM6-Expression zur Abschätzung der Tumorproliferation genutzt werden kann (Schrader et al., 2005). Somit könnte MCM6 als zusätzlicher prognostischer Marker nützlich sein, um die Voraussage des Verlaufs in diffusen großzelligen B-ZellLymphomen zu verfeinern (Schrader et al., 2005). Da MCM scheinbar als Folge einer Infektion mit HPV erhöht sind, wurde ihr Einsatz zum spezifischen Nachweis von 54 High-grade Zervixneoplasien angeregt (Malinowski, 2005). In der Melanomforschung liegen eine Reihe von Arbeiten zu MCM-Proteinen vor. Aktuelle Daten zeigten, dass MCM2, MCM3 und MCM4 in melanozytären Neoplasien abhängig von deren Dignität unterschiedlich exprimiert werden und eventuell ein zusätzliches Mittel zur Unterscheidung zwischen benignen und malignen melanozytären Läsionen bieten (Boyd et al., 2008; Gambichler et al., 2009). Ähnlich unserer Resultate für die MCM4-, MCM6- und MCM7-Proteinexpression in MM, haben Boyd et al. eine signifikante Erhöhung der MCM2-Proteinlevel in MM beobachtet (Boyd et al., 2008). Auch MCM3 und MCM4 zeigten eine signifikant erhöhte Positivität in superfiziell spreitenden Melanomen im Vergleich zu benignen melanozytären und dysplastischen Nävi (Gambichler et al., 2009). MCM7 hingegen wies keinen Unterschied bezüglich der Dignität der Präparate, sondern lediglich eine Korrelation mit der Tumordicke nach Breslow und dem Clark Level auf (Gambichler et al., 2009). MCM3, MCM4 und MCM6 wurden signifikant stärker in den Tumoren von MM-Patienten mit Fernmetastasen exprimiert (Winnepenninckx et al., 2006). In der vorliegenden Arbeit wurde in den untersuchten MCC-Präparaten eine im Vergleich zum MM mehr als doppelt so hohe Zahl MCM-positiver Zellen gefunden. Im Gegensatz zu Ki-67 ist die MCM-Proteinexpression während des gesamten Zellzyklus stabil und deshalb ein exzellenter Indikator für die Phase des Zellzyklus und der Proliferation (Ha et al., 2004; Gambichler et al., 2008). Der Unterschied von MCMProteinen zu anderen Proliferationsmarkern ist, dass man durch MCM auch solche Zellen identifizieren kann, die sich zwar im Ruhezustand (G0) befinden, aber noch teilungsfähig sind (Ha et al., 2004; Lei, 2005). Damit ist eine Aussage über das Proliferationspotential des Tumors und den erwarteten Tumorprogress viel genauer möglich. Dies hat Auswirkungen auf individuelle Therapieentscheidungen und die weitere medizinische Betreuung des Patienten. 55 4.4 Perspektiven Diese Studie ist die erste immunhistochemische Untersuchung der Expression von MCM-Proteinen in MCC und liefert damit wichtige Daten im Bereich der pathologischen Differentialdiagnostik kleinzelliger Hauttumore. Wie zahlreiche Studien belegen, ist MCM bei anderen Tumoren ein sehr guter Proliferationsmarker und hat oftmals prognostischen Wert. Das bietet die Aussicht auf eine zukünftige Etablierung dieser Proteinfamilie in der Routinediagnostik. Auch bei Tieren wurden Fälle von MCC beschrieben (Bagnasco et al., 2003; Konno et al., 1998; Nickoloff et al., 1985). Die Forschung am MCC kann daher ebenfalls für die Veterinärmedizin von Bedeutung sein. Die Untersuchung einer größeren Patientengruppe, auch im Zusammenhang mit anderen klinisch-pathologischen Parametern und weiteren Tumormarkern, wäre von Vorteil, um die prognostische Bedeutung sowie Sensitivität und Spezifität der MCMProteine im MCC zu validieren. Trotz der relativen Genauigkeit und Aussagekraft, die man bei der Streptavidin-BiotinFärbung erwarten kann, sollte diese Methode durch alternative biochemische Verfahren zur weiteren Validierung ergänzt werden. Seltene Kreuzreaktionen können z.B. mit dem Western Blot-Verfahren ausgeschlossen werden. Die mikroskopischen Auszählung an Immunfärbungen, wie sie in dieser Arbeit gezeigt wurde, erlaubt allerdings eine sofortige valide Interpretation der Ergebnisse. Dies legt den Grundstein für eine mögliche Weiterentwicklung der diagnostischen Nutzung der untersuchten Marker. Das Immunsystem stellt sowohl beim MCC als auch beim MM einen wichtigen Faktor in der Tumorgenese und –progression dar. In den 16 bis zum Jahr 2008 bekannten Fällen von Spontanremission trat diese immer nach der histologischen Sicherung auf. Einige Autoren gehen davon aus, dass mit dem chirurgischen Eingriff das Immunsystem angeregt wird und so der Körper in der Lage ist, den Tumor zu bekämpfen (Richetta et al., 2008; Karkos et al., 2010). In der Melanomtherapie ist die Stärkung des Immunsystems bereits anfänglich erforscht und mit bisher guten Erfolgen in klinischer Erprobung, wie beispielsweise die Vakzination durch mit spezifischen Melanomantigenen gepulste dendritische Zellen (Aarntzen et al., 2008). Wahrscheinlich können in der Zukunft auf diesem Gebiet neue therapeutische Angriffspunkte für das MCC entwickelt werden. Aufgrund der Erkenntnisse bezüglich des MCV könnten zukünftig auch virale Antigene als Ziele molekularer Medikamente in Frage kommen. 56 Durch diese Arbeit wurde ein Beitrag zum Verständnis grundlegender Prozesse im MCC geleistet und damit eine Erweiterung des medizinischen Wissensstandes ermöglicht. Darüber hinaus können aus dieser Studie wichtige Erkenntnisse in Bezug auf Tumorgenese und MCM-vermittelte Zellproliferationsregulation abgeleitet werden. Es wurde gezeigt, dass die MCM-Immunhistochemie ein nützliches Instrument für die Bestimmung der Tumorproliferation in MCC ist. Die weitere Forschung am MCC kann mit einem größeren Patientenkollektiv an diese Ergebnisse anknüpfen, neue Daten zur Verbesserung der Diagnostik sammeln und eventuell zum Verständnis der molekularen Mechanismen der Onkogenese des MCCs beitragen. 57 V. Zusammenfassung Das Merkelzellkarzinom (MCC) ist ein aggressiver Hauttumor und gewinnt in den letzten Jahren wegen seiner steigenden Inzidenz an klinischer Bedeutung. Seine eindeutige Diagnose ist noch immer nicht in allen Fällen gewährleistet und histologische Überschneidungen mit anderen kleinzelligen Hauttumoren sind häufig. Minichromosome Maintenance (MCM)-Proteine sind in anderen Tumoren schon als proliferative Marker beschrieben, fanden jedoch bisher in der Diagnostik von Hauttumoren kaum Beachtung. Die Untersuchung von MCM-Proteinen im MCC war Gegenstand dieser Arbeit und stellt eine wichtige Neuerung in der immunhistochemischen Tumordiagnostik und dar. Es wurden Proben aus läsionaler Haut von acht MCC-Patienten mittels immunhistochemischer Färbungen untersucht. Als Vergleichsgruppe wurden Proben von neun Patienten mit Malignem Melanom (MM) eingeschlossen. Es wurden immunhistochemische Färbungen mit den Markern CK20, Ki-67, p53, p21 und MCM4, MCM6 und MCM7 hergestellt und die Fluoreszenzsignale der beiden Tumorgruppen verglichen. Die mikroskopische Auswertung der fluoreszenzmarkierten Schnittpräparate ergab für das MCC im Vergleich zum MM eine signifikante Erhöhung von MCM4 (66,0 ± 26,5% vs. 33,9 ± 22,4%; P = 0,017), MCM6 (70,9 ± 11,9% vs. 31,7 ± 22,7%; P = 0,0031) und MCM7 (76,5 ± 16,4% vs. 34,9 ± 25,5%; P = 0,0013). Auch die Ki-67-Positivität war im MCC gegenüber dem MM deutlich erhöht (28,7 ± 7,9% vs. 11,0 ± 9,2%; P = 0,0012). Die Rate positiver Zellen in der Färbung mit p53 und p21 war im Vergleich zu gesunder Haut relativ hoch, jedoch bestand kein signifikanter Unterschied zwischen MCC und MM. Die Arbeit zeigt, dass die immunhistochemische MCM-Färbung als Proliferationsmarker im MCC angewandt werden kann. Die Markierung von MCM4, MCM6 und MCM7 könnte eine Abgrenzung des klinisch unspezifischen MCCs gegenüber dem MM ermöglichen. Des Weiteren erbringt sie Vorteile gegenüber der gängigen Ki-67-Färbung, da die MCM-Färbung die Gesamtheit der teilungsfähigen Zellen darstellt und somit eine genauere Beurteilung der Proliferationsfraktion ermöglicht. Hierdurch kann über die Form und Intensität der Therapie beim einzelnen Patienten genauer entschieden werden. Die Evaluation der Expression von MCMProteinen im MCC stellt eine Erweiterung der differentialdiagnostischen Verfahren dar und ermöglicht neue Einblicke in zelluläre Abläufe um MCM-Proteine. 58 VI. Literaturverzeichnis Aarntzen, E.H., Figdor, C.G., Adema, G.J., Punt, C.J., de Vries, I.J. (2008). Dendritic cell vaccination and immune monitoring. Cancer Immunol Immunother. 57 (10), 155968 Alexandrow, M.G., Ritzi, M., Pemov, A., Hamlin, J.L. (2002). A potential role for minichromosome maintenance (MCM) proteins in initiation at the dihydrofolate reductase replication origin. J Biol Chem. 277 (4), 2702-8 Arata, Y., Fujita, M., Ohtani, K., Kijima, S., Kato, J.Y. (2000). Cdk2-dependent and independent pathways in E2F-mediated S phase induction. J Biol Chem. 275 (9), 633745 AWMF Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Gesellschaften. (2007). Kurzleitlinie der Deutschen Dermatologischen Gesellschaft (DDG) und der Deutschen Krebsgesellschaft, AWMF-Leitlinien-Register Nr. 032/023, Kutanes Neuroendokrines Karzinom (Merkelzellkarzinom). Bagnasco, G., Properzi, R., Porto, R., Nardini, V., Poli, A., Abramo, F. (2003). Feline cutaneous neuroendocrine carcinoma (Merkel cell tumour): clinical and pathological findings. Vet Dermatol. 14 (2), 111-5 Beer, T.W. (2009). Merkel cell carcinomas with CK20 negative and CK7 positive immunostaining. J Cutan Pathol. 36 (3), 385-6 Benjamin, C.L., Melnikova, V.O., Ananthaswamy, H.N. (2008). P53 protein and pathogenesis of melanoma and nonmelanoma skin cancer. Adv Exp Med Biol. 624, 265-82 Berger, R.P., Dulani, T., Adelson, P.D., Leventhal, J.M., Richichi, R., Kochanek, P.M. (2006). Identification of inflicted traumatic brain injury in well-appearing infants using serum and cerebrospinal markers: a possible screening tool. Pediatrics. 117 (2), 325-32 59 Bichakjian, C.K., Lowe, L., Lao, C.D., Sandler, H.M., Bradford, C.R., Johnson, T.M., Wong, S.L. (2007). Merkel cell carcinoma: critical review with guidelines for multidisciplinary management. Cancer. 110 (1), 1-12 Bickle, K., Glass, L.F., Messina, J.L., Fenske, N.A., Siegrist, K. (2004). Merkel cell carcinoma: a clinical, histopathologic, and immunohistochemical review. Semin Cutan Med Surg. 23 (1), 46-53 Bobos, M., Hytiroglou, P., Kostopoulos, I., Karkavelas, G., Papadimitriou, C.S. (2006). Immunohistochemical distinction between merkel cell carcinoma and small cell carcinoma of the lung. Am J Dermatopathol. 28 (2), 99-104 Boyd, A.S., Shakhtour, B., Shyr, Y. (2008). Minichromosome maintenance protein expression in benign nevi, dysplastic nevi, melanoma, and cutaneous melanoma metastases. J Am Acad Dermatol. 58 (5), 750-4 Breslow, A. (1970). Thickness, cross-sectional areas and depth of invasion in the prognosis of cutaneous melanoma. Ann Surg. 172 (5), 902-8 Brown, D.C., Gatter, K.C. (2002). Ki67 protein: the immaculate deception? Histopathology. 40 (1), 2-11 Buell, J.F., Trofe, J., Hanaway, M.J., Beebe, T.M., Gross, T.G., Alloway, R.R., First, M.R., Woodle, E.S. (2002). Immunosuppression and Merkel cell cancer. Transplant Proc. 34 (5), 1780-1 Calder, K.B., Coplowitz, S., Schlauder, S., Morgan, M.B. (2007). A case series and immunophenotypic analysis of CK20-/CK7+ primary neuroendocrine carcinoma of the skin. J Cutan Pathol. 34 (12), 918-23 Calhoun, M.E., Jucker, M., Martin, L.J., Thinakaran, G., Price, D.L., Mouton, P.R. (1996). Comparative evaluation of synaptophysin-based methods for quantification of synapses. J Neurocytol. 25 (12), 821-8 60 Camisa, C., Weissmann, A. (1982). Friedrich Sigmund Merkel. Part II. The cell. Am J Dermatopathol. 4 (6), 527-35 Dancey, A.L., Rayatt, S.S., Soon, C., Ilchshyn, A., Brown, I., Srivastava, S. (2006). Merkel cell carcinoma: a report of 34 cases and literature review. J Plast Reconstr Aesthet Surg. 59 (12), 1294-9 Drijkoningen, M., de Wolf-Peeters, C., van Limbergen, E., Desmet, V. (1986). Merkel cell tumor of the skin: an immunohistochemical study. Hum Pathol. 17 (3), 301-7 Elgui de Oliveira, D. (2007). DNA viruses in human cancer: an integrated overview on fundamental mechanisms of viral carcinogenesis. Cancer Lett. 247 (2), 182-96 Enattah, N.S., Sahi, T., Savilahti, E., Terwilliger, J.D., Peltonen, L., Järvelä, I. (2002). Identification of a variant associated with adult-type hypolactasia. Nat Genet. 30 (2), 233-7 Endl, E., Kausch, I., Baack, M., Knippers, R., Gerdes, J., Scholzen, T. (2001). The expression of Ki-67, MCM3, and p27 defines distinct subsets of proliferating, resting, and differentiated cells. J Pathol. 195 (4), 457-62 Engels, E.A., Frisch, M., Goedert, J.J., Biggar, R.J., Miller, R.W. (2002). Merkel cell carcinoma and HIV infection. Lancet. 359 (9305), 497-8 Epstein, M.A., Barr, Y.M., Achong, B.G. (1964). A second virus-carrying tissue culture strain (EB2) of lymphoblasts from Burkitt´s lymphoma. Pathol Biol (Paris). 12, 1233-4 Feinmesser, M., Halpern, M., Fenig, E., Tsabari, C., Hodak, E., Sulkes, J., Brenner, B., Okon, E. (1999). Expression of the apoptosis-related oncogenes bcl-2, bax, and p53 in Merkel cell carcinoma: can they predict treatment response and clinical outcome? Hum Pathol. 30 (11), 1367-72 Feng, H., Shuda, M., Chang, Y., Moore, P.S. (2008). Clonal integration of a polyomavirus in human Merkel cell carcinoma. Science. 319 (5866), 1096-100 61 Fernández-Figueras, M.T., Puig, L., Musulén, E., Gilaberte, M., Lerma, E., Serrano, S., Ferrándiz, C., Ariza, A. (2007). Expression profiles associated with aggressive behavior in Merkel cell carcinoma. Mod Pathol. 20 (1), 90-101 Freeman, A., Morris, L.S., Mills, A.D., Stoeber, K., Laskey, R.A., Williams, G.H., Coleman, N. (1999). Minichromosome maintenance proteins as biological markers of dysplasia and malignancy. Clin Cancer Res. 5 (8), 2121-32 Fritsch, P. (2008). Haut. in Böcker, W., Denk, H., Heitz, P.U., Moch, H. (Hrsg). Pathologie. Urban & Fischer Verlag München Fujioka, S., Shomori, K., Nishihara, K., Yamaga, K., Nosaka, K., Araki, K., Haruki, T., Taniguchi, Y., Nakamura, H., Ito, H. (2009). Expression of minichromosome maintenance 7 (MCM7) in small lung adenocarcinomas (pT1): Prognostic implication. Lung Cancer. 65 (2), 223-9 Gambichler, T., Bischoff, S., Bechara, F.G., Altmeyer, P., Kreuter, A. (2008). Expression of proliferation markers and cell cycle regulators in T cell lymphoproliferative skin disorders.J Dermatol Sci. 49 (2), 125-32 Gambichler, T., Shtern, M., Rotterdam, S., Bechara, F.G., Stücker, M., Altmeyer, P., Kreuter, A. (2009). Minichromosome maintenance proteins are useful adjuncts to differentiate between benign and malignant melanocytic skin lesions. J Am Acad Dermatol. 60 (5), 808-13 Garbe, C., Leiter, U., Ellwanger, U., Blaheta, H.J., Meier, F., Rassner, G., Schittek, B. (2003). Diagnostic value and prognostic significance of protein S-100beta, melanomainhibitory activity, and tyrosinase/MART-1 reverse transcription-polymerase chain reaction in the follow-up of high-risk melanoma patients. Cancer. 97(7), 1737-45 Gartel, A.L., Radhakrishnan, S.K. (2005). Lost in transcription: p21 repression, mechanisms, and consequences. Cancer Res. 65 (10), 3980-5 62 Goessling, W., McKee, P.H., Mayer, R.J. (2002). Merkel cell carcinoma. J Clin Oncol. 20 (2), 588-98 Going, J.J., Keith, W.N., Neilson, L., Stoeber, K., Stuart, R.C., Williams, G.H. (2002). Aberrant expression of minichromosome maintenance proteins 2 and 5, and Ki-67 in dysplastic squamous oesophageal epithelium and Barrett's mucosa. Gut. 50 (3), 373-7 Gonzalez, M.A., Tachibana, K.E., Chin, S.F., Callagy, G., Madine, M.A., Vowler, S.L., Pinder, S.E., Laskey, R.A., Coleman, N. (2004). Geminin predicts adverse clinical outcome in breast cancer by reflecting cell-cycle progression. J Pathol. 204 (2), 121-30 Guida, T., Salvatore, G., Faviana, P., Giannini, R., Garcia-Rostan, G., Provitera, L., Basolo, F., Fusco, A., Carlomagno, F., Santoro, M. (2005). Mitogenic effects of the upregulation of minichromosome maintenance proteins in anaplastic thyroid carcinoma. J Clin Endocrinol Metab. 90 (8), 4703-9 Ha, S.A., Shin, S.M., Namkoong, H., Lee, H., Cho, G.W., Hur, S.Y., Kim, T.E., Kim, J.W. (2004). Cancer-associated expression of minichromosome maintenance 3 gene in several human cancers and its involvement in tumorigenesis. Clin Cancer Res. 10 (24), 8386-95 Heitz, P.U., Komminoth, P., Zimmermann, D., Odermatt, B., Probst-Hensch, N., Bopp, M. (2008). Untersuchungsmethoden der Pathologie. in Böcker, W., Denk, H., Heitz, P.U. (Hrsg). Repetitorium Pathologie. Urban & Fischer Verlag München Helfenstein, A., Frahm, S.O., Krams, M., Drescher, W., Parwaresch, R., Hassenpflug, J. (2004). Minichromosome maintenance protein (MCM6) in low-grade chondrosarcoma: distinction from enchondroma and identification of progressive tumors. Am J Clin Pathol. 122 (6), 912-8 63 Hendrickson, M., Madine, M., Dalton, S., Gautier, J. (1996). Phosphorylation of MCM4 by cdc2 protein kinase inhibits the activity of the minichromosome maintenance complex. Proc Natl Acad Sci U S A. 93 (22), 12223-8 Herz, E. (2005). Maligne Tumoren und Paraneoplasien. in Moll, I. (Hrsg.). Dermatologie. Georg Thieme Verlag Stuttgart, 306-49 Hodgson, N.C. (2005). Merkel cell carcinoma: changing incidence trends. J Surg Oncol. 89(1), 1-4 Houben, R., Schrama, D., Becker, J.C. (2009). Molecular pathogenesis of Merkel cell carcinoma. Exp Dermatol. 18 (3), 193-8 Iggo, A. (1977). Cutaneous and subcutaneous sense organs. Br Med Bull. 33 (2), 97-102 Iggo, A., Muir, A. (1969). The Structure and Function of a slowly adapting touch corpuscule in hairy skin. J. Physiol. 200, 763-96 Karimi, S., Mohammadi, F., Khodadad, K., Emami, H., Seyfollahi, L. (2008). High Expression of Minichromosome Maintenance Protein 6 in Classic Hodgkin's Lymphoma Points to a Cell Cycle Arrest in G1 Phase. Arch Iran Med. 11 (5), 532-8 Karkos, P.D., Sastry, A., Hampal, S., Al-Jafari, M. (2010). Spontaneous regression of Merkel cell carcinoma of the nose. Head Neck. 32 (3), 411-4 Kim, E.J., Kim, H.S., Kim, H.O., Jung, C.K., Ko, Y.H., Kim, T.H., Park, Y.M. (2009). Merkel cell carcinoma of the inguinal lymph node with an unknown primary site. J Dermatol. 36 (3), 170-3 Kodani, I., Osaki, M., Shomori, K., Araki, K., Goto, E., Ryoke, K., Ito, H. (2003). Minichromosome maintenance 2 expression is correlated with mode of invasion and prognosis in oral squamous cell carcinomas. J Oral Pathol Med. 32 (8), 468-74 64 Koljonen, V., Jahkola, T., Tukiainen, E., Granroth, G., Haglund, C., Böhling, T. (2005). Tenascin-C in primary Merkel cell carcinoma. J Clin Pathol. 58 (3), 297-300 Koljonen, V., Tukiainen, E., Haglund, C., Böhling, T. (2006). Proliferative activity detected by Ki67 correlates with poor outcome in Merkel cell carcinoma. Histopathology. 49 (5), 551-3 Konno, A., Nagata, M., Nanko, H. (1998). Immunohistochemical diagnosis of a Merkel cell tumor in a dog. Vet Pathol. 35 (6), 538-40 Kurokawa, M., Nabeshima, K., Akiyama, Y., Maeda, S., Nishida, T., Nakayama, F., Amano, M., Ogata, K., Setoyama, M. (2003). CD56: a useful marker for diagnosing Merkel cell carcinoma. J Dermatol Sci. 31 (3), 219-24 Kurzen, H., Kaul, S., Egner, U., Deichmann, M., Hartschuh, W. (2003). Expression of MUC 1 and Ep-CAM in Merkel cell carcinomas: implications for immunotherapy. Arch Dermatol Res. 295 (4), 146-54 Lane, D.P. (1992). Cancer. p53, guardian of the genome. Nature. 358 (6381), 15-6 Lardy, F., Gautier, C., Etesse-Pichon, S., Martin, J.C., Demeaux, H., Geniaux, M., Delaunay, M.M. (1996). Post-radiotherapy cutaneous neuro-endocrine carcinoma. Ann Dermatol Venereol. 123 (8), 464-7 Lee, J.K., Hurwitz, J. (2001). Processive DNA helicase activity of the minichromosome maintenance proteins 4, 6, and 7 complex requires forked DNA structures. Proc Natl Acad Sci U S A. 98 (1), 54-9 Lei, M. (2005). The MCM complex: its role in DNA replication and implications for cancer therapy. Curr Cancer Drug Targets. 5 (5), 365-80 Lens, M., Bataille, V. (2008). Melanoma in relation to reproductive and hormonal factors in women: current review on controversial issues. Cancer Causes Control. 19 (5), 437-42 65 Li, S.S., Xue, W.C., Khoo, U.S., Ngan, H.Y., Chan, K.Y., Tam, I.Y., Chiu, P.M., Ip, P.P., Tam, K.F., Cheung, A.N. (2005). Replicative MCM7 protein as a proliferation marker in endometrial carcinoma: a tissue microarray and clinicopathological analysis. Histopathology. 46 (3), 307-13 Llombart, B., Monteagudo, C., López-Guerrero, J.A., Carda, C., Jorda, E., Sanmartín, O., Almenar, S., Molina, I., Martín, J.M., Llombart-Bosch, A. (2005). Clinicopathological and immunohistochemical analysis of 20 cases of Merkel cell carcinoma in search of prognostic markers. Histopathology. 46 (6), 622-34 Lunder, E.J., Stern, R.S. (1998). Merkel-cell carcinomas in patients treated with methoxsalen and ultraviolet A radiation. N Engl J Med. 339 (17), 1247-8 Majumder, M., Ghosh, A.K., Steele, R., Ray, R., Ray, R.B. (2001). Hepatitis C virus NS5A physically associates with p53 and regulates p21/waf1 gene expression in a p53dependent manner. J Virol. 75 (3), 1401-7 Malinowski, D.P. (2005). Molecular diagnostic assays for cervical neoplasia: emerging markers for the detection of high-grade cervical disease. Biotechniques. Suppl. 17-23 Martín-Caballero, J., Flores, J.M., García-Palencia, P., Serrano, M. (2001). Tumor susceptibility of p21(Waf1/Cip1)-deficient mice. Cancer Res. 61 (16), 6234-8 McMahon, H.T., Bolshakov, V.Y., Janz, R., Hammer, R.E., Siegelbaum, S.A., Südhof, T.C. (1996). Synaptophysin, a major synaptic vesicle protein, is not essential for neurotransmitter release. Proc Natl Acad Sci U S A. 93 (10), 4760-4 McNiff, J.M., Cowper, S.E., Lazova, R., Subtil, A., Glusac, E.J. (2005). CD56 staining in Merkel cell carcinoma and natural killer-cell lymphoma: magic bullet, diagnostic pitfall, or both? J Cutan Pathol. 32 (8), 541-5 66 Medina-Franco, H., Urist, M.M., Fiveash, J., Heslin, M.J., Bland, K.I., Beenken, S.W. (2001). Multimodality treatment of Merkel cell carcinoma: case series and literature review of 1024 cases. Ann Surg Oncol. 8 (3), 204-8 Mehrany, K., Otley, C.C., Weenig, R.H., Phillips, P.K., Roenigk, R.K., Nguyen, T.H. (2002). A meta-analysis of the prognostic significance of sentinel lymph node status in Merkel cell carcinoma. Dermatol Surg. 28 (2), 113-7 Meng, M.V., Grossfeld, G.D., Williams, G.H., Dilworth, S., Stoeber, K., Mulley, T.W., Weinberg, V., Carroll, P.R., Tlsty, T.D. (2001). Minichromosome maintenance protein 2 expression in prostate: characterization and association with outcome after therapy for cancer. Clin Cancer Res. 7 (9), 2712-8 Merkel, F. (1875). Tastzellen and Tastkoerperchen bei den Hausthieren und beim Menschen. Arch Mikr Anat 11, 636–652 Merot, Y. (1990). Is the neuroendocrine carcinoma of the skin a Merkel cell tumor? What we can learn from immunohistochemical and ultrastructural studies. Int J Dermatol. 29 (2), 102-4 Miller, R.W., Rabkin, C.S. (1999). Merkel cell carcinoma and melanoma: etiological similarities and differences. Cancer Epidemiol Biomarkers Prev. 8 (2), 153-8. Erratum in: Cancer Epidemiol Biomarkers Prev 1999; 8 (5), 485 Moll, R., Löwe, A., Laufer, J., Franke, W.W. (1992). Cytokeratin 20 in human carcinomas. A new histodiagnostic marker detected by monoclonal antibodies. Am J Pathol. 140 (2), 427-47 Münger, K., Baldwin, A., Edwards, K.M., Hayakawa, H., Nguyen, C.L., Owens, M., Grace, M., Huh, K. (2004). Mechanisms of human papillomavirus-induced oncogenesis. J Virol. 78 (21), 11451-60 Nickoloff, B.J., Hill, J., Weiss, L.M. (1985). Canine neuroendocrine carcinoma. A tumor resembling histiocytoma. Am J Dermatopathol. 7 (6), 579-86 67 Nigro, J.M., Baker, S.J., Preisinger, A.C., Jessup, J.M., Hostetter, R., Cleary, K., Bigner, S.H., Davidson, N., Baylin, S., Devilee, P., Glover, T., Collins, F.S., Weslon, A., Modali, R., Harris, C.C., Vogelstein, B. (1989). Mutations in the p53 gene occur in diverse human tumour types. Nature. 342 (6250), 705-8 Nishihara, K., Shomori, K., Fujioka, S., Tokuyasu, N., Inaba, A., Osaki, M., Ogawa, T., Ito, H. (2008). Minichromosome maintenance protein 7 in colorectal cancer: implication of prognostic significance. Int J Oncol. 33 (2), 245-51 Nishitani, H., Lygerou, Z. (2002). Control of DNA replication licensing in a cell cycle. Genes Cells. 7 (6), 523-34 Padmanabhan, V., Callas, P., Philips, G., Trainer, T.D., Beatty, B.G. (2004). DNA replication regulation protein Mcm7 as a marker of proliferation in prostate cancer. J Clin Pathol. 57 (10), 1057-62 Pectasides, D., Pectasides, M., Economopoulos, T. (2006). Merkel cell cancer of the skin. Ann Oncol. 17 (10), 1489-95 Pietsch, E.C., Sykes, S.M., McMahon, S.B., Murphy, M.E. (2008). The p53 family and programmed cell death. Oncogene. 27 (50), 6507-21 Prasanth, S.G., Méndez, J., Prasanth, K.V., Stillman, B. (2004). Dynamics of prereplication complex proteins during the cell division cycle. Philos Trans R Soc Lond B Biol Sci. 359 (1441), 7-16 Quinn, C.M., Wright, N.A. (1990). The clinical assessment of proliferation and growth in human tumours: evaluation of methods and applications as prognostic variables. J Pathol. 160 (2), 93-102 Ramnath, N., Hernandez, F.J., Tan, D.F., Huberman, J.A., Natarajan, N., Beck, A.F., Hyland, A., Todorov, I.T., Brooks, J.S., Bepler, G. (2001). MCM2 is an independent 68 predictor of survival in patients with non-small-cell lung cancer. J Clin Oncol. 19 (22), 4259-66 Richetta, A.G., Mancini, M., Torroni, A., Lorè, B., Iannetti, G., Sardella, B., Calvieri, S. (2008). Total spontaneous regression of advanced merkel cell carcinoma after biopsy: review and a new case. Dermatol Surg. 34 (6), 815-22 Rockley, P.F., Trieff, N., Wagner, R.F. Jr., Tyring, S.K. (1994). Nonsunlight risk factors for malignant melanoma. Part I: Chemical agents, physical conditions, and occupation. Int J Dermatol. 33 (6), 398-406 Rockley, P.F., Trieff, N., Wagner, R.F. Jr., Tyring, S.K. (1994). Nonsunlight risk factors for malignant melanoma. Part II: Immunity, genetics, and workplace prevention. Int J Dermatol. 33 (7), 462-7 Schrader, C., Janssen, D., Klapper, W., Siebmann, J.U., Meusers, P., Brittinger, G., Kneba, M., Tiemann, M., Parwaresch, R. (2005). Minichromosome maintenance protein 6, a proliferation marker superior to Ki-67 and independent predictor of survival in patients with mantle cell lymphoma. Br J Cancer. 93 (8), 939-45 Schwab, B.L., Leist, M., Knippers, R., Nicotera, P. (1998). Selective proteolysis of the nuclear replication factor MCM3 in apoptosis. Exp Cell Res. 238 (2), 415-21 Shiohara, M., Koike, K., Komiyama, A., Koeffler, H.P. (1997). p21WAF1 mutations and human malignancies. Leuk Lymphoma. 26(1-2), 35-41 Shuda, M., Feng, H., Kwun, H.J., Rosen, S.T., Gjoerup, O., Moore, P.S., Chang, Y. (2008). T antigen mutations are a human tumor-specific signature for Merkel cell polyomavirus. Proc Natl Acad Sci U S A. 105 (42), 16272-7. Snyder, M., Huang, X.Y., Zhang, J.J. (2009). The Minichromosome Maintenance Proteins 2-7 (MCM2-7) Are Necessary for RNA Polymerase II (Pol II)-mediated Transcription. J Biol Chem. 284 (20), 13466-72 69 Stolte, M. (1992). Helicobacter pylori gastritis and gastric MALT-lymphoma. Lancet. 339 (8795), 745-6 Su, L.D., Lowe, L., Bradford, C.R., Yahanda, A.I., Johnson, T.M., Sondak, V.K. (2002). Immunostaining for cytokeratin 20 improves detection of micrometastatic Merkel cell carcinoma in sentinel lymph nodes. J Am Acad Dermatol. 46 (5), 661-6 Tachibana, K.E., Gonzalez, M.A., Coleman, N. (2005). Cell-cycle-dependent regulation of DNA replication and its relevance to cancer pathology. J Pathol. 205 (2), 123-9 Todorov, I.T., Werness, B.A., Wang, H.Q., Buddharaju, L.N., Todorova, P.D., Slocum, H.K., Brooks, J.S., Huberman, J.A. (1998). HsMCM2/BM28: a novel proliferation marker for human tumors and normal tissues. Lab Invest. 78 (1), 73-8 Toker, C., (1972). Trabecular carcinoma of the skin. Arch Dermatol. 105 (1), 107-10 Tolstov, Y.L., Pastrana, D.V., Feng, H., Becker, J.C., Jenkins, F.J., Moschos, S., Chang, Y., Buck, C.B., Moore, P.S. (2009). Human Merkel cell polyomavirus infection II. MCV is a common human infection that can be detected by conformational capsid epitope immunoassays. Int J Cancer. 125 (6), 1250-6 Tucci, M.G., Lucarini, G., Giangiacomi, M., Zizzi, A., Criante, P., Ricotti, G., Biagini, G. (2006). Immunohistochemical study of apoptosis markers and involvement of chemokine CXCR4 in skin Merkel cell carcinoma. J Eur Acad Dermatol Venereol. 20 (10), 1220-5 Tucker, M.A. (2009). Melanoma epidemiology. Hematol Oncol Clin North Am. 23 (3), 383-95 Vlad, R., Woodlock, T.J. (2003). Merkel cell carcinoma after chronic lymphocytic leukemia: case report and literature review. Am J Clin Oncol. 26 (6), 531-4 Watt, A.J., Kotsis, S.V., Chung, K.C. (2004). Risk of melanoma arising in large congenital melanocytic nevi: a systematic review. Plast Reconstr Surg. 113 (7), 1968-74 70 Weiler, R., Fischer-Colbrie, R., Schmid, K.W., Feichtinger, H., Bussolati, G., Grimelius, L., Krisch, K., Kerl, H., O'Connor, D., Winkler, H. (1988). Immunological studies on the occurrence and properties of chromogranin A and B and secretogranin II in endocrine tumors. Am J Surg Pathol. 12 (11), 877-84 Wharton, S.B., Chan, K.K., Anderson, J.R., Stoeber, K., Williams, G.H. (2001). Replicative Mcm2 protein as a novel proliferation marker in oligodendrogliomas and its relationship to Ki67 labelling index, histological grade and prognosis. Neuropathol Appl Neurobiol. 27 (4), 305-13 Winnepenninckx, V., Lazar, V., Michiels, S., Dessen, P., Stas, M., Alonso, S.R., Avril, M.F., Ortiz Romero, P.L., Robert, T., Balacescu, O., Eggermont, A.M., Lenoir, G., Sarasin, A., Tursz, T., van den Oord, J.J., Spatz, A. Melanoma Group of the European Organization for Research and Treatment of Cancer. (2006). Gene expression profiling of primary cutaneous melanoma and clinical outcome. J Natl Cancer Inst. 98 (7), 47282 Yiengpruksawan, A., Coit, D.G., Thaler, H.T., Urmacher, C., Knapper, W.K. (1991). Merkel cell carcinoma. Prognosis and management. Arch Surg. 126 (12), 1514-9 Danksagung Ich möchte mich ganz herzlich bedanken bei meinem Doktorvater Priv.-Doz. Dr. Thilo Gambichler für die exzellente Betreuung und die konstruktive fachliche Unterstützung während der verschiedenen Phasen meiner Arbeit. Ebenso möchte ich meinen Dank an Jun.-Prof. Dr. Alexander Kreuter aussprechen für die vielen praktischen Tipps und die Hilfe bei der Anfertigung der histologischen Bilder. Ein besonderer Dank geht weiterhin an Dr. Nick Othlinghaus, der mir mit seinen Ratschlägen und wertvollen Anregungen auf dem gesamten Weg des praktischen Teils meiner Arbeit zur Seite stand sowie die histologische Durchsicht der Präparate übernommen hat. Des Weiteren bedanke ich mich bei Prof. Dr. Markus Stücker für die histologische Betreuung. Auch möchte ich mich ganz herzlich bei Sabine Richter und Frau Pantz für die professionelle Einweisung in die histologische Aufarbeitung sowie die Ermöglichung der Arbeit in den Räumlichkeiten der Histologie des St. Josef Hospitals bedanken. Meinen persönlichen Dank möchte ich abschließend Concha Höfler, meinem Freund Roland Bücker und meiner Familie aussprechen. Sie haben mich während dieser Zeit begleitet sowie auf wunderbare Weise motiviert und unterstützt. Lebenslauf Persönliche Daten Name Annika Breininger Geburtsdatum und -ort 25.09.1981, Zweibrücken Familienstand ledig Staatsangehörigkeit deutsch Schulausbildung 08/1988-06/2001 Rudolf Steiner-Schule Schloss Hamborn 06/2001 Abitur Akademische Ausbildung 10/2002-12/2008 Studium der Medizin an der Ruhr-Universität Bochum 10/ 2004-06/2005 Studium der Medizin an der Université Louis Pasteur, Straßburg, Frankreich 12/2008 Staatsexamen, Approbation Famulaturen 07/2005 Innere Medizin, St. Josefs-Krankenhaus Salzkotten 12/2005 Blockpraktikum HNO im Hospital Clinic Barcelona, Spanien 03/2006 Allgemeinmedizinische Praxis Dr. von Campenhausen, Dortmund 08/2006 Gemeinschaftspraxis Ardeystraße nephrologischer Schwerpunkt), Witten 03/2007 Dermatologie, St. Josef-Hospital Bochum (onkologischer und Praktisches Jahr 08-12/2007 Dermatologie, St. Josef-Hospital Bochum 12/2007-04/2008 Innere Medizin, Schwerpunkte Gastroenterologie und Onkologie, St. Josef-Hospital Bochum 04-07/2008 Chirurgie, St. Josef-Hospital Bochum Dissertation 05/2007-08/2009 Thema: Immunhistochemische Merkelzellkarzinom Betreuer: Priv.-Doz. Dr. Thilo Gambichler Untersuchungen am Publikation 05/2009 Gambichler, T., Breininger, A., Rotterdam, S., Altmeyer, P., Stücker, M., Kreuter, A. (2009). Expression of minichromosome maintenance proteins in Merkel cell carcinoma. J Eur Acad Dermatol Venereol. 23(10), 1184-8. Sonstige praktische Tätikeiten 03-08/2007 Pflegetätigkeit im St. Josef-Hospital Bochum 01-06/2005 Nachtwachen in Krankenhäusern der Université Louis Pasteur, Straßburg 03-11/2006 Leitung von Kursen in Erster Hilfe 10/2003-03/2004 Studentische Hilfskraft am Institut für Anatomie, Bochum 08/2002-02/2003 Sechsmonatiges Pflegepraktikum in der Klinik Öschelbronn Auslandsaufenthalte 01-03/1997 Dreimonatiger Sprachaustausch in Stourbridge, England 07/1999 Vierwöchiger Sprachaustausch in Le Mans, Frankreich 04-07/2003 Viermonatiger Aufenthalt in Santa Cruz, Bolivien 03/2004 Zweiwöchige Mitarbeit im internationalen Arbeitscamp der Nimm-Meine-Hand-Stiftung in Pécs, Ungarn 12/2006 Blockpraktikum HNO im Hospital Clinic Barcelona, Spanien 10/ 2004-06/2005 Studium der Medizin an der Université Louis Pasteur, Straßburg, Frankreich Berufliche Tätigkeit Seit 07/2009 Innere Medizin, St. Hedwig-Krankenhaus Berlin