Bericht über eine Transfusionsreaktion
Werbung

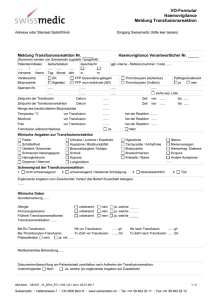
Bericht über eine Transfusionsreaktion Stempel des Einsenders: Bitte einsenden an Blutspendedienst des BRK gGmbH Zertifiziert nach DIN EN ISO 9001 Institut für Transfusionsmedizin Nürnberg Heimerichstr. 57 90419 Nürnberg Tel.: 0911 37 45 – 5401 Fax: 0800-1222999 Empfänger: Blutgruppe: ♀ Geschlecht: Geburtsdatum: ♂ Frühere Transfusionen: ja nein Wieviele: Wann zuletzt: bekannte irreguläre Ak: ja nein Wenn ja, welche Ak: Schwangerschaften: ja nein Transfusionsreaktionen bekannt: Allergien bekannt: ja nein Wenn ja, wogegen: ja nein Klinische Diagnose/Grunderkrankung: Medikamente: Transfundierte Blutkomponenten: Erythrozytenkonzentrate Thrombozytenkonzentrate Plasma Präparat Nr. Präparat Nr. Präparat Nr. Präparat Nr. Beginn der Transfusion Datum/Uhrzeit UAW- Beginn Datum/Uhrzeit Anderes Hämoglobin vor der Transfusion g/dl Temperatur °C RR Hämoglobin nach der Transfusion g/dl Temperatur °C RR ml Transfusion unter Transfundierte Blutmenge Kreuzprobe durchgeführt ja nein Kreuzprobenergebnis Narkose ja nein verträglich ja nein Welche anderen Infusionen/Injektionen oder therapeutische Maßnahmen wurden gleichzeitig durchgeführt : Befunde des Empfängers: Unwohlsein Schweißausbruch Schüttelfrost Temperaturanstieg > 1°C > 2°C Schwindelgefühl Übelkeit Erbrechen Kopfschmerzen Muskel-/Flankenschmerzen Urticaria/Hautjucken Dyspnoe Bronchospasmus Lungenödem Tachycardie/Arrhythmie Hypotonie – RR Abfall Syst. < 30 mm Hg > 30 mm Hg Kollaps / Schock Hämoglobinurie/Anurie Ikterus Purpura / Blutungen pulmonale Infiltrate (Rö-Diagn.) Klin. Verdachtsdiagnosen: hämolytische Reaktion febrile Reaktion allergische Reaktion bakterielle Reaktion transfusionsbedingte Dyspnoe Hypervolämie (TACO) TRALI Bewertung der Reaktion: leicht mittel schwer Labor (Veränderungen in Zusammenhang mit der Transfusionsreaktion): Station und Telefonnummer Datum Unterschrift von Ärztin/Arzt Name bitte zusätzlich in Blockschrift Für Untersuchungen zur Abklärung einer Transfusionsreaktion benötigen wir 20 ml Nativblut und ca. 10 ml EDTA-Blut des Empfängers (beschriftet mit Name, Vorname, Geburtsdatum und Abnahmedatum) und das Restmaterial der Blutpräparate (steril) mit Transfusionsbesteck. Nach einer Reaktion mit einem Erythrozytenpräparat benötigen wir außerdem eine Blutprobe des Empfängers aus der Zeit vor der Transfusion (Kreuzprobenblut, gekennz. als Blut vor der Transfusion, mit Abnahmedatum). Laboruntersuchungen werden gemäß den Ziffern GOÄ oder EBM abgerechnet. Stand Mai 2014/V1/TZF Therapeutisches Vorgehen: Venösen Zugang belassen und offen halten, symptomatische bzw. kausale Therapie einleiten und symptombezogen überwachen. Dokumentation der therapeutischen Maßnahmen und des klinischen Verlaufes in der Patientenakte. Asservierung von Probenmaterial zur Abklärung des Zwischenfalles (incl. verschlosssener Konservenbeutel), ggf. Blutkulturen bei dringendem Verdacht auf bakterielle Kontamination. Bei Verdacht auf TRALI (Transfusionsassoziierte akute Lungeninsuffizienz) Rö- Thorax Bei schweren oder tödlichen Reaktionen im zeitlichen Zusammenhang mit Bluttransfusionen ist eine besonders genaue und ausführliche Dokumentation erforderlich. Abklärung von Nebenwirkungen bzw. unerwünschten Ereignissen: an das Blutbanklabor unverzüglich zu schicken sind: Meldebogen, ausgefüllt Restblut vor Transfusion ( Kreuzblut ), gekennzeichnet mit „Blut vor Transfusion“ 20ml Nativblut nach Transfusion, gekennzeichnet ( bei Kindern entsprechend angepasst ) 10ml EDTA- Blut nach Transfusion, gekennzeichnet ( bei Kindern entsprechend angepasst ) Konservenbeutel incl. Transfusionsbesteck ( verschlossen, in geeignetem Transportbehältnis ) Begriffsdefinitionen: Unerwünschtes Ereignis nach § 16 Transfusionsgesetz (TFG) Alle unerwarteten Komplikationen nach der Anwendung von Blutprodukten bzw. gentechnisch hergestellten Plasmaproteinen zur Behandlung von Hämostasestörungen, auch wenn der Zusammenhang mit der Transfusion nicht unmittelbar erkennbar ist. Nebenwirkung bzw. Verdacht einer Nebenwirkung / unerwünschten Reaktion nach § 4 Arzneimittelgesetz (AMG): Nebenwirkung sind bei Arzneimitteln, die zur Anwendung bei Menschen bestimmt sind, schädliche und unbeabsichtigte Reaktionen auf das Arzneimittel. Schädliche und unbeabsichtigte Reaktionen, die evident andere – innere oder äußere – Ursachen als die Gabe eines bestimmten Medikamentes haben, erfüllen nicht die Definition einer Nebenwirkung dieses Arzneimittels (nach 5. Bekanntmachung zur Anzeigepflicht nach § 63b Abs. 1 bis 8 AMG). Schwerwiegende Nebenwirkung/schwerwiegende unerwünschte Reaktion: Die Nebenwirkung/Reaktion ist tödlich oder lebensbedrohend (z.B. anaphylaktische Reaktion), führt zu einer Arbeitsunfähigkeit oder einer Behinderung, hat stationäre Behandlung oder eine Verlängerung einer stationären Behandlung zur Folge. Unterrichtungspflichten bei unerwünschten Ereignissen nach § 16 TFG: Unverzügliche Information der transfusionsbeauftragten und der transfusionsverantwortichen Person (oder deren Vertreter) durch den transfundierenden Arzt. Zusätzlich ist bei Verdacht einer Nebenwirkung/unerwünschten Reaktion der Blutspendedienst bzw. der pharmazeutische Unternehmer zu unterrichten. Bei schwerwiegender Nebenwirkung/schwerwiegender unerwünschter Reaktion oder Verdacht darauf ist außerdem das Paul- Ehrlich- Institut als oberste Bundesbehörde zu informieren. Auf die Meldepflicht an die Arzneimittelkommission der deutschen Ärzteschaft gemäß ärztlicher Berufsordnung, sowie ggf. zusätzliche Meldepflichten gemäß Infektionsschutzgesetz und Laborberichtsverordnung wird hingewiesen. Paul- Ehrlich- Institut Paul- Ehrlich- Str. 51 – 59 63225 Langen http://www.pei.de AkdÄ Aachener Str. 233 – 237 50931 Köln http://www.akdae.de Robert- Koch- Institut (RKI) Nordufer 20 13353 Berlin http://www.rki.de Bei Verdacht auf eine Infektionsübertragung ist eine separate Meldung erforderlich. Stand Mai 2014/V1/TZF