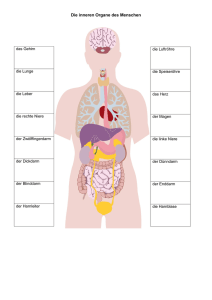
GEHIRN UND BLASE
Werbung

Diplomarbeit GEHIRN UND BLASE Der Einfluss neurogener Pharmaka auf das urologische System eingereicht von Elisa Moser zur Erlangung des akademischen Grades Doktorin der gesamten Heilkunde (Dr. med. univ.) an der Medizinischen Universität Graz ausgeführt am Institut für Klinische und Experimentelle Pharmakologie unter der Anleitung von Univ.-Prof.i.R. Mag. pharm. Dr. Eckhard Beubler und Univ.-Prof. Dr. med.univ. Josef Donnerer Graz, am 21.10.2016 Eidesstattliche Erklärung Ich erkläre ehrenwörtlich, dass ich die vorliegende Arbeit selbstständig und ohne fremde Hilfe verfasst habe, andere als die angegebenen Quellen nicht verwendet habe und die den benutzten Quellen wörtlich oder inhaltlich entnommenen Stellen als solche kenntlich gemacht habe. Graz, am 21.10.2016 Elisa Moser eh I II Danksagungen An erster Stelle möchte ich mich bei meinem Diplomarbeitsbetreuer Univ.-Prof.i.R. Mag. pharm. Dr. Eckhard Beubler bedanken. Er half mir während des Verfassens der Arbeit stets mit seinem Wissen weiter und unterstützte mich fachkundig. Mein größter Dank gilt meinen Eltern, die mir nicht nur das Studium ermöglichten, sondern mir auch immer Mut zusprechen und mich bestärken. Danke, dass ihr immer an mich glaubt. Auch möchte ich mich recht herzlich bei meinen Großeltern bedanken, ohne ihre Unterstützung wäre meine Studienzeit sicher nicht so erlebnisreich geworden. Weiters bedanke ich mich bei meiner Schwester Andrea. Unsere gemeinsame Zeit in Graz zählt zu der schönsten meiner Studienzeit. Danke, dass du auch in schwierigen Zeiten immer zu mir hältst. Meine Studienzeit ist durch meine Freunde unvergesslich geworden. Besonders danken möchte ich an dieser Stelle Stefanie und Anna, die mit mir jeden Weg beschreiten und eine große Bereicherung für mich sind. Herzlichen Dank! III Zusammenfassung Das Gehirn und die Harnblase sind zwei Organe, die nicht zwangsläufig miteinander in Verbindung gebracht werden, obwohl eine Vielzahl an neurologischen Erkrankungen Blasenentleerungsstörungen verursachen. Diese werden von den erkrankten Personen oft als äußerst belastend wahrgenommen, daher sollten sie auch in der Therapie einen hohen Stellenwert einnehmen. Krankheitsbilder wie Harninkontinenz und Harnverhalt erzeugen bei den betroffenen Personen einen enormen Leidensdruck, der in Folge oft der Grund dafür ist, dass sie sich aus der Gesellschaft zurückziehen. Aufgrund der sympathischen und parasympathischen Innervation der Harnblase und den dort vorhandenen Rezeptoren können diese Krankheitsbilder auch durch neurogene Pharmaka ausgelöst werden. Das pharmakologische Spektrum reicht von Psychopharmaka wie Antidepressiva, Neuroleptika und Sedativa über Antiepileptika, Narkotika und Parkinsonmittel bis hin zu Acetylcholinesterasehemmer als Antidementiva. In der folgenden Diplomarbeit wird dargestellt, welche neurogenen Pharmaka urologische Komplikationen mitverursachen können. Außerdem werden auch medikamentöse Therapieansätze, mit denen urologische Probleme gelöst werden können, aufgezeigt. Dazu wird im Rahmen einer umfassenden Literaturrecherche in verschiedenen Lehr- und Fachbüchern, medizinischen Datenbanken und Leitlinien sowie medizinischen Journalen und Internetquellen recherchiert und die Erkenntnisse werden in dieser Arbeit zusammengefasst dargestellt. IV Abstract The brain and the bladder are two organs that are not necessarily linked to one another, although this relationship is responsible for a large number of voiding disorders. Since these disorders are considered extremely burdensome by the patients concerned they should form a significant part of the therapy. Disorders like aconuresis and urinary retention lead to an enormous level of suffering in these patients, consequently being the main reason for their withdrawal from society and public life. These disorders can also be triggered by neurogenic drugs due to the sympathetic and parasympathetic innervation of the urinary bladder and the receptors present there. The pharmacological spectrum ranges from psychotropic drugs like antidepressants, neuroleptic drugs, sedatives to antiepileptics, narcotics and Parkinson inhibitors, all the way to acetylcholinesterase inhibitors as antidementives. The aim of this thesis is to show which neurogentic drugs can cause urological complications. Furthermore, medicinal therapeutic approaches solving urological problems are presented. The results and findings of an extensive literature research in different text- and reference books, medical database and medical journals and internet sources are collectively outlined. V Inhaltsverzeichnis Danksagungen ...................................................................................................... III Zusammenfassung ................................................................................................ IV Abstract .................................................................................................................. V Inhaltsverzeichnis .................................................................................................. VI Glossar und Abkürzungen ..................................................................................... IX Abbildungsverzeichnis ........................................................................................... XI Tabellenverzeichnis .............................................................................................. XII 1 Einleitung ...................................................................................................... 13 1.1 Anatomie der Harnblase.......................................................................... 13 1.1.1 Wandbau der Harnblase ................................................................... 13 1.1.2 Gefäßsystem und Innervation der Harnblase ................................... 15 1.1.3 Befestigung der Harnblase ............................................................... 15 1.2 Physiologie der Harnblase ...................................................................... 16 1.2.1 Füllung der Harnblase ...................................................................... 16 1.2.2 Entleerung der Harnblase ................................................................. 16 1.2.3 Kontinenzmechanismus .................................................................... 17 1.2.3.1 weiblicher Kontinenzmechanismus ............................................... 17 1.2.3.2 männlicher Kontinenzmechanismus .............................................. 18 2 Harninkontinenz ............................................................................................ 19 2.1 Risikofaktoren ......................................................................................... 19 2.2 Klassifikation ........................................................................................... 19 2.2.1 Belastungsinkontinenz ...................................................................... 19 2.2.2 Dranginkontinenz .............................................................................. 21 2.2.3 Überlaufinkontinenz .......................................................................... 24 2.3 Diagnostik ............................................................................................... 25 2.3.1 2.4 3 Urodynamik ...................................................................................... 25 Therapie .................................................................................................. 26 Neurogene Blasenentleerungsstörung .......................................................... 27 3.1 Ätiologie .................................................................................................. 27 3.1.1 Kortikale Läsionen ............................................................................ 28 3.1.2 Basalganglienläsionen ...................................................................... 29 3.1.2.1 Morbus Parkinson ......................................................................... 29 3.1.2.2 Multisystematrophie....................................................................... 30 VI 3.1.3 Hirnstammläsionen ........................................................................... 30 3.1.4 Rückenmarksläsionen ...................................................................... 31 3.1.5 Rückenmarksverletzungen ............................................................... 31 3.1.6 Multiple Sklerose .............................................................................. 32 3.1.7 Conus und Cauda Equina Läsionen ................................................. 33 3.1.8 Störung der peripheren Innervation .................................................. 34 3.1.8.1 Diabetische Neuropathie ............................................................... 34 3.1.8.2 Amyloidpolyneuropathie ................................................................ 34 3.1.9 4 3.2 Diagnostik ............................................................................................... 35 3.3 Therapie .................................................................................................. 35 Harnverhalt.................................................................................................... 38 4.1 Ursachen ................................................................................................. 38 4.2 Symptome ............................................................................................... 38 4.2.1 Akuter Harnverhalt ............................................................................ 38 4.2.2 Chronischer Harnverhalt ................................................................... 38 4.2.3 Harnverhalt bei jungen Frauen ......................................................... 39 4.3 5 Myotonische Dystrophie ................................................................... 35 Therapie .................................................................................................. 39 Neurogene Pharmaka ................................................................................... 40 5.1 Antidementiva ......................................................................................... 40 5.1.1 Acetylcholinesterasehemmer ............................................................ 40 5.1.2 NMDA – Rezeptorantagonisten ........................................................ 41 5.1.3 Nootropika ........................................................................................ 41 5.2 Antidepressiva ......................................................................................... 42 5.3 Antikonvulsiva ......................................................................................... 44 5.3.1 Carbamazepin .................................................................................. 45 5.3.2 Valproat ............................................................................................ 45 5.3.3 Phenytoin .......................................................................................... 46 5.3.4 Lamotrigin ......................................................................................... 46 5.3.5 Vigabatrin ......................................................................................... 46 5.3.6 Gabapentin ....................................................................................... 47 5.3.7 Ethosuximid ...................................................................................... 47 5.4 Anxiolytika ............................................................................................... 47 5.5 Narkotika ................................................................................................. 49 VII 5.6 Neuroleptika ............................................................................................ 50 5.7 Parkinsonmittel ........................................................................................ 53 5.7.1 Levodopa .......................................................................................... 53 5.7.2 Dopaminagonisten ............................................................................ 53 5.7.3 COMT - Inhibitoren ........................................................................... 54 5.7.4 Amantadin ........................................................................................ 54 5.7.5 Monoaminoxidase-B-Hemmer .......................................................... 55 5.7.6 zentral wirksame Anticholinergika..................................................... 55 6 Diskussion ..................................................................................................... 56 7 Literaturverzeichnis ....................................................................................... 58 VIII Glossar und Abkürzungen ml Milliliter mm Millimeter bzw. beziehungsweise A. Arterie V. Vene Nll. Nodi lymphari N. Nervus Nn. Nervi ZNS Zentralnervensystem Lig. Ligamentum α Alpha β Beta LUTS Lower Urinary Tract Symptoms ICS International Continence Society SSNRI selektive Serotonin Noradrenalin Reuptake Inhibitor EMG Elektromyogramm s Sekunde MS Multiple Sklerose MR Magnetresonanztomographie z.B. zum Beispiel ca. circa MSA Multisystematrophie l Liter NMDA N-Methyl-D-Aspartat SSRI selective Serotonin Reuptake Inhibitor MAO Monoaminoxidase H1 Rezeptor Histamin-H1-Rezeptor EKG Elektrokardiogramm Na+ Natrium GABA Gamma-Aminobutyric Acid Ca2+ Calcium N2O Distickstoffmonoxid, Lachgas iv. intravenös IX D2 Rezeptor Dopamin-Rezeptor % Prozent COMT Catechol-O-Methyltransferase L-Dopa Levodopa et al. et altera X Abbildungsverzeichnis Abbildung 1 Wandbau der Harnblase ................................................................... 14 Abbildung 2 Physiologie der Harnblase ................................................................ 17 Abbildung 3 Urodynamik ...................................................................................... 26 Abbildung 4 Actionable Bladder Symptom Screening Tool .................................. 33 XI Tabellenverzeichnis Tabelle 1 Risikofaktoren für Harninkontinenz ....................................................... 19 Tabelle 2 Einteilung nach Stamey für die Belastungsinkontinenz bei Frauen ...... 20 Tabelle 3 Einteilung nach Stamey für die Belastungsinkontinenz bei Männern ... 21 Tabelle 4 Substanzen zur Behandlung der Drangsymptomatik ............................ 22 Tabelle 5 Nebenwirkungen und Kontraindikationen der Therapie mit Muskarinrezeptorantagonisten ............................................................................. 23 Tabelle 6 ICS – Klassifikation der neurogenen Blasenentleerungsstörung .......... 28 Tabelle 7 Pharmakologische Beeinflussbarkeit des unteren Harntraktes ............. 37 Tabelle 8 Übersicht der Wirkung von Medikamenten auf den Harntrakt .............. 40 Tabelle 9 Benzodiazepine: Wichtigste pharmakologische Wirkung und therapeutische Anwendung .................................................................................. 48 Tabelle 10 Mögliche Auswirkungen von atypischen Neuroleptika auf die Harnblase ............................................................................................................................. 51 XII 1 Einleitung 1.1 Anatomie der Harnblase Die Harnblase ist ein muskulöses Hohlorgan, das die Funktion hat, den Harn zu sammeln und über die Harnröhre auszuscheiden. (1) Je nach Füllzustand verändern sich die Form, die Lagebeziehung und auch die Größe der Harnblase. (2) Das Volumen einer physiologisch gefüllten Harnblase beträgt ca. 150 bis 300 ml. Das Organ wird in Blasenscheitel (Apex vesicae), Blasenkörper (Corpus vesicae), Blasengrund (Fundus vesicae) und Blasenhals (Collum vesicae) eingeteilt. (1) 1.1.1 Wandbau der Harnblase Die Wand der Harnblase ist je nach Füllzustand unterschiedlich dick, überschreitet aber kaum 3 mm. Sie ist dreischichtig aufgebaut (2): Tunica mucosa, Schleimhaut Tunica muscularis, Muskelwand Tunica serosa, äußere Wandschicht Bei der Harnblase wird die Tunica mucosa als Urothel bezeichnet, sie kleidet als Übergangsepithel die Harnblase aus. Dieses mehrschichtige Epithel besteht aus einer Basalschicht, einer Intermediärschicht, die aus mehreren Zelllagen besteht, und einer Oberflächenschicht, die aus Deckzellen gebildet wird. (3) Im entleerten Zustand legt sich die Schleimhaut in Falten, diese verstreichen durch die Füllung. Die Verbindung von Tunica mucosa und Tunica muscularis wird durch eine lockere Tela submucosa hergestellt, außer im Trigonum vesicae, da ist die Schleimhaut fest mit der Muskelschicht verwachsen. (1) Die Tunica muscularis ist - außer im Trigonum vesicae - dreischichtig angeordnet (2): Stratum longitudinale externum, äußere Längsschicht Stratum circulare, zirkuläre Schicht Stratum longitudinale internum, innere Längsschicht 13 Die Schichten bestehen aus glatter Muskulatur und sind untereinander mit einzelnen Muskelfasern vernetzt, sie bilden als Ganzes den Musculus detrusor vesicae. Die Muskelzüge der äußeren Längsschicht bilden den Musculus vesicoprostaticus bzw. den Musculus vesicovaginalis und den Musculus pubovesicalis bzw. den Musculus puboprostaticus. Diese Muskeln sind für die Bildung des funktionellen Sphinktersystems der Harnblase verantwortlich. (2) Die Ausnahme ist das Trigonum vesicae, da sich hier die Dreischichtung verliert und sich elliptische Faserbündel der inneren Längsschicht um die Ureterostien und die Urethramündung schließen. Zirkuläre Muskelzüge bilden durch die Umlagerung der blasennahen Urethra den funktionellen Sphinkter, Musculus sphinkter urethrae internus, aus. (2) Die äußerste Schicht der Harnblase ist die Tunica serosa, sie umschließt als Peritoneum parietale oben und hinten das Organ. (2) Die untere und vordere Fläche wird von einer Tunica adventitia überzogen. (1) Dadurch ist die Harnblase gegenüber ihren Nachbarorganen gut verschiebbar. (2) Abbildung 1 Wandbau der Harnblase, übernommen aus (4) 14 1.1.2 Gefäßsystem und Innervation der Harnblase Die arterielle Versorgung der Harnblase wird hauptsächlich über die A. vesicalis superior und A. vesicalis inferior gewährleistet. Erstere geht aus dem durchgängigen Teil der A. umbilicalis hervor und versorgt den oberen Abschnitt. Zweitere entspringt aus der A. iliaca interna und versorgt den Blasengrund und den Blasenhals. Weiters wird die Harnblase von kleineren Ästen der A. obturatoria, der A. rectalis media, der A. pudenda interna und bei der Frau auch der A. uterina arteriell versorgt. (1) (2) Der venöse Abfluss findet über den Plexus venosus vesicalis statt, der in die V. iliaca interna mündet. Der submuköse Plexus bildet einen starken Polster, der an der Abdichtung der Harnblase beteiligt ist. (1) Der Lymphabfluss ist über die Nll. paravesicalis gewährleistet, diese gewinnen Anschluss an die iliakalen Lymphknoten und schlussendlich am Truncus lumbalis. (2) Die sympathischen Fasern, Nn. splanchnici lumbales, N. hypogastricus, Nn. splanchnici sacrales, aus dem Segment Th11-12 und die parasympathischen Fasern, Nn. splanchnici pelvici, Radix parasympathica, aus S2-4 innervieren die Harnblase über den Plexus vesicalis. (1) Der Sympathikus erregt die Muskulatur des Blasendreiecks und des Blasenhalses und ist somit für den Blasenverschluss und die Kontinenz mitverantwortlich. Die Aktivierung des Parasympathikus hat die Kontraktion des Musculus detrusor vesicae zur Folge und somit die Entleerung der Harnblase. (2) Die Blasenwandspannung und auch der Organschmerz werden über viszeroafferente Fasern an das ZNS übermittelt, diese laufen mit den Nn. splanchnici pelvici. (2) 1.1.3 Befestigung der Harnblase Der Halteapparat der Harnblase geht vom Fundus vesicae aus, damit ist die Ausdehnungsfähigkeit des Organs gegeben. Aufgrund der unterschiedlichen 15 Anteile von Bindegewebe und glatten Muskelfasern werden die Haltevorrichtungen sowohl als Bänder als auch als Muskeln bezeichnet (1): Ligamentum pubovesicale/ puboprostaticum: Das Band zieht mit den gleichnamigen eingelagerten Muskeln von der Symphyse zum Blasenhals. (2) Musculus rectovesicalis (Lig. rectovesicalis): Die Rektumsmuskulatur fixiert die Blase an der Vorderfläche des Kreuzbeins. (1) Musculus vesicoprostaticus (Lig. vesicoprostaticus): Der Muskel fixiert die Harnblase beim Mann an der Prostata. (2) Musculus vesicovaginalis: Der Muskel fixiert den Blasengrund mit der Scheide. (1) 1.2 Physiologie der Harnblase Die Aufgabe der Harnblase ist, den kontinuierlich von den Nieren gebildeten Harn zu sammeln. Dieser gelangt durch die Harnleiter zur Harnblase, wo bei jeder Volumszunahme der Druck ansteigt, aber durch die Detrusorrelaxation nach wenigen Sekunden wieder auf einen tonischen Dauerwert abfällt. (5) 1.2.1 Füllung der Harnblase Durch die stetige Füllung der Harnblase, zuerst in Quer- und danach in Längsrichtung, kommt es durch die Wanddehnung über die viszerosensiblen Fasern zum Harndrang. (2) Während der Füllungsphase hemmt der Sympathikus den Detrusor und kontrahiert die glatten Schließmuskeln. Aufgrund der sympathischen Wirkung kann geistige Ablenkung das Gefühl des Harndranges hinausschieben. (1) 1.2.2 Entleerung der Harnblase Die Entleerung der Harnblase wird Miktion genannt. Es kommt ab einer gewissen Füllung zum steilen Druckanstieg, der in weiterer Folge den Parasympathikus aktiviert. Dadurch erfolgt die Kontraktion des Detrusors und der innere Schließmuskel wird durch den Druckanstieg mechanisch geöffnet. (5) Durch die 16 parasympathische Wirkung kommt es bei Aufregung zum gesteigerten Harndrang. Generell kann der Harndrang auch durch akustische Reize und Hautreize gesteigert werden. (1) Abbildung 2 Physiologie der Harnblase, übernommen aus (6) 1.2.3 Kontinenzmechanismus Der Kontinenzmechanismus der Harnblase erfolgt durch die tonische Kontraktion der glatten Muskulatur des Musculus sphinkter internus und der Kontraktion des quergestreiften Musculus sphinkter externus. Die quergestreifte Muskulatur hat Slow-twitch- und Fast-twitch-Fasern, die Slow-twitch-Fasern gewährleisten die Kontinenz durch einen Dauertonus, die Fast-twitch-Fasern stellen diese bei plötzlicher abdomineller Druckerhöhung sicher. (5) 1.2.3.1 weiblicher Kontinenzmechanismus Der innere Sphinkter wird durch die glatte Detrusormuskulatur gebildet, die in die Längsmuskelschicht der Urethra einstrahlt. Quergestreifte Anteile der Beckenbodenmuskulatur und zirkuläre Fasern quergestreifter Muskulatur setzen sich als der äußere Sphinkter zusammen, dieser wird willkürlich kontrahiert. In der 17 intramuralen Muskulatur der Urethra befinden sich sogenannte Slow-twitchFasern, die eine kontinuierliche Kontraktion über einen längeren Zeitraum aufrechterhalten können. Die α1-Rezeptoren stärken den inneren Sphinkter, während die β2-Rezeptoren die Kontraktion des Musculus detrusor vesicae verhindern. (7) 1.2.3.2 männlicher Kontinenzmechanismus Der gesamte glattmuskuläre Anteil vom Blasenhals bis zum Ende der membranösen Harnröhre wird beim Mann als unwillkürlicher Kontinenzmechanismus bezeichnet. Dieser Bereich wird α-adrenerg innerviert. Der willkürliche Kontinenzmechanismus setzt sich aus dem äußeren Sphinkter, der am Apex prostatae beginnt, und der intramuralen quergestreiften Muskulatur mit Slowtwitch- und Fast-twitch-Fasern zusammen. Dieser Teil wird über den N. pudendus innerviert. (7) 18 2 Harninkontinenz Definiert wird die Harninkontinenz als Unfähigkeit, Urin zu speichern und diesen willkürlich abzugeben. Der Leidensdruck unter den Betroffenen ist sehr hoch, was dazu führt, dass sich diese aus diesem Grund oft aus der Gesellschaft zurückziehen. Frauen sind doppelt so oft betroffen wie Männer. (7) Im Jahr 2002 hat die International Continence Society Harninkontinenz als Krankheit definiert und die Terminologie der Funktion des unteren Harntrakts standardisiert. (8) (9) 2.1 Risikofaktoren Risikofaktoren für Harninkontinenz Frau Mann Alter Alter Schwangerschaften LUTS Geburten Funktionelle und kognitive Störungen Menopause Neurologische Erkrankungen Hysterektomie Prostatektomie Adipositas LUTS Funktionelle und kognitive Störungen Berufliche Risiken Positive Familienanamnese Tabelle 1 übernommen aus (10) 2.2 Klassifikation Harninkontinenz ist ein Sammelbegriff für folgende Krankheitsbilder: 2.2.1 Belastungsinkontinenz Bei der Belastungsinkontinenz, früher auch als Stressharninkontinenz bezeichnet, kommt es durch einen intraabdominellen Druckanstieg wie Husten, Niesen, 19 Lachen oder Heben zum unkontrollierten Urinverlust. Hauptsächlich dafür verantwortlich sind bei Frauen eine Beckenbodenschwäche, neuromotorische Läsionen, eine verkürzte Harnröhre oder operative Verletzungen. Beim Mann hingegen kann eine Beckenfraktur oder eine radikale Prostatektomie zur Belastungsinkontinenz führen. (7) Die häufigste Form der Harninkontinenz bei Frauen ist die Belastungsinkontinenz, diese kommt in allen Kulturen der Welt vor. Durchschnittlich beginnt die Belastungsinkontinenz bei Frauen mit ca. 47 Jahren. Aufgrund der notwendigen Flexibilität des weiblichen Beckens für Schwangerschaft und Geburt sind Frauen gefährdeter, an Harninkontinenz zu erkranken, als Männer. Die Pathophysiologie der Belastungsinkontinenz ist durch einen über dem Sphinkterverschlussdruck liegenden intravesikalen Druck erklärbar, meistens leiden diese Patientinnen auch unter einem insuffizienten Verschlussmechanismus, welcher als Sphinkterinkompetenz bezeichnet wird. (11) Bei der Belastungsinkontinenz bei Frauen kommt es zum ungewollten Urinabgang bei körperlicher Belastung, ohne dass ein Harndrang verspürt wird. Die klinische Einteilung des Schweregrads erfolgt nach Stamey. (11) Einteilung nach Stamey für die Belastungsinkontinenz bei Frauen Grad 1 Urinverlust beim Husten, Pressen, Niesen, schwerem Heben Grad 2 Urinverlust beim Gehen, Bewegen, Aufstehen Grad3 Urinverlust in Ruhe ohne Belastung Tabelle 2 übernommen aus (11) Die Pharmakotherapie bei Belastungsinkontinenz spielt nur eine untergeordnete Rolle, da nur wenige Präparate zum erwünschten Behandlungserfolg führen. Eine Möglichkeit zur medikamentösen Behandlung ist Duloxetin, ein Wirkstoff aus der Gruppe der selektiven Serotonin-Noradrenalin-Wiederaufnahme-Inhibitoren (SSNRI). Dieser wird primär zur Behandlung der Depression eingesetzt, aber durch die Steigerung der Motoneuronaktivität kommt es zur Anhebung des Beckenboden- und Sphinktertonus. Dadurch ergibt sich auch eine Verbesserung der Kontinenz. (11) 20 Als weitere Maßnahme der pharmakologischen Therapie bei Belastungsinkontinenz werden Östrogene lokal appliziert, um einen epithelialen Abdichtungseffekt im Bereich des glattmuskulären Sphinkters zu erreichen. In Kombination dazu werden Alphamimetika verabreicht. Diese erhöhen den Tonus des Sphinkters. (11) Die Belastungsinkontinenz beim Mann ist in den meisten Fällen durch eine radikale Prostatektomie bedingt. Andere Ursachen können Beckentraumata mit Verletzungen des Sphinktermechanismus oder neurogene Erkrankungen sein. Die klinische Einteilung des Schweregrads der Belastungsinkontinenz erfolgt wie bei der Frau durch Stamey. (11) Einteilung nach Stamey für die Belastungsinkontinenz bei Männern Grad 1 milde Belastungsinkontinenz, Urinverlust bei starker Belastung wie schweres Heben, Sport Grad 2 mäßige Belastungsinkontinenz, Urinverlust schon bei leichter Belastung wie Gehen Grad 3 schwere Belastungsinkontinenz, Urinverlust im Liegen Tabelle 3 übernommen aus (11) Zurzeit gibt es keine zugelassene Pharmakotherapie für die Belastungsinkontinenz bei Männern. (11) In den letzten Jahren wurden einige Studien durchgeführt, um die Wirksamkeit von Duloxetin auch bei Männern zu erforschen. Dieser Wirkstoff hat durchaus auch eine gute Effektivität bei Männern und wird vor allem in Kombination mit Beckenbodentraining eingesetzt. (11) (12) (13) (14) 2.2.2 Dranginkontinenz Die Dranginkontinenz ist durch einen starken und plötzlichen Harndrang mit unkontrolliertem Urinabgang gekennzeichnet. Es wird zwischen der motorischen Ursache mit Detrusorüberaktivität und der sensorischen Ursache mit erhöhter Blasensensibilität unterschieden. Im Falle einer sensorischen Ursache sollte besonders auf die psychosomatische Komponente geachtet werden. (7) 21 Patientinnen/Patienten mit Dranginkontinenz leiden unter Pollakisurie, erhöhter Miktionsfrequenz, imperativem Harndrang und Nykturie. Differentialdiagnostisch sollte eine unspezifische Harnwegsinfektion, eine chronische Zystitis, Tuberkulose und Bilharziose, ein Fremdkörper, Prostataerkrankungen, ein Östrogenmangel, obstruktive Blasenentleerungsstörungen, neurogene Erkrankungen, psychogene Vorgänge, degenerative oder entzündliche Neuropathie, Tumore und urethrale Veränderungen ausgeschlossen werden. (11) Die Pharmakotherapie bei Dranginkontinenz ist ein wichtiger Bestandteil der Behandlung. Bei der medikamentösen Therapie der Dranginkontinenz sind die Muskarinrezeptorantagonisten Mittel erster Wahl, weil sie sehr gut den imperativen Harndrang als Leitsymptom lindern. Die kompetitive Hemmung von Acetylcholin an postganglionären parasympathischen Muskarinrezeptoren (muskarinerg) und an parasympathischen und sympathischen Ganglien und sympathischen Rezeptoren (nikotinerg) werden von Muskarinrezeptorantagonisten bewirkt. (11) Substanzen zur Behandlung der Drangsymptomatik Substanz Wirkstoffgruppe Kommentar Oxybutynin M2/3-Anticholinergikum tertiäres Amin, retardierte Form hat weniger Nebenwirkungen Trospium M2/3-Anticholinergikum quarternäres Amin, keine ZNS Nebenwirkungen Propiverin M2/3-Anticholinergikum tertiäres Amin Tolterodin M2/3-Anticholinergikum tertiäres Amin, partielle Uroselektivität Solifenacin M3-Anticholinergikum subtypenselektives Präparat Darifenacin M3-Anticholinergikum subtypenselektives Präparat Fesoterodin M2/3-Anticholinergikum Tolterodin-Metabolit (Prodrug) Tabelle 4 übernommen aus (11) 22 Nebenwirkungen und Kontraindikationen der Therapie mit Muskarinrezeptorantagonisten (aus Jocham D, Miller K. Praxis der Urologie Bd. 2. 3. Aufl. Stuttgart: Thieme 2007) Organ Nebenwirkung Kontraindikation Augen Akkommodationsstörungen, Engwinkelglaukom Mydriasis, Augeninnendruckerhöhung Gastrointestinaltrakt Mundtrockenheit, gastrointestinale Obstipation, Übelkeit Obstipation, Megakolon, Achalasie, Colitis ulcerosa Kardiovaskulärsystem Tachykardie Tachyarrhythmie, Herzinsuffizienz, Lungenödem ZNS Unruhe, Verwirrtheit Zerebralsklerose, Myasthenia gravis Urogenitaltrakt Blasenentleerungsstörungen intravesikale Obstruktion, Detrusorhypokontraktilität, Restharnbildung Tabelle 5 übernommen aus (11) Die lokale Östrogenapplikation ist mittlerweile ein fester Bestandteil der Dranginkontinenztherapie bei Frauen, weil sie eine subjektive Heilungs- und Verbesserungsrate von 57% erzielt. (11) Eine weitere medikamentöse Möglichkeit zur Behandlung der Dranginkontinenz stellen die β3-Adrenozeptor-Agonisten, wie z.B. Mirabegron und Solabegron, dar. Diese Rezeptoren kommen auch in der Harnblase vor und entspannen die Blasenwandmuskulatur und erhöhen die Blasenkapazität. Außerdem haben sie weniger Nebenwirkungen auf das kardiovaskuläre System. Als wichtigste Nebenwirkungen zählen Übelkeit, Kopfschmerz, Bluthochdruck, Durchfall, Verstopfung, Schwindel und Tachykardie. (11) Eine Studie konnte zeigen, dass die Kombinationstherapie aus Mirabegron und Solifenacin die objektiven als auch die subjektiven Symptome verbessert. (15) 23 Die intravesikale Gabe von Botulinum-A-Toxin zählt durch das Infiltrieren der Blasenwand zu den minimalinvasiven Therapiemöglichkeiten. Dadurch wird die Freisetzung von Acetylcholin und anderer Neurotransmitter an den präsynaptischen Nervenendigungen blockiert. Die Wirkdauer dieser Behandlung beträgt ca. 9 Monate und ist somit wiederholungspflichtig. (11) Die intravesikale Gabe von Vanilloidrezeptoragonisten, wie Capsaicin und Resiniferatoxin, wird hauptsächlich bei der therapierefraktären sensorischen Dranginkontinenz angewendet. (11) 2.2.3 Überlaufinkontinenz Die Kombination aus überdehnter Blase, hoher Restharnmenge und fehlender Detrusoraktivität bei unwillkürlichem Urinverlust führt zur Überlaufinkontinenz. Die Ursachen liegen bei subvesikalen Obstruktionen oder bei sakralen Läsionen. (7) Mechanische Obstruktionen wie das benigne Prostatasyndrom, Blasensteine, Blasenhalsverengung, maligne Tumore der Blase, Prostata oder Harnröhre, tumorbedingte Kompression von außen, Harnröhrenenge, Meatusenge, ausgeprägte Phimose oder Harnröhrenklappen können zur Überlaufinkontinenz führen. Aber auch funktionelle Obstruktionen wie die Detrusor-BlasenhalsDyskoordination, Detrusor-Sphinkter-Dyssynergie, Detrusor-Sphinkter- Dyskoordination sind Ursachen für die Überlaufinkontinenz. (11) Ein weiterer Grund, warum es zur Überlaufinkontinenz kommen kann, ist die Detrusorakontraktilität. Hier kann keine Detrusorkontraktion ausgelöst werden, und die Miktion erfolgt nur durch den Einsatz der Bauchpresse. Durch die Detrusorhypokontraktilität kann es zur unvollständigen Blasenentleerung kommen, da die Kontraktion des Detrusors während der Miktion unzureichend stark oder lang ist. (11) Klinisch zeigen sich irritative Beschwerden wie eine erhöhte Miktionsfrequenz, Nykturie, imperativer Harndrang und Restharngefühl. Patientinnen/Patienten, die unter Überlaufinkontinenz leiden, berichten auch von obstruktiven Beschwerden wie einem verzögerten Miktionsbeginn, einem abgeschwächten Harnstrahl, einer verlängerten Miktion, von Bauchpresseneinsatz, Nachträufeln und einer zweizeitigen Miktion. (11) 24 2.3 Diagnostik An erster Stelle steht eine ausführliche Anamnese. Hierbei ist es wichtig, nach Voroperationen, Schwangerschaften, Geburtsverlauf, Sexualfunktion, neurologischen Erkrankungen, Medikamenten (besonders mit sympathischer oder parasympathischer Wirkung) oder Diabetes mellitus zu fragen. (7) Dieser allgemeinen Anamnese sollte eine symptomorientierte folgen. Fragen nach der Frequenz der Inkontinenz, den bemerkten Mengen beim Urinverlust, dem Einfluss auf das tägliche Leben und den Symptomen im Zusammenhang mit einem Organprolaps sind unumgänglich. Darauf folgt eine genaue körperliche Untersuchung. Diese sollte eine abdominelle, perineale, rektale und vaginale Abklärung beinhalten, außerdem sollte das äußere Genitale untersucht und ein Hustenprovokationstest durchgeführt werden. Weiters ist eine Urinanalyse zum Ausschluss eines Harnwegsinfektes obligat. Die Patientin/der Patient sollte ein Miktions- und Trinkprotokoll führen und die Restharnmenge durch eine Sonographie bestimmt werden. (10) Weiterführend sollte eine Inkontinenzabklärung mittels Urodynamik, Miktionszystourethrographie und Endoskopie angestrebt werden. (7) 2.3.1 Urodynamik Die Urodynamik ist eine Untersuchungsmethode zur Feststellung von Funktionsstörungen des unteren Harntraktes. Die Ziele der Urodynamik sind die Erhebung der Detrusorfunktion, der Sphinkterfunktion, der Koordination von Detrusor und Sphinkter, der Obstruktion bei Miktion und die Bestimmung der Restharnmenge. (10) Zu den urodynamischen Untersuchungsmethoden zählen die Uroflowmetrie, das Flow-EMG und die Zystometrie. (10) Die Uroflowmetrie ist ein einfaches und nichtinvasives Untersuchungsverfahren, sie dient zur Bestimmung der Harnflussrate als Volumen pro Zeiteinheit (ml/s). Das Flow-EMG erlaubt die gleichzeitige Messung von Harnflusskurve und Beckenbodenaktivität aufgrund von Klebeelektroden. Bei der Zystometrie wird die Messung von Speicher- und Entleerungsphase der Harnblase angestrebt. (10) 25 Abbildung 3 Urodynamik, übernommen aus (16) 2.4 Therapie Die Therapie der Harninkontinenz ist stark abhängig von ihrer Form und Ausprägung. Generell ist die konservative Therapie der invasiven und operativen Therapie vorzuziehen. (17) Konservative Therapiekonzepte reichen von Lifestyleveränderungen wie Reduzieren des Körpergewichtes, Vermeidung schwerer körperlicher Arbeit, weniger Flüssigkeitsaufnahme, gezieltes Beckenbodentraining, externe temporäre Elektrostimulation oder einer Magnetstimulation und Biofeedback bis hin zur Pessarbehandlung. (17) Bei der medikamentösen Therapie werden neben Hormontherapien vor allem αund β-Adrenergika, trizyklische Antidepressiva und Serotoninwiederaufnahmehemmer eingesetzt. Auch können Hilfsmittel wie Slipeinlagen, Vorlagen und Kondomurinal verwendet werden. (10) Bei den operativen Therapien werden bei der Belastungsinkontinenz vaginale und abdominelle oder kombinierte Verfahren zur Rekonstruktion eingesetzt, spannungsfreie Bandplastiken und beim Mann der artifizielle Sphinkter praktiziert. Bei der Dranginkontinenz sind die Obstruktionsbeseitigung, die Neuromodulation und die Blasenaugmentation obligat. (7) 26 3 Neurogene Blasenentleerungsstörung Beim Krankheitsbild der neurogenen Blasenentleerungsstörung kommt es durch eine zentrale oder periphere Läsion des Nervensystems zur unvollständigen Blasenentleerung. (7) 3.1 Ätiologie Die Ursachen für eine neurogene Blasenentleerungsstörung können der Lokalisation der Läsion zugeordnet werden: (17) zentral: zerebrovaskuläre Erkrankung, Apoplex, Multiple Sklerose, Morbus Parkinson, Hirntumore; spinal: Querschnittlähmung, Multiple Sklerose, Spinalkanalstenose, Ischämie; peripher: Neuropathie, Multiple Sklerose, Traumata; iatrogen: Beckenchirurgie, Wirbelsäulenchirurgie ICS – Klassifikation der neurogenen Blasenentleerungsstörung Blasenfunktion Speicherphase Miktionsphase Detrusoraktivität normal / stabil normal hyperaktiv / instabil hypoaktiv hyperreflexiv akontraktil Blasensensitivität erhöht / hypersensitiv reduziert / hyposensitiv fehlend Blasenkapazität normal / stabil hoch niedrig Compliance normal / stabil hoch niedrig 27 Urethrale Funktion normal normal inkompetent obstruktiv / hyperaktiv / mechanisch Tabelle 6 übernommen aus (7) 3.1.1 Kortikale Läsionen Die vorderen Regionen des Frontallappens sind wichtige Stellen für die Kontrolle der Harnblase. Dieses Wissen ist seit ca. 1960 bekannt. Somit zeigen sich bei Patientinnen/Patienten, die die Kontrolle über die Harnblase verloren haben, verschiedenste Frontalhirnschäden wie z.B. intrakranielle Tumore, Aneurysmenblutungen und penetrierende Gehirnverletzungen. Patientinnen/Patienten mit solchen Läsionen zeigen das typische klinische Bild mit starkem Harndrang, hoher Miktionsfrequenz und Dranginkontinenz, jedoch ohne eine Form der Demenz. Den Patientinnen/den Patienten ist ihre Inkontinenz durchaus bewusst, sie ziehen sich in der Folge oft immer mehr aus dem sozialen Leben zurück. (18) Bei Patientinnen/Patienten mit Frontallappenschädigung kann es aber auch zum Harnverhalt kommen. In einigen Fallberichten wird von Patientinnen/Patienten mit Läsionen im rechten Frontallappen berichtet, die unter Harnverhalt leiden. Nach erfolgreicher Behandlung der Läsion im Hirn berichten die Betroffenen vom Verschwinden der Probleme mit der Harnblase. (19) Harninkontinenz zeigt sich auch bei Patientinnen/Patienten nach einem Schlaganfall. Es kann zwar keine Korrelation zwischen einer bestimmten Lokalisation der Läsion und den urodynamischen Befunden aufgezeigt werden, aber am häufigsten zeigen Patientinnen/Patienten eine erhöhte Detrusoraktivität. Wird eine Patientin/ein Patient 7 Tage nach einem Schlaganfall inkontinent, so wirkt sich das meistens negativ auf die Prognose aus. (18) Patientinnen/Patienten mit einem hämorrhagischen Schlaganfall leiden eher unter einer verminderten Detrusoraktivität, im Gegensatz dazu neigen Patientinnen/Patienten mit einem ischämischen Schlaganfall eher zu erhöhter Detrusoraktivität. (20) 28 Small vessel disease in der weißen Substanz wird assoziiert mit Dranginkontinenz und es wird immer klarer, dass diese Erkrankung ein wichtiger Grund für die Inkontinenz bei der älteren Bevölkerung ist. (21) (18) Die Inkontinenz bei Demenz hat wahrscheinlich multifaktorielle Ursachen. In einer Studie konnte gezeigt werden, dass Inkontinenz bei Morbus Alzheimer in einem späteren Stadium auftritt, bei der Lewy-Körperchen-Demenz tritt die Inkontinenz in früheren Stadien auf. (22) 3.1.2 Basalganglienläsionen 3.1.2.1 Morbus Parkinson Die Symptome der Blasenfunktionsstörung bei Patientinnen/Patienten mit Morbus Parkinson korrelieren mit der neurologischen Beeinträchtigung und dem Krankheitsfortschritt. (18) (23) Diese zwei Faktoren bestätigen einen Zusammenhang zwischen der dopaminergen Degeneration und den Symptomen der Blasenfunktionsstörung. Bei der zurzeit gängigen Einteilung von Morbus Parkinson kommen durch die bei dieser Krankheit vorliegende Neuropathologie die Blasenfunktionsstörungen erst Jahre nach dem Auftreten der motorischen Symptome vor. (24) Die Blasenfunktionsstörungen bei Morbus Parkinson korrelieren mit dem Ausmaß der dopaminergen Erschöpfung. (18) 38 bis 71% der Parkinson-Patientinnen/Patienten leiden an Blasenfunktionsstörungen. (18) (25) (26) Speicherprobleme sind eines der häufigsten Symptome bei mehr als 60% aller Parkinson-Patientinnen/Patienten und diese sind die Ursache des zunehmenden Verlusts der Lebensqualität. (23) (27) (28) Nykturie ist dabei das häufigste Symptom, gefolgt von Dranginkontinenz. Es wird angenommen, dass der neuronale Verlust in der Substantia nigra den normalen Effekt der Basalganglien am Miktionsreflex enthemmt, was zu einer Detrusorüberaktivität führt. Eine Studie zeigt, dass eine dopaminerge RezeptorStimulation am D1-Rezeptor vor einer Enthemmung des Miktionsreflexes schützen kann, diese Behandlung bringt nur schlechte Ergebnisse bei Patientinnen/Patienten mit Morbus Parkinson. (18) (29) Die Reizblase ist einer der Hauptgründe für urologische Symptome bei Morbus Parkinson. Viele Patientinnen/Patienten mit Morbus Parkinson leiden an 29 nächtlicher Polyurie, sie produzieren sehr viel Urin in der Nacht, was wiederum zur Nykturie führt. Der Verlust von circadianen Rhythmen könnte eine Ursache dafür sein. (18) Andere Faktoren, die bei Patientinnen/Patienten mit Morbus Parkinson zu Blasenfunktionsstörungen führen, sind angiologische Erkrankungen, zervikale Spondylose, Myelopathien, Diabetes mellitus, Herzinsuffizienz, Ödeme und der Gebrauch von Diuretika. Schlafstörungen und Störungen der circadianen Rhythmen werden eng mit Nykturie verbunden. (18) (30) (31) (32) Wie eine Studie bestätigt, trägt das Schlafapnoesyndrom zur Nykturie bei. (33) Das Behandlungsmanagement für Patientinnen/Patienten mit Morbus Parkinson und Blasenfunktionsstörungen muss deshalb individuell auf die Begleiterkrankungen und deren Symptome abgestimmt werden. (18) 3.1.2.2 Multisystematrophie An eine MSA sollte gedacht werden, sobald die Symptome der Blasenfunktionsstörung überhand nehmen und parkinsonoide Symptome das Zustandsbild prägen. 41% der MSA-Patientinnen/Patienten zeigen Blasenfunktionsstörungen am Beginn ihrer Krankheit und 97% aller MSA-Patientinnen/Patienten entwickeln eine Blasenfunktionsstörung im Laufe ihrer Erkrankung. (18) (34) (35) (36) Die Blasenbeteiligung bei MSA ist sehr viel früher zunehmend beeinträchtigend als bei Morbus Parkinson. Die Symptome der Reizblase kommen aber bei beiden Krankheitsbildern vor. (18) 3.1.3 Hirnstammläsionen Wie in einer Studie gezeigt werden konnte, ist die Blasenentleerungsstörung ein markantes Symptom für eine Hirnstammläsion. (18) (19) Durch weitere Analysen konnte herausgefunden werden, dass sich das Zentrum für die Blasenkontrolle im dorsalen Bereich Patientinnen/Patienten des mit Hirnstamms Schlaganfällen befindet. im Dazu Hirnstamm wurden und 39 Miktions- beschwerden untersucht. (18) (37) 30 3.1.4 Rückenmarksläsionen Rückenmarksläsionen sind die häufigste Ursache für eine neurogene Blasenfunktionsstörung. Über das Rückenmark ist das Miktionszentrum in der Pons mit den sakralen Nerven verbunden. Eine intakte Verbindung ist notwendig, um die Detrusor- und Sphinkteraktivität aufrecht zu erhalten und zwischen Speicher- und Entleerungsphase zu wechseln. (18) Nach einer akuten Rückenmarksläsion tritt normalerweise eine neuronale Schockphase ein, diese dauert unterschiedlich lang und ist klinisch durch absoluten Harnverhalt gekennzeichnet. Urodynamisch zeigt sich ein kontraktiler Detrusor. Nach einiger Zeit bilden sich aber neue Reflexe, die das Entleeren der Blase wieder möglich machen, auch der Detrusor kontrahiert schon wieder bei bereits kleinen Füllungsvolumina. (18) Die Blasenfunktionsstörung bei einer Rückenmarksläsion ist durch ein geringes Füllungsvolumen und eine Reizblase gekennzeichnet. Die Patientinnen/Patienten leiden unter häufigem Harnlassen und am starken Harndrang. Im Gegensatz dazu haben Patientinnen/Patienten bei einer kompletten Durchtrennung des Rückenmarks keinen starken Harndrang. Wenn die Detrusorüberaktivität sehr massiv ausgeprägt ist, dann ist eine Harninkontinenz auch sehr wahrscheinlich. Schlechte neuronale Innervation während der Blasenentleerung und die DetrusorSphinkter Dyssynergie führen zu einer inkompletten Blasenentleerung. (18) Da die Areale im Rückenmark, die die Blase innervieren weiter kaudal liegen als diejenigen der unteren Extremität, ist es sehr leicht möglich, dass alle Rückenmarksläsionen, die eine Blasenfunktionsstörung aufweisen, auch Lähmungserscheinungen in der unteren Extremität hervorrufen. Eine Ausnahme bildet die Läsion, die im Conus lokalisiert ist. (18) 3.1.5 Rückenmarksverletzungen Nach einer Rückenmarksverletzung können Blasenfunktionsstörungen oft so ausgeprägt sein, dass es zum vesikorenalen Reflux, zur Hydronephrose und eventuell zu Komplikationen im oberen Harntrakt kommen kann. Die Blasenprobleme der Personen mit Rückenmarksverletzungen müssen daher sehr aggressiv therapiert werden, damit Komplikationen im oberen Harntrakt vorgebeugt werden kann und die Patientin/der Patient wieder die Kontrolle über 31 ihre/seine Harnblase erlangt. Dies stellt auch einen erheblichen Beitrag zur Steigerung der Lebensqualität der betroffenen Personen dar. (18) 3.1.6 Multiple Sklerose Die Pathophysiologie der Blasenfunktionsstörungen bei MS ist der Pathophysiologie der Blasenfunktionsstörungen bei Rückenmarksläsionen sehr ähnlich. Die Therapie ist aufgrund der fortschreitenden Beeinträchtigung jedoch eine andere. (18) In Studien konnte Harninkontinenz als gezeigt eine werden, der dass belastenden für Patientinnen/Patienten Folgeerscheinungen der MS wahrgenommen wird. (38) Es gibt eine enge Verbindung zwischen dem Auftreten von Blasenfunktionsstörungen Rückenmarksbeteiligung. und Ähnliche den klinischen Beobachtungen Zeichen gab es der bei Patientinnen/Patienten mit akuter disseminierter Enzephalomyelitis. (18) (39) Aufgrund der multifaktoriellen Symptome der MS werden im klinischen Alltag die Blasenfunktionsstörungen oft übersehen oder nicht ausreichend ernst genommen. Das North American Research Committee On Multiple Sclerosis hat herausgefunden, dass bei 5000 Patientinnen/Patienten mit Blasenfunktionsstörungen bei MS-Erkrankung nur 43% zu einer urologischen Fachuntersuchung geschickt wurden. (18) (40) Um dieses in Zukunft vorzubeugen, wurde das „Actionable Bladder Symptom Screening Tool“ entworfen. (41) Es kann auch zur Koexistenz von einer Reizblase und inkompletter Blasenentleerung kommen. Oft bemerken Patientinnen/Patienten nicht, dass sie die Blase nicht vollständig entleeren, daher ist es äußerst wichtig, in einer genauen klinischen Untersuchung die Restharnmenge bei Patientinnen/Patienten mit MS zu messen. (18) (42) Die neurologischen Symptome verschlechtern sich bei Harnwegsinfektionen und Fieber und je fortgeschrittener die MS-Erkrankung ist, desto öfter treten Harnwegsinfekte auf. (18) (43) 32 Abbildung 4 Actionable Bladder Symptom Screening Tool, übernommen aus (44) 3.1.7 Conus und Cauda Equina Läsionen Die Cauda Equina vereint die sakralen parasympathischen Fasern mit den somatischen efferenten und afferenten Fasern. Verletzungen in diesem Bereich dezentralisieren den Detrusor, weil die postganglionäre parasympathische Innervation uneffektiv ist. Daraus lässt sich schließen, dass sich Blasenfunktionsstörungen durch Cauda Equina Läsionen nicht vorhersagen lassen. Es wird sogar eine erhöhte Detrusoraktivität beschrieben. (18) (45) Eine weitere Studie zeigt, dass chronische Cauda Equina Läsionen mit einer Blasenfunktionsstörung einhergehen, sie korreliert mit den klinischen Befunden durch den sensorischen Verlust des unteren sakralen Segments. (46) 33 3.1.8 Störung der peripheren Innervation 3.1.8.1 Diabetische Neuropathie Mit den neuen Untersuchungstechniken wurde bekannt, dass eine Blasenfunktionsstörung keine Seltenheit bei einer diabetischen Neuropathie ist, jedoch verläuft sie oft asymptomatisch. Die Blasenfunktionsstörungen treten nie isoliert auf, denn bei den Betroffenen zeigen sich auch andere Symptome der diabetischen Neuropathie. Der Beginn einer Blasenfunktionsstörung ist schleichend, mit fortschreitendem Verlust des Blasengefühles und der immer stärkeren Beeinträchtigung beim Harnlassen endet sie schließlich mit chronischem Harnverhalt. (18) (47) Weitere urodynamische Studien zeigen, dass es bei der diabetischen Neuropathie zu einer Beeinträchtigung der Detrusorkontraktilität, einem reduzierten Urinfluss, einer erhöhten Restharnmenge und einem reduzierten Blasengefühl kommen kann. Es besteht die Möglichkeit, dass efferente und afferente Fasern der Harnblase involviert sind. Diese geschädigten Reduzierung des Bewusstseins für die Fasern verursachen eine Blasenfüllung und erhöhen die Blasenkontraktilität. (18) 3.1.8.2 Amyloidpolyneuropathie Autonome Manifestationen Hypertension, von Blasenfunktionsstörung erektiler und Dysfunktion, abnormale orthostatischer Pupillen sind bei Amyloidpolyneuropathie weit verbreitet. In den ersten 3 Jahren der Krankheit manifestieren sich Blasenfunktionsstörungen bei 50% der Betroffenen. Patientinnen/Patienten klagen oft über Schwierigkeiten beim Harnlassen und über Harninkontinenz. (18) (48) Oft bleiben die Blasenfunktionsstörungen asymptomatisch, aber urodynamische Studien zeigen eine Reduktion des Blasengefühls, reduzierte Detrusoraktivität und einen reduzierten Urinfluss auf. Mittels Ultraschall kann auch noch eine Blasenwandverdickung beobachtet werden. (18) 10% der Patientinnen/Patienten leiden an Polyurie und Nierenversagen. (49) Eine weitere Studie zeigt, dass Patientinnen/Patienten mit Harninkontinenz eine höhere Mortalität nach Lebertransplantationen aufweisen. (50) 34 3.1.9 Myotonische Dystrophie Bei Patientinnen/Patienten mit myotonischer Dystrophie lässt sich keine myotonische Aktivität im Sphinkter oder im Beckenboden nachweisen, aber Harnblasensymptome können bei diesen Personen große Probleme verursachen, da die glatte Muskulatur der Harnblase betroffen ist. (18) 3.2 Diagnostik Die Diagnose der neurogenen Blasenentleerungsstörung stützt sich auf drei Säulen (7): Die Anamnese Die neurologische Untersuchung Die urodynamische Untersuchung Bei der Anamnese ist es vor allem wichtig, neurologische Vorbefunde einzubeziehen und eine genaue Miktions-, Stuhl- und Sexualanamnese zu erheben. Weitere wichtige Fragen nach unwillkürlichem Harnabgang, Miktionsfrequenz und willentlicher Unterbrechung der Miktion sollten unbedingt gestellt werden. Die Patientin/der Patient sollte ein Miktionsprotokoll über mehrere Tage führen. (7) Bei der neurologischen Untersuchung ist das Augenmerk auf die Überprüfung der Reflexe im Rahmen der urologischen Diagnostik zu legen, da diese einen Hinweis auf die Höhe der neurologischen Läsion geben können und somit auf urologische Symptome rückgeschlossen werden kann. (7) Die urodynamische Untersuchung ist bei Patientinnen/Patienten mit neurogener Blasenentleerungsstörung unabdingbar, da diese die einzige Möglichkeit bietet, die Art und das Ausmaß der Funktionsstörung zu diagnostizieren. (17) 3.3 Therapie Das wichtigste Ziel der Therapie ist, den oberen Harntrakt vor Harnstau und Infektionen zu schützen. Danach stellen Kontinenz und Lebensqualität wichtige Therapieziele dar. Vielen Patientinnen/Patienten kann mit einer konservativen Therapie wie Toilettentraining, Elektrostimulation und Ausdrücken der Blase geholfen werden. (7) 35 Die minimalinvasive Therapie ermöglicht es, mit einem intermittierenden Katheterismus (Goldstandard), einem transurethralen Dauerkatheter oder einem suprapubischen Katheter die Komplikationen möglichst gering zu halten. (7) Eine operative Therapie wird nur bei Versagen aller anderen Therapieformen in Betracht gezogen. (7) Pharmakologische Beeinflussbarkeit des unteren Harntraktes (adaptiert nach Höfner und Jonas 2010) Stimulation Hemmung Detrusor Carbachol Butylscopolamin (parasympathisch) Bethanechol Darifenacin Distigminbromid Fesoterodin Flavoxat Oxibutynin Propiverin Solifenacin Tolterodin Trospiumchlorid Imipramin Diazepam Botulinumtoxin (intradetrusorale Injektion) Urethra, Midodrin Phentolamin innerer Sphinkter Phenoxybenzamin (α-adrenerg) Terazosin Alfuzosin Doxazosin Tamsulosin 36 externer Sphinkter, Duloxetin Baclofen Beckenboden Dantrolen (somatisch) Diazepam Tabelle 7 übernommen aus (17) 37 4 Harnverhalt Definiert ist der Harnverhalt durch das Unvermögen, die volle Harnblase zu entleeren. (17) 4.1 Ursachen Bei den Ursachen für den Harnverhalt wird zwischen den mechanischen und den funktionellen Obstruktionen unterschieden. Zu den mechanischen Verschlüssen werden das Prostataadenom, das Prostatakarzinom, die Prostatitis, die Blasenhalssklerose, die Meatusstenose, die Phimose, die Urethrastriktur, der Urethratumor, die Urethraverletzung, ein Urethrafremdkörper und iatrogene Verletzungen gezählt. Die neurologischen Ursachen wie Polyradikulitis, Poliomyelitis, Rückenmarkstrauma und Discusprolaps, die psychogenen und medikamentösen Ursachen durch vegetativ wirksame Pharmaka werden den funktionellen Ursachen zugeordnet. (17) 4.2 Symptome Aufgrund des Harnverhaltes entsteht ein unerträglicher Harndrang, der sehr starke Schmerzen erzeugt. Dazu kommt, dass die gefüllte Harnblase wie ein großer kugelförmiger Tumor im Unterbauch imponiert. (17) 4.2.1 Akuter Harnverhalt Der akute Harnverhalt ist durch ein plötzliches Unvermögen, den Harn zu lassen, gekennzeichnet. Die Patientinnen/Patienten sind unruhig, blass und schweißig. Meistens haben die Patientinnen/Patienten seit längerem Probleme bei der Harnblasenentleerung. (17) 4.2.2 Chronischer Harnverhalt Beim chronischen Harnverhalt können große Restharnmengen bis zu 5l beobachtet werden. Es kann auch zu einem unkontrollierten Urinabgang im Sinne einer Überlaufinkontinenz kommen. (17) 38 4.2.3 Harnverhalt bei jungen Frauen Der Harnverhalt bei jungen Frauen ohne Anzeichen auf eine neurologische Erkrankung oder einer anderen organischen Ursache hat lange Zeit als hysterisch gegolten. Diese Frauen im Alter von 20 bis 30 Jahren zeigen ein typisches klinisches Bild mit einem Harnverhalt, obwohl die Blase mit über einem Liter gefüllt ist, verspüren sie nicht den starken Drang, Harn zu lassen. Viele der Betroffenen berichten, eine Unterbrechung des Harnstrahles beobachtet zu haben. Alle anderen neurologischen Untersuchungen sowie Laboruntersuchungen, die eine Diagnose der MS unterstützen würden, fallen bei diesen Frauen negativ aus. Auch die Befunde der MR-Untersuchungen des Gehirns, des Rückenmarks und der Cauda Equina sind normal. Dieses Syndrom kommt oft im Zusammenhang mit dem Polyzystischen Ovarialsyndrom vor. (18) Als Therapie gibt es für diese Patientinnen oft nur die Möglichkeit, sich selbst zu katheterisieren. Wie in einer Studie gezeigt werden konnte, reagieren diese Frauen aber gut auf sakrale Neuromodulation, womit ihnen geholfen werden kann. (51) 4.3 Therapie Der wichtigste Schritt ist, die Blase sofort zu entlasten, dies geschieht durch das Setzen eines transurethralen oder eines suprapubischen Katheters. Dadurch wird der Harnverhalt zumindest symptomatisch therapiert. Eine endgültige Heilung geschieht erst, wenn die Grunderkrankung und die Ursache therapiert werden. (17) 39 5 Neurogene Pharmaka Übersicht der Wirkung von Medikamenten auf den Harntrakt (adaptiert nach Schultz-Lampel 2012) Medikamente Auswirkung auf den Harntrakt Antidepressiva Anticholinerge Wirkung, Sedierung Antikonvulsiva Senkung des Auslasswiderstands Anxiolytika Harnverhaltung Narkotika Harnverhaltung, Sedierung, Verwirrtheit Neuroleptika Anticholinerge Wirkung Parkinsonmittel Anticholinerge Wirkung, Harnverhaltung Tabelle 8 übernommen aus (17) 5.1 Antidementiva 5.1.1 Acetylcholinesterasehemmer Aufgrund einer Demenzerkrankung kann es zur cholinergen Unterversorgung kommen, da cholinerge Neurone zerstört werden. Die Transmitterfunktion soll durch die Verabreichung von Hemmstoffen verbessert werden. (52) Die Acetylcholinesterasehemmer sind die wichtigste Substanzklasse bei der Behandlung der Demenz, aber der Erfolg der Behandlung bleibt hinter den Erwartungen zurück, weil nicht nur cholinerge Neurone zugrunde gehen, sondern auch viele andere Neurone und Neurotransmittersysteme betroffen sind. (53) Wichtige Vertreter dieser Gruppe sind Donepezil, Rivastigmin und Galantamin, sie eigenen sich sehr gut für die Therapie im Frühstadium oder bei mittelschwerer Demenz. Je früher mit der Therapie begonnen wird, umso höher ist der therapeutische Nutzen, dieser kann jedoch erst nach Monaten klinisch festgestellt werden. Die Wirkung von Acetylcholinesterasehemmern ist dosisabhängig und muss im Therapieverlauf gesteigert und angepasst werden. Diese Medikamentengruppe eignet sich bei Ansprechen auch für eine Langzeittherapie. (52) Bei Obstruktion der Harnwege sind Acetylcholinesterasehemmer kontraindiziert, da es durch die Einnahme von diesen Mitteln zu Harnstau kommen kann. (54) (55) (56) 40 Anorexie, Schwindel, Schlaflosigkeit, Albträume, Übelkeit, Erbrechen, Agitiertheit, Verwirrtheit, Muskelkrämpfe und Infektionen der oberen Atemwege und des Urogenitaltraktes sind als Nebenwirkungen der Acetylcholinesterasehemmer zu nennen. Durch die Stimulation des Parasympathikus wird auch die Herzfrequenz verlangsamt, daher müssen bradykarde Rhythmusstörungen vor Behandlungsbeginn mittels EKG ausgeschlossen werden. (57) Eine Wirkungsverstärkung tritt bei der Gabe von Cholinomimetika, eine Wirkungsabschwächung bei der Gabe von Anticholinergika auf. Bei der gleichzeitigen Behandlung mit Donepezil kommt es zur Wechselwirkung durch CYP3A4 Substrate wie z.B. Chinidin, Makrolide und oral applizierte AzolAntimykotika. Dabei kommt es zur Erhöhung des Donepezil-Plasmaspiegels. (57) 5.1.2 NMDA – Rezeptorantagonisten Der wichtigste Vertreter der NMDA – Rezeptorantagonisten (Glutamat-N-MethylD-Aspartat-Rezeptor) ist Memantin. Dieser Wirkstoff hemmt den NMDA – Rezeptor, dadurch kann er in den Stoffwechsel des Neurotransmitters eingreifen. Medikamente dieser Wirkstoffgruppe werden oft bei fortgeschrittener Demenz in Kombination mit Acetylcholinesterasehemmern verschrieben. (52) Memantin kann eine Erhöhung der pH-Wertes im Urin verursachen, deshalb sollten diese Patientinnen/Patienten genau überwacht werden, denn dadurch könnten sich schwere Infektionen im unteren Harntrakt entwickeln. (58) Schwindel, Kopfschmerzen, Übelkeit, Unruhe und Übererregbarkeit sind als Nebenwirkungen für NMDA – Rezeptorantagonisten zu nennen. Diese Pharmaka sind bei Verwirrtheitszuständen, Epilepsie und schweren Nierenfunktionsstörungen kontraindiziert. Memantin verstärkt bei gleichzeitiger Einnahme die Wirkung von Neuroleptika, Anticholinergika, Levodopa, dopaminergen Agonisten und Amantadin. (57) 5.1.3 Nootropika Die Wirkstoffe Nicergolin, Piracetam und Pyritinol gehören verschiedenen Wirkstoffgruppen an. Der Begriff Nootropika bezeichnet alle Substanzen, die zentral stimulierende Effekte auf die Hirnleistung bringen. Insbesondere sollen 41 durch die Beeinflussung des Gehirnstoffwechsels, wie z.B. die Verbesserung der Membraneigenschaften oder die Erhöhung der Glucoseverwertung, Gedächtnisfähigkeit, Konzentrationsfähigkeit, Aufmerksamkeit, Urteilsvermögen und Orientierung gesteigert werden. (57) 5.2 Antidepressiva Die Monoaminmangelhypothese besagt, dass ein Mangel an zentralen Monoaminen oder ein Ungleichgewicht an zentralen Neurotransmittern an Stimmungsveränderungen beteiligt sein können. (52) Die Leitsubstanz bei den trizyklischen Antidepressiva ist Amitriptylin. Der Wirkmechanismus beruht auf einer Hemmung der neuronalen Rückaufnahme von biogenen Aminen wie Serotonin und Noradrenalin und einer Blockade der Muscarin-Rezeptoren im ZNS und in der Peripherie. (59) Die Einnahme von Antidepressiva führt zu keiner Abhängigkeit. Trizyklische Antidepressiva sollten nicht bei einer Harnretention verabreicht werden. Außerdem können sie die Wirkung von anticholinerg wirkenden Pharmaka auf die Blase, ZNS, Augen und Magen verstärken. (60) Diese anticholinergen Nebenwirkungen treten schnell auf, wohingegen die antidepressive Wirkung erst 2 bis 3 Wochen nach Einnahmebeginn eintritt. Bedeutend sind vor allem die kardiovaskulären Nebenwirkungen, wie z.B. Blutdrucksenkung, Tachykardie und eine Natriumkanalblockade. Deshalb sind trizyklische Antidepressiva bei kardiovaskulären Vorerkrankungen nur unter strenger Indikationsstellung zu verabreichen, weil es bei einer Überdosierung zu lebensgefährlichen Herzrhythmusstörungen kommen kann. Als weitere Kontraindikationen gelten akute Delirien, Alkohol- und Schlafmittelvergiftungen und das Glaukom. Trizyklische Antidepressiva können auch zentralvenöse Störungen wie Erregungs- und Verwirrtheitszustände, Schlaflosigkeit, Tremor, Krampfanfälle, Myoklonien Leberfunktionsstörungen, und Störungen Appetitsteigerung der hervorrufen. Sexualfunktion und Auch allergische Reaktionen können als Nebenwirkungen auftreten. (57) Die Wirkung von Alkohol, Sympathomimetika oder Anticholinergika wird durch die gleichzeitige Gabe von trizyklischen Antidepressiva verstärkt. Als weitere Interaktion wird die Wirkung von Antisympathotonika abgeschwächt. (57) 42 Eine Vergiftung mit trizyklischen Antidepressiva entspricht klinisch dem Bild einer Atropinvergiftung. Es kommt zu schweren Herzrhythmusstörungen, Hyperthermie, Delirien und Krämpfen und kann bis zum Herz- und Atemstillstand führen. Zur Behandlung steht der Verfügung. Dieses Cholinesterasehemmer Medikament wird unter Physostigminsalicylat EKG-Kontrolle und zur intensiv- medizinischer Überwachung appliziert und soll die Acetylcholinkonzentration im Organismus erhöhen. Für die Therapie der Rhythmusstörungen kann ein βRezeptorenblocker und gegen die Krämpfe können Benzodiazepine verabreicht werden. (57) Selektive-Serotonin-Rückaufnahme-Inhibitoren (SSRI) wie Fluoxetin und Citalopram hemmen im ZNS die zelluläre Rückspeicherung des freigesetzten Serotonins. (59) Eine häufige Nebenwirkung von Fluoxetin ist die Pollakisurie, wesentlich seltener treten Dysurie und Harnverhalt auf. (61) Bei Citalopram treten Miktionsstörungen und Polyurie häufig auf, es kann aber auch zur Harnretention kommen. (62) Schlafstörungen, Schwindel, Tremor, Schwitzen und gastrointestinale Störungen wie Übelkeit und Erbrechen werden als generelle Nebenwirkungen genannt. SSRI erhöhen bei gleichzeitiger Gabe mit trizyklischen Antidepressiva, Haloperidol, Phenytoin, Carbamazepin, Diazepam oder LithiumSalzen deren Serumkonzentration. Eine Kontraindikation stellen MAO-Hemmer dar, da eine toxische Serotoninkonzentration im Gehirn auftreten kann. (57) Der MAO-Hemmstoff Moclobemid hemmt reversibel die Monoaminoxidase vom Typ A. Diese baut im ZNS Noradrenalin und Serotonin ab. Diese Substanz wirkt antriebsteigernd. (59) Der unselektive Wirkstoff Tranylcypromin hemmt die Monoaminoxidase A und B irreversibel. Bei der Einnahme von Tranylcypromin muss eine tyraminarme Diät eingehalten werden, ansonsten kann es zu schwerwiegenden Interaktionen wie Blutdruckanstieg und hypertonen Krisen kommen. Schlafstörungen, Übelkeit Nebenwirkungen beider Substanzen Halluzinationen, Krampfanfälle, und Kopfschmerzen beobachtet. Hepatitiden, werden Tranylcypromin als kann Blutbildveränderungen und Verwirrtheitszuständen, bei gastrointestinale Beschwerden hervorrufen. (57) MAO-Hemmer sind bei Suizidgefahr, Patientinnen/Patientin mit Phäochromozytom, Thyreotoxikose, Pethidin und Clomipramin kontraindiziert. Außerdem kann es zu Unverträglichkeitsreaktionen 43 kommen, vor allem in Kombination mit Alkohol oder reserpinhältigen Pharmaka. (57) Durch die Blockade der Muskarinrezeptoren kommt es bei den trizyklischen Antidepressiva zu peripher vegetativen Nebenwirkungen. Miktionsbeschwerden, Obstipation, Tachykardie, Mundtrockenheit und Akkommodationsstörungen zählen dazu. Im Therapieverlauf nehmen diese Nebenwirkungen allerdings ab. Zu orthostatischen Störungen kann es durch die Blockade von α 1-Adrenozeptoren kommen, das Senken des Sympathikustonus kann aber auch zur Erhöhung der synaptischen Noradrenalinkonzentration im ZNS führen. Zentral werden auch H1Rezeptoren blockiert, wodurch es zur Sedierung und zu Schläfrigkeit kommt. Da trizyklische Antidepressiva die 5-HT2C- und/oder H1-Rezeptoren blockieren, kommt es zur Gewichtszunahme. Die chinidinartigen Eigenschaften führen zu einer direkten kardialen Wirkung, die sich im EKG als PQ-/QRS Verbreiterung zeigen kann. (63) Die Nebenwirkungen der anderen Antidepressiva unterscheiden sich von den Nebenwirkungen der trizyklischen Antidepressiva, da diese im Gegensatz keine oder nur eine geringe Affinität zu den zentralen und peripheren Neurotransmitterrezeptoren haben. Bei SSRI treten anticholinerge und kardiovaskuläre Nebenwirkungen sehr selten auf, sie wirken kaum sedierend und haben keine Gewichtszunahme zur Folge. Häufig kommt es zu Therapiebeginn mit SSRIs zu Übelkeit, gastrointestinalen Störungen und Kopfschmerzen. (63) Schwindel, Kopfschmerzen, Schlaflosigkeit, Agitiertheit, Tremor und Verwirrtheit sind die häufigsten Nebenwirkungen von MAO-Hemmern. (63) 5.3 Antikonvulsiva Die Ursache für einen epileptischen Anfall kann eine überstarke, synchronisierte Aktivität einer Neuronengruppe sein. Die neuronale Aktivität kann durch die Blockade spannungsabhängiger Na+ - Kanäle oder durch die Förderung der GABAnergen-Hemmung erfolgen. Bei der Blockade der spannungsabhängigen Na+ - Kanäle ist es von großem Vorteil, dass die Hemmung vom Funktionszustand abhängig ist. Somit werden umso mehr Pharmaka-Moleküle gebunden, je häufiger die Zelle depolarisiert. Die wichtigsten Vertreter dieser Gruppe sind Carbamazepin, Valproat, Phenytoin und Lamotrigin. Bei der GABAergen44 Hemmung können mehrere Wirkmechanismen zur antikonvulsiven Wirkung führen. Vigabatrin hemmt den GABA – Abbau und für die Förderung der GABA – Freisetzung ist Gabapentin verantwortlich. Ein weiterer Wirkmechanismus ist die Hemmung eines T-Typ-Ca2+ - Einwärtsstromes in thalamischen Neuronen durch Ethosuximid und Valproat. (59) Antikonvulsiva können die Entwicklung der Epilepsie nicht verhindern, sie wirken rein symptomatisch und unterdrücken epileptische Anfälle. (64) Miktionsstörungen wie Dysurie, Pollakisurie und Harnretention können als Nebenwirkungen auftreten. (65) 5.3.1 Carbamazepin Müdigkeit, Appetitlosigkeit, Brechreiz, Übelkeit, Kopfschmerz, Schwindel und Sehstörungen sind als Nebenwirkungen von Carbamazepin zu nennen. Sie treten vor allem zu Beginn der Therapie auf. Kontraindikationen für Carbamazepin sind Leberfunktionsstörungen und der AV – Block. Carbamazepin verringert als Enzymindikator von CYP3A4 die Wirkung von Clonazepam, Ethosuximid, Tiagabin, Topiramat, hormonellen Kontrazeptiva, Glucocorticoiden, Haloperidol oder Theophyllin. (57) 5.3.2 Valproat Zu den Nebenwirkungen von Valproat werden zentralnervöse Störungen wie Schlaflosigkeit, Beschwerden, Verwirrtheit, Haarausfall Gerinnungsstörungen Unruhe und infolge und Halluzinationen, Gewichtszunahme von gezählt. Thrombozytopenie und gastrointestinale Auch werden Fibrinogenabfall beobachtet. Weiters kann es auch zu einer Leberfunktionsstörung kommen, die in manchen Fällen tödlich verläuft. Deshalb sollte bei der Einnahme von Valproat eine Kontrolle von Thrombozytenzahl, Gerinnungsparametern und Leberfunktion stattfinden. Verminderte Wirkung von Valproat tritt bei gleichzeitiger Gabe von enzyminduzierten Antiepileptika wie Phenytoin und Carbamazepin ein. Außerdem verdrängt Valproat Diazepam aus der Plasmaalbuminbindung und hemmt den Metabolismus. Eine Wechselwirkung kann es unter anderem mit Antikoagulanzien oder Acetylsalicylsäure geben, weil eine erhöhte Blutungsneigung gegeben ist. (57) 45 5.3.3 Phenytoin Eine häufige Nebenwirkung bei der Verabreichung von Phenytoin ist eine kosmetisch störende Gingivahyperplasie und bei 10% der Patientinnen/Patienten kommt es zur Hypertrichose. Allergische Hautreaktionen, Osteoporose und Osteomalazie sind weitere Nebenwirkungen von Phenytoin. Bei einer Überdosierung kommt es zu Symptomen wie Schwindel, Gangataxie, Nystagmus, verwaschener Sprache und Erregungszuständen. Zu den Kontraindikationen zählen Leukopenie und AV-Block II. und III. Grades. Zu Arzneimittelinteraktionen kommt es bei der Gabe von oralen Antikoagulanzien, Cimetidin, Chloramphenicol, Cumarin-Derivate, Isoniazid, Sultiam und Valproat. Durch diese Pharmaka wird die Enzymhemmung erhöht, und diese vermindert den Abbau des Phenytoinspiegels. Außerdem verstärkt Phenytoin die Toxizität von Methotrexat. (57) 5.3.4 Lamotrigin Schwindel, Schläfrigkeit, Kopfschmerzen, gastrointestinale Beschwerden und Exantheme werden als Nebenwirkungen von Lamotrigin beobachtet. Bei Kindern unter 2 Jahren sowie bei Patientinnen/Patienten mit Leber- und Niereninsuffizienz ist Lamotrigin Carbamazepin kontraindiziert. und Phenytoin Der Abbau beschleunigt, des Arzneimittels wohingegen wird durch Valproat seine Biotransformation hemmt. (57) 5.3.5 Vigabatrin Das Spektrum der Nebenwirkungen von Vigabatrin geht von Müdigkeit, Schläfrigkeit, Kopfschmerz, Schwindel, Agitiertheit, aggressivem Verhalten über gastrointestinale Beschwerden bis hin zu Gesichtsfeldeinengungen. Die Gabe von Vigabatrin sollte besonders vorsichtig und unter strenger Überwachung bei Patientinnen/Patienten mit Nierenfunktionsstörung, Psychosen, Hyperkinesien, Endokrinopathien erfolgen. (57) 46 5.3.6 Gabapentin Gabapentin kann als Nebenwirkungen zentralnervöse Störungen wie z.B. Schwindel, Müdigkeit, Ataxie hervorrufen. Außerdem kann es zu Übelkeit, Erbrechen, Gewichtszunahme, Ödemen und Verhaltensauffälligkeiten kommen. Gabapentin ist bei einer akuten Pankreatitis kontraindiziert. Die Resorption von Gabapentin wird durch die gleichzeitige Einnahme von magnesium- oder aluminiumhaltigen Antazida verringert. (57) 5.3.7 Ethosuximid Durch Ethosuximid kann es zu Schwindel, Übelkeit, Erbrechen, Oberbauchbeschwerden und allergischen Reaktionen der Haut kommen. Bei einer Überdosierung tritt ein hypnotischer Effekt auf, es kann aber auch zu Reizbarkeit, Verstimmungs- und Erregungszuständen kommen. (57) Eine Schwangerschaft stellt keine Indikation zum Abbruch einer Antikonvulsivatherapie dar, da eine Nicht-Behandlung ein höheres Risiko für den Embryo bringt als die Epilepsietherapie an sich. Es ist besonders darauf zu achten, dass in einer Schwangerschaft Spurenelemente wie Folsäure und Vitamin K unter einer Therapie mit Carbamazepin, Phenytoin oder Valproat substituiert werden. Somit wird eine Schädigung des Embryos vermieden. (57) 5.4 Anxiolytika Die Benzodiazepine wirken spezifisch gegen ängstliche Zustände. Sie führen bei chronischer Gabe zu Abhängigkeit und Sucht. In höheren Dosen wirken Benzodiazepine dämpfend, antikonvulsiv, hypnotisch und narkotisch. Es kann die Wirkung durch Flumazenil als Antidot aufgehoben werden. Durch die Verstärkung der allosterischen Wirkung des inhibitorischen Überträgerstoffes GABA am GABAA–Rezeptor wirken sie anxiolytisch. (59) 47 Benzodiazepine: Wichtigste pharmakologische Wirkung und therapeutische Anwendung Pharmakologische Wirkung Klinische Indikation Anxiolyse, Antikonflikt- und Angst, Phobien, ängstliche Depression, Antifrustrationswirkung; Enthemmung neurotische Hemmung gewisser Verhaltensformen Anitkonvulsive Wirkung Verschiedenste Formen epileptischer Aktivität (Epilepsien, Konvulsivavergiftungen) Dämpfung der psychischen Hyperemotionelle Zustände, Reaktionsbereitschaft auf Reize Schizophrenie (?) (Sedation) Schlaffördernde Wirkung Schlafstörung Dämpfung zentral vermittelter vegetativ Psychosomatische Störungen nervöser und hormonaler Antworten auf (kardiovaskuläre, gastrointestinale, emotionelle und psychische Reize urogenitale, hormonelle) Zentrale Verminderung des Somatisch bedingte und psychogene Skelettmuskeltonus Muskelspasmen, Tetanus Verstärkung der Wirkung von zentral Anästhesiologie für chirurgische und dämpfenden Pharmaka; anterograde diagnostische Eingriffe Amnesie Fehlen direkter Wirkungen außerhalb Breites Indikationsfeld wegen guter den ZNS; ungewöhnlich geringe allgemeiner Verträglichkeit in Toxizität therapeutischen Dosen Tabelle 9 übernommen aus (53) Diazepam wird vor allem zur psychovegetativen Entkopplung bei Herzinfarkt und Krämpfen angewendet. Clonazepam dient als Antikonvulsivum. Nitrazepam wird als Durchschlafmittel eingesetzt und Brotizolam als Einschlafmittel. Midazolam findet seine Anwendung als Injektionsnarkotikum. (59) Die Nebenwirkungen von Benzodiazepinen unterscheiden sich bei akuter oder bei chronischer Anwendung. Bei akuter Anwendung kommen vor allem Müdigkeit, Schläfrigkeit, Konzentrationsschwächen und Einschränkung der Aufmerksamkeit 48 und des Reaktionsvermögens in Betracht. Benzodiazepine wirken zentral muskelrelaxierend. Dadurch kommt es zu Muskelschwäche und Gang- unsicherheit. Außerdem kann die Libido vermindert, der weibliche Zyklus gestört und ein vermehrter Appetit als Nebenwirkung aufgezeigt werden. Bei schneller intravenöser Gabe kann es zu Blutdruckabfall, Atemdepression und selten zu Herzstillstand kommen. (63) Als seltene Nebenwirkung kann es auch zur Harninkontinenz kommen (66) Bei der chronischen Einnahme von Benzodiazepinen ist die Gefahr von Abhängigkeit und Toleranz sehr hoch. Zusätzlich kommen affektive Verflachung, kognitive Leistungseinbußen, Beeinträchtigung der Initiative und neurologische Störungen als Nebenwirkungen hinzu. (63) Kontraindikationen für Anxiolytika stellen Ataxie, Myasthenia gravis und akute Intoxikationen mit Alkohol, Opioiden und Schlafmitteln dar. Diese Medikamente verstärken den zentral dämpfenden Effekt von Sedativa, Hypnotika, Neuroleptika und Alkohol und die Wirkung von Muskelrelaxanzien wird erhöht. (57) Benzodiazepine sind nicht nur plazentagängig, sondern gehen auch in die Muttermilch über. Deswegen muss immer an die Gefährdung des Kindes gedacht werden. Das „floppy infant syndrome“ mit Hypothermie sowie Muskelerschlaffung mit Atem- und Saugstörungen kann beobachtet werden. (63) 5.5 Narkotika Für eine gute Narkose ist es wichtig, dass folgende drei Bedingungen erfüllt werden. Erstens soll eine geringe Toxizität gegeben sein, zweitens sollen bestmögliche Operationsbedingungen herrschen und drittens soll eine optimale Stabilisierung der Patientin/des Patienten erreicht werden. Dieses kann nur durch das Zuführen mehrerer Medikamente erreicht werden. Daraus folgt die Kombinationsnarkose. (59) Zu den Inhalationsnarkotika zählen die Dampfnarkotika mit halogenhaltigen Ethern wie Isofluran, Desfluran und Sevofluran. Das Gasnarkotikum Stickoxydul (Lachgas, N2O) wird oft zur Kombinationsnarkose genutzt, da es deutlich analgetisch wirkt. Ein weiterer Vertreter der Inhalationsnarkotika ist das Edelgas Xenon. (59) 49 Bei den Injektionsnarkotika ist die schlechte Steuerbarkeit ein großer Nachteil. Daher werden die meisten Präparate nur zum Einleiten einer Narkose verwendet. Eine Ausnahme ist Propofol, das aufgrund seiner kurzen Wirkdauer und guten Verträglichkeit recht gut steuerbar ist, bei einer Langzeitgabe kann es zur Verfärbung des Urins kommen. (67) Bei den Barbituraten sind vor allem Thiopental und Methohexital in Verwendung. Thiopental kann bei hohen Dosen zur Polyurie führen. (68) Ketamin wirkt sehr gut analgetisch und bewirkt durch die Adrenalin-Freisetzung eine postnarkotische dissoziative Anästhesie. Etomidat ist aufgrund seiner hypnotischen Wirkung bei kardiologischen Risiko- patientinnen/Risikopatienten im Gebrauch. Das Benzodiazepin-Derivat Midazolam eignet sich iv. gegeben für die Einleitung einer Narkose. Opioide können in Kombination mit Midazolam oder Propofol genutzt werden. (59) 5.6 Neuroleptika Neuroleptika werden vor allem zur Behandlung von Psychosen, Wahn, Halluzinationen und psychomotorischen Erregungszuständen eingesetzt. Die Medikamente dämpfen psychomotorische Erregungszustände und verringern affektive Spannungen, Angst und Trugwahrnehmungen. Durch diesen Distanzierungsprozess kann die Patientin/der Patient ihre/seine Krankheit selbst erkennen. Neuroleptika wirken rezidivprophylaktisch und für die Patientinnen/Patienten wird ihr Zustand weniger quälend. (57) Diese Pharmaka wirken als Dopamin – Rezeptorantagonisten, insbesondere der Rezeptor D2. Die Wirkung setzt nur sehr langsam, meist erst nach Tagen oder Wochen ein. Neuroleptika führen nicht zur Abhängigkeit. (52) Bei der Gruppe der Neuroleptika kann man zwischen typischen und atypischen Neuroleptika unterscheiden. (52) Die Gruppe der typischen Neuroleptika wird nochmals in hoch- und niedrigpotente Wirkstoffe unterteilt. Der wichtigste Vertreter der hochpotenten Wirkstoffe ist Haloperidol, dieser Wirkstoff wird zumeist bei starker psychotischer und motorischer Erregbarkeit eingesetzt. (52) Harnretention tritt als eine häufige Nebenwirkung auf. (69) Levomepromazin gehört der Gruppe der niedrigpotenten Wirkstoffe an. Es wird vor allem bei Unruhe und Schlafstörungen verordnet. Bei den typischen Neuroleptika gilt als allgemeine Grundregel: je stärker der Wirkstoff, 50 umso schwächer sind die vegetativen und sedierenden Nebenwirkungen. (52) Levomepromazin wirkt auch auf die Harnblase, Miktionsstörungen bis hin zum Harnverhalt können als häufige Nebenwirkung auftreten. (70) Atypische Neuroleptika wirken aufgrund einer 5-HT2A-Rezeptorblockade und weniger durch die D2- Rezeptorblockade. Wichtige Vertreter dieser Gruppe sind Olanzapin, Risperidon, Ziprasidon, Quetiapin und Clozapin. Atypische Neuroleptika haben weniger extrapyramidal-motorische Nebenwirkungen als typische Neuroleptika und eignen sich daher zur Erstbehandlung sehr gut. Bei Olanzapin besteht die Gefahr einer Gewichtszunahme und bei Clozapin sollte regelmäßig das Blutbild kontrolliert werden, da es zur Agranulozytose kommen kann. (52) Mögliche Auswirkungen von atypischen Neuroleptika auf die Harnblase Olanzapin Harninkontinenz, Harnverhalt, Schwierigkeiten beim Harnlassen Risperidon Harninkontinenz, Pollakisurie, Harnretention, Dysurie Ziprasidon Harninkontinenz, Dysurie Quetiapin Harnretention Clozapin Harninkontinenz, Harnverhalt Tabelle 10 übernommen aus (71) (72) (73) (74) (75) Die extrapyramidal-motorischen Nebenwirkungen werden in fünf Stadien eingeteilt. Als erstes tritt die Frühdyskinesie mit einer Häufigkeit von 2-25% ein, diese beginnt meist in der ersten Woche. In diesem Stadium wird eine Verkrampfung der mimischen Muskulatur erwartet. Dies trifft besonders die äußeren Augenmuskeln, die Muskulatur von Zunge und Schlund sowie Bewegungsabläufe von Armen und Hals. Diese Symptome werden durch eine D2Rezeptor-Blockade und einem Übergewicht an cholinergen striatalen Interneuronen verursacht. Es kommt nur sehr selten zu lebensbedrohlichen laryngealen und pharyngealen Spasmen. (63) Als zweites Stadium ist das Neuroleptikum-induzierte Parkinsonoid definiert. Es kommt mit einer Häufigkeit von 15-30% vor. Der Beginn ist in den ersten 10 Wochen zu erwarten. Die Symptome reichen von erhöhtem Muskeltonus (Rigor), 51 Zittern (Tremor) und starrer Mimik bis hin zum kleinschrittigen Gang (Akinesie) und vegetativen Symptomen wie erhöhtem Speichelfluss. (63) Als Drittes kommt mit einer Häufigkeit von 20-25% die Akathisie vor, die in den ersten 7 Wochen beginnt. Es kommt zu einer quälenden Unruhe, die durch den Willen nicht beeinflussbar ist. Die Pathogenese dieses Stadiums ist noch nicht geklärt. (63) Die Spätdyskinesie ist das vierte Stadium der extrapyramidal-motorischen Nebenwirkungen von Neuroleptika. Sie kommt mit einer Häufigkeit von 15-20% vor und beginnt nach drei Monaten bis mehreren Jahren. Dabei zeigen sich typische Saug-, Schmatz-, Kau- und Zungenbewegungen. Diese Störungen sind meist irreversibel und werden vom Betroffenen nicht wahrgenommen. Als Ursachen kommen eine Überempfindlichkeit der D2-Rezeptoren im Corpus striatum in Frage und eine Unterfunktion von cholinergen Neuronen. (63) Das fünfte Stadium ist das maligne neuroleptische Syndrom und gilt als Notfall. Hier kommt es neben Rigor und Akinesie zu hohem Fieber, Blutdrucklabilität, Tachykardie und Tachypnoe. Es hat eine Häufigkeit von 0,02-0,5%, kommt in den ersten zwei Behandlungswochen vor und entwickelt sich innerhalb von ein bis drei Tagen. In 20% der Fälle führt das maligne neuroleptische Syndrom zum Tod. Labormedizinisch sind die Leukozytenanzahl und die Blutsenkungs- geschwindigkeit erhöht und es besteht eine metabolische Azidose. Es kommt zur Myoglobinurie, Dunkelfärbung des Urins, da die Skelettmuskulatur beteiligt ist und somit die Kreatinkinase im Plasma erhöht ist. Die Therapie erfolgt auf der Intensivstation durch Kühlung, Absetzen des Neuroleptikums und die Gabe von Dantrolen, Bromocriptin, Amantadin oder Lorazepam. (63) Neben den extrapyramidal-motorischen Nebenwirkungen kommt es bei Neuroleptikagabe auch zu weiteren Nebenwirkungen. Durch die Blockade der D2Rezeptoren kommt es zur Freisetzung von Prolaktin. Dieses führt bei Frauen zu Galaktorrhö und Amenorrhö, bei Männern zur Gynäkomastie und Verminderung der Libido. Weiters können Neuroleptika den H1-Rezeptor blockieren und es kommt zur Sedierung. Dieser Effekt wird oft therapeutisch ausgenutzt, wobei dieser im Verlauf der Behandlung jedoch nachlässt. Aufgrund der Blockade von peripheren Muskarinrezeptoren kommt es zu vegetativen Nebenwirkungen. Miktionsstörungen, Obstipation, Tachykardie, Mundtrockenheit und Störungen der Akkommodation können auftreten. Ein arterieller Hypertonus und orthostatische 52 Regulationsstörungen sind durch die Blockade der α1-Adrenozeptoren erklärbar. (63) 5.7 Parkinsonmittel Zerstörtes Hirngewebe kann medikamentös nicht ersetzt werden, der Krankheitsverlauf kann nur verlangsamt, aber nicht gestoppt werden. (59) 5.7.1 Levodopa Ein zentraler Dopaminmangel ist oft der Auslöser vieler Symptome des Morbus Parkinson. Deswegen sollte die medikamentöse Therapie den Neurotransmitter zentral ausgleichen. L-Dopa ist die Aminosäurenvorstufe des polaren Katecholamins Dopamin, da dieses die Blut-Hirn-Schranke nicht passieren könnte. Durch die Dopa-Decarboxylase wird L-Dopa erst am Wirkungsort zu Dopamin umgewandelt. Dieser Vorgang läuft aber auch außerhalb des Gehirns ab, und es sollte deshalb ein Dopa-Decarboxylase-Hemmer verabreicht werden. Dazu gehören Carbidopa und Benserazid. (52) Die Wirkung von Carbidopa auf den Harntrakt zeigt sich durch dunkel gefärbten Urin, sehr selten kommt es zur Harninkontinenz und Harnretention. (76) Als weitere Nebenwirkungen können motorische Symptome wie z.B. Dys- und Hyperkinesien, gastrointestinale Beschwerden, Tachyarrhythmien und orthostatische Beschwerden auftreten. Psychische Veränderungen Halluzinationen können wie auch Schlaflosigkeit, als Unruhe Nebenwirkungen Agitiertheit genannt und werden. Dekompensierte endokrine, renale, hepatische und kardiale Erkrankungen sowie Schizophrenie gelten als Kontraindikation für L-Dopa. Die Wirkung von L-Dopa wird durch Neuroleptika und Reserpin abgeschwächt, wohingegen Adrenalin und Noradrenalin die Wirkung verstärken. (57) 5.7.2 Dopaminagonisten Zu den Mutterkornalkaloiden zählt der Wirkstoff Cabergolin, zu der Gruppe der Nichtmutterkornalkaloide zählen Pramipexol und Ropinirol. Die Dopaminagonisten stimulieren die Dopamin – Rezeptoren und sind bei Patientinnen/Patienten unter 53 65 Jahren Therapie erster Wahl. (52) Die volle Wirkung der Dopaminagonisten tritt erst einige Wochen nach Behandlungsbeginn ein, da die Dosis nur sehr langsam gesteigert wird, um schwere Nebenwirkungen zu vermeiden. Durch die Stimulation der dopaminergen Rezeptoren, vor allem in der Area postrema, treten Nebenwirkungen wie Übelkeit und Erbrechen auf. Diese können aber durch die Gabe eines Dopaminantagonisten deutlich verringert werden. (57) 5.7.3 COMT - Inhibitoren Durch die Blockade der Catecholamin-O-Methyltransferase (COMT) wird der LDopa-Abbau in der Peripherie reduziert und das erhöht die zentrale Verfügbarkeit. Entacapon ist ein Wirkstoff aus dieser Gruppe der Parkinsonmittel. (52) Als häufige Nebenwirkung tritt hier eine Verfärbung des Urins auf. (77) Weiters können Dyskinesien, Übelkeit, Abdominalschmerzen, gastrointestinale Motilitätsstörungen und Mundtrockenheit durch COMT – Hemmer auftreten. Diese Medikamente sind bei Leberinsuffizienz, Phäochromozytom und malignem neuroleptischen Syndrom kontraindiziert, und sie sollten nicht mit Adrenalin, Noradrenalin oder nichtselektiven MAO – Hemmern kombiniert werden. (57) 5.7.4 Amantadin Dies ist ein NMDA – Rezeptorantagonist. Durch die Reduktion der Acetylcholinfreisetzung kommt es zur Symptomlinderung. Dieses Medikament ist vor allem bei akinetischen Krisen Mittel erster Wahl. Niereninsuffizienz ist eine Kontraindikation, da es rein renal ausgeschieden wird. (52) Als seltene Nebenwirkung kann eine Harnretention auftreten. (78) Die meisten Nebenwirkungen treten nur zu Beginn der Behandlung auf und sind im Vergleich zu Levodopa auch geringer. Innere Unruhe, Magen-Darm Beschwerden und Verwirrtheit können bei Einnahme von Amantadin auftreten. Als Kontraindikationen sind Niereninsuffizienz und hypotone Zustände zu nennen. (57) 54 5.7.5 Monoaminoxidase-B-Hemmer Durch die Hemmung der MAO-B-Aktivität kommt es zum verminderten Abbau von Dopamin. Selegilin kann einen Therapiebeginn mit L-Dopa hinauszögern. (52) Mundtrockenheit, Schwindel, Schlafstörungen, supraventrikuläre Arrhythmien, AVBlock und Blutdruckabfall sind bei Selegilin als Nebenwirkungen zu nennen. Bei eingeschränkter Leber- und Nierenfunktion sowie bei peptischen Ulzera sind MAO-B-Hemmer kontraindiziert, außerdem sollten sie nicht mit anderen MAOHemmern, Serotonin-Wiederaufnahme-Hemmern, Serotoninagonisten und OpioidAnalgetika kombiniert werden. (57) 5.7.6 zentral wirksame Anticholinergika Anticholinerge Medikamente, wie die Muscarin-Rezeptor-Antagonisten, zu denen z.B. Biperiden zählt, lindern besonders Tremor und Rigor, da sie das Übergewicht des Neurotransmitters reduzieren. (52) Als mögliche Auswirkungen auf die Harnblase gelten Miktionsstörungen und Harnverhalt als sehr seltene Nebenwirkungen. (79) Die Behandlung mit Biperiden muss schleichend erfolgen, und die Dosis darf nur langsam gesteigert werden. Bei Patientinnen/Patienten, die bereits unter psychoorganischen oder exogen-psychotischen Symptomen leiden, ist Biperiden kontrainduziert, weil zentral wirksame Anticholinergika diese Symptomatik verstärken würden. (57) 55 6 Diskussion Harninkontinenz und Harnverhalt sind zwei Krankheitsbilder, die bei den betroffenen Personen viele Probleme verursachen. Der Leidensdruck der Patientinnen/Patienten ist sehr hoch, daher brauchen sie eine besondere Behandlung auf allen drei Ebenen des biopsychosozialen Krankheitsmodells. Die Harninkontinenz wurde im Jahr 2002 von der ICS als Krankheit definiert, da diese Erkrankung die häufigste Ursache für eine Pflegeheimunterbringung ist. Sie ist mit einer starken Tabuisierung behaftet und fordert bei der Diagnostik und Therapie einen sensiblen Umgang mit den Patientinnen/Patienten. (11) An erster Stelle der Diagnostik sollte eine ausführliche Anamnese stattfinden. Fragen zu Voroperationen am Becken, Schwangerschaften, Geburtsverlauf, Sexualfunktion, neurologischen Erkrankungen, Medikamenten und Diabetes mellitus dürfen hier nicht fehlen. Weiters ist die Frequenz der Inkontinenz, die bemerkten Mengen beim Urinverlust, der Einfluss auf das tägliche Leben und ein möglicher Organprolaps zu thematisieren. Darauf folgt eine genau körperliche Untersuchung und die Patientinnen/Patienten sollten angehalten werden, ein Miktions- und Trinkprotokoll zu führen. Weiterführende diagnostische Maßnahmen stellen die Sonographie, Urodynamik, Miktionszystourethrographie und Endoskopie dar. (7) (10) Die Therapie der Harninkontinenz ist stark abhängig von ihrer Form. Bei der Belastungsinkontinenz spielt die pharmakologische Therapie eine untergeordnete Rolle, es steht nur der Wirkstoff Duloxetin zur Verfügung. Dieser erhöht den Beckenboden- und Sphinktertonus. Bei der Dranginkontinenz hingegen reicht das Spektrum von Muskarinrezeptorantagonisten über lokale Östrogenapplikation bei Frauen, β3-Adrenozeptor-Agonisten bis hin zu Botulinum-A-Toxin und Vanilloidrezeptoragonisten. (11) Beim Harnverhalt entsteht ein unerträglicher Harndrang, der sehr starke Schmerzen hervorruft. Therapeutisch kann diesen Personen geholfen werden, indem die Blase sofort entlastet wird. Dieses geschieht durch das Setzen eines transurethralen oder eines suprapubischen Katheters. Damit wird der Harnverhalt aber nur symptomatisch gebessert, eine Heilung kann nur geschehen, wenn die Ursache therapiert wird. (17) 56 Vor allem neurogene Pharmaka wirken auf die Harnblase. Diesen Nebenwirkungen wird im klinischen Alltag oft nicht die gewünschte Beachtung geschenkt. Acetylcholinesterasehemmer können bei Obstruktion der Harnwege zu einem Harnverhalt führen und zusätzlich zu einer Infektion des Urogenitaltraktes beitragen. NMDA-Rezeptorantagonisten können den pH-Wert im Urin erhöhen und somit erkranken Patientinnen/Patienten eher an Infektionen. (57) (58) Bei den trizyklischen Antidepressiva kann es zu Harnretention kommen, außerdem treten Miktionsbeschwerden bei Einnahme dieser Medikamente auf. (63) Zur Harninkontinenz kann es durch die Wirkung der Benzodiazepine kommen, bei Propofol zur Verfärbung des Urins und Thiopental kann in hohen Dosen zur Polyurie führen. (66) (67) (68) Vor allem atypische Neuroleptika wirken auf die Harnblase. Harninkontinenz, Harnverhalt, Schwierigkeiten beim Harnlassen, Pollakisurie, Harnretention und Dysurie können als Nebenwirkungen beobachtet werden. (71) (72) (73) (74) (75) Bei den Parkinsonmitteln können urologische Nebenwirkungen wie Harninkontinenz, Harnretention, dunkel gefärbter Urin und Miktionsstörungen auftreten. (76) (77) (78) (79) Bei fast allen neurologischen Erkrankungen treten im Krankheitsverlauf Blasenfunktionsstörungen auf. Selbst bei traumatischen Ereignissen, bei denen das Rückenmark beschädigt wird, kommt es zu Komplikationen im unteren Harntrakt. (7) An erster Stelle der Diagnostik steht eine ausführliche Anamnese, danach kommt eine neurologische Untersuchung und zuletzt wird mittels Urodynamik untersucht. (7) Das wichtigste therapeutische Ziel ist, den oberen Harntrakt vor Harnstau und Infektionen zu schützen, danach stellen Kontinenz und Lebensqualität wichtige Therapieziele dar. (7) Wichtig ist es, die Blasenfunktionsstörungen ernst zu nehmen, Patientinnen/Patienten dahingehend aufzuklären und eine individuell abgestimmte Therapie zu veranlassen. 57 7 Literaturverzeichnis 1. Anderhuber F, Pera F, Streicher J. Waldeyer - Anatomoie des Menschen. 19. Auflage. Berlin: De Gruyter, 2012. 2. Aumüller G, Aust G, Doll A, et al. Duale Reihe: Anatomie. 2. Auflage. Stuttgart: Georg Thieme Verlag KG, 2010. 3. Lüllmann-Rauch. Taschenlehrbuch Histologie. 3. Auflage. Stuttgart: Georg Thieme Verlag KG, 2009. 4. [Online 18. Oktober 2016.] https://www.lecturio.de/magazin/ableitende- harnorgane/. 5. Klinke R, Pape HC, Kurtz A, et al. Physiologie. 6. Auflage. Stuttgart: Georg Thieme Verlag KG, 2010. 6. [Online 18. Oktober 2016.] http://symptomat.de/Harnblase. 7. Hammes C, Heinrich E, Lingenfelder T, et al. Basics Urologie. 3. Auflage. München: Elsevier GmbH, 2015. 8. Abrams P, Cardozo L, Fall M, et al. The standardisation of terminology of lower urinary tract function: report from the Standardisation Sub-committee of the International Continence Society. 2002. Jul;187(1):116-26. 9. Abrams P, Cardozo L, Fall M, et al. The standardisation of terminology in lower urinary tract function: report from the standardisation sub-committee of the International Continence Society. 2003. Jan;61(1):37-49. 10. Schmelz HU, Sparwasser C, Weidner W. Facharztwissen Urologie Differenzierte Diagnostik und Therapie. 3. Auflage. Berlin Heidelberg: Springer Verlag, 2014. 11. Hegele A, Skrobek L. Urologie essentials. Stuttgart: Georg Thieme Verlag KG, 2016. 12. Cornu JN, Merlet B, Ciofu C, et al. Duloxetine for mild to moderate postprostatectomy incontinence: preliminary results of a randomised, placebocontrolled trial. 2011. Jan;59(1):148-54. 13. Filocamo MT, Li Marzi V, Del Popolo G, et al. Pharmacologic treatment in postprostatectomy stress urinary incontinence. 2007. Jun;51(6):1559-64. 14. Andersson. The use of pharmacotherapy for male patients with urgency and stress incontinence. 2014. Nov;24(6):571-7. 58 15. Abrams P, Kelleher C, Staskin D, et al. Combination treatment with mirabegron and solifenacin in patients with overactive bladder: exploratory responder analyses of efficacy and evaluation of patient-reported outcomes from a randomized, double-blind, factorial, dose-ranging, Phase II study. 2016. 16. [Online 18. Oktober 2016.] http://kontinenzzentrum.blogspot.co.at/2013/11/meilensteine-der-neurourologiedie.html. 17. Hautmann R, Gschwend JE. Urologie. 5. Auflage. Berlin Heidelberg: Springer Verlag, 2014. 18. Daroff RB, Jankovic J, Mazziotta JC, et al. Bradley's Neurology in Clinical Practice. 7th edition. London: Elsevier, 2016. 19. Fowler. Neurological disorders of micturition and their treatment. 1999. Jul;122 ( Pt 7):1213-31. 20. Han KS, Heo SH, Lee SJ, et al. Comparison of urodynamics between ischemic and hemorrhagic stroke patients; can we suggest the category of urinary dysfunction in patients with cerebrovascular accident according to type of stroke? 2010. Mar;29(3):387-90. 21. Tadica SD, Griffithsa D, Murrina A, et al. Brain activity during bladder filling is related to white matter structural changes in older women with urinary incontinence. 2010. Jul 15;51(4):1294-302. 22. Ransmayer G, Hollinger S, Schletterer K, et al. Lower urinary tract symptoms in dementia with Lewy bodies, Parkinson disease, and Alzheimer disease. 2008. Jan 22;70(4):299-303. 23. Araki I, Kitahara M, Oida T, et al. Voiding dysfunction and Parkinson's disease: urodynamic abnormalities and urinary symptoms. 2000. Nov;164(5):1640-3. 24. Braak H, Ghebremedhin E, Rüb U, et al. Stages in the development of Parkinson’s disease-related pathology. 2004. Oct;318(1):121-34. 25. Berger Y, Blaivas JG, DeLaRocha ER, et al. Urodynamic findings in Parkinson's disease. 1987. Oct;138(4):836-8. 26. Andersen. Disturbances of bladder and urethral function in Parkinson's disease. 1985. 17(1):35-41. 27. Campos-Sousa RN, Quagliato E, Borges da Silva B, et. al. Urinary symptoms in Parkinson's disease: prevalence and associated factors. 2003. Jun;61(2B):35963. 59 28. Sakakibara R, Shinotoh H, Uchiyama T, et.al. Questionnaire-based assessment of pelvic organ dysfunction in Parkinson's disease. 2001. Sep 17;92(1-2):76-85. 29. Yoshimura N, Kuno S, Chancellor MB, et al. Dopaminergic mechanisms underlying bladder hyperactivity in rats with a unilateral 6-hydroxydopamine (6OHDA) lesion of the nigrostriatal pathway. 2003. Aug;139(8):1425-32. 30. Cochen De Cock V, Abouda M, Leu S, et al. Is obstructive sleep apnea a problem in Parkinson’s disease? 2010. Mar;11(3):247-52. 31. Gomez-Esteban JC, Zarranz JJ, Lezcano E, et al. Sleep complaints and their relation with drug treatment in patients suffering from Parkinson's disease. 2006. Jul;21(7):983-8. 32. Menza M, DeFronzo Dobkin R, Marin H, et al. Sleep disturbances in Parkinson's disease. 2010. 1:S117-22. 33. Saunders JB, Schuckit MA. The development of a research agenda for substance use disorders diagnosis in the Diagnostic and Statistical Manual of Mental Disorders, fifth edition (DSM-V). 2006. Sep;101 Suppl 1:1-5. 34. Sakakibara R, Kishi M, Ogawa E, et al. Bladder, bowel, and sexual dysfunction in Parkinson's disease. 2011. 2011:924605. 35. Sakakibara R, Uchiyama T, Yamanish T, et al. Genitourinary dysfunction in Parkinson's disease. 2010. Jan 15;25(1):2-12. 36. Sammour ZM, Gomes CM, Barbosa ER, et al. Voiding dysfunction in patients with Parkinson's disease: impact of neurological impairment and clinical parameters. 2009. 28(6):510-5. 37. Sakakibara R, Hattori T, Yasuda K, et al. Micturitional disturbance and the pontine tegmental lesion: urodynamic and MRI analyses of vascular cases. 1996. Sep 15;141(1-2):105-10. 38. Hemmett L, Holmes J, Barnes M, et al. What drives quality of life in multiple sclerosis? 2004. Oct;97(10):671-6. 39. Panicker J, Nagaraja D, Kovoor J, et al. Lower urinary tract dysfunction in acute disseminated encephalomyelitis. 2009. Sep;15(9):1118-22. 40. Mahajan ST, Patel PB, Marrie RA. Under treatment of overactive bladder symptoms in patients with multiple sclerosis: an ancillary analysis of the NARCOMS Patient Registry. 2010. Apr;183(4):1432-7. 60 41. Burks J, Chancellor M, Bates D, et al. Development and validation of the actionable bladder symptom screening tool for multiple sclerosis patients. 2013. Winter;15(4):182-92. 42. Fowler CJ, Panicker JN, Drake M, et al. A UK consensus on the management of the bladder in multiple sclerosis. 2009. May;80(5):470-7. 43. Buljevac D, Flach HZ, Hop WC, et al. Prospective study on the relationship between infections and multiple sclerosis exacerbations. 2002. May;125(Pt 5):95260. 44. [Online 18. Oktober 2016.] http://www.urotoday.com/categories/1547- conferences/sufu-wm-2014/sufu-wm-2014-session-highlights/69088-sufu-wm2014-factors-influencing-barriers-to-care-in-patients-with-multiple-sclerosis-mscomplaining-of-urinary-symptoms-based-on-the-actionable-bladder. 45. Podnar. Utility of sphincter electromyography and sacral reflex studies in women with cauda equina lesions. 2014. Apr;33(4):426-30. 46. Podnar S, Trsinar B, Vodusek DB. Bladder dysfunction in patients with cauda equina lesions. 2006. 25(1):23-31. 47. Hill SR, Fayyad AM, Jones GR. Diabetes mellitus and female lower urinary tract symptoms: a review. 2008. 27(5):362-7. 48. Andrade. Lower urinary tract dysfunction in familial amyloidotic polyneuropathy, Portuguese type. 2009. 28(1):26-32. 49. Lobato. Portuguese-type amyloidosis (transthyretin amyloidosis, ATTR V30M). 2003. May-Jun;16(3):438-42. 50. Adams D, Samuel D, Goulon-Goeau C, et al. The course and prognostic factors of familial amyloid polyneuropathy after liver transplantation. 2000. Jul;123 ( Pt 7):1495-504. 51. Dasgupta R, Wiseman OJ, Kitchen N, et al. Long-term results of sacral neuromodulation for women. London : s.n., 2004. Aug;94(3):335-7. 52. Ellegast. Basics Klinische Pharmakologie. 3. Auflage. München: Elsevier, 2015. 53. Möller HJ, Laux G, Kapfhammer HP. Psychiatrie, Psychosomatik, Psychotherapie, Band 1: Allgemeine Psychiatrie. 4. Auflage. Berlin Heidelberg: Springer-Verlag GmbH, 2011. 54. Prometax 1,5mg-Hartkapseln Fachinformation Austria Codex 2016. [Online] http://www.pharmazie.com/graphic/A/13/0-90213.pdf. 61 55. Reminyl 4mg-Filmtabletten Fachinformation Austria Codex 2016. [Online] http://www.pharmazie.com/graphic/A/51/1-23751.pdf. 56. Aricept 5mg-Filmtabletten Fachinformation Austria Codex 2016. [Online] http://www.pharmazie.com/graphic/A/56/1-22056.pdf. 57. Mutschler E, Arzneimittelwirkungen. Geisslinger 10. G, Kroemer Auflage. H, et Stuttgart: al. Mutschler Wissenschaftliche Verlagsgesellschaft mbH, 2013. 58. Ebixa 10 mg-Filmtabletten Fachinformation Austria Codex 2016. [Online] http://www.pharmazie.com/graphic/A/84/0-90584.pdf. 59. Lüllmann H, Mohr K, Wehling M, et al. Pharmakologie und Toxikologie. 18. Auflage. Stuttgart: Georg Thieme Verlag KG, 2016. 60. Saroten 10 mg-Filmtabletten Fachinformation Austria Codex 2016. [Online] http://www.pharmazie.com/graphic/A/34/0-11734.pdf. 61. Fluctine 20mg-Kapseln Fachinformation Austria Codex 2016. [Online] http://www.pharmazie.com/graphic/A/70/1-18570.pdf. 62. Citalopram Sandoz 10mg-Filmtabletten Fachinformation Austria Codex 2016. [Online] http://www.pharmazie.com/graphic/A/61/1-24561.pdf. 63. Aktories K, Föstermann U, Hofmann FB, et al. Allgemeine und spezielle Pharmakologie und Toxikologie. 11. Auflage. München: Elsevier GmbH, 2013. 64. Graefe KH, Lutz W, Bönisch H. Duale Reihe: Pharmakologie und Toxikologie. 2. Auflage. Stuttgart: Georg Thieme Verlag KG, 2016. 65. Neurotop 400 mg-Tabletten Fachinformation Austria Codex 2016. [Online] http://www.pharmazie.com/graphic/A/26/1-18026.pdf. 66. Rivotril “Roche” 0,5 mg-Tabletten Fachinformation Austria Codex 2016. [Online] http://www.pharmazie.com/graphic/A/43/0-15943.pdf. 67. Propofol “Fresenius” 1% mit MCT-Emulsion zur Injektion oder Infusion Fachinformation Austria Codex 2016. [Online] http://www.pharmazie.com/graphic/A/30/1-25830.pdf. 68. Thiopental medicamentum 1 g-Trockenstechampulle Fachinformation Austria Codex 2016. [Online] http://www.pharmazie.com/graphic/A/36/0-71236.pdf. 69. HALDOL 1 mg-Tabletten Fachinformation Austria Codex 2016. [Online] http://www.pharmazie.com/graphic/A/06/0-14106.pdf. 70. Nozinan 25 mg-Filmtabletten Fachinformation Austria Codex 2016. [Online] http://www.pharmazie.com/graphic/A/16/0-10816.pdf. 62 71. ZYPREXA 2,5mg-überzogene Tabletten Fachinformation Austria Codex 2016. [Online] http://www.pharmazie.com/graphic/A/37/0-90037.pdf. 72. RISPERDAL 1mg-Filmtabletten Fachinformation Austria Codex 2016. [Online] http://www.pharmazie.com/graphic/A/97/1-20297.pdf. 73. Zeldox 20 mg-Hartkapseln Fachinformation Austria Codex 2016. [Online] http://www.pharmazie.com/graphic/A/61/1-24361.pdf. 74. Seroquel 25 mg-Filmtabletten Fachinformation Austria Codex 2016. [Online] http://www.pharmazie.com/graphic/A/60/1-23460.pdf. 75. Leponex 25mg-Tabletten Fachinformation Austria Codex 2016. [Online] http://www.pharmazie.com/graphic/A/32/0-15132.pdf. 76. Sinemet 25 mg/250 mg-Tabletten Fachinformation Austria Codex 2016. [Online] http://www.pharmazie.com/graphic/A/15/0-15715.pdf. 77. Comtan 200mg-Filmtabletten Fachinformation Austria Codex 2016. [Online] http://www.pharmazie.com/graphic/A/75/0-90175.pdf. 78. PK-Merz-Schoeller-Filmtabletten Fachinformation Austria Codex 2016. [Online] http://www.pharmazie.com/graphic/A/18/0-15018.pdf. 79. Akineton 5 mg-Injektionslösung Fachinformation Austria Codex 2016. [Online] http://www.pharmazie.com/graphic/A/34/0-10234.pdf. 63 64