PD Dr - Institut für Biochemie
Werbung

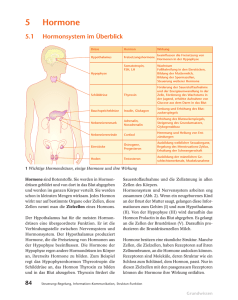
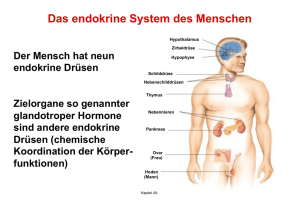
Prof. Dr. KH Friedrich, UKJ, Institut für Biochemie II Hormone und Signaltransduktion Vorlesung WS 2013/14 1. Übersicht, Wiederholung: Prinzipien der Signaltransduktion, Rezeptoren und Liganden, „Pathways“ 2. Schnelle Stoffwechselregulation: Insulin, Glucagon; Catecholamine 3. Die Organisation des glandulären Systems 4. Die Hypothalamus-Hypophysen-Schilddrüsenachse: T3, T4 5. Die Hypothalamus-Hypophysen-NNR-Achse: Cortisol, Glucocorticoide 6. Die Hypothalamus-Hypophysen-Gonadenachse: Androgene; Estrogene, Gestagene 7. Lokale Kommunikation zwischen Zellen: Gewebshormone; Cytokine 8. Hormonelle Regulation des Wachstums 9. Steuerung von Wasser- und Elektrolythaushalt 1. Übersicht, Wiederholung: Prinzipien der Signaltransduktion, Rezeptoren und Liganden, „Pathways“ „Signaltransduktion“ beschreibt die Erzeugung, Weiterleitung und Wirkung von Information in lebenden Systemen. Wir können Signaltransduktion auf verschiedenen Organisationsebenen (Moleküle, Zellen, Gewebe, der Gesamtorganismus) beobachten und unterscheiden „chemische“ und „elektrische“ Übertragung von Information. Für die Medizin ist das Gebiet von grundlegender Bedeutung, weil viele (wenn nicht letztlich alle) Krankheiten mit fehlerhaften Signaltransduktions-Prozessen assoziiert sind, deren gezielte pharmazeutische Beeinflussung zu den Zielen der angewandten Forschung gehört. Vielversprechende Entwicklungen gibt es etwa bei neurologischen und Tumorerkrankungen oder chronischen Entzündungsprozessen. In der „gesunden“ Situation koordiniert Signaltransduktion vielfältige Zellfunktionen bei der Reaktion auf äußere Reize und bei der Regulation endogener Funktionen. Signalvermittelnde Botenstoffe gehören unterschiedlichen chemischen Substanzklassen an. Bei vielen handelt es sich um Proteine oder Peptide. Als Beispiele seien genannt die Cytokine (s.u.), das Wachstumshormon, die Stoffwechselregulatoren Insulin und Glucagon oder das follikelstimulierende Hormon. Manche Signalstoffe sind niedermolekulare Substanzen wie AminosäureAbkömmlinge (Beispiele: das Schilddrüsenhormon Tyroxin, Histamin als Entzündungsmediator sowie Adrenalin) oder Fettsäure -Derivate (die Eikosanoide, Prostaglandine und Leukotriene, die als Gewebshormone wirken. Steroide wie Cortisol, Testosteron, Estrogen und Aldosteron stammen vom Cholesterol ab. Die Steroide wie auch die Schilddrüsenhormone sind aufgrund ihres lipophilen Charakters fähig, Membranen zu durchdringen und finden ihre Rezeptoren im Cytoplasma, die meisten anderen Signalmoleküle bedienen sich jedoch membranständiger Rezeptoren zur Signalvermittlung ins Zellinnere. Rezeptoren lassen sich in Familien mit gemeinsamen strukturellen und funktionellen Eigenschaften gruppieren. Eine grundsätzliche Unterscheidung ist zunächst die in membranständige und intrazelluläre Rezeptoren. Intrazelluläre Rezeptoren sind solche für lipophile und damit membrangängige Liganden wie Steroide. Sie werden durch Bindung des Liganden in ihrer Konformation verändert und können dadurch in den Zellkern migriere n. Dort wirken sie als spezifische Transkriptionsfaktoren. Bei den Membranrezeptoren kennt man ligandenabhängige Ionen-Kanäle und Membranproteine, die direkt Signale ins Zellinnere weiterleiten. Sie tun dies entweder, indem durch ligandeninduzierte Aktivierung eine intrinsische enzymatische Aktivität angeschaltet oder durch Vermittlung von intrazellulären G-Proteinen die Bildung von „Second Messengern“ im Zellinneren ausgelöst wird. Liganden enzymatisch aktiver Rezeptoren sind beispielsweise Insulin, der „Epidermal Growth Factor“ (EGF) oder Cytokine. Adrenalin und Glucagon u.a. haben G-Proteingekoppelte Rezeptoren, der nicotinische Acetylcholin-Rezeptor ist ein Beispiel für einen ligandengesteuerten Ionenkanal. Aktivierte Rezeptoren tragen Signale ins Zellinnere, indem sie nachgeschaltete Reaktionswege starten und modulieren. Eine Folge fast aller bekannter Aktivierungsabläufe ist die hierdurch bewirkte Veränderung von Enzymaktivitäten. Rezeptoren können unmittelbar selbst enzymatische Aktivität besitzen, die durch den Ligandenkontakt eingeschaltet wird (z.B. “Rezeptor-Tyrosinkinasen”), oder sie können nach Aktivierung cytoplasmatische Kinasen und andere Enzyme in den Rezeptorkomplex rekrutieren. Die Änderung der Ionenkonzentration durch die Öffnung ligandenabhängiger Ionenkanäle kann zur Modulation enzymatischer Aktivitäten führen. Am Ende derartiger Enzymkaskaden oder „Pathways“ erreicht das Signal den Zellkern und die DNA. Es kommt zur spezifischen Beeinflussung der Transkription von Zielgenen und zur Realisierung zellulärer Programme wie Proliferation, Differenzierung und Zelltod. So kompliziert die zelluläre Signalverarbeitung auch erscheinen mag, beruht sie doch auf wenigen generellen Mechanismen: 1. Reversible kovalente Protein-Modifikation Ihre wichtigste Art ist die Phosphorylierung. Reversible Proteinphosphorylierung von Serin/Threonin- und Tyrosin-Resten durch Kinasen und Phosphatasen ist in eukaryontischen Zellen die vorherrschende Strategie, die Aktivität von Proteinen zu kontrollieren. Ser/Thr-Phosphorylierung ist z.B. an der Regulation vieler Enzyme des Stoffwechsels beteiligt. Tyr-Phosphorylierung steuert viele Vorgänge, die mit dem Ablauf zellulärer Wachstums- und Teilungsprozesse zu tun haben. 2. Reversible Bildung von Multiprotein-Komplexen Vorübergehendes Zusammenlagern von Signalproteinen (etwa im Komplex mit aktivierten Rezeptoren) ist ein Weg, Signale gezielt auf spezifischen Wegen weiterzuleiten. Viele an der Signaltransduktion beteiligte Proteine sind “modular” aufgebaut: Charakteristische Proteindomänen und Sequenzmotive tauchen in verschiedenen Kombinationen immer wieder auf und haben spezielle Bindungseigenschaften. Besonders wichtig ist die sehr verbreitete SH2- („Src homology 2“-) Domäne. SH2-Domänen sind für die spezifische Wechselwirkung von Proteinen mit phosphorylierten Tyrosinen und ihrer jeweiligen Umgebung in den jeweiligen Bindungspartnern verantwortlich und haben daher eine zentrale Bedeutung für Signalprozesse, die mit Tyrosinphosphorylierungen einhergehen. Einige interessante Signalproteine sind selbst keine Enzyme. Proteine wie Crk und GRB2 besitzen keine katalytische Domäne, sondern nur Strukturelemente, die an Protein-Protein Wechselwirkungen beteiligt sind. Diese Moleküle fungieren als sogenannte Adaptor-Proteine und organisieren die Ausbildung von MultiproteinKomplexen. 3. Reversible Aktivierung von Schalterproteinen Das kleine, wachstumsregulierende G-Protein Ras ist ein Beispiel für einen molekularen Schalter. Wenn es GTP gebunden hat, befindet es sich in einer aktiven Konformation und kann Signale weiterleiten, hat es jedoch statt dessen GDP gebunden (das durch Hydrolyse des GTP entsteht), ist es inaktiv. Auch heterotrimere G-Proteine, die die Signale mancher Rezeptoren weiterleiten, arbeiten nach diesem Schema. 4. Erzeugung intrazellulärer „Second Messenger“ Manche Rezeptoren bedienen sich sogenannter “Second Messenger”, kleiner Moleküle, die in der Zelle die Aktivität nachgeschalteter Enzyme steuern. Der bekannteste Second Messenger ist cyclisches AMP (cAMP). 5. Veränderung von intrazellulären Ionenkonzentrationen Signalprozesse können Ionenkanäle und Ionenpumpen beeinflussen. Eine herausragende Rolle spielt die Regulation der intrazellulären Konzentration von Ca 2+. Die Ca2+-Konzentration ist ein wichtiger Parameter, die Aktivität vieler signalleitender Enzyme (z.B. Protein-Kinasen) sind von ihr abhängig. Ein Beispiel hierfür sind die Calmodulin abhängigen “CaM-Kinasen”. Calmodulin ist ein Ca 2+-„Sensorprotein“, das durch Konformationsänderung auf unterschiedliche Calciumionen-Konzentrationen reagiert. 6. Spezifische Modulation der Genaktivität Das „Endergebnis“ der zellulären Signaltransduktion ist Genregulation auf Transkriptions-Ebene. Viele externe und interne Signale bewirken eine spezifische Regulation der Genexpression. Transkriptionsfaktoren bestimmen dabei die Aktivität von Promotoren, indem sie Chromatin-Rearrangements induzieren und Kontakt mit Erkennungssequenzen in der DNA sowie mit dem basalen Transkriptionsapparat aufnehmen. Die Aktivität der Transkriptionaktivatoren oder -repressoren für die DNA oder andere Proteine der Transkriptions -Maschinerie wird sehr häufig durch reversible Phosphorylierung, manchmal auch durch Effektor-Bindung oder InhibitorEntfernung gesteuert. Auch die Kerngängigkeit, eine Voraussetzung für die Funktion bei der Genregulation, kann vom signalinduzierten Phosphorylierungs - oder Bindungszustand abhängen. 2. Schnelle Stoffwechselregulation: Insulin, Glucagon; Catecholamine Der Energiestoffwechsel des Organismus passt sich den beiden unterschiedlichen Zuständen der Resorptions- und Postresorptionsphase an. Die zwei wichtigsten Hormone, die die entsprechenden Regulationsvorgänge organisieren sind Insulin und Glucagon. Sie sind Gegenspieler bei der Steuerung des Stoffwechsels. Insulin wirkt auf das Fettgewebe, Leber und Muskelzellen und sorgt für ein Absinken des Blutspiegels von Glucose, Aminosäuren, Fettsäuren und Ketonkörpern. Glucagon, das im wesentlichen nur Leber- und Fettzellen beeinflusst, bewirkt im Gegensatz dazu einen Anstieg von Glucose-, Fettsäure- und Ketonkörper-Konzentration im Blut. Insulin und Glucagon werden im endokrinen Teil des Pankreas gebildet, das Insulin in den -, Glucagon in den -Zellen. Beide Hormone sind Proteine (Insulin besteht aus zwei Polypeptidkette, Glucagon aus nur einer) und entstehen unter posttranslationaler Prozessierung von Vorläufermolekülen (Prohormonen). Insulin wird in in der Resorptionsphase ausgeschüttet und vermittelt die Aufnahme und Weiterverarbeitung von Nährstoffen sowie das Anlegen von Depots. Die Sekretion von Insulin durch die -Zellen des Pankreas wird durch die GlucoseKonzentration im Blut gesteuert. Der zugrunde liegende Mechanismus umfasst Glucose-Aufnahme durch einen hochaffinen Transporter, Bildung von ATP, Verschluss ATP-abhängiger Kalium-Kanäle, Depolarisierung der Zellmembran und dadurch verursachte Öffnung von spannungsgesteuerten Calcium -Kanälen. Die einströmenden Calcium-Ionen sind schließlich verantwortlich für die Biosynthese und Ausschüttung des Insulins. Wichtig ist, dass die K-Kanäle durch Sulfonylharnstoffe blockiert werden können, wodurch es zu einer verstärkten Insulin-Synthese kommt. Dies eine Möglichkeit der Behandlung von Typ II-Diabetes. Die Stoffwechselregulation durch Insulin beruht auf einer Kombination von schnellen und langsamen Effekten. Die schnellen Effekte finden auf Proteinebene statt. Zu ihnen gehört die Steigerung des Glucose - und Aminosäuretransports im Skelettmuskel, die Aktivierung der Glycogensynthase und die Aktivierung der cAMPspezifischen Phosphodiesterase (Senkung der cAMP-Konzentration). Langfristige Effekte kommen durch insulininduzierte Veränderung der Genexpression zustande. Hierzu zählt die Induktion von Enzymen der Glycolyse (z.B. Phosphofructokinase) und die Repression von Enzymen der Gluconeogenese. Die zellulären Effekte von Insulin werden durch den Insulin-Rezeptor vermittelt, bei dem es sich um eine Rezeptor-Tyrosinkinase handelt. Nach Aktivierung durch Insulin bindet und phosphoryliert er u.a. das "Insulin Rezeptor Substrat 1" (IRS-1), ein großes Adapterprotein, welches als vielseitiger Verteiler von Signalen wirkt. Unter Vermittlung weiterer Signalmediatoren bewirkt IRS-1 die Translokation des „insulinabhängigen“ Glucose-Transporters GLUT-4 aus intrazellulären Speicher- Vesikeln in die Zellmembran. GLUT-4 sorgt nun für einen charakteristischen InsulinEffekt, nämlich für die Aufnahme von Glucose aus dem Blut. Störungen der Insulinfunktion führen bekannterweise zum Diabetes mellitus. Man unterscheidet Diabetes Typ I und Typ II. Typ I (juveniler Diabetes) entsteht durch Insulinmangel, etwa in Folge eines Untergangs von Pankreasgewebe, Typ II (Altersdiabetes) beruht auf Störungen der Signalübertragung des Insulins, etwa in Folge einer verringerten Rezeptorexpression. Symptome von Diabetes sind u.a. Hyperglycämie, verminderte Proteinbiosynthese (Muskelschwund) und erhöhter Fettsäureabbau (Acidose). Eine schnelle Anpassung des Stoffwechsels an Stresssituationen wird durch Catecholamine bewerkstelligt. Adrenalin und Noradrenalin werden im Nebennierenmark auf nervale und hormonelle Reize hin (Glucocorticoide, s.u.) aus Phenylalanin bzw. Tyrosin synthetisiert. Es gibt funktions - und gewebespezifische Catecholamin-Rezeptoren, die alle G-Protein-gekoppelt sind. Beispiele sind der 1Rezeptor, der in glatten Muskelzellen Kontraktionsvorgänge kontrolliert, der 1Rezeptor, der Herzmuskel-Kontraktion bewirkt und der 2-Rezeptor, der in Leberzellen die Glycogenolyse stimuliert. Die vielfältigen Effekte, die von den unterschiedlichen Rezeptoren vermittelt werden, sorgen für eine kurzfristige Mobilisierung des Organismus. Überproduktion von Catecholaminen, die durch Phäochromozytome verursacht werden kann, führt u.a. zu einer erhöhten Glucosekonzentration in Blut und Urin sowie zu vermehrter Bildung von Vanillinmandelsäure, dem Endprodukt des Catecholamin-Abbaus. 3. Die Organisation des glandulären Systems Das glanduläre System ist in sogenannten Achsen organisiert, die in hierarchischer Weise über zwischengeschaltete Hormone Signale vom Hypothalamus über die Hypophyse zu spezialisierten endokrinen Drüsen leiten. Interne und externe Stimuli veranlassen den Hypothalamus zur Synthese von „Releasing Hormones“ (Liberinen), und „Inhibiting Hormones“ (Statine n), die Peptide mit Längen zwischen 3 und 56 Aminosäure-Resten sind. Die Hypophyse wird durch die Liberine und Statine zur Sekretion von glandotropen Hormonen veranlasst, die ihrerseits über den Blutstrom Zielzellen erreichen, die (meist) in spezialisierten endokrinen Drüsen lokalisiert sind. Die Drüsenhormone aktivieren Rezeptoren in vielen Geweben und koordinieren globale Prozesse wie Wachstum, Differenzierung und Stoffwechsel. Das glanduläre System umfasst auch negative Kontrollvorgänge, d.h. Rückkopplungsprozesse, die die aktivierenden Signale begrenzen. „Short loop Feedback“ bedeutet dabei, dass Hormone der Hypophyse inhibierend auf den Hypothalamus zurückwirken und die Ausschüttung von Liberinen bremsen, „Long loop Feedbacks“ sind negative Rückwirkungen von Drüsenhormonen auf das Hypothalamus/Hypophysen-System. Hormonproduktion und –wirkung bilden ein komplexes Netzwerk im Organismus. Proliferation, Wachstum und Entwicklung, Stoffwechsel, Verdauung und Homöostase werden durch Hormone positiv und negativ beeinflusst. Die Intensität der Hormonwirkung wird letztlich durch das Summe der Prozesse der HormonBiosynthese aus Vorstufen (in Drüsenzellen), des Hormon-Transports (evtl. durch spezifische Carrier), des Abbaus und der Ausscheidung von Hormonen bestimmt. Wenn dieses System fehlreguliert ist, kommt es zu endokrinen Störungen, d.h. Überund Unterfunktionen. Man unterscheidet „primäre Störungen“ durch Defekte an der endokrinen Drüse (Aplasie, Hypoplasie, Entzündung, Mangeldurchblutung, Tumor) und „sekundäre Störungen“, die durch Defekte am übergeordneten Regulator oder Erfolgsorgan oder durch Probleme beim Transport oder Stoffwechsel der Hormone entstehen. 4. Die Hypothalamus-Hypophysen-Schilddrüsenachse: T3, T4 Der Hypothalamus steuert über zwei Zwischenstufen die Ausschüttung der Schilddrüsenhormone T3 (Trijodthyronin) und T4 (Thyroxin). Vom Hypothalamus wird TRH (das „TSH releasing hormone) sezerniert. Es handelt sich um ein Tripeptid, das durch Proteolyse aus einem Prohormon gebildet wird. Das von der Hypophyse produzierte Thyroidea stimulierende Hormon TSH ist ein Protein aus zwei Untereinheiten ( und ), die -Untereinheit ist zugleich auch Bestandteil des Luteinisiernden Hormons (LH) und des Follikelstimulierenden Hormons (FSH). Die jodhaltigen Schilddrüsenhormone T3 und T4 entstehen in den Schilddrüsenfollikeln aus dem tyrosinhaltigen Prohormon Thyreoglobulin. Die Bildung von T3 und T4 in den Thyreocyten ist ein komplizierter mehrstufiger Prozess, der Jodaufnahme, Oxidation, Proteolyse und Sekretion umfasst. Alle diese Prozesse werden durch TSH reguliert. Die jodhaltigen Enzyme, von denen T3 das dreifach wirksamere ist, werden hauptsächlich durch das Thyroxin-bindende Globulin transportiert. In der Peripherie wird T4, das eine Art Depot darstellt, in T3 umgewandelt. Sowohl T3 als auch T4 sind an ein negatives Rückkopplungsnetzwerk eingebunden, beide Hormone inhibieren die Ausschüttung von TRH durch den Hypothalamus und von TSH durch die Hypophyse. Die Schildrüsenhormone wirken auf Stoffwechsel, Wachstum und Entwicklung sowie auf die Herzfunktion. Bei den Stoffwechselwirkungen sind die Vermehrung von Grundumsatz, O2 -Verbrauch und Wärmeproduktion zu nennen sowie die Steigerung von Gluconeogenese, Glycogenabbau und Lipolyse. Wachstum und Entwicklung werden durch eine Stimulation der Somatotropin-Bildung in der Hypophyse (s.u.) gefördert. Die Schilddrüsenhormone sind essentiell für die embryonale Gehirnentwicklung. Auf das Herz wirken sie durch eine Induktion von -adrenergen Rezeptoren (höhere Catecholamin-Empfindlichkeit) und durch Erhöhung von Kontraktilität und Schlagfrequenz. Die Thyroidhormon-Rezeptoren sind intrazellulär und fungieren nach Aktivierung als Transkriptionsfaktoren. Überfunktion der Schilddrüse (Hyperthyreose), z.B. durch Tumoren oder Autoantikörper gegen den TSH-Rezeptor, die wie das Hormon wirken, führen zu charakteristischen Symptomen. Typisch für Morbus Basedow ist die sog. „Merseburg-Trias“, eine Kombination von Struma (Kropf), Tachykardie und Exophtalmus (hervortretende Augen). Hypothyreose, z.B. durch Jodmangel, manifestiert sich in reduziertem Metabolismus, Bradykardie und Myxödem (Weichteilschwellung). Ein unbehandelter kindlicher Mangel an Schildrüsenhormonen führt zum Kretinismus. 5. Die Hypothalamus-Hypophysen-NNR-Achse: Cortisol, Glucocorticoide Diese Achse ist von entscheidender Bedeutung für die Reaktion des Organismus auf Stress. Der Hypothalamus sezerniert nach einem tageszeitlichen Rhythmus (frühmorgens häufiger) in Pulsen wird CRH (das „Corticotropin releasing hormone“), ein 41 Aminosäurereste langes Peptid, das aus einem viel größeren Prohormon freigesetz wird. CRH ist zentrale Komponente der Stressantwort, es steigert Aufmerksamkeit, Muskelreflexe und Konzentration, senkt den Appetit und erhöht die Schmerzschwelle. In Reaktion auf CRH produziert die Hypophyse, ebenfalls pulsatil ACTH, das adrenocorticotrope Hormon. ACTH wird mit mehreren anderen Hormonen (LPH: lipotropes Hormon, MSH: Melanocyten stimulierendes Hormon) sowie Endorphinen durch Proteolyse aus einem gemeinsamen Vorläuferprotein, dem Proopiomelanocortin (POMC) gebildet. In der Nebennierenrinde induziert der hormonaktivierte ACTH-Rezeptor (über GProteine) sowohl die Freisetzung von Cholesterin aus Depots als auch seine Aufnahme und Neusynthese. Cholesterin ist die Vorstufe der Cortisol-Synthese, die zunächst in den Mitochondrien durch die Bildung von Pregnenolon beginnt. In den beiden Kompartimenten Mitochondrium und Endoplasmatisches Reticulum wird über mehrere Zwischenstufen (wichtig: Progesteron) das Cortisol gebildet, welches ins Plasma abgegeben und dort zum Großteil von dem Transportprotein Transcortin gebunden wird. Neben Cortisol, dem wichtigsten Glucocorticoid, werden aus den Zwischenprodukten Pregnenolon und Progesteron auch die Androgene (Testosteron u.a.) und davon ausgehend die Estrogene wie Estradiol gebildet. Letzeres geschieht zum größten Teil in den Gonaden (s.u.). Progesteron ist auch Zwischenprodukt bei der Synthese der Mineralcorticoide (Aldosteron). Die Glucocorticoide beeinflussen den Stoffwechsel, das Immunsystem und andere Gewebe und sind von größter pharmazeutischer Bedeutung. In Übereinstimmung mit seiner Funktion als Stresshormon erhöht Cortisol den Blutspiegel metabolisierbarer Moleküle, also von Glucose, Aminosäuren, Fettsäuren und Glycerin. Die Effekte von Adrenalin und Glucagon werden verstärkt und verlängert, es kommt zur Steigerung von Gluconeogenese und Glycogenabbau in der Leber, von Proteolyse und Lipolyse in der Peripherie. Cortisol sowie synthetische Glucocorticoide (z.B. Dexamethason) supprimieren die Immunantwort und Entzündungsprozesse. Das geschieht durch die Reduktion der Produktion von entzündungsauslösenden und erhaltenden Cytokinen, durch Verminderung der Zellmigration und insbesondere durch Hemmung der Synthese von Eicosanoiden (Entzündungsmediatoren). Cortisol wirkt auch auf das Bindegewebe, es stört Collagensynthese und Wundheilung und vermindert die Calciumresorption. Das Syndrom des Hypercortisolismus (Morbus Cushing) entsteht insbesondere durch Tumoren (Hypothalamus/Hypophyse oder ACTH-produzierendes BronchialCA) und ist geprägt durch Hypertonie, Stammfettsucht, Osteoporose und eine Verminderung von Immunzellen. Hypocortisolismus (Morbus Addison) ist meist Folge einer Autoimmunerkrankung der Nebennieren und geht mit Hypotonie, Gewichtsabnahme und einer charakteristischen braunen Hautpigmentierung einher („Bronze-Krankheit“). Bei genetisch bedingter Störung der Cortisol-Biosynthese kann es zum androgenetischen Syndrom kommen. Wenn das Enzym 21-Hydroxylase, das für die Umsetzung von Pregnenolon bzw. Progesteron zum Cortisol essentiell ist, ausfällt, wird aus Progesteron vermehrt Testosteron gebildet. Das führt zu einer verfrühten Pubertät bei Jungen und einer Virilisierung bei Mädchen. 6. Die Hypothalamus-Hypophysen-Gonadenachse: Androgene; Estrogene, Gestagene Die Mechanismen der Sexualhormon-Funktion sind bei beiden Geschlechtern sehr ähnlich. Alle männlichen und weiblichen Hormone kommen bei Mann und Frau vor, nur die Konzentrationen und Verhältnisse zueinander sind verschieden. Im Hypothalamus wird LH-RH („LH-releasing hormone“), ein Dakapeptid, gebildet. Es stimuliert in der Hypophyse die Produktion von LH (Luteinisierendes Hormon) und FSH (Follekelstimulierendes Hormon). Beide sind Protein-Dimere, die ihre Untereinheit mit anderen glandotropen Hormonen wie dem TSH (s.o.) teilen. Die Vernetzungs- und Rückkopplungsmechanismen der Hypothalamus -HypophysenGonadenachse lassen sich am besten an den Abläufen bei der der Spermatogenese aufzeigen: Zwei Zelltypen in den Testes sind beteiligt, die Leydig-Zellen und die Sertolizellen. Leydig-Zellen reagieren auf LH durch Synthese von Testosteron, welches seinerseits Rezeptoren in Sertolizellen anspricht, und dort für ein aufrecht erhalten er Spermatogenese sorgt. Eine negative Rückkopplung findet auf zwei Ebenen statt, zum einen durch einen inhibierenden Effekt von Testosteron auf die LH-RH-Sekretion des Hypothalamus und zum zweiten durch das Protein Inhibin, welches von den Sertoli-Zellen produziert wird und die LH/FSH-Ausschüttung durch die Hypophyse bremst. Testosteron hat pleiotrope Wirkungen und steuert insbesondere die Ausprägung der primären und sekundären männlichen Geschlechtsmerkmale. Das wirksamste Androgen ist nicht Testosteron selbst, sondern sein Derivat Dihydrotestosteron, welches in testosteronempfindlichen Geweben durch die 5 -Reduktase gebildet wird. Es gibt synthetische Androgene, die entweder agonistisch wirken und als Anabolika eingesetzt werden (z.B. für den Muskelaufbau…) oder pharmazeutisch als antagonistische Antiandrogene Verwendung finden, etwa bei der Behandlung hormonabhängiger Prostatacarcinome. Die weibliche Hormonachse ist ähnlich wie die männliche organisiert. Auch hier wirken die gonadotropen Hormone der Hypophyse auf zwei Zelltypen in der Keimdrüse, nämlich LH auf die Theca interna -Zellen, FSH auf die Granulosazellen. In den Theca-Zellen wird durch LH die Biosynthese von Androgenen induziert. Diese diffundieren in die Granulosazellen, wo sie durch das Enzym Aromatase in Estrogene umgewandelt werden. Die Estrogene sind für das Follikelwachstum verantwortlich. Auch hier gibt es eine negative Rückkopplung durch Inhibin auf die GonadotropinSekretion der Hypophyse, zusätzlich wirkt auch Estrogen auf die Hypophyse ein, und zwar in konzentrationsabhängiger Weise (niedrige Spiegel sind inhibierend, hohe stimulierend). Estrogene haben pleiotrope Wirkungen auf die Ausprägung der weiblichen Geschlechtsmerkmale, die ebenfalls in den Gonaden produzierten Gestagene (Progesteron) steigen in ihrer Konzentration während der Schwangerschaft an und sind für deren Aufrechterhaltung verantwortlich. Die Ausschüttung der gonadotropen Hormone bei der Frau variiert tageszeitlich und in den Lebensphasen. Insbesondere unterliegt der Spiegel sowohl von LH und FSH als auch der der Estrogene und Gestagene dem monatlichen Menstruationszyklus. Man kann den Zyklus in eine Phase der Follikelreifung (die mit dem Eisprung endet), eine Luteal- und eine Luteolyse-Phase einteilen. Charakteristisch ist ein starker Anstieg des Estrogen-Spiegels kurz vor der Ovulation, und einen durch positive Rückkopplung entstehenden Gipfel der LH- und FSH-Konzentrationen unmittelbar vor dem Eisprung. Für die Lutealphase ist ein hohes Progesteron-Level typisch, das ebenso wie das der Estrogene gegen Ende des Zyklus wieder abfällt, wenn es nicht zur Befruchtung kommt. Hormonelle Kontrazeption beruht auf einer Kombination von Estrogenen und Progesteronen in Konzentrationen, die zum einen den Eisprung durch Verhinderung des (rückkopplungsbedingten) LH-Gipfels unterdrücken und zum zweiten eine Schwangerschaft „vortäuschen“. 7. Lokale Kommunikation zwischen Zellen: Gewebshormone; Cytokine Im Gegensatz zu den glandulären Hormonen werden die sogenannten Gewebshormone oder „Mediatoren“ in verschiedenen, in den Geweben verstreuten Zellen synthetisiert. Es gibt meist keine Speicherform. Einige Gewebshormone wirken nur auf die unmittelbaren Nachbarzellen, einige werden aber auch über den Blutweg zu den Zielzellen transportiert. Bezüglich des chemischen Aufbaus sind Gewebshormone heterogen. Eine mögliche Einteilung der Gewebshormone (Mischung Struktur und Funktion) sieht aus wie folgt: 1. 2. 3. 4. 5. 6. Biogene Amine (Histamin, Serotonin u.a.) Kinine Prostaglandine und Leukotriene Gase (z.B. NO) Gastrointestinale Hormone Cytokine Biogene Amine entstehen durch Decarboxylierung aus Aminosäuren. So wird Histidin in Mastzellen aus Histamin durch eine His-Decarboxylase gebildet und in deren Granula gespeichert, kann aber auch in vielen anderen Körperzellen entstehen. Es ist auch Bestandteil von Pflanzen- und Insektengiften. Das Hormon hat sehr unterschiedliche Funktionen: So steuert es die Sekretion von Magensäure und ist an Entzündungen beteiligt, u.a. auch an der allergischen Sofortreaktion, wirkt gefäßdilatierend und fungiert als Neurotransmitter. Interessanterweise gibt es drei verschiedene (G-Protein-gekoppelte) Rezeptoren, über die Histidin gewebespezifische Reaktionen auslöst. Der H1 Rezeptor findet sich überall dort, wo auch Mastzellen zu finden sind, nämlich in den Schleimhäuten und in der Haut. Er vermittelt Kontraktion der glatten Muskulatur als Schutzmechanismus gegen das Eindringen von Antigenen und eine lokale Gefäßdilatation und starke Durchblutung der betroffenen Regionen. Der H2 Rezeptoren der Belegzellen in der Magenschleinhaut signalisiert HCl-Produktion, vermittelt über cAMP. Im ZNS findet sich zusätzlich ein H3 Rezeptor. Selektive Histidin-Rezeptor-Antagonisten sind wichtige Medikamente: Antiallergika, H2-Antagonisten Ulcus-Therapeutika. H1-Blocker sind Serotonin (5-Hydroxytryptamin) wird u.a. in enterochromaffinen Zellen des Intestinaltrakts und in Neuronen durch Decarboxylierung von Tryptophan gebildet, wobei als Zwischenprodukt 5-Hydroxtryptophan (5HT) beteiligt ist. Wie Histidin ist es sowohl Gewebshormon als auch Neurotransmitter. Es hat seinen Namen erhalten, weil es den Gefäßtonus erhöht und weil es bei der Serum-Bildung (also bei der Gerinnung) aus Thrombocyten freigesetzt wird. Serotonin hat weitere vielfältige Wirkungen, so fördert es Verdauungsvorgänge (Darmperistaltik), ist an einer lokalen Gefäßkontraktion der kranialen Gefäße beteiligt und kann unter Vermittlung des Nervus vagus Übelkeit und Schmerz bewirken. Die Serotonin-Effekte beruhen auf der Funktion unterschiedlicher Rezeptoren (5HT1, 5HT-2 und 5HT-4 sind GCRs, 5HT-3 ist ein K +-Ionenkanal), die von vielen Medikamenten und Drogen beinflusst werden. Manche Antidepressiva und Ecstasy verringern die Rückaufnahme von Serotonin in Synapsen, LSD ist ein Agonist des 5HT-2A Rezeptors, Antagonisten des 5HT-1 und 5HT-3 Rezeptors sind Mittel gegen Migräne bzw. Übelkeit. Kinine sind kleine Peptide, die Entzündungsprozesse beeinflussen. Kallidin ist zehn, Bradykinin neun Aminosäurereste lang. Beide werden durch spezifische Proteasen (Kallikreine) aus einer Vorstufe, dem in der Leber synthetisierten Plasmaprotein Kininogen freigesetzt. Die Kallikreine werden lokal aktiviert, sie entstammen dem plasmatischen Gerinnungssystem oder aus geschädigten Zellen. Die Wirkung der Kinine besteht darin, die Produktion nachgeschalteter Entzündungsmediatoren (Prostaglandine, NO) zu induzieren. Es kommt zur Vasodilatation, zur Kontraktion glatter Muskulator und zu chemotaktischen Signalen für Entzündungszellen. Es gibt zwei Rezeptoren: B2 ist ein konstitutiv exprimierter GCR, B2 wird nur bei Entzündungen induziert. Verschiedene Entzündungsmediatoren wie Histamin, Serotonin und Bradikinin induzieren (über rezeptorvermittelte Änderungen der Ca 2+-Konzentration) die Synthese der Eicosanoide. Sie wirken je nach Gewebe und aktiviertem Rezeptor (es gibt unterschiedliche GCRs) vasodilatierend oder konstringierend. Eicosanoide spielen auch bei der Geburt ein Rolle (Uteruskonstriktion). Diese wichtigen Derivate von C20-Fettsäuren umfassen u.a. Prostaglandine und Leukotriene. Ursprünglich leiten sich die Eicosanoide von mehrfach ungesättigten, essentiellen Fettsäuren wie der Arachidonsäure ab, die in Membranphospholipiden enthalten sind. Arachidonsäure wird durch die Ca 2+-regulierte Phospholipase A2 (PLA2) freigesetzt. Daraus wird zum einen Prostaglandin H, die „Muttersubstanz“ für alle Prostaglandine und Thromboxane (durch die PGH-Synthase) und zum zweiten die Leukotriene (durch die 5-Lipoxigenase) gebildet. Bestandteil der PGH-Synthase ist eine Cyclooxigenase (COX) als Schlüsselenzym, die eine sehr wichtige Zielstruktur für antientzündlich wirkenden P harmaka darstellt. Es gibt zwei COX-Isoformen – eine ubiquitäre, konstitutiv exprimierte COX1 und ein Isoenzym, das nur bei Entzündungen eine Rolle spielt (COX2). Entzündungen werden seit sehr langer Zeit mit Steroiden (PLA2-inhibierend), aber auch mit Hemmern der COX behandelt. Bis vor kurzem hatte man nur unspezifische Hemmer, die beide Isoenzyme blockieren wie Acetylsalicylsäure (Aspirin), was häufig zu Nebenwirkungen wie Bronchospasmus und Magenulcera führte. Inzwischen ist es gelungen, selektive COX2-Inhibitoren herzustellen. Seit relativ kurzer Zeit weiss man, dass auch Gase als Signalmoleküle und Gewebshormone wirken können, der Prototyp ist Stickoxid (NO). Je nach Kontext wirkt NO regulierend auf den Gefäßtonus, fördert die Herzkontraktion oder beeinflusst die Genexpression. NO wird durch Nitroxid-Synthasen (NOS) aus Arginin freigesetzt. Es gibt wenigstens drei Isoenzyme, die sich in ihrer Gewebeverteilung, Regulation und Expression unterscheiden. NOS I kommt konstitutiv in Neuronen vor, wird durch Stress und Zellschädigungen hoch- und durch Lipopolysaccharide herunterreguliert; NOS II kommt in Macrophagen vor, wird durch Cytokine und LPS induziert und durch Interleukin-4 und -10 reprimiert; NOS III findet sich konstitutiv im Epithel und wird durch Hypoxie reprimiert. Der Wirkungsmechanismus von NO verläuft über die Aktivierung von Guanylatcylasen. Ihr Produkt, der Second Messenger cGMP, aktiviert seinerseits cGMP-abhängige Proteinkinasen. Nitroglycerin ist ein NO-Donor und wird zur Therapie von Herzinsuffizienz und coronaren Durchblutungsstörungen eingesetzt. Zu den Gewebshormonen gehören auch die gastrointestinalen Hormone. Dabei handelt es sich um Peptide, die Verdauungsvorgänge steuern. Wichtig sind Gastrin (17 bzw. 34 Aminosäurereste), Secretin (27), Cholecystokinin/Pancrezymin (CCK/PZ, 33) und das Gastroinhibitorische Peptid (GIP, 43). Gastrin ist gemeinsam mit Histamin an der parakrinen Regulation der HCl-Sekretion durch die Belegzellen des Magens beteiligt. Es induziert zusätzlich die Produktion von Pepsinogen durch die Hauptzellen. Auch die Pankreas-Sekretion wird von Peptidhormonen gesteuert, nämlich u.a. von CCK/PZ und Secretin. Letzeres bewirkt zudem die Neutralisierung des sauren Speisebreis im Dünndarm. Zur Produktion von Secretin führt u.a. ein saurer pH und das Auftreten von Fettsäuren im Dünndarm. Somatostatin, das von den D-Zellen des Verdauungstraktes gebildet wird, hemmt alle gastrointestinalen Hormone. Die generelle Nahrungsaufnahme wird durch das Leptin-Rückkopplungssystem kontrolliert. Fettzellen produzieren Leptin (ein kleines Protein mit Ähnlichkeiten zu Cytokinen). Leptin hemmt im Gehirn die Ausschüttung der Substanz „NPY“, welche die Hungerempfindung bewirkt. Cytokine sind Vermittler der chemischen Kommunikation zwischen Zellen des blutbildenden und des Immunsystems. Sie lösen in ihren Zielzellen unterschiedliche Reaktionen wie "Überleben", Proliferation und Differenzierung aus. Wichtige Vertreter sind Interleukin- (IL-) 1 (Entzündungs- und Fieber-Mediator), IL-2 als Akti vator von TZellen sowie die antiviral wirkenden Interferone. Ebenfalls zu den Cytokinen gehören das Erythropoietin und die sog. Kolonie-stimulierenden Faktoren (CSFs), die als Signalmoleküle die Hämatopoiese steuern, in dem sie die Differenzierung von Stammzellen und die Proliferation von myeloiden und lymphoiden Zellen dirigieren. Cytokin-Rezeptoren, anders als die RTKs, können nicht durch eigene intrazelluläre Enzymaktivität Informationen ins Zellinnere weiterleiten. Sie aktivieren nach ligandeninduzierter Dimerisierung vielmehr cytoplasmatische Tyrosin-Kinasen, die mit den Rezeptormolekülen in schon vorher in Kontakt standen. Es handelt sich um rezeptorassoziierte Kinasen der JAK ("Janus Kinase")-Familie. Wichtige Phosphorylierungs-Substrate der JAKs sind Transkriptionsfaktoren aus der Gruppe der STATs ("Signal Transducers and Activators of Transcription"). Diese cytoplasmatischen Proteine werden nach Rekrutierung in den Rezeptorkomplex und Tyrosin-Phosphorylierung dimerisiert und wandern in dieser Form in den Zellkern, wo sie als Transkriptionsfaktoren für die Expression spezifischer Gene sorgen. 8. Hormonelle Regulation des Wachstums Eine weiteres wichtiges hormonelles Regelkreis-System kann man auch als „Wachstumshormon-Achse“ bezeichnen. Ihre Komponenten sind zunächst das GRH („Growth hormone releasing hormone“) des Hypothalamus (ein Peptid aus 44 Aminosäureresten) und das Wachstumshormon selbst, welches auch Somatotropin (ST) genannt wird. Somatotropin ist ein Protein, das strukturell mit den Cytokinen verwandt ist und wirkt auf seine Zielzellen unter Vermittlung eines Rezeptors, der funktionell zu den Cytokin-Rezeptoren gehört. Die Zielzellen des Wachstumshormons liegen in der Leber und vielen anderen Geweben. Sie produzieren in Reaktion auf ST-Stimulation Insulin-like Growth Factor (IGF-1), der die Signale im Organismus weiterträgt. Somatotropin wirkt „indirekt“, d.h. unter Vermittlung durch IGF-1 wachstumsfördernd, indem es die Synthese von Protein und Nucleinsäuren ankurbelt, die Zellprolifera tion beschleunigt und letztlich die Zunahme von Knochen-, Knorpel- und Muskelmasse bewirkt. „Direkte“, IGF-1-unabhängige Wirkungen von ST betreffen den Stoffwechsel: Es ist diabetogen, d.h. fördert Insulinresistenz, steigert den Blutglucose-Spiegel und führt zu verstärkter Lipolyse und Ketogenese. Ein Somatotropinmangel vor Epiphysenschluss führt zum Zwergwuchs, nach Epiphysenschluss zu Adiposits und Insulinresistenz-Syndrom. Bei ST-Überschuss vor Epiphysenschluss kommt es zu proportioniertem Riesenwuchs, nach Epiphysenschluss beobachtet man Akromegalie, d.h. das Auswachsen won peripherem Knorpel (Nase, Kinn). 9. Steuerung von Wasser- und Elektrolythaushalt Die hormonelle Regulation des Wasser- und Elektrolythaushaltes wirkt sich auf den Blutdruck aus. Drei unterschiedliche Hormonsysteme wirken blutdrucksteigernd (ADH, Aldosteron, Angiotensin), eines hat blutdrucksenkende Funktion (ANP). Das Antidiuretische Hormon (ADH), auch als Adiuretin oder Vasopressin bezeichnet, ist ein vom Hypophysen-Hinterlappen gebildetes Peptidhormon und fördert die Wasser-Rückresorption in der Niere durch die Induktion des Einbaus von Aquaporinen. Das Steroidhormon Aldosteron fördert die Na +- Retention in der Niere und kann medikamentöse durch Antagonisten effektiv gehemmt werden. Angiotensin II, das durch zwei Schritte limitierter Proteolyse aus Angiotensinogen hervorgeht, wirkt gefäßkonstriktorisch und aktiviert die Aldosteron-Sekretion. Das natriuretische Atriumpeptid (ANP), auch Atriopeptin genannt, wird von Cardiomyocyten als Reaktion auf Druckbelastung sezerniert und wirkt gefäßrelaxierend sowie natriuretisch.