Rechts oder links? Wie Nervenfasern ihren Weg finden
Werbung
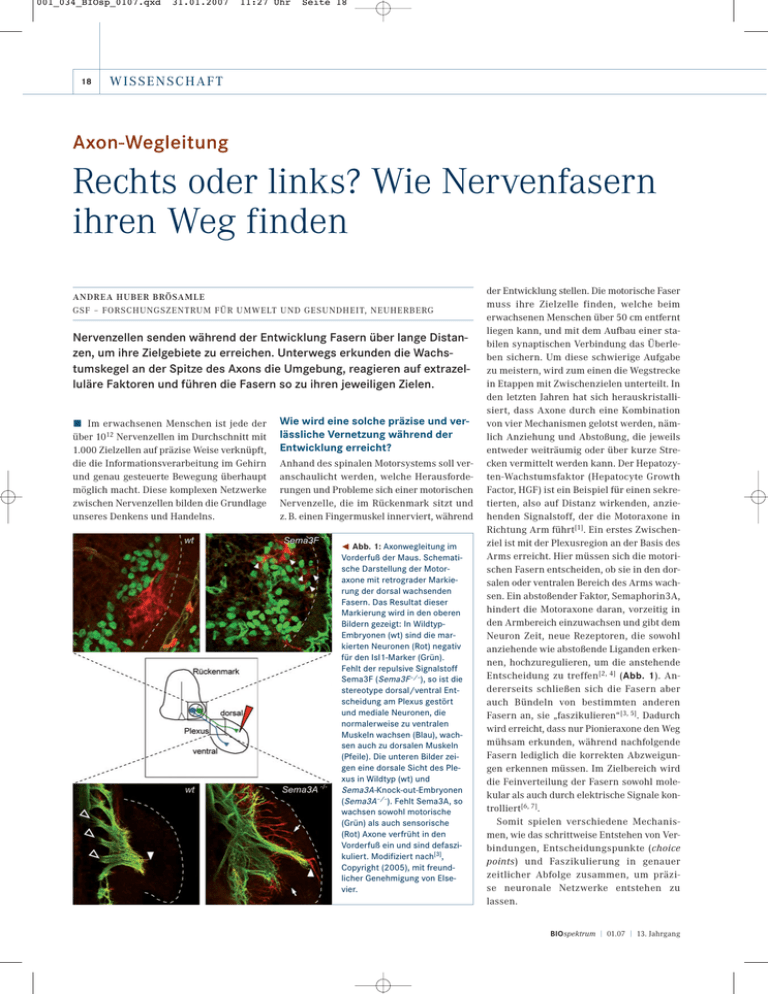
001_034_BIOsp_0107.qxd 18 31.01.2007 11:27 Uhr Seite 18 WISSENSCHAFT Axon-Wegleitung Rechts oder links? Wie Nervenfasern ihren Weg finden ANDREA HUBER BRÖSAMLE GSF – FORSCHUNGSZENTRUM FÜR UMWELT UND GESUNDHEIT, NEUHERBERG Nervenzellen senden während der Entwicklung Fasern über lange Distanzen, um ihre Zielgebiete zu erreichen. Unterwegs erkunden die Wachstumskegel an der Spitze des Axons die Umgebung, reagieren auf extrazelluläre Faktoren und führen die Fasern so zu ihren jeweiligen Zielen. ó Im erwachsenen Menschen ist jede der über 1012 Nervenzellen im Durchschnitt mit 1.000 Zielzellen auf präzise Weise verknüpft, die die Informationsverarbeitung im Gehirn und genau gesteuerte Bewegung überhaupt möglich macht. Diese komplexen Netzwerke zwischen Nervenzellen bilden die Grundlage unseres Denkens und Handelns. Wie wird eine solche präzise und verlässliche Vernetzung während der Entwicklung erreicht? Anhand des spinalen Motorsystems soll veranschaulicht werden, welche Herausforderungen und Probleme sich einer motorischen Nervenzelle, die im Rückenmark sitzt und z. B. einen Fingermuskel innerviert, während ¯ Abb. 1: Axonwegleitung im Vorderfuß der Maus. Schematische Darstellung der Motoraxone mit retrograder Markierung der dorsal wachsenden Fasern. Das Resultat dieser Markierung wird in den oberen Bildern gezeigt: In WildtypEmbryonen (wt) sind die markierten Neuronen (Rot) negativ für den Isl1-Marker (Grün). Fehlt der repulsive Signalstoff Sema3F (Sema3F–/–), so ist die stereotype dorsal/ventral Entscheidung am Plexus gestört und mediale Neuronen, die normalerweise zu ventralen Muskeln wachsen (Blau), wachsen auch zu dorsalen Muskeln (Pfeile). Die unteren Bilder zeigen eine dorsale Sicht des Plexus in Wildtyp (wt) und Sema3A-Knock-out-Embryonen (Sema3A–/–). Fehlt Sema3A, so wachsen sowohl motorische (Grün) als auch sensorische (Rot) Axone verfrüht in den Vorderfuß ein und sind defaszikuliert. Modifiziert nach[3], Copyright (2005), mit freundlicher Genehmigung von Elsevier. der Entwicklung stellen. Die motorische Faser muss ihre Zielzelle finden, welche beim erwachsenen Menschen über 50 cm entfernt liegen kann, und mit dem Aufbau einer stabilen synaptischen Verbindung das Überleben sichern. Um diese schwierige Aufgabe zu meistern, wird zum einen die Wegstrecke in Etappen mit Zwischenzielen unterteilt. In den letzten Jahren hat sich herauskristallisiert, dass Axone durch eine Kombination von vier Mechanismen gelotst werden, nämlich Anziehung und Abstoßung, die jeweils entweder weiträumig oder über kurze Strecken vermittelt werden kann. Der Hepatozyten-Wachstumsfaktor (Hepatocyte Growth Factor, HGF) ist ein Beispiel für einen sekretierten, also auf Distanz wirkenden, anziehenden Signalstoff, der die Motoraxone in Richtung Arm führt[1]. Ein erstes Zwischenziel ist mit der Plexusregion an der Basis des Arms erreicht. Hier müssen sich die motorischen Fasern entscheiden, ob sie in den dorsalen oder ventralen Bereich des Arms wachsen. Ein abstoßender Faktor, Semaphorin3A, hindert die Motoraxone daran, vorzeitig in den Armbereich einzuwachsen und gibt dem Neuron Zeit, neue Rezeptoren, die sowohl anziehende wie abstoßende Liganden erkennen, hochzuregulieren, um die anstehende Entscheidung zu treffen[2, 4] (Abb. 1). Andererseits schließen sich die Fasern aber auch Bündeln von bestimmten anderen Fasern an, sie „faszikulieren“[3, 5]. Dadurch wird erreicht, dass nur Pionieraxone den Weg mühsam erkunden, während nachfolgende Fasern lediglich die korrekten Abzweigungen erkennen müssen. Im Zielbereich wird die Feinverteilung der Fasern sowohl molekular als auch durch elektrische Signale kontrolliert[6, 7]. Somit spielen verschiedene Mechanismen, wie das schrittweise Entstehen von Verbindungen, Entscheidungspunkte (choice points) und Faszikulierung in genauer zeitlicher Abfolge zusammen, um präzise neuronale Netzwerke entstehen zu lassen. BIOspektrum | 01.07 | 13. Jahrgang 001_034_BIOsp_0107.qxd 31.01.2007 Wo liegen nun die unmittelbaren Herausforderungen des Forschungsgebietes? Ein Wachstumskegel sieht viele verschiedene Richtungsinformationen in Form von Ligand-Rezeptor-Paaren zur gleichen Zeit. Die Aufklärung der intrazellulären Signalweiterleitungsmaschinerie ist entscheidend um zu verstehen, auf welcher Ebene die verschiedenen Signale zusammenlaufen und integriert werden, sodass eine korrekte Reaktion des Zytoskeletts erfolgen kann. Es gibt nur eine endliche Anzahl von Wegleitungsfaktoren, zu wenige um jedes einzelne Neuron nach dem „Schlüssel-SchlossPrinzip“ an sein Ziel zu bringen. Durch kombinatorische Zusammensetzung von Rezeptorelementen kann die Wirkung von Signalstoffen jedoch moduliert und dadurch die möglichen Reaktionen um ein Vielfaches multipliziert werden. Die Aufklärung der Grundlagen der axonalen Wegleitung während der Entwicklung ist eine der großen Erfolgsgeschichten der molekularen Neurobiologie. Ein aufregendes neues Kapitel wird sein, herauszufinden welche Rolle diese molekularen Signalwege in der Regulierung von Plastizität und Regeneration im erwachsenen Nervensystem der Wirbeltiere haben. ó 11:27 Uhr Seite 19 Literatur [1] Ebens, A., Brose, K., Leonardo, E. D., Hanson, M. G., Bladt, F., Birchmeier, C., Barres, B. A., Tessier-Lavigne, M. (1996): Hepatocyte growth factor/scatter factor is an axonal chemoattractant and a neurotrophic factor for spinal motor neurons. Neuron 17: 1157–1172. [2] Kania, A., Jessell, T. M. (2003): Topographic motor projections in the limb imposed by LIM homeodomain protein regulation of ephrin-A:EphA interactions. Neuron 38: 581–596. [3] Huber, A. B., Kania, A., Tran, T. S., Gu, C., De Marco, N., Lieberam, I., Johnson, D., Jessell, T. M., Ginty, D. D., Kolodkin, A. L. (2005): Distinct roles for secreted semaphorin signaling in spinal motor axon guidance. Neuron 48: 949–964. [4] Kramer, E. R., Knott, L., Su, F., Dessaud, E., Krull, C. E., Helmbacher, F., Klein, R. (2006): Cooperation between GDNF/Ret and ephrinA/EphA4 signals for motor-axon pathway selection in the limb. Neuron 50: 35–47. [5] Landmesser, L., Dahm, L., Tang, J., Rutishauer, U. (1990): Polysialic acid as a regulator of intramuscular nerve branching during embryonic development. Neuron 4: 655–667. [6] Livet, J., Sigrist, M., Stroebel, S., De Paola, V., Price, S. R., Henderson, C. E., Jessell, T. M., Arber, S. (2002): ETS gene Pea3 controls the central position and terminal arborization of specific motor neuron pools. Neuron 35: 877–892. [7] Sanes, J. R., Lichtman, J. W. (2001): Induction, assembly, maturation and maintenance of a postsynaptic apparatus. Nat. Rev. Neurosci. 2: 791–805. Korrespondenzadresse: Dr. Andrea B. Huber Brösamle GSF – Forschungszentrum für Umwelt und Gesundheit Institut für Entwicklungsgenetik Ingolstädter Landstr. 1 D-85764 Neuherberg Tel.: 089-3187-4117 [email protected] AUTORIN Andrea Huber Brösamle (Jahrgang 1972) studierte Biologie an der Universität Basel und promovierte 2000 am Institut für Hirnforschung an der Eidgenössisch Technischen Hochschule (ETH). Während eines Postdoc Aufenthaltes an der Johns Hopkins University in Baltimore, USA, untersuchte sie die Rolle, die sekretierte repulsive Faktoren in der Entstehung des spinalen Motorsystems spielen. Seit 2006 leitet sie die Nachwuchsgruppe „Neuronal Circuit Formation“ an der GSF in Neuherberg. BIOspektrum | 01.07 | 13. Jahrgang