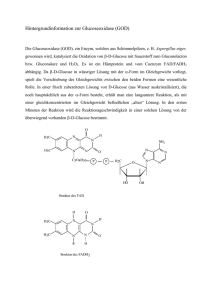
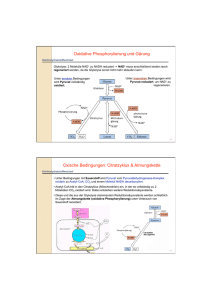
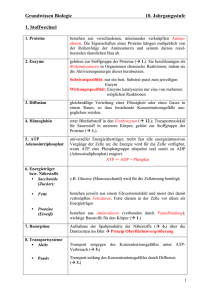
Stoffwechsel wichtiger Organe
Werbung

Grundpraktikum Humanbiologie I -Organstoffwechsel
Organstoffwechsel
Einführung
Für die Aufrechterhaltung von Vitalität, Vermehrung und Apoptose müssen alle Zellen und
Gewebe ständig Energie (in Form von ATP) erzeugen. Dazu müssen ihnen permanent Substrate zur Verfügung stehen, die von aussen, bzw. aus dem Blut, aufgenommen oder aus zwischenzeitig angelegten intrazellulären Speichern abgerufen werden. Der Mensch als 'chemotropher Organismus' erzeugt ATP vor allem durch sauerstoffabhängigen (aeroben) Abbau
dieser Substrate zu CO2 und H2O. Steht nicht genügend Sauerstoff zur Verfügung, können
einige Gewebe für eine gewisse Zeit ATP auch anaerob erzeugen, wobei als Endprodukt der
Glycolyse Lactat (Milchsäure) entsteht. In Zellen, die keine oder nur wenige Mitochondrien
besitzen, wird Lactat ständig gebildet und an das Blut abgegeben. Lactat wird überwiegend
von der Leber verwertet, die als zentrales Puffer- und Speicherorgan im Zusammenwirken mit
Muskulatur und Fettgewebe eine gleichmässige Energiesubstratversorgung des Körpers gewährleistet. Zu diesem Zweck können Lactat, Glycerol und glucogene Aminosäuren zur 'Gluconeogenese' und langkettige Fettsäuren zur 'Ketogenese' herangezogen werden.
Ziel
Dieser Versuch befasst sich exemplarisch mit den tiefgreifenden Stoffwechselumstellungen
wichtiger Organe, die durch Phasen der Nahrungsaufnahme und Verwertung ("Resorptionssphase" - Insulin dominiert) und durch Phasen, in denen keine Nahrung zur Verfügung
steht ("Postresorptionsphase" - Glucagon dominiert) vorgegeben sind.
ALLE PraktikumsteilnehmerInnen werden zu Probanden und ermitteln ihr Profil an BlutGlucose und Blut-Lactat wenn sie nach etwa 6 Stunden ohne Nahrungsaufnahme unterschiedlich belastet werden. Dazu wird eine Praktikumsgruppe in vier Untergruppen unterteilt
(unbedingt beim vorhergehenden Versuch absprechen !)
• Gruppe A testet ihre Stoffwechselumstellung während der Zufuhr größerer Mengen von
Glucose in Form eines oralen Glucose-Toleranz-Test (ergänzt durch Insulinbestimmung).
• Gruppe B testet ihre Stoffwechselumstellung bei der Zufuhr von komplexen Kohlenhydraten, z.B. verschiedenen Brötchen (ergänzt durch Insulinbestimmung).
• Gruppe C testet ihre Stoffwechselumstellung bei der Zufuhr von Protein und Fett (Eier)
• Gruppe D testet ihre Stoffwechselumstellung von körperlicher Ruhe zu mittelschwerer
Arbeit (Treppenlaufen über mehrere Stockwerke, ca. 150 W).
Methoden
Zur Bestimmung des Blutglucose- und Blutlactat-Profil über den Versuchszeitraum wird
mehrmals Blut aus der Fingerbeere entnommen. Die beiden Metabolite werden mittels optisch-enzymatischen Tests quantitativ bestimmt. Mit ausgewählten Proben wird ein InsulinELISA durchgeführt.
Stichworte zur Vorbereitung
Das Stoffgebiet dieses Versuchs ist sehr umfangreich; eine rechtzeitige gründliche Vorbereitung ist erforderlich. Das Lernziel wird durch die Fragen am Ende dieser Anleitung abgesteckt; diese enthalten auch die theoretischen und praktischen Grundlagen vorangegangener
Versuche sowie Methoden wie Photometrie, Fluorimetrie und Enzymatische Testverfahren..
Am Versuchstag
sollten alle PraktikumsteilnehmerInnen zum Versuchsbeginn um 14.00 Uhr in der "Postresorptionsphase" sein, d.h. ca 6 Std. nüchtern (s.u. → Wichtige Sicherheitshinweise). Bitte ein
,
1
Grundpraktikum Humanbiologie I -Organstoffwechsel
normales Frühstück bis 9 Uhr und auf keinen Fall ein Mittagessen einnehmen; auf ausreichende Flüssigkeitszufuhr (möglichst zuckerfreie Getränke) ist unbedingt zu achten. Aus
organisatorischen Gründen beginnen wir mit dem praktischen Teil bereits um 14.00 Uhr und
halten die Einführung (theoretische Grundlagen sowie Besprechung der praktischen Versuchsdurchführung) in der Zeit zwischen den Blutentnahmen ab.
Erwartung und Vorgabe für die Diskussion der Befunde im Protokoll
Die Gruppen A und B (Versuchszdauer 1,5 h) überprüfen inwieweit der Blutglucosespiegel
nach alleiniger Kohlenhydratzufuhr ansteigt, und ob er innerhalb eines bestimmten Zeitraums
wieder auf den Normalwert absinkt. Bei Gruppe A sollte die Blutglucose (1/2 Menge OGTTest) innerhalb von 30 min von < 5 mmol/L (normal bis hypoglykämisch) auf etwa 9-10
mmol/L ansteigen, wobei die Nierenschwelle i.a. gerade noch nicht erreicht wird (kann mit
Teststreifen überprüft werden) . Nach 60 min beginnt der Glucose-Spiegel i.a. bei Gruppe A
wieder abzufallen. Eine nicht-adäquate Glucose-Toleranz könnte auf einen latenten Diabetes
hindeuten. Bei mindestens einem Probanden dieser Gruppe sowie einem Probanden der
Gruppe B wird der Insulin-Spiegel im Kapilarblut bestimmt. Bei Gruppe B wird i.a. ein verzögerter Anstieg der Blutglucose beobachtet, beim Genuss von Vollkornbrötchen kann dieser
gering ausfallen (warum?). Bei manchen Probanden der Gruppen A + B geht mit dem hohen
Blutglucosespiegel ein leichter Anstieg des Blutlactatwertes einher (normalerweise liegt dieser bei 1-2 mmol/L). Denkbar ist, dass Lactat nicht mehr im gleichen Umfang wie in der Postresorptionssphase zur Gluconeogenese herangezogen wird.Trifft dies für Ihr Profil zu?
Bei der Gruppe C (Versuchzeitdauer 1,5 h) ändern sich die Spiegel von Glucose und Lactat meist nur geringfügig, so dass Nachlässigkeiten beim Blutabnehmen und Pipettieren (s.u.)
die Vesuchsergebnisse dieser Gruppe besonders stark beeinträchtigen! Nur wenn wirklich
über 6 Std. keine Nahrungsaufnahme erfolgt ist, kann sich die 'spezifisch-dynamische Wirkung' der Proteinverdauung ('Eiweiss-Diät' ?) bemerkbar machen: dem zur Bewältigung der
Verdauungsarbeit (für welche Prozesse wird dabei viel Energie benötigt?) notwendigen Glucosebedarf trägt auch die Leber durch erhöhte Gluconeogenese Rechnung (durch welches
Hormon stimuliert?). Die Änderung des Glucose-Spiegels ist individuell sehr verschieden,
jedoch wird bei vielen Probanden ein Absinken des Lactat-Spiegels beobachtet.Warum? Alle
Beobachtungen sind im Protokoll genau zu erklären..
Gruppe D bleibt im 30-50 minütigen Versuchzeitraum in der Postresorptionssphase. Bei
allen Probanden kommt es zu einem ausgeprägten Lactatanstieg (etwa 5-10 mmol/L nach 5
min), der jedoch je nach Trainingsgrad mehr oder weniger rasch absinkt, oft unter den Ausgangswert.. Der erhöhte Glucose-Verbrauch der arbeitenden Muskulatur führt hier meist zu
einem geringen (aber beim 5 min-Wert noch sichtbaren !) Abfall der Blut-Glucose, woraufhin
die Leber mit verstärkter Glucose-Freisetzung reagiert. Da die O2-Versorgung durch intensivere Durchblutung bei Trainierten besser als bei Nichtrainierten funktioniert, wird ATP im
Muskel zunehmend aerob gebildet. Der Blutglucosespiegel dieser Probanden normalisiert
sich auffallend schnell und ist dann oft höher als zu Beginn des Versuchs. Bereits der 30 min
Wert beider Parameter zeigt i. a. sehr deutliche Unterschiede zwischen Trainierten und weniger Trainierten. Lässt sich diese Erwartung am Versuchsnachmittag bestätigen ? Wie könnte
sich ein erhöhte Adrenalinausschüttung auf die Parameter auswirken?
DURCHFÜHRUNG
Wichtige Sicherheitshinweise:
TeilnehmerInnen mit diabetischer Stoffwechselsituation nicht in Gruppe A, mit Hühnereiweiss-Allergie nicht in Gruppe C; mit labilem Kreislauf nicht in Gruppe D. Auch wenn das
,
2
Grundpraktikum Humanbiologie I -Organstoffwechsel
Nüchternsein nicht eingehalten werden kann, erfolgt trotzdem die Teilname in einer der Untergruppen (ausser in Gruppe A, Kosten für OGT nicht zu rechtfertigen) mit Erstellung des
Profils . Aussnahme: Schwangerschaft. Im Praktikum muß ein Schutzkittel getragen werden.
Da jede Person ihre eigene Blutprobe aufbereitet, sind keine zusätzlichen Maßnahmen erforderlich, andernfalls sind unbedingt Handschuhe zu benutzen. Falls Perchlorsäure verschüttet
wird, muß sofort weggewischt werden und das Papier mit Wasser 'ausgespült' werden (nicht
direkt in den Papierkorb!).
Gerätschaften und Lösungen
Benötigt werden: Eppendorfpipetten, Eppendorf Cups für 1 ml, Ständer, Halbmikroküvetten
Zur Blutentnhame: 20 µl Glaskapillaren, Stechhilfe, Alkohol-Tupfer, Einmalhandschuhe,
Geräte: Photometer, Wärmeblock
Reagentien: 0.33 M Perchlorsäure (PCA), Testmischung für Blutglucose, Testmischung für
Blutlactat, OGT Packung. Testpackung Insulin-ELISA
Brötchen (Weiss oder Vollkorn) und harte Eier sind von den Gruppen B + C mitzubringen.
TEIL I
Blutentnahme für Metabolit-Profile
Die benötigte Anzahl Eppendorf-Gefässe (pro Person 4 x '1 ml Cup' mit Spitzboden) im
Ständer bereitstellen und in alle Cups 200 µl 0.33 M PCA vorlegen. Arm kräftig schleudern
o.ä.; nach Desinfizieren kleine Wunde mit Einmal-Lanzette seitlich an der Fingerkuppe setzten; aus dem sich bildenden Blutstropfen sofort mit präparierter Glaskapillare 20 µl (Kapillare
muss ganz gefüllt sein!) entnehmen; diese in die 200 µl Perchlorsäure überführen; das Gefäss
verschliessen; kräftig schütteln (die Kapillare bleibt im Cup). Erst wenn alle Blutproben genommen sind, d.h. nach Ablauf des Versuchszeitraums, in einer Eppendorf-Zentrifuge bei
voller Drehzahl 5 min abzentrifugieren; die klaren Überstände werden in neue Cups überpipettiert (mehr als 150 µL entnehmen!), erneut abzentrifugieren. Danach werden die benötigen
Volumina (100 µl für Lactat-Test; 50 µl für Glucose-Test) direkt in die Testansätze überführt.
'Verschleppte' partikuläre Bestandteile des Pellets würden die photometrische Bestimmung
stören und die Ergebnisse erheblich verfälschen ! Beschreibung der Blutentnahme für InsulinELISA: s. unten
Gruppe A
Gruppe B
Gruppe C
Gruppe D
,
Blutentnahme bei t = 0 min
Aufnahme von 1/2 OGT-Test, danach ruhig sitzen;
Weitere Blutentnahme nach t = 30 min, t = 60 min und t = 90 min.
Blutentnahme bei t = 0 min.
Aufnahme von ca. 75 g Stärke (3 Brötchen ohne Belag),
danach ruhig sitzen,
Blutentnahme nach t = 30 min, t = 60 min und t = 90 min.
Blutentnahme bei t = 0 min
Aufnahme von ca. 12 g Protein + 12 g Fett (2 harte Eier)
ruhig sitzen
Blutentnahme nach t = 30 min, t = 60 min und t = 90 min.
Blutentnahme bei t = 0 min.
Im Treppenhaus des Hauptgebäudes innerhalb weniger Minuten
dreimal vom UG ins 3. OG laufen (Leistung = ca. 150 W).
Blutentnahme unmittelbar danach (t = 5 min), nach 30 min und nach
50 min.
3
Grundpraktikum Humanbiologie I -Organstoffwechsel
TEIL II
Optisch-enzymatische Metabolit-Bestimmungen
A. Perchlorsäure-Stopp
Auch nach der Entnahme von Blut läuft der Stoffwechsel der Blutzellen weiter, wodurch sich
die Metabolit-Werte verändern können. Sollen Substrat/Metabolit-Bestimmungen durchgeführt werden, muß die Stoffwechsel-Aktivität nach der Entnahme sofort beendet werden. Dies
wird hier durch einen "Perchlorsäure-Stop", d.h. durch Eingabe der Blutprobe in einen Überschuss von PCA erreicht (wie in Teil I, S. 3 beschrieben). Die Zellen werden durch die Säure
zerstört, alle Proteine der Zellen und des Serums denaturiert; nach Zentrifugation zum Abtrennen der unlöslichen Bestandteile befinden sich alle löslichen Metabolite im klaren
perchlorsauren Überstand. Dieser wird für die optisch-enzymatischen Tests verwendet. Diese
Tests enthalten starke Pufferlösungen, die den Perchlorsäurebestandteil der Testproben neutralisieren, so dass der optimale pH-Wert für den jeweiligen Enzymtest gewährleistet ist.
B. Testablauf
Lactat und Glucose werden mit Hilfe des "optisch-enzymatischen Tests" bestimmt.
Prinzip der Bestimmung von Lactat
Lactat wird hier mit Hilfe von Lactat-Dehydrogenase und NAD oxidiert, d.h. in Pyruvat zurückgeführt (Reaktion in Muskel bzw. Leber ?). Da das Gleichgewicht der Reaktion auf der
Seite des Lactats liegt, muss das entstehende Pyruvat permanent entfernt werden, damit die
Lactatumsetzung vollständig abläuft (wie geschieht dies in der Leber?). Im Test wird das Pyruvat chemisch durch Umsetzung mit Hydrazin entfernt oder der Test enthält zusätzlich das
Enzym GPT (Glutamat-Pyruvat-Transaminase) und Glutamat. Beide Arten der Pyruvat Umsetzung sind im Test nicht sichtbar.
Lactat-Dehydrogenase
L-Lactat
+ NAD+ −−−−−−−−−−−−−−−−> Pyruvat + NADH + H+
Glutamat-Pyruvat-Transaminase
Pyruvat
+ Glutamat −−−−−−−−−−−−−−−> Alanin + Oxo(Keto)glutaratat
Durchführung mit der ausstehenden Testlösung
Testlösung enthält LDH, NAD, Puffer und Zusätze.
Die erforderliche Anzahl 1 ml Cups wie folgt beschicken:
Leerwert
Testlösung
Probe
H2 O
(µl)
(µl)
(µl)
700
--100
Anzahl Proben
der Probanden
700
100
---
Gefässe schliessen und kräftig schütteln; 15 min bei 37 °C im Wärmeblock ODER 30 min bei
Raumtemperatur inkubieren; danach Inhalt vollständig in Halbmikroküvetten überführen und
die Absorption der Proben gegen den Leerwert bei 340 nm messen.
Achtung: Falls die inkubierten Proben trüb sind (Verunreinigung durch Pellett, s.o.) müssen
diese vor dem Photometrieren nochmal 2 min in der Tischzentrifuge abzentrifugiert werden.
Messwerte ins Protokoll eintragen und wie dort angegeben weiterrechnen bzw. darstellen.
,
4
Grundpraktikum Humanbiologie I -Organstoffwechsel
Prinzip der Bestimmung von Glucose
Es handelt sich um einen 'gekoppelten' optisch-enzymatischen Test. Hier wird die Glucose
der Probe mit Hilfe der Glucose-Oxidase zu Gluconsäure oxidiert. Das dabei entstehende
Wasserstoffperoxid wird von der Peroxidase zur Oxidation eines Chromogens benutzt. Das
oxidierte Chromogen wird photometrisch bestimmt.
Glucose-Oxidase
Glucose + H2O + O2
−−−−−−−−−−>
Gluconsäure + H2O2
Peroxidase
H2O2 + red. Chromogen −−−−−−−−−−> ox. Chromogen + H2O
farblos
hier: rosa
Durchführung mit der ausstehenden Testlösung und dem Glucose-Standard
(1) Glucose-Testlösung (Glucose-Oxidase, Peroxidase, Chromogen, Puffer)
(2) Glucose Standardlösung (entspricht 1 mg Glucose / 1 mL Blut, → Anhang, berücksichtigt
bereits die Verdünnung durch die Perchlorsäure-Fällung und den Test-Ansatz).
Testlösung
Probe
Standard
H2 O
(µl)
(µl)
(µl)
(µl)
Anzahl Proben der Standard (doppelt)
Probanden
700
700
50
----50
-----
Leerwert
700
----50
Gefäße schließen und kräftig schütteln, mind. 20 min bei Raumtemperatur stehen lassen, danach Inhalt vollständig in Halbmikroküvetten überführen und die Absorption der Proben und
der Standards gegen den Leerwert bei 500 nm messen (Messung sollte spätestens nach 45
min abgeschlossen sein).
Messwerte ins Protokoll eintragen und wie angegeben weiterrechenen (s. auch ANHANG).
ANHANG ZUR AUSWERTUNG
(1) Auf Seite 1 des Protokolls dokumentieren die Probanden alle Messwerte ihrer eigenen
Blutprobe, werten diese aus und stellen diese graphisch dar.
(2) Auf Seite 2 sind die Ergebnisse für je einen 'typischen' Probanden aller Untergruppen A-D
aufzuführen; diese Person wird von den jeweiligen Gruppen selbst ausgesucht.
Beschreiben Sie zunächst die Erwartungen - später die Beobachtungen für die Probanden AD. Falls Abweichungen, suchen Sie nach einer Erklärung.
(3) Auf Seite 3 sind die Insulinkonzentrationen aus der Kalibrierkurve zu ermitteln (s. unten).
Zu beachten:
Zur Berechnung der Konzentration der Probe (nach dem Lambert-Beerschen Gesetz) muß der
Absorptionskoeffzient ε entweder bekannt sein (→ Lactat-Test) oder aus Messdaten ermittelt werden. Der Absorptionskoeffizient wird entbehrlich, wenn mit Standardlösungen, d.h.
mit Lösungen des Metaboliten in bekannter Konzentration (hier Glucose), gearbeitet wird.
Dann gilt
AProbe = ε · cProbe
Astandard = ε · cStandard
⇒
,
AProbe/ AStandard = cProbe / cStandard
5
Grundpraktikum Humanbiologie I -Organstoffwechsel
TEIL III
Enzymimmunologische Insulin-Bestimmung (ELISA)
Mittels Enzyme-Linked-Immuno-Sorbent-Assay werden im klinischen Labor Hormone, die in
sehr geringer Konzentration im Blut vorliegen, quantitativ nachgewiesen. Hier wird die Methode des direkten Sandwich-ELISA-Tests auf einer Mikrotiterplatte angewendet. Das sog.
Biotin-Streptavidin System wird zur Verstärkung der Antikörper-Hormonreaktion genutzt;
das Ausmass der Reaktion wird mit einem Enzymfarbtest gemessen und daraus die Insulinkonzentration mittels Standards (Kalibrierkurve) bestimmt.
(I) Im Test gibt es 2 monoklonale Antikörper (AK), die gegen zwei unterschiedliche Regionen der Insulin-Peptidketten gerichtet sind. AK1 ist in die Vertiefungen (Wells) der Platte
bereits vom Hersteller gebunden. Wird eine Insulin-haltige Probe (Serum oder Standard) in
die Wells gegeben, so erkennt der immobilisierte AK1 das Hormon und bindet es fest. Der
dann zugegebene AK2 (der als Biotin-Antikörper-Konjugat vorliegt) erkennt das an AK1
gebundene Insulin und bindet seinerseits an das Hormon: 'Sandwich' aus AK1-Insulin-AK2.
(II) Nach Entfernen aller nicht-gebundenen Komponenten durch Waschen wird ein Streptavidin-Peroxidase-Komplex zugesetzt: dieser erkennt Biotin, bindet daran und setzt ein zugegebenes chromogenes Substrat um. Das Ausmass der Farbreaktion hängt von der Menge gebundenen Enzyms ab und ist als Absorptionsänderung im ELISA-Platten-Reader (spezielles
Photometer) messbar.
(III) Mit Hilfe der parallel geführten Insulin-Standards kann die unbekannte Insulinkonzentration im Serum aus einer Kalibrierkurve abgelesen werden.
Testmaterial + Reagenzien
Pipetten für 25, 50, 300 µl; 1 Platten-Strip mit 8 Wells, aufgesetzt in Plattenrahmen;
Standard- Lösungen mit 0 / 6.25 / 12.5 / 25 / 50 / 100 µIU Insulin / ml.
Lösungen 'AK-Konjugat'; 'Waschpuffer'; 'Peroxidase-Komplex'; 'Substrat'; 'Stopp'.
Blutprobe (t = 0 min, t= 30-45 min) aus Fingerbeere in ein 1 ml Cup tropfen lassen oder mit
einer 50 µL Pipette durch mehrmaliges Aufziehen überführen; nach Gerinnung (ca. mind. 10)
5 min zentrifugieren; 25 µL SERUM wird für den Test benötigt!
Testdurchführung
1
Reagenzien vor Gebrauch auf Raumtemperatur bringen /'Strip' in den Halterahmen.
2.
Je 25 µL der 6 Standards in 6 Wells pipettieren (für Kalibrierkurve)
3.
Je 25 µL der 2 Serumproben in das 7. und 8. Well pipettieren.
4.
25 µL AK-Konjugat in alle Wells pipettiern.
5.
Zur Durchmischung die Platte horizontal (nach Anweisung) vorsichtig schütteln.
6.
30 min bei Raumtemperatur inkubieren.
7.
Überstand abekantieren. In jedes Well 300 µL Waschpuffer geben, wieder entfernen.
2 x wiederholen. Dann Platte umdrehen, auf saugfähigem Papier abklopfen.
8.
50 µL Peroxidase-Komplex in jedes Well geben.
9.
30 min bei Raumtemperatur inkubieren.
10.
Wie vorher (Punkt 7) 3 x waschen; gut abklopfen.
11.
50 µL Substrat in jedes Well geben.
12.
Platte 15 min bei Raumtemperatur inkubieren.
13.
50 µL Stopp-Lösung in jedes Well geben.
14.
Die Absorption in den Wells bei 450 nm im Platten-Reader messen.
Die Messung muss innerhalb von 30 min erfolgen.
15.
Protokollieren
,
6
Grundpraktikum Humanbiologie I -Organstoffwechsel
FRAGEN
1. Zur Methodik: Welcher Wellenlängenbereich wird für photometrische Messungen im
UV, im sichtbaren (vis) verwendet? Absorptionsspektrum von NAD+ und NADH? Fluorimetrische Metabolitbestimmung? ELISA Methode zur Hormonbestimmung?
2. Praktisches: Welchen Zweck hat der "Perchlorsäure-Stop" für die nachfolgende Metabolitbestimmung der Blutproben? Mit welchen anderen Verfahren könnte derselbe Zweck
erreicht werden? Welche Bedingungen, die allgemein für den Umgang mit Enzymen gelten, müssen auch bei enzymatischen Tests eingehalten werden? Wozu dient ein 'Standard'
im Test, wozu der 'Leerwert'? Erläutern Sie den Unterschied zwischen einfachem und gekoppeltem optisch-enzymatischem Test. Schlagen Sie enzymatische Bestimmungen für
folgende Metabolite vor: Glucose, Lactat, Pyruvat, Glucose-6-P, Glyceral-3-P, Ethanol,
ß-Hydroxybutyrat, Alanin, Oxo(Keto)glutarat, Glutamat (oft nur über gekoppelte Tests!).
3. Erläutern Sie den oralen Glucose-Toleranz-Test. Warum ist er einem intravenösen Belastungstest vorzuziehen? Welche Rolle spielen die gastro-intestinalen Hormone?
4. Zahlen-Bilanzen-Energetik: Welche ‘Physiol. Brennwerte’ haben 1 g Kohlenhydrat, 1 g
Protein, 1g Fett? Zusammensetzung einer 'typischen' Mahzeit? Glucoseverbrauch des Gehirns in 24 h? Glykogenspeicher in Leber und Muskulatur? Normbereich der Blutglucose
in mmol/L, in mg/100ml? Übliche Blut-Lactatspiegel? Ketonkörperspiegel? Glucosurie,
Ketonurie? Können Sie beschreiben: Substratkettenphosphorylierung? Lokalisation, Ablauf, Hemmung der Atmungskette? Oxidative Phosphorylierung? Vereinfachte Bilanzen
(1 mol NADH ~ 3 mol ATP; 1 mol FADH ~ 2 mol ATP): ATP-Gewinn der Leber beim
vollständigen Abbau (aerob) von 1 mol Glucose, Fructose, Galactose, Lactat?..des Skelettmuskels beim anaeroben Abbau von 1 mol Glucose?.. des Herzmuskels beim aeroben
Abbau von 1 mol Acetoacetat?..des Gehirns beim aeroben Abbau von 1 mol ßHydroxybutyrat?..des Erythrozyten beim aeroben Abbau von 1 mol Glucose? ..der Muskulatur beim Abbau von 1 mol C18-Fettsäure? ATP-Bedarf für Gluconeogenese aus
Lactat? aus Glycerol?
5. Formeln: Acetat, Aceton, Alanin, Ethanol, Fructose, Glutamin, Glucose, Gluconsäure,
Glucuronsäure, Glycerol, ß-Hydroxybutyrat, Lactat, Pyruvat, Purin, Pyrimidin, Sorbitol.
6. Hormone: Beschreiben Sie (chemisch) das Molekül Insulin, Glucagon, Adrenalin, Cortisol? Lokalisation der Rezeptoren für diese Hormone? Kennen Sie die prinzipielle Wirkung dieser Hormone auf den Kohlenhydrat-, Aminosäure, Fettstoffwechsel von Leber,
Niere, Muskulatur, Gehirn, Fettgewebe, Erythrozyt? Glucosetransporter? Diabetes Typ I,
Typ II? Hypoglykämie? Hyperglycämie? Ketogenese? Ammoniagenese?
7. Welche Organe/ Stoffwechselprozesse können Aminosäuren, Glucose, Glycerol, Lactat,
Ketonkörper, 'freie' Fettsäuren, Lipoproteine ans Blut abgeben....in der Resorptionsphase, in der Postresorptionsphase?
8. Welcher besondere Zusammenhang...besteht zwischen Muskel, Alanin und Leber? ....
Glutamin, Glucose und Niere? ...Glutamin, Glutamat und ZNS?.. Lactat, Glycerol, Alanin
und Leber? ...Glucose, Glycerol und Adipozyt? ... Glutathion, Pentose und Erythrozyt....
Glucose, Sorbit und Auge?
9. Geben Sie an, welche Organe/Zellen folgende Umsetzungen prinzipiell durchführen
können / nicht können (auf die Formulierung von aktivierten Fettsäuren bzw. phosphorylierten Zuckern wird bei dieser Betrachtung verzichtet): Glucose → Glycogen? Glucose → Fettsäuren? Glucose → Lactat? Lactat → Glucose zur Homöostase der Blutglucose? langkettige Fettsäuren → Glucose? Aminosäuren → Glucose? Glucose → CO2 +
H2O? Glucose → Pentose? Pentose → Glucose? Acetyl-CoA → 'Ketonkörper'?
'Ketonkörper' → Acetyl-CoA? langkettige Fettsäuren → ß-Oxidation + Citratzyklus +
Energie? kurzkettige Fettsäuren → Citratcyclus + Energie?
,
7