Janning_V4 368..369 - Wissenschaft Online
Werbung

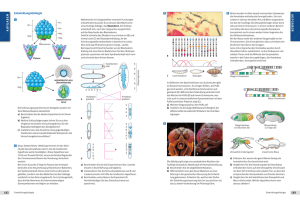
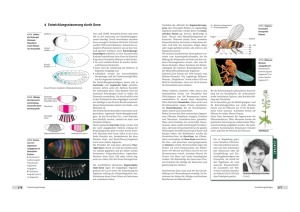
368 22 Die Genetik der larvalen Segmentierung bei Drosophila Abb. 22.33 Hox-Gene steuern die Entwicklung der Extremitten. Whrend der Entwicklung der Vorder- und Hinterbeine der Maus werden die Hoxa- und Hoxd-Gene exprimiert. Dass im Wildtyp die Gene 9 bis 13 dieser Cluster die Normalentwicklung steuern, weiß man aus genetischen Experimenten. Der homozygoten Doppelmutante Hoxa11– Hoxd11– fehlen, z. B. Radius (Speiche) und Ulna (Elle). Scapula (Schulterblatt), Humerus (Oberarmknochen), Metacarpus (Mittelhand) und Digiti (Finger) werden durch die Hox-Gene 9, 10, 12 und 13 bestimmt [ Nature 1995. Davis, A. P., Witte, D. P., Hsiehli, H. M., Potter, S. S., Capecchi, M. R.: Absence of radius and ulna in mice lacking hoxa-11 and hoxd-11. Nature 375 (1995) 791–795]. S Wildtyp Doppelmutante Hoxa11 Hoxd11 Hoxa11 Hoxd11 Hoxa11 Hoxd11 Hoxa11 Hoxd11 H H R M M D S D U 9 10 Scapula Humerus 11 Radius Ulna 12 13 Metacarpus Digiti bryo dargestellt, in dem die konsekutive anterior-posteriore Abfolge der Expression der Hox-Gene 4 bis 9 eingezeichnet ist. Diese erstaunlichen hnlichkeiten im Expressionsmuster bestrken die Hypothese, dass das HOM-C-Cluster weit vor der evolutionren Trennung von Arthropoden und Vertebraten durch Genduplikationen entstanden sein knnte. Innerhalb der Vertebraten haben dann weitere Duplikationen der Cluster zu paralogen Gengruppen gefhrt, deren Funktionen sich gendert haben. Geblieben ist jedenfalls die Kolinearitt von Genanordnung im Chromosom und sequenzieller Funktion entlang der Krperachse. Die Kolinearitt ist nicht nur innerhalb der gesamten Krperachse, sondern auch in einzelnen Strukturen, wie z. B. bei der Entwicklung der Extremitten gegeben. Bei der Maus werden vom Schulterblatt bis zu den Fingern die Hox-Gene 9–13 konsekutiv exprimiert. In einer Dop- Deformed (Dfd) (Drosophila) Abb. 22.34 Expressionsdomnen homologer Gene verschiedener Spezies entsprechen sich. Dfd und Hoxb4 werden bei Drosophila und Suger in anterioren Bereichen exprimiert. Ein Transgen mit der Dfd-Kontrollregion und einem Reportergen ist in der Maus am Ort der Hoxb4-Expression nachweisbar. Umgekehrt wird das Transgen aus der Kontrollregion des menschlichen Hoxb4 und einem Reporter im Drosophila-Embryo in der Domne von Dfd exprimiert. Reportergen Janning, Knust, Genetik (ISBN 3131287713), 2004 Georg Thieme Verlag Reportergen Hoxb4 (Homo) 22.5 pelmutante, die homozygot fr Hoxa11– und Hoxd11– ist, fehlen dementsprechend Elle und Speiche (Abb. 22.33). Homologe Drosophila- und menschliche Gene knnen sich in ihren Expressionsdomnen gegenseitig ersetzen, wie das folgende Experiment zeigt (Abb. 22.34). Das Drosophila-Gen Deformed wird im vorderen Kopfbereich des Embryos exprimiert, das Hoxb4-Gen bei Maus und Mensch ebenfalls in einer anterioren Region des Embryos. Wenn ein Hybridgen aus der Dfd-Kontrollregion von Drosophila und einem Reportergen (z. B. lacZ von E. coli) in das Mausgenom integriert wird, so findet man die Reporterexpression dort, wo auch das Hoxb4-Gen exprimiert wird. Umgekehrt findet man die Expression eines Reportergens, dem die menschliche Hoxb4-Kontrollregion vorgeschaltet wurde, im Drosophila-Embryo dort, wo das Dfd-Gen exprimiert wird. Knnen Gene von Drosophila und Maus auch im jeweils anderen Organismus entsprechende Funktionen ausben? Zumindest fr ein Mausgen, das in das Drosophila-Genom integriert wurde, konnte dies gezeigt werden (Abb. 22.35). Mit einem P-Element-Vektor, der den Drosophila-heat-shock-Promotor hsp70 vor dem Hoxb6-Gen der Maus enthielt, wurden Fliegen transformiert. Nach Hitzebehandlung konnte in den transgenen Fliegen homeotische Transformation induziert werden: Statt der Antennen differenzierten die behandelten Fliegen Beinstrukturen! Das Hoxb6-Gen ist homolog zu Antp (s. Abb. 22.32). Seine berexpression in der Fliege hat eine berexpression von Antp zur Folge, also einen mutanten gain-of-function-Phnotyp. Die Beispiele haben gezeigt, dass große hnlichkeiten zwischen den Genen unterschiedlicher Spezies nicht nur in der Basensequenz oder Genstruktur, sondern auch in ihrer Funktion bestehen. Da all diese Gene als Homeobox-Gene Transkriptionsfaktoren kodieren, bleibt die Herausforderung bestehen, die Genkaskaden der nachfolgenden Differenzierungs- oder Realisatorgene zu erforschen. Zusammenfassung & Die Achsen des Drosophila-Eis werden durch maternale Gene festgelegt, die als Koordinatengene bezeichnet werden. & In der Oozyte sind in unterschiedlichen Positionen mRNAs lokalisiert, die in der Zygote translatiert werden. Durch Diffusion und Abbau werden von der Translationsquelle aus Proteingradienten aufgebaut, die morphogene Wirkungen zeigen. Unterschiedliche Proteinkonzentrationen entlang des Gradienten vermitteln den Zellkernen bzw. Zellen Positionsinformation. Homeotische Gene als Kontrollgene 369 a P white hsp 70 Hoxb6 b d c e P Abb. 22.35 Mausgen simuliert DrosophilaGen. a Fliegen werden mit einem P-Element-Vektor transformiert, der neben dem white-Gen zur Erkennung der erfolgreichen Transformation (s. Abb. 20.5) das Hybridgen aus Drosophila-heatshock-Promotor hsp70 und dem Mausgen Hoxb6 (Drosophila-Antp-Homolog) enthlt. Werden wildtypische und transgene Embryonen und Larven Hitzeschocks ausgesetzt, so ergeben sich dramatische Effekte. In den transgenen Fliegen werden homeotische Transformationen induziert. b, c Anstatt Antennen werden Beinstrukturen differenziert. Der Pfeil zeigt auf die Endstruktur eines Drosophila-Beins, die Klauen. d, e Der Wildtyp bleibt unbeeinflusst [Bilder von W. McGinnis, La Jolla, s. Malicki et al. 1990]. & Morphogene im anterioren Bereich des Fliegenembryos sind die Proteine Bicoid und Hunchback, im posterioren Bereich Nanos und Caudal. & Die dorso-ventralen Koordinaten werden durch den Dorsal-Gradienten bestimmt. & Unter den zygotischen Segmentierungsgenen gibt es drei Gruppen, die aufgrund des allgemeinen Phnotyps der Mutationen als Gap-Gene (Lckengene), Paarregelgene und Segmentpolarittsgene bezeichnet werden. Sie werden whrend der Embryogenese in dieser Reihenfolge aktiviert, berlappen aber rumlich und zeitlich. Janning, Knust, Genetik (ISBN 3131287713), 2004 Georg Thieme Verlag