V E.1 Simulation der elektrischen Eigenschaften von biologischen
Werbung

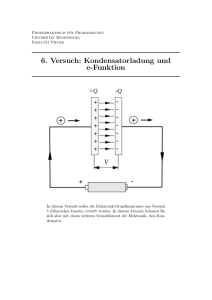
V E.1 Simulation der elektrischen Eigenschaften von biologischen Membranen Ziele: In diesem Versuch werden die Grundlagen der Entstehung des Ruhemembranpotenzials und der Übertragung von elektrischen Signalen in Nervenzellen- und Muskelzellen bearbeitet. Dabei werden die elektrischen Eigenschaften der Zellmembran mit einfachen Modellen simuliert und veranschaulicht. Zusätzlich wird der Einfluss dieser Eigenschaften auf die Ausbreitung von elektrischen Signalen in erregbarem Gewebe untersucht. 1. Passive Eigenschaften biologischer Membranen 1.1 Das Ruhemembranpotential und die Nernst’sche Gleichung 1 2 Membran jD C1 jE C2 x Abb. 1.1 Doppelkammer mit kationenselektiver Membran zur Trennung unterschiedlicher Elektrolytkonzentrationen. In Abb. 2.1. ist eine Doppelkammer mit den Teilkammern 1 & 2 dargestellt. Füllt man beide Teilkammern mit unterschiedlichen Konzentrationen einer NaCl-Lösung, die Teilkammer 1 mit der Konzentration C1 und die Teilkammer 2 mit der Konzentration C2, so liegt zwischen beiden Kammern der Konzentrationsgradient (∆C/Δx vor. Dieser Gradient (chemische Triebkraft) bewirkt einen Teilchenstrom durch eine permeable Membran hin zur geringeren Konzentration. Hieraus ergibt sich nach dem Fick’schen Diffusionsgesetz: jD = − D ⋅ ∆C ( 1.1 ) ∆x −2 −1 2 −1 die sog. Teilchenstromdichte (Fluss) jD [mol m s ] mit der spezifischen Diffusionskonstante D (m s ). + Ist die Membran zwischen den Teilkammern z.B. nur kationenselektiv, so diffundieren nur die Na -Ionen entlang des Konzentrationsgradienten durch die Membran. Sie hinterlassen in der höher konzentrierten NaCl- Lösung jeweils ein Cl -Ion. Da die Ionen die Ladung Q = z ⋅ e0 besitzen, lässt diese Ladungstrennung ein E1.1 [Version1 22.10.2010] -1 ansteigendes elektrisches Feld E [V m ] entstehen, das der chemischen Triebkraft entgegen wirkt. Es bedeuten e0 = 1,6 ⋅ 10 −19 Coulomb die Elementarladung und z die Wertigkeit (s. unten) des Ions. Für die elektrisch -2 -1 erzeugte Teilchenstromdichte jE [m s ] gilt dann: jE = z ⋅ µ ⋅ c ⋅ E ; ( 1.2 ) Übung: Wie hängt die Leitfähigkeit und der Widerstand eines Elektrolyten von den Größen z, µ und c (aus Gl. 1.2) ab? Welche physiologische Rolle könnte diese Abhängigkeit haben? 2 -1 -1 die das Ohm’sche Gesetz für wässerige Lösungen darstellt. Die Größe µ [m V s ] ist die Ionenbeweglichkeit -3 und c [mol m ] die Konzentration der Ionen. Durch das zunehmende elektrische Feld kommt es nach kurzer Zeit zum Stillstand der Ionendiffusion, d.h. die chemische und die elektrische Triebkraft stehen im Gleichgewicht ( jD = jE ). Dabei kann man das Gleichgewichtspotenzial (Diffusionspotenzial) mittels der Nernst’schen Gleichung ausrechnen: U 21 = wobei R = 8,314472 J ⋅ mol-1 K -1 F = 96485,34 C · mol -1 C R ⋅T ⋅ ln 1 , z⋅F C2 ( 1.3 ) die universelle Gaskonstante, T die Temperatur in Kelvin, die Faraday-Konstante und in der z die Ionenwertigkeit ( z Na = +1 , zCl = −1 ) darstellt. Will man aus gemessenen Membranpotentialen die Konzentrationen von Lösungen ermitteln, so muss man Gl. 1.3 umformen und erhält dann: C2 = C1 ⋅ e z⋅F − ⋅U 21 ⋅ R T E1.2 [Version1 22.10.2010] . ( 1.4 ) 1.2 Experiment: Das Ruhemembranpotenzial und die Nernst’sche Gleichung Multim eter mV - + Elektrod en 1 2 Aufbewahrun gsgefäß Meß kamme r 1 & 2 Abb. 1.2 Versuchsaufbau zur Messung von Membranpotentialen Die Versuchsanordnung ist wie in Abb.2.2 auf den Labortischen aufgebaut und sollte nicht verändert werden. Die beiden Elektroden befinden sich anfangs in einer Stativhalterung über dem Aufbewahrungsgefäß, dass mit einer 0,1 M KCl-Lösung gefüllt ist. Die Elektroden sind elektrisch so mit dem Multimeter verbunden, wie es in Abb.2.2 gezeigt ist (Referenzelektrode in Kammer 1 und mit COM-Buchse verbunden, die zweite Elektrode befindet sich in Kammer 2 und ist mit der V-Buchse verbunden) Das Messgerät wird auf 200mV Gleichspannung gestellt. Die Messkammern befinden sich unter einer weiteren Halterung, in die die Elektroden zur Messung des Membranpotentials gehängt werden müssen. 1.2.1 Messung 1: 1.) Die Messkammer wird auf die Stirnfläche der Kammer 1 gestellt und durch Lösen von vier Rändelschrauben in zwei Teile zerlegt. Dann wird ein vorgeschnittenes Membranstück aus dem Reservoir (Farbmarkierung im Protokoll notieren!) entnommen, zwischen die Flansche der beiden Kammerhälften gelegt und anschließend wieder verschraubt. Die beiden Kammerhälften sind mit "1" und "2" gekennzeichnet. In das Becherglas "1" werden 80 ml einer 0,1 -molaren NaCl-Lösung gefüllt. In das Becherglas "2" werden aus der Lösungsflasche "B" wiederum 80 ml NaCl-Lösung abgefüllt. Anschließend werden die Kammern mit Hilfe eines Trichters und der entsprechenden Nummernzuordnung mit den Lösungen befüllt. Die Messkammer wird dann so unter die Elektrodenhalterung geschoben, dass die Elektroden leichtgängig in die Kammern eingeführt werden können. Die Silberchloridelektroden müssen zu diesem Zweck aus dem Aufbewahrungsgefäß entnommen und vorher mit Zellstoff abgeputzt werden. 2.) Halten sie die Elektroden in die Kammern und lesen sie den Spannungswert Umess ab und tragen ihn in Tabelle 2.1. ein. Danach werden die Elektroden sofort wieder aus den Kammern entnommen, abgeputzt und in das Aufbewahrungsgefäß zurückgestellt. Dort kann ein sog. Asymmetriepotenzial Uass auftreten, das ebenfalls ermittelt und notiert wird. Das Membranpotential U21 selbst erhält man dann durch Subtraktion des Asymmetriepotentials vom Spannungswert zwischen den Kammern. 3) Zum Abschluss dieser Messreihe wird die Kammer "1" mit einem Stopfen verschlossen und die Kammer "2" entleert. Dann wird die gesamte Messkammer senkrecht auf die Stirnfläche von Kammer "1" gestellt und nach E1.3 [Version1 22.10.2010] Lösen der vier Rändelschrauben die Teilkammer "2" abgehoben und mit Zellstoff ausgetrocknet. Abschließend ist die Teilkammer wieder zu montieren, wobei die Messkammer in senkrechter Position verbleibt. Nach der letzten Messung der Messreihe ist auch die Kammer 1 zu entleeren und die Membran zurück ins Aufbewahrungsgefäß zu legen. 1.2.2 Messung 2: 1.) In das Becherglas "2" werden aus der Lösungsflasche "C" 80 ml NaCl-Lösung abgefüllt. Anschließend wird die aufrecht stehende Messkammer in die Waagerechte gebracht und die Kammer "2" über einen Trichter mit der Lösung aus Becherglas "2" befüllt. Der Korken aus Kammer "1" wird entfernt. Die Messkammer wird dann wieder so unter die Elektrodenhalterung geschoben, dass die Elektroden leichtgängig in die Kammern eingeführt werden können. Die Silberchlorid Elektroden müssen zu diesem Zweck wieder aus dem Aufbewahrungsgefäß entnommen und mit Zellstoff abgeputzt werden. 2.) Der weitere Ablauf der 2. Messung erfolgt nun wie unter 2.) und 3.) bei der ersten Messung beschrieben. Konzentration (Buchstaben notieren) TA [K] Umess[mV] Uass[mV] U21[mV] mol C2 l Tabelle 1.1 Messreihe von Membranpotentialen bei verschiedenen Konzentrationen und einer Referenzkonzentration von 0,1 mol/l. Als Temperaturwert wird die Raumtemperatur genommen (22°C). 1.) Finden Sie heraus, ob bei Ihrer Messreihe eine kationen- oder eine anionenselektive Membran verwandt wurde! ( C1 > C2 ) Hilfen zur Bestimmung der Membranselektion: • Haben Sie eine positive oder negative Spannung gemessen? • In welche Richtung bewegen sich die Ionen aufgrund des chemischen Gradienten (in Richtung welcher Kammer)? • Welchen Ionen konnten durch die Membran diffundieren, um eine positive bzw. negative Potentialdifferenz zu erzeugen? 2.) Ermitteln Sie aus den gemessenen Membranspannungen die Konzentrationen C2 der Lösungen, die Sie aus den Gefäßen "B" bis "C" entnommen haben und tragen Sie sie in Tabelle 1.1. ein. Benutzen Sie dabei das F = 39,37V −1 bei 22°C ist. R ⋅T E1.4 [Version1 22.10.2010] 1.3 Plattenkondensator - Beladung und Entladung Wird ein Kondensator an eine Gleichspannungsquelle angeschlossen, so fließt ein Ladestrom, beim Entladen ein Entladestrom. Das Aufladen eines Kondensators bedeutet das Aufbauen eines elektrischen Feldes zwischen seinen Platten. Abb.1.3 Laden und Entladen eines Kondensators. 1.4 Elektrische Eigenschaften von biologischen Membranen Die Membran einer Zelle trennt das Innere der Zelle von dem Außenraum. Die Membran besteht aus einer Doppelschicht amphiphiler Fettsäuremoleküle. Zu beiden Seiten dieser Lipid-Doppelschicht befindet sich Elektrolytflüssigkeit, also ein elektrischer Leiter, die Doppelschicht ist jedoch ein Isolator. Zusammen mit den Elektrolytflüssigkeiten wirkt sie deshalb als Kondensator mit der Membrankapazität CM. Eine biologische Zellmembran ist jedoch kein perfekter Isolator, da Ionenkanäle in die Membran eingebaut sind, die die Passage von Ionen erlauben. Deshalb muss man in einem Modell zusätzlich zum Kondensator einen Parallelwiderstand, den sogenannten Membranwiderstand RM, berücksichtigen (siehe Abb. 2.6). Ein Stromfluss durch die Membran ändert die Spannung am Kondensator. Diese Spannung, die Potentialdifferenz zwischen Innen- und Außenraum der Zelle, wird in der Biologie als Membranpotenzial bezeichnet. Die Kombination von Kondensator und Parallelwiderstand, in der Elektrotechnik als RC-Glied bezeichnet, kann genutzt werden, um die passive Ausbreitung von elektrischen Impulsen über ein Membranstück zu simulieren und die damit verbundene, auch zeitliche Veränderung der Impulse zu untersuchen. Die die zeitliche Veränderung beschreibende Größe ist die Membranzeitkonstante τM, die sowohl von CM als auch von RM abhängt: τ = RM CM (1.5) In einer langgestreckten Zelle wie einem Neuron findet auch eine räumliche Ausbreitung der Impulse längs der Membran statt. Der Elektrolyt im Innern hat einen elektrischen Widerstand, der bei Betrachtung der räumlichen Ausbreitung der Impulse als Längswiderstand Ri berücksichtigt werden muss. Der Längswiderstand hängt vom Durchmesser der Zelle (Leiterquerschnitt) ab und beeinflusst die Reichweite der Ausbreitung der Impulse. Die Reichweite der Ausbreitung von elektrischen Impulsen wird durch die Membranlängskonstante (λ) charakterisiert. λ gibt an, nach welcher Strecke (in Metern) ein Potenzial auf 37% (= 1/e) des Ausgangswerts abgefallen ist. Je größer lambda ist, desto weiter gelangt ein Potenzial. Bei einer zylinderförmigen Zelle kann die Längskonstante durch λ= RM berechnet werden. Ri E1.5 [Version1 22.10.2010] Extrazellulärraum RM Ra CM Intrazellulärraum Membran Ri Ionenkanäle Axon Nervenzelle Abb.1.4 Elektrisches Modell der Zellmembran. E1.6 [Version1 22.10.2010] 1.5 Experiment: Bestimmen der Zeitkonstante an einem Modell von biologischen Membranen 1.5.1 Messen der charakteristischen Zeitkonstante von einem RC-Glied Bauen Sie gemäß Abb. 2.7 eine Schaltung mit einem Kondensator CM = 34 nF und einem Widerstand RM = 22kΩ auf. Diese Schaltung beschreibt in guter Näherung die elektrischen Eigenschaften einer Zellmembran. Die Stromquelle liefert rechteckförmige Strompulse (Frequenz=30 Hz), die zu einer mit den Zeitkonstanten zunehmenden bzw. abnehmenden Spannung (U=UR=UC) am RC-Glied führen. Da die Stromquelle ebenfalls einen Innenwiderstand hat, wird der Kondensator nicht nur über den Widerstand RM entladen, sondern auch über diesen Innenwiderstand. Um diesen Effekt zu minimieren wird in die Schaltung ein Vorwiderstand (RV = 220 kΩ eingebaut. Als Messgerät nutzen sie das Netbook. Melden sich als „Praktikum“ an und nutzen „Physik“ als Passwort. Am Arbeitsplatz befindet sich eine USB-Messbox, die sie anschließen. In der Taskleiste befindet sich das Programm Scope, welches Sie starten müssen. Das Programm funktioniert wie ein digitales Oszilloskop. Verkabeln Sie die Schaltung so mit der USB-Box, wie in Abb. 1.5 zu sehen (A4-Anschluss). Abb. 1.5 Versuchsaufbau zur Messung der Membranzeitkonstante Hinweis: Vergleichen Sie Abb. 1.5 mit Abb. 1.3. Welche Ähnlichkeiten lassen sich erkennen? • Messen Sie an dieser Ersatzschaltung für Membranen die Membranzeitkonstanten für die Einschalt- und für die Ausschaltflanke des Impulses bei jeweils drei verschiedenen Stromamplituden (der Amplitudenreger sollte mind. auf 5 stehen). (Die Zeitkonstante ist die Zeit, in der der Spannungswert auf 63% (1-1/e)seines Endwertes angestiegen bzw. auf 37% (1/e)seines Ausgangswertes abgefallen ist. Siehe dazu Appendix1). Der angegebene Wert auf dem Kondensator ist nur sehr ungenau. Berechnen Sie den tatsächlichen Wert ihres Kondensators aus der Zeitkonstante und dem Widerstand (Der Wert des Widerstandes hat nur eine geringe Abweichung). E1.7 [Version1 22.10.2010] 1.5.2 Auswirkung der Kapazität des Kondensators auf die Zeitkonstante des RC-Glieds Myelinisierte Membranen haben eine geringere Kapazität als nicht-myelinisierte Membranen. Welchen Einfluss hat die Myelinisierung der Membran auf die Zeitkonstante? Wiederholen Sie den Versuch 1.5.1 mit einem anderen Kondensator (z. B. 11nF). Berechnen Sie die Zeitkonstanten (τ = R·C) und vergleichen Sie das Ergebnis mit ihren Messwerten. 1.6 Experiment: Elektrotonische Ausbreitung von elektrischen Impulsen 1.6.1 Versuchsaufbau Simulieren Sie die Ausbreitung von Stromimpulsen und deren Veränderung entlang eines Dendriten. Dazu müssen insgesamt 10 RC-Glieder (Membranabschnitte) mit CM = 30 nF und RM = 22 kΩ aufgebaut werden, die jeweils über Längswiderstände RL = 5,6 kΩ gemäß Abb.1.6 verbunden sind. Da nicht alle 10 Glieder nebeneinander auf das Steckbrett passen, müssen sie in 2 Reihen aufgebaut werden, wie in der Abbildung zu sehen. Abb. 1.6 Versuchsaufbau zur Messung der passiven Membraneigenschaften Neben den Querströmen durch die einzelnen Membranabschnitte tritt nun zusätzlich ein Längsstrom entlang der Membran auf. Stellen sie den Amplitudenregler auf den maximalen Wert. Nutzen Sie hier das Netbook-USB-Messbox-System. Betrachten Sie auf Kanal 1 des Oszilloskops stets den zeitlichen Spannungsverlauf der Impulse am ersten Membranabschnitt. Betrachten Sie auf Kanal 2 des Oszilloskops den zeitlichen Verlauf der Spannungen der Reihe nach an den anderen Membranabschnitten. Regeln Sie, wenn nötig, die Verstärkung von Kanal 2 nach. Skizzieren Sie die Signalformen des 1., 4. und 8. Membranabschnitts und interpretieren Sie das Ergebnis. E1.8 [Version1 22.10.2010] 1.6.2 Bestimmung der Längskonstante des elektrischen Membranmodels Untersuchen Sie nun die räumliche Ausbreitung des Signals entlang des Membranmodells (Abb, 1.6). Messen Sie dazu die an jedem der acht Membranabschnitte anliegende Spannung mit dem Oszilloskop. Tragen Sie ihre Messwerte in einem Diagramm der Spannung U in (V) in Abhängigkeit vom Weg x in (mm) auf. Berücksichtigen Sie bei dieser Betrachtung, dass der Weg zwischen zwei RC-Gliedern einer Distanz von 0.5 mm an der Zellmembran entspricht. Ermitteln Sie aus dem Diagramm die Membranlängskonstante. Diese ist die Strecke, nach der der Spannungswert auf 37% (auf 1/e) abgeklungen ist. Tabelle 1.2 Messreihe 1 zur Bestimmung der Längskonstante des elektrischen Membranmodels. E1.9 [Version1 22.10.2010] 1.6.3 Auswirkung des Längswiderstands auf die Längskonstante der Modellmembran (entspricht z. B. dem Faserdurchmesser bei einer biologischen Membran) Ändern Sie den Längswiderstand (RL=2,2 kΩ) und führen sie den Versuch zur Bestimmung der Längskonstanten noch einmal durch. Interpretieren sie die Unterschiede! Tabelle 1.3 Messreihe 2 zur Bestimmung der Längskonstante des elektrischen Membranmodels. 1.6.4 Auswirkung der Myelinisierung auf die Längskonstante der Modellmembran Myelinscheiden verhindern Leckströme durch die Membran und wirken daher als Isolator. Darüber hinaus verringern sie die Membrankapazität. Warum ist das so? Tauschen sie die Widerstände und Kondensatoren von RC-Gliedern (4,7MΩ und 2,2 pF), die in der Mitte der Nervenfaser liegen und symbolisieren somit eine Myelinscheide. Wie verändern sich die Messwerte bzw. Kurven aus dem vorigen Versuch? Tabelle 1.4 Messreihe 3 zur Bestimmung der Längskonstante des elektrischen Membranmodells. Zeichnen Sie die die Daten aus den Tabellen 1.2-1.4 Beschriften Sie dabei die Achsen mit passenden Werten! E1.10 [Version1 22.10.2010] 1.7 Experiment: Simulierte Aktionspotentiale und Spannungsklemmmessungen am Tintenfischriesenaxon Das Programm HHsim finden Sie im Internet unter: http://www.cs.cmu.edu/~dst/HHsim/ Es erlaubt die Simulation von Aktionspotentialen (APs) und Stromregistrierungen für eine Vielzahl von Ionenzusammensetzungen. Ein AP wird durch Klicken auf "Stim 1" oder "Stim 2" gestartet. Die ionischen Bedingungen werden durch Klicken auf "Membrane" geändert. Im Plot des simulierten AP kann man mittels Mausklicks und Bewegung des Kursors Zeit- und Spannungswert ablesen. 1.7.1 Aktionspotentiale Simulieren Sie ein Aktionspotential unter den vorgegebenen Bedingungen. Verändern Sie dann die + + extrazellulären [K ] and [Na ] in einem weiten Bereich (mindestens 6 verschiedene Werte). Wann werden keine AP-s mehr ausgelöst? Wie könnte das erklärt werden? 1.7.2 Pharmakologische Effekte von TTX und Pronase Was passiert, wenn TTX oder Pronase zugegeben wird? TTX blockiert den Natriumkanal, während Pronase ein Proteasegemisch ist, das einen Abschnitt des Natriumkanals abspaltet und so die Inaktivierung aufhebt. Beschreiben und zeichnen Sie die beobachteten Veränderungen! E1.11 [Version1 22.10.2010] 1.7.3 Effekte, die bei Veränderungen der Membrankapazität auftreten Was passiert mit den AP-s, wenn die Kapazität der Membran verändert wird (verdoppelt/halbiert)? Wie könnte das erklärt werden? E1.12 [Version1 22.10.2010] 2. Übungsfragen 1. Welche elektrischen Eigenschaften charakterisieren die Zellmembran? 2. Definieren Sie das Ohm'sche und das Fick'sche Gesetz für wässrige Lösungen. 3. Wie wird aus den obengenannten Gesetze die Nernst'sche Gleichung abgeleitet? Kalkulieren sie die physiologischen Gleichgewichtspotentiale für Na+, K+, Ca+ und Cl-. 4. Wie werden sich in den Praktikumsversuchen anionen- und kationenselektive Membrane unterscheiden? 5. Warum befindet sich zwischen den Kondensatorplatten ein Dielektrikum? 6. Warum weisen Zellen ein Ruhemembranpotential auf? Wie hängt die Goldmann-HodgkinKatz Gleichung mit der Nernst'schen Gleichung zusammen? 7. Beschreiben Sie das physiologische Aktionspotential! Aus welchen Phasen besteht es? 8. Welche Proteine sind für die Aktionspotentialbildung verantwortlich? 9. Welche Effekte auf das Aktionspotential erwarten Sie bei einer erhöhten Kaliumkonzentration des Blutplasmas? Welche Effekte auf das Aktionspotential erwarten Sie bei einer erhöhten Natriumkonzentration des Blutplasmas? E1.13 [Version1 22.10.2010] Appendix 1. Die Exponentialfunktion Die Be- bzw. Entladung von einem Kondensator (Fig. A1) kann mathematisch mit Hilfe von Exponentialfunktionen beschrieben werden. Fig. A1. Beladung (a) und Entladung (b) eines Kondensators Der Zeitverlauf der Beladung von einem Kondensator (a) wird mit der Gleichung Uc = U ⋅ (1 − e −t τ ) und die Entladung (b) entsprechend mit der Gleichung Uc = U ⋅ e −t τ beschrieben. Dabei ist: U – die maximale Spannung bei einer vollständiger Beladung (a), oder Anfangsspannung der Entladung (b) und τ – die Zeitkonstante der Be- oder Entladung (die Zeit, bis 63% der maximalen Spannung (a) oder 37% der Anfangsspannung (b) erreicht werden). Typische Zeitpunkte beim Laden: • nach der Zeit τ ist der Kondensator auf 63% der Ausgangsspannung aufgeladen (0,63 U); • nach der Zeit 2τ ist der Kondensator auf 86% der Ausgangsspannung aufgeladen (0,86 U); • nach der Zeit 4τ ist der Kondensator auf 98% der Ausgangsspannung aufgeladen (0,98 U); • die Tangente im Punkt t = 0 schneidet die 100%-Linie im Abstand τ. Typische Zeitpunkte beim Entladen: • nach der Zeit τ ist der Kondensator auf 37% der Ausgangsspannung entladen (0,37 U); • nach der Zeit 2τ ist der Kondensator auf 14% der Ausgangsspannung entladen (0,14 U); • nach der Zeit 4τ ist der Kondensator auf 2% der Ausgangsspannung entladen (0,02 U); • die Tangente im Punkt t = 0 schneidet die Nulllinie im Abstand τ. E1.14 [Version1 22.10.2010]