Vorlesung #2 Elektrische Eigenschaften von Neuronen
Werbung

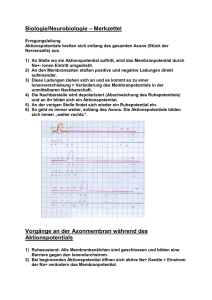
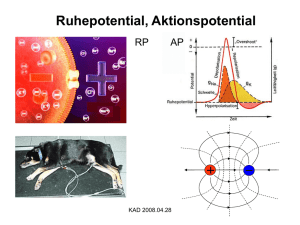
Vorlesung #2 Elektrische Eigenschaften von Neuronen, Aktionspotentiale und deren Ursprung Alexander Gottschalk, JuProf Universität Frankfurt SS 2010 Elektrische Eigenschaften von Neuronen Elektrische Eigenschaften der neuronalen Plasmamembran bestimmt durch: 1. Lipidschicht: undurchlässig für Ionen 2. spezifische Ionenkanäle, die Lipidschicht für bestimmte Ionen selektiv durchlässig machen 3. Ionengradienten über der Membran, durch Ionenpumpen aufrecht erhalten Pumpen erzeugen Ionengradienten über der Plasmamembran ATP-getriebene Ionenpumpen erzeugen Ionengradienten über der Membran, verbrauchen fast 70% der Energie, die in Neuron erzeugt wird: Na+/K+-Pumpe: Tetramer aus α- und β-Untereinheiten, Konformationsänderungen exponieren 3 Na+ und 2K+ Bindestellen in Cytoplasma bzw. auf Zellaußenseite, mit wechselnden Bindungsaffinitäten (Na+ raus, K+ rein) weitere Pumpen nutzen den Na+-Ionengradienten, um als Sym- oder Antiporter Gradienten anderer Ionen zu erzeugen, z.B. Ca2+/Na+ Austauscher Die Sarco-Endoplasmatische Ca2+-ATPase bei der Arbeit Ionengradienten in neuronalen Zellen Ion Innen (mM) Außen (mM) GGWPotential (mV) Ion Innen (mM) Außen (mM) GGWPotential (mV) Na+ 50 440 + 55 Na+ 18 145 + 56 K+ 400 20 - 76 K+ 135 3 - 102 Cl- 40 560 - 66 Cl- 7 120 - 76 Ca2+ 0,4 µM 10 + 145 Ca2+ 100 nM 1,2 + 125 Riesenaxon des Tintenfisches Säugerneuron Innen- und Aussenraum der Zellen zunächst elektrisch neutral (Gegenionen) ABER: Plasmamembran enthält Kanalproteine, selektiv für K+-Ionen: K+-Ionen fliessen aus Zelle (ohne Gegenion !), resultierendes Ladungsungleichgewicht erzeugt Membranpotential (auch durch elektrogene Na+/K+-Pumpe), Zellinneres negativ geladen 0 mV Nernstpotential EK + + 100 mM K+ 10 mM Na+ 10 mM Cl100 mM A- 10 mM K+ 100 mM Na+ 110 mM Cl- - x mV - + - - - 100 mM K+ 10 mM Na+ 10 mM Cl100 mM A- - + - + + + + - + + + JK = PK ([K+]i –[K+]0) 10 mM K+ 100 mM Na+ 110 mM Cl- Ionenfluß von Kalium + - + 100 mM K+ 10 mM Na+ 10 mM Cl100 mM A- + + - + - (P = Leitfähigkeit der Membran) 10 mM K+ 100 mM Na+ 110 mM Cl- EK = Vo-Vi = RT zF ln [K+]o = - 58 mV [K+]i Nernstpotential (elektrochemisches Gleichgewichtspotential) für Kalium Das Ruhepotential resultiert aus einem Fließgleichgewicht verschiedener Ionen Einführung von Na+-Kanal: Na+ würde einströmen, bis +58 mV erreicht Æda aber K+ weiter ausströmt: Æ Fließ-GGW Ruhepotential echter Neuronen zwischen – 40 und –75 mV, nur ungefähr Umkehrpotential von K+: weitere Ionenkanäle in Membran, Fließgleichgewicht stellt sich ein: Vm= RT F x ln Σk=1,n zkPk[Xk]0 + Σl=1,m zlPl[Yl]i Σk=1,n zkPk[Xk]i + Σl=1,m zlPl[Yl]0 k Kationen, l Anionen P Membranleitfähigkeit Goldmann-Hodgkin-Katz Gleichung K+, Na+, in Neuronen nur von Bedeutung, daher: Cl- Vm= 58 log PK[K+]0 + PNa[Na+]0 + PCl[Cl-]i PK[K+]i + PNa[Na+]i + PCl[Cl-]0 Æ je größer P für Ion X, umso stärker wird Vm von X bestimmt passive Eigenschaften der Plasmamembran Depolarisation Ruhepotential Hyperpolarisation Plasmamembran wirkt als Widerstand (Lipide), und als Kondensator (Ladungstrennung, durch Veränderung des Membranpotentials umgeladen) Gesamtleitfähigkeit Membran für K+: PK = 1 / RK Kapazität C = Q/V; bei Zellmembran ca. 1µF/cm² Zeitkonstante τ =RC; Zeit, nach der ∆V 63% von Endwert erreicht Ersatzschaltbild für die passiven elektrischen Eigenschaften der Plasmamembran nur ein Ion (K+) drei relevante Ionen (K+, Na+, Cl-) Ionenfluß in einer „echten“ Zelle Absolutmenge an K+-Ionen, die ausfließen müssen um in Neuron von d=50 µm das Potential von 0 mV auf -58 mV zu bringen ist sehr gering: Kapazität C = Q/V; ca. 1µF/cm² in echten Neuronen um ∆V = -58 mV aufzubauen, sind 5,5 * 10-8 Coulomb / cm² nötig 1 Coulomb = 6.2 * 1018 Elementarladungen Æ Q=3,6 * 1011 Elementarl. / cm² dZelle=50 µm, Fläche = 7,85 * 10-5 cm² Æ Ladungstrennung von 28*106 nötig In einer Zelle ca. 4 * 1012 K+-Ionen, also muß nur ca. 1/150.000 der Gesamtmenge an K+ aus der Zelle fließen Æ KEINE nennenswerte Änderung der Ionenkonzentration. Trotzdem, da dauernd Ionen durch Membran fließen, muß Zelle durch Pumpen dagegen anarbeiten Æ diese verbrauchen ca. 70% der Energie des Neurons Elektrotonische Eigenschaften der Plasmamembran (passive Reizleitung) Exzitatorische und inhibitorische post-synaptische Potentiale (EPSPs & IPSPs) werden in Dendriten passiv fortgeleitet Zytoplasma in Dendrit ist 107x schlechterer Leiter als Metalldraht mit gleichem d Æ Beträchtlicher Anteil des Stromes geht durch die Membran verloren passive Signale werden durch Widerstand von Cytosol und Kapazität von Membran 1). abgeschwächt und 2). zeitlich verzögert, je weiter sie wandern Signale schwächen mit Entfernung vom Ursprung ab RM: 1.000 – 100.000 Ωcm² je nach Art und Zustand des Neurons λ= 0.1-1 mm Æ passive Leitung nur über kurze Distanz Vx = V0 e –x/λ ; λ = rm/ri ; λ = Rmd/4Ri r = Widerstand in Segment der Länge l; R=spezifischer Widerstand je mehr Kanäle in Membran, desto kleiner rm und λ, desto weniger weit kommt Signal elektrotonische Leitung im Dendriten Verzweigungen, unterschiedliche Durchmesser müssen beachtet werden, ausserdem Randbedingungen, da Dendriten kurz 1 Extrema: 1. Dendrit endet an Punkt a, kein Strom in axialer Richtung möglich, alles durch Membran Spannung fällt langsam ab 2. Dendrit öffnet sich in Raum mit grossem Durchmesser (anderer Dendrit oder Soma), Innenwiderstand nimmt stark ab, Membrankapazität steigt an Spannung fällt schnell ab 2 a b c x Verzögerung und Verkleinerung transienter Signale im Dendriten Messung im Soma, Signalursprung an verschiedenen Punkten: Amplitude wird kleiner, je weiter weg Signalursprung zeitliche Verzögerung wird größer Morpho-elektrotonische Transformation (MET) Elektrotonische Länge L = x / λ Soma Wichtig für „backpropagation“ von Aktionspotentialen in den Dendritenbaum MET II: höherfrequente Signale werden stärker abgeschwächt als niederfrequente „low-pass filter“ durch die Membrankapazität Zeitliche und räumliche Summation dendritischer EPSPs erlaubt Integration von Signalen ABER: räumliche Summation nur linear, wenn Signale räumlich entfernt voneinander eintreffen, sonst "schließen" sich Ströme, die Membrankondensator aufladen "kurz", Signale schwächen sich durch Überlagerung ab, da das erste Signal die Membraneigenschaften verändert MET III: Elektrotonische Eigenschaften können dynamisch sein K+ Kanäle werden durch Depolarisierung geschlossen, Membranwiderstand steigt, somit wird λ gross, L klein, Signale kommen leichter bis zum Soma; stärkere Depolarisierung läßt andere K+-Kanäle öffnen Æ L wieder größer Form dendritischer Dornen beeinflußt Stärke von EPSPs elektrotonische Leitung im Axon Signal muß große Entfernung schnell überwinden (τ = RC soll klein sein) und weit kommen (λ muß groß sein) Æ also sollte Rm groß sein, Ri klein sein (λ = Rmd/4Ri) (oder Durchmesser größer: rm ~ 1/d², aber dann Platzproblem...) Problem: wenn Rm groß ist τ auch groß (τ = RC) Æ Signal wird stark verzögert Lösung: C muß kleiner werden: "Dicke" der Isolierschicht wird erhöht Æ Kapazität wird erniedrigt, Ladungen „spüren“ sich nicht mehr so stark Cm ~ 1/x ; x = Dicke der Isolierschicht (viele R in Serie zur Membran schaltet: Rm = R1+R2+…+Rx) Î Myelinisierung Signalgeschwindigkeit (m/sec) in myelinisierten Axonen Æ ca. 6 x so gross wie Axondurchmesser in µm (empirischer ‚Hursh‘ Faktor) bei gleichem Durchmesser: Signal in myelinisiertem Axon ca. 100 x schneller als ohne Myelin Das Aktionspotential 1 mm aus Hodgkin & Huxley, 1939 kleine Ströme Æ Membranpotential folgt mit kleinen Veränderungen (ca. +2 bis +5 mV) Depolarisation um 10-20 mV Æ Membranspannung folgt mit sehr großem „Spannungssprung“ Das Aktionspotential Schwellenwert 10-20 mV über Ruhepotential Æ plötzliche Depolarisation bis ca. + 40 mV, ca. 1 ms „Aktionspotential“ „alles-oder-nichts-Prinzip“ Æ Amplitude enthält keine Information über Stärke des ursprünglichen Stimulus Spannungsgesteuerte Na+-Kanäle sind für den Anstieg des Aktionspotentials verantwortlich Spannungsgesteuerte Kaliumkanäle beenden das Aktionspotential ? Spannungsklemme Hyperpolarisation Depolarisation „unter Spannungsklemme“ ? ? Ströme unter Spannungsklemme, bei verschieden stark eingestellten Depolarisationen (Umkehrpotential Na+ ca. +50 mV) Strom-Spannungs-Beziehung der frühen und späten Ströme beim Aktionspotential unter Spannungsklemme Wodurch werden die frühen Ströme geleitet ? ? Ionenaustausch-Experimente (Außenmedium Na+-frei) Pharmakologische Blockierung der Na+- und der K+-Kanäle (Tetrodotoxin; Tetraethylammonium) Refraktorische Periode und Frequenzkodierung Rückkehr von Na+-Kanal aus inaktivem Zustand erst ab bestimmtem Potential möglich (negativer im Vegl. zu Spitze des AP's Æ vorher absolute Refraktärphase Aktionspotentiale können sich nur in eine Richtung ausbreiten ! Refraktärphase Frequenzkodierung der Stimulusstärke Fortpflanzung des Aktionspotentials passive Weiterleitung das Aktionspotential „springt“ 1-2 mm Ranvier´scher Schnürringe Figure 3.13. Saltatory action potential conduction along a myelinated axon. (A) Diagram of a myelinated axon. (B) Local current in response to action potential initiation at a particular site flows locally, as described in Figure 3.12. However, the presence of myelin prevents the local current from leaking across the internodal membrane; it therefore flows farther along the axon than it would in the absence of myelin. Moreover, voltage-gated Na+ channels are present only at the nodes of Ranvier. This arrangement means that the generation of active, voltage-gated currents need only occur at these unmyelinated regions. The result is a greatly enhanced velocity of action potential conduction. Panel to the left of the figure legend shows the changing membrane potential as a function of time at the points indicated. Figure 3.14. Comparison of speed of action potential conduction in unmyelinated (upper) and myelinated (lower) axons. In Neuronen viele Arten von Ionenkanälen mit charakteristischen Strömen, die neuronale Aktivität bestimmen Na+-Ströme: Inaktivierende und nicht inaktivierende K+-Ströme: auch inaktivierende, andere, die durch Ca2+ moduliert sind, sehr grosse Genfamilie Cl--Ströme: hyperpolarisierend, inhibitorisch Ca2+-Ströme: cytosolisches Ca2+ hat viele Funktionen, second messenger, beeinflußt Genexpression, Neurotransmitter Freisetzung, moduliert Ionenkanäle, Kinasen, etc. Unterschiedliche Arten neuronaler Aktivität Berndt et al., Nat. Neurosci. 2008