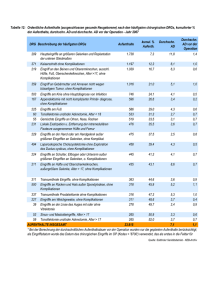
Korrelation des präoperativen physischen Status und prädiktiver
Werbung

Aus der Chirurgischen Universitätsklinik Abteilung Allgemeine und Viszeralchirurgie mit Poliklinik der Albert-Ludwigs-Universität Freiburg im Breisgau Direktor: Prof. Dr. Dr. h. c. U. T. Hopt Korrelation des präoperativen physischen Status und prädiktiver Parameter mit perioperativer Morbidität, Mortalität und Langzeitüberleben nach Ösophagusresektion INAUGURAL-DISSERTATION Zur Erlangung des Medizinischen Doktorgrades der Medizinischen Fakultät der Albert-Ludwigs-Universität Freiburg im Breisgau vorgelegt 2005 von Wolfram Johannes Hörth geboren in Kehl am Rhein Dekan: Prof. Dr. med. Christoph Peters Erstgutachter: Prof. Dr. med. Andreas Imdahl Zweitgutachter: PD Dr. med. Florian Otto Jahr der Promotion: 2006 Inhaltsverzeichnis 1. Einleitung 1.1. Überblick ...................................................................................................................... 1 1.2. Ösophageale Neoplasien ............................................................................................... 2 1.2.1. Primäre Tumoren ..................................................................................... 2 1.2.2. Sekundäre Tumoren ................................................................................. 2 1.3. Epidemiologie, Ätiologie und Klinik des Ösophaguskarzinoms .................................. 4 1.3.1. 1.3.2. 1.3.3. 1.3.4. Epidemiologie .......................................................................................... 4 Risikofaktoren .......................................................................................... 7 Pathogenesekonzepte ............................................................................... 9 Klinik ...................................................................................................... 13 1.4. Diagnostik und Klassifikation des Ösophaguskarzinoms ........................................... 14 1.4.1. 1.4.2. 1.4.3. 1.4.4. 1.4.5. 1.4.6. 1.4.7. Allgemeine klinisch-topographische Klassifikation ............................... 14 Klassifikation der Adenokarzinome ....................................................... 14 TNM-Klassifikation ................................................................................ 15 Residualtumor-Klassifikation ................................................................. 16 Histopathologisches Grading .................................................................. 16 Stadiengruppierung und 5-Jahres-Überlebensrate .................................. 17 Klinisches Staging .................................................................................. 18 1.5. Therapie ...................................................................................................................... 21 1.5.1. Neoadjuvante Therapie ............................................................................ 22 1.5.2. Operativer Eingriff unter kurativem Gesichtspunkt ................................ 23 1.6. Patientenselektion ....................................................................................................... 25 1.6.1. Einfluss der Beeinträchtigung wichtiger Organsysteme .......................... 26 1.6.2. Freiburger Standardprogramm zur Ermittlung der Narkose- und Operationsfähigkeit vor elektiver Ösophagusresektion ........................... 28 1.6.3. Präoperative Risikoanalyse nach H. Bartels et al. ................................... 29 1.7. Ziel dieser Arbeit ........................................................................................................ 32 2. Material und Methoden 2.1. Datenerhebung .......................................................................................................... 33 2.1.1. 2.1.2. 2.1.3. 2.1.4. 2.1.5. 2.1.6. 2.1.7. 2.1.8. 2.1.9. Allgemeine Patientendaten ...................................................................... 33 Angaben zu Lebensgewohnheiten und Gesundheitszustand ................... 33 Präoperative Tumordiagnostik ................................................................. 34 Weitere präoperativ erhobene Befunde und Parameter .............................34 Angaben zur neoadjuvanten Therapie ...................................................... 35 Operation .................................................................................................. 35 Pathologisches Staging ............................................................................. 35 Perioperativer Verlauf .............................................................................. 36 Langzeitüberleben .................................................................................... 37 2.2. Verfügbarkeit der Daten ............................................................................................ 38 2.3. Statistische Auswertung ............................................................................................. 40 3. Ergebnisse 3.1. Präoperativ erhobene Parameter .................................................................................. 41 3.1.1. 3.1.2. 3.1.3. 3.1.4. 3.1.5. Allgemeine Patientendaten ...................................................................... 41 Anamnestische Angaben ......................................................................... 42 Präoperative Tumordiagnostik .................................................................44 Weitere präoperativ erhobene Befunde und Parameter ........................... 45 Angaben zur neoadjuvanten Therapie ..................................................... 48 3.2. Angaben zur Operation ................................................................................................ 50 3.3. Pathologisches Staging und Grading ........................................................................... 51 3.4. Perioperativer Verlauf und retrospektive Anwendung des Bartels-Scores ................. 53 3.4.1. 3.4.2. 3.4.3. 3.4.4. 3.4.5. Dauer des postoperativen stationären Aufenthalts .................................... 53 Perioperative Morbidität ........................................................................... 55 Perioperative Letalität ............................................................................... 63 Ergebnisse der Regressionsanalyse ........................................................... 67 Retrospektive Anwendung des Bartels-Scores ......................................... 70 3.5. Langzeitüberleben ........................................................................................................ 73 4. Diskussion 4.1. Methodenkritik und Einschätzung des Wertes der erhobenen Daten .......................... 79 4.2. Allgemeinen Angaben ................................................................................................. 80 4.3. Lebensgewohnheiten und Begleiterkrankungen .......................................................... 82 4.4. Operatives Vorgehen ................................................................................................... 83 4.5. Tumorlokalisation und postoperative Pathologie ........................................................ 85 4.6. Perioperativer Verlauf und Langzeitüberleben ............................................................ 86 4.7. Retrospektive Anwendung des Bartels-Scores ............................................................ 92 4.7.1. Darstellung der Untersuchungskollektive .................................................... 92 4.7.2. Abweichungen von den Maßgaben des Scores ............................................ 93 4.7.3. Perioperative Letalität in den drei Untersuchungskollektiven ..................... 94 4.7.4. Perioperative Letalität innerhalb der einzelnen Risikogruppen ................... 94 4.7.5. Perioperative Letalität und erreichter Score ................................................. 97 4.8. Risikoanalysen im Vergleich ........................................................................................ 99 4.8.1. Risikoanalysen mit der Zielgröße „perioperative Letalität“ ......................... 99 4.8.2. Risikoanalysen mit der Zielgröße „pulmonale Komplikationen“ ...............102 4.9. Patientenaufkommen ...................................................................................................104 4.10. Schlussfolgerung ...................................................................................................... 105 5. Zusammenfassung ................................................................................................... 106 6. Literaturverzeichnis .................................................................................................107 7. Lebenslauf ................................................................................................................... 121 8. Danksagung ................................................................................................................ 123 1 1. Einleitung 1.1. Überblick Das Ösophaguskarzinom ist ein relativ seltenes Malignom mit schlechter Prognose. Die aktuellsten epidemiologischen Zahlen beziehen sich auf die Vereinigten Staaten von Amerika; dort wurden für das Jahr 2004 etwa 14250 Neuerkrankungen und 13300 Todesfälle erwartet. Bezüglich Diagnostik und Therapie konnten in den letzten Jahren gewisse Fortschritte erzielt werden. Die Behandlung erfolgt heute an Zentren; unter kurativer Zielsetzung folgt man multimodalen Konzepten, bei denen sich, je nach Tumorstadium und klinischem Gesamtbild, operative Verfahren mit Bestrahlung und systemischer Chemotherapie ergänzen. Die wesentliche Säule der kurativen Therapie ist dabei nach wie vor die Ösophagusresektion mit Lymphadenektomie und Speiseröhrenersatz. Der Nutzen der chirurgischen Intervention ist gut belegt; allerdings geht mit der Größe des Eingriffs auch ein relativ hohes Risiko perioperativer Morbidität und Mortalität einher. Neben dem Tumorstadium kommt bei der Beurteilung der Operabilität daher der präoperativen Einschätzung des körperlichen Gesamtstatus des Patienten eine wichtige Rolle zu. H. Bartels, H.J. Stein und J.R. Siewert haben bereits 1998 ein Bewertungssystem zur Optimierung der Risikoerfassung vor Ösophagusresektion publiziert, mit dessen Hilfe es gelang, in einer prospektiven Studie mit 323 Patienten die perioperative Mortalität von vormals 9,9% auf 1,2% zu senken. In der vorliegenden Arbeit werden die Patientendaten zu 131 Ösophagusresektionen bei Ösophaguskarzinom in bezug auf präoperativen Status, Therapie, perioperative Morbidität und Mortalität sowie bezüglich des Langzeitüberlebens retrospektiv analysiert. Die Operationen wurden zwischen Januar 1991 und Januar 2003 in der Abteilung für Allgemeine und Viszeralchirurgie der Universitätsklinik Freiburg durchgeführt. 2 1.2. Ösophageale Neoplasien 1.2.1. Primäre Tumoren Die häufigste Neubildung im Bereich der Speiseröhre ist das squamöse Papillom; man geht von einer Prävalenz von bis zu 1% aus. Zwar wird im Zusammenhang mit einer Infektion mit bestimmten Stämmen des Humanen Papillomavirus die Möglichkeit einer malignen Entartung diskutiert, es gibt aber bislang keinen Anlass zur therapeutischen Intervention [49]. Unter den benignen Ösophagustumoren kommt deshalb vom chirurgischen Standpunkt aus dem Leiomyom die größte Bedeutung zu, gefolgt von Lipom und Fibrom, die allerdings beide erheblich seltener sind. Ein eigentliches Entartungsrisiko besteht bei keiner dieser Neoplasien. Ein Eingriff dient vorwiegend der Diagnosesicherung im Sinne des Ausräumens eines Malignitätsverdachts [120]. Bei den malignen Tumoren des Ösophagus handelt es sich bei der weitaus größten Zahl der Fälle um Karzinome, meist um Plattenepithel- oder Adenokarzinome. Für die vorliegende Arbeit sind diese beiden Typen von wesentlicher Bedeutung. Kleinzellige und undifferenzierte Karzinome sind selten, andere Karzinome und Malignome nichtepithelialen Ursprungs sind ausgesprochen rar [60]. Eine Übersicht über die primären ösophagealen Neoplasien gibt Tabelle 1 (Seite 3). 1.2.2. Sekundäre Tumoren Gelegentlich kommt es im Bereich der Speiseröhre auch zur Absiedlung von Metastasen. Meist stammen sie von Karzinomen mit primärer Lokalisation in Lunge, Mamma oder Magen [60]. 3 Tabelle 1: Primäre Ösophagustumoren nach Klassifikation der WHO [60] Epitheliale Tumoren: Nicht-epitheliale Tumoren: Squamöses Papillom Leiomyom Intraepitheliale Neoplasie • squamöse • glanduläre (adenomatöse) Lipom Karzinome • Plattenepithelkarzinom (Normalform) • Verrucöses Plattenepithelkarzinom • Basaloides Plattenepithelkarzinom • Spindelzelliges Plattenepithelkarzinom • Adenokarzinom • Adenosquamöses Karzinom • Mucoepidermoides Karzinom • Adenoid zystisches Karzinom • Kleinzelliges Karzinom • Undifferenziertes Karzinom • Andere Gastrointestinaler Strumatumor • benigne • unklarer Dignität • maligne Karzinoider Tumor Granularzelltumor Leiomyosarkom Rhabdomyosarkom Kaposi Sarkom Malignes Melanom Andere 4 1.3. Epidemiologie, Ätiologie und Klinik des Ösophaguskarzinoms 1.3.1. Epidemiologie Bei einer Analyse von Daten der Weltgesundheitsorganisation für das Jahr 1990, die etwa 28% der Weltbevölkerung repräsentieren, stehen Krebserkrankungen der Speiseröhre mit 286000 gemeldeten Todesfällen unter den krebsbezogenen Todesursachen an sechster Stelle [112]. Insgesamt betrug die altersstandardisierte Inzidenz (ASR*) bei Männern 9,3 und bei Frauen 3,8. Abgesehen von der deutlich höheren Morbidität beim männlichen Geschlecht, bestehen vor allem erhebliche geographische Unterschiede. Südafrika (ASR ♂= 28,9; ♀= 10,5) und China (ASR ♂= 19,8; ♀= 9,1) stehen bezüglich der Erkrankungshäufigkeit und der Mortalität bei beiden Geschlechtern deutlich an der Spitze, gefolgt von Ostafrika und einem südwestasiatischen Hochinzidengürtel, der ausgehend vom Osten der Türkei, über die südlichen GUS-Staaten bis nach Zentralasien reicht und auch Iran und Irak einschließt [91, 110,112,124]. In Europa gelten vor allem Nordwestfrankreich und Teile der Schweiz als Gebiete mit erhöhter Inzidenz, aber auch Finnland, Schottland und Island [91,110,124]. Etwa 80% der Todesfälle entfallen auf Entwicklungs- und Schwellenländer [112]. Während dort das Plattenepithelkarzinom unter den malignen ösophagealen Tumoren nach wie vor klar dominiert, steigt in den Industrieländern der Anteil des Adenokarzinoms rapide an [110,124,128]. Die beste Datenlage besteht für die Vereinigten Staaten: Inzidenz und Mortalität des Ösophaguskarzinoms sind bereits für die Jahre 1975-2001 getrennt nach Erkrankungsalter, Geschlecht und Ethnie statistisch erschlossen [103]. Die American Cancer Society nennt für das Jahr 2003 etwa 13900 Neuerkrankungen, davon 10600 bei Männer und 3300 bei Frauen. Damit liegt das Lebenszeitrisiko für USamerikanischen Männern derzeit etwa bei 0,8%, für US-amerikanische Frauen bei 0,3%. Das mittlere Erkrankungsalter bei Diagnosestellung wird mit 67 Jahren angegeben. Im selben Zeitraum sind dort 13000 Menschen an den Folgen eines Ösophaguskarzinoms gestorben, davon 9900 Männer und 3100 Frauen [4,39]. Dabei nimmt der Anteil des Adenokarzinoms seit den 70er Jahren exponentiell zu [32]; in den Vereinigten Staaten ist dieser histologische Typ sogar das Malignom mit der am stärksten steigenden Zahl an Neuerkrankungen überhaupt [2]: im Erhebungszeitraum 1992-1994 lag * Im folgenden beziehen sich Angaben zur Inzidenz immer auf 100000 Einwohner; soweit nicht anders vermerkt, handelt es sich um die bezüglich der Weltstandardbevölkerung altersstandardisierte Rate (ASR). 5 seine Inzidenz unter den weißen US-amerikanischen Männer nach einem Anstieg von mehr als 350% gegenüber den Jahren 1974-1979 mit 3,2 erstmals höher als die des Plattenepithelkarzinoms mit 2,2. Bei letzterem blieb die Zahl der Neuerkrankungen dagegen in allen Bevölkerungsgruppen weitgehend konstant [32]. Für das Jahr 2004 wurden insgesamt etwa 14250 Neuerkrankungen erwartet [5]. Dagegen ist die Informationslage über die epidemiologische Situation in Deutschland aufgrund des Fehlens eines einheitlichen Krebsregisters deutlich schlechter. Für die Jahre 1998 bis 2000 liegen zumindest für einen Teil der Bundesländer vergleichbare Daten vor (Tabelle 2, Seite 6). Für das gesamte Bundesgebiet wird in diesem Zeitraum die Zahl der jährlich Neuerkrankten auf 3370 Männer und 880 Frauen geschätzt; das entspricht einer altersstandardisierten Inzidenz von 7,5 beziehungsweise 1,4, womit das Ösophaguskarzinom an der Gesamtzahl der malignen Neuerkrankungen bei den Männern einen Anteil von etwa 2%, bei den Frauen von etwa 0,5% hat [8]. Damit lag Deutschland bezüglich der relativen Häufigkeit von Neuerkrankungen für das Jahr 1998 im Vergleich mit den anderen Mitgliedsstaaten der Europäischen Union sowohl bei Männern als auch bei Frauen im Mittelfeld [41]. Der Anteil an den krebsbezogenen Todesfällen wird bei den Männern mit 2,9% und bei den Frauen mit 0,9% angegeben. Das mittlere Erkrankungsalter liegt bei Männern bei 63 Jahren, bei Frauen bei 70 Jahren und damit 3 Jahre unter beziehungsweise 3 Jahre über dem jeweiligen geschlechtsspezifischen mittleren Alter bei Erstmanifestation einer Krebserkrankung in Deutschland [8]. Bezüglich der Inzidenzentwicklung bei den beiden wichtigsten histologischen Typen wurden für die ostdeutschen Bundesländer Brandenburg, Mecklenburg-Vorpommern und Sachsen für die Jahre 1977-1989 und 1997-1998, sowie für das Saarland für die Jahre 1986-1997 folgende Zahlen publiziert [14]: Insgesamt lag der Anteil des Adenokarzinoms bei etwa 18%. Unter der männlichen Bevölkerung des Saarlandes stieg im angegebenen Zeitintervall die Inzidenz des Adenokarzinoms um 432% von 0,22 auf 1,17, in den untersuchten drei östlichen Bundesländern um 248% von 0,23 auf 0,8; unter den Frauen lag sie bei geringfügigem Zuwachs deutlich niedriger. Für das Saarland ergibt sich ein Geschlechterverhältnis ♂:♀ von 4:1, für die drei östlichen Bundesländer von 3,6:1. Zum Zeitpunkt der Erstdiagnose waren 84% der Betroffenen älter als 54 Jahre. Die Inzidenz des Plattenepithelkarzinoms blieb insgesamt weitgehend konstant. Sein Anteil an den Ösophaguskarzinomen lag in beiden Kollektiven noch bei über 80%. Für das Saarland ergab sich hier ein Geschlechterverhältnis ♂:♀ von 4,8:1, für die drei östlichen Bundesländer 6 von 4:1. In Deutschland war damit im genannten Zeitraum das Plattenepithelkarzinom auch unter der männlichen Bevölkerung noch der häufigste Typ des Ösophaguskarzinoms. Die Inzidenz des Adenokarzinoms dürfte allerdings zwischenzeitlich erheblich zugenommen haben. Datenanalysen für Australien [137], Neuseeland [9], Großbritannien [93,114], Skandinavien [58,59,98,122] , Frankreich [87] und die Schweiz [85] zeigen den selben Trend. Tabelle 2: Verfügbare Angaben zur jährlichen Inzidenz des Ösophaguskarzinoms in Deutschland 1998-2000: Erkrankungen pro 100000 Einwohner; altersstandartisierte Rate. Bei einem Erfassungsgrad < 90% ist die Angabe mit * gekennzeichnet. [8] Region Männer Frauen Baden-Württemberg (nur Ortenaukreis) 10,8 1,6 Bayern 5,7* 0,9* Berlin 8,7* 2,4 Brandenburg 9,2 1,2* Bremen 9,3 1,4 Hamburg 9,0 2,5 Hessen (Regierungsbezirk Darmstadt) Register in der Aufbauphase Mecklenburg-Vorpommern 10,6 1,6 Niedersachsen (Regierungsbezirk Weser-Ems) 5,0* 1,0* Nordrhein-Westfalen (Regierungsbezirk Münster) 9,6 2,0 Rheinland-Pfalz 9,4* 1,6* Saarland 9,2 1,8 Sachsen 7,6 1,3 Sachsen-Anhalt 7,5* 1,1* Schleswig-Holstein 7,1* 1,6 Thüringen 6,2* 1,0 Deutschland gesamt (geschätzt) 7,5 1,4 7 1.3.2. Risikofaktoren Trotz umfangreicher molekularbiologischer Untersuchungen ist die genaue Ätiologie des Ösophaguskarzinoms weiterhin unklar. Exogene Noxen chemischer oder physikalischer Art scheinen in den meisten Fällen eine erhebliche Rolle zu spielen. Aufgrund der verfügbaren epidemiologischen Daten sind eine Reihe von Risikofaktoren bekannt. Tabelle 3: Synopse der Risikofaktoren für das Ösophaguskarzinom [39]: Risikofaktoren Nikotinabusus Alkoholabusus Barrett-Ösophagus Gastroösophagealer Reflux > 1 mal/Woche Übergewicht Armut Achalasie Verätzungen des Ösophagus Familiäre Tylosis Plummer-Vinson Syndrom HNO-Tumoren in der Vorgeschichte Strahlentherapie des Mediastinums Häufiger Konsum sehr heißer Getränke Regelmäßiger Gebrauch von ß-Blockern, Anticholinergika oder Aminophyllin Plattenepithel-CA +++ +++ - Adeno-CA ++ ++++ - +++ ++ +++ ++++ ++++ ++++ ++++ +++ + +/+++ - - +/- Ein einfaches Pluszeichen bezeichnet ein um weniger als das Doppelte erhöhtes Risiko, zwei Pluszeichen verweisen auf einen Risikoanstieg auf das Zwei- bis Vierfache, drei Pluszeichen auf einen Anstieg um das Vier- bis Achtfache, vier Pluszeichen auf einen Anstieg um einen Faktor größer acht. Risikofaktoren für das Plattenepithelkarzinom: In den Industrieländern kommt hier dem Alkohol- und Nikotinabusus die größte Bedeutung zu [8,23,132]. Die Höhe des Zigarettenkonsums korreliert direkt mit dem Erkrankungsrisikos [23,150]. Beide Faktoren scheinen sich in ihrer negativen Potenz synergistisch deutlich zu verstärken [21,91]. Dabei steigt auch das Risiko für Karzinome der oberen Speise- und Luftwege; eine Koinzidenz dieser Erkrankungen findet sich bei 1-2% der Patienten [40]. Prinzipiell kann aber ebenso jede andere chronische Irritation der ösophagealen Mucosa als Risikofaktor betrachtet werden: Reizung durch Speisereste bei Achalasie [117] oder bei Ösophagusdivertikeln [39,91,132], chronische Entzündungen im Rahmen von Infektionen der Speiseröhre, Laugenverätzungen [91,132], therapeutische oder akzidentelle 8 Strahlenexposition [10]. In einigen Regionen Asiens spielt offenbar das regelmäßige Trinken von sehr heißem Tee eine Rolle [48]. Auch der Konsum von Nahrungsmitteln, die stark mit Nitraten, Nitriten und Nitrosaminen [133] oder mit Mykotoxinen [39,132] belastet sind, gilt als relevanter Faktor; ebenso bestimmte Mangelzustände bei Vitaminen und Spurenelementen, wie Vitamin A und E, Folsäure, Zink, Selen, Molybdän und Eisen [91,132]. Ferner wird eine Papillomavirusinfektion, insbesondere mit den Hochrisikostämmen HPV 16 und 18, als möglicher Pathogenesefaktor diskutiert [91,96,132]. Bei der Familiären Tylosis, der nichtepidermolytischen palmoplantaren Keratose, kommt es neben den typischen Hautveränderungen in bis zu 95% der Fälle zur Entwicklung eines Ösophaguskarzinoms [38,132]. Die Erkrankung beruht auf einer seltenen genetischen Prädispositon mit Veränderungen auf Chromosom 17q25, und wird autosomal dominant vererbt. Das Plummer-Vinson-Syndrom, eine sideropenische Schleimhautatrophie an Zunge, Oropharynx und Ösophagus, gilt ebenfalls als erheblicher Risikofaktor [80,100,132]. Unter sozialmedizinischem Gesichtspunkt besteht ein deutlicher Zusammenhang mit schlechten sozioökonomischen Lebensbedingungen [23,112]. Risikofaktoren für das Adenokarzinom: Das Risiko der Entstehung eines Adenokarzinoms ist bei Personen mit häufig wiederkehrenden Symptomen von gastroösophagealem Reflux etwa um das achtfache erhöht. Allerdings kann Reflux auch ohne begleitende Beschwerden bestehen, und ist dann wahrscheinlich kaum weniger gefährlich. In diesem Zusammenhang ist der Verdacht gegeben, dass auch Medikamente, die den Tonus des gastroösophagealen Sphinkters erniedrigen indirekt die Karzinogenese begünstigen [77]. Im Gegenzug wird diskutiert, ob eventuell eine Infektion mit bestimmten cagA-Protein positiven Helicobacter-pylori-Stämmen das Risiko der Entstehung eines Adenokarzinoms reduziert, da sie offenbar jenes für gastroösophagealen Reflux senkt [51]. Die meisten, aber keineswegs alle Adenokarzinome entstehen auf dem Boden eines BarrettÖsophagus (syn.: Endobrachyösophagus), einer dysplastischen Umbildung des normalen Plattenepithels der Speiseröhrenwand in ein Zylinderepithel [132]. Das Risiko der malignen Transformation einer bestehenden Barrettläsion wird mit etwa 0,5% pro Jahr angegeben [39,119]. Zwar scheint die epidemiologische Koinzidenz der starken Zunahme von Barrett-Ösophagus und Übergewicht in den Industriestaaten einen Zusammenhang zwischen beidem nahezulegen, die Studienlage ist aber keineswegs eindeutig [23,26,39,79,91,104]. 9 Alkoholkonsum spielt bei der Genese des Adenokarzinoms keine wesentliche Rolle. Die Aussagen zum Nikotinabusus sind widersprüchlich. Sicherlich ist der Einfluss hier nicht so groß wie beim Plattenepithelkarzinom [23,47,91,150,151]. Eine Radiotherapie im Bereich des Mediastinums (zum Beispiel in Zusammenhang mit der Behandlung eines Mammakarzinoms) gilt gleichermaßen als Risikofaktor für die Entwicklung eines Plattenepithel-, wie eines Adenokarzinoms [10]. 1.3.3. Pathogenesekonzepte Formalpathogenetisch gehen beiden histologischen Typen spezifische präkanzeröse Läsionen voraus: sowohl die Entwicklung der Epitheldysplasie und die anschließende Tumortransformation beim Plattenepithelkarzinom als auch die Metaplasie-Dysplasie-Karzinom-Sequenz beim Adenokarzinom beruhen dabei auf dem kumulativen Effekt verschiedener molekularer und genetischer Veränderungen [97,132]. In beiden Fällen spielt die Inaktivierung des Protoonkogens p53 eine zentrale Rolle; die zugrundeliegenden Mutationsmuster sind allerdings unterschiedlich [97] und variieren beim Plattenepithelkarzinom zudem geographisch [60]. Eine weitere wichtige Veränderung bei beiden Tumorentitäten ist der Verlust der Funktion der Tumorsuppressorgene p15 und (weitaus häufiger) p16 aufgrund chromosomaler Alterationen, wodurch Zellzyklusregulation und DNA-Mismatch-Repair-System nachhaltig geschädigt werden [97]. Beim Plattenepithelkarzinom wurde in 20-40% Fälle eine deutliche Überexpression von Cyclin D1 nachgewiesen, die tendenziell mit einer höherer Proliferationsaktivität des Tumors, dem Nachweis befallener Lymphknoten und einem schlechteren Ansprechen auf eine verabreichte Chemotherapie einhergeht [60,97]. Auch die Expression des ras-Onkogens p21 korreliert invers mit dem Gesamtüberleben und gilt einigen Autoren dabei als besserer Prädiktor für das Langzeitüberleben als das pathologische Staging [134]. Bezüglich der Metaplasie-Dysplasie-Karzinom-Sequenz beim Barrettkarzinom scheint ein Verlust der Apoptoseregulation durch bcl-2 ein frühzeitiges Ereignis in der Malignitätsentwicklung darzustellen [97,148]. Außerdem ist bei beiden Tumorentitäten eine verstärkte Expression von Wachstumsfaktoren, wie dem Epidermal Growth Factor (EGF), dem Transforming Growth Factor Alpha (TGF-α) und der entsprechenden Rezeptoren häufig zu beobachten; für das Adenokarzinom ist zudem eine abnorme Expression von Adhäsionsmolekülen wie E-Cadherin, α-Catenin und ß-Catenin und eine Zunahme der Serin-Proteasen zu nennen [39,102]. Tabelle 4 und 5 (Seite 10-11) geben einen umfassenden Überblick über die bisher nachgewiesenen möglichen 10 chromosomalen Alterationen; es bleibt allerdings anzumerken, dass die Häufigkeit des jeweiligen Auftretens sehr unterschiedlich ist. Tabelle 4a: Synopse möglicher Zugewinne an chromosomalem Material beim Plattenepithelkarzinom des Ösophagus [97]. Ort der Alteration 3q 5p15.1-15.2 7p12.13 8q24 11q13 12p 13q34 14q32 17q 19 20q13.3 Xq27-28 Betroffene Gene und Genprodukte PK13CA, hTR CDH6, CDH12, CDH14 EGFR, Cyclin D1 C-MYC TFDPI Tabelle 4b: Synopse möglicher Verluste an chromosomalem Material beim Plattenepithelkarzinom des Ösophagus [97]. Ort der Alteration 3p 4q 5q21 9p21-22 9p23-24 11q13-15 13q14 17p13 18q21 Betroffene Gene und Genprodukte FHIT APC, MCC p16 c-ras-Ha-1 RB1 p53 DCC, DPC4, SMAD2, SMAD4 APC= Adenomatosis polyposis coli; CDH= Cadherin; C-MYC= c-myc myelocytomatosis oncogene; DPC= dystrophin-associated protein complex; EGFR= epidermal growth factor receptor; DCC= deleted in colorectal carcinoma; FHIT= fragile histidine triad gene; hTR= human telomerase RNA; MCC= mutated in colorectal cancer; PK13CA= gene for catalytic submit of phosphaticlylinositol-3 kinase; RB1= retinoblastomlocus 1; SMAD= signal transducer in the TGF-ß pathway; TFDPI= transcription factor. 11 Tabelle 5a: Synopse möglicher Zugewinne an chromosomalem Material beim Adenokarzinom des Ösophagus [97]. Ort der Alteration 2p 5p14 6p12-21 7p12 8q23-24.1 10q 12q21 15q25-26 17q12-21 19q13.1 20p12 20q12 20q13 Xp25 Betroffene Gene und Genprodukte MLV12 NRASL3 EGFR C-MYC IGF1R ERBB2/HER2-neu TGFb1, BCL3, AKT2 PCNA C-MYB, PTPN1 AIB1, BTAK, SRC Tabelle 5b: Synopse möglicher Verluste an chromosomalem Material beim Adenokarzinom des Ösophagus [97]. Ort der Alteration 3p14 4q 5q14-21 9p21 13q 14q31-32.1 16q23 17p 18q21 21q21 Y Betroffene Gene und Genprodukte FHIT, RCAI TSHR APC, MCC p16 (MTS1/CDKN2) TSHR p53 DCC, p15 AIB1= steroid receptor coactivator; APC= Adenomatosis polyposis coli; AKT2= v-akt murine thymoma oncogene 2; BCL3= B-cell CLL/lymphoma 3; BTAK= serin-threonin kinase; C-MYB= myeloblastosi-like oncogene; C-MYC= c-myc myelocytomatosis oncogene; EGFR=epidermal growth factor receptor; DCC=deleted in colorectal carcinoma; FHIT= fragile histidine triad gene; IGF1R: insuline-like growth factor 1 receptor; MCC= mutated in colorectal cancer; MLV12= MoMulV, integration site 2; MTS1= multiple tumor suppressor 1; NRASL3= c-Nras; PCNA= proliferating cell nuclear antigene; PTPN1= protein tyrosine phosphatase nonrec. Type 1; SRC= nonreceptor tyrosine kinase; TGFb1= transforming growth factor b1; TSHR= thyroid stimulating hormone receptor. 12 Bei Gegenüberstellung der molekularen Mechanismen der häufigsten malignen Tumoren des oberen Gastrointestinaltrakts, zu denen neben dem Adeno- und Plattenepithelkarzinom des Ösophagus auch die Adenokarzionome der Kardia und des Magens zählen, zeigen sich eine Reihe wichtiger Gemeinsamkeiten [Abbildung 1]. Abbildung 1: Venn Diagramm zur Darstellung der Gemeinsamkeiten und Unterschiede bezüglich der veränderten Expression spezifischer Gene und Genprodukte beim Adenokarzinom des Ösophagus (AGC), dem Plattenepithelkarzinom des Ösophagus (ESCC), dem Adenokarzinom des Magens (GC) und der Kardia (AGC) [89]. ↑= vermehrte Expression; ↓= verminderte Expression; APC= Adenomatosis polyposis coli ; Bax= BCL2-associated X-protein ; BCL2= B-cell CLL/lymphoma 2; CK= cytokeratin; COX= cyclooxygenase; DCC= deleted in colorectal carcinoma; EGF= epidermal growth factor; EGFR= epidermal growth factor receptor; ERBB2= erbBOnkogen; Fas= a member of the tumor necrosis factor superfamily; FHIT= fragile histidine triad gene; IL-1= Interleucin 1; K-SAM= fibroblast growth factor receptor; KRas= a member of the RAS-family of protooncogens; MET= hepatocyte growth factor receptor; MDM2= an inhibitor of p53; MSI= microsatellite instability; MYC= myelocytomatosis oncogene; Rb0= retinoblastomlocus 0; SRC= nonreceptor tyrosine kinase; TOC= tylosis esophageal cancer gene locus. 13 1.3.4. Klinik des Ösophaguskarzinoms In den prognostisch günstigeren Frühstadien verläuft die Erkrankung meist asymptomatisch. Das Leitsymptom „Dysphagie“ tritt in der Regel erst auf, wenn etwa zwei Drittel des ösophagealen Lumens verlegt sind. So handelt es sich zum Zeitpunkt der Erstdiagnose bei mehr als 50% der Patienten um ein so fortgeschrittenes Krankheitsstadium, dass entweder der Tumor lokal als nicht resektabel erscheint, oder sich bereits Fernmetastasen nachweisen lassen. Die zunehmende Verlegung der Speiseröhre geht dann mit Reurgitation fester Nahrung und oft mit massivem Gewichtsverlust einher. Unspezifische Frühsymptome wie retrosternales Brennen oder Globusgefühl führen oft nicht zur richtigen Diagnose [120]. In einer amerikanischen Studie mit 907 Patienten aus dem Jahr 1986 stellte sich die relative Häufigkeit der angegebenen Beschwerden bei Erstdiagnose eines Ösophaguskarzinoms wie folgt dar [43]: Dysphagie 85,4% Gewichtsverlust 60,9% Retrosternaler Schmerz 26,5% Regurgitation oder Erbrechen 22,8% Heiserkeit 4,4% Husten 2,5% Im Einzelfall kann es auch zu Melaena, Hämatemesis oder (im Zusammenhang mit einer ösophagotrachealen Fistel) zur Aspirationspneumonie kommen. 14 1.4. Diagnostik und Klassifikation des Ösophaguskarzinoms Therapieentscheidung und Prognose sind wie bei allen Malignomen wesentlich abhängig von der Lokalisation, der lokalen und systemischen Ausdehnung und der histologischen Beschaffenheit des Tumors zum Zeitpunkt der Diagnosestellung. Klassifikationssysteme ermöglichen die Standardisierung des diagnostischen und therapeutischen Vorgehens und damit die Vergleichbarkeit von Befunden und Therapieergebnissen. 1.4.1. Allgemeine klinisch-topographische Klassifikation [149] Neben der Zuordnung des Tumors zu einem der anatomischen Bereiche der Speiseröhre ist unter therapeutischen Gesichtspunkten auch seine Lage in bezug zum Tracheobronchialystem von Bedeutung. Dies spiegelt sich in der im folgenden aufgeführten klinisch-topographischen Klassifikation des Ösophaguskarzinoms wieder (die Längenangaben in Zentimeter bezieht sich dabei auf Personen von normaler Körpergröße): 1. Zervikaler Ösophagus: Vom Unterrand des Ringknorpels bis zum Durchtritt durch die obere Thoraxapertur (bis etwa 18 cm distal der oberen Schneidezähne). 2. Intrathorakaler (und abdominaler) Ösophagus: a) oberer thorakaler Abschnitt: von der oberen Thoraxapertur bis zur Höhe der Trachealbifurkation (bis etwa 24 cm distal der oberen Schneidezähne). b) mittlerer thorakaler Abschnitt: die obere Hälfte des Abschnitts von der Trachealbifurkation bis zum gastroösophagealen Übergang (bis etwa 32 cm distal der oberen Schneidezähne). c) unterer thorakaler und abdominaler Abschnitt: die untere Hälfte des Abschnitts von der Trachealbifurkation bis zum gastroösophagealen Übergang (bis etwa 40 cm distal der oberen Schneidezähne). Maligne Tumoren im Bezirk 1 und 2.a infiltrieren aufgrund ihrer engen Nachbarschaft oft bereits früh das Tracheobronchialsystem und sind dann kaum noch im kurativen Sinne resektabel [120]. 1.4.2. Klassifikation der Adenokarzinome des distalen Ösophagus und des gastroösophagealen Übergangs [142] Die Adenokarzinome im Bereich von 2 cm oral bis 2 cm aboral der anatomischen Cardia werden nach Empfehlung der International Gastric Cancer Association und der International 15 Society for the Diseases of the Esophagus wie folgt klassifiziert: Typ I Tumor: Adenokarzinom des distalen Ösophagus Typ II Tumor: Eigentliches Cardiakarzinom Typ III Tumor: Subcardiales Magenkarzinom Dabei bezieht sich die jeweilige Zuordnung auf die muskuläre Grenze zwischen Ösophagus und Magen und nicht auf die Mucosa. Tumoren vom Typ II und Typ III zählen allerdings nicht zu den Ösophaguskarzinomen und spielen in der vorliegenden Arbeit keine weitere Rolle. 1.4.3. TNM-Klassifikation des Ösophaguskarzinoms nach Maßgabe der UICC/AJCC von 1987 und ihre jüngste Aktualisierung von 1997 Die TNM-Klassifikation dient der Beschreibung und Dokumentation der anatomischen Ausdehnung der Erkrankung. Klinische TNM-Klassifikation [6,146,149]: Sie ist das Resultat klinischer Diagnostik und bildet die Grundlage der Therapieentscheidung. T-Kategorie: Primärtumor TX: Primärtumor nicht beurteilbar T0 : Kein Anhalt für einen Primärtumor Tis : Carcinoma in situ T1: Tumor infiltriert die Lamina propria oder die Submukosa T2: Tumor infiltriert die Muscularis propria T3: Tumor infiltriert die Adventitia T4: Tumor infiltriert Nachbarstrukturen N-Kategorie: Regionäre Lymphknoten NX: Regionärer Lymphknotenstatus nicht beurteilbar N0: Keine regionären Lymphknotenmetastasen N1: Nachweis von regionären Lymphknotenmetastasen M-Kategorie: Fernmetastasen MX: Fernmetastasen nicht beurteilbar M0: Kein Anhalt für Fernmetastasen M1: Nachweis von Fernmetastasen 16 In Ergänzung dazu gilt seit 1997 : Für Tumoren des unteren thorakalen Ösophagus: M1a: Metastase(n) in zöliakalen Lymphknoten M1b: Andere Fernmetastasen Für Tumoren des mittleren thorakalen Ösophagus: M1a: Nicht anwendbar M1b: Befall nichtregionärer Lymphknoten und andere Fernmetastasen Für Tumoren des oberen thorakalen Ösophagus: M1a: Metastase(n) in zervikalen Lymphknoten M1b: Andere Fernmetastasen Pathologische (p-)TNM-Klassifikation [149]: Nach der Beurteilung des Resektats durch den Pathologen erfolgt die Klassifikation in pTNM-Stadien in Anlehnung an die obengenannten klinischen Kategorien. Bezüglich der pNKategorie sollten dazu nach Maßgabe von 1997 mindestens 6 regionäre Lymphknoten histologisch aufgearbeitet worden sein. ypTNM verweist auf eine vor Exzision und pathologischer Beurteilung stattgehabte multimodale Therapie. 1.4.4. Residualtumor-(R-)Klassifikation [149] Aus historischen Gründen ist die R-Klassifikation nicht obligater Bestandteil der TNMKlassifikation. Nach chirurgischer Therapie ist sie allerdings aufgrund ihrer prognostischen Bedeutung unerlässlich und im Dokumentationssystem der Arbeitsgemeinschaft Deutscher Tumorzentren (ADT) deshalb zwingend vorgesehen: R0: Residualtumor nicht nachweisbar; komplette chirurgische Tumorentfernung R1: Mikroskopischer Residualtumor nachweisbar R2: Makroskopischer Residualtumor nachweisbar 1.4.5. Histopathologisches Grading Bei der Bestimmung des Tumorgewebes werden gemäß der Vorgaben der UICC von 1987 folgende Grade der histopathologischen Differenzierung unterschieden [123,149]: GX: Differenzierungsgrad kann nicht bestimmt werden G1: Gut differenziert G2: Mäßig differenziert G3: Schlecht differenziert G4: Undifferenziert 17 Im Dokumentationssystem der Arbeitsgemeinschaft Deutscher Tumorzentren werden in Übereinstimmung mit der Internationalen Histologischen Klassifikation der WHO G1 und G2 auch als „low grade“, G3 und G4 als „high grade“ zusammengefasst [146]. 1.4.6. Stadiengruppierung und 5-Jahres-Überlebensrate Anhand der unterschiedlichen Überlebensraten lassen sich unter den TNM-Stadien weitere mehr oder weniger homogene Gruppen bilden: Tabelle 6: Stadiengruppierung nach Richtlinien der UICC/AJCC 1997 und 5-Jahres-Überlebensrate [39]. Stadium T-Klassifikation N-Klassifikation M-Klassifikation 5-J-Überlebensrate 0 Tis N0 M0 > 95% I T1 N0 M0 50-80% II A T2-3 N0 M0 30-40% II B T1-2 N1 M0 10-30% T3 N1 M0 T4 Jedes N M0 IV A Jedes T Jedes N M1a < 5% IV B Jedes T Jedes N M1b < 1% III 10-15% Es ist anzumerken, dass neben dieser Stadienzuordnung vermutlich auch andere Faktoren von prognostischer Bedeutung sind. So zeigte sich für Patienten mit Adenokarzinom (gegenüber Patienten mit Plattenepithelkarzinom nach R0-Resektion bei vergleichbarem pTNM-Stadium) in einer großen retrospektiven Studie (n= 1059) ein signifikanter Vorteil im 5-JahresÜberleben [121]. Die Rolle der neoadjuvanten Therapie wird unter 1.5.1. besprochen (Seite 22). 18 1.4.7. Klinisches Staging Ziel ist die exakte Klassifikation des Tumors und die Klärung seiner lokalen Resektabilität. Nach Anamnese und allgemeiner klinischer Untersuchung kommen folgende apparative Verfahren in Betracht: 1.4.7.1. Ösophago-Gastroskopie mit Biopsie Die Diagnose „Ösophaguskarzinom“ wird heute in aller Regel nach einer endoskopischen Untersuchung gestellt, bei der eine histologische Befundsicherung mittels Zangenbiopsie erfolgt. Dieses Vorgehen erlaubt bereits eine Abschätzung der lokalen Tumorausdehnung und ermöglicht eine Kontrolle bezüglich möglicher Zweitkarzinome des oberen Gastrointestinaltraktes [120]. 1.4.7.2. Röntgenkontrastuntersuchung des Ösophagus Beim „Breischluck“ mit Bariumsulfat in wässriger Suspension lässt sich die intraluminale Tumorausdehnung gut bestimmen. Das Verfahren ist im Gegensatz zur Endoskopie auch noch bei Bestehen einer hochgradigen Stenose anwendbar [120,141]. 1.4.7.3. Spiral-Computertomographie mit intravenöser Kontrastmittelgabe Dieses Verfahren eignet sich besonders zur Abklärung malignitätsverdächtiger abdomineller Lymphknoten und zum Aufspüren von Fernmetastasen, vor allem wenn sie typisch lokalisiert sind, zum Beispiel in Leber, Lunge oder Knochen [116]. Bei der Abschätzung der lokalen Ausdehnung des Primärherdes, insbesondere bei der Frage nach etwaiger Infiltration von Nachbarorganen scheint der CT-Befund allein, vor allem im Vergleich zur Endosonographie, nur eingeschränkt aussagekräftig zu sein [116,120]. 1.4.7.4. Röntgen-Thorax in zwei Ebenen Allgemeine Routineuntersuchung vor einem großen operativen Eingriff und Mittel der Wahl zum Ausschluss pulmonaler Metastasen [120,141]. 1.4.7.5. Sonographie Die Ultraschalluntersuchung der Bauchorgane gehört wegen der allgemeinen Verfügbarkeit und der geringen Kosten in Ergänzung zur CT-Diagnostik zum Standard beim Ausschluss von Metastasen [120]. 19 1.4.7.6. Endosonographie (EUS) Zur Abschätzung der Invasionstiefe des Primärtumors und der Beteiligung regionärer Lymphknoten spielt dieses Verfahren im klinischen Alltag neben der CT-Diagnostik eine wichtige Rolle [116,120]. Die Vorhersagewahrscheinlichkeit bezüglich des regionären Lymphknotenstatus lässt sich durch eine kombinierte Feinnadelbiopsie zusätzlich verbessern. 1.4.7.7. Positronenemissionstomographie unter Verwendung von 18F-FluoroDeoxyglukose (FDG-PET) Nach derzeitiger Studienlage scheint dieses Schnittbildverfahren der Computertomographie beim Erkennen von Fernmetastasen zwar überlegen zu sein, ob sein tatsächlicher klinischer Nutzen allerdings wirklich größer ist, bleibt umstritten [67,116]. Nicht zuletzt wegen der hohen Kosten findet dieses Verfahren seinen Einsatz wohl vor allem im Rahmen weiterer Studien und im Zusammenhang mit unklaren CT-Befunden. Allerdings könnten sich durch technische Verbesserungen, insbesondere durch tumoraffinere Radiopharmaka, neue Indikationen ergeben. 1.4.7.8. Skelettszintigraphie Die Untersuchung dient hier, wie bei anderen Tumorerkrankungen, dem Ausschluss von Knochenmetastasen, allerdings gehört sie nicht zu den Routineuntersuchungen [141]. 1.4.7.9. Tracheobronchoskopie Diese Untersuchung ist bei einem vermuteten Bezug des Tumors zum Tracheobronchialsystem obligat, wird aber an vielen Zentren ohnehin routinemäßig durchgeführt, um ein synchrones Bronchialkarzinom auszuschließen [141]. 1.4.7.10. Laryngoskopie und fachärztliche Inspektion des Mund-Nasen-Rachenraums Besonders bei Patienten mit einem Plattenepithelkarzinom empfiehlt sich dieses Vorgehen zur Abklärung der lokalen Tumorausdehnung (Ausschluss einer Rekurrensparese) und zum Ausschluss eines möglichen Zweitkarzinoms; auch diese Untersuchung wird an den meisten Zentren routinemäßig durchgeführt [141]. 1.4.7.11. Chirurgische Exploration Bei unklarer Tumorausdehnung in der Bildgebung wird zur Klärung der lokalen Resektabilität in seltenen Fällen eine chirurgische Exploration von Thorax und/oder Abdomen durchgeführt [120,141]. 20 Die unter 1.4.7.1.- 1.4.7.4. genannten Verfahren werden nach den interdisziplinären Leitlinien der Deutsche Krebsgesellschaft und der Deutschen Gesellschaft für Chirurgie für das Staging in jedem Fall für zwingend notwendig erachtet [30]. 21 1.5. Therapie Die Therapie soll stadiengerecht erfolgen. Außerhalb von Studien wird dabei derzeit nicht nach der histologischen Entität unterschieden [141]: Abbildung 2: Schema der stadiengerechten, multimodalen Behandlung des Ösophaguskarzinoms an der Universitätsklinik Freiburg [35]. Stadium 0-I Stadium II-III Stadium IV T1 N0 M0 „resektabel“ T1 N1 M0, T2-4 N0-1 M0 „lokal fortgeschritten“ T1-4 N0-1 M1 „metastasiert“ Präoperativ RxCx Befundkontrolle operabel primäre OP R0 Befundkontrolle R1 RxCx inoperabel OP mit kurative Intension R0 R1 Befundkontrolle fakultativ RxCx Systemische Chemotherapie So lange der Tumor chirurgisch vollständig resektabel erscheint und nicht von der Existenz von Fernmetastasen auszugehen ist, gilt das Ösophaguskarzinom prinzipiell als kurabel. Der Nutzen der chirurgischen Intervention ist gut belegt [126,127,135]. Bei lokal fortgeschrittenen Tumoren ist derzeit eine multimodale Therapie im Sinne einer Kombination von Operation und präoperativer Radiochemotherapie im Rahmen von Studien an vielen Zentren üblich. Bei R0-Resektion lässt sich mit den bislang verfügbaren adjuvanten Radio- und Chemotherapiekonzepten keine weitere Verbesserung des Langzeitüberlebens erzielen [36]. Bei primär palliativer Situation oder Rezidiv kann mit supportiven Maßnahmen meist eine deutliche Verbesserung der Lebensqualität erreicht werden. Im Zentrum stehen dabei die Aufrechterhaltung der natürlichen Nahrungspassage durch endoskopische oder chirurgische Intervention und die Hemmung der Tumorprogression mittels Radio- und Chemotherapie [35]. 22 1.5.1. Neoadjuvante Therapie Verschiedene multimodale Therapieschemata wurden bereits evaluiert oder sind derzeit Gegenstand von Studien, wobei die bisher erzielten Resultate widersprüchlich sind [7,22,24, 53,68,82,84,94,106,125,126,143,145,147]. Eindeutige Belege für eine generelle Verbesserung des Langzeitüberlebens im Vergleich zu einer rein chirurgischen Therapie fehlen, auch wenn sich die Rate der R0-Resektionen durch neoadjuvante Therapie deutlich erhöhen läßt [125]. Die Ergebnisse von drei umfangreichen Metaanalysen aus den Jahren 2003 und 2004 legen eine moderate Überlegenheit des neoadjuvanten Ansatzes in bezug auf das Zwei-, Drei-, bzw. Fünfjahresüberleben nahe [53,68,145]. Vorallem für die Untergruppe der Patienten, bei denen der Tumor auf die neoadjuvante Therapie gut anspricht scheint, unabhängig vom histologischen Typ, ein Vorteil zu bestehen, insbesondere wenn es sich um einen Komplettresponse handelt [126]. Allerdings gibt es Hinweise dafür, dass der Anteil perioperativer Komplikationen und perioperativer Letalität leicht ansteigt [53,95,145]. Am Universitätsklinikum Freiburg wird bei lokal fortgeschrittenen Tumoren eine protrahierte 5-Fluorouracil/Cisplatin-Chemotherapie mit zeitgleicher lokaler Bestrahlung durchgeführt, wobei man zur Zeit eine histologisch gesicherte Komplettremission in 20-30% der Fälle erreicht [35,64]. Ohne anschließende chirurgische Therapie ist allerdings von einem hohen Rezidivrisiko auszugehen. Abbildung 3: Freiburger Protokoll für die neoadjuvante Therapie bei Ösophaguskarzinom (modifiziert nach Naunheim) [35]. RTX, 36 Gy (1,8 Gy/d) d 1-5 d 1-5 d 1-5 d 1-5 CTX 5-FU, 500mg/m2 i.v. d 1-5 d 1-5 d 1-5 d 1-5 Restaging und OP CTX Cisplatin, 20mg/m2 i.v. d 1-5 d 1-5 1 2 3 4 5 6 7 Wochen 23 1.5.2. Operativer Eingriff unter kurativem Gesichtspunkt Wegen der Gefahr einer submukösen longitudinalen Metastasierung muss die Ösophagusresektion möglichst radikal unter Belassung eines nur kurzen proximalen Speiseröhrenrestes erfolgen [30,120]. 1.5.2.1. Resektionsverfahren Thorako-abdominale Ösophagusresektion: Nach Eröffnung des Thorax wird der Ösophagus zunächst mit dem umgebenden Fett- und Bindegewebe und allen adhärenten Strukturen aus seinem Bett gelöst, nach abdominaler und zervikaler Freilegung abgesetzt und durch das Interponat ersetzt. Dieses Vorgehen ermöglicht die optimale Darstellung des Tumors und eine umfangreiche mediastinale Lymphadenektomie [30,43,90,120]. Transmediastinale Ösophagusresektion (syn.: transhiatale Resektion): Bei Verzicht auf eine Thorakotomie wird die Speiseröhre über den Bauchraum stumpf aus dem Mediastinum herausgelöst, dann nach zervikaler Freilegung abgesetzt und durch das Interponat ersetzt. Dieser Zugang führt in der Regel zu einer kürzeren Operationsdauer und ist für den Patienten kardiopulmonal weniger belastend. Wegen der eingeschränkten Möglichkeit zur Lymphadenektomie kommt das Verfahren unter kurativen Gesichtspunkten aber nur in Frage, wenn der Tumor weit distal lokalisiert ist [30,43,90,120]. 1.5.2.2. Lymphadenektomie Aus onkologischer Sicht gilt folgender Grundsatz: Alle Lymphknoten im Bereich des Lymphabflussgebietes des Tumors sollten entfernt werden. Als Standard gilt die sogenannte 2-Feld-Lymphadenektomie, bei der neben den abdominellen Lymphknoten (den zoeliakalen und jenen entlang der A. hepatica communis und im Bereich der kleinen Kurvatur des Magens) auch die mediastinalen Lymphknoten reseziert werden [30]. Bei der 3-Feld-Lymphadenektomie kommen noch die Lymphknoten im Halsbereich hinzu. Die thorako-abdominale Ösophagektomie mit sorgfältiger 2-Feld-Lymphadenektomie wird auch als En-bloc-Resektion bezeichnet [120]. 24 1.5.2.3. Ösophagusersatz Mageninterponat: Nach ausgedehnter abdomineller Mobilisierung und Bildung eines „Schlauchmagens“ kann dieser durch das Mediastinum bis auf Halsniveau hochgezogen und dort mit dem verbliebenen kurzen proximalen Speiseröhrenrestes anastomosiert werden. Dabei bleibt die Blutversorgung des Interponats über die Arteria gastroepiploica und die Arteria gastrica dextra gewährleistet. Dieses Verfahren ist technisch vergleichsweise einfach und wird deshalb am häufigsten angewannt. Prinzipiell kann der Magenhochzug auch subkutan oder retrosternal erfolgen [43,120]. Koloninterponat: Steht der Magen aufgrund einer Voroperation oder einer Begleiterkrankung als Ersatzorgan nicht zur Verfügung, fällt die Wahl auf die isoperistaltische Interposition des Colon transversum mit der linken Kolonflexur bei Wahrung der Blutversorgung über die Arteria colica sinistra. Die Ösophagokolostomie erfolgt ebenfalls zervikal, das aborale Ende des Kolons kann in die Magenvorderwand implantiert oder, bei vorangegangener Gastrektomie, auch mit dem Duodenum oder Jejunum verbunden werden. Dieses Verfahren ist wesentlich aufwendiger und geht häufiger mit Komplikationen einher. Statt des linken kann prinzipiell auch das rechte Hemikolon benutzt werden [43,120]. Dünndarminterponat: Aufgrund der ungünstigen Gefäßversorgung kommt eine Dünndarminterposition zum Komplettersatz der Speiseröhre nur in Ausnahmefällen zur Anwendung. Allerdings kann nach einer limitierten zervikalen Ösophagusresektion die Rekonstruktion mit einem freien Jejunalinterponat erfolgen, das dann einen mikrovaskulären Anschluss über die Halsgefäße erhält [43,120]. 25 1.6. Patientenselektion Die Ösophagusresektion mit Speiseröhrenersatz ist eine große und eingreifende Operation mit einem erheblichen Risiko perioperativer Komplikationen. Der Anteil der Patienten, die an den unmittelbaren Folgen der Operation versterben, wird in aktuellen Publikationen meist mit etwa 5 bis 10% angegeben [3,11,12,13,18,28,57,75,94]. Dabei hängt der Erfolg der Operation neben der Qualität der chirurgischen Therapie und der postoperativen Versorgung wesentlich vom körperlichen Zustand des Patienten ab. Da das Ösophaguskarzinom im allgemeinen eher im fortgeschrittenen Lebensalters auftritt, sind Begleiterkrankungen häufig. Besonders beim Plattenepithelkarzinom sind viele Patienten durch den oft zugrunde liegenden langjährigen Nikotin- und Alkoholabusus in bezug auf ihre Leber-, Herz- und Lungenfunktion erheblich kompromittiert. Außerdem kann es bei ausgeprägter Dysphagie zur drastischen Verstärkung des bei Krebsleiden häufig beobachteten starken Gewichtsverlustes kommen. Welche Bedeutung damit der präoperativen Beurteilung des physischen Status, beziehungsweise der Kenntnis der sich daraus ergebenden individuellen Risikofaktoren zukommt, haben Bartels et al. wie folgt zusammengefasst: Abbildung 4: Einfluss der Kenntnis patientenbezogener Risikofaktoren [16]. Die Kenntnis patientenbezogener Risikofaktoren hat Einfluss auf • die Indikationsstellung, im Sinne der Patientenselektion: operiert werden kann ein Patient nur, wenn das individuelle Risiko vertretbar bleibt. der Therapieplanung: gestörte Organfunktionen lassen sich präoperativ teilweise durch adäquate Therapie optimieren. der Verfahrenswahl: unter Umständen ist ein limitiertes chirurgisches Vorgehen indiziert. • die problemorientierte postoperative Prophylaxe und Therapie. • bessere Vergleichbarkeit von Therapiestudien durch Unterscheidung verschiedener Risikokategorien. Ziel ist die Reduktion von perioperativer Morbidität und Mortalität. 26 1.6.1. Einfluss der Beeinträchtigung wichtiger Organsysteme 1.6.1.1. Lungenfunktion [16] Bekanntermaßen stellen vorbestehende Lungenerkrankungen bei großen chirurgischen Eingriffen ein erhöhtes Risiko für pulmonale Komplikationen im perioperativen Verlauf dar. Zudem gehen Ösophagusresektion und Interposition des Ersatzorgans zwangsläufig mit intrathorakalen und intramediastinalen Manipulationen und Traumata einher, die die pulmonale Funktion vorübergehen deutlich beeinträchtigen, womit sich für vorbelastete Patienten eine ungleich größere Bedrohung verbindet. Die klinisch größte Bedeutung hat dabei die chronisch obstruktive Lungenerkrankung (COPD) als die häufigste Folge langjährigen inhalativen Rauchens. Neben der präoperativen Blutgasanalyse gibt hier vor allem der Tiffeneau-Test wichtige Anhaltspunkte. Ein deutlich vermindertes forciertes exspiratorisches 1-Sekunden-Volumen (FEV1) korrelierte in einer prospektiven Studie deutlich mit der erhöhten Inzidenz pulmonaler Komplikationen [55]. Postoperativ ist die Fähigkeit der Betroffenen, ausreichend tief einzuatmen und abzuhusten oft stark herabgesetzt. Ein wichtige Ursache nach Ösophagusresektion ist hier vor allem die intraoperative Schädigung des N. recurrens: Verhindert eine Parese den adäquaten Glottisschluß wird das Husten erschwert. Sekretretention und basale Minderbelüftung fördern die Bildung von Atelektasen, verändern die intrapulmonalen Perfusionsverhältnisse mit der möglichen Folge einer Hypoxämie und erhöhen vor allem das Risiko für Pneumonien. 1.6.1.2. Herzkreislaufsystem [16] Herzversagen ist, vor allem im Zusammenhang mit kardialen Vorerkrankungen, eine der wichtigsten Ursachen perioperativer Letalität. In einer anästhesologischen Studie über kardiale Risiken bei allgemeinschirurgischen Eingriffen lag die perioperative Letalität bei Patienten mit koronarer Herzerkrankung (KHK) bei über 4%, im Gegensatz zu Patienten ohne vorbestehende Herzerkrankung mit weniger als 0,5% [50]. Beim Ösophaguskarzinom liegt der Anteil der Patienten mit fortgeschrittenen Formen der Arteriosklerose im Sinne von peripherer arterieller Verschlusskrankheit (pAVK) oder KHK bei 20-30% [37,74]. 1.6.1.3. Leber [16] Auch hepatisch beeinträchtigte Patienten schneiden im perioperativen Verlauf durchschnittlich deutlich schlechter ab, als die Vergleichsgruppe ohne entsprechende Begleiterkrankung. Die bei weitem häufigste Ursache einer Leberschädigung ist der 27 chronische Alkoholabusus. In Deutschland gelten circa 9% der allgemeinchirurgischen Patienten als alkoholabhängig, im Vergleich zu etwa 3% in der Normalbevölkerung [63]. Im perioperativen Verlauf spielen Komplikationen als Folge von Alkoholismus und hepatischer Dysfunktion eine vielfältige Rolle. Darunter fallen vor allem vermehrte kardiale Ereignisse durch toxische Kardiomyopathie, Gerinnungsstörungen, höhere Infektanfälligkeit, sowie im Falle einer Entzugssymptomatik, eine massive Einschränkung der Compliance mit Problemen beim Abhusten und der damit steigenden Gefahr pulmonaler Komplikationen. Eine vorbestehende Zirrhose gilt als Ausdruck einer massiven Schädigung der Leber und deshalb meist als Kontraindikation für einen elektiven Eingriff. 1.6.1.4. Niere [16] Im Gegensatz zu den bereits genannten Organsystemen ist eine eingeschränkte Nierenfunktion klinisch besser zu beherrschen und beeinflusst den perioperativen Verlauf meist nicht wesentlich. Im Rahmen einer Sepsis stellt eine akute renale Dekompensation therapeutisch allerdings ein zusätzliches ernstzunehmendes Problem dar. 1.6.1.5. Allgemeinzustand und Compliance [16] Vom Funktionsstatus einzelner Organsysteme abgesehen, ist ein adäquater Allgemeinzustand und die mentale Fähigkeit zur Kooperation Grundbedingung dafür, die Phase nach einer großen Operation gut zu bewältigen. Beide Bereiche sind allerdings schwer zu objektivieren und die präoperative Beurteilung beruht meist auf dem „klinischen Eindruck“ des behandelnden Arztes. Bezüglich des Allgemeinzustandes bietet der Karnofsky-Index [Tabelle 7] eine wichtige Hilfe; er orientiert sich vor allem am Grad der körperlichen Aktivität im Alltag. Tabelle 7: Karnofsky-Index zur Beurteilung des Allgemeinzustandes [70]. 100% 90% 80% 70% 60% 50% 40% 30% 20% 10% Normale körperliche Aktivität; keinerlei Beschwerden Geringfügig verminderte Aktivität und Belastbarkeit Deutlich verminderte Aktivität; normale Aktivität nur mit Anstrengung Unfähigkeit zur normalen Aktivität; Patient versorgt sich selbstständig Patient versorgt sich weitgehend selbstständig, benötigt aber gelegentlich Hilfe Ständige Unterstützung und Pflege sind notwendig, ebenso häufige ärztliche Hilfe Überwiegend bettlägerig; geschulte Pflegekraft notwendig Dauerhaft bettlägerig; geschulte Pflegekraft notwendig Schwerkrank, hospitalisiert, aktive supportive Therapie Moribund 28 Eine postoperative Einschränkung der Kooperationsfähigkeit ist in jedem Fall zu erwarten, wenn beim Patienten eine Begleiterkrankung im Sinne einer hirnorganischen Vorschädigung, einer Substanzabhänigkeit oder einer klassischen psychiatrischen Störung besteht. Auch bei älteren Menschen ist Fähigkeit zur adäquaten Interaktion häufig eingeschränkt. Fortgeschrittenes Lebensalter allein gilt in der Chirurgie heute zunehmend seltener als Grund zum Ausschluss von komplexen elektiven Eingriffen, da auch bei älteren Patienten in guter körperlicher Verfassung oft gute Ergebnisse erzielt werden können. Der Einfluss des eigentlichen „biologischen Alters“ bleibt dabei zumindest teilweise in der Kategorie „Allgemeinzustand“ repräsentiert. Ob Personen über 70 Jahre grundsätzlich ein erhöhtes operatives und perioperatives Risiko haben, ist in der Literatur umstritten [44,73,81,113,115, 139]. Besonders kardiopulmonale Komplikationen sind in diesem Krankengut in der Mehrzahl der Studien deutlich häufiger. Gerade jüngere Publikationen gehen aber davon aus, dass bezüglich der Letalität kein signifikanter Unterschied besteht [73,115]. Auch der Grad der Unterernährung korreliert insbesondere beim Ösophaguskarzinom direkt mit der Häufigkeit chirurgischer Komplikationen wie Anastomoseninsuffizienz, oder Wundinfektionen [135]. 1.6.2. Freiburger Standardprogramm zur Ermittlung der Narkose- und Operationsfähigkeit vor elektiver Ösophagusresektion [141] Ergänzend zum Tumor-Staging werden an der Universitätsklinik Freiburg präoperativ regelhaft folgende Untersuchungen durchgeführt: • Anamnese und klinische Untersuchung mit Prüfung der Compliance • Röntgen-Thorax-Aufnahme in zwei Ebenen ( posterior-anterior und lateral) • Apparativer Lungenfunktionstest mit Spirometrie und Blutgasanalyse • Kardiologisches Konsil mit Beurteilung von Elektrokardiogramm (EKG) und Belastungs-EKG (gegebenenfalls auch mit Myokardszintigramm und Koronarangiographie) • Bestimmung von Routinelaborparametern wie Blutbild, Elektrolytkonzentrationen, Gerinnungs-, Leber- und Nierenfunktionsparametern: Harnstoff, Kreatinin, Quick, PTT, Cholinesterase, Bilirubin, GOT, GPT, GGT. • Koloskopie • Anästhesiologisches Konsil zur Beurteilung der Narkosefähigkeit Je nach Vorgeschichte und Begleiterkrankungen kann auch eine spezielle neurologische Zusatzdiagnostik (z.B. Dopplersonographie der Karotiden) indiziert sein. 29 1.6.3. Präoperative Risikoanalyse nach H. Bartels, H.J. Stein und J.R. Siewert [17,18] Eine Arbeitsgruppe um H. Bartels publizierte 1998 erstmals ein Bewertungssystem zur Evaluation des individuellen perioperativen Risikos bei Ösophagusresektion. Intention war, die präoperative Beurteilung weitestmöglich zu objektivieren, zu standardisieren und die relevanten Befunde ihrem Vorhersagewert gemäß bezüglich des perioperativen Verlaufs optimal zu gewichten. Zunächst wurden die Daten von 432 Patienten retrospektiv analysiert. Dabei ließen sich die Beeinträchtigung des Allgemeinzustandes (p< 0,001) und eine schlechte kardiale (p< 0,001), respiratorische (p< 0,05) und hepatische Funktion (p< 0,05) als unabhängige Prädiktoren für einen letalen perioperativen Verlauf identifizieren. Tabelle 8: Die bei der Entwicklung der Risikoanalyse nach Bartels et al. analysierten 23 Parameter [17]. Allgemeinzustand: • Geschlecht • Alter • Karnofky-Index in % • Alkoholanamnese positiv: ja/nein • Raucheranamnese positiv: ja/nein • Gewichtsverlust in % • Compliance gut: ja/nein Leberfunktion: • Serumalbumin in g/dl • Serumbilirubin in mg/l • PTT in sec. • Aminopyrin-Atemtest • Zirrhose: ja/nein Nierenfunktion: • Kreatinin-Clearance in ml/min Lungenfunktion: • Vitalkapazität in % der Normalleistung • FEV1 in % der Normalleistung • Peak flow in % der Normalleistung • Pa O2 in mmHg • Pa CO2 in mmHg Herzfunktion: • EKG unauffällig: ja/nein • Röntgen-Thorax unauffällig: ja/nein • Kardiologisches Konsil (Risiko normal/erhöht/hoch) Tumor-Staging: • T1+2 vs T3+4 Diabetes mellitus: • ja/nein Unter besonderer Berücksichtigung dieser Risikobereiche wurden daraufhin 23 präoperativ erhobenen Parameter [Tabelle 8] mittels Regressionsanalyse bezüglich ihres Einflusses auf den postoperativen Verlauf untersucht und die aussagekräftigsten in einem Score kombiniert [Tabelle 9, Seite 30]. 30 Tabelle 9: Risikoanalyse nach Bartels et al. – verwendete Parameter und ihre Gewichtung [18]. Bereich Parameter Lungenfunktion Leberfunktion Kardiologisches Risiko laut Facharztkonsil Allgemeinzustand Punkte VC>90% und PaO2 >70% 1 VC<90% oder PaO2 <70% 2 VC<90% und PaO2 <70% 3 Aminopyrin-Atemtest > 0,4 1 A.P.-Atemtest < 0,4; keine Zirrhose 2 Zirrhose 3 normales Risiko 1 erhöhtes Risiko 2 deutlich erhöhtes Risiko 3 Karnofsky-Index >80% u. Compliance gut 1 K.-Index <80% oder Compliance schlecht 2 K.-Index <80% u. Compliance schlecht 3 Multiplikator 2 2 3 4 Die geringste zu erreichende Punktzahl für einen Patienten mit minimalem Risiko beträgt 1·2 + 1·2 + 1·3 + 1·4 = 11 Punkte, die höchst mögliche Punktzahl beträgt 3·2 + 3·2 + 3·3 + 3·4 = 33 Punkte. Beispiel: Ein Patient mit einer VC von 93%, einem PaO2 von 75%, ohne auffällige Leberfunktion, aber mit deutlich erhöhtem kardialen Risiko (z.B. bei Zustand nach Myokardinfarkt) bei einem Karnofsky-Index von 90% und guter Compliance erreichte 1·2 + 1·2 + 3·3 + 1·4 = 17 Punkte. Der perioperative Verlauf wurde in vier Kategorien unterteilt: Tabelle 10: Kategorien zur Bewertung des perioperativer Verlaufs [18]. normal prolongiert erschwert letal maschinelle Beatmung < 48h und / oder intensivmedizinische Betreuung ≤ 7d maschinelle Beatmung 48h – 7d u./ o. intensivmedizinische Betreuung 7d – 21d maschinelle Beatmung >7d u./ o. intensivmedizinische Betreuung >21d Tod binnen 30d nach Operation 31 Durch die Analyse des Verhältnisses von Punktverteilung und perioperativer Letalität ordnete man die Patienten drei unterschiedlichen Risikogruppen zu: • Gruppe mit niedrigem Risiko ~ 11-15 Punkten • Gruppe mit moderatem Risiko ~ 16-21 Punkten • Gruppe mit hohem Risiko ~ 22-33 Punkten Im folgenden wurde dieses Bewertungssystem mit Erfolg prospektiv getestet und in einem nächsten Schritt nur noch die Patienten mit niedrigem oder moderatem Risiko operiert. Patienten mit mehr als 21 Punkten erhielten von vornherein eine konservative Therapie. Die Zahl der perioperativen Todesfälle ließ sich so erheblich reduzieren [siehe 4.7., Seite 92]. 32 1.7. Ziel dieser Arbeit Dieser Arbeit möchte einen Beitrag leisten in der Diskussion um die präoperative Patientenselektion bei Ösophagusresektion, um mitzuhelfen die Selektionskriterien an der Universitätsklinik Freiburg zu optimieren und somit die Zahl der perioperativen Todesfälle weiter zu verringern. Allerdings kann ihr dabei aufgrund ihres retrospektiven Charakters lediglich eine orientiernde Funktion zukommen. Die Auswertung der verfügbaren Krankenakten soll der Beantwortung folgender Fragestellungen dienen: • Welcher Art waren die aufgetretenen perioperativen Komplikationen, in welcher Häufigkeit waren sie zu beobachten und wann waren sie letal? • Wie korrelierte der präoperative Status der betroffenen Patienten mit der Art des perioperativen Verlaufs ? • Wie korrelierten präoperativer Status und perioperativer Verlauf mit der Zielgröße „Langzeitüberleben“? Im weiteren liegt der Schwerpunkt der Arbeit auf der Auseinandersetzung mit dem von Bartels et al. publizierten Präoperativscore [17,18]. Zum einen wird der Score retrospektiv auf das Freiburger Untersuchungskollektiv angewendet, insbesondere um zu prüfen, ob die perioperative Letalität unter jenen Patienten, die von Bartels et al. der Hochrisikogruppe zugeordnet worden wären tatsächlich bedeutend höher war, als unter den übrigen. Zum andern wird mit einer Auswahl von präoperativen Faktoren eine Regressionsanalyse durchgeführt, um zu klären, ob sich auf dem Hintergrund der Freiburger Daten Hinweise auf weitere Einflussgrößen mit prädiktivem Wert finden lassen, die von den von Bartels et al. postulierten Faktoren abweichen. Anschließend werden die gewonnenen Ergebnisse jenen der aktuellen Vergleichsliteratur gegenüber gestellt. 33 2. Material und Methoden 2.1. Datenerhebung Für diese Arbeit wurden Patientendaten zu 131 Ösophagusresektionen bei Ösophaguskarzinom gesammelt. Die Operationen wurden zwischen Januar 1992 und Januar 2003 in der Abteilung für Allgemeine und Viszeralchirurgie der Universitätsklinik Freiburg durchgeführt. Die Datenerhebung erfolgte retrospektiv durch Auswertung der entsprechenden Krankenblätter. Die Angaben zum Überlebensstatus wurden durch schriftliche Anfrage bei den betreffenden Einwohnermeldeämtern ermittelt. Stichtag war hier der 15.04.2004. Es folgt die Liste der erhobenen Parameter: 2.1.1. Allgemeine Patientendaten • Therapiejahr • Alter zum Operationszeitpunkt in Jahren • Geschlecht 2.1.2. Anamnestische Angaben zu Lebensgewohnheiten und Gesundheitszustand Lebensgewohnheiten: • Regelmäßiger Alkoholkonsum (>2 mal pro Woche) aktuell bestehend oder in der Vorgeschichte: ja/nein • Regelmäßiger Tabakkonsum: aktuell bestehend oder in der Vorgeschichte: ja/nein Voroperationen: • Vorhergehende zervikale, thorakale oder abdominale Operationen: ja/nein; wenn ja, Art des Eingriffs Begleiterkrankungen: • kardiale Begleiterkrankung: ja/nein; wenn ja, Art der Erkrankung • pulmonale Begleiterkrankung: ja/nein; wenn ja, Art der Erkrankung • hepatische Begleiterkrankung: ja/nein; wenn ja, Art der Erkrankung • renale Begleiterkrankung: ja/nein; wenn ja, Art der Erkrankung • Vorbestehender Hypertonus: ja/nein • Vorbestehende Leberzirrhose: ja/nein • Vorbestehender Diabetes mellitus: ja/nein • Vorbestehendes Zweitmalignom: ja/nein; wenn ja, Art des Malignoms 34 2.1.3. Präoperative Tumordiagnostik • Endoskopische Tumorlokalisation im Sinne der allgemeinen klinisch- topographische Klassifikation (1.4.1.) • Endoskopische Tumorausdehnung in cm • Präoperative Histologie nach Biopsie und histopathologisches Grading (1.4.5.) • Präoperatives Staging (1.4.7.) im Sinne der klinischen TNM-Klassifikation (1.4.3.) und der Stadiengruppierung nach den Richtlinien der UICC/AJCC (1.4.6.) 2.1.4. Weitere präoperativ erhobene Befunde und Parameter • Compliance nach klinischer Einschätzung: gut/schlecht (1.6.1.5.) • Karnofsky-Index in % (1.6.1.5.) • Body mass index (BMI) in kg/m2 • Gewichtsverlust in den letzten 6 Monaten vor Operation in % des vorherigen Körpergewichts Lungenvolumina und Blutgasanalyse: Hier wurde jeweils der Absolutwert in Liter, beziehungsweise in Millimeter Quecksilbersäule erhoben, einschließlich des individuellen Referenzbereichs und des erreichten prozentualen Anteils am individuellen Sollwert. • Inspiratorische Vitalkapazität (VC) • Forcierte exspiratorische Vitalkapazität (FEV1) • Peak exspiratory flow (PEF) • Maximaler exspiratorischer Flow bei 50% der forcierten Vitalkapazität (MEF50) • Arterieller Sauerstoffpartialdruck (PaO2) in mmHg • Arterieller Kohlendioxidpartialdruck (PaCO2) in mmHg Laborparameter: Die Messwerte wurden einschließlich des jeweils gültigen Referenzbereichs erhoben. • Thromboplastinzeit (Quick) in % • Partielle Thromboplastinzeit (PTT) in Sekunden • Gesamteiweiß (GE) im Serum in g/dl • Gesamtbilirubin im Serum in mg/dl • γ-Glutamyl-Transferase (GGT) im Serum in U/l • Glutamat-Oxalacetat-Transaminase (GOT) im Serum in U/l • Glutamat-Pyruvat-Transaminase (GPT) im Serum in U/l • Serum-Kreatinin in mg/dl 35 • Serum-Harnstoff in mg/dl Kardiologische Diagnostik und präoperative Risikoeinschätzung des Kardiologen: • Elektrokardiogramm (EKG) unauffällig: ja/nein • Röntgen-Thoraxbefund kardiologisch unauffällig: ja/nein • kardiologische Bewertung des operativen und perioperativen Risikos (je nach Einzelfall unter Einbeziehung verschieden umfangreicher apparativer Diagnostik): Risiko normal, erhöht oder deutlich erhöht 2.1.5. Angaben zur neoadjuvanten Therapie • Stattgehabte neoadjuvanten Therapie: ja/nein • Bei stattgehabte neoadjuvanten Therapie, Angaben zum Response: komplett/partiell/kein Response (als kompletter Response wurden ypT0N0M0Befunde gewertet; partieller Response: ypTNM < dem klinischen TNM-Stadium; kein Response: ypTNM ≥ dem klinischen TNM-Stadium) 2.1.6. Operation • Art des Resektionsverfahrens (1.5.2.1.) • Art des Ösophagusersatzes (1.5.2.3.) • Operationsdauer von Schnitt bis Naht in Minuten • Besonderheiten im operativen Verlauf in Stichworten Grad der Lymphadenektomie: • Zervikale Lymphadenektomie: ja/nein • Thorakale Lymphadenektomie: ja/nein • Abdominale Lymphadenektomie: ja/nein 2.1.7. Pathologisches Staging • pTNM-Klassifikation (1.4.3.) und postoperative Stadiengruppierung nach den Richtlinien der UICC/AJCC (1.4.6.) • Postoperative Histologie und histopathologisches Grading (1.4.5.) • Residualtumor-(R-)Klassifikation (1.4.1) 36 2.1.8. Perioperativer Verlauf • Dauer des stationären Aufenthalts in Tagen • Perioperativ verstorben: ja/nein; gewertet wurden alle Todesfälle während des stationären Aufenthalts. Ferner wurden der präfinale Verlauf, das Sterbedatum und die genaue Todesursache in Stichworten dokumentiert. • Perioperative Komplikationen (allgemein): ja/nein • Operative Revision während des stationären Aufenthalts: ja/nein; wenn ja, Art und Zeitpunkt des Eingriffs • Postoperative Tracheotomie: ja/nein Chirurgische Komplikationen: • Chirurgische Komplikationen (allgemein): ja/nein; wenn ja, Art der Komplikation • Blutung: ja/nein • Wundinfektion: ja/nein • Anastomoseninsuffizienz: ja/nein • Interponatsnekrose: ja/nein • Platzbauch: ja/nein • Magenausgangsstenose: ja/nein • Chylothorax: ja/nein • Rekurrensparese: ja/nein • Sonstige chirurgische Komplikationen: ja/nein Pulmonale Komplikationen: • Pulmonale Komplikationen (allgemein): ja/nein; wenn ja, Art der Komplikation • Pneumonie: ja/nein • Akutes Lungenversagen (ARDS): ja/nein • Punktionswürdiger Pleuraerguß: ja/nein • Pleuraempyem: ja/nein Kardiale Komplikationen: • Kardiale Komplikationen (allgemein): ja/nein; wenn ja, Art der Komplikation Renale Komplikationen: • Renale Komplikationen (allgemein): ja/nein; wenn ja, Art der Komplikation Hepatische Komplikationen: • Hepatische Komplikationen (allgemein): ja/nein; wenn ja, Art der Komplikation Psychiartrische Komplikationen: • Hirnorganisches Psychosyndrom (HOPS): ja/nein 37 • Depressive Reaktion im Rahmen der Krankheitsverarbeitung: ja/nein Gastrointestinale Komplikationen: • Gastrointestinale Komplikationen (allgemein): ja/nein; wenn ja, Art der Komplikation • Ileus: ja/nein • Ösophagusstenose: ja/nein • Ulcus im Mageninterponat: ja/nein Weitere Komplikationen: • Sepsis: ja/nein • Mediastinitis: ja/nein • Peritonitis: ja/nein • Multiorganversagen (MOV): ja/nein • Sonstige Komplikationen: ja/nein; wenn ja, Art der Komplikation 2.1.9. Langzeitüberleben • Überlebensstatus: Patient bis zum Stichtag 15.04.2004 verstorben: ja/nein; wenn ja, Sterbedatum 38 2.2. Verfügbarkeit der Daten Die ursprünglich Absicht, lediglich vollständige Datensätze zu verwenden, ließ sich aufgrund des retrospektiven Charakters dieser Arbeit nicht verwirklichen. Nur 122 der 131 statistisch ausgewerteten Datensätze sind komplett. Von den 154 durchgesehen Krankenakten waren etwa 15% so unvollständig, dass es nicht sinnvoll erschien, diese in die Auswertung mit einzubeziehen. Um das Untersuchungskollektiv aber nicht weiter zu dezimieren, wurden auch solche Datensätze berücksichtigt, bei denen einzelne Angaben fehlen. Die Verfügbarkeit der meisten Daten liegt bei > 98%; nur die Angaben zur endoskopischen Tumorausdehnung und zur Operationsdauer fehlen etwas häufiger; ihre Verfügbarkeit liegt bei 95,4%, beziehungsweise bei 93,1%. Eine genaue Übersicht gibt Tabelle 11. Die Risikoanalyse nach Bartels et al. konnte retrospektiv mit 130 dieser 131 Datensätze durchgeführt werden. Tabelle 11: Verfügbarkeit der erhobenen Daten; jene 15 der 48 Bereiche oder Einzelparameter, deren Verfügbarkeit eingeschränkt war, sind fett hervorgehoben. zu 2.1.1. Allgemeine Patientendaten Alter 131/131 Geschlecht 131/131 100% 100% Therapiejahr 131/131 100% zu 2.1.2. Anamnestische Angaben zu Lebensgewohnheiten und Vorbefunden Alkoholanamnese 131/131 100% Raucheranamnese 131/131 100% Voroperationen 131/131 100% Begleiterkrankungen 131/131 100% 2.1.3. Präoperative Tumordiagnostik Endoskop. Lokalisation 131/131 Präoperative Histologie 131/131 cTNM-Klassifikation 130/131 100% 100% 99,2% Endoskop. Ausdehnung 125/131 95,4% Präoperatives Grading 131/131 100% 2.1.4. Präoperativ erhobene Befunde und Parameter Compliance 131/131 100% Body mass index Karnofsky-Index 131/131 100% Gewichtsverlust VC 130/131 99,2% PEF FEV1 130/131 99,2% MEF50 PaO2 130/131 99,2% PaCO2 Quick 130/131 99,2% PTT Gesamteiweiß 129/131 98,5% Gesamtbilirubin GGT 129/131 98,5% GOT GPT 131/131 100% Serum-Kreatinin 131/131 100% Serum-Harnstoff EKG 131/131 100% Röntgen-Thorax Kardiale Risikobewertung 131/131 100% 131/131 131/131 130/131 129/131 130/131 130/131 130/131 131/131 100% 100% 99,2% 98,5% 99,2% 99,2% 99,2% 100% 131/131 100% 131/131 100% 39 2.1.5. Angaben zur neoadjuvanten Therapie Angaben zur Therapie 131/131 100% Angaben zum Response 96/96 2.1.6. Operation Resektionsverfahrens Operationsdauer 100% 93,1% Art des Öso.-Ersatzes Lymphadenektomie 130/131 99,2% 129/131 98,5% 100% 100% R-Klassifikation postoperatives Grading 131/131 100% 131/131 100% Überlebensstatus Perioperative Morbidität 115/115 100% 131/131 100% 131/131 122/131 2.1.7. Pathologisches Staging pTNM-Klassifikation 131/131 postoperative Histologie 131/131 2.1.8. Peri- und postoperativer Verlauf Aufenthaltsdauer 115/115 100% Perioperative Mortalität 131/131 100% 100% 40 2.3. Statistische Auswertung Neben der deskriptiven Darstellung des erhobenen Datenmaterials ging es zunächst darum, die verschiedenen präoperativen Parameter und die perioperativen Ereignisse mittels statistischer Standardverfahren miteinander in Beziehung zu setzen. Aufgrund des meist binären Charakters der erhobenen Daten ließ sich dabei in einem großen Teil der Fälle Fisher`s Exact Test, ein χ²-Vierfeldertest für unabhängige Stichproben, anwenden [65,92]. Viele stetig-quantitativen Merkmale konnten zuvor in binäre transformiert werden. So wurde bei den erhobenen Laborparametern und Lungenvolumina letztlich nur berücksichtigt, ob die Werte im jeweils aktuell geltenden Referenzbereich lagen oder nicht; bei weiteren stetigen Größen wie etwa Alter oder Body mass index ließen sich Vergleichsgruppen bilden (zum Beispiel: Patienten < 70 Jahre versus Patienten ≥ 70 Jahre). Ansonsten wurde bei stetig-quantitativen Merkmalen Student`s t-Test für unabhängige Stichproben verwendet, falls allerdings nicht von einer Normalverteilung ausgegangen werden konnte wurde der Mann-Whitney U-Test angewandt [65,92]. Es galt jeweils die exakte zweiseitige Signifikanz, beim Mann-Whitney U-Test die asymptotische zweiseitige Signifikanz. Als Signifikanzniveau wurde p< 0,05 angenommen. Dann erfolgte die retrospektive Anwendung der Risikoanalyse nach Bartels et al., wie unter 1.6.3. beschrieben. Bezüglich der Analyse des Langzeitüberlebens wurde zunächst eine Kaplan-Meier-Kurve erstellt, dann mögliche Einflussfaktoren mittels Logrank-Test geprüft [65,92]. Dieser Teil der statistischen Analyse erfolgte mit Hilfe des Programmsystems SPSS für Windows (Version 11.5.). Mit dem selben Datenmaterial wurde zudem eine Logistische Regressionsanalyse durchzuführt. Zielgrößen waren zum einen das Auftreten pulmonaler und chirurgischer Komplikationen, zum andern die perioperative Letalität. Dieses Verfahren dient zur Ermittlung von Beziehungen zwischen den geprüften Einflussgrößen, um die Kombination derjenigen zu bestimmen, welche gemeinsam die Zielgröße am stärksten beeinflussen [92]. Dieser Teil der statistischen Analyse erfolgte mit Hilfe des Programmsystems SAS. Auch hier galt das Signifikanzniveau p< 0,05. 41 3. Ergebnisse 3.1. Präoperativ erhobene Parameter 3.1.1. Allgemeine Patientendaten Patientenverteilung nach Therapiejahr und Histologie: Bei den 131 verwendeten Datensätzen entfielen auf ein Therapiejahr durchschnittlich 10,7 Ösophagusresektionen. Dabei schwankte die Anzahl der erfassten Eingriffe zwischen 4 im Gesamtjahr 1993 und 15 im Gesamtjahr 1997 [Abbildung 5]. In 86 Fällen (65,6%) handelte es sich um ein Plattenepithelkarzinom, in 42 Fällen (32,1%) um ein Adenokarzinom, bei zwei Patienten (1,5%) um ein undifferenziertes und einmal um ein kleinzelliges Karzinom (0,8%). Abbildung 5: Patientenverteilung nach Therapiejahr (1/1991-1/2003) unter Berücksichtigung der Histologie 16 14 12 10 Anzahl 8 6 4 2 0 1991 1992 1993 1994 1995 1996 1997 1998 1999 2000 2001 2002 Gesamtkollektiv n=131 13 10 4 12 10 10 15 10 9 7 14 14 2003 3 Plattenepithel-Ca n=86 10 7 2 8 7 7 12 7 4 5 11 4 2 Adeno-Ca n=42 3 3 2 3 3 2 3 3 5 2 3 9 1 sonstige n=3 0 0 0 1 0 1 0 0 0 0 0 1 0 Geschlecht: Von den 131 Patienten waren 106 Männer (80,9%) und 25 Frauen (19,1%). In der Patientengruppe mit Plattenepithelkarzinom war der Anteil an Frauen im t-Test tendenziell höher (p= 0,058), als in jener mit Adenokarzinom [Tabelle 12, Seite 42]. 42 Tabelle 12: Merkmal ♂ e Geschlecht Gesamt absolut % 106 80,9 25 ♀ 19,1 Plattenepithel-Ca absolut % 65 75,6 21 n=86 n=131 Adeno-Ca absolut % 38 90,5 24,4 4 n=42 p=0,058 9,5 Alter zum Operationszeitpunkt: Das Durchschnittsalter der Patienten lag bei 58,7 Jahren, der Altersmedian bei 60 Jahren. Im t-Test bestand hier weder zwischen Männern und Frauen (p=0,189), noch zwischen Patienten mit Adeno- und Plattenepithelkarzinom (p=0,263) ein signifikanter Unterschied [Tabelle 13]. Insgesamt 15 Personen (11,4%) waren 70 Jahre oder älter. Tabelle 13: Alter bei OP [Jahre] Minimum Maximum Mittelwert Median Gesamt n=131 36 77 58,7 60 Adeno-Ca n=42 37 72 60,1 61 PlattenepithelCa n=86 36 77 58,2 58,5 ♀ n=106 36 77 59,2 59,5 ♂ n=25 42 70 56,6 60 3.1.2. Anamnestische Angaben zu Lebensgewohnheiten und Gesundheitszustand Alkohol- und Nikotinanamnese: Regelmäßiges Rauchen und regelmäßiger Alkoholkonsum wurden in 79,4% beziehungsweise 80,9% der Fälle angegeben. Im Gegensatz zu den Patienten mit Adenokarzinom war die Korrelation zwischen einer positiven Alkohol- und Nikotinanamnese und dem Bestehen eines Plattenepithelkarzinoms mit p<0,0001 und p=0,001 hoch signifikant [Tabelle 14 und 15]. Tabelle 14: Merkmal Ja Nikotinanamnese positiv Nein Gesamt absolut % 104 79,4 27 n=131 20,6 Plattenepithel-Ca absolut % 76 88,4 10 n=86 11,6 Adeno-Ca absolut % 25 59,5 17 n=42 p<0,0001 40,5 43 Tabelle 15: Merkmal Ja Alkoholanamnese positiv Nein Gesamt absolut % 106 80,9 25 19,1 Plattenepithel-Ca absolut % 77 89,5 9 n=86 Adeno-Ca absolut % 26 61,9 10,5 16 n=42 p=0,001 n=131 38,1 Voroperationen und Begleiterkrankungen: Laut Krankenakte war bei 75 Patienten (57,3%) in anderem Zusammenhang bereits eine Operationen im Bereich von Hals, Thorax oder Abdomens erfolgt [Tabelle 16]. Tabelle 16: Voroperation im Bereich des Abdomens Voroperation im Bereich des Halses Voroperation im Bereich des Thorax Häufigkeit absolut 63 23 8 % 48,1 17,6 6,1 Bei 110 Patienten (84%) bestand zum Operationszeitpunkt, ungeachtet des Schweregrades, mindestens eine Begleiterkrankung [Tabelle 17]. Tabelle 17: Bereich ( n= 131) Keine Begleiterkrankungen 1-3 Begleiterkrankungen > 3 Begleiterkrankungen Hypertonus Pulmonale Begleiterkrankungen Kardiale Begleiterkrankungen Anderer maligner Tumor in der Anamnese Diabetes mellitus Hepatische Begleiterkr. (einschl. Zirrhose) Eingeschränkte Nierenfunktion Leberzirrhose Häufigkeit absolut 21 99 11 60 39 36 15 9 7 4 3 % 16 75,6 8,4 45,8 29,8 27,4 11,5 6,9 5,3 3,1 2,3 Bezüglich der Häufigkeit von Voroperationen und Begleiterkrankungen gab es keinerlei signifikanten Unterschiede zwischen den histologischen Subtypen. 44 3.1.3. Präoperative Tumordiagnostik mit Standardverfahren [1.4.7.] In mehr als der Hälfte der Fälle (58,8%) lag die Tumorlokalisation im distalen Bereich der Speiseröhre, bei den Adenokarzinomen mit 85,7% allerdings besonders häufig. Ein Plattenepithelkarzinom betraf den zervikalen Ösophagus. Bei einem Patienten trat ein plattenepitheliales Doppelkarzinom im proximalen und distalen Anteil des thorakalen Ösophagus auf. In der endoskopischen Diagnostik betrug die intraluminal nachweisbare Tumorausdehnung bei 61,8% der Patienten zwischen 5 und 10cm, bei 24,4% war der Tumor kleiner als 5cm, bei 3,1% größer als 5cm; acht Patienten hatten zu diesem Zeitpunkt bereits eine Tumorstenose und in sechs Fällen fehlten detaillierte Untersuchungsbefunde [Tabelle 18]. Tabelle 18: Merkmal oberes Drittel Endoskopische Tumorlokalisation Plattenepithel-Ca absolut % 10,5 9 Adeno-Ca absolut % 0 0 mittleres Drittel 43 32,8 37 43 6 14,3 unteres Drittel 77 58,8 38 44,2 36 85,7 cervical 1 0,8 1 1,2 0 0 Doppel-Ca 1 0,8 1 1,2 0 0 n= 131 32 24,4 n= 86 23 26,7 n= 42 8 19 5-10 cm 81 61,8 52 60,5 28 66,7 > 5 cm 4 3,1 1 1,2 3 7,1 Stenose 8 6,1 7 8,1 1 2,4 k.A. 6 4,6 3 3,5 2 4,8 < 5 cm Endoskopische Tumorausdehnung (gruppiert) Gesamt absolut % 6,9 9 n= 131 n= 86 n= 42 Bei 129 Patienten (98,5%) erfolgte die Ösophagusresektion in kurativer Absicht, d.h. es war klinisch von einem Tumor ≤ cT3 auszugehen, ohne dass Verdacht auf eine Fernmetastasierung bestand. Immerhin 48,1% hatten ein präoperatives Tumorstadium ≤ II a 45 und damit keinen Verdacht auf positive Lymphknoten. Bei zwei Patienten musste vor dem Eingriff bereits ein T4-Tumor beziehungsweise eine Fernmetastasierung vermutet werden; hier diente die Ösophagusresektion der Befundsicherung und der palliativen Therapie. In einem Fall war der präoperativ vermutete Lymphknotenstatus und damit das entsprechende UICC-Stadium retrospektiv nicht mehr zu ermitteln [Tabelle 19]. Tabelle 19: Merkmal 0 präoperatives UICC-Stadium Tumorausdehn. in der präoperativen Diagnostik Gesamt absolut % 0 0 Plattenepithel-Ca absolut % 0 0 Adeno-Ca absolut % 0 0 I 9 6,9 8 9,3 1 2,4 II a 54 41,2 32 37,2 21 50 II b 16 12,2 10 11,6 4 9,5 III 49 37,4 35 40,7 14 33,3 IV a 0 0 0 0 0 0 IV b 2 1,5 0 0 2 4,8 k.A. 1 0,8 1 1,2 0 0 ≤T2 n= 131 46 35,1 n= 86 32 37,2 n= 42 11 26,2 T3/T4 85 64,9 54 n= 86 n= 131 62,8 31 n= 42 p= 0,238 73,8 3.1.4. Weitere präoperativ erhobene Befunde und Parameter Karnofsky-Index und Compliance: Während beim Karnofsky-Index zwischen den Patienten mit Adeno- und Plattenepithelkarzinom im Mittel keinen wesentlicher Unterschied bestand (p= 0,195), war die Gruppe der Patienten mit neoadjuvanter Therapie derjenigen ohne signifikant überlegen (p= 0,010). Der Mittelwert im Gesamtkollektiv betrugen 86%, der Median 90% [Tabelle 20, Seite 46]. 19,1% der Patienten hatten präoperativ einen reduzierten Allgemeinzustand mit einem Karnofsky-Index < 80%. Bei sieben Patienten (5,3%) wurde die Compliance bereits vor dem Eingriff als beeinträchtigt eingeschätzt; auch hier bestand kein Unterschied zwischen den histologischen Subtypen. 46 Tabelle 20: KarnofskyIndex [%] Minimum Maximum Mittelwert Median Gesamt n= 131 Adeno-Ca n= 42 PlattenepithelCa n= 86 50 100 86 90 60 100 88,1 90 50 100 85,2 90 Neoadj. Therapie nein n= ja n= 35 96 50 60 100 100 87,6 81,7 90 80 Body-Mass-Index und Gewichtsverlust [%]: Mittelwert und Median im Gesamtkollektiv betrugen beim Body-Mass-Index jeweils 23,3 kg/m2. Bei den Patienten mit Adenokarzinom war er signifikant höher, als bei jenen mit Plattenepithelkarzinom (p= 0,002), und auch bei den Männern tendenziell höher, als bei den Frauen (p= 0,066) [Tabelle 21]. Insgesamt ließen sich 37 Patienten (28,3%) als übergewichtig einzustufen (BMI > 25), ohne dass hier jedoch ein relevanter Unterschied zwischen den histologischen Subtypen oder zwischen den Geschlechtern bestand. Tabelle 21: BMI vor OP [kg/m2] Minimum Maximum Mittelwert Median Gesamt n= 131 15,7 41,2 23,3 23,3 Adeno-Ca n= 42 17,9 41,2 25,1 24,6 PlattenepithelCa n= 86 15,7 36,6 22,5 21,9 männlich n= 106 15,7 41,2 23,7 23,5 weiblich n= 25 16 34,4 21,8 20,7 Der Gewichtsverlust betrug im Mittel 8,5%, der Median lag hier bei 7,8%. 58 Personen (44,3%) verloren präoperativ mehr als 10% ihres Körpergewichts. Es gab weder in bezug auf die Histologie (p= 0,776), noch bezüglich des präoperativen Therapiemodus (p= 0,179) einen bemerkenswerten Unterschied zwischen den jeweiligen Gruppen [Tabelle 22]. Tabelle 22: Gewichtsverlust Gesamt [%] n= 131 Adeno-Ca n= 42 PlattenepithelCa n= 86 Minimum Maximum Mittelwert Median 0 21,3 8,2 6,7 0 26,2 8,6 8 0 26,2 8,5 7,8 neoadj. Therapie ja nein n= 96 n= 35 0 0 26,2 21,2 9 7,1 8 6,4 47 Laborparameter: Nur 35 Personen zeigten hinsichtlich der hier betrachteten Blutuntersuchungen keinerlei Auffälligkeiten. Eine Übersicht über die Häufigkeit der jeweils auffälligen Befunde gibt Tabelle 23. Es gab keine signifikanten Unterschiede zwischen den Patienten mit unterschiedlicher Histologie. Tabelle 23: Parameter n= PTT Gesamteiweis GGT Serum-Harnstoff Quick GPT Serum-Kreatinin GOT Gesamtbilirubin 130 129 129 131 130 131 131 131 130 Häufigkeit von Befunden außerhalb des geltenden Referenzbereichs absolut % 47 36,2 42 32,6 34 26,4 14 10,7 7 5,4 7 5,3 7 5,3 6 4,6 5 3,8 Lungenfunktionsprüfung: Nur in 13 Fällen war die gesamte Lungenfunktionsprüfung einschließlich Blutgasanalyse unauffällig. Einen Überblick über die Häufigkeit von Untersuchungsbefunden außerhalb des jeweils gültigen Referenzbereichs gibt Tabelle 24. Bei keinem der Parameter gab es dabei einen signifikanten Unterschiede zwischen den histologischen Subtypen. Tabelle 24: Parameter n= PaCO2 PEF PaO2 MEF50 FEV1 VC 130 130 130 129 130 130 Häufigkeit von Befunden außerhalb des individuellen Referenzbereichs absolut % 59 45,4 54 41,5 51 39,2 43 33,3 28 21,5 22 16,9 Kardiologischen Diagnostik: Das Elektrokardiogramm (EKG) war bei 71,7% der Patienten unauffällig. Nur zwei hatten einen kardiologisch bedeutsamen Röntgen-Thorax-Befund. 48 Unter Einbeziehung einer dem jeweiligen Fall angemessenen, verschieden umfangreichen apperativen Diagnostik galten 96 der 131 Patienten (73,3%) aus kardiologischer Sicht als Personen mit normalem intra- und perioperativem Risiko. Bei 32 Patienten (24,4%) galt das Risiko als erhöht und bei drei (2,3%) als sehr hoch. Auch hier bestand kein signifikanter Unterschied zwischen den histologischen Subtypen. 3.1.5. Angaben zur Neoadjuvanten Therapie Zum systematischen Einsatz einer neoadjuvanter Therapie kam es erst ab Ende des Jahres 1993, ab diesem Zeitpunkt dann aber bei der überwiegenden Mehrheit der Patienten: von den 104 Patienten, die ab Januar 1994 operiert wurden, wurden 95 Personen (91,3%) vorbehandelt. Abbildung 6: Patientenverteilung nach Therapiejahr und präoperativem Behandlungsmodus 16 14 12 10 8 6 4 2 0 1991 1992 1993 1994 1995 1996 1997 1998 1999 2000 2001 2002 2003 Gesamtkollektiv n=131 13 10 4 12 10 10 15 10 9 7 14 14 3 keine neoadj. Therapie n=35 13 10 3 2 0 2 2 0 2 0 1 0 0 neoadjuvante Therapie n=96 0 0 1 10 10 8 13 10 7 7 13 14 3 Insgesamt erhielten 96 Patienten (73,3%) eine neoadjuvante Therapie [Abbildung 6]; das durchgeführte Therapieprotokoll ist unter 1.5.1. erläutert [Abbildung 3]. Ein histopathologisch gesicherter, kompletter Response fand sich nur bei 19,8% der Vorbehandelten; zwar lag dieser Anteil bei Patienten mit einem Plattenepithelkarzinom mit 49 25,8% deutlich höher als bei jenen mit Adenokarzinom mit 9,7%, der Unterschied war aber mit p= 0,101 nicht signifikant [Tabelle 25]. Tabelle 25: Merkmal Ja Neoadjuvante Therapie Response bei neoadjuvanter Therapie Gesamt absolut % 96 73,3 Nein 35 komplett n= 131 19 19,8 partiell 49 kein Response 28 n= 96 Plattenepithel-Ca absolut % 62 72,1 24 n= 86 11 n= 42 26,2 16 p=1 25,8 3 9,7 51 27 43,5 20 64,5 29,2 19 30,6 8 25,8 26,7 n= 62 27,9 Adeno-Ca absolut % 31 73,8 n= 31 50 3.2. Angaben zur Operation Operatives Vorgehen: In Abhängigkeit von Tumorgröße, Tumorlokalisation, dem Grad des präoperativ vermuteten Lymphknotenbefalls und der körperlichen Verfassung des Patienten erfolgte der Eingriff in 111 Fällen transthorakal (84,7%) und in 20 Fällen transhiatal (15,3%). Wegen der meist weiter distal gelegenen Tumorlokalisation entschieden sich die Operateure beim Adenokarzinom häufiger für den transhiatalen Zugang (p= 0,058). Zur Wiederherstellung der Speisepassage wurde in 126 Fällen (96,2%) ein Schlauchmageninterponat und in vier Fällen (3%) ein Koloninterponat verwendet. In einem Fall (0,8%) wurde die Kontinuität vorläufig nicht wiederhergestellt. 92,2% der Patienten wurden abdominel und 86,8% thorakal lymphadenektomiert. Es bestand kein relevanter Unterschied zwischen den histologischen Subtypen. Bei elf Patienten mit Plattenepithelkarzinom erfolgte aufgrund eines weit proximal gelegenen Tumors allerdings zudem eine zervikale Lymphadenektomie. Operationsdauer: Die mittlere Operationsdauer betrug 468,6 Minuten. Zwischen Operationsdauer und histologischem Befund gibt es keine bedeutende Korrelation (p= 0,2567). Allerdings wird die Länge des Eingriffs natürlich vom Operationsverfahren mitbestimmt. In der Gruppe mit „stumpfer“ Dissektion ist die mittlere Dauer des Eingriffs im t-Test hochsignifikant kürzer als bei den Patienten bei denen der transthorakale Zugang gewählt wurde (p< 0,0001) [Tabelle 26]. Tabelle 26: OP-Dauer [min] Minimum Maximum Mittelwert Median Gesamt n= 122 180 760 468,6 480 Adeno-Ca n= 38 200 650 451 467,5 Plattenep.-CA n= 81 240 760 477,1 490 transthor. n= 103 300 760 495 492,5 stumpf n= 19 180 600 327,9 300 51 3.3. Pathologisches Staging und Grading Wie bereits unter 3.1.5. beschrieben befanden sich nach vorangegangener neoadjuvanter Therapie 19 Patienten im histologisch gesicherten Stadium einer Vollremission. Zudem erwiesen sich drei der zunächst als T1 kategorisierten Tumoren postoperativ als Carcinoma in situ. Damit konnten insgesamt 16,8% der Operierten dem pathologischen UICC-Stadium 0 zugeordnet werden. Bei 56,5% wurde ein Tumor der Kategorie ≤ T2 entfernt. Bei immerhin 48,8% der Patienten (Stadium 0 + I + II a) war keiner er exzidierten Lymphknoten positiv, 15,3% befanden sich postoperativ im Stadium II b, 26,7% im Stadium III und 12 Patienten mussten dem Stadium IV zugeordnet werden [Tabelle 27]. Tabelle 27: Merkmal 0 pathologisches UICC-Stadium nach OP Tumorausdehn. in der postoperativen Pathologie Gesamt absolut % 22 16,8 Plattenep.-Ca absolut % 18 20,9 Adeno-Ca absolut % 4 9,5 I 7 5,3 5 5,8 2 4,8 II a 35 26,7 24 27,9 11 26,2 II b 20 15,3 9 10,5 10 23,8 III 35 26,7 24 27,9 10 23,8 IV a 3 2,3 3 3,5 0 0 IV b 9 6,9 3 3,5 5 11,9 k.A. 0 0 0 0 0 0 ≤ pT2 n= 131 74 56,5 n= 86 48 55,8 n= 42 24 57,1 pT3/4 57 43,5 38 n= 86 n= 131 44,2 18 n= 42 42,9 p= 1 4,6% der Tumoren waren gut differenziert, 50,4% mäßig und 41,2% schlecht. Zwei Tumoren wurden als undifferenziert beurteilt. Bei drei Präparaten ließ sich nach stattgehabter neoadjuvanter Therapie keine verbindliche Aussage mehr treffen. 52 In 93,1% der Fälle erfolgte eine R0-Resektion, vier mal wurde R1-reseseziert, und in fünf Fällen handelte es sich um einen lokal so fortgeschritten Befund, dass intraoperativ makroskopische Tumoranteile belassen werden mussten [Tabelle 28]. Tabelle 28: Merkmal 1 pathologisches Grading Residualtumor Klassifikation Gesamt absolut % 4,6 6 Plattenep.-Ca absolut % 4 4,7 Adeno-Ca absolut % 2 4,8 2 66 50,4 50 58,1 16 38,1 3 54 41,2 31 36 22 52,4 4 2 1,5 0 0 0 0 k.A. 3 2,3 1 1,2 2 4,8 0 n= 131 122 93,1 n= 86 80 93 n= 42 39 92,9 1 4 3,1 4 4,7 0 0 2 5 3,8 2 2,3 3 7,9 n= 131 n= 86 n= 42 53 3.4. Perioperativer Verlauf 3.4.1. Dauer des postoperativen stationären Aufenthalts Unter Einbeziehung der perioperativ Verstorbenen lag die mittlere Dauer des stationären Aufenthaltes bei 33,8 Tagen, der Median bei 25 Tagen [Tabelle 29]. Abbildung 7 zeigt die Verteilung der Verweildauer kumuliert in 10-Tages-Intervallen. Abbildung 7: Dauer des postoperativen Krankenhausaufenthalts (n=131) Dabei hatte die Gruppe der Patienten mit Adenokarzinom mit 29,4 Tagen im Mittel einen signifikant kürzeren stationären Aufenthalt als die der Patienten mit Plattenepithelkarzinom mit 36,5 Tagen (Mann-Whitney U-Test: p= 0,011). Die Mittelwerte in den Gruppen mit und ohne neoadjuvante Therapie zeigten zwar mit 36,2 und 27,4 Tagen einen noch deutlicheren Unterschied, mit p= 0,071 wurde das geltende Signifikanzniveau aber nicht erreicht. Auch die Patienten von 65 Jahren oder älter unterschieden sich hier nicht signifikant von den jüngeren (p= 0,690). Tabelle 29: Aufenthalt nach OP [Tage] Minimum Maximum Mittelwert Median Gesamt n= 131 Adeno-Ca n= 42 Plattenep.-CA n= 86 1 238 33,8 25 13 113 29,4 20 1 238 36,5 29,5 neoadj. Therapie ja nein n= 96 n= 35 1 7 238 104 36,2 27,4 27 21 54 Von wesentlichem Einfluss war hingegen vor allem die Morbidität: Bei Personen ohne therapiepflichtige perioperative Ereignisse war die Aufenthaltsdauer mit durchschnittlich 18,2 Tagen nur halb so lang, wie bei den übrigen mit durchschnittlich 36,5 Tagen (Mann-Whitney U-Test: p< 0,0001). Ferner lag die Aufenthaltsdauer bei den Patienten mit einer bis drei Komplikationen mit durchschnittlich 26,8 Tagen mit p< 0,0001 deutlich unter den durchschnittlich 62,9 Tagen in der Gruppe mit vier und mehr Komplikationen. Betrachtet man nur die 115 Patienten, die perioperativ überlebten, lag die mittlere Dauer des Krankenhausaufenthaltes bei 34,8 Tagen, der Median bei 17,5 Tagen. Das Maximum waren auch hier 238 Tage, das Minimum elf Tage. 55 3.4.2. Perioperative Morbidität Bei 112 der 131 Personen (85,5% des Gesamtkollektivs) kam es während des perioperativen Verlaufs zu therapiepflichtigen Komplikationen; diese waren am häufigsten pulmonaler Art (bei 64,1% der Operierten) oder betrafen den chirurgischen Bereich (bei 54,2% der Operierten). Dabei waren die Betroffenen in der überwiegenden Zahl der Fälle mit mehr als einer Komplikation konfrontiert [Tabelle 30]. Tabelle 30: Keine Komplikationen 1-3 Komplikationen Mehr als 3 Komplikationen Häufigkeit des Auftretens absolut % 19 14,5 82 62,6 30 22,9 Insgesamt betrachtet waren Patienten mit Plattenepithelkarzinom gegenüber jenen mit Adenokarzinom von Komplikationen signifikant häufiger betroffen (p= 0,024). Zudem war in der Gruppe der Personen mit Komplikationen der Karnofsky-Index im t-Test signifikant niedriger (p= 0,002). Einen Einfluss weiterer präoperativ ermittelbarer Parameter auf das generelle Auftreten perioperativer Morbidität war nicht nachweisbar. Insbesondere machte es keinen Unterschied, ob die Operierten zuvor neoadjuvant behandelt wurden oder nicht (p= 0,586). Tabelle 31 gibt eine Überblick zur Häufigkeit der Komplikationen bezüglich der Verteilung auf die einzelnen Organsysteme. Die Zahlen geben an, wie viele der 131 Patienten von mindestens einer Komplikation aus diesem Bereich betroffen waren. Organbeteiligungen im Rahmen eines Multiorganversagens sind hier nicht berücksichtigt. Tabelle 31: Pulmonale Komplikationen Chirurgische Komplikationen Kardiale Komplikationen Psychiartrische Komplikationen Gastrointestinale Komplikationen Renale Komplikationen Hepatische Komplikationen *Mehrfachnennungen möglich Anzahl der betroffenen Patienten* absolut % 84 64,1 71 54,2 27 20,6 9 6,9 8 6,1 3 2,3 2 1,5 56 Im weiteren folgt die Darstellung der einzelnen Arten von Ereignissen geordnet nach eben diesen Bereichen. Genannt werden jeweils die absolute Häufigkeit des Auftretens der Komplikation, der prozentuale Anteil der betroffenen Patienten und die Korrelation mit den unter 3.1. und 3.2. genannten, präoperativen Parametern, sofern das entsprechende Testergebnis entweder signifikant oder von sonstiger Bedeutung ist. Auf die Beziehungen zwischen perioperativer Morbidität und Letalität wird unter 3.4.3 eingegangen (Seite 63). Die Ergebnisse der Regressionsanalyse für das Auftreten chirurgischer und pulmonaler Komplikationen und letaler Verläufe finden sich unter 3.4.4. (Seite 67). Pulmonale Komplikationen: Bei 84 der Operierten (64,1%) wurde mindestens eine der nachfolgend aufgeführten pulmonalen Komplikationen beobachtet [Tabelle 32]. Tabelle 32: Art der Komplikation Absolute Häufigkeit des Auftretens* Pneumonien Punktionswürdiger Pleuraerguss ARDS Pleuraempyem 57 49 9 5 Anteil der betroffenen Patienten [%] 43,5 37,4 6,9 3,8 *Mehrfachnennungen möglich Eine signifikante Häufung pulmonaler Morbidität fand sich bei Patienten, die präoperativ einen Karnofsky-Index < 80% aufwiesen (p= 0,005) und bei pulmonal Vorerkrankten (p=0,018). Pneumonien waren mit 57 Fällen von der größten klinischen Bedeutung: Patienten mit Plattenepithelkarzinom waren hier gegenüber Patienten mit Adenokarzinom signifikant häufiger betroffen (p= 0,038). Vor allem erkrankten aber Personen mit einem präoperativ reduzierten Karnofsky-Index < 80% (p= 0,005) besonders oft an einer Pneumonie; auch eine positive Raucheranamnese (p= 0,050) und das Bestehen pulmonaler Vorerkrankungen (p=0,022) schienen hier zu prädisponieren. Ein punktionswürdiger Pleuraerguss trat bei Patienten mit einem Karnofsky-Index < 80% ebenfalls signifikant häufiger auf (p= 0,005); diese Komplikation wurde allerdings noch öfter bei Patienten mit einem abweichenden arteriellen CO2-Partialdruck beobachtet (p= 0,001). 57 Chirurgische Komplikationen: 71 Patienten (54,2%) waren von mindestens einer der in Tabelle 33 aufgeführten chirurgischen Komplikationen betroffen. Bezüglich der Häufigkeit spielte die unterschiedliche Histologie und die Höhe des präoperativen Karnofsky-Index keine Rolle, wohl aber die neoadjuvante Therapie: Vorbehandelte Personen erkrankten hier signifikant häufiger (p= 0,017). Tabelle 33: Art der Komplikation Absolute Häufigkeit des Auftretens* Rekurrensparese Anastomoseninsuffizienz Wundinfekt Magenausgangsstenose Chylothorax Interponatsnekrose Blutung Bronchial- oder Trachealleck Collare oder mediastinale Fistel Platzbauch Enterothorax Akzessoriusläsion Hämatoperineum Fasziendehiszens 39 20 18 10 7 3 2 2 2 1 1 1 1 1 Anteil der betroffenen Patienten [%] 29,8 15,3 13,7 7,6 5,3 2,3 1,5 1,5 1,5 0,8 0,8 0,8 0,8 0,8 *Mehrfachnennungen möglich Kardiale Komplikationen: Bei 27 Personen (20,6%) wurde je eine, der nachfolgend aufgeführten kardialen Komplikationen beobachtet [Tabelle 34, Seite 58]. Personen mit präoperativ reduziertem Karnofsky-Index waren auch hier besonders häufig betroffen (t-Test: p= 0,004); zudem war der Altersdurchschnitt in der Patientengruppe mit kardialen Komplikationen im t-Test mit p=0,024 signifikant höher. Dagegen spielten kardiale Vorerkrankung keine bedeutende Rolle (p=0,465), und auch die Korrelation mit einem aus kardiologischer Sicht erhöhten Operationsrisiko war mit p= 0,095 nicht signifikant. Es bestand kein relevanter Unterschied zwischen den histologischen Subtypen . 58 Tabelle 34: Art der Komplikation Absolute Häufigkeit des Auftretens Therapierte postop. Rhythmusstörungen Kardiale Insuffizienz Myokardiale Ischämie oder Infarkt Perikarditis Perikarderguss 17 5 3 1 1 Anteil der betroffenen Patienten [%] 13 3,8 2,3 0,8 0,8 Renale und hepatische Komplikationen: In drei Fällen kam es perioperativ zu einem isolierten Nierenversagen, einmal davon irreversibel. Bei zwei Personen bildete sich aufgrund einer starken hepatischen Funktionsbeeinträchtigung Aszites. Hier bestand ein signifikanter Zusammenhang mit dem Vorbestehen einer Leberzirrhose (p= 0,023). Es gab in beiden Bereichen keinen relevanten Unterschied zwischen den histologischen Subtypen. Gastrointestinale Komplikationen: Auch postoperative gastrointestinale Komplikationen waren mit insgesamt 8 Betroffenen (6,1%) relativ selten [Tabelle 35]. Auffälligkeiten bezüglich der unterschiedlichen Histologie oder sonstigen Faktoren bestanden nicht. Tabelle 35: Art der Komplikation Absolute Häufigkeit des Auftretens Ösophagusstenose Ileus Rezidivierendes Erbrechen unklarer Genese Infarzierung einer Dünndarmschlinge Subakute Stress-Cholezystitis Nekrotisierende Pankreatitis Ulcus im Mageninterponat 3 1 1 1 1 1 0 Anteil der betroffenen Patienten [%] 2,3 0,8 0,8 0,8 0,8 0,8 0 Psychiartrische Komplikationen: Je fünf mal kam es perioperativ zu einem Hirnorganischen Psychosyndrom (einschließlich Alkoholentzugsdelir), beziehungsweise zu einer reaktiven Depression im Rahmen der Krankheitsverarbeitung. Dabei war ein Patient von beiden Ereignissen betroffen. Auffällige 59 Korrelationen mit der präoperativen Einschätzung der Compliance oder anderer präoperativ ermittelter Parameter wurden nicht beobachtet. Sepsis und Multiorganversagen: 13 Patienten (9,9%) hatten während des postoperativen stationären Aufenthalts eine Sepsis im Sinne einer mit dem klinischen Bild eines Systemic Inflammatory Response Syndromes verbundenen Septikämie. In sieben Fällen (5,3%) kam es zum Multiorganversagen. Sonstige Komplikationen: In 21 Fällen (16%) traten weitere Komplikationen auf, die sich nicht den bisher genannten Bereichen zuordnen ließen. Sie werden in nachfolgender Tabelle 36 namentlich genannt. Tabelle 36: Art der Komplikation Absolute Häufigkeit des Auftretens* Postop. Schmerzsyndrome mit erhöhtem Analgetikabedarf 3 2 Harnwegsinfekt 2 Transiente postoperative Parese (Lagerungsschaden) 1 Apoplex 1 Elektrolytentgleisung 1 Störung der plasmat. und thrombozytischen Gerinnung 1 Vena Subclavia-Thrombose 1 Epididymitis 1 Generalisiertes Exanthem ohne Kreislaufbeteiligung 1 Leukopenie 1 Decubitus 1 Retrobulbäre Einblutung 1 Heparininduzierte Thrombozytopenie Typ 1 (HIT 1) 1 Reaktivierung einer vorbestehenden Tuberkulose 1 Blasenentleerungsstörung bei benig. Prostatahyperplasie 1 Stomatitis 1 Lokale Hypästesie Anteil der betroffenen Patienten [%] 2,3 1,5 1,5 0,8 0,8 0,8 0,8 0,8 0,8 0,8 0,8 0,8 0,8 0,8 0,8 0,8 0,8 *Mehrfachnennungen möglich Revisionsoperationen und Tracheotomie bei Langzeitbeatmung: In 25 Fällen (19,1%) wurde im perioperativen Verlauf aus unterschiedlichsten Gründen eine chirurgische Revision notwendig [Tabelle 37, Seite 60-62], in ebenfalls 25 Fällen eine Tracheotomie in Zusammenhang mit einer Langzeitbeatmung. Auch hier waren bezüglich der histologischen Subtypen keine relevanten Unterschiede zu beobachten. 60 Tabelle 37: Fälle mit Revisionsoperation geordnet nach Therapiejahr Nr. 1 2 3 4 5 6 7 8 Tage Art und Ursache der zwischen Revisionsoperation OP und ReOP Relaparatomie: Cholecystektomie und Choledochusrevision bei Stresscholecystitis, sowie 11 Nekrosektomie und Lavage bei nekrotisierender Pankreatitis und retroperitonealem Abszess Collare Mediastinotomie mit Tamponade und Rethorakotomie 5 mit Costotomie zur Hämatomausräumung Rethorakotomie bei Anastomoseninsuffizienz 9 mit Wundinfekt: Revision mit Empyemausräumung Relaparatomie: Resektion einer infarzierten Jejunumschlinge und 10 Bauchdeckenverschluss bei Platzbauch Rethorakotomie bei 28 Anastomoseninsuffizienz Rethorakotomie bei Wundinfekt 11 mit Spülung und Drainageneinlage Rethorakotomie bei Pleuraempyem 13 mit Spülung und Drainageneinlage Sekundärnaht wegen 39 Wundheilungsstörung Periop. Exitus Alter in Jahren nein 55 Geschlecht Histologie Neoad. Therapie Zugang Score- Therapiebeim Punkte jahr Ersteingriff ♂ Adeno-Ca (A) nein transhiatal 15 1992 ja transthorakal 11 1994 nein 60 ♀ Plattenepithel-Ca (P) nein 62 ♂ P ja transthorakal 16 1995 nein 47 ♂ P ja transthorakal 15 1995 nein 56 ♂ P ja 13 1995 nein 68 ♂ A nein 15 1996 nein 56 ♂ P ja 15 1996 nein 63 ♂ P ja 18 1996 transthorakal transthorakal transthorakal transthorakal 61 Tabelle 37 – Fortsetzung: Fälle mit Revisionsoperation geordnet nach Therapiejahr Nr. 9 10 11 12 13 14 15 16 17 18 19 Tage Art und Ursache der zwischen Revisionsoperation OP und ReOP 5 Rethorakotomie zum Verschluss eines Leck im linken Hauptbronchus 7 Relaparatomie wegen freier Flüssigkeit 12 Revision der collaren Anastomose bei Anastomoseninsuffizienz 8 Relaparatomie: Jejunumteilresektion und Spülung 10 Revision der collaren Anastomose bei Anastomoseninsuffizienz 11 Revision der collaren Anastomose bei Anastomoseninsuffizienz 14 Revision der collaren Anastomose bei Anastomoseninsuffizienz 52 Rethorakotomie mit Übernähen des Ductus thoracicus, Pleurolyse, partielle Pleurektomie und multiple Übernähungen der Lunge 13 Rethorakotomie mit Übernähen des Ductus thoracicus und Pleurodese 10 Revision der collaren Anastomose Anastomoseninsuffizienz 6 Rethorakotomie bei Pleuraempyem und Anastomoseninsuffizienz Periop. Exitus Alter in Jahren Geschlecht Histologie nein 51 ♂ P ja ja 52 ♂ P ja nein 64 ♀ P ja ja 52 ♀ P ja nein 66 ♂ P ja nein 65 ♂ P ja nein 52 ♂ A ja nein 70 ♂ A ja nein 60 ♀ P ja nein 36 ♂ P ja nein 60 ♂ A ja Neoad. Therapie Zugang Score- Therapiejahr beim Punkte Ersteingriff transthorakal 17 1997 20 1997 11 1997 14 1998 15 1998 11 1998 13 1998 transthorakal 13 1998 transthorakal 15 1999 13 1999 11 1999 transthorakal transthorakal transthorakal transthorakal transthorakal transthorakal transthorakal transthorakal 62 Tabelle 37 – Fortsetzung: Fälle mit Revisionsoperation geordnet nach Therapiejahr Nr. 20 Tage zwischen OP und ReOP 5 21 5 22 11 23 15 113 24 11 25 33 Art und Ursache der Revisionsoperation in Stichworten Relaparatomie zur Restgastrektomie bei Nekrose u. Insuffizienz der Klammernaht Rethorakotomie wegen Interponatsnekrose; temporärer Aufhebung der Kontinuität Rethorakotomie mit Debridement, Spülung und Vakuumversiegelung Rethorakotomie: Mobilisation des Magens, Spülung, Drainage und Katheterjejunostomie Relaparatomie mit Splenektomie, Cholezystektomie und Ausräumung von Nekrosen Revision, Spülung, Drainage bei Abszess und Insuffizienz der Magenklammernaht Relaparatomie bei Hämoperitoneum: Spülung und Drainageneinlage Periop. Exitus Alter in Jahren Geschlecht Histologie Neoad. Therapie Zugang beim Ersteingriff ScorePunkte Therapiejahr ja 61 ♂ P ja transthorakal 15 2000 nein 62 ♀ P ja transthorakal 11 2001 ja 58 ♂ A ja 11 2001 nein 63 ♂ P ja transthorakal transthorakal 15 2001 nein 62 ♂ P ja transhiatal 19 2002 ja 65 ♂ P ja transthorakal 22 2003 63 3.4.3. Perioperative Letalität 16 Patienten (12,2%) verstarben perioperativ während des stationären Aufenthalts, zwölf davon (9,2%) in den ersten 30 Tagen [Tabelle 38, Seite 64-65]. Bezüglich der Geschlechts- und Altersverteilung, des präoperativen Therapiemodus und der histologischer Zuordnung gab es keinerlei signifikante Unterschiede zum Gesamtkollektiv. In jedem der Fälle mit letalem Ausgang erfolgte die Ösophagusresektion transthorakal. Die Speisepassage wurde in 14 Fällen mittels Magenhochzug rekonstruiert, in zwei Fällen durch ein Koloninterponat. Im Mittel verstarben diese Patienten nach 24,5 Tagen, der Median lag bei 22 Tagen, die maximale Dauer des postoperativen Krankenhausaufenthalts vor Exitus bei 59 Tagen, die minimale bei einem Tag. Bei elf Patienten (68,7% der perioperativ Verstorbenen) stand final die respiratorischer Insuffizienz im Vordergrund und zwar entweder unmittelbar in Zusammenhang mit einer Aspiration oder im Rahmen einer Pneumonie, einer (meist pneumogenen) Sepsis oder eines ARDS. Herzversagen war in vier Fällen (25%) ursächlich für den Exitus, dabei einmal im Rahmen einer Pleuroperikarditis und einmal in Zusammenhang mit einem Apoplex. Ein Patient verstarb unmittelbar am ersten postoperativen Tag an den Folgen einer nicht mehr kontrollierbaren Massenblutung. Perioperative Letalität und präoperative Parameter: Von den präoperativ erhobenen Parametern ließen in der Einzelprüfung nur zwei eine signifikante Beziehung mit einem letalen perioperativen Verlauf erkennen: Patienten mit reduziertem Karnofsky-Index (t-Test: p= 0,002) und jene mit erhöhter GGT (p= 0,033) verstarben deutlich häufiger. Zwischen Exitus und fortgeschrittenem Lebensalter ergab sich im t-Test (p= 0,165) kein signifikanter Zusammenhang. Darstellung und Ergebnisse der Regressionsanalyse zur perioperativen Letalität finden sich unter 3.4.4. (Seite 67). 64 Tabelle 38: Fälle der perioperativ Verstorbenen geordnet nach Anzahl der Tage zwischen Operation und Tod Nr. Tage zwischen OP und Exitus 1 1 2 7 3 8 4 8 5 10 6 17 7 19 8 22 9 25 10 27 11 30 12 33 13 34 Todesursache in Stichworten MOV nach Massenblutung MOV bei pneumogener Sepsis MOV bei ARDS Kardiales Globalversagen Atem- und Kreislaufstillstand nach Aspiration Hypoxisches Herzkreislaufversagen bei pneumogener Sepsis Respiratorische Insuffizienz bei Pneumonie Respiratorische Insuffizienz MOV bei pneumogener Sepsis MOV bei ARDS MOV bei pneumogener Sepsis ARDS mit konsekutivem Herzkreislaufversagen Respiratorische Insuffizienz bei Sepsis Neoadjuvante Histologie Therapie Geschlecht Therapiejahr Alter in Jahren ScorePunkte 55 17 ja PlattenepithelCa (P) ♂ 1996 57 17 nein P ♂ 1992 42 19 nein P ♀ 1992 64 17 ja P ♂ 1997 74 21 ja P ♂ 1995 70 22 ja P ♂ 1998 65 17 nein Adeno-Ca (A) ♂ 1993 66 17 ja P ♂ 1996 58 11 ja A ♂ 2001 57 19 nein P ♀ 1993 77 16 ja P ♂ 2001 52 14 ja P ♀ 1998 52 20 ja P ♂ 1997 65 Tabelle 38 – Fortsetzung: Fälle der perioperativ Verstorbenen geordnet nach Anzahl der Tage zwischen Operation und Tod Nr. Tage zwischen OP und Exitus 14 45 15 47 16 59 Todesursache in Stichworten MOV nach Pleuroperikarditis Herzkreislaufversagen Kardiopulmonales Versagen nach Apoplex Neoadjuvante Histologie Therapie Geschlecht Therapiejahr Alter in Jahren ScorePunkte 61 15 ja P ♂ 2000 65 22 ja P ♂ 2003 70 20 ja A ♂ 1997 66 Perioperative Letalität und Morbidität: Mit Fisher`s Exact Test wurden die unter 3.4.2. genannten Ereignisse mit dem Auftreten perioperativer Letalität in Beziehung gesetzt. Tabelle 39 zeigt die Resultate für die verschieden Hauptgruppen perioperativer Morbidität und die signifikanten Ergebnisse für einzelne Komplikationen. Tabelle 39: Keine Komplikationen 1-3 Komplikationen Mehr als 3 Komplikationen Pulmonale Komplikationen (gesamt) Pneumonien Punktionswürdiger Pleuraerguss ARDS Chirurgische Komplikationen (gesamt) Interponatsnekrose Kardiale Komplikationen (gesamt) Psychiartrische Komplikationen (gesamt) Gastrointestinale Komplikationen (gesamt) Renale Komplikationen (~Nierenversagen) Hepatische Komplikationen (~Aszites) Sepsis MOV Anzahl der Betroffenen mit Exitus 0 7 9 16 11 11 6 7 2 8 1 0 2 0 8 7 p= 0,126 0,107 0,002 0,001 0,035 0,011 < 0,0001 0,424 0,039 0,005 1 0,597 0,039 1 < 0,0001 < 0,0001 67 3.4.4. Ergebnisse der Regressionsanalyse Bezüglich des Auftretens chirurgischer Komplikationen, pulmonaler Komplikationen und des letalen perioperativen Verlaufs wurden mit folgenden 23 präoperativen Parametern [Tabelle 40] eine Regressionsanalyse durchgeführt. Tabelle 40: Allgemeine Angaben: • Geschlecht • Alter bei OP in Jahren • Karnofsky-Index in % • Regelmäßiger Alkoholkonsum: ja/nein • Vorbestehender Tabakkonsum: ja/nein • Compliance: gut/schlecht • BMI in kg/m2 • Gewichtsverlust in % • Neoadjuvanten Therapie: ja/nein Leberfunktion: • Quick unauffällig: ja/nein • PTT unauffällig: ja/nein • Gesamteiweiß unauffällig: ja/nein • Gesamtbilirubin unauffällig: ja/nein • GGT unauffällig: ja/nein • GOT unauffällig: ja/nein • GPT unauffällig: ja/nein Nierenfunktion: • Serum-Kreatinin unauffällig: ja/nein • Serum-Harnstoff unauffällig: ja/nein Herzfunktion: • Rö-Thorax kardial unauffällig: ja/nein Histologie und Tumor-Staging: • Histologie: Adeno- oder Plattenepithel-Ca • Präoperatives T-Staging • Präoperatives N-Staging • Tumorausdehnung > T2: ja/nein Die Auswahl der Parameter orientierte sich an derjenigen von Bartels et al. [Tabelle 8, Seite 29]. Allerdings mit einigen Abweichungen, denn aufgrund des retrospektiven Ansatzes waren die identischen Parameter nur teilweise verfügbar. Bezüglich der hepatischen Funktion musste in Ermangelung des Aminopyrin-Atemtests und der Angaben zum Serumalbuminspiegel auf die Reihe der in Tabelle 40 genannten leberspezifischen Laborparameter ausgewichen werden. Auch bei der Beurteilung der Nierenfunktion lagen zwar keine Daten zur Kreatinin-Clearance vor, dafür aber zum Kreatinin- und Harnstoffspiegel. In bezug auf die Herzfunktion fand nur der Parameter „Röntgen-Thorax kardial unauffällig: ja/nein“ Berücksichtigung. Die Größe „präoperativer Gewichtsverlust“ wurde durch die Angaben zum präoperativen Body-mass-Index ergänzt, die Faktoren „vorbestehende Leberzirrhose“ und „Diabetes 68 mellitus“ wurden wegen der in bezug auf dieses Kollektiv geringen Prävalenz dieser Erkrankungen nicht berücksichtigt. Die Gesamtzahl der zu prüfenden Faktoren war entsprechend dem relativ kleinen Untersuchungskollektiv grundsätzlich begrenzt. Bei 131 zum Teil unvollständigen Datensätzen befindet man sich mit der Berücksichtigung von 23 Einflussgrößen und 3 Zielgrößen bereits am äußersten Rand des bezüglich der statistischen Aussagefähigkeit Vertretbaren. Es muss somit angemerkt werden, dass die Bereiche Herz- und Lungenfunktion in dieser Auswahl unzureichend bzw. gar nicht repräsentiert sind. Allerdings erhält diese Regressionsanalyse durch die Einbeziehung der Faktoren „präoperative Histologie“, „neoadjuvante Therapie“ und „präoperatives T- und N-Staging“ einen anderen interessanten Schwerpunkt. Ein weiteres Problem stellte die bereits unter 2.2. besprochene Unvollständigkeit der Angaben zu einzelnen Patienten dar: Das verwendete Statistikprogramm akzeptierte zu Beginn des rechnerischen Verfahrens nur Datensätze, die bezüglich der zu analysierenden Einflussgrößen vollständig waren. Es war allerdings teilweise möglich, anfangs ausgeschlossene Datensätze in die laufende Berechnung nachträglich mit einzubeziehen, wenn der fehlende Parameter zuvor bereits als nicht signifikant eliminiert worden war. Regressionsmodell mit der Zielgröße „Chirurgische Komplikationen: ja/nein“ (n= 128) Das Auftreten chirurgischer Komplikationen korrelierte am deutlichsten mit der Kombination der folgenden fünf präoperativ ermittelten Merkmale [Tabelle 41]: Tabelle 41: Position Dimension Parameter 1. 2. 3. 4. 5. Gewichtsverlust in % Geschlecht: ♂/♀ GPT unauffällig: ja/nein Neoadjuvante Therapie: ja/nein Histologie: Adeno-/Plattenepithel-Ca zunehmend ♂ nein ja P.-Ca p-Wert im Wald χ²-Test 0,1080 0,0634 0,0553 0,0167 0,0452 Odds Ratio 1,047 0,391 9,296 0,343 0,429 Männer mit Plattenepithelkarzinom und überdurchschnittlichem Gewichtsverlust, die zuvor eine neoadjuvante Therapie erhalten hatten, hatten im Zusammenhang mit einer Serum-GPTBestimmung außerhalb des Referenzbereichs Komplikationen, als die anderen Patienten. bedeutend häufiger chirurgische 69 Regressionsmodell mit der Zielgröße „Pulmonale Komplikationen: ja/nein“ (n= 124) Das Auftreten pulmonaler Komplikationen korrelierte am deutlichsten mit der Kombination der folgenden vier präoperativ ermittelten Merkmale [Tabelle 42]: Tabelle 42: Position Dimension Parameter 1. 2. 3. 4. Alter bei OP in Jahren Karnofsky-Index in % GGT unauffällig: ja/nein Präoperatives N-Staging zunehmend abnehmend nein zunehmend p-Wert im Wald χ²-Test 0,0702 0,0085 0,0548 0,0690 Odds Ratio 1,045 0,952 2,644 2,098 Personen in reduziertem Allgemeinzustand mit einem präoperativ positiven LymphknotenStaging erlitten in Verbindung mit überdurchschnittlich hohem Alter und dem Befund einer auffälligen GGT bedeutend häufiger pulmonale Komplikationen, als andere Patienten. Regressionsmodell mit der Zielgröße „Perioperative Mortalität: ja/nein“ (n= 128) Das Auftreten perioperativer Letalität korrelierte am deutlichsten mit der Kombination der folgenden vier präoperativ ermittelten Merkmale [Tabelle 43]: Tabelle 43: Position Dimension Parameter 1. 2. 3. 4. Alter bei OP in Jahren Karnofsky-Index in % PTT unauffällig: ja/nein GGT unauffällig: ja/nein zunehmend abnehmend ja * nein p-Wert im Wald χ²-Test 0,0515 0,0006 0,0379 0,0093 Odds Ratio 1,084 0,915 0,214 5,608 * paradoxes Ergebnis Personen mit reduziertem Allgemeinzustand und überdurchschnittlichem Alter waren in Verbindung mit dem Befund einer auffälligen GGT bedeutend häufiger von einem letalen perioperativen Verlauf betroffen als die anderen Patienten. Paradoxer Weise war in dieser Gruppe zudem signifikant häufiger eine PTT innerhalb des Normbereichs zu beobachten. 70 3.4.5. Retrospektive Anwendung des Bartels-Scores Die retrospektive Anwendung des Bartels-Scores einschließlich der Klassifikation des perioperativen Verlaufs erfolgte wie unter 1.6.3. [Tabelle 9-10, Seite 30] dargestellt. Lediglich zur Beurteilung der Leberfunktion wurden statt des Aminopyrin-Atemtests die Laborparameter GOT, GPT, GGT, Quick, PTT und Gesamtbilirubin verwendet. Es konnten 130 Datensätze berücksichtigt werden. Erreichte Punkte im Präoperativscore und Verteilung nach Risikogruppen: Eine Übersicht der Ergebnisse bezüglich der einzelnen Bereiche gibt Tabelle 44. Die letzten beiden Spalten zeigen nochmals den jeweils zuzuordnenden Punktwert und die Faktorierung: Tabelle 44: Bereich Parameter VC > 90% und PaO2 > 70% Lungenfunktion Leberfunktion Plattenep-Ca absolut % n= 86 42 48,8 Adeno-Ca absolut % n= 42 25 59,5 Punkte Faktor 1 VC< 90% oder PaO2 < 70% 61 46,9 44 51,2 17 40,5 2 VC< 90% und PaO2 < 70% alle hepatische Laborparameter unauffällig 0 0 0 0 0 0 3 63 48,5 40 46,51 23 54,8 1 mindestens ein Parameter auffällig 64 49,2 44 51,16 19 45,2 2 Zirrhose 3 2,3 2 2,3 0 0 3 95 73,1 61 70,9 32 76,2 1 32 24,6 24 27,9 8 19 2 normales Risiko Herzfunktion erhöhtes Risiko als OP-Risiko nach kardiodeutlich erhöhtes logischer Risiko Einschätzung Allgemeinzustand Gesamt absolut % n= 130 69 53,1 ·2 ·2 ·3 3 2,3 1 1,2 2 4,8 3 Karnofsky > 80% und Compliance gut 74 56,9 45 52,3 28 66,7 1 Karnofsky <80% oder Compliance schlecht 50 38,5 37 43 12 28,6 2 Karnofsky <80% und Compliance schlecht 6 ·4 4,6 4 4,7 2 4,8 3 71 Für das Gesamtkollektiv ergibt sich damit folgende Punktverteilung [Abbildung 8]: Abbildung 8: Patientenverteilung nach Scoreergebnis unter Berücksichtigung der Histologie Mit 65 Personen erreichte genau die Hälfte der Patienten ein Ergebnis zwischen 11 und 15 Punkten, was nach Bartels et al. einem niedrigen perioperativen Risiko entspricht, 55 Patienten (42,3%) gehörten mit 16 bis 21 Punkten zur Gruppe mit moderat erhöhtem Risiko und 10 Personen (7,7%) zählten mit einem Ergebnis von 22 Punkten oder mehr zu den Hochrisikopatienten. Keiner der Patienten erreichte mehr als 26 Punkte. Klassifikation des perioperativen Verlaufs nach Bartels et al. (Tabelle 10, Seite 30): Bei 112 Patienten (86,1%) ließ sich der postoperative Verlauf nach diesem Schema als „normal“ einstufen, bei zwei Patienten (1,5%) fällt der Verlauf in die Kategorie „prolongiert“, bei vier Patienten (3,1%) in die Kategorie „erschwert“ und 12 Patienten (9,2%) verstarben binnen der ersten 30 Tage. Im Mann Whitney U-Test bestand mit p= 0,020 eine signifikante Korrelation zwischen einem erhöhten Score-Ergebnis und der Kategorie „letal“ (Mittelwert 17,75 gegenüber 15,60). In der Gruppe mit „normalem“ Verlauf lag der Mittelwert mit 15,59 gegenüber 17,11 signifikant unter dem der übrigen Patienten (Mann Whitney U-Test: p= 0,035). Setzt man mit Fisher`s Exact Test die einzelnen Risikogruppen und die von Bartels et al. verwendeten Verlaufskategorien miteinander in Beziehung ergibt sich folgendes: 72 Patienten der Niedrigrisikogruppe starben in den ersten 30 Tagen signifikant seltener, als alle andern (p= 0,004). Beim Vergleich der Patienten mit moderatem und hohem Risiko ergab sich kein deutlicher Unterschied. Auch überlebten die als Hochrisikopatienten klassifizierten Personen die ersten 30 Tagen keineswegs signifikant seltener als die Gesamtgruppe der Personen mit weniger als 22 Score-Punkten (p= 0,355). Bezüglich der Kategorien „prolongierter“ und „erschwerter“ Verlauf ließen sich wegen der geringen Zahl der Betroffenen keine bedeutenden Korrelationen beobachten. Tabelle 45: Verteilung im Sinne der Klassifikation des perioperativen Verlaufs nach Bartels et al. Verlauf normal prolongiert erschwert lethal (binnen 30 d) Gesamt n= 130 absolut 112 2 4 12 % 86,1 1,5 3,1 9,2 Plattenepithel-Ca n= 86 absolut % 71 82,6 2 2,3 3 4,5 10 11,6 Adeno-Ca n= 42 absolut % 39 92,5 0 0 1 2,4 2 4,8 Beziehungen zwischen Score, perioperativer Morbidität und Gesamtletalität: Der Mittelwert aller 16 perioperativ Verstorbenen lag mit 17,75 Punkten signifikant über dem der Überlebenden mit 15,53 (Mann Whitney U-Test: p= 0,007). Eine deutliche Beziehung zwischen hohem Score und perioperativer Morbidität bestand allerdings weder bei Betrachtung der Gesamtmorbidität (Mann Whitney U-Test: p= 0,250), noch bezüglich der häufigen pulmonalen (Mann Whitney U-Test: p= 0,264), chirurgischen (Mann Whitney U-Test: p= 0,822) und kardialen Komplikationen (Mann Whitney U-Test: p= 0,107). Ferner gab es im Mann Whitney U-Test mit p= 0,108 keinen signifikanten Unterschied zwischen Patienten mit Plattenepithelkarzinom (mittlerer Score 16,98) und jenen mit Adenokarzinom (mittlerer Score 15,09). Weitere Ergebnisse finden sich unter 4.7. (Seite 92) in direkter Gegenüberstellung mit jenen von Bartels et al. 73 3.5. Langzeitüberleben Das Langzeitüberleben des Gesamtkollektivs betrug einschließlich Krankenhausletalität (n=131; zensiert 35) im Mittel 3,80 Jahre, der Überlebensmedian lag bei 1,41 Jahren. Die Fünfjahresüberlebensrate betrug 24,35% [Abbildung 9]. Stichtag war der 15.04.2004. Abbildung 9: Kaplan-Meier-Kurve für das Gesamtkollektiv einschließlich Krankenhausletalität Betrachtet man nur die perioperativ überlebenden Patienten (n= 115; zensiert 35), lag die mittlere Überlebensdauer bei 4,31 Jahren, der Median bei 1,53 Jahren und die Fünfjahresüberlebensrate bei 27,74%. Die Angaben zum Langzeitüberleben der Patienten getrennt nach den histologischen Subtypen und dem präoperativen Therapiemodus sind Tabelle 46 (Seite 74) zu entnehmen. Abbildung 10 (Seite 75) zeigt die Überlebenskurven getrennt nach der histologischen Zuordnung. Ein signifikanter Unterschied bestand nicht (Logrank-Test: p= 0,4435). Für die neoadjuvante Therapie konnte nur bei Patienten mit Adenokarzinom ein signifikanter Überlebensvorteil nachgewiesen werden (Logrank-Test: p= 0,0075). Abbildung 11 (Seite 75) zeigt die entsprechenden Überlebenskurven. 74 Tabelle 46: Patientengruppe n= zensiert Mit neoadjuvanter Therapie Ohne neoadjuvante Therapie Plattenepithel-Ca (SCC) Adeno-Ca (AC) SCC mit neoadju. Therapie SCC ohne neoadju. Therapie AC mit neoadju. Therapie AC ohne neoadju. Therapie 96 35 86 42 62 24 31 11 29 6 19 15 62 24 14 1 Mittleres Überleben [Jahre] 3,30 3,36 3,48 3,91 2,51 4,03 4,13 1,66 Median [Jahre] 1,42 1,15 1,18 1,42 1,16 1,01 2,04 0,79 5-Jahres- Logrank Überleben -Test [%] p= 24,93 0,5017 22,04 p= 29,23 0,4435 22,00 19,36 p= 0,4508 27,78 35,99 p= 0,0075 09,09 75 Abbildung 10: Kaplan-Meier-Kurven für die Patientengruppen mit Plattenepithel- und Adenokarzinom 100 90 kumulatives Überleben [%] 80 70 60 50 Adeno-Ca 40 Adeno-Ca 30 zensiert 20 Plattenepithel-Ca 10 Plattenep.-Ca zensiert 0 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 postoperatives Überleben [Jahre]; n=128 Abbildung 11: Kaplan-Meier-Kurven für Adenokarzinompatienten mit und ohne neoadjuvante Therapie 100 90 kumulatives Überleben [%] 80 70 Adeno-Ca 60 Neoad. Therapie 50 nein 40 Neoad. Therapie nein; zensiert 30 Neoad. Therapie 20 ja 10 Neoad. Therapie ja; zensiert 0 0 1 2 3 4 5 6 7 8 9 10 11 postoperatives Überleben [Jahre]; n=31 12 13 14 76 Die Kategorien der pTNM- und R-Klassifikation gelten in bezug auf das Langzeitüberleben allgemein als die wichtigsten prädiktiven Parameter [Tabelle 47]. In diesem Kollektiv kam dem Lymphknotenbefall mit p< 0,0001 die größte Bedeutung zu. Die entsprechenden Überlebenskurven zeigt Abbildung 12. Tabelle 47: Betrachtete Patientengruppen n= zensiert ≤ pT2 > pT2 pN0 pN+ pM0 pM+ R0 R+ 74 57 67 64 119 12 122 9 28 7 29 6 35 0 35 0 Mittleres Überleben [Jahre] 4,75 2,27 5,31 1,92 4,11 0,92 4,02 1,02 Median [Jahre] 3,08 0,95 3,69 0,81 1,50 0,62 1,41 0,86 5-JahresÜberleben [%] 33,35 12,18 39,60 08,53 26,99 00,00 26,36 00,00 Logrank -Test p= 0,0012 p< 0,0001 p= 0,0031 p= 0,0125 Abbildung 12: Kaplan-Meier-Kurven für Patientengruppen mit pN0 und pN+ 100 Kumulatives Überleben [%] 90 80 70 60 pN 0 / + 50 pN+ 40 pN+ 30 zensiert 20 pN0 10 pN0 0 zensiert 0 1 2 3 4 5 6 7 8 9 10 11 postoperatives Überleben [Jahre]; n=131 12 13 14 77 Die positive Ausprägung der folgenden präoperativen Parameter ging unabhängig voneinander mit einer signifikant höheren Lebenserwartung einher, als in der entsprechenden Vergleichsgruppe [Tabelle 48]. Dem gegenüber gab es zwischen den Patienten unter 70 Jahren und den älteren keinen relevanten Unterschied. Umgekehrt zeigt Tabelle 49 den signifikant negativen Einfluss des Auftretens bestimmter perioperativer Komplikationen auf das Langzeitüberleben. Die Gegenüberstellung der Logrank-Test-Resultate mit und ohne Berücksichtigung der perioperativ Verstorbenen zeigt allerdings, dass nach überlebtem perioperativem Verlauf die wenigsten dieser Faktoren ihre prädiktive Bedeutung behalten. Tabelle 48: Präoperativer Parameter Logranktests bezüglich des Gesamtkollektiv (n= 131) Karnofky-Index gruppiert ≥ 80 Alle Lungenfunkt.-Parameter unauffällig: ja Vitalkapazität unauffällig: ja PaO2 unauffällig: ja Kardiales Risiko für OP erhöht: nein Raucheranamnese positiv: nein Alter < 70 Jahre p= 0,0019 p= 0,0194 p= 0,0041 p= 0,0401 p= 0,0037 p= 0,0368 p= 0,7266 Logranktests bezüglich der Gruppe der periop. Überlebenden (n= 115) p= 0,184 p= 0,007 p= 0,2633 p= 0,0529 p= 0,013 p= 0,007 p= 0,2555 Tabelle 49: Perioperative Komplikationen Logranktests bezüglich des Gesamtkollektiv (n= 131) Pulmonale Komplikationen gesamt: ja Pneumonie: ja ARDS: ja Pleuraerguss: ja Kardiale Komplikationen gesamt: ja Chirurgische Komplikationen: ja Wundinfekt: ja Interponatsnekrose: ja Renale Komplikationen gesamt: ja Sepsis: ja MOV: ja p= 0,0420 p= 0,0414 p= 0,0130 p= 0,0275 p< 0,0001 p= 0,9409 p= 0,0071 p= 0,0010 p< 0,0001 p< 0,0001 p< 0,0001 Logranktests bezüglich der Gruppe der periop. Überlebenden (n= 115) p= 0,080 p= 0,206 p= 0,742 p= 0,229 p= 0,067 p= 0,6923 p= 0,005 p= 0,014 p= 0,123 p= 0,087 - 78 Das Langzeitüberleben für die Gruppen der perioperativen Risikoeinteilung nach Bartels et al. ist in Tabelle 50 dargestellt. Patienten mit niedrigem perioperativem Risiko waren den übrigen auch bezüglich der Langzeitprognose klar überlegen. Umgekehrt verstarben Hochrisikopatienten im Durchschnitt deutlich früh als jene mit elf bis 22 Score-Punkten. Der Vorteil der Personen mit moderat erhöhtem Risiko gegenüber der Hochrisikogruppe war nicht signifikant. Tabelle 50: Betrachtete Patientengruppen n= zensiert Bartels-Score: 11-15 Punkte Bartels-Score: 16-33 Punkte Bartels-Score: 16-21 Punkte Bartels-Score: 22-33 Punkte Bartels-Score: 22-33 Punkte Bartels-Score: 11-21 Punkte 65 65 55 10 10 120 26 9 9 0 0 35 Mittleres Überleben [Jahre] 2,54 2,66 2,95 1,21 1,21 4,06 Median [Jahre] 2,22 1,15 1,15 0,75 0,75 1,41 5-Jahres- Logrank Überleben -Test [%] 35,81 p= 0,0029 14,36 p= 17,25 0,2575 0 0 p= 0,0389 26,93 79 4. Diskussion 4.1. Methodenkritik und Einschätzung des Wertes der ermittelten Daten Die Aussagekraft retrospektiv generierter Daten und ihrer Analyse ist gegenüber einer prospektiven Studie mit vergleichbarer Fragestellung nach den heute üblichen Kriterien zur Einschätzung der Evidenz bekanntermaßen deutlich eingeschränkt [31]. Dies gilt natürlich auch für die vorliegende Arbeit. Aus dem retrospektiven Ansatz ergeben sich eine Reihe von Fehlerquellen, die auch bei sorgfältigstem Vorgehen nur schwer zu minimieren sind: Die Protokolle zur präoperativen Diagnostik und neoadjuvanten Therapie, der operative Eingriff selbst, sowie die postoperative Versorgung wurden im klinischen Alltag nicht mit der Intention geplant und durchgeführt um später als Grundlage einer Studie zu dienen. Diagnostische wie therapeutische Maßnahmen und ihre Dokumentation erfolgten somit nur bedingt standardisiert, ein Problem, das durch den langen Beobachtungszeitraum von elf Jahren und die große Zahl von etwa 80 erhobenen Parametern noch deutlich verstärkt wird, besonders in bezug auf die Erhebung der Begleiterkrankungen und der perioperativen Komplikationen. Hier zählten die genannten Diagnosen im Wortlaut der Krankenakte. Dabei ist im nachhinein nicht mehr sicherzustellen, dass einer genannten Diagnose stets gleiche Kriterien zu Grunde lagen und auch nicht, dass die Vor- und Begleiterkrankungen und der perioperative Verlauf mit Nennung aller stattgehabten Komplikationen wirklich vollständig dokumentiert wurden. Das Problem verschärft sich nochmals bezüglich der Gegenüberstellung der Daten mit jenen der Vergleichsliteratur: welche perioperativen Komplikationen dort als relevant aufgeführt werden und welche Kriterien ihrer Diagnose zugrunde liegen bleibt in den betreffenden Publikationen meist ungenannt. Der Grad der sich daraus ergebenden Unregelmäßigkeiten lässt sich kaum adäquat einschätzen und muss deshalb potentiell als sehr groß veranschlagt werden. Hinzu kommt noch die Unvollständigkeit einzelner Datensätzen (siehe 2.2., Seite 38), sowie der Umstand, dass für diese Arbeit die Einschätzung von Karnofsky-Index, Compliance und kardiologischem Risiko in einigen Fällen erst nachträglich durch sorgfältige Auswertung der verfügbaren Arztbriefe, Diagnosen und Vorbefunden erfolgte. Dennoch darf der retrospektive Ansatz dieser Arbeit angesichts der relativen Seltenheit des Ösophaguskarzinoms als gerechtfertigt gelten. Allerdings können die Ergebnisse letztlich nur dazu dienen einen orientierenden Überblick zu gewinnen, aus dem sich neue Hypothesen generieren lassen. Diese zu prüfen bleibt in jedem Fall Aufgabe prospektiver Studien. 80 Im folgenden werden die unter 3.1. bis 3.5. dargestellten Resultate mit jenen anderer Autoren verglichen. Neun Arbeiten beschäftigen sich schwerpunktmäßig mit dem postoperativen Verlauf nach Ösophagusresektion: Law et al. 2004 [83] und Bailey et al. 2003 [13] prospektiv, Swanson et al. 2001 [130], Atkins et al. 2004 [11] und Karl et al. 2000 [69] retrospektiv. Avendano et al. 2002 [12] und Ferguson et al. 2002 [42] setzen sich in ihren ebenfalls retrospektiven Analysen vor allem mit den gleichermaßen häufigen wie bedrohlichen pulmonalen Komplikationen auseinander. Bei der prospektiven Studie von Doty et al. 2002 [33] steht die Betrachtung des Einflusses der neoadjuvanten Therapie im Vordergrund. Die in ihrem zweiten Teil prospektive Arbeit von Konopke et al. 2003 [75] befasst sich als einzige dieser Publikationen ebenfalls mit der Analyse des von Bartels et al. 1997/2000 [17,18] publizierten Scores und steht bezüglich der direkten Vergleichbarkeit der Angaben der vorliegenden Untersuchung in vielen Punkten am nächsten. Hagen et al. 2001 [57], Altorki et al. 2001 [3], Collard et al. 2001 [27,28] und Dresner et al. 2000 [34] beschäftigen sich retrospektiv vor allem mit dem Langzeitüberleben nach En-blocResektion. Die große Multicenterstudie des Medical Research Council 2002 [94] vergleicht die Langzeitergebnisse nach präoperativer Chemotherapie mit denen nach rein chirurgischer Intervention. 4.2. Allgemeinen Angaben Einen Überblick zur Größe des jeweiligen Untersuchungskollektivs, zu Beobachtungszeitraum, Alter, Geschlecht, Histologie und dem präoperativen Therapiemodus gibt Tabelle 51 (Seite 81). Der Beobachtungszeitraum überschneidet sich in allen Publikationen deutlich; die Mehrzahl von ihnen ist retrospektiv. Bei Patientenzahlen zwischen 96 [12] und 1777 [13] liegt die vorliegende Arbeit mit 131 Patienten im unteren Drittel. Durchschnittsalter bzw. Median des Patientenalters schwankt in engem Rahmen um das 60. Lebensjahr. Beim Geschlechterverhältnis gab es dagegen erhebliche Unterschiede: war in einigen Arbeiten mehr als jeder dritte Patient weiblichen Geschlechts [12,34,94], lag der Frauenanteil bei Konopke et al. [75] unter 10% und in der umfangreichen Studie von Bailey et al. sogar unter 1% [13]. 81 Tabelle 51: Synopse der Rahmendaten der berücksichtigten Studien Studie Uni Freiburg Konopke et al. [75] Bartels et al. [18] Law et al. [83] MRC [94]*** Bailey et al. [13]+ Doty et al. [33] Atkins et al. [11]++ Swanson et al. [130] Avendano et al. [12] +++ Karl et al. [69] Ferguson et al. [42] Collard et al. [27] Collard et al. [28] Hagen et al. [57] Altorki et al. [3] Dresner et al. [34] * Beobachtungs- Patientenzeitraum alter [Jahre] 01/91-01/03 Median: 60 131 retrospektiv Mittel:58,7 ♂:♀ Histologie: Neoad. SCC/A/sonst. Therapie [%] [%] 4,2:1 65,6/32,1/2,3 RxCx: 73,3 n= 181 10/93-12/02* 876 07/82-10/97** Mittel: 57,5 421 802 1777 120 379 342 96 143 292 183 324 100 111 176 01/90-12/01 prospektiv 03/92-06/98 prospektiv 01/91-12/01 prospektiv 01/89-12/98 prospektiv 01/96-12/02 retrospektiv 03/89-07/00 retrospektiv 01/94-10/00 retrospektiv 01/89-03/99 retrospektiv 01/80-12/00 retrospektiv 11/84-01/00 retrospektiv 10/84-01/97 retrospektiv 01/82-11/00 retrospektiv 01/88-12/98 retrospektiv 04/90-12/99 retrospektiv Median: 62 10,4 :1 6,3:1 nicht durchgeführt keine keine Angabe Angabe Cx: 14,5 keine Angabe RxCx: 19,5 52,5/46,8/0,7 Mittel: 63,4 4,8:1 Median: 63 3:1 Mittel: 63,4 110:1 keine Angabe Mittel: 58 7,6:1 18,5/60,1/21,4 RxCx:100 Mittel: 60,3 4,3:1 23/75/2 Cx:44 Mittel: 62,7 4,8:1 31/68/1 Cx:81 Mittel: 62,1 3,1:1 35/60,7/4,3 Median: 65 Mittel: 63,7 7,9:1 11,2/80,4/8,4 RxCx:19,6 Mittel: 60,1 3,8:1 34,5/64,1/1,4 Mittel: 63,6 4,4:1 0/100/0 Zwischen 33 und 85 3,3:1 50/48,5/1,5 Median: 57 8,1:1 0/100/0 nicht durchgeführt Median: 60 3,6:1 27/73/0 Cx:10 Median: 64 2,5:1 35,8/64,2/0 30,8/66,4/2,6 Cx: 46 keine Angabe Cx:15,6 RxCx:20,8 Cx:26,4 Rx:13,4 keine Angabe Cx:19,7 nicht durchgeführt 10/93-12/98 retrospektiv ; 01/99-12/02 prospektiv; die Angaben schließen 38 nicht operierte Patienten ein. ** 07/82-12/91 retrospektiv; 01/92-10/97 prospektiv. *** Medical Research Council Oesophageal Cancer Working Party; an d. Studie beteiligten sich 42 europäische Zentren; die Angaben schließen 55 nicht operierte Patienten ein. + Kohortenstudie an 109 Kliniken; nur 84,9% der Tumoren waren Malignome. ++ Die Angaben schließen 75 Patienten ein, die nicht wegen eines Malignoms operiert wurden. +++ Die meisten Angaben beziehen sich auf 61 Patienten mit vollständigem Datensatz. 82 In zwei Studien wurden lediglich Patienten mit Adenokarzinom behandelt [27,57]. Auch sonst überwog dieser histologische Typ in den meisten Arbeiten deutlich. Nur im Freiburger Datenmaterial und bei Konopke et al. [75] waren die Tumoren mit 65,6% bzw. 52,5% mehrheitlich Plattenepithelkarzinome. Lediglich in einer Studie wurden alle Patienten neoadjuvant behandelt [33]. Die Chirurgische Uniklinik Freiburg lag hier mit 73% an zweiter Stelle, die übrigen folgen mit weitem Abstand. In drei der Studien [34,57,75] wurden keine vorbehandelten Patienten berücksichtigt, in vier der Arbeiten fehlen diesbezügliche Angaben [11,13,18,27]. 4.3. Lebensgewohnheiten und Begleiterkrankungen Angaben zu Lebensgewohnheiten und Komorbidität fehlen in den meisten der genannten Publikationen. Einen Überblick über die verfügbaren Daten gibt Tabelle 52. Tabelle 52: Angegebene Begleiterkrankungen [%]* Begleiterkrankungen Keine 1-3 >3 Kardiale Pulmonale Diabetes mellitus Renale Dysfunktion Hepatische Dysfunktion Gewichtsverlust > 10% Hypertonus Alkoholanamnese Raucheranamnese Uni Freiburg 16 75,6 8,4 27,4 29,8 6,9 3,1 5,3 40,4 45,8 80,9 79,4 Konopke et al. [ 75] 37 61,9 1,1 42,5 26 18,2 2,8 nicht gewertet - Bailey et al.[13] 22,6** 12,6 0,6 32 19,6*** 44,8*** Ferguson et al. [42] 9 32,3 74 79,9 Karl et al. [69] 10,5 28 82,5 84,6 Die höchste und die niedrigste Angabe sind jeweils fett gedruckt. „ - “ bedeutet: keine Angaben verfügbar. * Innerhalb eines Kollektivs sind selbstverständlich Mehrfachnennungen möglich. ** gewertet wurde nur COPD *** in den letzten zwei Wochen vor der Operation Der Anteil der Patienten mit mindestens einer Begleiterkrankung lag im Freiburger Untersuchungskollektiv mit 84% im Vergleich zu Konopke et al. [75] (63%) deutlich höher. Dies ist zum Teil auf den Umstand zurückzuführen, dass bei der retrospektiven Auswertung der Freiburger Krankenakten jeder aktuelle präoperative pathologische Befund als Begleiterkrankung gewertet wurde, so zum Beispiel auch die Diagnose „essentielle Hypertonie“. 83 Patienten mit einem Gewichtsverlust >10% waren mit 40,3% häufiger als bei Bailey et al. [13] (32%) und Karl et al. [69] (28%). Die Angaben zum regelmäßigen Alkoholkonsum und zum Nikotinabusus lagen dagegen allgemein in einer ähnlichen Größenordnung. 4.4. Angaben zum operativen Vorgehen Einige Arbeiten befassen sich ausschließlich mit der En-bloc-Resektion mit 2-FeldLymphadenektomie [57,69,3,34]. Auch sonst war der transthorakale Zugang derjenige, welcher in Abhängigkeit von der jeweiligen Tumorlokalisation deutlich häufiger gewählt wurde. Eine Ausnahme machen Doty et al. [33]. Zur Rekonstruktion der Speisepassage bevorzugten die meisten Teams standardmäßig die Schlauchmagenbildung. Kolon- und Jejunalinterponat hatten in der Regel einen gemeinsamen Anteil von < 10%. Lediglich Collard et al. [27] und Hagen et al. [57] verwendeten Koloninterponate mit 29% bzw. 72% ohne nähere Angabe von Gründen deutlich häufiger. Insbesondere bei distaler Tumorlokalisation wählten Konopke et al. [75], Law et al. [83] und Collard et al. [27] häufig eine intrathorakale Anastomosierung. An der Universitätsklinik Freiburg und bei Swanson et al. [130] wurde die Anastomose regelhaft zervikal angelegt. Bezüglich der Operationsdauer (von Schnitt bis Naht) lagen Karl et al. [69] mit einem Mittelwert von 327 Minuten und einem Median von 315 Minuten deutlich besser als die Freiburger Chirurgen mit 469 bzw. 480 Minuten, obwohl diese Autoren nur transthorakal operierten. Eine Übersicht zu den operationsbezogenen Angaben gibt Tabelle 53 (Seite 84). 84 Tabelle 53: Angaben zur Operation Studie Uni Freiburg Konopke et al. [75] Bartels et al. [18] Law et al. [83] MRC[94] Bailey et al. [13] Doty et al. [33] Atkins et al. [11] Swanson et al.[130] Avendano et al. [12] Karl et al. [69] Ferguson et al. [42] Collard et al. [27] Collard et al. [28] Hagen et al. [57] Altorki et al. [3] Dresner et al. [34] Anastomose: Interponat: OP-Dauer Resektionsverfahren: [%] [%] [min] [%] Transthor./hiatal./sonst. zervikal/thorakal Magen/Kolon/Jejunum Mittel: 469 84,7 / 15,3 / 0 100 / 0 96,3 / 3 / 0 Median:480 keine 84,7 / 15,3 / 0 16,8 / 83,2 92,3 / 7,7 / 0 Angabe keine keine Angabe 93,3 / 16,7 88,7 / 12,3 / 0 Angabe keine 83,1 / 9,3 / 7,6 37,1 / 62,9 96 / 3,3 / 0,7 Angabe keine Angabe keine Angabe 22 / 76 / 2 keine Angabe 47,2 / 34,3 / 18,5 keine Angabe 73,1 / ? / ? 100 / 0 100 / 0 / 0 keine Angabe keine Angabe 100 / 0 / 0 keine Angabe 71,9 / 25,3 / 2,7 88,5 / 11,5 / 0 keine Angabe 56,3 / 43,7 88 / 12 / 0 66,7 / 29 / 4,3 keine Angaben keine Angabe 100 / 0 / 0 100 / 0 28 / 72 / 0 100 / 0 / 0 91,8 / 9,2 91,8 / 9,2 / 0 100 / 0 / 0 Mittel: 327 Median:315 keine Angabe keine Angabe keine Angabe 85 4.5. Angaben zur Tumorlokalisation und zur postoperativen Pathologie Die distale Tumorlokalisation war im Mittel deutlich häufiger. Zum einen weil sich Tumoren im oberen und mittleren Drittel der Speiseröhre in fortgeschrittenem Stadium meist nicht mehr mit kurativer Intension operieren lassen [120], zum anderen, weil in den meisten Studien der Anteil der Adenokarzinome überwog, die meist im distalen Ösophagus lokalisiert sind [132]. Einen Überblick zur Lokalisation, zur Verteilung der pathologischen UICC-Stadien und zum erreichten Resektionsgrad gibt Tabelle 54. Tabelle 54: Tumorlokalisation und postoperative Pathologie Studie Uni Freiburg Konopke et al. [75] Bartels et al. [18] Law et al. [83] MRC [94] Bailey et al. [13] Doty et al. [33] Atkins et al. [11] Swanson et al. [130] Avendano et al. [12] Karl et al. [69] Ferguson et al. [42] Collard et al. [27] Collard et al. [28] Hagen et al. [57] Altorki et al. [3] Dresner et al. [34] Tumorlokalisation: oben /Mitte/unten [%] 6,9 / 32,8 / 58,8 14,7 / 25,2 / 59,4 R0/ R1 / R2 UICC-Stadium nach OP [%] 0 I IIA II B III IVA IVB [%] 93,1 / 3,1 / 16,8 5,3 26,7 15,3 26,7 2,3 6,9 3,8 90,2 / 8,4 / 0 0,7 21 27,3 21,7 26,5 2,8 1,4 keine Angaben keine Angabe 6,2 6,7 28,3 3,6 40,9 1 / 25 / 74 69,6 (R0) / 30,4 (R1/2) 12,4 keine Angabe 57 / 17 / 11 keine Angabe keine Angabe keine Angabe 22,1 57,7 18,8 5,1 keine Angabe 93 / 5 / 2 4 / 18 / 78 25,2 13,4 28,1 12,6 20,6 0 keine Angabe 19,7 13,1 14,8 14,8 26,2 11,5 keine Angabe 9,8 13,3 21,7 16 31,5 7,7 keine Angabe 18,1 32,2 39 7,9 32 18 keine Angabe keine Angabe keine Angabe keine Angabe keine Angabe keine Angabe 0 4,5 / 15,3 / 80,2 0 0 / 29,5 / 70,5 26 11 13 20,7 18 9 31,5 20,7 keine Angabe 0 keine Angabe keine Angabe 86 4.6. Perioperativer Verlauf und Langzeitüberleben Perioperative Morbidität: Zehn der Publikationen machen in verschieden umfangreicher Weise Angaben zur perioperativen Morbidität. Alle Autoren betonen die besondere Häufigkeit pulmonaler Komplikationen. Dabei wird dem Auftreten von Pneumonien stets die größte klinische Bedeutung zugesprochen. Die Gruppe der chirurgischen Komplikationen steht allgemein an zweiter Stelle. Sofern detaillierte Angaben gemacht wurden, spielte hier die Anastomoseninsuffizienz die wichtigste Rolle [3,11,75,69,83]. Einen Überblick bezüglich der Gesamtmorbidität und der Verteilung der Komplikationen auf die einzelnen Organsysteme gibt die folgende Tabelle: Tabelle 55: Übersicht zum Auftreten perioperativer Komplikationen Komplikationen [%] Anteil der Patienten mit Komplikationen pulmonale kardiale chirurgische hepatische Nierenversagen Apoplex Sepsis Multiorganversagen Freiburg 85,5 Kono. Law [75] [83] 63 - Bailey Atkins Swan. Aven. Karl [13] [11] [130] [12] [69] 49,5 50 29 Doty [42] 36,7 Hagen Altor. [57] [3] 71 49 64,1 20,6 54,2 1,5 2,3 0,8 9,9 5,3 18,2* 8,2 33,6 0 0,7 2,8 2,8 21,4+ 14,3 4,9 0,3 9,5 - 0,8 30* 22 1 1 2 - 15,9* 22,8 16,6 0,2 1 0,2 - 15,8+ 15,3 0,8 5,5 - 5,2+ 0,4 - 30** - 7,7+ 14 - 27* 11,7 0,9 0,9 - Die höchste und die niedrigste Angabe sind jeweils fett gedruckt. „ - “ bedeutet: keine Angaben verfügbar. * berücksichtigt Atelektasen, Pneumonien, respiratorische Insuffizienz, ARDS ** Pleuraergüsse, Atelektasen, Chylothorax, Pneumonien, respiratorische Insuffizienz, Lungenembolie + nur Pneumonien Mit 85,5% war der Anteil jener Patienten, die im postoperativen Verlauf mit mindestens einer Komplikation konfrontiert waren im Freiburger Untersuchungskollektiv mit Abstand am höchsten. Besonders pulmonale und chirurgische Komplikationen waren mit 64,1% bzw. 54,2% deutlich häufiger als die Angaben in der Vergleichsliteratur. Eine mögliche Erklärung wäre unter anderem der umfangreiche Einsatz neoadjuvanter Therapie. Zwar ließ sich ein signifikanter Zusammenhang zum generellen Auftreten erhöhter Morbidität nicht belegen (p= 0,586), aber unter den vortherapierten Patienten war der Anteil chirurgischer Komplikationen deutlich größer (p= 0,017). Dies entspricht in gewisser Hinsicht 87 den Beobachtungen von Meneu-Diaz et al. 2000 [95]. Auch dort zeigte sich nach einem vergleichbaren präoperativen Radiochemotherapieprotokoll eine Gesamtmorbidität von 87,5%. Allerdings schien hier die Zunahme pulmonaler Komplikationen die bedeutendere Rolle zu spielen. Diesbezüglich ließ sich im Freiburger Kollektiv aber kein signifikanter Zusammenhang erkennen (p= 0,840). Von den beiden oben genannten Publikationen, die sich dezidiert mit den Ergebnissen nach neoadjuvanter Therapie auseinandersetzen, konnten Doty et al. [33] eine Zunahme der Gesamtmorbidität nicht bestätigen, verweisen allerdings ebenfalls auf die widersprüchlichen Aussagen in anderen Veröffentlichungen [1,22,62,71,72,86,136,143,147]. Aus der großen Multicenterstudie des MRC [94] liegen zu diesem Punkt leider keine detaillierten Angaben vor. Einen weiteren Grund für die vergleichsweise hohen Angaben zur Gesamtmorbidität im Freiburger Untersuchungskollektiv stellen zu einem gewissen Teil sicherlich auch die unterschiedlichen Erhebungskriterien dar: Die retrospektive Analyse der Freiburger Krankenakten berücksichtigte jeden genannten pathologischen Befund in der Zeit des postoperativen stationären Aufenthalts. Dagegen beschränken sich die Aussagen der anderen Autoren offenbar in der Regel auf jene Komplikationen, die ihnen für den klinischen Verlauf als wesentlich erschienen, allerdings ohne dabei genaue Auswahlkriterien anzugeben. So gingen beispielsweise in der vorliegenden Arbeit in die Kategorie „pulmonale Komplikationen“ auch jene zahlreichen Fälle ein, in denen ein punktionswürdiger Pleuraerguss auftrat (bei 37,4% der Patienten); diese wurden sonst nur noch von Hagen et al. [57] und Avendano et al. [12] namentlich erwähnt (9% bzw. 86,9%), die sie aber offenbar nicht zu der von ihnen verwendeten Kategorie „significant pulmonary complications“ zählten. Unter den kardialen Komplikationen sind transiente artriale Arrhythmien wahrscheinlich allgemein die häufigsten. Da sie meist aber keine unmittelbare Bedrohung für den Patienten darstellen, wurden sie von verschieden Autoren gar nicht berücksichtigt [Tabelle 58, Seite 88]. Letztlich bleiben aber auch die jeweils verwendeten Kriterien für häufig genannte wichtige klinischer Ereignisse wie Pneumonien oder einzelne chirurgische Komplikationen unscharf, zumal es sich bei der Mehrheit der genannten Publikationen ebenfalls um retrospektive Studien handelt. Trotz der begrenzten Vergleichbarkeit erscheint es sinnvoll, die vorhandenen Angaben bezüglich der Häufigkeit einzelner Komplikationen zur orientierenden Übersicht einander gegenüberzustellen (Tabelle 56-59; Seite 88-89). 88 Tabelle 56: Pulmonale Komplikationen Komplikationen [%] Pneumonien Punkt. Pleuraerguss Pleuraempyem ARDS Atelektasen Tracheotomie Lobärkollaps Freiburg 43,5 37,4 3,8 6,9 19,1 - Kono. [75] 8,4 2,8 3,5 - Law [83] 23 - Bailey [13] 21,4 - Atkins Swan. Aven. [11] [130] [12] 15,8 32,8 5 86,9 10,6 1 1 9,8 - Karl [69] 7,6 - Doty [33] 2,5 3,3 - Hagen [57] 19 9 7 - Altor. [3] 7,2 9 8,1 Tabelle 57: Chirurgische Komplikationen Komplikationen [%] Rekurrensparese Anastomoseninsuffizienz Wundinfekt Magenausgangsstenose Chylothorax Interponatsnekrose Blutung Bronchialleck Trachealleck collare Fistel mediastinale Fistel Tracheoösophag. Fistel Pankreas- Fistel Platzbauch Enterothorax Akzessoriusläsion Hämatoperineum Fasziendehiszens Revisions-OP Freiburg 29,8 15,3 13,7 7,6 5,3 2,3 1,5 0,8 0,8 0,8 0,8 0,8 0,8 0,8 0,8 0,8 19,1 Kono. [75] 9,1 12,6 4,9 0,7 1,4 3,5 Law [83] 10,9 3,1 1,2 0,7 0,5 - Bailey [13] 14,6 0,8 - Atkins [11] 2,1 14 11,9 25,1 0,8 0,8 - Swan. [130] 14 8,8 2 0,8 - Karl [69] 3,5 2,8 1,4 - Doty [33] 3,3 6,7 1,7 - Hagen [57] 2 10 1 6 6 1 - Altor. [3] 3,6 9 1,8 1,8 4,5 - Tabelle 58: Kardiale Komplikationen Komplikationen [%] Rhythmusstörungen Insuffizienz Ischämie/ Infarkt Perikarditis Perikarderguss Freiburg 13 3,8 2,3 0,8 0,8 Kono. [75] 4,9 1,4 1,4 - Law [83] 20,4 1,4 1 - Bailey [13] 7,6 1,2 - Atkins [11] 13,7 1,1 0,5 Karl [69] 13,3 - Doty [33] 7,5 0,8 - Hagen [57] 6 1 - Altor. [3] 9 0,9 1,8 - Die höchste und die niedrigste Angabe sind jeweils fett gedruckt. „ - “ bedeutet: keine Angaben verfügbar. 89 Tabelle 59: Weitere Komplikationen Komplikationen [%] Schmerzsyndrome Harnwegsinfekt Transiente Parese Elektrolytentgleisung Gerinnungsstörung V. Subclavia-Thrombose Epididymitis Leukopenie Decubitus Retrobulbäre Einblutung HIT 1 Reaktivierte Tbc Lokale Hypästesie Ösophagusstenose Ileus Darminfarkt Cholezystitis C. difficile Colitis HOPS Reaktive Depression Tiefe Beinvenenthrombose Lungenembolie Gastrointestinale Blutung Mediastinitis Peritonitis Intraabdominaler Abszess Freiburg 2,3 1,5 1,5 0,8 0,8 0,8 0,8 0,8 0,8 0,8 0,8 0,8 0,8 2,3 0,8 0,8 0,8 3,8 3,8 - Kono. [75] 0,7 0,7 4,2 - Bailey [13] 0,9 0,7 - Atkins [11] 4,2 1,8 1,6 2,4 2,4 1,6 - Swan. [130] 1 0,4 - Karl [69] 0,7 1,4 Doty [33] 0,8 - Hagen [57] 3 5 1 1 13 Altor. [3] 0,9 4,5 0,9 - Die höchste und die niedrigste Angabe sind jeweils fett gedruckt. „ - “ bedeutet: keine Angaben verfügbar. 90 Dauer des stationären Aufenthaltes: Soweit verfügbar gab es auch unter den Angaben der anderen Autoren bezüglich der mittleren Dauer des postoperativen stationären Aufenthaltes mit 13 bis 19 Tagen gewisse Unterschiede. Der Durchschnitt unter den Freiburger Patienten lag mit 33,8 Tagen aber deutlich darüber [Tabelle 60, Seite 91]. Ein wichtiger Grund ist sicherlich die höhere Zahl perioperativer Komplikationen. Wie bereits unter 3.4.1. (Seite 53) dargestellt war der Krankenhausaufenthalt unter den Freiburger Patienten bei jenen ohne therapiepflichtige Komplikationen mit einem Mittelwert von 18,2 Tagen signifikant kürzer als bei den übrigen Personen (p= 0,012). Andere, nichtmedizinische Ursachen liegen vermutlich auch in der unterschiedlichen Organisation der einzelnen nationalen Gesundheitssysteme, die in den angelsächsischen Ländern möglicherweise einen kürzeren stationären Aufenthalt der Patienten begünstigt. Perioperative Letalität: Noch in den 90er Jahren fanden sich bezüglich der perioperativen Letalität in vergleichbaren Publikationen häufig Angaben von über 12% [56,66,99,101] und auch unter den hier diskutierten Arbeiten nennen Ferguson et al. einen Anteil von 13,7%. Dennoch liegt im Freiburger Kollektiv die Krankenhausletalität als die wichtigste Zielgröße im perioperativen Verlauf mit 12,2% im allgemeinen Vergleich sehr hoch [Tabelle 60, Seite 91]. Auch bei isolierter Betrachtung des letzten Drittels des Untersuchungszeitraums von 01/99 bis 01/03 (n= 47) zeigt sich mit einer Krankenhausletalität von 10,5% und einer 30Tage-Letalität von 5,2% nur ein geringfügig besseres Ergebnis. Wie unter 3.4.3. ausführlich dargestellt, führten im überwiegenden Teil der Fälle kardiopulmonale Ursachen zum Tod. Dies entspricht im wesentlichen den Angaben der Vergleichsliteratur [3,11,12,33,42,75,83,130]. Langzeitüberleben: Zwar lag die 5-Jahres-Überlebensrate bei den Freiburger Patienten mit 24,3% noch über den Ergebnissen der großen Multicenterstudie des MRC [94], doch die Resultate von Collard et al. [27,28], Hagen et al. [57], Altorki et al. [3] und Dresner et al. [34] waren mit 31% bis 52,2% deutlich besser (Tabelle 60, Seite 91). 91 Tabelle 60: Studie Uni Freiburg Konopke et al. [75] Bartels et al. [18] Law et al. I [83] ** Law et al. II [83] ** MRC I [94] *** MRC II [94] *** Bailey et al. [13] Doty et al. [33] Atkins et al. [11] Swanson et al. [130] Avendano et al. [12] Karl et al. [69] Ferguson et al. [42] Collard et al. [27] Collard et al. [28] Hagen et al. [57] Altorki et al. [3] Dresner et al. [34] Tage stationär nach OP Mittel: 33,8 Median: 25 Perioperative Letalität [%] 30 d gesamt 5-Jahres-Überleben* Median [%] 9,2 12,2 keine Angabe 4,9 8,4 keine Angabe 6,4 keine Angabe 2,6 7,8 keine Angabe keine Angabe 0 1,1 keine Angabe keine Angabe keine Angabe 16,9 Monate 24,3 keine Angabe keine Angabe 10 16,8 Monate 10 13,3 Monate 21 keine Angabe 9,8 keine Angabe Mittel: 15 0,8 keine Angabe keine Angabe 5,8 keine Angabe Mittel: 13 3,6 3,6 keine Angabe keine Angabe 8,6 keine Angabe 2,1 2,1 keine Angabe keine Angabe 13,7 keine Angabe Mittel: 17,7 Median: 13 Mittel: 13,5 Median: 11 Mittel: 19 keine Angabe 4,3 keine Angabe 35,3 keine Angabe 5 18 Monate 35 keine Angabe 6 keine Angabe > 60 Monate 52,2 keine Angabe 3,6 5,4 38 Monate 40 keine Angabe 2 4 26 Monate 31 * Angaben zum 5-Jahres-Überleben jeweils einschließlich der perioperativen Letalität ** Law et al. I: 01/90-06/95 ; Law et al. II: 07/95-12/01 *** MRC I: Gruppe mit neoadjuvanter Chemotherapie ; MRC II: Gruppe ohne neoadjuvante Therapie 92 4.7. Ergebnisse der retrospektiven Anwendung des Bartels-Scores Im folgenden werden die Ergebnisse aus der retrospektiven Anwendung des Scores auf das Freiburger Datenmaterial den Publikationen von Bartels et al. [17,18] und Konopke et al. [75] gegenübergestellt. 4.7.1. Darstellung der Untersuchungskollektive München: Die Münchner Studie [17,18] erfasst 876 Patienten, die sich im Zeitraum zwischen Juni 1982 und Oktober 1997 wegen eines Adeno- oder Plattenepithelkarzinoms einer Ösophagusresektion unterzogen. Der Eingriff erfolgte stets in kurativer Absicht. Zielgröße der Untersuchung war die 30-Tage-Letalität. Patienten mit einem zervikal lokalisierten Karzinom fanden keine Berücksichtigung. Aussagen zur Häufigkeit der verschiedenen Tumorentitäten, sowie genaue Angaben bezüglich der Wahl des operativen Zugangs und des Einsatz einer neoadjuvanten Therapie liegen nicht vor. Die Rekonstruktion der Speisepassage erfolgte in 777 Fällen durch Bildung eines Schlauchmagens, in 91 Fällen mit einem Koloninterponat; die Anastomosierung wurde in 817 der 876 Fälle im Halsbereich vorgenommen. In der ersten Phase (6/82-12/91) wurden die Daten von 432 Patienten retrospektiv analysiert (377 Männer und 45 Frauen mit einem Durchschnittsalter von 56,7 Jahren). In einer zweiten, prospektiven Phase (1/92-12/93) wurden 121 Patienten (106 Männer und 15 Frauen mit einem Durchschnittsalter von 57,9 Jahren) behandelt. In einer weiteren, dritten Phase (1/94-10/97) kam der Score schließlich prospektiv zur praktischen Anwendung, d.h. man operierte nur noch die 323 Patienten mit niedrigem oder moderat erhöhtem Risiko (265 Männer und 58 Frauen mit einem Durchschnittsalter von 58,4 Jahren). Die 27 Patienten der Hochrisikogruppe erhielten von vornherein eine palliative Therapie. Dresden: Eine Arbeitsgruppe an der Technischen Universität Dresden um R. Konopke veröffentlichte nach retrospektiver (10/93-12/98; n= 69) und prospektiver (1/99-12/02; n= 74) Anwendung des Scores eigene Ergebnisse [75]. Bei den insgesamt 143 Patienten, die hier unter kurativer Zielsetzung operiert wurden, erfolgte der Eingriff in 96 Fällen transthorakal mit hoch intrathorakaler Anastomose, in 24 Fällen transthorakal mit zervikaler Anastomose und in 23 Fällen transhiatal. 132 mal wurde ein Mageninterponat verwendet, 11 mal ein 93 Koloninterponat. Die Angaben zur Histologie und zur Alters- und Geschlechtsverteilung sind Tabelle 51 (Seite 81) zu entnehmen. Keine der Personen wurde zuvor neoadjuvant behandelt. Freiburg: Bei der retrospektiven Anwendung des Scores konnten 130 Patienten berücksichtigt werden, welche zwischen Januar 1991 und Januar 2003 operiert wurden (105 Männer und 25 Frauen im Durchschnittsalter von 58,6 Jahren). Dabei handelte es sich 86 mal um ein Plattenepithelkarzinom, 42 mal um ein Adenokarzinom und zweimal um ein undifferenziertes Karzinom. In einem der Fälle betraf der Tumorbefall den zervikalen Ösophagus, sonst die thorakalen Abschnitte bzw. den gastroösophagealen Übergang (Typ I nach Siewert). Bei 128 Patienten erfolgte die Ösophagusresektion in kurativer Absicht, bei zwei Patienten musste zum Operationszeitpunkt bereits von einem T4-Tumor beziehungsweise von einer Fernmetastasierung ausgegangen werden. In Abhängigkeit von Tumorgröße, Tumorlokalisation, dem Grad des präoperativ vermuteten Lymphknotenbefalls und der körperlichen Verfassung des Patienten erfolgte der Eingriff in 111 Fällen transthorakal und in 19 Fällen transhiatal. Zur Wiederherstellung der Speisepassage wurde in 125 Fällen ein Schlauchmageninterponat und in vier Fällen ein Koloninterponat verwendet, in einem Fall wurde die Kontinuität vorläufig nicht wiederhergestellt. 95 Patienten erhielten vor dem Eingriff eine neoadjuvante Radiochemotherapie, 35 Patienten wurden aus unterschiedlichen Gründen direkt operiert. 4.7.2. Abweichungen von den Maßgaben des Scores Der von Bartels et al. zur Objektivierung der Leberfunktion favorisierte Aminopyrin-Atemtest stand an den Kliniken in Dresden und Freiburg nicht zur Verfügung. In bezug auf das Freiburger Datenmaterial wurde die hepatische Funktion dann als eingeschränkt bewertet, wenn einer der erfassten Leber-bezogenen Parameter Quick, PTT, Gesamtbilirubin, GOT, GPT, GGT präoperativ außerhalb des Referenzbereiches lag. Konopke et al. verfuhren in gleicher Weise unter Berücksichtigung der Parameter Serumalbumin, Gesamtbilirubin und Quick. 94 4.7.3. Perioperativen Letalität in den drei Untersuchungskollektiven Unter den berücksichtigten 130 Freiburger Patienten lag die Krankenhausletalität mit 12,3% unter den Angaben zu Phase I und II der Studie von Bartels et al. von 15,3% bzw. 12,4%; bezüglich der 30-Tage-Letalität war nur die Sterblichkeit in Phase I der Münchner Studie mit 9,9% noch höher als unter den Freiburger Patienten mit 9,2%. Alle weiteren verfügbaren Resultate waren deutlich besser als die entsprechenden Freiburger Zahlen [Tabelle 61]. Tabelle 61: Studie Uni Freiburg Bartels et al. gesamt [18] Bartels et al. I [18] Bartels et al. II [18] Bartels et al. III [18] Konopke et al. gesamt [72] Konopke et al. I [75] Konopke et al. II [75] Beobachtungszeitraum 01/91 - 01/03 n= 30-TageLetalität absolut [%] absolut [%] retrospektiv 130 16 12,3 12 9,2 06/82 - 10/97 876 06/82 - 12/91 01/92 - 12/93 01/94 - 10/97 Klinikletalität - - 56 6,4 retrospektiv 432 prospektiv 121 prospektiv 323 66 15* ** 15,3 12,4* ** 43 9 4 9,9 7,4 1,2 10/93 - 12/02 143 12 8,4 7 4,9 10/93 - 12/98 01/99 - 12/02 retrospektiv 69 prospektiv 74 - - 4 3 5,8 4,0 „ - “ bedeutet: keine Angaben verfügbar * 90d-Letalität [17]. ** Von 1/94-12/96 betrug die 90d-Letalität 5,1%, die 30d-Letalität 1,6% (13 bzw. 4 von 252 Patienten) [17]. 4.7.4. Perioperative Letalität innerhalb der einzelnen Risikogruppen Bezüglich der Einteilung der jeweiligen Patienten in die drei von Bartels et al. postulierten Risikogruppen sind die verfügbaren Angaben zur perioperativen Letalität aus Tabelle 62 bis 64 (Seite 94-95) zu entnehmen: Tabelle 62: Patienten mit geringem Risiko Studie Beobachtungszeitraum Uni Freiburg Bartels et al. I [18] Bartels et al. II [18] Bartels et al. III [18] Konopke et al. I [75] Konopke et al. II [75] 01/91 - 01/03 06/82 - 12/91 01/92 - 12/93 01/94 - 10/97 10/93 - 12/98 01/99 - 12/02 „ - “ bedeutet: keine Angaben verfügbar n= 30-TageLetalität absolut [%] absolut [%] retrospektiv 65 3 4,6 1 1,5 retrospektiv 194 8 4,1 prospektiv 46 1 2,2 prospektiv retrospektiv 41 1 2,4 prospektiv 43 1 2,3 Klinikletalität 95 Tabelle 63: Patienten mit moderat erhöhtem Risiko Studie Beobachtungszeitraum Uni Freiburg Bartels et al. I [18] Bartels et al. II [18] Bartels et al. III [18] Konopke et al. I [75] Konopke et al. II [75] 01/91 - 01/03 06/82 - 12/91 01/92 - 12/93 01/94 - 10/97 10/93 - 12/98 01/99 - 12/02 30-TageLetalität absolut [%] absolut [%] retrospektiv 55 11 20 10 18,2 retrospektiv 166 15 9 prospektiv 55 3 5,4 prospektiv retrospektiv 27 2 7,4 prospektiv 31 2 6,4 n= Klinikletalität „ - “ bedeutet: keine Angaben verfügbar Tabelle 64: Patienten mit hohem Risiko Studie Beobachtungszeitraum Uni Freiburg Bartels et al. I [18] Bartels et al. II [18] Bartels et al. III [18] Konopke et al. I [75] Konopke et al. II [75] 01/91 - 01/03 06/82 - 12/91 01/92 - 12/93 01/94 - 10/97 10/93 - 12/98 01/99 - 12/02 n= 30-TageLetalität absolut [%] absolut [%] retrospektiv 10 2 20 1 10 20 27,8 retrospektiv 72 prospektiv 20 5 25 prospektiv präoperativ selektiert 0 retrospektiv 1 1 100 prospektiv präoperativ selektiert 0 Klinikletalität „ - “ bedeutet: keine Angaben verfügbar München: Bei „Bartels et al. I“ lag der Anteil der 30-Tage-Letalität in der Gruppe mit geringem Risiko signifikant unter jenem in der Gruppe mit moderat erhöhtem Risiko, in der Gruppe mit moderat erhöhtem Risiko signifikant unter jenem in der Gruppe mit hohem Risiko (jeweils mit p< 0,05) [18]. Bei „Bartels et al. II“ lag der Anteil der 30-Tage-Letalität in der Gruppe mit hohem Risiko signifikant über jenem in der Gruppe mit geringem bzw. mit moderat erhöhtem Risiko (mit p< 0,01 bzw. p< 0,05) [18]. 96 Dresden: Bei „Konopke et al. I“ und „Konopke et al. II“ gab es bezüglich der 30-Tage-Letalität zwischen den Gruppen mit geringem und moderat erhöhtem Risiko mit p= 0,55 bzw. p= 0,56 (Fisher`s Exact Test) keinen signifikanten Unterschied. Nur ein Hochrisikopatient wurde operiert. Trotz dessen perioperativen Todes ist eine gültige Aussage über eine signifikant höhere Letalität in dieser Risikogruppe nicht möglich [75]. Freiburg: Auch im Freiburger Untersuchungskollektiv starben Patienten der Niedrigrisikogruppe in den ersten 30 Tagen signifikant seltener als Patienten mit höherem Score (p= 0,004). Beim Vergleich der Patienten mit moderatem und hohem Risiko ergab sich dagegen kein bemerkenswerter Unterschied (p= 1 bezüglich der 30-Tage-Letalität wie der Krankenhausletalität). Die als Hochrisikopatienten klassifizierten Personen überlebten die ersten 30 Tage keineswegs signifikant seltener als die Gesamtgruppe derer mit weniger als 22 Score-Punkten (p= 0,355). Wären alle zehn Personen der Hochrisikogruppe von vornherein von der Operation ausgeschlossen worden, läge die Krankenhausletalität unter den übrigen 120 Patienten mit 11,7% nur unwesentlich unter dem bisherigen Ergebnis von 12,3%; die 30-Tage-Letalität läge unverändert bei 9,2%. 97 4.7.5. Perioperative Letalität und erreichter Score Konopke et al. geben in ihrer Publikation leider keine Auskunft über die genaue Punktverteilung. Die Gegenüberstellung der Freiburger Ergebnisse mit den Angaben von Bartels et al. II folgt in Tabelle 65. Tabelle 65: Erreichte Punkte im Vergleich Gruppe n= Uni Freiburg: gesamt 130 Uni Freiburg: 30d überlebt 118 Uni Freiburg: binnen 30d verstorben Uni Freiburg: periop. Aufenthalt überlebt Uni Freiburg: im Krankenhaus verstorben Bartels et al. II: gesamt [18] 12 Bartels et al. II: 30d überlebt [18] Bartels et al. II: binnen 30d verstorben [18] 112 MannWhitney Minimum Maximum Median Mittelwert U-Test 114 16 121 9 Score 11 26 17 15,8 11 26 15 15,6 11 22 17 17,7 11 26 15 15,5 11 22 17 17,7 - - - - 12 21 17 - 16 25 21 - p= 0,020 p= 0,007 p< 0,01 „ - “ bedeutet: keine Angaben verfügbar Patienten mit 11 bis 16 Punkten hatten in jedem der beschriebenen Kollektive eine durchschnittlich deutlich niedrigere 30-Tage-Letalität als Patienten mit höherem Score. Im Freiburger und im Münchner Datenmaterial ist dieser Unterschied statistisch hoch signifikant, die Dresdner Angaben zeigen dieselbe Tendenz. Es ist ebenfalls eindeutig, dass der durchschnittliche Score der Verstorbenen signifikant über dem der Überlebenden liegt. Mit einem Median von 17 Punkten in der Gruppe der perioperativ Überlebenden und einem Median von 21 Punkten bei den Verstorbenen ist dieser Unterschied in dem von Bartels et al. beschriebenen Kollektiv allerdings sehr viel deutlicher als bei den Freiburger Patienten mit einem Median von 15 bzw. 17 Punkten [Tabelle 65]. 98 Schlussfolgerung: Der Münchner Arbeitsgruppe gelang es mit ihrem Score retrospektiv eine Hochrisikogruppe mit durchschnittlich deutlich höherer perioperativer Letalität zu identifizieren und diesen signifikanten Unterschied im weiteren prospektiv zu belegen. Diese Unterscheidung zwischen einer Hochrisikogruppe und einer Gruppe mit moderat erhöhtem Risiko kann durch die retrospektive Analyse der Freiburger Daten nicht bestätigt werden. Die Krankenhausletalität betrug hier in beiden Gruppen 20%, die 30-Tage-Letalität lag in der Hochrisikogruppe im Verhältnis sogar leicht unter jener in der Gruppe mit moderat erhöhtem Risiko. Auch den Ergebnissen von Konopke et al. ist diesbezüglich kein signifikanter Unterschied zwischen den Risikogruppen zu entnehmen. 99 4.8. Ergebnisse der Risikoanalysen im Vergleich Auch mit der Anwendung des Bartels-Scores gelang es in bezug auf das Freiburger Datenmaterial zumindest im retrospektiven Ansatz nur unzureichend, Patienten mit erhöhtem, aber noch vertretbarem Risiko von jenen zu unterscheiden, bei denen von vornherein besser von einer Operation abgesehen werden sollte. Somit erscheint es sinnvoll, neben den im Score berücksichtigten Parametern auch andere Faktoren zu diskutieren. Hierzu werden den von Bartels et al. ermittelten Einflussgrößen die Resultate der Regressionsanalyse der Freiburger Daten [siehe auch 3.4.4., Seite 67], sowie Risikoanalysen aus den unter 4.1. bis 4.5. genannten Arbeiten gegenübergestellt. 4.8.1. Regressionsanalysen mit der Zielgröße „perioperative Letalität“ In Tabelle 66 finden sich die von Bartels et al. [18] und Bailey et al. [13] mittels Regressionsanalyse identifizierten Faktoren im Vergleich mit den entsprechenden Freiburger Ergebnissen. In diesen Untersuchungen wurden nur präoperativ ermittelbare Parameter berücksichtigt. Tabelle 66: Bartels et al. [18]* n=432 Parameter Karnofsky-Index [%] Compliance gut: ja/nein Kardiales Risiko normal/erhöht/hoch VC> 90%: ja/nein PaO2> 70%: ja/nein Aminopyrin-Atemtest > 0,4: ja/nein Zirrhose: ja/nein * p= - Bailey et al. [13] n=1777 Parameter p= Zunehmendes Alter 0,0001 Zunehmendes Alter 0,0515 Vorbestehen von Ascites Diabetes mellitus 0,0001 Abnehmender Karnofsky-Index 0,002 PTT im Referenzbereich*** 0,007 GGT nicht im Referenzbereich 0,01 0,0006 Schlechter Allgemeinzustand ** Stattgehabte neoad. Therapie Serum-Harnstoff > 0,01 40mg/dl Alkoholanamnese: 0,02 aktuell > 2 Drinks/7d Alkal. Phosphatase im 0,05 Serum > 125 U/l Freiburg n=131 Parameter p= 0,0379 0,0093 genaue Angaben zu den Ergebnissen der durchgeführten Regressionsanalyse liegen nicht vor [17,18] ** Art der Quantifizierung nicht angegeben *** paradoxes Ergebnis 100 Allgemeinzustand und Compliance: Alle drei Untersuchungen unterstreichen die Bedeutung des Allgemeinzustandes. Bei der Analyse der Freiburger Daten erwies sich ein reduzierter Karnofsky-Index zudem auch in der univariaten Analyse als der wichtigste unabhängige Prädiktor für einen letalen perioperativen Verlauf (p= 0,002). Ein relevanter statistischer Einfluss der Compliance zeigte sich allerdings nicht; dieser Parameter wurde von Bailey et al. nicht berücksichtigt. Kardiologische Risikoeinschätzung: Der Risikoeinschätzung im kardiologischen Konsil wird im Bartels-Score ein hoher Stellenwert beigemessen, dieser Parameter erwies sich aber in der Regressionsanalyse der Freiburger Daten als nicht relevant. Allerdings erfolgte hier die Zuordnung der Patienten zu den jeweiligen kardiologischen Risikogruppen erst retrospektiv nach den Angaben der vorliegenden kardiologischen Befunde, was der aktuellen präoperativen Einschätzung durch einen Facharzt keinesfalls gleichzusetzen ist. Bei Bailey et al. finden sich keine Angaben zum Einfluss kardialer Faktoren. Lungenfunktion: Bartels et al. werteten Patienten mit einer VC< 90% bzw. eines PaO2< 70% als pulmonal kompromittiert. Lungenfunktionsparameter fanden bei der Regressionsanalyse der Daten dieser Arbeit leider keine Berücksichtigung. Ein unabhängiger Einfluss dieser Faktoren auf die perioperative Letalität konnte in der univariaten Analyse nicht bestätigt werden. Bei Bailey et al. finden sich auch hier keine Angaben. Leberfunktion: Bailey et al. nennen hier das Vorbestehen von Ascites und die anamnestische Angabe aktuell bestehenden, regelmäßigen Alkoholkonsums; auch die Erhöhung der Alkalischen Phosphatase wird von den Autoren mit einer hepatischen Dysfunktion in Zusammenhang gebracht. In bezug auf die Freiburger Regressionsanalyse erwiesen sich eine abweichende GGT und paradoxerweise eine partielle Thromboplastinzeit im Normbereich als relevant. Letzteres ist wohl einem Zufallseffekt zuzuschreiben und kann mit medizinischen Ursachen nicht erklärt werden. Der präoperative Nachweis einer GGT außerhalb des Referenzbereichs korrelierte hier auch in der univariaten Analyse signifikant mit einem letalen perioperativen Verlauf (p= 0,033). 101 Nierenfunktion und Diabetes mellitus: In der Regressionsanalyse von Bailey et al. waren auch die Erhöhung des Serum-Harnstoffes und das Bestehen eines Diabetes mellitus von Bedeutung. Sowohl die Analyse von Bartels et al. als auch die der Freiburger Daten zeigten hier keine signifikante Beziehung zur perioperativen Letalität. Neoadjuvante Therapie: Der Einfluss einer präoperativ durchgeführten Chemo- oder Radiochemotherapie auf die Verschlechterung der perioperativen Ergebnisse findet in der Arbeit von Bartels et al. keine Erwähnung. Bailey et al. sehen allerdings sowohl in der univariaten wie auch in der Regressionsanalyse einen deutlichen Zusammenhang zwischen einer stattgehabten neoadjuvanten Therapie und dem Anstieg der perioperativen Letalität. Dies kann in bezug auf die Freiburger Daten nicht bestätigt werden. Alter: Nach Ansicht von Bartels et al. kommt dem Alter als unabhängigem Prädiktor für perioperative Letalität keine Bedeutung zu. Auch Kinugasa et al. 2001 [73] und Sabel et al. 2002 [115], die sich in ihren Arbeiten dezidiert mit der Ösophagusresektion bei Patienten mit einem Alter von mehr als 70 Jahren auseinandersetzen, unterstützen diese Auffassung. Dies konnte in der univariaten Analyse der Freiburger Daten bestätigt werden (p= 0,165). Dagegen ist bei den bereits oben genannten Autoren Law et al. [83] und Atkins et al. [11] das Alter der einzige präoperative Parameter, der mit p< 0,0001 bzw. p= 0,002 überhaupt eine signifikante Beziehung zur perioperativen Letalität zeigt. In der Regressionsanalyse gewinnt der Einfluss des Alters im Zusammenspiel mit anderen Negativfaktoren sowohl in bezug auf die Freiburger Daten wie auch bei Bailey et al. allerdings ebenfalls wieder klar an Bedeutung. 102 4.8.2. Risikoanalysen mit der Zielgröße „pulmonale Komplikationen“ In bezug auf einen letalen perioperativen Verlauf erwies sich das Auftreten pulmonaler Morbidität sowohl bei der Analyse der Freiburger Daten (p= 0,005) als auch bei vielen anderen Autoren [3,11,12,42,75,83,130] von besonderer Bedeutung. Prädiktoren für pulmonale Komplikationen sollten bei der präoperativen Patientenselektion deshalb unbedingt berücksichtigt werden. In Tabelle 67 finden sich die von Law et al. [83] und Ferguson et al. [42] mittels Regressionsanalyse identifizierten Faktoren im Vergleich mit den entsprechenden Freiburger Ergebnissen. Tabelle 67: Law et al. [83] n=421 Parameter Ferguson et al. [42] n=292 Parameter p= Zunehmendes Alter 0,0001 Zunehmendes Alter 0,059 Zunehmendes Alter 0,0702 Zunehmende OP-Dauer 0,0059 Verminderte FEV1 0,003 Abnehmender Karnofsky-Index 0,0085 Tumorlokalisation: mittlerer vs oberer thorak.Ösophagus Tumorlokalisation: unterer vs oberer thorak.Ösophagus 0,0441 Verminderter Allgemeinzustand* 0,14 GGT nicht im Referenzbereich 0,0548 Präoperativ N+ 0,0690 0,0044 p= Freiburg n=131 Parameter p= * Eastern Cooperative Oncology Group scale; erhoben unmittelbar vor der Operation. Alter: Die Regressionsanalyse zeigte in allen drei Kollektiven die Bedeutung zunehmenden Alters für das Auftreten pulmonaler Komplikationen. Allgemeinzustand: Der Allgemeinzustand wurde von Law et al. nicht berücksichtigt. Die Regressionsanalysen von Ferguson et al. und des Freiburger Datenmaterials unterstreichen aber dessen Bedeutung auch für das Auftreten pulmonaler Komplikationen. In dieser Arbeit erwies sich ein präoperativer Karnofsky-Index < 80 zudem als wichtigster unabhängiger Prädiktor für das 103 Auftreten pulmonaler Morbidität (p= 0,005), gefolgt vom Vorbestehen pulmonaler Vorerkrankungen (p= 0,018). Lungenfunktionsparameter: Die Prüfung von Lungenfunktionsparametern fand bei der Regressionsanalyse des Freiburger Datenmaterials und bei Law et al. keine Berücksichtigung. Ferguson et al. nennen hier eine verminderte FEV1. Auch Avendano et al. [12] heben als Ergebnis ihrer univariaten Analysen die hohe Korrelation von pulmonalen Komplikationen und einer präoperativen FEV1< 65% hervor. Tumorstaging, Tumorlokalisation und Operationsdauer: Law et al. nennen als weitere Ergebnisse ihrer Regressionsanalyse den bedeutenden Einfluss einer Tumorlokalisation oberhalb der trachealen Bifurkation und einer längeren Operationsdauer. Diese Faktoren wurden innerhalb der anderen beiden Untersuchungen nicht berücksichtigt. Bei der Analyse der Freiburger Daten erwies sich aber ein präoperativ positives N-Staging als relevant. Alle drei genannten Parameter deuten darauf hin, dass zunehmende Dauer und Komplexität des Eingriffs mit einem Anstieg des Risikos pulmonaler Komplikationen verbunden sind. Neoadjuvante Therapie: Ein bedeutender Zusammenhang zwischen einer stattgehabten neoadjuvanten Therapie und der Zunahme pulmonaler Komplikationen konnte im Gegensatz zu den Arbeiten von Avendano et al. [12] und Meneu-Diaz et al. [95] in keiner der drei Regressionsanalysen belegt werden. Weitere Laborparameter: Die präoperative Messung einer GGT außerhalb des Referenzbereiches erwies sich im Rahmen der Regressionsanalyse der Freiburger Patientendaten auch in bezug auf das Auftreten pulmonaler Komplikationen als von Bedeutung. Der Parameter lässt sich in Verbindung mit Patienten mit Alkoholabusus bringen. Ein vermehrtes pulmonales Risiko solcher Patienten erscheint auch nach allgemeiner klinischer Erfahrung als wahrscheinlich. 104 4.9. Patientenaufkommen In der aktuellen Diskussion über den Zusammenhang zwischen der Anzahl der an einer Einrichtung durchgeführten chirurgischen Eingriffe und der Qualität der erzielten Resultate, konnte auch in bezug auf die Ösophagusresektion gezeigt werden, dass an Krankenhäusern mit hohem Patientenaufkommen die perioperative Letalität im Durchschnitt deutlich niedriger ist als an Häusern mit sehr geringen Fallzahlen [20,76,139]. Allerdings ließ sich von einigen Autoren durchaus belegen, dass sich Ösophagusresktionen auch bei einer Zahl von weniger als sechs Eingriffen pro Jahr an einer gut ausgerüsteten Klinik mit akzeptablen Ergebnissen durchführen lassen ( die Krankenhausletalität lag bei 7%, die 30-Tage-Letalität bei 4,8%) [107]. Nach Auffassung von Urbach und Baxter 2004 [144] entscheidet vor allem, ob an einem Krankenhaus generell viele komplexe Eingriffe durchgeführt werden oder nicht. Dies trifft auf die Abteilung für Allgemeine- und Viszeralchirurgie der Universitätsklinik Freiburg sicher zu. Auch überschreitet hier die Zahl der Ösophagusresektionen den jährlichen Durchschnitt der in dieser Arbeit ausgewerteten Fälle gerade in jüngerer Zeit deutlich. So wurden im Jahr 2003 in Freiburg insgesamt mehr als 20 Ösophagusresektionen durchgeführt. 105 4.10. Schlussfolgerung Der zentrale Stellenwert der Ösophagusresektion in der kurativen Therapie des Ösophaguskarzinoms ist unbestritten. Für einen Patienten in guter physischer Verfassung übersteigt der zu erwartende Vorteil bezüglich des Langzeitüberlebens die verbleibenden Risiken des Eingriffs deutlich. Begleiterkrankungen und schlechter Allgemeinzustand gehen aber mit einer wesentlichen Erhöhung des Risikos perioperativer Morbidität und Mortalität einher. Eine strenge präoperative Patientenselektion ist daher unerlässlich. Hauptproblem bleibt, Patienten mit erhöhtem, aber noch vertretbarem Risiko von jenen zu unterscheiden, bei denen besser von einer Operation abgesehen werden sollte. Diesbezüglich war das Ergebnis der retrospektiven Anwendung des von Bartels et al. publizierten Scores auf das Freiburger Datenmaterial leider unzureichend. Als wichtige Kritikpunkte an der Publikation von Bartels et al. sind zudem zu nennen, dass die Autoren quantitative Angaben zur Histologie, sowie zur Wahl des operativen Zugangs schuldig bleiben und den möglichen Einfluss einer neoadjuvanten Therapie nicht berücksichtigen. In der vorliegenden Arbeit wurde gezeigt, dass im Freiburger Untersuchungskollektiv vor allem die Verbindung von reduziertem Karnofsky-Index und zunehmendem Lebensalter wesentlich für perioperative Ereignisse wie pulmonale und kardiale Komplikationen sowie für einen letalen Verlauf prädestinierte. Ferner scheint eine stattgehabte neoadjuvante Therapie besonders für das Auftreten chirurgischer Komplikationen eine bedeutende Rolle zu spielen, wobei sich aber ein Einfluss auf die perioperative Letalität nicht nachweisen ließ. Die Aussagen der Vergleichsliteratur sind zwar nicht ganz einheitlich, die Ergebnisse verschiedener anderer Risikoanalysen unterstützen aber diese Einschätzung von KarnofskyIndex, Alter und neoadjuvanter Therapie in deren Bedeutung für den perioperativen Verlauf. Unter Beibehaltung des am Universitätsklinikum Freiburg üblichen präoperativen diagnostischen Vorgehens sollte die Therapieentscheidung auch weiterhin auf der differenzierten Betrachtung des individuellen Risikoprofils getroffen werden, wobei den genannten Faktoren zukünftig aber ein noch größerer Stellenwert eingeräumt werden muss. 106 5. Zusammenfassung Diese Arbeit analysierte retrospektiv die Patientendaten zu 131 Ösophagusresektionen bei Ösophaguskarzinom, die zwischen Januar 1992 und Januar 2003 in der Abteilung für Allgemeine und Viszeralchirurgie der Universitätsklinik Freiburg durchgeführt wurden. Dabei lag der Schwerpunkt auf der Betrachtung des Zusammenhangs von präoperativem physischen Status und perioperativem Verlauf. Bei 84% der Patienten bestand zum Operationszeitpunkt mindestens eine Begleiterkrankung. Kardiopulmonalen Erkrankungen kam dabei die größte Bedeutung zu. 8,4% der Patienten mussten als multimorbid eingestuft werden, 19,1% hatten einen Karnofsky-Index < 80%. Als wichtigste Größe im perioperativen Verlauf lag die Krankenhausletalität bei 12,2%. Die Todesursachen waren überwiegend kardiopulmonaler Art. Signifikante Beziehungen zu entsprechenden Begleiterkrankungen ließen sich aber nicht feststellen. Bei der retrospektiven Anwendung des Bartels-Scores waren zwar Personen mit niedrigem Risiko gut zu identifizieren (Letalität von 4,6% bei einem Anteil von 50% am Gesamtkollektiv), es gelang aber nur unzureichend, Patienten mit erhöhtem, aber noch vertretbarem Risiko von jenen Patienten zu unterscheiden, bei denen von vornherein besser von einer Operation abgesehen werden sollte. Die Letalität betrug sowohl in der Gruppe mit „moderat erhöhtem“ als auch in der Gruppe mit „hohem“ Risiko 20%. Bei 85,5% der Patienten kam es zu mindestens einer therapiepflichtigen Komplikation. Quantitativ am bedeutendsten waren dabei pulmonale Komplikationen (64,1%); hier bestand zudem eine signifikante Beziehung zum letalen perioperativen Verlauf (p= 0,001). Aufgrund ihrer relativen Häufigkeit und ihrer klinischen Relevanz sind unter den Einzelkomplikationen Pneumonien (57 Fälle) und Anastomoseninsuffizienz (20 Fälle) besonders hervorzuheben. Als wichtigster unabhängiger Prädiktor für perioperative Ereignisse wurde der KarnofkyIndex identifiziert: er korrelierte invers mit dem Auftreten kardialer (p= 0,002) und pulmonaler (p= 0,005) Komplikationen, insbesondere mit dem von Pneumonien (p= 0,005) und Pleuraergüssen (p= 0,005), sowie mit der Gesamtmorbidität (p= 0,024) und der perioperativen Letalität (p= 0,002). Auf der Grundlage einer Regressionsanalyse wurden unter den präoperativen Parametern Alter, Karnofsky-Index, sowie die Laborparameter PTT und GGT als gemeinsame Prädiktoren für einen möglichen letalen perioperativen Verlauf identifiziert. Die Dauer des postoperativen stationären Aufenthalts betrug im Mittel 33,8 Tage. Die 5Jahres-Überlebensrate lag insgesamt bei 24,3%, der Überlebens-Median bei 1,41 Jahren. 107 6. Literaturverzeichnis [1] Adelstein D.J.; Rice T.W.; Becker M.; [et al.]. 1997. „Use of concurrent chemotherapy, accelerated fractionation radiation, and surgery for patients with esophageal carcinoma.” Cancer 80, 1011-1120. [2] Altorki N.K.; Oliveria S.; Schrump D.S. 1997. „Epidemiology and molecular biology of Barrett`s adenocarcinoma.” Sem Surg Oncol 13, 270-280. [3] Altorki N.K.; Skinner D. 2001. „Should en bloc esophagectomy be standard of care for esophageal carcinoma?” Ann Surg 234, 581-587. [4] American Cancer Society (Hrsg.). 2003. Cancer facts & figures 2003. Atlanta. [5] American Cancer Society (Hrsg.). 2004. Cancer facts & figures 2004. Atlanta. [6] American Joint Comitee on Cancer (Hrsg.). 1997. AJCC Cancer Staging Manual. 5. Auflage. Philadelphia. [7] Apinop C.; Puttisak P.; Preecha N. 1994. „A prospective study in combined therapy in esophageal carcinoma.” Hepatogastroenterology 41, 391-393. [8] Arbeitsgemeinschaft Bevölkerungsbezogener Krebsregister in Deutschland (Hrsg.). 2004. Krebs in Deutschland – Häufigkeiten und Trends. 4. überarbeitete, aktualisierte Auflage. Saarbrücken. [9] Armstrong R.W.; Borman B. 1996. „Trends in incidence rates of adenocarcinoma of the oesophagus and gastric cardia in New Zealand, 1978-1992.” Int J Epidemiol 25, 941-947. [10] Ashan H.; Neugut A. 1998. „Radiotion therapy for breast cancer and increased risk for esophageal carcinoma.” Ann Intern Med 128, 114-117. [11] Atkins B.Z.; Shah A.S.; Hutcheson K.A.; [et al.]. 2004. „Reducing morbidity and mortality following esophagectomy.” Ann Thorac Surg 78, 1170-1176. [12] Avendano E.C.; Flume P.A.; Silvestri G.A.; [et al.]. 2002. „Pulmonary complications after esophagectomy.” Ann Thorac Surg 73, 922-926. 108 [13] Bailey S.H.; Bull D.A.; Harpole D.H.; [et al.]. 2003. „Outcomes after esophagectomy: A Ten-Year Prospective Cohort.” Ann Thorac Surg 75, 217-222. [14] Bareiß D.; Stabenow R.; Müller R.; [et al.]. 2002. „Aktuelle Epidemiologie des Ösophaguskarzinoms und des Kardiakarzinoms in Deutschland.“ Dtsch Med Wochenschr 127, 1367-1374. [15] Bartels H.; Lehr L.; Siewert J.R. 1988. „Risikoabschätzung der chirurgischen Therapie beim Ösophaguskarzinom.” Z Herz/Gefäßchir 2, 114. [16] Bartels H.; Stein H.J.; Schömig A.; Siewert J.R. 1997. „Risikoerfassung.” Chirurg 68, 654-661. [17] Bartels H.; Stein H.J.; Siewert J.R. 1998. „Preoperative risk analysis and postoperative mortality of oesophagectomy for respectable oesophageal cancer.” Br J Surg 85, 840-844. [18] Bartels H.; Stein H.J.; Siewert J.R. 2000. „Risk analysis in Esophageal Surgery.” In Lang J.; Siewert J.R. (Hrsg.). 2000. Esophageal Carcinoma: State of the Art (Recent Results in Cancer Research; 155). Heidelberg. 89-96. [19] Bartels H.; Siewert J.R. 1990. „Postoperative Lungenkomplikationen: Spezielle Probleme am Beispiel der Ösophaguschirurgie.” Langenbecks Arch Chir Suppl Kongressbd II, 1101. [20] Birkmeyer J. D.; Siewers A.E.; Finlayson E.V.A.; [et al.]. 2002. „Hospital Volume and surgical Mortality in the United States.” N Eng J Med 346, 1128-1137. [21] Blot W.J. 1992. „Alkohol and cancer.” Cancer Res 52, 2119s. [22] Bosset J.-F.; Gignoux M.; Triboulet J.-P.; [et al.]. 1997. „Chemoradiotherapy followed by surgery compared with surgery in squamouscell cancer of the esophagus.” N Eng J Med 337, 161-167. [23] Brown L.M.; Hoover R.; Silverman D.; [et al.]. 2001. „Excess incidence of squamous cell esophageal cancer among US Black men: role of social class and other risk factors.” Am J Epidemiol 153, 114-122. 109 [24] Burmeister B.H.; Smithers B.M.; Fitzgerald L.; [et al.]. 2002. „A randomized phase III trial of preoperative chemoradiation followed by surgery.” Prog Proc Am Soc Clin Oncol 21, 130a (Abstract). [25] Castellsague X.; Munoz N.; De Stefani E.; [et al.]. 1999. „Independent and joint effects of tabacco smoking and alkohol drinking on the risk of esophageal cancer in men and women.” Int J Cancer 82, 657-664. [26] Chow W.H.; Blot W.J.; Vaughan T.L.; [et al.]. 1998. „Body mass index and risk of adenocarcinomas of the esophagus and gastric cardia.” J Natl Cancer Inst 90, 150-155. [27] Collard J.M. 2001. „Exclusive radical surgery for esophageal adenocarcinoma.“ Cancer 91, 1098-1104. [28] Collard J.M.; Otte J.B.; Fiasse R.; [et al.]. 2001. „Skeletonizing en bloc esophagectomy for cancer.“ Ann Surg 234, 25-32. [29] Date H.; Miyashita M.; Sasajima K.; [et al.]. 1990. „Assessment of adventitia involvement of esophageal carcinoma by endoscopic ultrasound.” Surg Endosc 4, 195. [30] Deutsche Krebsgesellschaft (Hrsg.). 2002. „Interdisziplinäre Leitlinien der Deutsche Krebsgesellschaft und der Deutsche Gesellschaft für Chirurgie.“ 3. Auflage. Online-Version: http://www.uni-duesseldorf.de/WWW/AWMF/ll/032-008.htm (17.8.2003). [31] Deutsches Netzwerk Evidenzbasierte Medizien (Hrsg.). 2004. Glossar zur Evidenzbasierten Medizin. http://www.ebm-netzwerk.de (30.04.2005). [32] Devesa S.S.; Blot W.J.; Fraumeni J. F. 1998. „Changing patterns in the incidence of esophageal and gastric Carcinoma in the United States.” Cancer 83, 2049-2053. [33] Doty J.R.; Salazar J.D.; Forastiere A.A.; [et al.]. 2002. „Postesophagectomy morbidity, mortality, and length of hospital stay after preoperative chemoradiation therapy.” Ann Thorac Surg 74, 227-231. [34] Dressner S.M.; Griffin S.M. 2000. „Pattern of recurrence following radical oesophagectomy with two-field lymphadenectomy.“ Br J Surg 87, 1426-1433. 110 [35] Dwenger A.; Berger D.P.; Engelhard R. 2002. „Ösophaguskarzinom.“ In: Berger D.P.; Engelhard R.; Mertelsmann R. (Hrsg.). 2002. Das Rote Buch: Hämatologie und internistische Onkologie. 2. überarbeitete und erweiterte Auflage. Landsberg/Lech. [36] Earle C.C.; Maronn J.A. 1998. „Adjuvant chemotherapy after curative resection for gastric cancer: Revisiting a meta-analysis of randomized trials (abstract).“ Proc Am Soc Clin Oncol 17, 263. [37] Elman A.; Guili R.; Sancho-Garnier H. 1988. „Risk factors of pulmonary complications following esophagectomie in carcinoma of the esophagus: Results of the prospective study conducted by the OESO group.” In: Siewert J.R.; Hölscher A.H. (Hrsg.). 1988. Diseases of the Esophagus. Berlin. [38] Ellis A.; Field J.K. Field E.A.; [et al.]. 1994. „Tylosis associated with carcinoma of the oesophagus and oral leukoplacia in a large Liverpool family – a review of six generations.” Eur J Cancer B Oral Oncol 30B, 102-112. [39] Enzinger P.C.; Mayer R.J. 2003. „Esophageal Cancer.” N Engl J Med 349, 2241-52. [40] Erkal H.S.; Mendenhall W.M.; Amdur R.J.; [et al.]. 2001. „Synchronous and metachronous squamous cell carcinomas of had and neck mucosal sites.” J Clin Oncol 19, 1358-1362. [41] EUCAN (Hrsg.); Ferlay J.; Bray F.; Sankila R.; [et al.] 1999. Cancer Incidence, Mortality and Prevention in the European Union. 1998. Version 5.0, IARC CancerBase No. 5. Lyon. [42] Ferguson M.K.; Durkin A.E. 2001. „Preoperative prediction of the risk of pulmonary complications after esophagectomy for cancer.” J Thorac Cardiovasc Surg 123, 661-669. [43] Ferguson M.K. 2002. „Carcinoma of the Esophagus and Cardia.” In: Zuidema G.D. ; Yeo C. J. (Hrsg.). 2002. Shackelford`s surgery of the alimentary tract. Philadelphia, Band 1. 5. Auflage. [44] Ferguson M.K.; Martin T.R.; Reeder L.B.; (et al.). 1997. „Mortality after esophagectomy: Risk factor analysis.” World J Surg 21, 599. 111 [45] Fleischhauer K.; Drenckhahn D. 1994. „Speiseröhre.“ In: Drenckhahn D.; Zenker W. (Hrsg.). 1994. Benninghoff: Anatomie. 15. völlig neu bearbeitete Auflage. München; Wien; Baltimore, Band 1, 828-838. [46] Fujita H. ; Kakegawa T.; Yamana H.; [et al.]. 1995. „Mortality and morbidity rates, postoperative course, quality of life, and prognosis after extended radical lymphadenectomy for esophageal cancer.” Ann Surg 222, 654-662. [47] Gammon M.D.; Schoenberg J.B.; Ahsan H.; [et al.]. 1997. „Tobacco, alcohol, and socioeconomic status and adenocarcinomas for the esophagus and gastric cardia.” J Natl Cancer Inst 89, 1277-1284. [48] Ghavamazadeh A.; Moussavi A.; Jahani M.; [et al.]. 2001. „Esophageal Cancer in Iran.” Semin Oncol 28, 153-157. [49] Glickman J.N. 2003. „Pathology and Pathologic Staging of Esophageal Cancer.” Sem Thor & Cardiovasc Surg 15, 167-179. [50] Goldmann W.; Caldera D.; Nussbaum R.; [et al.]. 1988. „Multifactorial index of cardiac risk in noncardiac surgical procedures.” Anaesthesiol 61, 38. [51] Graham D.Y.; Yamaoka Y. 1998. „H. pylori and cagA: relationships with gastric cancer, duodenal ulcer, and reflux esophagitis and its complications.” Helicobacter 3, 145-51. [52] Green F.L.; Page D.L.; Fleming I.D.; [et al.]. 2002. AJCC cancer staging manual. 6. Auflage. Berlin; Heidelberg; New York. [53] Greer S.E.; Goodney P.P.; Sutton J.E.; [et al.]. 2005. „Neoadjuvant chemoradiotherapy for esophageal carcinoma: A metaanalysis.” Surgery 137, 172-177. [54] Grimm H.; Maydeo A.; Hamper K.; [et al.]. 1991. „Results of endoscopic ultrasound (EUS) and computed tomography (CT) in preoperative staging of esophageal cancer.” Gastrointest Endosc 37, 279A. [55] Guili R.; Sancho-Garnier H. 1986. „Diagnostic, therapeutic, and prognostic features of cancer of the esophagus: Results of the prospective study conducted by the OESO group.” Surg 99, 614. 112 [56] Gurkan N.; Terzioglu T.; Tezelman S.; [et al.]. 1991. „Transhiatal esophagectomy for esophageal cancer.” Br J Surg 78, 1348-1351. [57] Hagen J.A.; DeMeester S.R.; Peters J.H.; [et al.]. 1996. „Curative Resection for Esophageal Adenocarcinoma: Analysis of 100 En Block Esophagectomies.” Ann Surg 234, 520-531. [58] Hansen S.; Johan N. 1997. „Esophageal and gastric cancer in Norway 1958-1992.” Int J Cancer 71, 340-344. [59] Hansson L.E.; Sparen P.; Nyren O. 1993. „Increasing incidence of both major histological types of esophageal carcinoma among men in Sweden.” Int J Cancer 54, 492-407. [60] Hamilton S.R.; Aaltonen L.A. 2000. World Health Organisation Classification of Tumors. Pathology and Genetic of Tumors of the Digestive System. Lion. [61] Headrick J.R.; Nichols F.C.III ; Miller D.L.; [et al.]. 2002. „High-grade esophageal dysplasia: longterm survival and quality of life after esophagectomy.” Ann Thorac Surg 73, 1697-1702. [62] Heath E.I.; Burtness B.A.; Heitmiller R.F.; [et al.]. 2000. „Phase II evaluation of preoperative chemoradiation and postoperative adjuvant chemotherapy for squamous cell and adenocarcinoma of the esophagus.” J Clin Oncol 18, 868-876. [63] Herold G. 2004. Innere Medizin: Eine vorlesungsorientierte Darstellung. Köln. [64] Imdahl A.; Schöffel U.; Ruf G. 2004. „Impact of neoadjuvant therapy of perioperative morbidity in patients with esophageal cancer.“ Am J Surg 187, 64-68. [65] Institut für Medizinische Biometrie und Medizinische Informatik der Universität Freiburg (Hrsg.). 1994. „Biomathematik für Mediziner: Vorlesungsskript zum Wintersemester 1994/95.“ Freiburg. [66] Junginger T.; Dutkowski P. 1996. „Selective approach to the treatment of esophageal cancer.“ Br J Surg 83, 1473-1477. 113 [67] Junginger T.; Kneist W.; Schreckenberger.; [et al.]. 2002. „Positronen-Emissions-Tomographie zum präoperativen Staging des Ösophaguskarzinoms.“ Dtsch Med Wochenschr 127, 1935-1941. [68] Kaklamanos I.G.; Walker G.R.; Ferry K.; [et al.]. 2003. „Neoadjuvant Treatment for Resectable Cancer of the Esophagus and the Gastroesophageal Junktion: A Meta-Analysis of Randomized Clinical Trials.” Ann Surg Oncol 10, 754-761. [69] Karl R.C.; Schreiber R.; Boulware D.; [et al.]. 1999. „Factors affecting morbidity, mortality, and survival in patients undergoing Ivor Lewis esophagectomy.“ Ann Surg 231, 635-643. [70] Karnofsky D. 1984. „Reporting results of cancer treatment.” Cancer 1, 634. [71] Kelsen D.P.; Ginsberg R.; Pajak T.F; [et al.]. 1998. „Chemotherapy followed by surgery compared with surgery alone for localized esophageal cancer.” N Eng J Med 339, 1979-1984. [72] Keller S.M.; Ryan L.M.; Coia L.R.; [et al.]. 1998. „High dose chemoradiotherapy followed by esophagectomy for adenocarcinoma of the esophagus and gastroesophageal junction.” Cancer 83, 1908-1916. [73] Kinugasa S.; Tachibana M.; Yoshimura H.; [et al.]. 2001. „Esophageal Resection in Elderly Esophageal Carcinoma Patients: Improvement in Postoperative Complications”. Ann Thorac Surg 71; 414-418. [74] Konder H.; Poenitz-Pohl E. ; Stahlknecht C.D.; [et al.]. 1988. „Analysis of cardiopulmonary function in esophageal cancer patients prior to surgery.” In: Siewert J.R.; Hölscher A.H. (Hrsg.). 1988. Diseases of the Esophagus. Berlin [75] Konopke R.; Kersting S.; Ockert D.; [et al.]. 2003. „Frühergebnisse der Ösophaguschirurgie beim Karzinom.“ Swiss Surg 9, 173-180. [76] Kuo E.Y.; Chang Y.; Wright C.D. 2001. „Impact of Hospital Volume on Clinical and Economic Outcomes for Esophagectomy.” Ann Thorac Surg 72, 1118-1124. [77] Lagergren J.; Bergstrom R.; Adami H.O.; [et al.]. 2000. „Association between medications that relax the lower esophageal sphincter and risk for esophageal adenocarcinoma.” Ann Intern Med 133, 165-75, 2000. 114 [78] Lagergren J.; Bergstrom R.; Lindgren A. 1999. „Symptomatic gastroesophageal reflux as a risk factor for esophageal adenocarcinoma.” N Engl J Med 340, 825-831. [79] Lagergren J.; Bergstrom R.; Nyren O. 2000. „No relation between body mass and gastrooesophageal reflux in a Swedish population based study.” Gut 47, 26-29. [80] Larsson L.G.; Sandstrom A.; Westling P. 1975. „Relationship of Plummer-Vinson disease to cancer of upper alimentary tract in Sweden.” Cancer Res 30B, 3308-3316. [81] Law S.Y.K.; Fok M.; Wong J. 1994. „Risk analysis in resection of squamous cell carcinoma.” World J Surg 18, 339-346. [82] Law S.; Kwong D.; Tung H.; [et al.]. 1998. „Preoperative chemoradiation for squamous cell esophageal carcinoma: a prospective randomized trial.” Can J Gastroenterol 12, Suppl B. 56B (Abstract). [83] Law S.; Wong K.H.; Kwok K.F.; [et al.]. 2004. „Predictive factors for postoperative pulmonary complications and mortality after esophagectomy for cancer.” Ann Surg 240, 791-800. [84] Le Prise E.; Etienne P.L.; Meunier B.; [et al.]. 1994. „A randomized study of chemotherapy, radiation therapy, and surgery versus surgery for localized squamous cell carcinoma of the esophagus.” Cancer 73, 1179-1184. [85] Levi F.; Randimbison L.; La Vecchia C. 2001 „Epidemiology of the adenocarcinoma and squamous cell carcinoma of the esophagus.” Eur J Cancer Prev 10, 91-96. [86] Lew J.I.; Gooding W.E.; Ribeiro U.; [et al.]. 2001. „Long-term survival following induction chemoradiotherapy for esophageal carcinoma.” Arch Surg 136, 737-742. [87] Liabeuf A.; Faivre J. 1997. „Time trends in oesophageal cancer incidence in Cote d`Or (France) 1976-93.” Eur J Cancer Prev 6, 24-30. [88] Lightdale C.J.; Botet J.F. 1990. „Esophageal carcinoma: preoperative staging and evaluation of anastomotic recurrence.” Gastrointest Endosc 36, 1. [89] Lin J.; Beer D.G. 2004. „Molecular Biology of Upper Gastrointestinal Malignancies.“ Semin Oncol 31, 476-486. 115 [90] Linden P.A.; Sugarbaker D. J. 2003. „Techniques of Esophageal Resection.” Sem Thor & Cardiovasc Surg 15, 197-209. [91] Lukanich J.M. 2003. „Epidemiological Review.” Sem Thor & Cardiovasc Surg 15, 158-166. [92] Matthews D.E.; Farewell V.T. 1988. Using and Understanding Medical Statistics. 2. überarbeitete Auflage. Basel. [93] Mc Kinney P.A.; Sharp L.; MacFarlane G.J.; [et al.]. 1995. „Oesophageal and gastric cancer in Scotland.” Brit J Cancer 71, 411-415. [94] Medical Research Council Oesophageal Cancer Working Group. 2002. „Surgical resection with or without preoperative chemotherapy in oesophageal cancer: a randomised controlled trial.” Lancet 359, 1727-1733. [95] Meneu-Diaz J.C.; Blazquez L.A.; Vincente E. ; [et al.]. 2000. „The role of multimodality Therapy for resectable esophageal cancer.“ Am J Surg 179, 508-513. [96] Mertens S. 2001. „Humane Papillomaviren: Die Vakzine wird Realität.“ Deutsches Ärzteblatt 98, 1032-34. [97] Metzger R.; Schneider P.M.; Warnecke-Eberz U.; [et al.]. 2004. „Molecular Biology of Esophageal Cancer.” Oncologie 27, 200-206. [98] Moller H. 1992. „Incidence of cancer of the oesophagus, cardia and stomach in Denmark.” Eur J Cancer Prev 1, 159-164. [99] Moreno-González E.; Garcia-Garcia I.; González-Pinto l.; [et al.]. 1992. „Results of transhiatal esophagectomy for esophageal cancer and other diseases.” Hepato-Gastroenterol 39,439-442. [100] Morita M.; Saeki H.; Mori M.; [et al.]. 2002. „Risk faktors of esophageal cancer and the multiple occurrence of carcinoma in the upper aerodigestive tract.” Surg 131, S1-6. [101] Müller J.M.; Erasmi H.; Stelzner M.; [et al.]. 1990. „Surgical therapy of esophageal carcinoma.“ Br J Surg 77, 845-857. 116 [102] Mueller J.; Werner M.; Siewert J.R. 2000. „Malignant Progression in Barrett`s Esophagus: Pathology and Molecular Biology.” In: Lang J.; Siewert J.R. (Hrsg.). 2000. Esophageal Carcinoma: State of the Art (Recent Results in Cancer Research; 155). Heidelberg, 29-41. [103] National Cancer Institute (Hrsg.). Ries L.A.G.; Eisner M.P.; Kosary C.L.; [et al.] 2004. Surveillance, Epidemiology, and End Results Program (SEER) Cancer Statistics Review, 1975-2001. Bethesda. http://seer.cancer.gov/csr/1975_2001/,2004 (04.06.2004). [104] Nilsson M.; Lundegardh G.; Carling L.; [et al.]. 2002. „Body mass and reflux oesophagitis: an oestrogen-dependent association?” Scand J Gastroenterol 37, 626-630. [105] Nishi M.; Hiramatsu Y.; Hioki K.; [et al.]. 1988. „Risk factors in relation to postoperative complications in patients undergoing esophagectomy or gastrectomy for cancer.” Ann Surg 207, 148. [106] Nygaard K.; Hagen S.; Hansen H.S.; [et al.]. 1992. „Pre-operative radiotherapy prolongs survival in operable esophageal carcinoma: a randomized, multicenter study of pre-operative radiotherapy and chemotherapy: the second Scandinavian trial in esophageal carcinoma.” World J Surg 16, 1104-1110. [107] Padmanabhan R.S.; Byrnes M.C.; Helmer S.D.; [et al.]. 2002. „Should esophagectomy be performed in a low-volume center ?“ Am Surg 68, 348-351. [108] Parkin D.M.; Pisani P.; Ferlay J. 1993. „Estimates of the worldwide Incidence of eighteen major Cancers in 1985.” Int J Cancer 54, 1-13. [109] Paul S.; Bueno R. 2003. „Complications Following Esophagectomy: Early Detection, Treatment, and Prevention.” Sem Thor & Cardiovasc Surg 15, 210-215. [110] Pera M. 2000. „Epidemiology of Esophageal Cancer, Especially Adenocarcinoma of the Esophagus and Esophagogastric Junction.” In: Lang J.; Siewert J.R. (Hrsg.). 2000. Esophageal Carcinoma: State of the Art (Recent Results in Cancer Research; 155). Heidelberg, [111] Pera M.; Trastek V.F.; Carpenter H.A.; [et al.].1992. „Barret`s esophagus with high-grade dysplasia: an indikation for esophagectomy?” Ann Thorac Surg 54, 1199-1204. 117 [112] Pisani P.; Parkin D.M.; Bray F.; Ferlay J. 1999. „Estimates of the worldwide Mortality from 25 Cancers in 1990.” Int J Cancer 83, 18-29 (Erratum: Int J Cancer 83, 870-873). [113] Poon R.T.P.; Law S.Y.K.; Chu K.M.; [et al.]. 1998. „Esophagectomy for Carcinoma of the esophagus in the elderly.” Ann Surg 227, 357. [114] Powell J.; Mc Conkey C.C. 1992. „The rising trend in oesophageal adenocarcinoma and gastric cardia.” Eur J Cancer Prev 1, 265-269. [115] Sabel M.S.; Smith J.L.; Nava H.R.; [et al.]. 2002. „Esophageal Resection for Carcinoma in Patients Older than 70 Years.” Ann Surg Oncol 9, 210-214. [116] Saltzman J.R. 2003. „Endoscopic and Other Staging Techniques.” Sem Thor & Cardiovasc Surg 15, 180-186. [117] Sandler R.S.; Nyren O.; Ekbom A.; [et al.]. 1995. „The risk of esophageal cancer in patients with achalasia: apopulation-based study.” JAMA 274, 1359-1362. [118] Sarbia M.; Gabbert H.E. 2000. „Modern Pathology: Prognostic Parameters in Squamous Cell Carcinoma.” In: Lang J.; Siewert J.R. (Hrsg.). 2000. Esophageal Carcinoma: State of the Art (Recent Results in Cancer Research; 155). Heidelberg, 15-28. [119] Shaheen N.; Randsohoff D.F. 2002. „Gastroesophageal reflux, Barrett esophagus, and esophageal cancer: scietific review.” JAMA 287, 1972-1981. [120] Siewert J.R.; Stein H.J. 2001. „Speiseröhre.“ In: Siewert J.R. (Hrsg.). Chirurgie. 7. überarbeitete Auflage. Berlin; Heidelberg; New York, 555-578. [121] Siewert J.R.; Stein H.J.; Feith M.; [et al.]. 2000. „Histologic Tumor Type is an Indipendent Prognostic Parameter in Esophageal Cancer: Lessons from more than 1000 consecutive resections at a singele center in the western world.” Ann Surg 234, 360-369. [122] Sihvo E.I.T.; Salminen J.T.; Rämö O.J. „The epidemiology of oesophageal AC.” Scand J Gastroenterol 10, 1082-1086. [123] Spiessel B.; Beahrs O.H.; Hermanek P.[et al.]. (Hrsg.). 1990. TNM-Atlas: Illustrierter Leitfaden zur TNM/pTNM-Klassifikation maligner Tumoren. Berlin; Heidelberg; New York. 118 [124] Stathopoulus G.P.; Tsiaras N. 2002. „Epidemiology and pathogenesis of esophageal cancer: Management and its controversial results (Review).” Oncology Report 10, 449-454. [125] Stein H.J.; Sendler A.; Fink U.; [et al.]. 2000. „Multidisciplinary approach to esophageal and gastric cancer.” Surg Clin North Am 80, 659-682. [126] Stein H.J.; Siewert J.R. 2004. „Improved Prognosis of resected esophageal cancer.” World J Surg 28, 520-525. [127] Stein H.J.; von Rahden B.H.A.; Siewert J.R. 2004. „Survival after oesophagectomy for cancer of the oesophagus.” Langenbeck`s Archives of Surgery, Online-Version: http://springerlink.metapress.com/media/ ECXLUJXRLR3CC2NHXNBY/ Contributions/5/T/9/8/5T98B8K18WK2WRB9_html/fulltext.html (25.09.2004.) [128] Stewart B.W.; Kleihues P. (Hrsg.). 2003. World Cancer Report. Lion. [129] Stilidi I.; Davydov M.; Bohhyan V.; [et al.]. 2002. „Subtotal esophagectomy with extended 2-field lymph node dissection for thoracic esophageal cancer.” Europ J Cardio-Thorac Surg 23, 415-420. [130] Swanson S.J.; Batirel H.F.; Bueno R.; [et al.]. 2001. „Transthoracic Esophagectomy with radical mediastinal and abdominal lymph node dissection and cervical esophagogastrostomy for esophageal carcinoma.” Ann Thorac Surg 72, 1918-1925. [131] Reed C.E. [et al.].1999. „Surgical management of esophageal carcinoma.” Oncologist 4, 95-105. [132] Riede U. N.; Werner M.; Schäfer H.E. (Hrsg.). 2004. Allgemeine und spezielle Pathologie. 5. komplett überarbeitete Auflage. Stuttgart, 678-680. [133] Rogers M.A.M.; Vaughan T.L.; Davis S.; [et al.]. 1995. „Consumtion of nitrate, nitrite, and nitrosodimethylamine and the risk of upper aerodigestive tract cancer.” Cancer Epidemiol Biomarkers Prev 4, 29-36. [134] Ruol A.; Stephens J.K.; Maiorana A.; [et al.]. 1987. „Expression of ras oncogene p21 in esophageal squamous cell carcinoma.” Surg Forum 38, 445. 119 [135] Tachibana M.; Kinugasa S.; Yoshimura H.; [et al.]. 2004. „En-bloc esophagectomy for esophageal cancer (Review).” Am J Surg 188, 254-260. [136] Tamim W.Z.; Davidson R.S.; Quinlan R.M.; [et al.]. 1998. „Neoadjuvant chemoradiotherapy for esophageal cancer.“ Arch Surg 133, 722-726. [137] Thomas R.J.; Lade S.; Giles G.G. ; [et al.]. 1996. „Incidence trends in oesophageal and proximal gastric carcinoma in Victoria.” Aust N Z J Surg 66, 271-275. [138] Tio L.N.; Cohen P.; Coene P.P.; [et al.]. 1989. „Endosonography and computed tomography of esophageal carcinoma.” Gastroenterol 96, 1478-1486. [139] Traverso L.W.; Shinchi K.; Low D.E. 2004. „Useful benchmarks to evaluate outcomes after esophagectomy and pancreaticoduodenectomy.” Am J Surg 187, 604-608. [140] Tsutsui S.; Moriguchi S.; Morita M.; [et al.]. 1992. „Multivariate analysis of postoperative complications after esophageal resection.” Ann Thorac Surg 53, 1052. [141] Tumorzentrum Freiburg (Hrsg.); Ruf G. (Red.); Farthmann E.H.; [et al.] 2001. Empfehlungen zur standartisierten Diagnostik, Therapie und Nachsorge des Ösophaguskarzinoms. Freiburg. [142] Tumorzentrum München (Hrsg.). 1998. Karzinome des Ösophagus und des gastroösophagealen Übergangs. http://www.krebsinfo.de/ki/empfehlung/gastro/S100.html (30.07.2003). [143] Urba S.G.; Orringer M.B.; Turrisi A.; [et al.]. 2001. „Randomized trial of preoperative chemoradiation versus surgery alone in patients with locoregional esophageal carcinoma.” J Clin Oncol 19, 305-319. [144] Urbach D.R.; Baxter N.N. 2004. „Does it matter what a hospital is high volume for? Specificity of hospital volumeoutcome associations for surgical procedures: analysis of administrative data.” BJM 328, 737-740. [145] Urschel J.D.; Vasan H.A. 2003. „A meta-analysis of randomized controlled trials that compared neoadjuvant chemoradiation and surgery to surgery alone for resectable esophageal cancer.” Am J Surg 185, 538-543. 120 [146] Wagner G.; Hermanek P.; Wittekind Ch.; Sinn H.P. 2002. Organspezifische Tumordokumentation – Prinzipien und Verschlüsselungsanweisungen für Klinik und Praxis. 2. Auflage. Online-Version: Deutsche Krebsgesellschaft, Frankfurt (Main). http://www. Krebsgesellschaft.de/html (30.7.2003). [147] Walsh T.; Noonan N.; Hollywood D.; [et al.]. 1996. „A comparison of multimodal therapy and surgery from esophageal adenocarcinoma.” N Eng J Med 335, 462-467 [Erratum, N Eng J Med 341, 384]. [148] Wijnhoven B.P.L.; Tilanus H.W.; Dinjens W.N.M. 2001. „Molecular Biology of Barrett`s Adenocarcinoma.” Ann Surg 233, 322-337. [149] Wittekind Ch.;. Meyer H.-J.; Bootz F. (Hrsg.). 2002. TNM-Klassifikation maligner Tumoren. Berlin; Heidelberg; New York. [150] Wu A.H.; Wan P.; Bernstein L. 2001. „A multiethnic population based study of smoking, alkohol and body size and risk of adenocarzinoma of the stomach and esophagus (United States).” Sem Thor & Cardiovasc Surg 15, 158-166. [151] Zang Z.F.; Kurtz R.C.; Marshall J.R. 1997. „Cigarette smoking and esophageal and gastric cardia adenocarcinoma.” J Natl Cancer Inst 89, 1247-1249. 121 7. Lebenslauf 1. Angaben zur Person Name: Hörth Vorname: Wolfram Johannes Geburtsdatum: 28.10.1974 Geburtsort: Kehl am Rhein Familienstand: ledig Vater: Gerhard Hörth, Realschullehrer Mutter: Birgit Hörth, Hausfrau 2. Schulische Ausbildung Grimmelshausenschule, Renchen 1981-1985 Heimschule Lender, Sasbach 1985-1994 Abitur Juni 1994 3. Zivildienst Janusz-Korczak-Schule zur Förderung geistig behinderter Kinder, Freiburg 1994-1995 4. Weiterer Bildungsweg Immatrikulation in den Fächern Indologie und Kunstgeschichte, Magisterstudiengang an der Albert-Ludwigs-Universität Freiburg Oktober 1995 Exmatrikulation mit dem Wunsche Medizin zu studieren Oktober 1997 Überbrückung der Wartezeit auf einen Studienplatz mit einem Italienaufenthalt und dem Besuch der Sprachschule Lingua Viva, Florenz April - Dezember 1998 122 5. Medizinstudium Immatrikulation im Fach Humanmedizin an der Justus-Liebig-Universität Gießen April 1999 – September 2001 Physikum September 2001 Immatrikulation im Fach Humanmedizin an der Eberhard Karls Universität Tübingen Oktober 2001 – März 2002 Immatrikulation im Fach Humanmedizin an der Albert-Ludwigs-Universität Freiburg seit März 2002 Erster Abschnitt der Ärztlichen Prüfung April 2003 Zweiter Abschnitt der Ärztlichen Prüfung März 2005 Praktisches Jahr am Universitätsklinikum Freiburg April 2005 – März 2006 Dritter Abschnitt der Ärztlichen Prüfung und Approbation als Arzt April 2006 123 8. Danksagung Mein Dank gilt in erster Linie Herrn Prof. Dr. med. Andreas Imdahl für die Überlassung des Themas, die gleichermaßen freundliche wie zuverlässige Betreuung und die Erstellung des Erstgutachtens und Herrn PD Dr. med. Florian Otto für die Übernahme des Zweitgutachtens. Herrn Prof. Dr. rer. nat. Jürgen Schulte-Mönting vom Institut für Medizinische Biometrie und Medizinische Informatik danke ich sehr für seine Berechnungen und deren ausführliche Erläuterung. Herzlichen Dank natürlich auch an Frau Dipl.-Biol. Eva Fischer, wissenschaftliche Dokumentarin der Abteilung für Allgemeine und Viszeralchirurgie, für ihre vielfache Unterstützung und die praktische Hilfe im Umgang mit dem Computer, an Herrn Jörn Michels MA für die sorgfältige Durchsicht der Arbeit, sowie an meinen Kommilitonen Herrn cand. med. Philipp Grimsehl für seine Gesellschaft in den Arbeitspausen und für manch guten Rat.