Präsentation - GI
Werbung

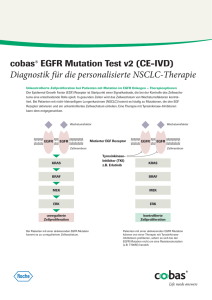
Neue Biomarker beim kolorektalen Karzinom – KRAS und dann? Thomas Kirchner Pathologisches Institut der LMU [email protected] Maßgeschneiderte Krebstherapie Krebspatienten Zielgerichtete Therapie Selektion therapiegeeigneter Krebspatienten nach Zielstruktur Antikörper (Ak) gegen EGFR Cetuximab oder Panitumumab zur zielgerichteten Therapie von Darmkrebs Antikörper gegen EGFR blockieren Bindung der Liganden Biomarker für den EGFR-Signalweg EGFR dimer EGFR – Expression P P STAT EGFR – Amplifikation cSrc KRAS Akt EGFR – Mutation BRAF KRAS – Mutation BRAF – Mutation PI3K – Mutation mTOR MEK MAPK Nucleus PTEN – Expression Harari PM et al (2007)J Clin Oncol 25:4057-65 Van Krieken H et al (2008) Virchows Arch 453:417-31 PI3K PTEN Biomarker für den EGFR-Signalweg im Dickdarmkarzinom EGFR – Expression EGFR – Amplifikation EGFR – Mutation KRAS – Mutation BRAF – Mutation PTEN – Mutation PI3K - Mutation Keine Korrelation zwischen EGFR-Expression und Therapieansprechen. Saltz LB et al. (2004) J Clin Oncol 22: 1201-08 Cunningham D et al.(2004) N Engl J Med 351: 337-345 Bechstein et al. : ASCO # 4091 (CELIM-Studie) (2009) Biomarker für den EGFR-Signalweg im Dickdarmkarzinom EGFR – Expression EGFR – Amplifikation Ras-Protein konstitutiv aktiv. Ras-Protein nicht konstitutiv aktiv. EGFR – Mutation KRAS–Mutation BRAF – Mutation PTEN – Mutation PI3K - Mutation Anti-EGFR-Therapie nicht effektiv. Anti-EGFR effektiv. Signalweg-Autonomisierung downstream von 1. Schubbert, S, et al.(2007) Nature Rev Cancer 7: 295-308. EGFR durch eine KRAS-Mutation 2. Benvenuti, S, et al. (2007) Cancer Res. 67: 2643-2648. 3. Yang, X-D, et al. (2001) Crit Rev Oncol Hematol. 38: 17-23. 4. Esteller, M, et al., (2001) J Clin Oncol. 19: 299-304. KRAS-Mutation = negativer prädiktiver Biomarker ORR (overall response rate) einer Anti-EGFR-Antikörpertherapie bei vorbehandelten Patienten mit metastasierten kolorektalen Karzinom Referenz Behandlung Patienten KRAS mut (n) KRAS wt ORR KRAS mut ORR Lievre et al.; JCO 2008 Cetux +/- CT 114 32% 44% 0% De Roock et al.; Ann Oncol 2008 Cetux +/- CT 113 41% 41% 0% Cappuzzo et al.; Br J Cancer 2008 Cetux +/- CT 80 53% 26% 10% Di Fiore et al.; Br J Cancer 2007 Cetux +/- CT 59 27% 28% 0% Khambata-Ford et al.; JCO 2007 Cetux 80 38% 10% 0% Karapetis et al.; NEJM 2008 BSC+/-Cetux 394 42 13% 1% Amado et al.; JCO 2008 Panitumumab 208 40 17% 0% Stintzing S, Heinemann V, Jung A, Moosmann, Hiddemann W, Kirchner T (2009) Dt Ärzteblatt 12: 202-206 ASCO Provisonal Clinical Opinion: Testing for KRAS Gene Mutations in Patients with Metastatic Colorectal Carcinoma to Predict Response to Anti-AGFR Monoclonal Antibody Therapy Carmen JA et. al. (2008) Based on systematic reviews of relevant literature, all patients with metastatic colorectal carcinoma who are candidates for anti-EGFR antibody therapy should have their tumor tested for KRAS mutations in a CLIA-accredited laboratory. If KRAS mutation in codon 12 or 13 is detected, then patients with metastatic colorectal carcinoma should not receive anti-EGFR antibody therapy as part of their treatment. Codon 12 und 13: > 98 % der KRAS-Mutationen im CRC Prädiktiver Biomarker KRAS-Mutation beim Dickdarmkarzinom THE TISSUE IS THE ISSUE! HE-Präparat Gewebe Paraffinblock KRAS-Statuskonkordanz Primärtumor/Fernmetast. > 90 % * Mikrodissektion Genomische DNA Sanger-Sequenzierung ARMS®-PCR Analytik PCR/Sequenzierung Van Krieken H., Jung A., Kirchner T. et al (2008) Virchows Arch 453: 417-31 * Gattenlöhner S. et al. (2009) Pathologe 30 (Suppl.1) Fr-123 Pyro®-Sequenzierung Qualitätgesicherter KRAS-Mutationstest durch QuIP-Ringversuche im deutschsprachigen Raum* Erfolgreiche Teilnahme 67 Einrichtungen für Pathologie in Deutschland *Finanzierung mit Unterstützung durch AMGEN GmbH 2008 durch AMGEN GmbH und Merck-Pharma 2009 Entwicklung der Diagnostik zur Anti-EGFR-Therapie des Dickdarmkarzinoms: mögliche prädiktive Biomarker EGFR dimer BRAF – Mutation (bis 10%) PP STAT KRAS cSrc Akt BRAF PI3K – Mutation (bis 12%) PTEN – Loss (bis 35%) mTOR MEK MAPK Nucleus PI3K PTEN Patienten mit KRAS-Wildtyp und BRAF (V600E)-Mutation zeigen ein signifikant geringeres progressionsfreies Überleben sowie Gesamtüberleben unter Cetuximab oder Panitumumab Therapie n=78 → davon BRAF-wt: 68 (87 %) → davon BRAF mutiert: 11 (13 %) Di Nicolantonio F. et al. (2008) J Clin Oncol 26: 5705-5712 Abhängigkeit der Ansprechraten einer Therapie mit Cetuximab von KRAS- und BRAF-Mutationen Köhne C. et al.: ASCO # 4068 (Crystal-Studie) (2009) 1,91 (1,23-2,93) p=0,003 1,42 (0,9-2,02) p=0,055 Odds Ratios (95% CI) P(Cochran-MantelHaenszel test) 0,80 (0,44-1,45) p=0,46 Cetuximab+ FOLFIRI FOLFIRI 1,47 (0,17-12,44) p=0,76 KRASwt (n=348) KRASmt (n=192) CI: confidence interval; ITT: intention to treat; mt:: mutiert; wt: wildtyp BRAFwt (n=501) BRAFmt (n=28) PI3K Mutationen in Exon 9 (3 Mut.) oder Exon 20 (1 Mut.) und Nichtansprechen auf eine Anti-EGFR-Therapie Signifikante Korrelation Keine Korrelation Sartore-Bianchi et al. (2009) Cancer Res (2009) 69: 1851 108 Fälle davon 15 (14%) mutiert Prenen et al. (2009) Clin Cancer Res 15: 3184 200 Fälle davon 23 (12%) mutiert Der Verlust der PTEN-Proteinexpression ( durch Promoter-Methylierung oder Deletion) korreliert mit dem Ansprechen auf eine Cetuximab-Therapie PTEN positiv PTEN negativ PTEN-Immunhistochemie Nachweis der Korrelation • Diskordanz von Primärtumor u. Metastase Sartore-Bianchi (2009) Cancer Res 69 80 Fälle davon 32 (40 %) PTEN-Loss • Reproduzierbarkeit nicht gesichert Frattini (2007) Br J Cancer 97 27 Fälle davon 11 (41 %) PTEN-Loss Ergebnis von Genexpressionsprofilen: Hohe mRNA Expression von Amphiregulin oder Epiregulin korreliert mit längerem progressionsfreien Überleben nach Cetuximab-Therapie Epiregulin Khambata-Ford et al. (2007) J Clin Oncol 25: 3230 n = 110 Amphiregulin Prenen: ASCO # 4019 (2009) - 220 Fälle Jonker: ASCO # 4016 (2009) - 385 Fälle Prädiktive Biomarker für die Chemotherapie des kolorektalen Karzinoms Prädiktive Biomarker Prädiktion NachweisMethode Metaanalyse Retrospektive Studie FDA-Empfehlung RoutineEinsatz Mismatch-RepairDefect MSI-hoch Resistenz gegen 5-FU oder Capecitabin PCR, Sequenz. Paraffinblock Sargent (2008) J Clin Oncol 26 (Suppl) abstract 4008 Vor Monotherapie mit 5-FU oder Capecitabin ThymidilatSynthase (TS) hohe TS-Expression Resistenz gegen 5-FU oder Capecitabin qRT-PCR, Immunhisto. Paraffinblock Koopman (2009) Eur J Cancer (published online) (CAIRO-Study) Nein ERCC1Polymorphismen mit hoher Expression/ niedriger Expression Resistenz/ Empfindlichkeit für Oxaliplatin qRT-PCR oder PCR/Sequenz. Paraffinblock Koopman (2009) Eur J Cancer (published online) (CAIRO-Study) Nein UGT1A1*28Polymorphismus Neutropenie durch Irinotecantoxizität qRT-PCR oder FDA-Empfehlung PCR/Sequenz. zur Dosisreduktion Paraffinblock von Irinotecan bei UGT1A*28 Vor hochdosierter Irinotecan-Gabe Fazit für die Routine KRAS-Mutation einziger etablierter prädiktiver Biomarker für das metastasierte CRC ● plausible biologische Grundlage ● sehr hoher negativ prädiktiver Wert ● robuster, qualitätsgesicherter Nachweis Walther A. et al : Genetic and prognostic predictive markers in colorectal cancer. Nature Reviews Cancer, published online 18 June 2009 Wann ist der KRAS-Mutationstest indiziert? Synchron metastasiertes CRC (primär Stadium IV) → Routine-Testung jedes Primärtumorresektats (KRAS-Test en principe) Metachron metastasiertes CRC (sekundär Stadium IV) → Retrospektive Testung des Primärtumorresektats bei geplanter Anti-EGFR-Therapie (selektiver KRAS-Test) Diskussionsstand des IX. Expertenworkshop „Gastrointestinale Tumoren“ vom 5.-7.02.2009 im Schlossgut Oberambach, Münsing unter Leitung von H.J.Schmoll und W. Schmiegel