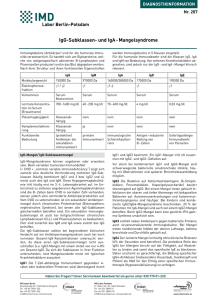
Konzentrationen der Immunglobuline IgG1, IgG2 und IgM im
Werbung

Tierärztliche Hochschule Hannover Konzentrationen der Immunglobuline IgG1, IgG2 und IgM im peripartalen Zeitraum bei Hochleistungsmilchkühen unter Berücksichtigung der Energiebilanz sowie der Fütterung mit konjugierten Linolsäuren INAUGURAL-DISSERTATION zur Erlangung des Grades einer Doktorin der Veterinärmedizin - Doctor medicinae veterinariae (Dr. med. vet.) vorgelegt von Jana Horn Bückeburg Hannover 2013 Wissenschaftliche Betreuung: Prof. Dr. Gerhard Breves Physiologisches Institut 1. Gutachter: Prof. Dr. Gerhard Breves 2. Gutachter: Prof. Dr. Jürgen Rehage Tag der mündlichen Prüfung: 15.11.2013 Mit freundlicher Unterstützung der H. Wilhelm Schaumann Stiftung sowie der Jutta und Georg Bruns-Stiftung Für Mama und Papa Inhaltsverzeichnis INHALTSVERZEICHNIS Abkürzungsverzeichnis ................................................................................................ I I. Einleitung ................................................................................................................. 1 1.1 Der Stoffwechsel der Milchkuh im peripartalen Zeitraum .................................. 1 1.2 Supplementierung der Futterration mit konjugierten Linolsäuren ...................... 6 1.3 Das Immunsystem ............................................................................................. 7 1.4 Immunglobuline des Rindes .............................................................................. 9 1.4.1 Immunglobulin G ......................................................................................... 9 1.4.2 Immunglobulin M ....................................................................................... 11 1.5 Verhalten der Immunglobuline im peripartalen Zeitraum ................................. 12 1.6 Immunisierung des neu geborenen Kalbes ..................................................... 15 II. Fragestellung ........................................................................................................ 18 III. Material und Methoden ........................................................................................ 19 3.1 Tiere ................................................................................................................ 19 3.2 Fütterung ......................................................................................................... 20 3.3 Blutprobenentnahme ....................................................................................... 23 3.4 Milchleistung, Milchprobenentnahme und -aufbereitung ................................. 24 3.5 Bestimmung von Immunglobulin-Isotypen mittels ELISA ............................... 25 3.6 ELISA zur Bestimmung des Gehaltes von IgG1, IgG2 sowie IgM im bovinen Plasma und im Kolostrum ..................................................................................... 26 3.6 Statistische Auswertung .................................................................................. 29 IV. Ergebnisse .......................................................................................................... 31 4.1 Verlauf der Plasma-Immunglobuline im peripartalen Zeitraum ........................ 31 4.1.1 Verlauf von Gesamt-IgG im Plasma .......................................................... 31 4.1.2 Verlauf von IgG1 im Plasma...................................................................... 32 4.1.3 Verlauf von IgG2 im Plasma...................................................................... 33 Inhaltsverzeichnis 4.1.4 Verlauf von IgM im Plasma ....................................................................... 34 4.2 Verlauf der Immunglobuline in Abhängigkeit der Laktationszahl .................. 35 4.3 Verlauf der Immunglobuline in Abhängigkeit der Fütterung ......................... 37 4.4 Energiebilanz (EB) ....................................................................................... 39 4.4.1 Zusammenhang zwischen Energiebilanz und Immunglobulingehalt im Plasma ............................................................................................................... 40 4.5 Milchleistung ................................................................................................ 42 4.6 Transfer der Plasma-Immunglobuline ins Kolostrum.................................... 43 4.7 Aufnahme kolostraler Immunglobuline durch das Kalb ................................ 47 V. Diskussion ............................................................................................................ 50 5.1 Immunglobulinbestimmung im Plasma ............................................................ 50 5.1.1 IgG-Bestimmung im Plasma...................................................................... 51 5.1.2 IgM-Bestimmung im Plasma ..................................................................... 56 5.2 Abhängigkeit der Ig-Plasmakonzentrationen von der Laktationszahl .............. 60 5.3 Abhängigkeit der Ig-Plasmakonzentrationen von der Fütterung ...................... 60 5.4 Abhängigkeit der Ig-Plasmakonzentrationen von der Energiebilanz ............... 62 5.5 Immunglobulinbestimmung im Kolostrum ........................................................ 63 5.5.1 Abhängigkeit der Immunglobulinkonzentrationen von der Laktationszahl . 64 5.6 Immunglobulinbestimmung im Plasma der Kälber .......................................... 66 VI. Zusammenfassung .............................................................................................. 67 VII. Summary ............................................................................................................ 69 VIII. Literaturverzeichnis ............................................................................................... i IX. ANHANG ............................................................................................................... a Verwendete Chemikalien ........................................................................................ a Originaldaten ......................................................................................................... 71 X. Danksagung ......................................................................................................... 71 Abkürzungsverzeichnis ABKÜRZUNGSVERZEICHNIS a.p. ante partum BHB β-Hydroxybutyrat Ca Kalzium CLA konjugierte Linolsäuren Co Cobald Cu Kupfer DMSO Dimethylsulfoxid EB Energiebilanz ECM energy corrected milk ELISA Enzyme linked immunosorband assay FCM fat corrected milk FFS freie Fettsäuren FPTA failure of passive transfer H2SO4 Schwefelsäure I Jod Ig Immunglobulin IFN- Interferon IGF Insulin-like Growth Factor IL- Interleukin IU international Units (internationale Einheiten) I Abkürzungsverzeichnis kDa Kilo-Dalton Lam. Lamina Mg Magnesium MHC major histocompatibility complex Mn Mangan mRNA messenger RNA Na Natrium NADPH Nikotinamid-Adenindinukleotid-Phosphat NEB negative Energiebilanz NEL Netto-Energie Laktation n.s. nicht signifikant OD optische Dichte P Phosphat PBMC periphere mononukleäre Zellen pIgR polymerischer Immunglobulinrezeptor PGF Platelet Growth Factor PMN polymorphkernige Monozyten p.p. post partum RER raues endoplasmatisches Retikulum Se Selen SEM Standardfehler sRid single radial immunodiffusion TGF Transforming Growth Factor II Abkürzungsverzeichnis Th-Zellen T-Helferzellen TMB Tetramethylbenzidin TNF- Tumornekrosefaktor T Trockensubstanz V. Vena Zn Zink III Abbildungsverzeichnis Abbildungsverzeichnis Abbildung 1: Molekularstruktur von Immunglobulin G............................................... 10 Abbildung 2: Molekularstruktur von Immunglobulin M .............................................. 11 Abbildung 3: Transport der Immunglobuline durch die Epithelzelle .......................... 13 Abbildung 4: Übersicht über die Laktationsanzahl .................................................... 19 Abbildung 5: Übersicht über die Probenentnahmen ................................................. 23 Abbildung 6:ELISA ................................................................................................... 26 Abbildung 7: Verlauf von Plasma-Gesamt-IgG bei Milchkühen der Rasse HolsteinFriesian im peripartalen Zeitraum ............................................................................. 31 Abbildung 8: Verlauf von Plasma-IgG1 bei Milchkühen der Rasse Holstein-Friesian im peripartalen Zeitraum ........................................................................................... 32 Abbildung 9: Verlauf von Plasma-IgG2 bei Milchkühen der Rasse Holstein-Friesian im peripartalen Zeitraum ........................................................................................... 33 Abbildung 10: Verlauf von Plasma-IgM bei Milchkühen der Rasse Holstein-Friesian im peripartalen Zeitraum ........................................................................................... 34 Abbildung 11: IgG1 im Plasma von Milchkühen der Rasse Holstein-Friesian in Abhängigkeit der Laktationszahl. .............................................................................. 35 Abbildung 12: IgG2 im Plasma von Milchkühen der Rasse Holstein-Friesian in Abhängigkeit von der Laktationszahl. ....................................................................... 36 Abbildung 13: IgM im Plasma von Milchkühen der Rasse Holstein-Friesian in Abhängigkeit von der Laktationszahl. ....................................................................... 36 Abbildung 14: IgG1 im Plasma von Milchkühen der Rasse Holstein-Friesian in Abhängigkeit der Fütterung unter Berücksichtigung der Laktation. .......................... 37 Abbildung 15: IgG2 im Plasma von Milchkühen der Rasse Holstein-Friesian in Abhängigkeit der Fütterung unter Berücksichtigung der Laktation. .......................... 38 Abbildung 16: IgM im Plasma von Milchkühen der Rasse Holstein-Friesian in Abhängigkeit der Fütterung. .................................................................................... 39 Abbildung 17: Verlauf der EB von Milchkühen der Rasse Holstein-Friesian über den gesamten Versuchszeitraum .................................................................................... 39 Abbildung 18: Verlauf der EB von Milchkühen der Rasse Holstein-Friesian in Abhängigkeit der Laktationsnummer. ....................................................................... 40 IV Abbildungsverzeichnis Abbildung 19: Übersicht über die Korrelationen zwischen EB und Immunglobulinspiegel im Plasma von Milchkühen der Rasse Holstein-Friesian an Tag -7 und Tag 7 für alle untersuchten Isotypen (IgG1, IgG2 und IgM). .................. 41 Abbildung 20: Verlauf der Milchleistung von Milchkühen der Rasse Holstein-Friesian über den Versuchszeitraum. ..................................................................................... 42 Abbildung 21: Verlauf der Milchleistung von Milchkühen der Rasse Holstein-Friesian in Abhängigkeit der Laktationszahl. .......................................................................... 43 Abbildung 22: Konzentrationen von IgG1, IgG2 und IgM im Kolostrum von Milchkühen der Rasse Holstein-Friesian. ................................................................. 44 Abbildung 23: Gehalt von Gesamt IgG im Kolostrum von Milchkühen der Rasse Holstein-Friesian in Abhängigkeit der Laktationszahl.. ............................................. 45 Abbildung 24: Gehalt von IgG1 im Kolostrum von Milchkühen der Rasse HolsteinFriesian in Abhängigkeit von der Laktationszahl. ...................................................... 45 Abbildung 25: Gehalt von IgG2 im Kolostrum von Milchkühen der Rasse HolsteinFriesian in Abhängigkeit von der Laktationszahl. ...................................................... 46 Abbildung 26: Gehalt von IgM im Kolostrum von Milchkühen der Rasse HolsteinFriesian in Abhängigkeit von der Laktationszahl. ...................................................... 46 Abbildung 27: IgG1-Plasmakonzentrationen von Kälbern der Rasse Holstein-Friesian ................................................................................................................................. 47 Abbildung 28: IgG2-Plasmakonzentrationen von Kälbern der Rasse Holstein-Friesian ................................................................................................................................. 48 Abbildung 29: IgM-Plasmkonzentrationen von Kälbern der Rasse HolsteinFriesian………………………………………………………………………………………49 V Tabellenverzeichnis Tabellenverzeichnis Tabelle 1: Normales und krankhaftes Lipomobilisationsgeschehen bei der Milchkuh 4 Tabelle 2: Verteilung der an Mastitis erkrankten Versuchstiere innerhalb der unterschiedlichen Fütterungsgruppen....................................................................... 20 Tabelle 3: Zusammensetzung der Futtermittel (%). ................................................. 21 Tabelle 4: Fütterungsdesign. .................................................................................... 22 Tabelle 5: Übersicht der aufgetragenen Verdünnungen ........................................... 28 Tabelle 6: Vergleich zwischen Literaturdaten und eigenen Messungen der Immunglobulinspiegel im Plasma a.p. ...................................................................... 59 Tabelle 7: Vergleich zwischen Literaturdaten und eigenen Messungen der Immunglobulinspiegel im Kolostrum ......................................................................... 65 Tabelle 8: Durchführung ELISA .................................................................................. b Tabelle 9: Verwendete Antikörper ............................................................................... c Tabelle 10: Übersicht über verwendete Lösungen ..................................................... d Tabelle 11: Zusammensetzung der verwendeten Puffer ............................................ e Tabelle 12: Originaldaten IgG1 (Plasma).................................................................. 71 Tabelle 13: Originaldaten IgG2 (Plasma).................................................................. 72 Tabelle 14: Originaldaten IgM (Plasma) ................................................................... 73 Tabelle 15: Originaldaten IgG1 (Plasma) und EB (Tier 1 bis 36) .............................. 74 Tabelle 16: Originaldaten IgG1 (Plasma) und EB (Tier 37 bis 66) ............................ 75 Tabelle 17: Originaldaten IgG2 (Plasma) und EB (Tier 1 bis 39) .............................. 76 Tabelle 18: Originaldaten IgG2 (Plasma) und EB (Tier 40 bis 66) ............................ 77 Tabelle 19: Originaldaten IgM (Plasma) und EB ....................................................... 78 Tabelle 20: Originaldaten Kolostrum (Tier 1 bis 59) ................................................. 79 Tabelle 21: Originaldaten Kolostrum (Tier 60 bis 66) ............................................... 80 Tabelle 22: Originaldaten Kälber IgG1 (Plasma) ...................................................... 80 Tabelle 23: Originaldaten Kälber IgG2 (Plasma) ...................................................... 81 Tabelle 24: Originaldaten Plasma Kälber IgM (Plasma) ........................................... 81 IV I. Einleitung I. EINLEITUNG 1.1 Der Stoffwechsel der Milchkuh im peripartalen Zeitraum Durch gezielte züchterische Ansätze sowie durch stetige Verbesserung von Haltung und Fütterung haben sich die Laktationsleistungen in der modernen Milchviehhaltung in den vergangenen fünf Jahrzehnten mehr als verdoppelt. JANINHOFF (2012) gibt in seiner Wirtschaftlichkeitsanalyse von 2009 – 2012 an, dass für eine rentable Milchwirtschaft Jahresleistungen von 8.000 bis 9.000 kg/Jahr erforderlich sind. Die Milchleistung weist während des Laktationszyklus einen charakteristischen Verlauf auf. Zu Beginn der Laktation steigt sie stark an, wobei maximale Tagesleistungen in der 7.-14. Laktationswoche erreicht werden. In dieser Zeit ist mit etwa 25 kg/Tag die maximale Trockenmasseaufnahmekapazität ausgeschöpft (BREVES u. RODEHUTSCORD 2007). Bei sehr hoher Milchleistung müsste das Tier zur Bedarfsdeckung aufgrund der begrenzten Aufnahmekapazität eine Energiekonzentration von mehr als 8 MJ Nettoenergie Laktation (NEL) aufnehmen. Diese hohen NEL-Konzentrationen können jedoch nicht erreicht werden, da über einen ausreichend hohen Anteil von Grundfutter auch die Strukturwirksamkeit und damit die Wiederkäuergerechtigkeit der Ration sichergestellt werden muss (INGVARTSEN u. ANDERSEN 2000; PETERSON et al. 2005; BREVES u. RODEHUTSCORD 2007). Neben den Grenzen der Energiedichte zeigt auch der freiwillige Verzehr im peripartalen Zeitraum charakteristische Veränderungen. PETERSON et al. (2005) konnten zeigen, dass sich in den letzten vier Wochen a.p. die Trockenmasseaufnahme um bis zu 50% reduzierte und erst zum Ende der vierten Laktationswoche eine Trockenmasseaufnahme von 22-24 kg/Tag erreicht wurde. Der Übergang von der Spätträchtigkeit zur Frühlaktation ist der Zeitpunkt der niedrigsten Trockenmasseaufnahme. In dieser Periode ist somit die Aufnahme der benötigten Energiemengen mit dem Futter nicht möglich. Folglich kommt es peripartal zur Ausprägung einer negativen Energiebilanz (NEB) mit starker Mobilisation von Körperfett. Die Auswahl der Grundfuttermittel kann bei hoher Leistung zwar noch einen Einfluss auf die NEL-Konzentration, die Energieaufnahme und damit auf das Ausmaß der 1 I. Einleitung Fettmobilisierung haben, dennoch ist die Entwicklung einer negativen Energiebilanz unvermeidlich. Diese kann unter Umständen bis zu 12 Wochen andauern (BULANG et al. 2006). Der Abbau von Körpersubstanz geht unter anderem mit der Bereitstellung von Metaboliten für die Milchfettsynthese einher. Allerdings kann eine hohe Milchleistung auch bei moderater Mobilisierung von Körperreserven erzielt werden (LEE u. KIM 2006; DUSKE et al. 2009; HAMMON et al. 2009; VAN DORLAND et al. 2009). Die Mechanismen, die dieser unterschiedlichen Anpassungsfähigkeit zugrunde liegen, sind zum jetzigen Zeitpunkt noch unbekannt. Der bei NEB vorliegende katabole Zustand führt zu charakteristischen Veränderungen hormoneller und chemischer Parameter. So kommt es zu einer Abnahme der Plasmakonzentrationen von Insulin, IGF-1, Leptin und Glukose und zu einer Zunahme der Plasmakonzentrationen von nicht-veresterten Fettsäuren (FFS) und β-Hydroxybutyrat (BHB) (BUTLER 2003). Gerade besonders hoch leistende Tiere befinden sich nun in einer labilen metabolischen Stoffwechsellage, die bei zusätzlichen peripartalen Belastungen wie Futterwechsel, Bewegungsmangel, Klimaschwankungen, Schwergeburten oder Vorerkrankungen (Labmagenverlagerung oder Mastitis) schnell entgleisen kann. (DIRKSEN et al. 2006). Die genannten Faktoren führen zu verminderter Futteraufnahme. Um den Energiebedarf für Erhaltung und Laktation decken zu können, muss der Organismus auf eigene Reserven zurückgreifen. Zur Energiegewinnung wird dem Intermediärstoffwechsel vermehrt Glukose entzogen. Die entstandene Hypoglykämie soll über eine vermehrte Glukoneogenese ausgeglichen werden. Dieses entzieht dem Citratzyklus jedoch Oxalactetat, das nun in der Leber als Reaktionspartner für die aus dem Fettstoffwechsel anfallenden C2Bruchstücke fehlt. Bei einer starken Anflutung freier Fettsäuren in der Leber und damit vermehrt stattfindender β-Oxidation entstehen aus dem biologisch aktivierten C2-Bruchstück Acetyl-Coenzym A nun sehr schnell Ketonkörper. Dieses geschieht gerade in der frühen Laktation in großem Umfang. Daher besteht die Gefahr der Entwicklung einer Ketose. Der Begriff Ketose beschreibt die Akkumulation von Ketonkörpern (β-Hydroxy-Butyrat, Acetoazetat und Aceton) in den Körperflüssigkeiten. Überschreitet das Ausmaß der Bildung der Ketonkörper dasjenige von Verbrauch und Ausscheidung, kann es zu Symptomen wie Gewichtsabnahme, Milchrückgang und zu einer Beeinträchtigung der Fruchtbarkeit 2 I. Einleitung kommen. Die Grenzwerte für eine subklinische Ketose liegen dabei bei 0,7 mmol*l -1 BHB für trockenstehende Kühe bzw. 1,4 mmol*l -1 BHB für frisch abgekalbte Kühe (DIRKSEN et al. 2006). Der Überschuss an nicht benötigten Fettsäuren wird v.a. bei überkonditionierten Tieren in der Leber gespeichert (MCNAMARA 2000). Die Hyperlipomobilisation kann zu einer die Funktion der Leber erheblich einschränkenden Hepatosteatose führen. Sind mehr als 30 % des Lebergewebes betroffen, kommt es zu einer Verschiebung des Gleichgewichts zwischen lipostabilisierenden und damit antiautoperoxidativen Substanzen und eingelagertem Fett (DIRKSEN et al. 2006). Die Gefahr der Membranschädigungen nimmt damit zu. Da überbelastetes Lebergewebe nicht mehr ausreichend Eiweiß produziert, kommt es zu einem Mangel an Apolipoprotein, welches für die Ausschleusung resynthetisierter Triglyzeride aus der Leber benötigt wird. Dies wiederum führt zu einer zunehmenden Hepatosteatose (DIRKSEN et al. 2006), die mit reduziertem Gesundheitsstatus, reduzierter Produktivität und verminderter Fruchtbarkeit in Verbindung gebracht werden kann (WENSING et al. 1997). Die Inzidenz einer Hepatosteatose ist eng assoziiert mit der Inzidenz anderer metabolischer Erkrankungen, v.a. Ketose und Labmagenverlagerung. Die Akkumulation von Lipiden in der Leber führt ebenfalls zu einer stärkeren Ausprägung und Schwere infektiöser Erkrankungen wie Mastitis (HILL et al. 1985) und Metritis (HARASZTI et al. 1982). Auch fieberhafte Allgemeininfektionen können gehäuft vorkommen (DIRKSEN et al. 2006). Durch lokale Durchblutungsstörungen kommt es zur Entstehung von Klauenerkrankungen, v.a. zu Klauenrehe (ONYIRO et al. 2008; KUJALA et al. 2010). Eine herabgesetzte Kontraktionsfähigkeit der Muskulatur kann zu Wehenschwäche sowie Puerperal- und Peristaltikstörungen (STENGÄRDE et al. 2012) führen. Des Weiteren werden bei Kühen, die eine ausgeprägte Fettleber besitzen, schlechtere Fruchtbarkeitsergebnisse erzielt (LÓPEZ-GATIUS et al. 2005; KAFI u. MIRZAEI 2010). Die herabgesetzte Immunität und Kontraktilität begünstigen eine gestörte Involution und Entzündungen der Gebärmutter. Außerdem führt der Energiemangel zu einem verzögerten Anlaufen der Ovaraktivität. Niedrige Konzentrationen an IGF-1, Insulin und Glukose hemmen Follikelwachstum und reifung (MARKUSFELD 1987; STEVENSON u. CALL 1988; REIST et al. 2003; BOSSAERT et al. 2008). 3 I. Einleitung Da die Leber das primäre Metabolisierungsorgan für Steroidhormone darstellt, resultiert aus der Steigerung der Leberperfusion eine erhöhte Abbaurate der Sexualsteroide, die bei unveränderter Syntheserate zu einer Abnahme der Konzentrationen an Sexualsteroiden im peripheren Plasma führt. Dies wiederum wird als Ursache einer verminderten Konzeptionsrate, einer verkürzten Oestrusdauer, des gehäuften Auftretens multipler Ovulationen und einer verminderten Eizellqualität diskutiert (WILTBANK et al. 2006). Eine Übersicht über die physiologischen und pathologischen Vorgänge innerhalb des Lipomobilisationsgeschehens gibt Tabelle 1. Tabelle 1: Normales und krankhaftes Lipomobilisationsgeschehen bei der Milchkuh (DIRKSEN et al. 2006) Normales Lipomobilisationsgeschehen Entgleisung des Energiestoffwechsels (Lipomobilisationssyndrom) unkontrollierte, zu energiereiche Fütterung während der u.U. verlängerten Trockenstehzeit (> 60 Tage), fehlende Bewegung Entwicklung übermäßiger Körperfettreserven a.p. peripartale Belastung/ Erkrankung extrem hohe Milchleistung Appetitrückgang Glukoneogenese ↓ überschießende Lipomobilisation hochgradige Verfettung der Leber (> 25 %) mit Funktionsstörung klinisch manifeste Ketose übermäßiger, auf Lipomobilisation und Eiweißfreisetzung beruhender, länger anhaltender Gewichtsrückgang verzögertes/ schwaches Einsetzen der Brunst herabgesetzte Fruchtbarkeit Zwischenkalbezeit > 380 Tage überwachte, „verhaltene“ Fütterung und mäßige körperliche Bewegung während der Trockenstehzeit (< 55 Tage) Ansammlung mäßiger Körperfettreserven a.p. gesundes, ungestörtes Puerperium gute Milchleistung gute, allmählich zunehmende Fresslust Glukoneogenese ↑ normale Lipomobilisationsrate leichte bis mäßige Leberverfettung (< 20 %) ohne Funktionsstörung keine/ subklinische Ketose normaler abkalbe-/laktationsbedingter Gewichtsrückgang normales Einsetzen der Brunst normale Fruchtbarkeit Zwischenkalbezeit < 370 Tage Im Gegensatz zu den leistungsbedingten Reproduktionsstörungen gibt es gegenwärtig keine fundierte Wissensgrundlage, um die Bedeutung der Milchleistung für das vermehrte Auftreten von infektiös bedingten Erkrankungen zu erklären. 4 I. Einleitung Allerdings kommt es in der peripartalen Periode zu Veränderungen verschiedener immunologischer Parameter, die sowohl das angeborene wie auch das adaptive Immunsystem betreffen. MEHRZAD et al. (2002) konnten zeigen, dass bei Kühen im peripartalen Zeitraum die Anzahl an neutrophilen Granulozyten im Blut signifikant reduziert ist. Weiterhin sind die Adhäsionsfähigkeit und die Migration der Zellen in die Milchdrüse beeinträchtigt. Interessanterweise weisen diese Zellen eine erhöhte phagozytotische Aktivität auf, was auf eine verbesserte funktionelle Aktivität schließen lässt. Allerdings zeigen diese Zellen eine verminderte „respiratory burst“-Fähigkeit, was in einer verminderten Eliminierungsrate für Bakterien resultiert. Die Eigenschaften von bovinen Lymphozyten in der peripartalen Periode wurden bereits von mehreren Arbeitsgruppen untersucht. KEHRLI und GOFF (1989) konnten beim Rind eine signifikante Reduktion des Vorkommens von T-Lymphozyten im Blut beschreiben. Funktionelle Studien zeigten weiterhin einen Wechsel von einer THelfer(Th)-1- zu einer Th2-Antwort (KEHRLI u. GOFF 1989). Die bei der Th2-Antwort produzierten immunregulatorischen Zytokine (v.a. IL-10 und TGF-β) haben nach einer Infektion die Aufgabe, die immunologische Homöostase wieder herzustellen, um Schäden am Tier einzugrenzen. Nachfolgende Arbeiten konnten zeigen, dass einige dieser immunsuppressiven Effekte einer NEB durch zusätzliche Fütterung hoch energetischer Substrate wie leicht fermentierbarer Kohlenhydrate umgekehrt werden konnten (STABEL et al. 2003; OHTSUKA et al. 2006). In einem Tierversuch, in dem jeweils 25 Milchkühe mit einerseits hohen FFSKonzentrationen a.p. und starker Fettmobilisation p.p. und andererseits mit niedriger FFS-Konzentration a.p. und geringer Fettmobilisation p.p. gehalten wurden, konnte MÖSCH (2011) keinen Einfluss der FFS-Konzentration a.p. bzw. der Fettmobilisation nach der Geburt auf den Verlauf der Immunglobulin(Ig)G-Konzentration zwischen dem 8. Tag a.p. und dem 56. Tag p.p. zeigen. Allerdings ist ein starker Anstieg der FFS-Konzentration zwischen Tag 8 a.p. und Tag 3 p.p. mit einer erniedrigten IgGKonzentration an Tag 3 p.p. verbunden (MÖSCH 2011). Die Autorin schloss daraus, dass eine stark erhöhte FFS-Konzentration zu Beginn der Laktation mit einer Abnahme der IgG-Konzentration korreliert. Allerdings hatten die Parameter BHB, Leptin, Rückenfettdicke und IGF-1 keinen signifikanten Einfluss auf die IgGKonzentration (MÖSCH 2011) 5 I. Einleitung 1.2 Supplementierung der Futterration mit konjugierten Linolsäuren Konjugierte Linolsäuren (CLA) sind Isomere der Linolsäure, die u.a. durch mikrobielle Fermentationsprozesse im Pansen (KEPLER et al. 1966) synthetisiert werden. Aufgrund ihrer Milchfett-reduzierenden Effekte (BAUMGARD et al. 2000) werden CLA häufig in Futterrationen für Milchkühe eingemischt. Milchfett macht etwa 50% der gesamten Milchenergie aus und entspricht somit dem größten Anteil des Energieverlustes über die Milch (TYRRELL u. REID 1965). Durch eine Supplementation mit CLAs soll erreicht werden, dass durch die eingesparte Energie der Ausbildung einer negativen Energiebilanz entgegengewirkt werden kann. Grundsätzlich haben Fettsäuren die Fähigkeit, Immunantworten durch Veränderung der Phospholipidzusammensetzung der Immunzellen zu modulieren und auch nachgeschaltete Signalwege zu beeinflussen (MILES u. CALDER 1998). Die Fütterung von pflanzlichen oder tierischen Ölen mit hohem Anteil an ungesättigten Omega-3-Fettsäuren reduziert inflammatorische Reaktionen und die Produktion von Interleukin (IL)-1, IL-6 und Tumornekrosefaktor-α (TNF-α) in verschiedenen Spezies (CALDER et al. 2002). Einige Studien haben bereits gezeigt, dass das bovine Immunsystem sensitiv auf Fettsäuren reagiert. So konnten LACETERA et al. (2001; 2002) sowohl beim Rind als auch beim Schaf zeigen, dass hohe Konzentrationen an FFS im Blut oder hohe Konzentrationen der selben Fettsäuren (Palmitat, Palmitoleat, Stearat, Oleat und Linoleat) im Kulturmedium mit einer Beeinträchtigung der Lymphozytenantwort auf Mitogene einhergehen. Der Anstieg der FFS im Blut als Konsequenz der Lipomobilisation könnte somit ein möglicher Grund für die in der Frühlaktation bestehende unzureichende Effektivität des Immunsystems während einer negativen Energiebilanz sein (KEHRLI et al. 2006). Weiterhin konnten THANASAK et al. (2005) in einer in vitro-Studie zeigen, dass bovine periphere Blutmonozyten (PBMC) in der Anwesenheit von mehrfach ungesättigten Fettsäuren funktionell beeinträchtigt werden. Aufgrund dieser Befunde sind die Auswirkungen einer Fettsäure-supplementierten Fütterung auf die Immunglobulinfraktionen besonders interessant und sollen in der vorliegenden Studie untersucht werden. 6 I. Einleitung 1.3 Das Immunsystem Das Immunsystem besteht aus einer Vielzahl von Zellen und Molekülen, die in der Lage sind, fremde, in den Organismus eindringende Mikroorganismen zu erkennen und zu eliminieren. In der Literatur unterscheidet man dabei die angeborene (unspezifische) Immunität von der erworbenen (spezifischen) Immunität. Rein funktionell ist diese Unterscheidung allerdings nicht möglich, da beide Systeme eng zusammenarbeiten. Das angeborene oder unspezifische Immunsystem ist schnell aktivierbar und dient im frühen Stadium einer Infektion als primäre Immunabwehr. Die unspezifische Abwehr wird von Phagozyten wie z.B. polymorphkernigen neutrophilen Granulozyten (PMN) und Makrophagen gebildet (RAINARD u. RIOLLET 2006). Makrophagen erkennen, phagozytieren und eliminieren unspezifische Fremdpathogene. Sie produzieren Zytokine wie IL-1β, IL-6 und TNF-α. Weiterhin sind sie in der Lage, über den Major Histocompatibility Complex (MHC) Klasse IIRezeptor Antigen zu präsentieren und bilden so die Verbindung zwischen angeborenem und spezifischem Immunsystem (RAINARD u. RIOLLET 2006). Nach der Einleitung der inflammatorischen Antwort sind die vorherrschenden Zellen am Infektionsherd v.a. PMN. Die Migration dieser Zellen aus dem Blut zum Ort der Entzündung wird als Chemotaxis bezeichnet (SURIYASATHAPORN et al. 1999). Am Entzündungsherd angekommen, phagozytieren sowohl PMN als auch ansässige Makrophagen eindringende Mikroorganismen und töten sie ab (PAAPE et al. 1991). Sobald ein Mikroorganismus phagozytiert ist, kommt es in aktivierten Makrophagen durch die Aktivierung einer NADPH-abhängigen Oxidase zum so genannten respiratory burst. Die Oxidase katalysiert die Reduktion von Sauerstoff zu einem hoch reaktiven Sauerstoff-Radikal, das für die aufgenommenen Bakterien hoch toxisch ist. Nach dem respiratory burst werden die aufgenommenen Bestandteile des Mikroorganismus über Exozytose ausgeschieden. Die spezifische Immunität besteht aus Antikörpern, Makrophagen (Antigenpräsentierenden Zellen) sowie B- und T-Lymphozyten, die spezifische Mikroorganismen erkennen (SORDILLO et al. 1997). Sie wird bei einer länger bestehenden oder persistierenden Infektion aktiviert. T-Zellen können in T-Helferzellen und zytotoxische T-Zellen eingeteilt werden. THelferzellen produzieren Zytokine wie IL-2 und Interferon (IFN)-γ, die für eine 7 I. Einleitung effektive zellvermittelte Immunantwort entscheidend sind. Zytotoxische T-Zellen erkennen und eliminieren mit Antigen infizierte Zellen sowie alte oder beschädigte Immunzellen. Die B-Lymphozyten differenzieren sich zu Plasmazellen, die Antikörper (Immunglobuline) wie IgG1, IgG2 oder IgM produzieren oder als Gedächtniszellen fungieren (SORDILLO et al. 1997). Sowohl die angeborene als auch die spezifische Immunabwehr haben eine umfassende Mechanismendiversität. Ihre Interaktion ermöglicht dem Organismus, zwischen Eigen- und Fremdmolekülen zu unterscheiden. 8 I. Einleitung 1.4 Immunglobuline des Rindes 1.4.1 Immunglobulin G IgG bildet mit 70-75 % des Gesamtimmunglobulins die im Serum hauptsächlich vorkommende Immunglobulinklasse und spielt aus diesem Grund eine Hauptrolle in der Antikörper-vermittelten Immunantwort. Es wird von Plasmazellen in der Niere, den Lymphknoten und dem Knochenmark produziert und sezerniert. IgG hat ein Molekulargewicht von 180 kDa und besteht aus zwei identischen leichten Ketten und zwei identischen schweren γ- Ketten. Durch ihre Anordnung zueinander entsteht die für Antikörper-Monomere typische Y-Struktur (Abbildung 1) (BUTLER 1983; TIZARD 2004). Da es das kleinste der Immunglobulinmoleküle ist, kann IgG am leichtesten aus den Blutgefäßen in das umliegende Gewebe austreten. Dies spielt v.a. im entzündeten Gewebe bei erhöhter Gefäßpermeabilität eine wichtige Rolle (BUTLER et al. 1972a, 1972b; BUTLER 1983). IgG bindet z.B. auf Bakterienoberflächen an spezifische Antigene. Die Anwesenheit der Antikörper auf der Bakterienoberfläche führt zur Agglutination und zur Opsonierung der Bakterien (CURTAIN et al. 1970). Man unterscheidet drei Subklassen bovinen IgGs: IgG1, IgG2 und IgG3. Die konstanten Domänen der Subklassen weisen eine 95%ige Homologie ihrer Aminosäuresequenzen auf. Die größten Unterschiede kommen dabei in der HingeRegion vor. Die Hinge-Region ist der Teil des Moleküls, der die schweren Ketten über Disulfidbrücken miteinander verbindet und somit die Flexibilität und Beweglichkeit des gesamten Moleküls bestimmt. So weist IgG1 im Gegensatz zu IgG2 eine sehr flexible Hinge-Region auf, die aus 216 – 231 Aminosäuren besteht. Die Fab-Fragmente, d.h. die „Arme“ des y-förmigen Moleküls, können um ihre Symmetrieachse rotieren. Die Hinge-Region des IgG2-Moleküls besteht aus nur 12 Aminosäuren und vier Disulfidbrücken und weist somit eine beschränkte Flexibilität auf (TIZARD 2004). Der unterschiedliche Aufbau der Immunglobulinsubklassen führt zu Unterschieden in Effektorfunktionen wie Komplementaktivierung und Fc-Rezeptor-Bindung. Die Subklassen weisen ebenso unterschiedliche biologische Aktivitäten auf. 9 I. Einleitung IgG1 ist das vorherrschende Immunglobulin in mukösen Sekreten des Rindes (CURTAIN et al. 1970) und ist sowohl im Kolostrum als auch im Speichel des Rindes konzentriert. Radioaktive Markerstudien (CURTAIN et al. 1970) haben gezeigt, dass der größere Anteil dieses Immunglobulins nicht aus dem Plasma stammt, sondern lokal synthetisiert wird. Immunfluoreszenzstudien weisen darauf hin, dass IgG1 von lymphoiden Zellen produziert wird, die in der Lam. propria und der Basis der Mikrovilli in der Schleimhaut des Darm-, des Atem- und Genitaltrakts nachgewiesen werden konnten. Zusätzlich gibt es einen selektiven Transportmechanismus für IgG1 aus dem Plasma. Im Gegensatz dazu stammt der größte Anteil des IgG2 in den mukösen Sekreten aus dem Plasmapool. Einen weiteren Hinweis auf den selektiven Transport von IgG1 im Vergleich zu IgG2 konnten CURTAIN et al. (1970) in einer Studie mit radioaktiv markierten Antikörpern liefern. Dort konnte gezeigt werden, dass der Transport und die initiale Eliminierung von IgG1 in vaginale Sekrete viel schneller verlief als der von IgG2. Abbildung 1: Molekularstruktur von Immunglobulin G 10 I. Einleitung 1.4.2 Immunglobulin M IgM wird von Plasmazellen in der Niere, in den Lymphknoten und im Knochenmark produziert. Es ist mit 5-15% des Gesamtimmunglobulins das am zweithöchsten konzentrierte Immunglobulin im Blut. Im Organismus kommt IgM in zwei unterschiedlichen Formen vor: als Monomer, als Teil des B-Zell-Rezeptors an die Zelloberfläche von B-Lymphozyten gekoppelt, sowie als im Serum lösliches Pemtamer. Letzteres stellt bei der Konfrontation mit einem Antigen den vorherrschenden Immunglobulinisotyp der Primärantwort dar. Zwar spielt IgM auch bei der sekundären Immunantwort eine Rolle, wird aber durch die dort vorherrschende Dominanz des IgG maskiert (TIZARD 2004). Das membranale IgM ist ein 180 kDa schweres Immunglobulin-Monomer, welches auf der B-Zell-Oberfläche als Antigenrezeptor fungiert. Das sekretorische IgM besteht aus fünf strukturell konventionell aufgebauten 180 kDa-Untereinheiten, die durch Disulfidbrücken in einer zirkulatorischen Form verbunden sind (Abbildung 2). Das absolute Molekulargewicht der sekretorischen Form beträgt 900 kDa. Ein kleines Polypeptid, die J-(joining)Kette (15 kDa), verbindet zwei der Einheiten, um den Kreis zu vervollständigen (BUTLER 1983; TIZARD 2004). Obwohl nur in geringeren Konzentrationen sezerniert, ist IgM effizienter als IgG, was Komplementaktivierung, Opsonierung, Virusneutralisation und Agglutination angeht. Aufgrund ihrer Größe können IgM-Pentamere auch bei akuten Entzündungen i.d.R. nicht ins Gewebe übertreten (TIZARD 2004). Abbildung 2: Molekularstruktur von Immunglobulin M 11 I. Einleitung 1.5 Verhalten der Immunglobuline im peripartalen Zeitraum In den letzten vier bis acht Wochen vor der Abkalbung kommt es beim Rind unter dem hormonellen Einfluss von Östrogen und Progesteron zu einem starken Abfall der Serumkonzentrationen von IgG und IgM. Die niedrigsten Serumspiegel werden dabei um den Geburtszeitpunkt herum erreicht (DETILLEUX et al. 1995; FRANKLIN et al. 2005). Etwa vier Wochen p.p. sind die Serumkonzentrationen von IgG1 wieder so hoch wie etwa fünf Wochen a.p., während die IgM-Konzentrationen zunächst niedrig bleiben. Diese Beobachtung spricht dafür, dass der erhöhte Transfer von IgG1 ins Euter so lange erhalten bleibt, bis die Serumkonzentrationen wieder im Normbereich liegen (SASAKI et al. 1976). Das Ausmaß der IgG-Reduktion scheint laut HERR et al. (2011) von der initialen IgGKonzentration beim Trockenstellen abhängig zu sein. Im Gegensatz zu IgM ist das Ausmaß der IgG-Reduktion mit der IgG-Konzentration im Kolostrum korreliert. BRANDON et al. (1971) zeigten, dass sich die Konzentrationen von IgG2 nicht signifikant verändern, während DETILLEUX et al. (1995) beobachten konnten, dass es um den Abkalbezeitpunkt zu einem Anstieg der IgG2-Konzentration im Serum kommt. Die Konzentration von IgG1 im Kolostrum ist zu Beginn der Sekretbildung etwa 11fach höher als die von IgG2 und erreicht ihr Maximum etwa zwei Wochen a.p. Nach der Geburt fällt die Konzentration von IgG1 in der Milch stark ab und ist etwa vier Wochen p.p. nur noch vier bis fünf Mal höher als die IgG2-Konzentration (BRANDON et al. 1971). Der schnelle Anstieg der IgG1-Konzentrationen im Serum am Ende der aktiven Kolostrumbildung spricht für eine sehr hohe Syntheserate von IgG1. BUTLER et al. (1972a; 1972b) konnten zum Zeitpunkt der Abkalbung einen Abfall der IgG1-Konzentrationen im Kolostrum und p.p. einen Anstieg dieses Proteins im Serum nachweisen. Diese Ergebnisse unterstützen die Vermutung, dass es zu einer Abnahme des selektiven Transports ins Euter kommt. Bei Eintritt der Milchproduktion kommt es zu einer Verdünnung der Immunglobulinkonzentrationen im Milchserum. Veränderungen im Verhältnis von IgG1 zu Gesamtprotein in Serum und Milch suggerieren, dass es zu einer Reduktion der selektiven Transportmechanismen kommt (BUTLER et al. 1972a; BUTLER et al. 1972b). Anders als bei IgG1 kommt es sowohl bei IgG2 als auch bei IgM im peripartalen Zeitraum im Serum und auch im Kolostrum nicht zu signifikanten Veränderungen der 12 I. Einleitung Konzentrationen. Dennoch ist die Konzentration von IgM im Kolostrum etwa 2-7 Mal höher als vergleichbare Werte im Serum (BRANDON et al. 1971). Diese höheren Konzentrationen könnten, wie bereits beim Schaf beschrieben (LEE u. LASCELLES 1970; MCDOWELL u. LASCELLES 1970) mit einer lokalen Synthese durch Plasmazellen zusammenhängen. Transportmechanismus durch Ebenfalls das wäre Drüsenepithel für IgM denkbar. ein selektiver Obwohl die Konzentrationen von IgG1 und IgG2 im Serum von Kühen etwa gleich hoch sind, ist IgG1 das vorherrschende Immunglobulin im bovinen Kolostrum. Es entstammt dem zirkulierenden IgG1-Pool des Serums und wird während der Kolostrumbildung zu einem Großteil über die Alveolarepithelzellen der Milchdrüse ins Kolostrum transportiert (BUTLER 1983). Bei diesem Mechanismus handelt es sich um einen aktiven und Rezeptor-vermittelten, selektiven Transport der Immunglobuline mittels zytoplasmatischer Vesikel (Abbildung 3) (BRANDTZAEG 1981). basolateral luminal Abbildung 3: Transport der Immunglobuline durch die Epithelzelle; • sekretorische Komponente 13 I. Einleitung BARRINGTON et al. (1997) konnten immunhistochemisch spezifische Anfärbungen für bovines IgG1 sowohl in Alveolarepithelien von hochtragenden Kühen als auch in Kolostrum-produzierendem Gewebe nachweisen. Studien von SASAKI et al. (1976) zeigten, dass die Menge der transportierten Immunglobuline etwa vier bis sechs Wochen a.p. zunimmt, so dass das Maximum der Transportkapazität kurz vor oder zum Zeitpunkt der Geburt erreicht wird. Dieser rapide Anstieg, v.a. von IgG1, ist von einer reduzierten Plasmakonzentration und einer verkürzten Lebensspanne der Immunglobuline begleitet und bezeichnet nicht nur eine akut erhöhte Syntheserate, sondern auch einen Transfer dieses Proteins aus Immunglobulinspeichern wie Milz und Lymphknoten in das periphere Blut (SASAKI et al. 1976). Nach der Abkalbung nimmt die Transportrate rapide ab und ist während der Laktation und in der frühen Trockenstehphase nur minimal (BLAKEMORE u. GARNER 1956; MACKENZIE u. LASCELLES 1968). Der Transportmechanismus bleibt jedoch in allen Phasen der Laktation funktionsfähig. Vermutlich besitzen die Alveolarepithelien zwei unterschiedliche Typen von IgG1-Rezeptoren: Rezeptoren mit niedriger Affinität, die während der Laktation ausgebildet werden und solche mit höherer Affinität, die etwa eine Woche a.p. erscheinen (SASAKI et al. 1976). LARSON et al. (1980) schlossen daraus, dass der erhöhte Immunglobulintransfer nicht durch den Vorgang des Trockenstellens der Kuh, sondern durch die herannahende Geburt eingeleitet wird. Dabei weist die Menge an Östrogen, das bei tragenden Kühen mit dem Urin ausgeschieden wird, einen engen Zusammenhang zur Transportkapazität der sekretorischen Epithelzellen für IgG1 auf. SMITH et al. (1971) konnten in einer Studie an nicht laktierenden, nicht tragenden Rindern zeigen, dass eine Applikation von Östrogen und Progesteron über sieben Tage zu einer Bildung von Sekret führt, dass in seiner Zusammensetzung dem physiologischen bovinen Kolostrum entspricht. Die Verschiebung von Serumprotein in die Milchdrüse scheint, verglichen mit IgG2 oder Serumalbumin, selektiv für IgG1 zu sein. Die Menge an IgG2 blieb unbeeinflusst von der Hormonapplikation und war im Vergleich zu IgG1 immer niedrig. KACSKOVICS et al. (2000) konnten bei Kühen ein Protein nachweisen, das als IgG-Fc-Rezeptor fungiert. Dieses Protein scheint für die Akkumulation von IgG und den selektiven und aktiven Transport aus dem Serum in das Lumen des Euters verantwortlich zu sein. 14 I. Einleitung Die bovine Milchdrüse sezerniert in allen Phasen der Laktation selektiv Serum-γGlobuline (IgG). Dieses findet jedoch verstärkt in der Phase der Kolostrumbildung statt, wenn die kolostralen IgG-Werte die des Serums um das bis zu Fünffache überschreiten (SASAKI et al. 1976). Dagegen gibt es kaum Unterschiede zwischen IgM in Kolostrum und Serum. Die Tatsache, dass der selektive Transport von IgG1 einer hormonellen Kontrolle zu unterliegen scheint, führt zu der Annahme, dass IgG1 nur eine kleine Rolle beim Schutz der Milchdrüse vor Infektionen spielt. MACKENZIE und LASCELLES (1968) zeigten, dass beim Schaf eine Infektion oder akute Entzündung den selektiven Transport von IgG1 in die Milchdrüse hemmt. 1.6 Immunisierung des neu geborenen Kalbes Im Gegensatz zu anderen Säugetieren, bei denen Immunglobuline bereits diaplazentar von der Mutter auf den Fetus übertragen werden und somit für einen passiven Schutz des Neugeborenen zum Zeitpunkt der Geburt sorgen, lässt die Plazenta epitheliochorialis des Rindes eine diaplazentare Aufnahme maternaler Antikörper nicht zu (BRAMBELL 1966; BUSH u. STALEY 1980). Kälber werden also nahezu ohne passiven Immunschutz geboren und sind daher nach der Geburt auf eine möglichst zeitnahe und ausreichende Aufnahme von Antikörpern aus dem Kolostrum angewiesen, um einen ersten spezifischen Schutz gegen Infektionserreger zu erhalten (ERHARD et al. 1999). Sowohl KLAUS (1969) als auch PIERCE (1955) konnten zeigen, dass Kälber bei der Geburt nicht vollständig agammaglobulinämisch sind, sondern bereits geringe Konzentrationen von IgG und IgM im Serum nachgewiesen werden können. Eventuell werden diese Mengen vom bovinen Fetus selbst synthetisiert, so wie es bereits beim Menschen (VAN FURTH et al. 1965) und auch bei Ratten und Hühnern (READE et al. 1965) beschrieben wurde. Es kann davon ausgegangen werden, dass die Bildung dieser Immunglobuline durch Antigenstimulierung des Fetus während der Trächtigkeit induziert wird. Es ist bekannt, dass bovine Feten bereits pränatal auf spezifische Pathogene mit einer Immunantwort reagieren (KOBAYASHI u. TIZARD 1976). Nach der Kolostrumaufnahme bis zur 12. Stunde p.p. steigen die IgG- und IgMSpiegel beträchtlich an. Dabei ist die Korrelation zwischen den IgG- und IgM15 I. Einleitung Konzentrationen im Serum 24 Stunden p.p. und dem IgG- bzw. IgM-Gehalt im Kolostrum hoch signifikant (BENDER u. BOSTEDT 2009). Die Absorption kolostraler Immunglobuline aus dem Gastrointestinaltrakt (v.a. Jejunum und Ileum) neugeborener Kälber ist ein unselektiver Prozess. IgG und IgM werden i.d.R. gleichwertig gut aufgenommen. PIERCE und FEINSTEIN (1965) kamen zu dem Schluss, dass der Intestinaltrakt des neugeborenen Kalbes verschiedene Proteine mehr oder weniger wahllos absorbiert. Das neugeborene Kalb ist in der Lage, aufgrund der niedrigen proteolytischen Aktivität seines Darminhaltes und des Vorkommens von Trypsininhibitoren im Kolostrum die aufgenommenen Immunglobuline unzerstört zu absorbieren. Die Absorption wird durch einen pinozytischen Mechanismus der Mukosazellen vom fetalen Typ ermöglicht. Diese Zellen werden nach und nach durch ausgereifte Zellen ersetzt, die die Fähigkeit der pinozytischen Absorption verloren haben (SMEATON u. SIMPSON-MORGAN 1985). BUSH und STALEY (1980) zeigten, dass der Prozess, aufgrund dessen das Darmepithel seine Permeabilität für die Antikörper verliert („gut closure“; CLOVER u. ZARKOWER (1980)), etwa 12 Std. p.p. eingeleitet und durchschnittlich 24 Std. p.p. abgeschlossen ist. Danach ist der passive Transfer von Antikörpern nahezu unmöglich. Die Abnahme der Absorptionsfähigkeit der intestinalen Mukosa tritt schrittweise auf Geschwindigkeit. und variiert Nach KIM für und die unterschiedlichen SCHMIDT (1983) tritt Isotypen der in ihrer Schluss der Darmschranke für IgM erheblich früher ein als für IgG. Außerdem bleibt IgM aufgrund seiner Größe länger zwischen den Mikrovilli im intestinalen Lumen hängen und wird somit erst mit einiger Verspätung resorbiert. Eine ungenügende Kolostrum- und somit auch Immunglobulinaufnahme führt zu einer erhöhten Morbiditäts- und Mortalitätsrate, verursacht durch klassische Kälbererkrankungen wie Septikämie, Diarrhoe, Pneumonie und Omphalophlebitis (MCGUIRE et al. 1976; REA et al. 1996). In diesem Zusammenhang hat sich in der englischsprachigen Literatur der Begriff des „Failures of passive tranfer of antibodies (FPTA)“ durchgesetzt (GAY et al. 1983; BESSER u. GAY 1994). Gründe für einen unzureichenden Transfer von Immunglobulinen können in Mängeln bei der Geburtsüberwachung, einem schlechten Gesundheitszustand der Muttertiere und bei den Neugeborenen selbst liegen (Unreife, intestinale Malabsorption) (VOGELS et al. 2013). Untersuchungen 16 I. Einleitung von McGUIRE et al. (1976) konnten zeigen, dass bei 69 % der in der ersten Lebenswoche verendeten Kälber ein Immundefizit vorliegt. Ebenso weisen nach REA et al. (1996) IgG-defiziente Kälber ein höheres Sterblichkeitsrisiko auf. Mit zunehmendem Abbau der maternalen Antikörper muss das Kalb nach entsprechendem Antigenkontakt mit der Eigensynthese von spezifischen Antikörpern beginnen. Die aktive eigene Immunität ersetzt somit den schwindenden passiven maternalen Immunschutz. Nach Untersuchungen von WITTUM und PERINO (1995) und PERINO (1995) gilt ein Serum IgG-Gehalt von 16 mg*ml-1 24 Std. nach der Geburt als ausreichend. Unter der Voraussetzung, dass das neugeborene Kalb innerhalb der ersten 12 – 15 Lebensstunden zwei Kolostrumgaben von jeweils 2 l erhält, gilt ein Kolostrumgehalt von IgG von mindestens 50 mg*ml-1 als notwendig für die Ausbildung eines effizienten Immunschutzes (GUY et al. 1994; ARTHINGTON et al. 1997). 17 II. Fragestellung II. FRAGESTELLUNG Der peripartale Zeitraum ist für die Hochleitungsmilchkuh ein sehr sensibler Abschnitt, in dem das Tier hohen Belastungen ausgesetzt ist. Stoffwechselstörungen und Erkrankungen in diesem Zeitraum können sich auf die gesamte Laktation, die darauf folgende erneute Konzeption und damit auf die Nutzungsdauer des Einzeltieres negativ auswirken. HERR (2009) untersuchte bereits den Verlauf der Immunglobuline G und M im Plasma von Kühen in einem Zeitraum acht Wochen a.p. bis vier Wochen p.p. unter Berücksichtigung des Geburtsablaufs. Allerdings enthielt diese Studie keine Unterscheidung der einzelnen Immunglobulin-Isotypen. Weiterhin wurden keine Korrelationen zwischen der Ausprägung einer negativen Energiebilanz und dem Verlauf der Immunglobulintiter berechnet. Diese Studie soll daher im Hinblick auf die Auswirkungen der negativen Energiebilanz auf die Antikörperspiegel von IgG1 und IgG2 sowie IgM im Plasma und im Kolostrum bzw. der Milch des Muttertieres neue Erkenntnisse liefern. Außerdem soll anhand von Serumproben der Kälber die Übertragung der kolostralen Antikörper nachvollzogen werden. Da in dem Versuchsvorhaben täglich Futteraufnahme und Leistung des Einzeltieres erfasst wurde, konnte die Energiebilanz berechnet werden. Es sollte daher überprüft werden, ob ein kausaler Zusammenhang zwischen einer ausgeprägten negativen Energiebilanz und einem erhöhten Abfall der Immunglobulintiter hergestellt werden kann. Weiterhin wurde ein Teil der Probanden mit einer Linolsäure-supplementierten Diät gefüttert. Die Auswirkung einer Fütterung von ungesättigten Fettsäuren auf Immunzellen wurde bereits von verschiedenen Arbeitsgruppen untersucht (LACETERA et al. 2002; LACETERA et al. 2004b; LACETERA et al. 2004a; THANASAK et al. 2005; LACETERA et al. 2007). Die Auswirkung einer Fettsäuresupplementierten Fütterung auf die einzelnen Immunglobulinfraktionen scheint gerade in Hinblick auf die Ergebnisse der vorangegangenen Studien auf Zellebene besonders interessant und soll in der vorliegenden Studie ebenfalls untersucht werden. 18 III. Material und Methoden III. MATERIAL UND METHODEN 3.1 Tiere Das Tierkollektiv für die vorgelegte Untersuchung umfasste insgesamt 63 Rinder der Rasse Deutsche Schwarzbunte, die im Institut für Tierernährung des FriedrichLöffler-Institutes in Braunschweig gehalten wurden. Das Alter der Tiere betrug durchschnittlich 3,5 ± 1,5 Jahre (2 bis 9 Jahre). Die durchschnittliche Laktationszahl der Versuchstiere betrug 2,3 ± 1,2 Laktationen. Die Auswahl, Haltung und Fütterung der Tiere sowie das Schema zur Probenentnahme ist im Detail bei Petzold et al. (2013) beschrieben. Nach der Laktationszahl verteilten sich die untersuchten Tiere wie folgt: 25 Tierzahl 20 15 10 5 0 1. 2. 3. 4. 5. Anzahl der Laktationen 7. Abbildung 4: Übersicht über die Laktationsanzahl Die Gruppeneinteilung erfolgte anhand der Parameter Milchleistung in der vorausgegangenen Laktation, Lebendmasse und Laktationsnummer. Hierbei wurde auf eine gleichmäßige Verteilung der Versuchstiere nach BCS, Lebensmasse und Erstlaktation in allen Gruppen geachtet. Von den Versuchstieren erkrankten sieben Tiere postpartal an Ketose, fünf an Milchfieber und 28 an Mastitis, davon zwölf mehrfach. Dabei stammten 75% der an Mastitis erkrankten Tiere aus den CLA-Gruppen. Die Tiere wurden dem jeweiligen 19 III. Material und Methoden Krankheitsbild entsprechend behandelt. Bei der Darstellung der Immunglobulingehalte im maternalen Plasma als Funktion der Zeit wurde überprüft, ob durch Proben der Tiere mit Mastitis diese Zeitverläufe beeinflusst wurden. Da diese Effekte statistisch nicht nachzuweisen waren, wurde auf die Elimination der Proben von erkrankten Tieren verzichtet. Eine Tötung aufgrund vorangegangener Krankheit erfolgte bei fünf Tieren, von denen jeweils eines aufgrund von Milchfieber, Mastitis und Fremdkörpererkrankung euthanasiert wurde und zwei aufgrund von Mastitis zur Schlachtung freigegeben wurden. Tabelle 2: Verteilung Fütterungsgruppen. der an Mastitis erkrankten Versuchstiere innerhalb der unterschiedlichen Mastitis Rezidivierende Mastitiden CLA-20 7 4 CLA-60 5 4 KON-20 3 2 KON-60 - 2 Die Geburtsverläufe verliefen über den gesamten Versuchszeitraum ohne besondere Schwierigkeiten. Insgesamt wurden 28 männliche und 34 weibliche Kälber geboren. Ein Kalb kam als Totgeburt zur Welt. Nach der Abkalbung verblieben die Kälber für 16 bis 24 Stunden bei ihren Muttertieren und hatten während dieser Zeit die Möglichkeit, Kolostrum ad libitum aufzunehmen. Die genaue Menge an aufgenommenem Kolostrum konnte nicht dokumentiert werden. Nachdem die Kälber von ihren Muttertieren getrennt wurden, wurden sie mit handelsüblichem Milchaustauscher versorgt. 3.2 Fütterung Die Versorgung der Tiere mit Energie und Nährstoffen wurden entsprechend der Empfehlungen der GfE (2001) vorgenommen. Alle Tiere erhielten eine Mischration, die im Versuchsverlauf aus variierenden Anteilen Kraftfutter (Grundmischung) und 20 III. Material und Methoden Silage (60% Mais- und 40% Grassilage auf Trockenmassebasis) zusammengesetzt wurde. Diese Mischration wurde ad libitum angeboten. Tabelle 3: Zusammensetzung der Futtermittel (%). CLA: konjugierte Linolsäuren, TMR trocken: totale Mischration für trocken stehende Kühe, TMR Lak: totale Mischration für laktierende Kühe Kontrolle CLA (Lutrell® TMR (Silafat®) Pure) trocken Rapsextraktionsschrot 20 20 20 20 Weizen 41 41 41 41 Sojaextraktionsschrot 6,5 6,5 6,5 6,5 Trockenschnitzel 25,5 25,5 30,5 30,3 2 2 2 - - - - 2 - - - 0,2 - 5,0 - - 5,0 - - - Futtermittel Mineralfuttermischung BASU 3800 Mineralfuttermischung BASU 243401 Futterkalk CLA-Gemisch (Luta CLA 20 P) Fettmischung (Grasso Sila Fat 2) TMR Lak Die Mineralfuttermischung für trocken stehende Kühe enthielt 60 g Ca, 105 g Na, 80 g P, 50 g Mg, 7000 mg Zn, 4800 mg Mn, 1250 mg Cu, 100 mg I, 40 mg Se, 30 mg Co, 800.000 IU Vitamin A, 100.000 IU Vitamin D 3 und 1.500 mg Vitamin E pro kg. Mit Beginn der Laktation bekamen die Tiere ein Mineralfutter mit 140 g Ca, 120 g Na, 70 g P, 40 g Mg, 6.000 mg Zn, 5.400 mg Mn, 1.000 mg Cu, 100 mg I, 40 mg Se, 25 mg Co, 1.000.000 IU Vitamin A, 100.000 IU Vitamin D 3 und 1.500 mg Vitamin E pro kg. Zusätzlich erhielten die Tiere eine Zulage von pansenstabilen konjugierten Linolsäuren, die in 2 kg Kraftfutter eingemischt wurden und den Tieren über eine Abrufstation zugänglich waren. Die Fettsäuren wurden dabei in das Kraftfutter eingepresst, um eine Entmischung zu vermeiden. Wasser stand den Kühen ad libitum zur Verfügung. Die Tiere waren in einem nicht klimatisierten Boxenlaufstall untergebracht. Die Kühe wurden in vier Versuchsgruppen eingeteilt und vor der Abkalbung mit Rationen mit hohem und niedrigem Kraftfutteranteil jeweils mit und ohne Zusatz von 21 III. Material und Methoden 10 g trans-10, cis-12-CLA/Tag und 10 g cis-9, trans-11-CLA/Tag gefüttert (enthalten in 100 g CLA-Gemisch, Lutrell® Pure, BASF SE, Ludwigshafen) bzw. mit 100 g einer pansenstabilen Kontrollfettmischung auf Stearinsäurebäsis (Silafat®, BASF SE, Ludwigshafen). Nach der Abkalbung wurde der Versuch weitergeführt, wobei dann alle Tiere im gleichen Verhältnis mit Grund- und Kraftfutter versorgt wurden. Ab Tag 31 p.p. wurden die ursprünglichen CLA-Gruppen ein weiteres Mal aufgeteilt. Jeweils acht Tiere wurden weiterhin mit CLA substituiert, während die anderen acht Tiere stattdessen mit Kontrollfett gefüttert wurden (Tabelle 4). Der hohe Kraftfutteranteil in den letzten Wochen der Trächtigkeit sollte eine präpartale Prädisposition für eine deutlich ketogene Stoffwechsellage post partum provozieren, um auf dieser Grundlage im Vergleich zu einer angepassten Fütterung mit niedrigem Kraftfutteranteil die Wirkungen der CLA besser untersuchen zu können. Tabelle 4: Fütterungsdesign. Legende: Kon: Fütterung mit Kontrollfett auf Stearinsäurebasis. CLA: Supplementierung mit 100 g konjugierten Linolsäuren/Tag. Versuchsperiode I: -20: 20% Kraftfutter in der Ration (Versuchsperiode I). -60: 60% Kraftfutter in der Ration Versuchsperiode II: 50% Kraftfutter in der Ration (alle Fütterungsgruppen). Versuchsperiode III: B: keine Supplementierung mit CLA Zeitraum I Tag 21 bis 1 a.p. CLA KF Gruppe n (g/d) (%) II Tag 1 bis 30 p.p. CLA KF Gruppe n (g/d) (%) III Tag 31 bis 60 p.p. CLA KF Gruppe n (g/d) (%) Kon-20 16 0 20 Kon-20 16 0 50 Kon-20 16 0 50 Kon-60 15 0 60 Kon-60 15 0 50 Kon-60 15 0 50 CLA-20A 8 100 50 CLA-20 16 100 20 CLA-20 16 100 50 CLA-20B 8 0 50 CLA-60A 8 100 50 CLA-60B 8 0 50 CLA-60 16 100 60 CLA-60 16 22 100 50 III. Material und Methoden Zu Versuchsbeginn wurde die Lebendmasse aller Tiere bestimmt. Über den gesamten Versuchszeitraum erfolgte eine tierindividuelle Erfassung der Kraft- und Grundfutteraufnahme. Während der Laktation wurden zusätzlich die Parameter Milchleistung, Lebendmasse sowie wöchentlich die Bestimmung der Milchzusammensetzung (Fett, Eiweiß, somatische Zellzahl) erfasst. Zusätzlich wurden Milchproben für weitere Untersuchungen gesammelt. Die Berechnung der Energiebilanz erfolgte an den Tagen -7, 7, 14, 21, 42 und 56 relativ der Abkalbung nach folgender Formel: EB [mJ] = T-Aufnahme [kg/Tag]*NEL [mJ/kg] T des jeweiligen Futtermittels – 0,293 MJ NEL/kg KG0,75 – 3,17 MJ NEL/kg FCM. Dabei entspricht NEL der Nettoenergie Laktation und KG 0,75 dem metabolischen Körpergewicht. Für 1 kg FCM wurden 3,17 MJ NEL gerechnet. Lebendmasse, tägliche Futteraufnahme und Milchleistung wurden vor der Analyse der Daten zu wöchentlichen Mittelwerten zusammengefasst. 3.3 Blutprobenentnahme Die Blutprobenentnahme aus der V. jugularis erfolgte ab dem errechneten 259. Trächtigkeitstag an den in Abbildung 2 dargestellten Tagen. Die Plasma-Monovetten wurden bei 2000 g und 15°C für 15 min zentrifugiert (Varifuge 3.OR, Heraeus). Nach der Aliquotierung des Plasmas wurde es bei -18°C eingefroren. Von den Kälbern wurde ebenfalls Blut aus der V. jugularis gewonnen. Die Probennahme erfolgte hier unmittelbar nach der Geburt, noch vor Kolostrumaufnahme, dann unmittelbar nach Kolostrumaufnahme und am 42. Lebenstag (Abbildung 5). nach Kolostrumaufnahme vor Kolostrumaufnahme - 21 - 40 - 14 -7 -3 1 3 7 14 Geburt 21 28 42 56 60 Abbildung 5: Übersicht über die Probenentnahmen 23 III. Material und Methoden 3.4 Milchleistung, Milchprobenentnahme und -aufbereitung Die Milchleistung wurde ab Tag 7 p.p. über den gesamten Versuchszeitraum täglich erfasst. Vor Auswertung der Daten wurde ein wöchentlicher Mittelwert gebildet. Zur besseren Vergleichbarkeit ist die Milchleistung im Folgenden als fat corrected milk (FCM) dargestellt. Der FCM wurde nach folgender Formel berechnet (GAINES 1928): FCM [kg/Tag] = ((Milchfett [%] * 0,15) + 0,4) * Milchleistung [kg/Tag]. Die Milchprobenentnahme erfolgte jeweils morgens in den ersten sieben Tagen nach der Geburt sowie an Tag 14 und 21 p.p.. Es wurden etwa 250 ml Sekret gewonnen. Dabei handelt es sich um Sammelmilchproben aus allen Eutervierteln des jeweiligen Tieres. Die Milchproben wurden zunächst bis zu ihrer weiteren Verwendung bei -18°C eingefroren. Als Vorbereitung für den ELISA wurden die Milchproben für 2 x 10 min bei 18.670 g und 4°C zentrifugiert (RC-5C bzw. RC-5B Sorvall Superspeed Centrifuge, Dupont, Rotortyp: SS34). Nach der ersten Zentrifugation wurde das Milchfett abgenommen, dass sich durch das Zentrifugieren an der Oberfläche der Milch abgesetzt hatte. Anschließend wurde das verbliebene Milchserum noch einmal zentrifugiert und nach der zweiten Zentrifugation eventuelle Überstände aus Milchfett erneut verworfen. Die Milchproben wurden anschließend aliquotiert und bis zur weiteren Verwendung bei -18°C eingefroren. Vor der Herstellung der Verdünnungsreihe für den ImmunglobulinELISA wurden die Proben zunächst bei Raumtemperatur aufgetaut und dann bei 6.800 g für 5 Minuten bei Raumtemperatur zentrifugiert (Espresso-Zentrifuge, Thermo Scientific). 24 III. Material und Methoden 3.5 Bestimmung von Immunglobulin-Isotypen (IgG1 und IgG2 sowie IgM) mittels ELISA (enzyme-linked immunosorband assay) Bei dem so genannten „ELISA“ (enzyme-linked immunosorband assay) handelt es sich um einen Mikrotiterplattentest, der auf dem Nachweis spezifischer AntikörperAntigen-Komplexe beruht. Zunächst wird ein markerspezifischer Antikörper, der so genannte primäre Antikörper an einen festen Träger gebunden, z.B. in einer Polyvinylchlorid- oder Polystyrolplatte mit üblicherweise 96 Vertiefungen (so genannte 96-Well-Mikrotiterplatten). Proteine binden fest an die Polystyrolplatte, so dass nach der Entfernung ungebundener primärer Antikörper durch Waschen die Vertiefungen auf den Platten mit einer dünnen Schicht Antikörper bedeckt („gecoatet“) sind. Im Folgenden wird die Probe in verschiedenen Verdünnungsstufen auf das gebundene Material gegeben. Im nächsten Schritt wird ein sekundärer Antikörper dazugegeben, der spezifisch an die zu untersuchende Probe bindet. Der sekundäre Antikörper ist mit einem Enzym (z.B. alkalische Phosphatase (AP), Peroxidase oder Urease) gekoppelt, das die Umwandlung eines farbloses Substrats in ein farbiges Produkt katalysiert. Ungebundene sekundäre Antikörper werden durch Waschen wieder entfernt, danach wird das Substrat dazugegeben. Ist die antigene Zielsubstanz in der Probe vorhanden, bindet sie an den primären Antikörper und der sekundäre Antikörper bindet dann an ein anderes Epitop an der Probe. Das gekoppelte Enzym katalysiert eine Farbreaktion (siehe Abbildung 5). Die großen Vorteile dieses Testverfahrens sind die leichte Durchführung, die Möglichkeit der Automatisierung und die Messung der Farbtiefe in kurzer Zeit mit Hilfe eines Photometers. 25 III. Material und Methoden Abbildung 6:ELISA: (1): Coaten der Mikrotiter-Platte; (2): Beschichten der Platte mit den zu untersuchenden Proben (=Antigen); (3): Zugabe des Detektions-Antikörper + Substrat; (4): Zugabe der Stopplösung und Farbumschlag In Zusammenarbeit mit der Arbeitsgruppe für Immunologie der Tierärztlichen Hochschule Hannover wurde ein Sandwich-ELISA zur Bestimmung von bovinem Immunglobulin G1 und G2 sowie IgM verwendet (HUSSEN 2012). 3.6 ELISA zur Bestimmung des Gehaltes von IgG1, IgG2 sowie IgM im bovinen Plasma und im Kolostrum Zunächst wurden die Mikrotiterplatten (NUNC-Immuno Plate F96 Maxisorp) mit jeweils 75 µl Primärantikörper und Coating-Puffer pro Well beschichtet. Nach einer Inkubationszeit von 30 Minuten auf einem Schüttler (Heidolph Titramax 1000) wurden die gecoateten Platten über Nacht bei 4° C im Kühlschrank inkubiert. Im nächsten Schritt wurden die Platten gewaschen. Anschließend wurde der verbliebene Puffer abgeschüttet und die Platten auf mehreren Lagen Zellstoff trocken geklopft. 26 III. Material und Methoden Nun folgte die Belegung der Platten mit den zu messenden Proben. Vor der Herstellung der Verdünnungsreihe für den Immunglobulin-ELISA wurden die Proben bei Raumtemperatur aufgetaut. Die Herstellung einer Verdünnungsreihe ist notwendig, da der ELISA einer Sättigungskinetik folgt. Auch das Lambert-Beer‘scheGesetz gilt nur für Extinktionen in einem bestimmten Bereich (≤ 0,01 mol*l -1) (OTTO 2011). Somit ist die Aussagekraft des ELISAs bei hohen Antigenkonzentrationen eingeschränkt. Mittels einer Verdünnungsreihe kann ein Bereich gefunden werden, in dem belastbare Messungen durchführbar sind. Anschließend wurden die Proben durchmischt und mit einer Pipettenspitze die oft schon mit bloßem Auge sichtbaren Fibrinkoagula entfernt. Im Folgenden wurden die Proben bei 2383 g für 6 Minuten bei Raumtemperatur zentrifugiert (Labofuge 400, Heraeus, Rotortyp: 8172). Nach Titrationsversuchen zur Ermittlung der optimalen optischen Dichten (ODs) bei niedrigen Hintergrundwerten wurde eine Konzentration von 1 μg/ml sowohl für den Primärantikörper als auch für den Detektionsantikörper gewählt. Die idealen Verdünnungen, bei denen eine optimale Abstufung der ODs zu erkennen war, lagen zwischen 1x105 und 3x107 (Tabelle 5). Jede Probe wurde mit jeweils 75 µl/Well mit jeweils vier Verdünnungen/Probe im Doppelansatz aufgetragen (Tabelle 5). Auf jede Platte wurde außerdem das Referenzserum (Tabelle 9) im Doppelansatz aufgetragen. Die Platten wurden nun für eine Stunde auf einem Schüttler inkubiert und im Anschluss erneut gewaschen. Nach dem Trockenklopfen der Platten wurden sie mit 75 µl Detektionsantikörper/Well (Tabelle 9) beschichtet. Es folgte wiederum eine 45-minütige Inkubation auf dem Schüttler. Nach dem darauf folgenden Waschschritt wurden 75 µl einer Tetramethylbenzindin(TMB)-haltigen Substratlösung (6,24 mM/*l-1 in DMSO) auf die Platten gegeben. Nach einer Inkubationszeit von 15 – 20 Minuten bei Raumtemperatur unter Ausschluss von Tageslicht kam es aufgrund der Bildung von Enzym-SubstratKomplexen zwischen der Meerrettich-Peroxidase und dem TMB zu einem blauen Farbumschlag. Zum Stoppen der Reaktion wurden 50 µl 1 N H 2SO4 auf die Platte pipettiert, was zu einem gelben Farbumschlag führte. Die Farbintensität wurde in einem Plattenphotometer (ELISA-Reader Dynatech MR600 mit 2/86-PC und SeikoshNadeldrucker) bei einer Wellenlänge von 450 nm (Testfilter) und 630 nm 27 III. Material und Methoden (Referenzfilter) gemessen und als OD erfasst. Diese Dualmessung ermöglicht die Elimination von Messfehlern durch Schmutz, Kratzer oder Feuchtigkeit auf der Mikrotiterplatte. Die anschließende Auswertung erfolgt mit Hilfe eines Computerprogramms (MR5000 ELISA-Messung für MS DOS). Die logarithmierten Serumverdünnungen (X-Achse) wurden anschließend gegen die logarithmierten ODs (Y-Achse) aufgetragen. Die ELISA-Units unbekannter Proben wurden durch den Vergleich mit den Werten des Referenzserums (100 Units) im linearen Bereich als relative Werte angegeben und danach bezüglich der bekannten Immunglobulinkonzentrationen des Referenzserums in mg*ml -1 berechnet. Tabelle 5: Übersicht der aufgetragenen Verdünnungen Nachweis für: Verdünnungen Probe Verdünnungen Referenz IgG1 (Plasma) 105 3x105 106 3x106 105 3x105 106 3x106 IgG2 (Plasma) 106 3x106 107 3x107 105 3x105 106 3x106 IgG1 / IgG2 (Kolostrum) 3x105 106 3x106 107 3x105 106 3x106 107 IgM (Plasma) 3x105 106 3x106 107 3x105 106 3x106 107 28 III. Material und Methoden 3.6 Statistische Auswertung Die statistische Auswertung und Darstellung der Daten erfolgte mit den Computerprogrammen GraphPad Prism 5 (Graph Pad Software) und IBM SPSS Statistics 20 (IBM). Der Verlauf der Immunglobulinspiegel im Plasma wurde bis Tag 28 mittels multifaktorieller Varianzanalyse measurements (RM) „Laktationsnummer“ Zusätzlich wurde für der für ANOVA) die Fisher wiederholte zunächst einzelnen mit Beobachtungen den Faktoren Immunglobulin-Isotypen LSD-Test für den (Repeated Vergleich „Zeit“ und ausgewertet. der einzelnen Entnahmezeitpunkte miteinander angewendet. Zusätzlich wurden die Immunglobulinwerte der einzelnen Isotypen an den verschiedenen Zeitpunkten untereinander mittels einfaktorieller Varianzanalyse (OneWay ANOVA) verglichen. Da ab Tag 30 des Versuchsablaufes die Fütterung nochmals umgestellt wurde, wurden die letzten beiden Zeitpunkte (Tag 42 und Tag 56) ausschließlich mittels One-Way ANOVA verglichen. Um den Einfluss der Fütterung auf den Verlauf der Immunglobulin-Isotypen zu untersuchen, wurde ebenfalls bis Tag 28 eine multifaktorielle Varianzanalyse für die Faktoren „Zeit“, „Kraftfuttermenge a.p.“ und „Gruppe“ durchgeführt. Die Untersuchung der letzten beiden Entnahmezeitpunkte erfolgte wieder mittels OneWay ANOVA. Bei fehlenden Werten wurde bei der Berechnung der Zeitverläufe via RM ANOVA das betroffene Tier nicht mit berücksichtigt. Im Vergleich der Zeitpunkte miteinander wurden allerdings lediglich die fehlenden Werte ausgelassen. Die Auswertung der Immunglobulinspiegel im Kolostrum erfolgte ebenfalls mittels One-Way ANOVA. Um einen Unterschied zwischen den einzelnen Isotypen zu ermitteln, wurde eine One-Way ANOVA für wiederholte Beobachtungen durchgeführt. Die Plasmaproben der Kälber wurden ebenfalls mit einer One-Way ANOVA analysiert. Um zu überprüfen, ob ein Zusammenhang zwischen der Ausprägung der negativen Energiebilanz und der Höhe der Immunglobulinspiegel besteht, wurden an den jeweiligen Entnahmezeitpunkten lineare Korrelationen berechnet. 29 III. Material und Methoden In den folgenden Kapiteln werden in den Darstellungen jeweils arithmetische Mittelwerte (x‾ ) und entsprechende Standardfehler (SEM) angegeben. Für die Signifikanzangaben gilt Folgendes: n.s. nicht signifikant p < 0,05 * schwach signifikant p < 0,01 ** signifikant p < 0,001 *** hoch signifikant 30 IV. Ergebnisse IV. ERGEBNISSE 4.1 Verlauf der Plasma-Immunglobuline im peripartalen Zeitraum 4.1.1 Verlauf von Gesamt-IgG im Plasma Zwischen dem Ende des 8. Monats der Trächtigkeit und der Zeit unmittelbar a.p. kam es zu einem Abfall der intravasalen IgG-Konzentration (19,85 ± 1,45 mg*ml -1 auf 14,91 ± 1,68 mg*ml-1). Unmittelbar nach der Geburt stiegen die IgG-Werte wieder an und erreichten an Tag 21 mit 18,07 ± 1,51 mg*ml -1 die Ausgangskonzentration. Am Ende des Versuchszeitraums sank der IgG-Spiegel noch einmal leicht bis auf einen Wert von 14,58 ± 1,30 mg*ml -1 ab. Gesamt IgG [mg*ml-1] 25 a 20 ab ac abcd abc abcd abc abcd bcd bd abcd 15 10 d 5 0 -20 0 20 40 60 Tage Abbildung 7: Verlauf von Plasma-Gesamt-IgG bei Milchkühen der Rasse Holstein-Friesian im peripartalen Zeitraum (n=63). Angaben als arithmetischer Mittelwert mit Standardfehler (SEM). RM One-Way ANOVA; Tukey Post Test: Zeiteffekt: ***; Unterschiedliche Buchstaben stehen für signifikant unterschiedliche Mittelwerte 31 IV. Ergebnisse Da sich das intravasale Gesamt-IgG aus den Isotypen IgG1 und IgG2 zusammensetzt, werden im Folgenden die einzelnen Isotypen separat dargestellt. 4.1.2 Verlauf von IgG1 im Plasma Zwischen dem Messungen zu Beginn des Versuchs und unmittelbar peripartal sank die IgG1-Konzentration von 8,21 ± 0,77 mg*ml -1 auf 2,90 ± 0,27 mg*ml -1. Bis zum Ende des Versuchs wurde mit IgG1-Spiegeln von 8,34 ± 1,26 mg*ml -1 die Ausgangskonzentration wieder erreicht. 12 IgG1 [mg*ml-1] 10 a 8 a a a ab ab abc 6 bcd bcd 4 d cd 2 d 0 -20 0 20 40 60 Tage Abbildung 8: Verlauf von Plasma-IgG1 bei Milchkühen der Rasse Holstein-Friesian im peripartalen Zeitraum (n=63). Angaben als arithmetischer Mittelwert mit Standardfehler (SEM). RM One-Way ANOVA; Tukey Post Test: Zeiteffekt: ***; Unterschiedliche Buchstaben stehen für signifikant unterschiedliche Mittelwerte 32 IV. Ergebnisse 4.1.3 Verlauf von IgG2 im Plasma An Tag -21 lagen die Werte für IgG2 bei 12,7 ± 1,24 mg*ml-1. Im weiteren Verlauf waren keine signifikanten Veränderungen zu beobachten. Zum Geburtszeitpunkt wurden Werte von 13,88 ± 1,66 mg*ml -1 gemessen. Zum Ende der Versuchsperiode lagen die Werte bei 11,58 ± 1,22 mg*ml -1. IgG2 [mg*ml-1] 20 15 10 5 0 -20 0 20 40 60 Tage Abbildung 9: Verlauf von Plasma-IgG2 bei Milchkühen der Rasse Holstein-Friesian im peripartalen Zeitraum (n=63). Angaben als arithmetischer Mittelwert mit Standardfehler (SEM). RM One-Way ANOVA; Tukey Post Test: n.s. 33 IV. Ergebnisse 4.1.4 Verlauf von IgM im Plasma Für die Messung von IgM wurden 18 Tiere anhand ihrer Laktationzahl ausgewählt. Zu Beginn der Messungen lagen die Werte für IgM bei 6,66 ± 0,98 mg*ml -1. Zum Geburtszeitpunkt kam es zu einem rapiden Abfall der intravasalen IgMKonzentration. An Tag -3 wurden lediglich Werte von 0,59 ± 0,18 mg*ml -1 gemessen. Bereits an Tag 1 p.p. wurden wieder Plasmaspiegel von 6,69 ± 1,69 erreicht. Diese blieben bis zum Ende der Versuchsperiode konstant. An Tag 56 lagen die Werte bei 5,30 ± 1,40 mg*ml-1. 10 a IgM [mg*ml-1] 8 a a a a a 6 ab a a a ab 4 2 b 0 -20 0 20 Tage 40 60 Abbildung 10: Verlauf von Plasma-IgM bei Milchkühen der Rasse Holstein-Friesian im peripartalen Zeitraum (n=18). Angaben als arithmetischer Mittelwert mit Standardfehler (SEM).RM One-Way ANOVA; Tukey Post Test: Zeiteffekt: ***; Unterschiedliche Buchstaben stehen für signifikant unterschiedliche Mittelwerte 34 IV. Ergebnisse 4.2 Verlauf der Immunglobuline in Abhängigkeit der Laktationszahl In Abhängigkeit der Laktationszahl waren deutliche Unterschiede im Verlauf der unterschiedlichen Immunglobulin-Isotypen feststellbar. So zeigten Färsen signifikant niedrigere Ausgangswerte von IgG1 an Tag -21 (4,05 ± 0,79 mg*ml -1) und signifikant niedrigere IgG1-Spiegel zum Zeitpunkt der Geburt (1,95 ± 0,42 mg*ml -1) und erreichten auch post partum nicht so hohe Plasmaspiegel wie Tiere mit mehreren Laktationen. Insgesamt zeigten Kühe mit zwei oder mehr Laktationen über die gesamte Versuchsperiode höhere Plasmaspiegel an IgG1. So lagen die Plasmaspiegel bei Kühen in der 2. Laktation an Tag -21 bei 7,12 ± 0,78 mg*ml -1 und zum Zeitpunkt der Geburt 2,76 ± 0,65 mg*ml -1. Für Tiere mit mehr als zwei Laktationen lagen die Plasmaspiegel an Tag -21 bei 11,14 ± 1,33 mg*ml -1 und zum Zeitpunkt der Geburt bei 3,66 ± 0,42 mg*ml -1. 15 IgG1 [mg*ml-1] a 1. Laktation (N=16) 2. Laktation (N=25) > 2. Laktation (N=22) a 10 a a a 5 b ab a b a b b 0 -30 -20 -10 0 10 20 30 40 50 60 Tage um den Geburtszeitpunkt Abbildung 11: IgG1 im Plasma von Milchkühen der Rasse Holstein-Friesian in Abhängigkeit der Laktationszahl. Angaben als arithmetischer Mittelwert mit Standardfehler (SEM).Two Way ANOVA: Zeiteffekt: ***, Effekt der Laktation: **, Interaktion Zeit/Laktation: *; Fisher LSD Test: Unterschiedliche Buchstaben stehen für signifikant unterschiedliche Mittelwerte. 35 IV. Ergebnisse Im zeitlichen Verlauf von IgG2 und IgM konnten dagegen keine Unterschiede zwischen den einzelnen Laktationsgruppen festgestellt werden (Abbildung 12 und 13). 1. Laktation (N=16) 2. Laktation (N=25) > 2. Laktation (N=22) IgG2 [mg*ml-1] 20 15 10 5 0 -20 0 20 40 60 Tage um den Geburtszeitpunkt Abbildung 12: IgG2 im Plasma von Milchkühen der Rasse Holstein-Friesian in Abhängigkeit von der Laktationszahl. Angaben als arithmetischer Mittelwert mit Standardfehler (SEM). Two Way ANOVA: Zeiteffekt: *, Interaktion Zeit/Laktation: * IgM [mg*ml-1] 20 1. Laktation (N=6) 2. Laktation (N=6) > 2. Laktation (N=6) 15 10 5 0 -20 0 20 40 Tage um den Geburtszeitpunkt 60 Abbildung 13: IgM im Plasma von Milchkühen der Rasse Holstein-Friesian in Abhängigkeit von der Laktationszahl. Angaben als arithmetischer Mittelwert mit Standardfehler (SEM). Two Way ANOVA: Zeiteffekt: ** 36 IV. Ergebnisse 4.3 Verlauf der Immunglobuline in Abhängigkeit der Fütterung Wie bereits in Kapitel 3.2 beschrieben, wurden die Kühe in vier Versuchsgruppen eingeteilt und vor der Abkalbung mit Rationen mit hohem und niedrigem Kraftfutteranteil jeweils mit und ohne Zusatz von 10 g trans-10, cis-12-CLA/Tag und 10 g cis-9, trans-11-CLA/Tag gefüttert. Nach der Abkalbung wurde der Versuch weitergeführt, wobei dann alle Tiere im gleichen Verhältnis mit Grund- und Kraftfutter versorgt wurden (siehe Tabelle 4). Um den Einfluss der Fütterung auf den Verlauf der Immunglobulin-Isotypen zu untersuchen, wurde bis Tag 28 eine multifaktorielle Varianzanalyse für die Faktoren „Zeit“, „Kraftfuttermenge a.p.“ und „Gruppe“ durchgeführt. Der Faktor „Laktation“ wurde separat betrachtet. Dabei konnten für IgG1 und IgG2 keine Unterschiede zwischen den einzelnen Fütterungsgruppen gezeigt werden (siehe Abbildung 14 und 15). 15 I II III Kon-20 (N=16) IgG1 [mg*ml-1] Kon-60 (N=15) CLA-20A (N=16) 10 CLA-20B (N=16) CLA-60A (N=16) CLA-60B (N=16) 5 0 -30 -20 -10 0 10 20 30 40 50 60 Tage um den Geburtszeitpunkt Abbildung 14: IgG1 im Plasma von Milchkühen der Rasse Holstein-Friesian in Abhängigkeit der Fütterung unter Berücksichtigung der Laktation. Angaben als arithmetischer Mittelwert mit Standardfehler (SEM). Two Way ANOVA (bis Tag 28): Zeiteffekt: ***; One Way ANOVA (Tag 42 und 56): n.s. 37 IV. Ergebnisse Kon-20 (N=16) IgG2 [mg*ml-1] 25 I II III Kon-60 (N=15) CLA-20A (N=16) 20 CLA-20B (N=16) CLA-60A (N=16) 15 CLA-60B (N=16) 10 5 0 -30 -20 -10 0 10 20 30 40 50 60 Tage um den Geburtszeitpunkt Abbildung 15: IgG2 im Plasma von Milchkühen der Rasse Holstein-Friesian in Abhängigkeit der Fütterung unter Berücksichtigung der Laktation. Angaben als arithmetischer Mittelwert mit Standardfehler (SEM). Two Way ANOVA (bis Tag 28): Zeiteffekt: (*);One Way ANOVA (Tag 42 und 56): n.s. Da der Einfluss der Fütterung nach Betrachtung von IgG1 und IgG2 eine untergeordnete Rolle zu spielen schien und der Einfluss der Laktation vielversprechende Ergebnisse zeigte, wurden die Tiere für die Bestimmung von IgM ausschließlich nach ihrer Laktationsnummer ausgewählt. Bis auf signifikante Unterschiede zwischen der CLA-60B-Gruppe und den Kontrollgruppen an Tag 42 konnten hier ebenfalls keine Unterschiede Fütterungsgruppen gezeigt werden. 38 zwischen den einzelnen IV. Ergebnisse 25 I II III Kon-20 (N=6) Kon-60 (N=4) IgM [mg*ml-1] 20 CLA-20B (N=3) 15 CLA-60B (N=4) a 10 b 5 b 0 -20 0 20 40 Tage um den Geburtszeitpunkt 60 Abbildung 16: IgM im Plasma von Milchkühen der Rasse Holstein-Friesian in Abhängigkeit der Fütterung. Angaben als arithmetischer Mittelwert mit Standardfehler (SEM).Two Way ANOVA (bis Tag 28): Zeiteffekt: ***; One Way ANOVA (Tag 42 und 56): Unterschiedliche Buchstaben stehen für signifikant unterschiedliche Mittelwerte 4.4 Energiebilanz (EB) Anhand von Daten, die im Rahmen der Dissertation von PETZOLD et al. (2013) am Friedrich-Löffler-Institut in Braunschweig erhoben wurden, wurde die Energiebilanz berechnet, um eine Übersicht über die Stoffwechselsituation der Milchkühe über den Versuchszeitraum zu erhalten. Von Tag -7 a.p. zu Tag 7 p.p. kam es zu einem signifikanten Abfall der Energiebilanz von anfänglich 41,49 ± 4,32 mJ auf -33,52 ± 9,84 mJ. Bis zum Ende der Versuchsperiode wurden keine positiven Bilanzwerte erreicht. 60 Energiebilanz [mJ] a 40 20 e 0 0 20 -20 -40 b c Tage 60 40 d bcd -60 Abbildung 17: Verlauf der EB von Milchkühen der Rasse Holstein-Friesian über den gesamten Versuchszeitraum (n=63). Angaben als arithmetischer Mittelwert mit Standardfehler (SEM). One Way-ANOVA, Tukey Post Test: Unterschiedliche Buchstaben stehen für signifikant unterschiedliche Mittelwerte 39 IV. Ergebnisse In Abhängigkeit der Laktationszahl waren ab Tag 14 p.p. deutliche Unterschiede zwischen der 1. und den nachfolgenden Laktationen feststellbar. Tiere der 1. Laktation befanden sich an Tag 14 p.p. in einer Energiebilanz von -2,22 ± 4,67 mJ und lagen damit deutlich über den Werten der Kühe in der 2. Laktation (-36,87 ± 4,85 mJ) bzw. der nachfolgenden Laktationen (-42,85 ± 4,50 mJ). Die statistische Auswertung dieser Daten ergab, dass die Kühe in der 1. Laktation bis auf den letzten Messwert (Tag 56) signifikant höhere Energiebilanzwerte aufwiesen. 1. Laktation (N=16) 2. Laktation (N=25) > 2. Laktation (N=22) Energiebilanz [mJ] 60 30 a 0 a a 0 60 Tage 40ab 20 b -30 b b b b Abbildung 18: Verlauf der EB von Milchkühen der Rasse Holstein-Friesian in Abhängigkeit der Laktationsnummer. Angaben als arithmetischer Mittelwert mit Standardfehler (SEM). RM One Way-ANOVA: Zeiteffekt:**; Fisher LSD Test: Unterschiedliche Buchstaben stehen für signifikant unterschiedliche Mittelwerte 4.4.1 Zusammenhang zwischen Energiebilanz und Immunglobulingehalt im Plasma Um einen möglichen Zusammenhang zwischen dem Energiehaushalt und der humoralen Immunität zu charakterisieren, wurden die Immunglobulinspiegel im Plasma an allen Entnahmezeitpunkten mit der jeweiligen Energiebilanz korreliert. Dabei konnte kein Zusammenhang festgestellt werden. Da der Zeitpunkt um die Abkalbung ausschlaggebend für die Fragestellung dieser Arbeit war, sind in Abbildung 19 beispielhaft die Korrelationen für die Tage -7 und 7 p.p. für alle drei Isotypen dargestellt. 40 IV. Ergebnisse Korrelation NEB/IgG1 (Plasma) Tag 7 p.p. Korrelation NEB/IgG1 (Plasma) Tag -7 a.p. 25 15 Tag 7 (N=15) Tag -7 (N=46) 20 R2: 0,1 R2: 0,0005 10 15 10 5 5 -50 0 50 -100 100 -50 0 NEB NEB 50 100 Korrelation NEB/IgG2 (Plasma) Tag 7 p.p. Korrelation NEB/IgG2 (Plasma) Tag -7 a.p. 30 40 Tag 7 (N=15) Tag -7 (N=46) 30 R2: 0,02 R2: 0,008 20 20 10 10 -50 0 50 -100 100 -50 0 NEB NEB 50 100 Korrelation NEB/IgM (Plasma) Tag 7 p.p. Korrelation NEB/IgM (Plasma) Tag -7 a.p. 25 20 Tag -7 (N=14) 2 R : 0,1 15 R2: 0,15 mg*ml-1 mg*ml-1 Tag 7 (N=3) 20 10 15 10 5 5 -40 0 0 20 40 60 80 100 -20 0 NEB 20 40 NEB Abbildung 19: Übersicht über die Korrelationen zwischen EB und Immunglobulinspiegel im Plasma von Milchkühen der Rasse Holstein-Friesian an Tag -7 und Tag 7 für alle untersuchten Isotypen (IgG1, IgG2 und IgM). 41 IV. Ergebnisse 4.5 Milchleistung Die Milchleistung zeigte von Tag 7 p.p. bis Tag 42 p.p. einen leichten Anstieg (von 39,21 ± 1,94 kg an Tag 14 p.p. auf 42,96 ± 1,20 kg an Tag 42 p.p.), der allerdings statistisch nicht abzusichern war. FCM [kg] 50 45 40 35 0 20 40 60 Tage Abbildung 20: Verlauf der Milchleistung von Milchkühen der Rasse Holstein-Friesian über den Versuchszeitraum (FCM: fat corrected milk). Angaben als arithmetischer Mittelwert mit Standardfehler (SEM). RM One WayANOVA; Tukey Post Test: n.s. 42 IV. Ergebnisse In Abhängigkeit der Laktationsnummer zeigten sich deutliche Unterschiede in der Milchleistung zwischen Kühen in der ersten und denen der nachfolgenden Laktationen. Ab Tag 14 p.p. zeigten die Kühe der 1. Laktation über den gesamten Versuchszeitraum hinweg signifikant niedrigere Milchleistung im Vergleich mit den Kühen der zweiten oder späteren Laktationen (siehe Abbildung 21). 50 40 FCM [kg] 1. Laktation (N=16) 2. Laktation (N=25) > 2. Laktation (N=22) a a a 30 b a a a a a b b b 20 10 0 0 20 40 60 Tage Abbildung 21: Verlauf der Milchleistung von Milchkühen der Rasse Holstein-Friesian in Abhängigkeit der Laktationszahl. Angaben als arithmetischer Mittelwert mit Standardfehler (SEM). RM One Way-ANOVA; Fisher LSD-Test: Unterschiedliche Buchstaben stehen für signifikant unterschiedliche Mittelwerte 4.6 Transfer der Plasma-Immunglobuline ins Kolostrum Um den Transfer der unterschiedlichen Ig-Isotypen aus dem Plasma ins Kolostrum nachvollziehen zu können, wurden die Kolostrumproben ebenfalls mittels ELISA untersucht. Da die Erfassung der Tagesmilchmengen erst ab Tag 7 p.p. erfolgte, war eine quantitative Bestimmung der über das Kolostrum abgegebenen Mengen an Immunglobulinen nicht möglich. Sowohl IgG1, IgG2 und IgM sind im Kolostrum vorhanden, wobei das Verhältnis IgG1:IgG2:IgM etwa 4:2:1 beträgt. Da die Ergebnisse der Messungen der ersten fünf Tiere darauf hinwiesen, dass nach Tag 3 p.p. kaum noch nachweisbare Immunglobulingehalte im Kolostrum vorhanden sind, wurden von den restlichen Tieren nur die Proben der Tage 1 bis 3 p.p. untersucht. 43 IV. Ergebnisse Für die Untersuchung von IgM im Kolostrum wurde eine Stichprobe von zehn Tieren ausgewählt. Dabei wurden die Tiere berücksichtigt, von denen auch die Plasmaproben ihrer Kälber zur Verfügung standen. *** *** 50 IgG1 (N=63) IgG2 (N =63) IgM (N=10) [mg*ml-1] 40 30 *** *** ** 20 10 ** *** 0 1 2 3 1 2 3 1 2 3 Tage p.p. Abbildung 22: Konzentrationen von IgG1, IgG2 und IgM im Kolostrum von Milchkühen der Rasse HolsteinFriesian. Angaben als arithmetischer Mittelwert mit Standardfehler (SEM). Two Way ANOVA mit Tukey Post Test: Zeiteffekt: ***, Effekt des Isotyps: ***, Interaktion Zeit/Isotyp: *** In Abhängigkeit der Laktationszahl waren für Gesamt-IgG zunächst keine signifikanten Unterschiede im Immunglobulingehalt des Kolostrums feststellbar (Abbildung 23). 44 IV. Ergebnisse Gesamt IgG [mg*ml-1] 100 1. Laktation (N=16) 2. Laktation (N=22) > 2. Laktation (N=25) 80 60 40 20 0 1 2 Tage p.p. 3 Abbildung 23: Gehalt von Gesamt IgG im Kolostrum von Milchkühen der Rasse Holstein-Friesian in Abhängigkeit der Laktationszahl. Angaben als arithmetischer Mittelwert mit Standardfehler (SEM).Two Way ANOVA mit Tukey Post Test. Bei getrennter Betrachtung der einzelnen Isotypen waren jedoch eindeutige Unterschiede zwischen den einzelnen Laktationszahlen erkennbar. Dabei zeigten Tiere der 1. Laktation mit 60,83 ± 11,83 mg*ml -1 an Tag 1 p.p. deutlich höhere Immunglobulinspiegel von IgG1 im Kolostrum als Tiere der 2. Laktation (50,28 ± 5,80 mg*ml-1) oder als Tiere in höheren Laktationen (35,64 ± 5,58 mg*ml -1). IgG1 [mg*ml-1] 80 1. Laktation (N=16) 2. Laktation (N=22) < 2. Laktation (N=25) 60 ** 40 20 0 1 2 Tage p.p. 3 Abbildung 24: Gehalt von IgG1 im Kolostrum von Milchkühen der Rasse Holstein-Friesian in Abhängigkeit von der Laktationszahl. Angaben als arithmetischer Mittelwert mit Standardfehler (SEM). Two Way ANOVA mit Tukey Post Test: Zeiteffekt: *** 45 IV. Ergebnisse Im Gegensatz dazu wiesen die Tiere der 1. Laktation an Tag 1 deutlich niedrigere Werte von IgG2 auf (11,22 ± 2,47 mg*ml -1) als die Tiere der anderen Laktationsgruppen (16,55 ± 1,96 mg*ml-1 für Tiere der 2. Laktation respektive 17,80 ± 1,73 mg*ml-1 für Tiere > 2. Laktation). IgG2 [mg*ml-1] 25 1. Laktation (N=16) 2. Laktation (N=22) < 2. Laktation (N=25) * 20 15 10 5 0 1 2 Tage p.p. 3 Abbildung 25: Gehalt von IgG2 im Kolostrum von Milchkühen der Rasse Holstein-Friesian in Abhängigkeit von der Laktationszahl. Angaben als arithmetischer Mittelwert mit Standardfehler (SEM). Two Way ANOVA mit Tukey Post Test: Zeiteffekt: *** Für IgM konnten statistisch keine Unterschiede zwischen den einzelnen Laktationsgruppen nachgewiesen werden. IgM [mg*ml-1] 8 > 2. Laktation (N=4) 2. Laktation (N=3) 1. Laktation (N=3) 6 4 2 0 1 2 Tage p.p. 3 Abbildung 26: Gehalt von IgM im Kolostrum von Milchkühen der Rasse Holstein-Friesian in Abhängigkeit von der Laktationszahl. Angaben als arithmetischer Mittelwert mit Standardfehler (SEM). Two Way ANOVA mit Tukey Post Test: n.s. 46 IV. Ergebnisse 4.7 Aufnahme kolostraler Immunglobuline durch das Kalb Um die Aufnahme der kolostralen Immunglobuline durch das Neugeborene überprüfen zu können, wurden die Plasmaproben der Kälber ebenfalls mittels ELISATechnik auf IgG1, IgG2 und IgM untersucht. Zur Verfügung standen dabei Proben von 19 Kälbern zu den Zeitpunkten vor und direkt nach der Kolostrumaufnahme sowie vom 42. Lebenstag. Die untersuchten Kälber hatten vor der Kolostrumaufnahme einen IgG1- Plasmaspiegel von 0,76 ± 0,06 mg*ml-1. Bereits direkt nach der Kolostrumaufnahme konnte ein signifikanter Anstieg auf 6,45 ± 1,57 mg*ml -1 beobachtet werden. An Tag 42 wiesen die Kälber einen Plasmaspiegel von 11,43 ± 1,47 mg*ml -1 auf und lagen damit im Bereich adulter Tiere. * 14 vor Kolostrumaufnahme (N=19) *** nach Kolostrumaufnahme (N=19) IgG1 [mg*ml-1] 12 10 8 Tag 42 (N=19) ** 6 4 2 0 Abbildung 27: IgG1-Plasmakonzentrationen von Kälbern der Rasse Holstein-Friesian (n=19). Angaben als arithmetischer Mittelwert mit Standardfehler (SEM). RM One Way ANOVA mit Tukey Post Test 47 IV. Ergebnisse Für IgG2 konnte kein signifikanter Unterschied vor und nach der Kolostrumaufnahme beobachtet werden (3,60 ± 0,27 mg*ml -1 vor der Kolostrumaufnahme respektive 4,07 ± 0,39 mg*ml-1 nach der Kolostrumaufnahme). Allerdings waren die Plasmaspiegel an Tag 42 mit 6,37 ± 0,81 mg*ml -1 signifikant höher als an den beiden vorangegangenen Entnahmezeitpunkten. IgG2 [mg*ml-1] 8 * vor Kolostrumaufnahme (N=19) nach Kolostrumaufnahme (N=19) * 6 Tag 42 (N=19) 4 2 0 Abbildung 28: IgG2-Plasmakonzentrationen von Kälbern der Rasse Holstein-Friesian (n=19). Angaben als arithmetischer Mittelwert mit Standardfehler (SEM). RM One Way ANOVA mit Tukey Post Test 48 IV. Ergebnisse Auch für IgM wurde ein Anstieg der Plasmakonzentration nach der Kolostrumaufnahme festgestellt (von 0,92 ± 0,39 mg*ml -1 auf 3,27 ± 1,11 mg*ml -1). Dieser ließ sich statistisch jedoch nicht bestätigen. Es gab jedoch einen statistisch signifikanten Effekt in der Zunahme der Plasma-IgM-Konzentration von vor der Kolostrumaufnahme zu Tag 42 (4,29 ± 1,05 mg*ml -1). 6 * vor Kolostrumaufnahme (N=19) IgM [mg*ml-1] nach Kolostrumaufnahme (N=19) Tag 42 (N=19) 4 2 0 Abbildung 29: IgM-Plasmakonzentrationen von Kälbern der Rasse Holstein-Friesian (n=13). Angaben als arithmetischer Mittelwert mit Standardfehler (SEM). RM One Way ANOVA mit Tukey Post Test 49 V. Diskussion V. DISKUSSION 5.1 Immunglobulinbestimmung im Plasma Trotz der großen Bedeutung, die dem Immunstatus des Rindes gerade im peripartalen Zeitraum in Klinik und Wissenschaft beigemessen wird, gibt es auf diesem Themengebiet bisher nur wenig publizierte Daten. Mit Hilfe eines in Zusammenarbeit mit der Arbeitsgruppe Immunologie der Tierärztlichen Hochschule Hannover entwickelten Sandwich-ELISAs (HUSSEN 2012) konnten in der vorliegenden Studie IgG und IgM und erstmals auch die unterschiedlichen Isotypen von IgG (IgG1 und IgG2) quantitativ bestimmt werden. Ab der dritten Woche a.p. konnte ein signifikanter Abfall der Plasmakonzentration von IgG1 beobachtet werden. Die Konzentrationen von IgG2 blieben während des gesamten Untersuchungszeitraumes konstant. LARSON beschrieb als einer der ersten Autoren (1958) eine Abnahme der γ1-Globulin-Konzentration im Serum von Kühen von der 6. Woche a.p. bis zur Geburt. Allerdings konnten mit der von ihm gewählten Methode der Gelelektrophorese lediglich Proteinfraktionen gemessen werden, welche nicht genauer bestimmt werden konnten. Darauf basierend folgten einige Studien, die sich mit der Quantifizierung der Immunglobulingehalte im bovinen Serum beschäftigten. Daraus resultierten sehr unterschiedliche Immunglobulinkonzentrationen, die für IgG mit Werten von 9,3 bis 36,8 ± 11,6 mg*ml-1 und für IgM von 2,6 bis 8,6 mg*ml-1 angegeben wurden (KLAUS et al. 1969; CURTAIN et al. 1970; BRANDON et al. 1971; DUNCAN et al. 1972; J. E. BUTLER 1973; NORMAN u. HOHENBOKEN 1981; GUNNINK 1984; DETILLEUX et al. 1995; FRANKLIN et al. 2005; HERR et al. 2011). Diese hohe Varianz ist möglicherweise darauf zurückzuführen, dass die Messungen unabhängig vom Leistungsstadium innerhalb der Reproduktionsperiode sowie mit unterschiedlichen Methoden (Radioimmunoassay, single radial immunodiffusion (sRid), ELISA) erfolgten (Tabelle 6. 50 V. Diskussion Zwar geben die bereits publizierten Daten zu den Plasma IgG- und IgMKonzentrationen eine gute Orientierung, allerdings lassen sie keine Rückschlüsse darüber zu, inwiefern die unterschiedlichen Reproduktionsabschnitte Einfluss auf die Antikörpergehalte im Plasma nehmen. Dabei wird in der Fachliteratur häufig die Meinung vertreten, dass die überdurchschnittlich hohe Anfälligkeit für Erkrankungen im peripartalen Zeitraum bei der Milchkuh in engem Zusammenhang mit einer Depression des Immunsystems stehe (GUNNINK 1984; GOFF u. HORST 1997; LEWIS 1997; MALLARD et al. 1998). BOSTEDT und BERCHTHOLD postulierten bereits 1968, dass die humoralen Abwehrmechanismen des Milchrindes während der Geburt einer Depression unterliegen. Während der Austreibungsphase konnte eine signifikante Reduktion der eosinophilen Granulozyten gezeigt werden, die erst drei bis fünf Stunden p.p. abgeschlossen war. Die Dauer der Eosinopenie variierte dabei zwischen 12 und 24 Stunden. 5.1.1 IgG-Bestimmung im Plasma Die direkte Charakterisierung des Immunstatus der Milchkuh in diesem kritischen Zeitraum wurde erst in jüngerer Zeit Gegenstand einiger Untersuchungen (DETILLEUX et al. 1995; FRANKLIN et al. 2005; HERR et al. 2011). Diese Arbeitsgruppen beschäftigten sich mit der Bestimmung des tatsächlichen Immunglobulingehaltes im letzten Trimester der Trächtigkeit und den ersten drei Wochen p.p. In allen Publikationen konnte ein präpartaler Abfall der IgG- bzw. IgG1-Konzentration nachgewiesen werden. Allerdings gab es Unterschiede Immunglobulinkonzentrationen und in Bezug auf auf den die absoluten Beginn des Konzentrationsabfalls a.p. (Tabelle 6). DETILLEUX et al. (1995) konnten eine Reduktion des IgG1-Gehaltes von 5,6 mg*ml-1 (fünfte Woche a.p.) bis auf 2 mg*ml-1 (Geburt) feststellen. Dagegen beschrieben FRANKLIN et al. (2005) einen kontinuierlichen Abfall der IgG1-Konzentration von der vierten Woche a.p. bis zur Geburt (von 10,2 ± 0,9 auf 3,3 ± 0,7 mg*ml -1 intra partum) während HERR et al. (2011) einen Abfall des Gesamt-IgG von 36,8 51 V. Diskussion ± 11,6 mg*ml-1 acht Wochen a.p. auf 18,0 ± 9,1 mg*ml -1 einen Tag vor der Geburt nachweisen konnten. In der Studie von HERR et al. (2011) wurden auch unter der Geburt in den unterschiedlichen Geburtsphasen Blutproben für die Bestimmung für IgG gewonnen. Dabei konnte gezeigt werden, dass der Abfall der IgG-Konzentration erst bei Expulsion des Fetus mit 15,0 ± 6,4 mg*ml-1 sein Minimum erreichte. Die Unterschiede in den absoluten Immunglobulinkonzentrationen stehen sicherlich mit dem versetzten Beginn der Studien in der achten bzw. fünften und vierten Woche a.p. in Zusammenhang. Außerdem haben HERR et al. (2011) sich auf die Bestimmung von Gesamt-IgG konzentriert, während in den anderen Studien IgG1 gemessen wurde. Darüber hinaus wurde die Studie von FRANKLIN et al. (2005) an 30 Rindern der Rasse Holstein Friesian und 20 Rindern der Rasse Jersey durchgeführt, wobei die Versuchs- und Kontrollgruppen unabhängig von der Rassenzugehörigkeit zusammengesetzt wurden. Weiterhin wurden sowohl die Rinder der Kontroll- als auch der Versuchsgruppe in der vierten und zweiten Woche a.p. mit Vakzinen gegen Rota- und Coronaviren sowie E. coli geimpft. Es ist daher fraglich, ob die angegebenen Immunglobulinkonzentrationen als Diskussionsgrundlage genutzt werden können, da sie aufgrund der erfolgten Impfung keine Referenzwerte darstellen können. DETILLEUX et al. (1995) konnten den Versuch zwar an einer größeren Tierzahl durchführen (137 Rinder der Rasse Holstein Friesian), Ziel der Studie war jedoch, eine genetisch determinierte Differenz der Immunfunktion bei verschiedenen Zuchtlinien milchbetonter Rassen zu untersuchen. Ebenso wie bei FRANKLIN et al. (2005) wurden die Konzentrationen von IgG1, IgG2 und IgM mittels radialer Immunodiffusion (sRid) bestimmt. Diese Methodik der Immunglobulinbestimmung ist allerdings besonders in dem niedrigen Konzentrationsbereich, in dem sich die intravasalen Immunglobulinkonzentrationen bewegen, mit nicht zu vernachlässigenden Ungenauigkeiten belegt (GRANZER 1986). HERR et al. (2011) verwendeten zur Bestimmung der Immunglobulinkonzentrationen einen von BENDER (2004) und BENDER und BOSTEDT (2008) entwickelten kompetitiven ELISA. Allerdings konnte 52 V. Diskussion mit diesem Verfahren nur die Gesamtkonzentration an IgG bestimmt werden. Eine Differenzierung zwischen IgG1 und IgG2 war nicht möglich. Gerade bei der Immunglobulinkonzentrationen differenzierten im Betrachtung peripartalen Zeitraum wäre der eine Unterscheidung zwischen den einzelnen Isotypen durchaus interessant. Zum einen haben die Subtypen unterschiedliche Anteile am Gesamt-IgG (IgG1 etwa 60%, IgG2 etwa 40% des Gesamt-IgGs) (CURTAIN et al. 1970; BRANDON u. LASCELLES 1971; BUTLER 1973), zum anderen konnten SASAKI et al. (1976) in einer ähnlichen Studie ein unterschiedliches Verhalten der Isotypen im peripartalen Zeitraum zeigen. So kam es vor der Abkalbung zu einem Abfall von IgG1 im Plasma, während die Konzentration von IgG2 weitgehend unverändert blieb. Diese Beobachtung konnte in der vorliegenden Studie bestätigt werden. Allerdings gab es Unterschiede hinsichtlich der Immunglobulinkonzentration (Tabelle 6). HERR et al. (2011) ermittelten in einem ähnlichen Zeitraum (vier Wochen a.p.) einen Gesamt-IgG-Gehalt von 29,0 ± 11,6 mg*ml -1. Von der Annahme ausgehend, dass IgG1 etwa 60% der Gesamt-IgG-Konzentration im Plasma ausmache (CURTAIN et al. 1970; BRANDON u. LASCELLES 1971; J. E. BUTLER 1973), errechneten HERR et al. (2011) einen IgG1-Gehalt von 17,4 mg*ml-1. Dieser Wert liegt deutlich über den Werten aus vorausgegangenen Studien von DETILLEUX et al. (1995), die fünf Wochen a.p. einen IgG1-Gehalt von etwa 6,0 mg*ml -1 ermittelten und FRANKLIN et al. (2005), die in ihrer Studie vier Wochen a.p. eine Konzentration von 10,2 ± 0,9 mg*ml-1 für IgG1 nachweisen konnten. Ähnliche Unterschiede gab es auch in Bezug auf das Ausmaß der absoluten Konzentrationsabnahme bis zur Geburt. DETILLEUX et al. (1995) zeigten eine IgG1-Reduktion von 5,6 mg*ml-1 auf 2,0 mg*ml -1 i.p., während FRANKLIN et al. (2005) einen präpartalen Abfall von 10,2 ± 0,9 mg*ml -1 auf 3,3 ± 0,7 mg*ml-1 i.p. nachweisen konnten. HERR et al. (2011) konnten eine Abnahme des Gesamt-IgG-Gehaltes von 29,0 ± 11,6 mg*ml -1 auf 15,0 ± 6,4 mg*ml-1 messen und ermittelten daraus rechnerisch eine anteiligen Verlust von 8,4 mg*ml-1 IgG1. 53 V. Diskussion In der vorliegenden Studie wurde zum Geburtszeitpunkt ein Gesamt-IgGAbfall von 19,85 ± 1,45 auf 14,91 ± 1,68 mg*ml -1 ermittelt. Der zum Geburtszeitpunkt ermittelte Wert setzte sich aus 2,9 ± 0,27 mg*ml -1 IgG1 und 13,88 ± 1,66 mg*ml -1 IgG2 zusammen. Das bedeutet für IgG1 eine Gesamtreduktion von etwa 5,3 mg*ml-1, während die Konzentration von IgG2 im Vergleich zum Messbeginn sogar um etwa 1,8 mg*ml-1 anstieg. Dieser Befund entspricht den Ergebnissen von KICKHÖFEN et al. (1968) und BUTLER (1969), die postulierten, dass nur IgG1 ins Kolostrum diffundiert, während IgG2 im Plasma verbleibt. Die Beobachtung, dass es bei der Milchkuh zu einem präpartalen Abfall der IgG1- und IgM-Konzentrationen kommt, erscheint zunächst widersprüchlich. Gerade im peripartalen Zeitraum sollte das Muttertier ein stabiles Immunsystem aufrechterhalten können. Ein bedeutender Faktor für die intravasale IgG1-Reduktion im letzten Trimester der Trächtigkeit ist die Diffusion der IgG1-Moleküle ins Kolostrum, wo sie zunächst akkumulieren. Diese Annahme wird von den Ergebnissen von LARSON (1958) gestützt, der erstmals präpartal (sechs Wochen a.p. bis zur Geburt) eine Erhöhung der Immunglobulinfraktion im trockenstehenden Euter bei gleichzeitigem Abfall der γ- und β-Globuline im Serum nachweisen konnte. Er stellte die These auf, dass während der Trockenstehphase ein Transfer der Immunglobuline aus dem Blut in das Euter existieren müsse. Allerdings konnte LARSON (1958) weder eine qualitative Angabe über den Isotyp noch eine quantitative Angabe über den absoluten Gehalt der Immunglobuline treffen. Auch KICKHÖFEN (1968) und BUTLER (1973) postulierten, die Erniedrigung der intravasalen γ- und β-Globuline in der Trockenstehperiode beruhe hauptsächlich auf einer Überführung des IgG1 in die Milchdrüse, während IgG2 im Blut verbleibe. DETILLEUX et al. (1995) und FRANKLIN et al. (2005) beschrieben ebenfalls einen präpartalen Abfall von IgG1. Durch die vorgelegte Arbeit konnten diese Ergebnisse bestätigt werden. PRITCHETT et al. (1991) konnten in einer Studie an 919 Holstein-FriesianKühen zeigen, dass die Abkalbesaison, die Laktationsnummer, die Länge der Trockenstehperiode, das Zwischenkalbeintervall, die Milch- und Milchfettproduktion in der gesamten Laktation, das Gewicht des Kolostrums 54 V. Diskussion und die Dauer von der Abkalbung bis zum ersten Melken einen Einfluss auf den IgG1-Gehalt im Kolostrum hatten. Somit ist nicht auszuschließen, dass auch die Immunglobulingehalte im Plasma von diesen Faktoren beeinflusst werden. Der Entzug des IgG1 aus dem maternalen Blutkreislauf im letzten Drittel der Gravidität und dessen Transfer ins Euter ist als physiologischer Vorgang zu bewerten. BARRINGTON et al. (1997) stellten in diesem Zusammenhang fest, dass im Eutergewebe trächtiger Milchkühe in der Trockenstehperiode vor allem IgG1-Rezeptoren exprimiert werden. Dabei konnten in trockenstehenden Eutern deutlich mehr Rezeptoren nachgewiesen werden als in laktierenden. So lässt sich die bereits von LARSON (1958), KICKHÖFEN et al. (1968) und BUTLER (1969) publizierte Umkompartimentierung der Immunglobuline (vorwiegend IgG1) ins Euter erklären. Weiterhin wurde der Frage nachgegangen, in welchen Zeitraum es zum Ausgleich des Verlustes der Immunglobuline im Plasma kommt. In dieser Studie konnte dabei ab Tag 3 p.p. ein sukzessiver Anstieg der IgG1Konzentration im Plasma beobachtet werden. Etwa drei Wochen p.p. wurden die Ausgangskonzentrationen von IgG1 bereits wieder erreicht. Im Gegensatz dazu beschrieben HERR et al. (2011) bis zum Tag 7 p.p. konstant niedrigere Gesamt-IgG-Konzentrationen. Erst danach folgte ein stetiger Anstieg bis zur vierten Woche p.p. FRANKLIN et al. (2005) beschrieben zwar auch einen Anstieg der IgG1-Spiegel bis zur dritten Woche p.p., jedoch eignen sich die Messwerte aufgrund der Vakzinierung der Studientiere in der zweiten und vierten Woche a.p. nur bedingt zum Vergleich. Allerdings zeigen die Ergebnisse von DETILLEUX et al. (1995) einen Anstieg der IgG1-Konzentration. Auf diesem Niveau stagnierten die Werte bis zum Studienende (fünfte Woche p.p.). Für IgG2 zeigten DETILLEUX et al. (1995) einen protrahierten Plasmakonzentration bis zur dritten Woche p.p. 55 Anstieg der V. Diskussion 5.1.2 IgM-Bestimmung im Plasma Bei der Auswertung der Daten wurde ersichtlich, dass auch im Verlauf der IgM-Konzentration vom Ende der Laktation bis zur Geburt Unterschiede bestanden. In der Studie von FRANKLIN et al. (2005) blieben die IgM-Konzentrationen von der vierten Woche a.p. bis zur Geburt weitgehend konstant, wobei die Frage offen bleibt, inwiefern die Impfungen (Vakzinen gegen Rota- und Coronaviren sowie E. coli in der vierten und zweiten Woche a.p.) Einfluss auf die IgM-Konzentration genommen haben könnten. DETILLEUX et al. (1995) zeigten eine Abnahme der IgM-Konzentration von der fünften Woche a.p. bis zur Geburt, die allerdings statistisch nicht gesichert werden konnte. Post partum blieben die Werte auf einem konstant niedrigen Niveau. Die Ausgangskonzentrationen wurden auch zum Studienende nicht wieder erreicht. HERR et al. (2011) konnten dagegen ab der vierten Woche a.p. einen hoch signifikanten Abfall der intravasalen IgM-Konzentration nachweisen, der sich bis in die subpartale Periode fortsetzte. Nach der Geburt blieben die IgM-Spiegel über die gesamte Untersuchungsperiode bis zur vierten Woche p.p. auf einem konstanten Niveau und lagen deutlich unter den Konzentrationen zu Versuchsbeginn. Dieser Befund konnte durch die vorliegende Arbeit bestätigt werden. Allerdings kam es in dieser Studie erst unmittelbar vor der Geburt zu einem rapiden und sehr starken Abfall der IgM-Konzentration im Plasma. Da ein ähnliches Verhalten auch für IgG1 im Plasma beschrieben wurde, liegt die Vermutung nahe, dass auch IgM zum Geburtszeitpunkt ins Kolostrum umkompartimentiert wird. KICKHÖFEN et al. (1968) und BUTLER (1969) konnten auch im Kolostrum IgM-Konzentrationen nachweisen, die deutlich über den Konzentrationen im Plasma lagen. BOURNE und CURTIS (1973) beschrieben, dass ein großer Anteil des kolostralen IgM aus dem Serum stammt und mittels eines selektiven Transports aktiv in das Euter transportiert wird. Weiterhin zeigten 56 BRANDTZAEG (1968) und V. Diskussion BRANDTZAEG et al. (1970; 1971a), dass menschliche Drüsenepithelien auch für IgM-Pentamere einen selektiven Transportmechanismus aufweisen. Hingegen stellten LASCELLES und McDOWELL (1970) die Vermutung auf, dass das Immunglobulin auf antigene Stimulation hin lokal im Euter synthetisiert wird. BARRINGTON et al. (1997) konnten mit Hilfe der Durchflusszytometrie in kurz vor der Geburt stehenden „trockenen“ Eutergeweben wesentlich höhere IgM-Konzentrationen nachweisen als in laktierenden Eutergeweben. Somit ist zumindest denkbar, dass auch eine Umkompartimentierung von IgM aus dem Plasma ins Euter möglich ist. UNDERDOWN (1989) konnte zeigen, dass der polymerische Immunglobulinrezeptor pIgR für den transzellulären Transport von sowohl dimerem IgA als auch von pentamerem IgM in Mukosa- und Drüsenzellen zuständig ist. Dieser Rezeptor konnte auch an der basolateralen Membran der Drüsenepithelzellen im bovinen Euter nachgewiesen werden (MOSTOV 1994; HUNZIKER u. KRAEHENBUHL 1998). RINCHEVAL-ARNOLD et al. (2002) untersuchten die Ausprägung und die hormonelle Regulation des pIgR während der Entwicklung der Milchdrüse im Euter des Schafes. Dabei stellten sie fest, dass es im letzten Trimester der Trächtigkeit zu einer Akkumulation des Rezeptors im Euter kommt. Eine Behandlung mit Östradiol-17β und Progesteron führte zu einer leicht gesteigerten mRNA-Expression des pIgR. Eine zusätzliche Behandlung mit Glukokortikoiden führte zu einer signifikanten Akkumulation von pIgRmRNA in der Milchdrüse der behandelten Tiere. Bei Inhibition der ProlaktinSekretion konnte dagegen kein Anstieg in der mRNA-Expression gezeigt werden. Diese Ergebnisse lassen darauf schließen, dass eine Kombination von 17β-Östradiol, Progesteron, Glukokortikoiden und Prolaktin notwendig ist, um sowohl die Zelldifferenzierung im Euter als auch die Expression des pIgR zu induzieren. Außerdem kommt es v.a. in stark ausdifferenzierten Epithelzellen zur maximalen Ausprägung des pIgR. Zusammenfassend scheint die Expression des pIgR von komplexen Interaktionen zwischen Steroid- und Peptidhormonen reguliert zu werden. Dabei spielt der geburtsassoziierte rasche Abfall von Progesteron im Plasma eine besonders wichtige Rolle. Gleichzeitig kommt es zu einem 57 V. Diskussion plötzlichen Anstieg von Prolaktin in Zusammenhang mit einem Anstieg der Glukokortikoid-Konzentration. möglicherweise Zu diesem ausschlaggebend für Zeitpunkt ist Aufrechterhaltung Prolaktin der pIgR- Expression auf hohem Niveau (RINCHEVAL-ARNOLD et al. 2002). In Studien an Ziegen und an Mäusen, bei denen radioaktiv markierte Disaccharide ins Euter appliziert wurden, konnte gezeigt werden, dass das Drüsenepithel während der Trächtigkeit auch für größere Moleküle durchlässig ist. LINZELL und PEAKER (1974) injizierten [14C]-Saccharose in das Drüsenlumen von Ziegen und konnten den Marker unmittelbar nach der Injektion im Blut nachweisen. Nur eine geringe Fraktion des Markers war in der Milch nachweisbar. Im Gegensatz dazu konnte während der Laktation nach intramammärer Injektion kein Marker im Blut nachgewiesen werden (NGUYEN u. NEVILLE 1998). Weiterhin konnten LINZELL und PEAKER (1971, 1974) bei trächtigen Ziegen nachweisen, dass [ 14C]-Saccharose auch aus dem Blut in die Milch diffundieren kann. Dass die tight junctions während der Trächtigkeit für große Moleküle durchlässig sind, wurde im Drüsenlumen trächtiger Mäuse durch den Transport von fluoreszenzmarkiertem Albumin und IgG aus dem Lumen ins Interstitium nachgewiesen (NGUYEN u. NEVILLE 1998). Während der Laktation waren diese Moleküle im Lumen der Milchdrüse gebunden. Elektronenmikroskopische Studien von PITELKA et al. (1973) zeigten, dass das Netzwerk der tight junctions während der Trächtigkeit noch unorganisiert ist und weniger Zell-Zell-Verbindungen aufweist als das hoch organisierte tight junctions-Netzwerk während der Laktation. Ergebnisse mehrerer Studien (LINZELL et al. 1975; ZETTL et al. 1992; FLINT u. GARDNER 1994; SINGER et al. 1994; THOMPSON 1996; NGUYEN et al. 2001) weisen darauf hin, dass Progesteron, Prolaktin und Glukokortikoide eine Rolle in der Regulation der tight junctions im Drüsenepithel der Milchdrüse spielen. Progesteron verhindert den Schluss der tight junctions während der Trächtigkeit, möglicherweise mit lokalen Faktoren wie TGF-β und Prostaglandin. Glukokortikoide werden für die Differenzierung des Drüsenepithels von trächtigen zum laktierenden Tier benötigt. Auch Prolaktin wird mit der Regulation der tight junctions im Drüsenepithel der Milchdrüse in Verbindung gebracht. 58 V. Diskussion Weiterhin kommt es auf zellulärer Ebene zum Geburtszeitpunkt zu einer Reduktion der T- und B-Zellen im Blut. Um eine Immunantwort leisten zu können, ist eine zusätzliche Hilfe von antigenspezifischen T-Helferzellen für die B-Zellen sehr entscheidend. Die T-Zellhilfe führt zu Aktivierung, Proliferation und Ausdifferenzierung der B-Zellen in Antikörper- produzierende Plasmazellen (KUCHEN et al. 2007). Dieses könnte sich evtl. auch auf die Gesamtkonzentrationen der Immunglobuline im Plasma auswirken. Dazu kommt, dass IgM – zusammen mit IgA – eine deutlich geringere Halbwertszeit im Plasma hat (ca. vier Tage), da es durch pIgR schneller aus der Zirklulation entfernt werden kann (GODDEERIS 1998). Es kann nur spekuliert werden, ob sich der rapide Abfall der IgMKonzentrationen im Plasma mit der Durchlässigkeit des Drüsenepithels a.p. erklären lässt, oder ob durch den pIgR doch ein aktiver Transport ins Drüsenlumen geschieht. Tabelle 6: Vergleich zwischen Literaturdaten und eigenen Messungen der Immunglobulinspiegel im Plasma a.p. 59 V. Diskussion 5.2 Abhängigkeit der Ig-Plasmakonzentrationen von der Laktationszahl Weiterhin wurde untersucht, ob eine Beziehung zwischen der Laktationsanzahl und der peripartalen Abnahme der IgG-Konzentration im Plasma besteht. HERR et al. (2011) gingen dieser Fragestellung in ihrer Studie erstmals nach, konnten allerdings über den gesamten Untersuchungszeitraum hinweg weder signifikante Unterschiede in den absoluten IgG-Konzentrationen noch einen von der Laktationszahl abhängigen IgG-Abfall a.p. feststellen. Im Gegensatz dazu konnten in dieser Studie für IgG1 deutliche Unterschiede zwischen den einzelnen Laktationsgruppen festgestellt werden. Insgesamt zeigten Kühe mit zwei oder mehr Laktationen über die gesamte Versuchsperiode signifikant höhere IgG1-Plasmaspiegel als Tiere in der ersten Laktation (11,4 ± 1,33 mg*ml -1 respektive 4,05 ± 0,79 mg*ml -1). Zur Geburt hin war bei diesen Tieren ebenfalls ein stärkerer Abfall von IgG1 zu beobachten, ebenso wie ein steilerer Anstieg der Plasma-IgG1Konzentration p.p.. Im Verlauf von IgG2 und IgM konnten dagegen keine Unterschiede zwischen den einzelnen Laktationsgruppen festgestellt werden. 5.3 Abhängigkeit der Ig-Plasmakonzentrationen von der Fütterung Im weiteren Verlauf wurde der Einfluss einer CLA-supplementierten Fütterung auf den Verlauf der unterschiedlichen Immunglobulin-Isotypen untersucht. Wie bereits erwähnt, wird die Immunfunktion von Milchkühen durch eine immunsupprimierte Zeitspanne um den Geburtszeitpunkt herum charakterisiert. Diese Immunsuppression führt u.a. zu einer reduzierten Monozytenantwort (peripheral blood mononuclear cells, PBMCs) auf Antigenstimulation (NONNECKE et al. 2003; LOISELLE et al. 2009). Dieses könnte durch eine p.p. erhöhte FFS-Konzentration im Serum hervorgerufen werden, die bei der erhöhten Fettmobilisierung in der Frühlaktation 60 V. Diskussion freigesetzt werden. LACETERA et al. (2004b) konnten bereits zeigen, dass FFS die Proliferation von bovinem PBMCs in vitro hemmen. STAPLES et al. (2008) postulierten, dass eine Linolsäure-supplementierte Fütterung die Freisetzung von Prostaglandin F (PGF)-Metaboliten erhöhen könnte, da Linolsäure als Vorstufe dieses Metaboliten dient. Dieses kann um den Geburtszeitpunkt herum durchaus von Vorteil sein, da PGF-2α proinflammatorisch wirkt und somit zur Migration neutrophiler Granulozyten an den Ort des entzündlichen Geschehens beiträgt, so dass Entzündungen effektiver bekämpft werden können. Weiterhin wiesen Kühe, die mit CLA supplementiert worden waren, u.a. höhere Antikörperkonzentrationen im Kolostrum auf. Der Gehalt an FFS und BHB im Plasma der Tiere der vorliegenden Untersuchung wurde in einer anderen Studie bestimmt (PETZOLD et al. 2013). Dabei konnte kein Einfluss der Fütterung nachgewiesen werden. Weiterhin konnte in der vorliegenden Studie entgegen den Ergebnissen von HUSSEN (2011b) ebenfalls kein Einfluss der Fütterung auf den Verlauf von IgG1, IgG2 und IgM nachgewiesen werden. Allerdings handelte es sich bei der Studie von HUSSEN (2011a, b) um eine Langzeitstudie, die einen Zeitraum von Tag -21 bis Tag 252 relativ zur Abkalbung untersuchte. Dabei traten die immunsuppressiven Effekte in der CLA100-Gruppe erst ab Tag 21 p.p. auf. Von Tag 21 bis Tag 182 p.p. zeigte die CLA100-Gruppe signifikant niedrigere Anteile an CD4+αβ-T-Zellen als die Kontrollgruppe. Diese Wirkung zeigte vier Wochen nach dem Absetzen der CLAs (ab Tag 210 p.p.) einen rückläufigen Effekt. Die IgG1- und IgG2-Spiegel waren in der CLA100-Gruppe ab Tag 7 p.p. signifikant niedriger als in den beiden anderen Gruppen. CLA100-Kühe zeigten ebenfalls signifikant niedrigere Milch-IgG1-Spiegel, verglichen mit den beiden anderen Gruppen. Die signifikant unterschiedlichen Mittelwerte für IgM an Tag 42 der vorliegenden Studie ergeben sich zwischen den Kontrollgruppen und der CLA-60B-Gruppe, die zu diesem Versuchszeitpunkt keinen Unterschied in der Fütterung der Kontrollgruppe aufwies. Somit sind die Unterschiede wahrscheinlich auf den geringen Stichprobenumfang und starke individuelle Schwankungen zurückzuführen. 61 V. Diskussion Allerdings stammten in der vorliegenden Studie 75% der an Mastitis erkrankten Tiere (21 von insgesamt 28 Erkrankten) aus den mit CLA supplementierten Fütterungsgruppen. Dieser Befund passt zu den von HUSSEN et al. (2011a, b) gemachten Beobachtungen, dass die mit CLA gefütterten Tiere eine Depression der CD4+-T-Zellen zeigten. CD4+αβ-THelferzellen spielen eine zentrale Rolle in der Regulation des adaptiven Immunsystems (ROMANGNANI 2006). Ihre Bedeutung wird besonders deutlich bei angeborenen Infekten oder Infektionen, die zum Ausfall dieser Zellen führen. Ein Beispiel dafür ist das Humane Immundefizinz-Virus (HIV) (PIRZADA et al. 2006). CD4+αβ-T-Zellen erkennen die von MHC-Klasse-II präsentierten Peptide und sind, u.a. durch Sekretion von Zytokinen, für die Aktivierung von Makrophagen verantwortlich. Weiterhin unterstützen sie zytotoxische T-Zellen bei ihrer Aufgabe, virusinfizierte oder tumorentartete Zellen abzutöten und helfen B-Zellen bei der humoralen Immunantwort gegen T-Zell-abhängige Antigene (JANEWAY u. TRAVERS 2005). 5.4 Abhängigkeit der Ig-Plasmakonzentrationen von der Energiebilanz Um eine Übersicht über die Stoffwechselsituation der Milchkühe im Versuchszeitraum zu erhalten, wurde die Energiebilanz berechnet und diese dann mit den Immunglobulinspiegeln im Plasma in Beziehung gesetzt. Tiere in der ersten Laktation wiesen über den gesamten Versuchszeitraum eine positivere Energiebilanz als Tiere in höheren Laktationen auf. In Zusammenhang mit der Milchleistung wird ersichtlich, dass die Färsen über den gesamten produzierten als Versuchszeitraum Kühe der 2. hinweg oder deutlich weniger > Laktation. 2. Milch Die Landwirtschaftskammer Schleswig-Holstein (MAHLKOW-NERGE 2012) gab für Färsen eine Jahresmilchmenge von 7.500 kg ECM (energy corrected milk) an, während Kühe der 2. Laktation 9.980 kg ECM und Kühe der 3. Laktation 10.469 kg ECM erreichten. Folglich liegt die Schlussfolgerung nahe, dass Färsen aufgrund ihrer geringeren Milchleistung auch einen geringeren Energieverlust zu Beginn der Laktation auszugleichen haben 62 V. Diskussion und somit bereits früher als ältere Kühe wieder eine positive Energiebilanz aufweisen. Negative Effekte einer Energiemangelsituation auf Komponenten der zellulären Immunität sind bereits bekannt. Um proliferieren zu können, ist ausreichend Glukose für Lymphozyten essentiell (FOX et al. 2005). MEHRZAD et al. (2002) konnten im peripartalen Zeitraum außerdem eine signifikante Reduktion der Lymphozyten nachweisen. Da ihnen die Fähigkeit der autonomen Kontrolle für die Aufnahme der notwendigen metabolischen Substrate fehlt, sind auch T-Zellen von Glukose, Fettsäuren und Aminosäuren aus ihrer extrazellulären Umgebung angewiesen. Außerdem wird Energie für die Aktivierung von T-Zellen benötigt. Ruhende T-Zellen nutzen den Großteil ihrer Energiereserven, um ihren Stoffwechsel aufrecht zu erhalten. Stehen einer ruhenden T-Zelle nicht genügend Nährstoffe für die Aufrechterhaltung ihres Stoffwechsels zur Verfügung, wird die Apoptose der Zelle eingeleitet. Auch die replikative Zellteilung nach Antigenkontakt ist ein sehr energieaufwändiger Prozess, bei dem es bei naiven T-Zellen zu einem etwa 20-fachen Anstieg der Glukoseaufnahme innerhalb einer Stunde kommen kann (FOX et al. 2005). MEHRZAD et al. (2002) zeigten eine peripartale Reduktion der neutrophilen Granulozyten beim Rind. Die Zellen wiesen zwar eine erhöhte Phagozytoseleistung auf, zeigten aber ebenfalls eine reduzierte respiratory burst-Aktivität, was in einer verminderten bakteriziden Wirkung resultierte. Trotz dieser Einflüsse einer negativen Energiebilanz auf einige Zellen des angeborenen Immunsystems gibt es bisher keine Studien über die Auswirkungen eines Glukosemangels auf B-Zellen. Allerdings konnte in dieser Studie gezeigt werden, dass eine negative Energiebilanz zu keinem der untersuchten Zeitpunkte mit den Antikörpergehalten im Plasma korreliert. 5.5 Immunglobulinbestimmung im Kolostrum Der Gesamt-IgG-Gehalt im Kolostrum spricht mit 61,51 ± 4,71 mg*ml -1 für ein qualitativ hochwertiges Kolostrum. Nach GUY et al. (1994) und ARTHINGTON et al. (1997) sollte hochwertiges Kolostrum mindestens 50 mg*ml-1 an IgG enthalten. 63 V. Diskussion 5.5.1 Abhängigkeit der Immunglobulinkonzentrationen von der Laktationszahl Die Unterschiede zwischen den einzelnen Laktationsgruppen konnten auch bei der Bestimmung der Immunglobulinsubtypen im Kolostrum beobachtet werden. Auch hier gab es deutliche Unterschiede im IgG1-Gehalt in Abhängigkeit der Laktationszahl. Dabei wiesen Färsen an Tag 1 die höchsten gemessenen Werte an IgG1 im Kolostrum auf. Im Gegensatz dazu wiesen diese Tiere deutlich niedrigere Werte von kolostralem IgG2 auf (8,40 ± 1,41 mg*ml-1) als die Tiere der anderen Laktationsgruppen (11,65 ± 2,45 mg*ml-1 für Tiere der 2. Laktation respektive 11,97 ± 3,10 mg*ml -1 für Tiere der > 2. Laktation). Diese Beobachtungen stehen im Gegensatz zum aktuellen wissenschaftlichen Stand. In einer Studie von SHEARER et al. (1992) wurden für Erstkalbende signifikant niedrigere Immunglobulingehalte ermittelt. Allerdings unterschieden sie nicht zwischen den unterschiedlichen Immunglobulin-Isotypen, sondern schätzten den gesamten Immunglobulingehalt ausschließlich anhand einer speziell entwickelten Skala am Kolostrometer, die auf dem Zusammenhang zwischen der spezifischen Schwerkraft des Kolostrums und seines Immunglobulingehaltes beruht (FLEENOR u. STOTT 1980). Auch andere Autoren postulierten bereits die These, dass die Konzentration an kolostralen Immunglobulinen in der ersten Laktation am niedrigsten ist und mit zunehmender Laktationsnummer steigt (KRUSE 1970 b; FOLEY u. OTTERBY 1978; DEVERY-POCUS u. LARSON 1983). In Studien von PRITCHETT et al. (1991) sowie MOORE et al. (2005) und KEHOE et al. (2011) wurde der Gehalt von Gesamt-IgG bzw. IgG1 im Kolostrum mittels sRID bestimmt. Auch hier wurde ein höherer Immunglobulingehalt bei Kühen in der dritten Laktation als bei Kühen der ersten oder zweiten Laktation nachgewiesen. Ein möglicher Grund für die Abweichung der Ergebnisse der vorliegenden Studie von ähnlichen Studien könnte in der gewählten Messtechnik liegen. Wie bereits erwähnt, kann es bei der sRID64 V. Diskussion Methode zu nicht zu vernachlässigenden Messungenauigkeiten kommen. Des Weiteren wurden auch in dieser Studie bei der Bestimmung des Gesamt-IgG-Gehaltes im Kolostrum keine Unterschiede zwischen den einzelnen Laktationszahlen festgestellt. Erst bei der getrennten Untersuchung der einzelnen Isotypen wurden diese Unterschiede deutlich. KEHOE et al. (2011) konnten weiterhin in ihrer Studie zeigen, dass die IgGKonzentration mit steigendem Volumen des Kolostrums abnimmt. Dieses widerspricht den in derselben Studie ermittelten Ergebnissen, dass das Kolostrum von Färsen geringere Immunglobulinkonzentrationen aufweist als das von multiparen Kühen. PRITCHETT et al. stellten bereits 1991 fest, dass die Immunglobulinkonzentrationen im Kolostrum mit steigender Erstgemelkmenge abnimmt. Gerade hoch leistende Milchkühe produzieren eine weitaus größere Menge an Kolostrum als Färsen. Bei steigender Milchmenge in höheren Laktationen kann auch ein Verdünnungseffekt nicht ausgeschlossen werden. Weiterhin zeigte sich, dass die gemessen kolostralen Werte der vorliegenden Studie mit den Ergebnissen von STENGEL (1998) und HERR et al. (2011) übereinstimmen (Tabelle 7). Tabelle 7: Vergleich zwischen Literaturdaten und eigenen Messungen der Immunglobulinspiegel im Kolostrum 65 V. Diskussion 5.6 Immunglobulinbestimmung im Plasma der Kälber Aufgrund der plazentären Verhältnisse ist beim Rind, im Gegensatz zu Nagetieren, Primaten und dem Menschen eine diaplazentare Übertragung maternaler Antikörper zur passiven Immunisierung des Fetus nicht möglich. Bei der Placenta epitheliochorialis cotyledonaria des Rindes kann der fetomaternale Stoffaustausch ausschließlich durch Endo- und Exozytose erfolgen (BOSTEDT 2004). Eine erleichterte Diffusion zum Transport höhermolekularer Substanzen ist nicht möglich (SAMUEL et al. 1976). Durch die Plazenta des Rindes können nur kleinere Moleküle aus dem Kreislauf der Mutter in den des Fetus übertreten (BJÖRCKMAN 1954). Immunglobuline können somit als Makromoleküle die Plazentarschranke des Rindes nicht penetrieren (SCHNORR 1996). Somit verfügen neugeborene Kälber zum Zeitpunkt der Geburt nicht über maternale Antikörper. In neueren Studien von STENGEL (1998), BENDER (2004) und LACK (2006) konnte jedoch gezeigt werden, dass Kälber bereits vor der ersten Kolostrumaufnahme geringe Mengen an IgG und IgM im Plasma aufweisen. Dieses konnte auch in vorliegender Studie bestätigt werden. Wahrscheinlich stammen diese Immunglobuline aus eigener Synthese. Dass Kälber bereits im letzten Trimester der Gravidität ein vollständig entwickeltes Immunsystem aufweisen und mit einer adaptiven Immunantwort auf entsprechende Stimuli reagieren können, konnten auch KELLING und TOPLIFF (2013) in ihrer Studie zeigen. 66 VI. Zusammenfassung VI. ZUSAMMENFASSUNG Jana Horn Konzentrationen der Immunglobuline IgG1, IgG2 und IgM im peripartalen Zeitraum unter Berücksichtigung der Energiebilanz sowie der Fütterung mit konjugierten Linolsäuren Bei hochleistenden Milchkühen kommt es mit Einsetzen der Milchproduktion zu einem Ungleichgewicht zwischen Energieaufnahme und Energieabgabe, was zur Ausprägung einer negativen Energiebilanz führt. Gerade in diesem Zeitraum haben die Tiere eine erhöhte Anfälligkeit für so genannte „Produktionskrankheiten“ wie Labmagenverlagerung, Nachgeburtsverhaltung, Klauenerkrankungen, Ketose, Mastitis und andere fieberhafte Erkrankungen. Es ist bereits bekannt, dass die Supplementierung von konjugierten Linolsäuren (CLAs) positive Effekte auf die Gesundheit der Milchkühe haben kann. Weiterhin sind bereits negative Effekte eines Energiemangels auf einige Immunzellen wie neutrophile Granulozyten und TLymphozyten beschrieben worden. Ziel dieser Studie war es, den Verlauf und das Verhalten der Immunglobulin-Isotypen IgG1, IgG2 und IgM im peripartalen Zeitraum unter der Berücksichtigung einer CLA-Fütterung sowie der Energiebilanz zu untersuchen. 21 Tage vor dem errechneten Geburtstermin wurden 63 hochtragende Milchkühe in vier Fütterungsgruppen eingeteilt (CLA bzw. Kontrollfett, hohe bzw. niedrigere Kraftfutterkonzentration). Über einen Versuchszeitraum von insgesamt 11 Wochen wurden den Tieren in regelmäßigen Abständen Blut- und Milchproben entnommen. Weiterhin wurden den Kälbern vor und nach ihrer ersten Kolostrumaufnahme sowie an Tag 42 ebenfalls Plasmaproben entnommen. Die Bestimmung der Immunglobuline IgG1, IgG2 und IgM in Plasma und Kolostrum erfolgte mittels eines enzyme linked immunosorbent assay (ELISA) mit spezifischen Antikörpern. Sowohl IgG1 als auch IgM zeigten um den Geburtszeitpunkt einen signifikanten Abfall der Plasmakonzentrationen. Dieser war für IgM bereits kurz nach der Geburt wieder ausgeglichen, während die Plasmaspiegel von IgG1 langsamer ansteigen und etwa drei Wochen p.p. wieder Konzentrationen wie zu Versuchsbeginn zeigten. Die Plasmaspiegel von IgG2 blieben über die gesamte Versuchsperiode konstant. Der 67 VI. Zusammenfassung Verlauf von IgG1 zeigte eine starke Abhängigkeit von der Laktationszahl. Färsen wiesen deutlich niedrigere Plasmaspiegel auf als ältere Kühe und zeigten um den Geburtszeitpunkt herum keinen deutlichen Abfall der Plasmakonzentrationen. Die Fütterung hatte keinen Einfluss auf die Höhe der Immunglobulinspiegel im Plasma. Auch die Energiebilanz korrelierte zu keinem Zeitpunkt mit den PlasmaImmunglobulinkonzentrationen. Sowohl IgG1 als auch IgG2 und IgM waren im Kolostrum nachweisbar, wobei das Verhältnis IgG1:IgG2:IgM etwa 4:2:1 betrug. Färsen hatten die höchsten IgG1- und die niedrigsten IgG2-Konzentrationen im Kolostrum. Dieser Befund steht im Gegensatz zu den Ergebnissen der einschlägigen Literatur. Dieses könnte einerseits an der in den meisten Studien verwendeten Methodik (sRid) liegen. Andererseits muss bei den älteren Tieren auch ein Verdünnungseffekt in Betracht gezogen werden, so dass die absoluten Immunglobulinkonzentrationen relativiert werden. Bei den Kälbern konnten bereits vor der ersten Kolostrumaufnahme geringe Plasmaspiegel aller drei untersuchten Immunglobulin-Isotypen nachgewiesen werden. Diese Ergebnisse weisen darauf hin, dass Kälber bereits ante partum in der Lage sind, geringe Mengen an Immunglobulinen selbst zu synthetisieren. Ziel weiterer Studien soll es sein, den Einfluss der Energiebilanz auf die zellulären Komponenten des Immunsystems zu untersuchen. 68 VII. Summary VII. SUMMARY Jana Horn Concentrations of IgG1, IgG2 and IgM in plasma and colostrum of high yielding dairy cattle during the periparturient period with special reference to energy balance and conjugated linoleic acids as feed supplements. In early lactation, high yielding dairy cows are unable to meet their energy requirements for both maintenance and milk production. This leads to a high energy deficit. During this period, there is a higher risk for “production diseases” such as left abomasal displacement, retained placenta, lameness, ketosis, mastitis and other febrile diseases. It is recently known, that supplementation of conjugated linoleic acids could have positive effects on the health status of dairy cattle. Furthermore, high energy deficit leads to negative effects on several cell types of the immune system, such as neutrophils and T-cells. The study aimed to characterize the development of IgG1, IgG2 and IgM during the periparturient period in consideration of energy balance as well as supplementation with conjugated linoleic acids. Three weeks prior to calving, 63 pregnant German Holstein cows were assigned to one of four dietary treatments (CLA supplement respectively control fat, high respectively low concentrate diet). Plasma and milk samples were taken in regular intervals over a period of 11 weeks, respectively. Furthermore, plasma samples of their calves were taken prior and after their first Colostral uptake and on day 42. Bovine IgG1, IgG2 and IgM in plasma and colostrum were determined by an enzyme linked immunosorbent assay (ELISA) using isotype-specific coating and detection antibodies. In plasma, both IgG1 and IgM show a significant decrease around parturition. For IgM, the decline was equalized shortly after parturition, whereas IgG1 showed initial plasma values around 3 weeks p.p. Plasma levels of IgG2 remained unchanged during the entire experimental period. The developing of IgG1 revealed a strong dependency on the lactation number. Heifers had significantly lower plasma levels over the entire period and did not show such a distinct decrease around parturition. 69 VII. Summary Dietary treatments had no effect on immunoglobulin plasma levels. IgG1, IgG2 and IgM were detectable in colostrum in which the ratio IgG1:IgG2:IgM was 4:2:1. Heifers showed the highest amounts of IgG1 and the lowest amounts of IgG2 in colostrum. These findings do not agree with the common literature, which could be due to the determination technique used in most of the studies (sRid). In addition, especially in older animals an effect of dilution cannot be excluded. In calves, low plasma levels of all examinated immunoglobulins could be detected even before their first colostral uptake. These results indicate, that calves are able to synthezise small amounts of immunoglobulins even ante partum. Further studies should be conducted to examine the influence of negative energy balance on cellular components of the immune system. 70 VIII. Literaturverzeichnis IX. LITERATURVERZEICHNIS ARTHINGTON, J. D., L. CORAH, J. MINTON, T. ELSASSER u. F. BLECHA (1997): Supplemental dietary chromium does not influence ACTH, cortisol, or immune responses in young calves inoculated with bovine herpesvirus-1. Journal of Animal Science 75, 217-223 BAIRD, G. (1982): Primary ketosis in the high-producing dairy cow: clinical and subclinical disorders, treatment, prevention and outlook. Journal of Dairy Science 65, 1-10 BARRINGTON, G. M., T. E. BESSER, W. C. DAVIS, C. C. GAY, J. J. REEVES u. T. B. MCFADDEN (1997): Expression of Immunoglobulin G1 Receptors by Bovine Mammary Epithelial Cells and Mammary Leukocytes. Journal of Dairy Science 80, 86-93 BAUMGARD, L., B. CORL, D. DWYER, A. SAEBO u. D. BAUMAN (2000): Identification of the conjugated linoleic acid isomer that inhibits milk fat synthesis. American Journal of Physiology. Regulatory, Integrative and Comparative Physiology 278, 179-184 BENDER, P. (2004) Bestimmung von Immunglobulin G und Immunglobulin M im Serum neugeborener Kälber während der ersten zehn Lebenstage unter besonderer Berücksichtigung der Darmgesundheit der Probanden sowie im Kolostrum derer Mütter mittels zweier neuartiger ELISAs. Justus Liebig Universität, Gießen BENDER, P. u. H. BOSTEDT (2008): Einfluss der IgG- und IgM-Serumkonzentrationen boviner Neonaten auf die Inzidenz gastroenteraler Erkrankungen während der ersten 10 Lebenstage. Tierärztliche Praxis 36, 73-83 BENDER, P. u. H. BOSTEDT (2009): Determination of IgG and IgM levels in sera of newborn calves until the 10th day of life by ELISA and description of their correlation to total plasma protein concentration and GGT activity. Deutsche Tierärztliche Wochenschrift 116, 44 - 52 BESSER, T. E. u. C. C. GAY (1994): The importance of colostrum to the health of the newborn calf. Veterinary Clinics of North America: Food Animal Practice 10, 107-117 BJÖRCKMAN, N. H. (1954): Morphological and histological studies on the bovine placentome. Acta Anatomica 22, 1-99 i VIII. Literaturverzeichnis BLAKEMORE, F. u. R. GARNER (1956): The maternal transference of antibodies in the bovine. Journal of Comparative Pathology 66, 287-289 BOSSAERT, P., J. LEROY, S. DE VLIEGHER u. G. OPSOMER (2008): Interrelations between glucose-induced insulin response, metabolic indicators, and time of first ovulation in high-yielding dairy cows. Journal of Dairy Science 91, 3363-3371 BOSTEDT, H. (2004): Morphologische und funktionelle Besonderheiten der Plazentationsformen bei Haustieren und Mensch. Nova Acta Leopoldina 334, 13-26 BOURNE, F. u. J. CURTIS (1973): The transfer of immunoglobulins IgG, IgA and IgM from serum to colostrum and milk in the sow. Immunology 24, 157-162 BRAMBELL, F. (1966): The transmission of immunity from mother to young and the catabolism of immunoglobulins. The Lancet 2, 1087-1093 BRANDON, M. R. u. A. K. LASCELLES (1971): Relative Efficiency of Absorption of IgG1, IgG2, IgA and IgM in the Newborn Calf. The Australian Journal of Experimental Biology and Medical Science 49, 629-633 BRANDON, M. R., D. L. WATSON u. A. K. LASCELLES (1971): The Mechanism of Transfer of Immunoglobulin into Mammary Secretion of Cows. The Australian Journal of Experimental Biology and Medical Science 49, 613-623 BRANDTZAEG, P. (1971a): Human sectretory immunoglobulins. II. Salivary secretions from individuals with selectively excessive or defective synthesis of serum immunoglobulins. Clinical and Experimental Immunology 8, BRANDTZAEG, P. (1981): Transport models for secretory IgA and secretory IgM. Clinical and Experimental Immunology 44, 221-232 BRANDTZAEG, P., I. FJELLANGER u. S. GJERULDSEN (1968): Immunoglobulin M: local synthesis and selective secretion in patients with immunoglobulin A deficiency. Science 160, 789 BRANDTZAEG, P., I. FJELLANGER u. S. GJERULDSEN (1970): Human secretory immunoglobulins. I. Salivary secretions from individuals with normal or low levels of serum immunoglobulins. Scandinavian Journal of Haematology 12, 1-83 ii VIII. Literaturverzeichnis BREVES, G. u. M. RODEHUTSCORD (2007): Potential und Grenzen der Leistungsfähigkeit von Nutztieren. Nova Acta Leopoldina NF 95 353, 91-99 BULANG, M., H. KLUTH, T. ENGELHARD, J. SPILKE u. M. RODEHUTSCORD (2006): Studies on the use of lucerne silage source for high-milk-producing dairy cows. Journal of Animal Physiology and Animal Nutrition 90 (3-4), 89-102 BUSH, L. J. u. T. STALEY (1980): Absorption of colostral immunoglobulins in newborn calves. Journal of Dairy Science 63, 672-680 BUTLER, J. E. (1969): Bovine immunoglobulins: A review. Journal of Dairy Science 52, 1895-1909 BUTLER, J. E. (1973): Synthesis and distribution of immunoglobulins. Journal of American Veterinary Medicine Association 163, 795-800 BUTLER, J. E. (1983): Bovine immunoglobulins: An augmented review. Veterinary Immunology and Immunopathology 4, 43-152 BUTLER, J. E., C. A. KIDDY, C. S. PIERCE u. C. A. ROCK (1972a): Quantitative Changes Associated with Calving in the Levels of Bovine Immunoglobulins in Selected Body Fluids; I. Changes in the Levels of IgA, IgGI and Total Protein. Canadian Journal of Comparative Medicine 36, 234-242 BUTLER, J. E., C. F. MAXWELL, C. S. PIERCE, M. B. HYLTON, R. ASOFSKY u. C. A. KIDDY (1972b): Studies on the Relative Synthesis and Distribution of IgA and IgG1 in Various Tissues and Body Fluids of the Cow. The Journal of Immunology 109, 38-46 BUTLER, W. R. (2003): Energy balance relationships with follicular development, ovulation and fertility in postpartum dairy cows Livestock Production Science 83, 211-218 CALDER, P., P. YACOOB, F. THIES, F. WALLACE u. E. MILES (2002): Fatty acids and lymphocyte functions. British Journal of Nutrition 87, 31-48 CLOVER, C. u. A. ZARKOWER (1980): Immunologic responses in colostrum-fed and colostrum-deprived calves. Amercian Journal of Veterinary Research 41, 1002-1007 iii VIII. Literaturverzeichnis CURTAIN, C. C., B. L. CLARK u. J. H. DUFTY (1970): The Origins of the Immunoglobulins in the Mucous Secretions of Cattle. Clinical and Experimental Immunology 8, 335-344 DETILLEUX, J. C., M. E. J. KEHRLI, J. R. STABEL, A. E. FREEMAN u. D. H. KELLEY (1995): Study of immunological dysfunction in periparturient Holstein cattle selected for high and average milk production. Veterinary Immunology and Immunopathology 44, 251-267 DEVERY-POCUS, J. E. u. B. L. LARSON (1983): Age and previous lactations as factors in the amount of bovine immunoglobulins. Journal of Dairy Science 66, 221-226 DIRKSEN, G., H.-D. GRÜNDER u. M. STÖBER (2006): Innere Medizin und Chirurgie des Rindes. MVS Medizinverlage Stuttgart GmbH und Co. KG DUNCAN, J. R., B. N. WILKIE, F. HIESTAND u. A. J. WINTER (1972): The Serum and Secretory Immunoglobulins of Cattle: Characterization and Quantitation. The Journal of Immunology 108, 965-976 DUSKE, K., H. HAMMON, A. LANGHOF, O. BELLMANN, B. LOSAND, G. NÜRNBERG, H. SAUERWEIN, H. SEYFERT u. C. METGES (2009): Metabolism and lactation performance in dairy cows fed a diet containing rumenprotected fat during the last twelve weeks of gestation. Journal of Dairy Science 92, 1670-1684 ERHARD, H. M, AMON, P, NUSRF, S, STANGASSINGER u. M (1999): Studies on the systemic availability of maternal and endogenously produced immunoglobulin G1 and G2 in newborn calves by using newly developed ELISA systems. Blackwell, Berlin, ALLEMAGNE FLEENOR, W. A. u. G. H. STOTT (1980): Hydrometer test for the estimation of immunoglobulin concentration in bovine colostrum. Journal of Dairy Science 63, 973-977 FLINT, D. u. M. GARDNER (1994): Evidence that growth hormone stimulates milk synthesis by direct action on the mammary gland and that prolactin exerts effects on milk secretion by maintenance of mammary deoxyribonucleic acid content and tight junction status. Endocrinology 135, 1119-1124 FOLEY, J. A. u. D. E. OTTERBY (1978): Availability, storage, treatment, composition, and feeding value of surplus colostrum: A review. Journal of Dairy Science 61, 1033-1060 i VIII. Literaturverzeichnis FOX, C. J., P. S. HAMMERMAN u. C. B. THOMPSON (2005): Fuel feeds function: energy metabolism and the T-cell response. Nature Reviews: Immunology 5, 844-852 FRANKLIN, S. T., M. C. NEWMAN, K. E. NEWMAN u. K. I. MEEK (2005): Immune Parameters of Dry Cows Fed Mannan Oligosaccharide and Subsequent Transfer of Immunity to Calves. Journal of Dairy Science 88, 766-775 GAINES, W. (1928): The energy basis of measuring milk yield of dairy cows. Illinois Agricultural Experiment Station Bulletin 308, 401-438 GAY, C. C., T. MCGUIRE u. S. PARISH (1983): Seasonal variation in passive transfer of immunoglobulin G1 to newborn calves. Journal of American Veterinary Medicine Association 183, 566-568 GODDEERIS, B. (1998): Immunology of cattle. In: Handbook of vertebrate immunology. San Diego, California, USA, S. 466ff GOFF, J. P. u. R. L. HORST (1997): Physiological Changes at Parturition and Their Relationship to Metabolic Disorders. Journal of Dairy Science 80, 1260-1268 GRANZER, W. (1986): Quality assurance of an enzyme immunoassay, ELISA, for the quantitative analysis of bovine immunoglobulins. Berliner und Münchner Tierärztliche Wochenschrift 99, 267-272 GUNNINK, J. W. (1984): Post-partum leucocytic activity and its relationship to caesarian section and retained placenta. Veterinary Quarterly 6, 52-54 GUY, M. A., T. B. MCFADDEN, D. C. COCKRELL u. T. E. BESSER (1994): Regulation of Colostrum Formation in Beef and Dairy Cows. Journal of Dairy Science 77, 3002-3007 HAMMON, H., G. STÜRMER, F. SCHNEIDER, A. TUCHSCHERER, H. BLUM, T. ENGELHARD, A. GENZEL, R. STAUFENBIEL u. W. KANITZ (2009): Performance and metabolic and endocrine changes with emphasis on glucose metabolism in high-yielding dairy cows with high and low fat content in liver after calving. Journal of Dairy Science 92, 1554-1566 ii VIII. Literaturverzeichnis HARASZTI, J., G. HUSZENICZA, L. MOLNÁR, E. IVANITS u. J. FEKETE (1982): Studies on the postpartum sexual function of "fatty" cows in the dry period (so-called "fat cow syndrome"). Magyar Állatorv. Lapja 37, 199-209 HERR, M. (2009) Humorale Immunglobulin G- und -M-Bestimmungen mittels kompetitivem ELISA im letzten Trimester der Gravidität sowie im peripartalen Zeitraum bei Milchrindern unter besonderer Berücksichtigung intra- und postpartaler Komplikationen. Justus-Liebig-Universität, Gießen HERR, M., H. BOSTEDT u. K. FAILING (2011): IgG and IgM levels in dairy cows during the periparturient period. Theriogenology 75, 377-385 HILL, A. W., I. M. REID u. R. A. COLLINS (1985): Influence of liver fat on experimental Escherichia coli mastitis in periparturient cows. Veterinary Record 117, 549-551 HUNZIKER, W. u. J. KRAEHENBUHL (1998): Epithelial transcytosis of immunoglobulins. Journal of Mammary Gland Biology and Neoplasia 3, 287-302 HUSSEN, J. (2011a): The effect of 9-cis:11-trans conjugated linoleic acid (CLA), 15d-PGJ2 and GW9662 on the proliferation of bovine peripheral blood mononuclear cells in vitro. Proceedings of the society of nutritional physiology 20, HUSSEN, J. (2011b): The effect of a long term dietary supplementation with conjugated linoleic acid (CLA) on the composition of bovine peripheral blood mononuclear cells (PBMC) and the concentration of IgG isotypes in blood and milk. Proceedings of the society of nutritional physiology 20 HUSSEN, J. (2012) Einfluss von konjugierten Linolsäuren (CLA) auf das bovine Immunsystem. Tierärztliche Hochschule Hannover INGVARTSEN, K. u. J. B. ANDERSEN (2000): Integration of metabolism and intake regulation: a review focusing on periparturient animals. Journal of Dairy Science 83, 1573-1597 JANINHOFF, A. (2012) Wann ist die Milchviehhaltung rentabel? www.swissmilk.ch KACSKOVICS, I., Z. WU, N. SIMISTER, L. FRENYÓ u. L. HAMMARSTRÖM (2000): Cloning and characterization of the bovine MHC class I-like FC receptor. Journal of Immunology 164, 1889-1897 i VIII. Literaturverzeichnis KAFI, M. u. A. MIRZAEI (2010): Effects of first postpartum progesterone rise, metabolites, milk yield, and body condition score on the subsequent ovarian activity and fertility in lactating Holstein dairy cows. Tropical Animal Health and Production 42, 761-767 KEHOE, S. I., A. J. HEINRICHS, M. L. MOODY, C. M. JONES u. M. R. LONG (2011): Comparison of immunoglobulin G concentrations in primiparous and multiparous bovine colostrum. The Professional Animal Scientist 27, 176-180 KEHRLI, M., J. NEILL, C. BURVENICH, J. GOFF, J. LIPPOLIS, T. REINHARDT u. B. NONNECKE (2006): Ruminant physiology: Digestion, metabolism and impact of nutrition on gene expression, immunology and stress. Wageningen KEHRLI, M. E. u. J. P. GOFF (1989): Periparturient Hypocalcemia in Cows: Effects on Peripheral Blood Neutrophil and Lymphocyte Function. Journal of Dairy Science 72, 1188-1196 KELLING, C. L. u. C. L. TOPLIFF (2013): Bovine maternal, fetal and neonatal responses to bovine viral diarrhea virus infections. Biologicals 41, 20-25 KEPLER, C., K. HIRONS, J. MCNEILL u. S. TOVE (1966): Intermediates and products of the biohydrogenation of linoleic acid by Butyrinvibrio fibrisolvens. Journal of Biological Chemistry 241, 1359-1354 KICKHÖFEN, B., D. K. HAMMER u. D. SCHEEL (1968): Isolation and characterization of gammaG-type immunoglobulins from bovine serum and colostrum. Hoppe-Seyler's Zeitschrift für physiologische Chemie 349 KIM, J. u. F. SCHMIDT (1983): Absorption of colostral immunoglobulins by the calf. Deutsche Tierärztliche Wochenschrift 90, 283-286 KLAUS, G. G. B., A. BENNETT u. E. W. JONES (1969): A quantitative study of the transfer of colostral Immunoglobulins to the newborn calf. Immunology 16, 293-299 KOBAYASHI, A. u. I. TIZARD (1976): The response to Trypanosoma congolese infection in calves. Determination of immunoglobulins IgG1, IgG2, IgM and C3 levels and the complement fixing antibody titres during the course of infection. Tropenmedizin und Parasitologie 27, 411-417 ii VIII. Literaturverzeichnis KRUSE, V. (1970 b): Yield of colostrum and immunoglobulin in cattle at the first milking after parturition. Animal Production 12, 619-626 KUCHEN, S., R. ROBBINS, G. P. SIMS, C. SHENG, T. M. PHILLIPS, P. E. LIPSKY u. R. ETTINGER (2007): Essential Role of IL-21 in B Cell Activation, Expansion, and Plasma Cell Generation during CD4+ T Cell-B Cell Collaboration. The Journal of Immunology 179, 5886-5896 KUJALA, M., I. DOHOO u. T. SOVERI (2010): White-line disease and haemorrhages in hooves of Finnish dairy cattle. Preventive Veterinary Medicine 94, 18-27 LACETERA, N., U. BERNABUCCI, B. RONCHI u. A. NARDONE (2001): Effects of subclinical pregnancy toxemia on immune responses in sheep. American Journal of Veterinary Research 62, 1020-1024 LACETERA, N., O. FRANCI, D. SCALIA, U. BERNABUCCI, B. RONCHI u. A. NARDONE (2002): Effects on functions of ovine blood mononuclear cells for each of several fatty acids at concentrations found in plasma of healthy and ketotic ewes. American Journal of Veterinary Research 63, 958-962 LACETERA, N., D. SCALIA, O. FRANCI, U. BERNABUCCI, B. RONCHI u. A. NARDONE (2004a): Effects of nonesterified fatty acids on lymphocyte function in dairy heifers. Journal of Dairy Science 87, 1012-1014 LACETERA, N., D. SCALIA, O. FRANCI, U. BERNABUCCI, B. RONCHI u. A. NARDONE (2004b): Short communication: effects of nonesterified fatty acids on lymphocyte function in dairy heifers. Journal of Dairy Science 87, 1012-1014 LACETERA, N., D. SCALIA, D. MESHEK, U. BERNABUCCI u. R. GRUMMER (2007): Effects of intravenous triacylglycerol emulsions on lymphocyte responses to mitogens in fasted dairy cows undergoing intense lipomobilization. Journal of Dairy Research 74, 323-328 LACK, P. (2006) Bestimmung von Immunglobulin G und M im Serum neugeborener Kälber während der ersten zehn Lebenstage unter besonderer Berücksichtigung des Fütterungsregimes. Justus-Liebig-Universität, Gießen LARSON, B. (1958): Transfer of specific blood serum proteins to lacteal secretions near parturition. Journal of Dairy Science 41, 1033-1044 iii VIII. Literaturverzeichnis LARSON, B., H. H. JR. u. J. DEVERY (1980): Immunoglobulin production and transport by the mammary gland. Journal of Dairy Research 63, 665-671 LASCELLES, A. u. G. MCDOWELL (1970): Secretion of IgA in the sheep following local antigenic stimulation. Immunology 19, LEE, C. u. A. LASCELLES (1970): Antibody-producing cells in antigenically stimulated mammary glands and in the gastro-intestinal tract of sheep. Australian Journal of Experimental Biology and Medical Science 1970, 5 LEE, J. u. I. KIM (2006): Advancing parity is associated with high milk production at the cost of body condition and increased periparturient disorders in dairy herds. Journal of Veterinary Science 7, 161-166 LEWIS, G. S. (1997): Symposium: Health problems of the postpartum cow: Uterine health and disorders. Journal of Dairy Science 80, 984-994 LINZELL, J. u. M. PEAKER (1971): The permeability of mammary ducts. Journal of Physiology (London) 216, 701-716 LINZELL, J. u. M. PEAKER (1974): Changes in colostrum composition and in the permeability of mammary epithelium at about the time of parturition in the goat. Journal of Physiology (London) 243, 129-151 LINZELL, J., M. PEAKER u. J. TAYLOR (1975): The effects of prolactin and oxytocin on milk secretion and on the permeability of the mammary epithelium in the rabbit. Journal of Physiology (London) 253, 547-563 LOISELLE, M., C. STER, B. TALBOT, X. ZHAO, G. WAGNER, Y. BOISCLAIR u. P. LACRASSE (2009): Impact of postpartum milking frequency on the immune system and the blood metabolite concentration of dairy cows. Journal of Dairy Science 92, 1900-1912 LÓPEZ-GATIUS, F., M. LÓPEZ-BÉJAR, M. FENECH u. R. HUNTER (2005): Ovulation failure and double ovulation in dairy cattle: risk factors and effects. Theriogenology 63, 1298-1307 MACKENZIE, D. u. A. K. LASCELLES (1968): The transfer of [131-I]-labelled immunoglobulins and serum albumin from blood into milk of lactating ewes. Australian Journal of Experimental Biology and Medical Science 46, 285-294 iv VIII. Literaturverzeichnis MALLARD, B. A., J. C. DEKKERS, M. J. IRELAND, K. E. LESLIE, S. SHARIF, C. LACEY VANKAMPEN, L. WAGTER u. B. N. WILKIE (1998): Alteration in Immune Responsiveness During the Peripartum Period and Its Ramification on Dairy Cow and Calf Health. Journal of Dairy Science 81, 585-595 MARKUSFELD, O. (1987): Inactive ovaries in high-yielding dairy cows before service: aetiology and effect of conception. Veterinary Research 121, 149-153 MCDOWELL, G. u. A. K. LASCELLES (1970): Local antibody production in the mammary gland of the ewe. Journal of Reproduction and Fertility 21, 373-374 MCGUIRE, T., N. PFEIFFER, J. WEIKEL u. R. BARTSCH (1976): Failure of colostral immunoglobulin transfer in calves dying from infectious disease. Journal of American Veterinary Medicine Association 169, 713-718 MCNAMARA, J. P. (2000): Integrating genotype and nutrition on utilization of body reserves during lactation of dairy cattle. Symposium on Ruminant Physiology 353-370 MEHRZAD, J., L. DUCHATEAU, S. PYÖRÄLÄ u. C. BURVENICH (2002): Blood and Milk Neutrophil Chemiluminescence and Viability in Primiparous and Pluriparous Dairy Cows During Late Pregnancy, Around Parturition and Early Lactation. Journal of Dairy Science 85, 3268-3276 MEYER, H. (2004): Supplemente zu Vorlesungen und Übungen in der Tierernährung. 10. überarbeitete Auflage Verlag M. & H. Schaper, Alfeld-Hannover MILES, E. u. P. CALDER (1998): Modulation of immune function by dietary fatty acids. Proceedings of the society of nutritional physiology 57, 277-292 MOORE, M., J. W. TYLER, M. CHIGERWE, M. E. DAWES u. J. R. MIDDLETON (2005): Effect of delayed colostrum collection on colostral IgG concentration in dairy cows. American Journal of Veterinary Research 226, 1375-1377 MÖSCH, A. (2011) Parameter des Energiestoffwechsels und Immunglobulin G im Blut von Milchkühen im peripartalen Zeitraum. Berlin, FB Veterinärmedizin, i VIII. Literaturverzeichnis MOSTOV, K. (1994): Transepithelial transport of immunoglobulins. Annual review of Immunology 12, 63-8 NGUYEN, D. u. M. NEVILLE (1998): Tight junction regulation in the mammary gland. Journal of Mammary Gland Biology and Neoplasia 3, 233-245 NGUYEN, D., A. PARLOW u. M. NEVILLE (2001): Hormonal regulation of tight junction closure in the mouse mammary epithelium during the transition from pregnancy to lactation. Journal of Endocrinology 170, 347-356 NONNECKE, B., K. KIMURA, J. GOFF u. M. KEHRLI (2003): Effects of the mammary gland on functional capacities of blood mononuclear leucocyte populations from periparturient cows. Journal of Dairy Science 86, 2359-2368 NORMAN, L. M. u. W. D. HOHENBOKEN (1981): Genetic Differences in Concentration of Immunoglobulins G 1 and M in Serum and Colostrum of Cows and in Serum of Neonatal Calves. Journal of Animal Science 53, 1465-1472 OHTSUKA, H., C. WATANABE, M. KOHIRUIMAKI, T. ANDO, D. WATANABE, M. MASUI, T. HAYASHI, R. ABE, M. KOIWA, S. SATO u. S. KAWAMURA (2006): Comparison of two different nutritive conditions against the changes in peripheral blood mononuclear cells of periparturient dairy cows. The Journal of Veterinary Medical Science 68, 1161-1166 ONYIRO, O., J. OFFER u. S. BROTHERSTONE (2008): Risk factors and milk yield losses associated with lameness in Holstein-Friesian dairy cattle. The Animal Consortium 2, 1230-1237 OTTO, M. (2011): Lambert-Beer'sches Gesetz. In: Analytische Chemie Wiley VCH, S. 236-237 PAAPE, M., A. GUIDRY, N. JAIN u. R. MILLER (1991): Leukocytic defense mechanisms in the udder. Flemish Veterinary Journal 62, 95-109 PERINO, L., T. WITTUM u. G. ROSS (1995): Effects of various risk factors on plasma protein and serum immunoglobulin concentrations of calves at postpartum hours 10 and 24. Amercian Journal of Veterinary Research 56, 1144-1148 ii VIII. Literaturverzeichnis PETERSON, A. B., M. W. ORTH, J. P. GOFF u. D. K. BEEDE (2005): Periparturient responses of multiparous Holstein cows fed different dietary phosphorus concentrations prepartum. Journal of Dairy Science 88, 3582-3594 PETZOLD, M., U. MEYER, S. KERSTEN, J. SPILKE, R. KRAMER, G. JAHREIS u. S. DÄNICKE (2013): Effects of conjugated linoleic acids and dietry concentrate proportion on performance, milk composition, milk yield and metabolic parameters of periparturient dairy cows. Archives of Animal Nutrition 67, 185-201 PIERCE, A. (1955): Electrophoretic and immunological studies on sera from calves from birth to weaning. I. Electrophoretic studies. Journal of Hygiene (London) 53, 247-260 PIERCE, A. u. A. FEINSTEIN (1965): Biophysical and immunological studies on bovine immune globulins with evidence for selective transport within the mammary gland from maternal plasma to colostrum. Immunology 8, 106-123 PIRZADA, Y., S. KHUDER u. H. DONABEDIAN (2006): Predicting AIDS-related events using CD4 percentage or CD4 absolute counts. AIDS Research and Therapy 3, PITELKA, D., S. HAMAMOTO, J. DUAFALA u. M. NEMANIC (1973): Cell contacts in the mouse mammary gland. I. Normal gland in postnatal development and the secretory cycle. Journal of Cellular Biology 56, 797-818 PRITCHETT, L. C., C. C. GAY, T. E. BESSER u. D. D. HANCOCK (1991): Management and Production Factors Influencing Immunoglobulin G 1 Concentration in Colostrum from Holstein Cows. Journal of Dairy Science 74, 2336-2341 RAINARD, P. u. C. RIOLLET (2006): Innate immunitiy of the bovine mammary gland. Veterinary Research 37, 369-400 REA, D., J. W. TYLER, D. D. HANCOCK, T. E. BESSER, L. WILSON, D. KRYTENBERG u. S. SANDERS (1996): Prediction of calf mortality by use of tests for passive transfer of colostral immunoglobulin. Journal of American Veterinary Medicine Association 208, 2047-2049 READE, P., C. JENKIN u. K. TURNER (1965): The synthesis of foetal chicks and rats of serum proteins having some properties of the immunoglobulins. Australian Journal of Experimental Biology and Medical Science 43, 699-712 iii VIII. Literaturverzeichnis REIST, M., D. ERDIN, D. VON EUW, K. TSCHÜMPERLIN, H. LEUENBERGER, H. HAMMON, C. MOREL, C. PHILIPONA, Y. ZBINDEN, N. KÜNZI u. J. BLUM (2003): Postpartum reproductive function: association with energy, metabolic and endocrine status in high yielding dairy cows. Theriogenology 59, 1707-1723 RINCHEVAL-ARNOLD, A., L. BELAIR u. J. DJIANE (2002): Developmental expression of pIgR gene in sheep mammary gland an hormonal regulation. Journal of Dairy Research 69, 13-26 ROMANGNANI, S. (2006): Regulation of T cell response. Clinical and Experimental Allergy 36, 1357-1366 SAMUEL, C. A., W. R. ALLEN u. D. H. STEVEN (1976): Studies on the equine placenta. 2. Ultrastructure of the placental barrier. Journal of Reproduction and Fertility 48, 257-264 SASAKI, M., C. L. DAVIS u. B. L. LARSON (1976): Production and Turnover of IgG1 and IgG2 Immunoglobulins in the Bovine around Parturition. Journal of Dairy Science 59, 2046-2055 SCHNORR, B. (1996): Plazentation beim Wiederkäuer. In: Embryologie der Haustiere Enke Verlag, Stuttgart, S. SCHWERIN, M. (2009): Die Zucht hochleistender und gesunder Milchkühe - nur ein Traum? Züchtungskunde 81, 389-396 SHEARER, J., H. O. MOHAMMED, J. S. BRENNEMANN u. T. Q. TRAN (1992): Factors associated with concentrations of immunoglobulins in colostrum at the first milking post-calving. Preventive Veterinary Medicine 14, 143-154 SINGER, K., B. STEVENSON, P. WOO u. G. FIRESTONE (1994): Relationship of serine/threonine phosphorylation/dephosphorylation signaling to glucocorticoid regulation of tight junction permeability and ZO-1 distribution in nontransformed mammary epithelial cells. Journal of Biological Chemistry 269, 16108-16115 SMEATON, T. u. M. SIMPSON-MORGAN (1985): Epithelial cell renewal and antibody transfer in the intestine of the foetal and neonatal lamb. Australian Journal of Experimental Biology and Medical Science 63, 41-51 iv VIII. Literaturverzeichnis SMITH, K. L., L. A. MUIR, L. C. FERGUSON u. H. R. CONRAD (1971): Selective Transport of IgG1 into the Mammary Gland: Role of Estrogen and Progesterone. Journal of Dairy Science 54, 1886 - 1894 SORDILLO, L., K. SHAFER-WEAVER u. D. DEROSA (1997): Immunobiology of the mammary gland. Journal of Dairy Science 80, 1851-1865 STABEL, J. R., J. P. GOFF u. K. KIMURA (2003): Effects of Supplemental Energy on Metabolic and Immune Measurements in Periparturient Dairy Cows with Johne's Disease. Journal of Dairy Science 86, 3527-3535 STENGÄRDE, L., J. HULTGREN, M. TRAVÉN, K. HOLTENIUS EMANUELSON (2012): Risk factors for displaced abomasum or ketosis in Swedish dairy herds. Preventive Veterinary Medicine 103, 280-286 u. U. STENGEL, K.-H. (1998) Immunglobulin G-Bestimmung im Blutserum neugeborener Kälber in den ersten zehn Lebenstagen sowie im Kolostrum derer Mütter mittels eines neu entwickelten kompetitiven ELISA. Justus-Liebig-Universität, Gießen STEVENSON, J. u. E. CALL (1988): Reproductive disorders in the periparturient dairy cow. Journal of Dairy Science 71, 2572-2583 SURIYASATHAPORN, W., A. DAEMEN, E. NOORDHUIZEN-STASSEN, S. DIELEMANN, M. NIELEN u. Y. SCHUKKEN (1999): Beta-hydroxybutyrate levels in peripheral blood and ketone bodies supplemented in culture media affect the in vitro chemotaxis of bovine leukocytes. Veterinary Immunology and Immunopathology 68, 117-186 THANASAK, J., K. MÜLLER, S. DIELEMANN, A. HOEK, J. NOORDHUIZEN u. V. RUTTEN (2005): Effects of polyunsaturated fatty acids on the proliferation of mitogen stimulated bovine peripheral blood mononuclear cells. Veterinary Immunology and Immunopathology 104, 289-295 THOMPSON, G. (1996): Cortisol and regulation of tight junctions in the mammary gland of the late-pregnant goat. Journal of Dairy Research 63, 305-308 TIZARD, I. (2004): Veterinary Immunology - An Introduction. v VIII. Literaturverzeichnis TYRRELL, H. u. J. REID (1965): Prediction of the energy value of cow's milk. Journal of Dairy Science 48, 1215-1223 UNDERDOWN, B. (1989): Structural and functional aspects of IgA transcytosis. Immunological Investigations 18, 287-297 VAN DORLAND, H., S. RICHTER, I. MOREL, M. DOHERR, N. CASTRO u. R. M. BRUCKMAIER (2009): Variation in hepatic regulation of metabolism during the dry period and in early lactation in dairy cows. Journal of Dairy Science 92, 1924-1940 VAN FURTH, R., H. SCHUIT u. W. HIJMANS (1965): The immunological development of the human fetus. Journal of Experimental Medicine 122, 1173-1188 VOGELS, Z., G. CHUCK u. J. MORTON (2013): Failure of transfer of passive immunity and agammaglobulinaemia in calves in southwest Victorian dairy herds: prevalence and risk factors. Australian Veterinary Journal 91, 150-158 WENSING, T., T. KRUIP, M. J. H. GEELEN, G. H. WENTINK u. A. M. VAN DEN TOP (1997): Postpartum fatty liver in high-producing dairy cows in practice and in animal studies. The connection with health, production and reproduction problems. Compendium of Haematology 7, 167-171 WILTBANK, M., H. LOPEZ, R. SARTORI, S. SANGSRITAVONG u. A. GÜMEN (2006): Changes in reproductive physiology of lactationg dairy cows due to elevated steroid metabolism. Theriogenology 65, 17-29 WITTUM, T. u. L. PERINO (1995): Passive immune status at postpartum hour 24 and long-term health and performance of calves. Amercian Journal of Veterinary Resear ch 56, 1149-1154 ZETTL, K., M. SJAASTAD, P. RISKIN, G. PARRY, T. MACHEN u. G. FIRESTONE (1992): Glucocorticoid-induced formation of tight junctions in mouse mammary epithelial cells in vitro. Proceedings of the national academy of sciences U.S.A. 89, 9069-9073 vi IX. Anhang X. ANHANG Verwendete Chemikalien Dimethylsulfoxid (DMSO) Sigma-Aldrich, Steinheim Di-Natriumhydrogenphosphat (Na2HPO4) Sigma-Aldrich, Steinheim Natriumcarbonat (Na2CO3) Sigma-Aldrich, Steinheim Natriumchlorid (NaCl) Roth, Karlsruhe Natrium-Dihydrogenphosphat (NaH2PO4) Roth, Karlsruhe Natriumhydrogencarbonat (NaHCO3) Sigma-Aldrich, Steinheim Schwefelsäure (H2SO4), 1N Merck KG aA, Darmstadt Tetramethylbenzidin (TMB) Sigma-Aldrich, Steinheim Tween 20 Sigma-Aldrich, Karlsruhe Wasserstoffperoxid (H2O2) , 30% Merck KG aA, Darmstadt Zitronensäure-Monohydrat (Citrat) Roth, Karlsruhe a IX. Anhang Tabelle 8: Durchführung ELISA Arbeitsschritt Temperatur Menge in µl/Well Zeit Coaten der Mikrotiterplatte mit Sheep Anti-Bovine IgG1- bzw. IgG2Antikörper und Coating-Puffer Raumtemperatur (RT) bzw. 4°C 75 µl 30 min auf dem Schüttler, dann über Nacht bei 4°C Waschen mit B-Puffer RT 5 Waschgänge mit je 300 µl B-Puffer/Well 4 min Inkubation mit Erstantikörper RT 75 µl 1 h auf dem Schüttler Waschen mit B-Puffer RT 5 Waschgänge mit je 300 µl B-Puffer/Well 4 min Inkubation mit Detektionsantikörper RT 75 µl 45 min auf dem Schüttler Waschen mit B-Puffer RT 5 Waschgänge mit je 300 µl B-Puffer/Well 4 min RT 75 µl 15 – 20 min RT 50 µl Inkubation mit Substratlösung Stoppen der Farbreaktion mit Stopplösung Messung der Extinktion bei 450 nm und 630 nm b IX. Anhang Tabelle 9: Verwendete Antikörper Name A10-116A Bethyl Laboratories Texas, USA A10-117A Bethyl Laboratories Texas, USA A10-101A Bethyl Laboratories Texas, USA A10-116P Bethyl Laboratories Texas, USA A10-117P Bethyl Laboratories Texas, USA A10-101P Bethyl Laboratories Texas, USA RS10-103 Bethyl Laboratories Texas, USA Sheep Anti-Bovine IgG1 Sheep Anti-Bovine IgG2 Sheep Anti-Bovine IgM HRP conjugated Sheep Anti-Bovine IgG1 HRP conjugated Sheep Anti-Bovine IgG2 HRP conjugated Sheep Anti-Bovine IgM Bovine Immunoglobulin Reference Serum c Inc., Montgomery, Inc., Montgomery, Inc., Montgomery, Inc., Montgomery, Inc., Montgomery, Inc., Montgomery, Inc., Montgomery, IX. Anhang Tabelle 10: Übersicht über verwendete Lösungen Name Zusammensetzung 15 mM Na2CO3 35 mM NaHCO3 pH = 9,6 2,5 mM NaH2PO4 7,5 mM Na2HPO4 145 mM NaCl 0,1% Tween 20 pH = 7,2 33,3 mM Citrat 66,7 mM Na2HPO4 pH = 5,0 1,5 mg 3,3,‘5,5‘-Tetramethylbenzidine (TMB, Sigma) gelöst in 1,0 ml DMSO 1 ml TMB 10 ml Substratpuffer („C-Puffer“) 40 µl H2O2 1 N H2SO4 Coating-Puffer („A-Puffer“) Verdünnungspuffer („B-Puffer”) Substratpuffer („C-Puffer“) Substrat Substratlösung Stopplösung d IX. Anhang Tabelle 11: Zusammensetzung der verwendeten Puffer Puffer A COATING Substanz Molar 1a b c 2a Na2CO3 0,015 NaHCO3 0,035 Puffer B H2O MW g/L g/0,5 l 0x 105,99 1,590 0,795 1x 124,00 1,860 0,930 10x 286, 14 4,292 2,146 0x 84,01 2,940 1,470 WASCHEN / VERDÜNNEN pH 7,2 H2O MW g/L g/5,0 l1 0x 120,00 0,300 15,00 1x 137,99 0,345 17,25 2x 156,01 0,390 19,50 2a 0x 142,00 1,065 53,25 b 2x 177,99 1,335 66,75 7x 268,07 2,010 100,53 12x 358,14 2,686 134,30 0x 58,44 8,474 423,69 Substanz Molar 1a b c c d NaH2PO4 Na2HPO4 3a NaCl 4a Tween 20 0,0025 0,0075 0,1450 final vom Tween 20 aus der Flasche (0,1%) Puffer C 1 ml SUBSTRAT 50 ml pH 5,0 H2O MW g/L g/5,0 l2 0x 192,13 6,398 3,199 1x 210,14 6,998 3,499 2a 0x 142,00 9,467 4,733 b 2x 177,99 11,866 5,933 7x 268,07 17,871 8,936 12x 358,14 23,867 11,938 1a b c d 1 pH 9,6 Substanz Molar Citrat 0,0333 Na2HPO4 0,0667 Konzentrat (auf 5,0 l): pH 6,8 e IX. Anhang Originaldaten Tabelle 12: Originaldaten IgG1 (Plasma) 71 IX. Anhang Tabelle 13: Originaldaten IgG2 (Plasma) 72 IX. Anhang Tabelle 14: Originaldaten IgM (Plasma) 73 IX. Anhang Tabelle 15: Originaldaten IgG1 (Plasma) und EB (Tier 1 bis 36) 74 IX. Anhang Tabelle 16: Originaldaten IgG1 (Plasma) und EB (Tier 37 bis 66) 75 IX. Anhang Tabelle 17: Originaldaten IgG2 (Plasma) und EB (Tier 1 bis 39) 76 IX. Anhang Tabelle 18: Originaldaten IgG2 (Plasma) und EB (Tier 40 bis 66) 77 IX. Anhang Tabelle 19: Originaldaten IgM (Plasma) und EB 78 IX. Anhang Tabelle 20: Originaldaten Kolostrum (Tier 1 bis 59) 79 IX. Anhang Tabelle 21: Originaldaten Kolostrum (Tier 60 bis 66) Tabelle 22: Originaldaten Kälber IgG1 (Plasma) 80 IX. Anhang Tabelle 23: Originaldaten Kälber IgG2 (Plasma) Tabelle 24: Originaldaten Plasma Kälber IgM (Plasma) 81 X. Danksagung VIII. DANKSAGUNG Bereits Wilhelm Busch wusste Bescheid: Es ist ein lobenswerter Brauch: wer was Gutes bekommt, der bedankt sich auch. Und weil ich in den letzten 2 ½ Jahren so viel Gutes bekommen habe, möchte ich mich an dieser Stelle auch mal bedanken. An erster Stelle danke ich Herrn Prof. Dr. Gerhard Breves für die Überlassung des interessanten Themas und die freundliche Aufnahme in die Arbeitsgruppe. Ich habe in der Physiologie eine tolle Zeit verbracht, an die ich mich sicher immer gerne zurück erinnern werde. Vielen Dank Marion und Kerstin, für eure Geduld beim Bestellen und der Beantwortung aller meiner Fragen und - nicht zu vergessen - für eure Hilfe beim Abzentrifugieren und Umfüllen und vor allem Waschen dieser unendlich vielen Milchprobengefäße. Danke an Jens, Imke und Inga für das Proben nehmen und Micha für das Abholen der Proben aus Braunschweig („Es sind auch nur ein paar Kartons…“). Weiterhin möchte ich mich bei allen Mitarbeitern und Mitarbeiterinnen der Arbeitsgruppe Tierernährung des Friedrich-Löffler-Institutes in Braunschweig bedanken, allen voran bei Herrn Prof. Dr. Dr. Sven Dänicke und Herrn Dr. Ulrich Meyer für die Bereitstellung der Proben aus dem Tierversuch M48 und ganz besonders bei Maria Petzold für ihre unendliche Geduld im Fragen beantworten und für die Zeit, die sie sich für meine Statistik genommen hat. Vielen Dank allen Mitarbeitern und Mitarbeiterinnen der Arbeitsgemeinschaft Immunologie, besonders Herrn appl. Prof. Dr. Hans-Joachim Schuberth für die Bereitstellung des ELISA-Labors, aller Materialien, die ich für meinen ELISA benötigt habe und natürlich auch für die selbstverständliche Hilfe und das Wissen, auf das ich jederzeit zugreifen durfte. Außerdem möchte ich mich ganz besonders bei Silke, Udo und Jamal bedanken, weil sie immer da waren, wenn ich sie brauchte und natürlich auch, weil sie mir meinen ELISA beigebracht haben und mir bei allen großen und kleinen Katastrophen immer zur Seite standen. Danke auch an Anna, Mirja, Johanna und Nino, dafür dass ihr mich wie selbstverständlich aufgenommen habt und mir das 71 X. Danksagung Gefühl gegeben habt, dazuzugehören – ich habe mich in der Immunologie euretwegen immer sehr wohl gefühlt und werde die gemeinsamen FrühstücksExzesse sehr vermissen. Mein ganz besonderer Dank gilt Herrn Prof. Dr. Dr. h.c. mult. Hartwig Bostedt, für die selbstverständliche Beantwortung aller meiner Fragen und die Bereitstellung der Literatur für meine Diskussion. Vielen vielen Dank an meine tollen Kollegen, die mir die Zeit in der Physio so leicht gemacht haben: danke Steffi, dass du dir solche Arbeit mit meiner Arbeit gemacht hast und dass du so bist wie du bist. Ich werde dich schrecklich vermissen. Danke Mirja, für deine unermüdliche Hilfe mit meiner doofen Statistik – ohne dich wäre das alles nie was geworden. Danke Imke und Gigi, dafür, dass ihr mich mit zum Klettern genommen habt und dafür, dass ihr da ward, wenn ich Hilfe brauchte beim Doktorand-Sein. Ohne euch hätte ich mich am Anfang bestimmt nicht so gut zurechtgefunden und ich vermisse euch schon jetzt ungefähr immer. Danke Katrin, für die Runden auf der Bult und für die Männergespräche (und Lene, weil du meine Tasche getragen hast, als ich zwei Hände für Mila brauchte und natürlich Finja, weil du Mila verziehen hast, dass sie dir manchmal Kopfschmerzen bereitet hat). Danke Matthias und Martina, für die unermüdliche Arbeit an eurem Paper und dass ihr mir damit die Zeit so oft versüßt habt, danke Matthias für Gespräche, die ich bisher noch mit niemandem geführt habe und die auf eine besondere Art und Weise sicherlich meinen Horizont erweitert haben und dafür, dass du uns manchmal aus der Zeitung vorgelesen hast, das werde ich sehr vermissen, und ich nehme an, auch mein Überblick über das aktuelle Tagesgeschehen in Deutschland und der Welt wird darunter leiden, dass ich dich nicht mehr täglich sehe. Und danke dafür, dass du mir ganz zum Schluss – und wahrscheinlich ohne es zu wissen – den Weg zurück gezeigt hast. Danke Gesine und Kristin dafür, dass ihr für mich ungefähr perfekt seid: schön, schlau, sportlich und dann auch noch so nett, dass man noch nicht mal sauer auf euch ist, weil man beinahe platzt vor Neid. Schade, dass ihr zwei Jahre zu spät angefangen habt mit der Doktorarbeit, ich hätte so gern mehr von euch gehabt. Und: danke Johanna. Ohne dich weiß ich gar nicht, wie ich das alles überstanden hätte. Danke, dass du immer für mich (und für meine Statistik-, Literatur-, Format72 X. Danksagung und Privatprobleme) da warst (ich hab dir prophezeit, dass ich anfange zu heulen, wenn ich das hier schreibe, schon ist es passiert). Ich bin so froh, dass wir uns getroffen haben. Ich vermisse dich jetzt schon so schrecklich, das kannst du dir gar nicht vorstellen. Du bist mein Ernie, ich bin dein Bert – und das wird für immer so bleiben. Vielen vielen Dank auch an alle, die schon viel länger für mich da sind: danke Judith und Fredi und Desi, dafür, dass ihr die besten Freunde seid, die man sich wünschen kann und extradanke nochmal an Desi, weil ohne dich der ganze Kram noch lange nicht fertig wäre. Danke Anna, Claudi, Jan und Fabian, dafür, dass ihr mich nie habt vergessen lassen, dass es auch noch andere Dinge als die Tiermedizin gibt und dass die auch wichtig und spannend sein können, danke Bine und Christian für das „Zu Hause-Gefühl“ und danke Katrin und Karl-Ludwig dafür, dass ihr mir immer wieder gezeigt habt, dass Tiere gesund machen ganz genau das ist, was ich schon immer machen wollte und was ich für immer machen will und natürlich dafür, dass ihr mich so aufgenommen habt, wie ihr mich aufgenommen habt und dass ich mich bei euch genau so wohl fühle wie zu Hause. Und ganz zum Schluss: danke an die Menschen, die mir am Allerwichtigsten sind: danke Mama und Papa, dafür, dass ihr immer für mich da seid, dafür, dass ihr immer hinter mir steht und an mich glaubt und dafür, dass ihr mich zu dem Menschen gemacht habt, der ich heute bin. Danke Insa, weil du die allerbeste Schwester bist, die man sich vorstellen kann, ich wüsste nicht, was ich ohne dich machen sollte. Ich habe euch sehr lieb. Und: vielen vielen Dank Justus, Peter und Bob. Ohne euch wäre einiges so viel schwerer zu ertragen. Mein größter Dank aber dem, der mich mit offenen Armen empfangen hat, als ich zu ihm zurückgekommen bin, der immer für mich da war und auch immer da sein wird. Ich bin gespannt auf den Plan, den Du für mich hast und freue mich darauf, meinen Weg gemeinsam mit Dir zu gehen. 73