Krebsrisiko: Doch kein Roulette?
Werbung

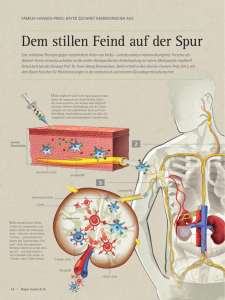
http://news.doccheck.com/de/newsletter/2724/17848/?utm_source=DC-Newsletter&utm_medium=EMail&utm_campaign=Newsletter-DE-DocCheck+News-2016-0224&user=8e4c9ed2c04b37663fb9f042822ab829&n=2724&d=28&chk=a762f6645c2d3e91c3d532fd56c89b80 Krebsrisiko: Doch kein Roulette? DocCheck News; 24. Februar 2016 Vor einem Jahr behaupteten Onkologen, die Diagnose „Krebs“ sei meist einfach nur Pech. Viele widersprachen, doch erst vor Kurzem lieferte eine Studie die Gegenposition. Unbeantwortet bleibt die Frage: Wie viele Treffer ins Genom reichen für die maligne Transformation? „Ich hab mir immer so viel Mühe gegeben, gesund zu leben – und jetzt trifft es mich – ganz unvorbereitet.“ Ärzten ist dieser Satz nicht ganz unbekannt, wenn sie ihrem Patienten die schlechte Nachricht überbringen, dass er an Krebs erkrankt ist. Noch vor 20 oder 30 Jahren schien alles ganz einfach zu sein. Wer viel rauchte, sich ungesund ernährte oder sich zu lange in der Sonne aufhielt, der musste damit rechnen, dass es ihn „trifft“. Es gab etliche Risikofaktoren, die das Risiko für einen bestimmten Tumor erhöhten. Zuweilen kamen auch vermehrte Fälle in der Familie vor, die sich auf vererbte „Suszeptibilitätsgene“ zurückführen ließen. Risikofaktor Zellteilung Bert Vogelstein vom renommierten Howard Hughes Medical Institute hatte sich mit seinen Arbeiten in der molekularen Onkologie einen in der Fachwelt geachteten Namen gemacht und schien mit einem Artikel in „Science“ vor einem Jahr alle diese Erkenntnisse plötzlich infrage zu stellen. Er und sein Kollege Cristian Tomasetti behaupteten, die Entstehung von Krebs hinge zum weit überwiegenden Teil vom Zufall ab und sei nichts anderes als „Pech“. Die gesamte Anzahl an Teilungen von Stammzellen eines bestimmten Gewebes im Laufe eines Lebens korreliere sehr stark mit der Krebsrate für dieses Organ. Jede Teilung einer dieser Gewebevorläuferzellen könne zu einem Schaden in der DNA führen. Einen Schaden mit dem Risiko, dass aus der „normalen“ Zelle eine ohne Wachstumshemmung werde. Die Publikation dieser Erkenntnisse bedeutete einen großen Rückschlag für die Krebsvorsorge. Sollte wirklich nur ein Drittel aller Krebsfälle durch ein vermeidbares Risiko entstanden sein, so wie es die Autoren errechnet hatten? Schnell gab es zahlreiche kritische Stimmen. Auch die IARC (International Agency for Research on Cancer) reagierte schnell und mit harscher Kritik. Zwei der wichtigsten Tumorarten, Karzinome von Brust und Prostata, hätten die Autoren nicht berücksichtigt. Außerdem, so die Pressemitteilung des IARC, „hätte der Vergleich verschiedener Populationen andere Resultate ergeben“. Tatsächlich ist die Krebsrate bei einzelnen Tumorformen in verschiedenen Regionen der Erde zum Teil ganz unterschiedlich. Brustkrebs kommt in Europa etwa fünfmal häufiger vor als in Ostasien oder Zentralafrika. In Australien ist das Risiko, an einem Prostatakarzinom zu erkranken, etwa 20-mal so hoch wie in Zentralasien. Auswanderer passen sich dabei den Gegebenheiten ihrer neuen Heimat an, was auch auf einen starken Einfluss von extrinsischen Faktoren schließen lässt, auch wenn diese Risikofaktoren häufig noch nicht bekannt sind. Epidemiologie gegen den Zufall Viele Monate lang konnte aber niemand stichhaltig beweisen, dass Vogelstein und Tomasetti in ihrer Arbeit Fehler gemacht hätten. Tatsächlich lassen sich die unterschiedlichen Krebsraten in verschiedenen Geweben allein durch den Einfluß von Umwelt und familiärem Risiko nicht wirklich erklären. Im Dezember erschien dann jedoch in „Nature“ eine Untersuchung [Paywall], die mit Fakten gegen das Zufallsprinzip beim Krebsroulette anzukommen schien. Yusuf Hannun und sein Team von der New Yorker Stony Brook University versuchten bei 30 Krebsarten, den Einfluss bekannter extrinsischer Faktoren zu quantifizieren. Auch wenn man die Gesamtzahl der Stammzellteilungen berücksichtigt, sind bei einzelnen Tumorformen immer noch deutliche Unterschiede in der Häufigkeit zu sehen – mehr, als sich mit dem Vogelstein-Tomasetti-Modell erklären lassen. Demzufolge muss der Anteil äußerer Einflüsse wohl weit höher sein. Die epidemiologischen Daten für einzelne Tumorformen korrelieren nicht mit den Berechnungen aus dem „Science“-Artikel, der den aus den Zellteilungen resultierenden Zufall weit höher als andere Einflüsse ansetzt. Aus Signaturen lesen Des Weiteren lassen sich bei vielen Tumoren bestimmte Veränderungen im Genom beobachten, sogenannte „Tumor-Signaturen“, die typisch für die entsprechende Geschwulst sind. Tumore, die auf extensive Sonnenbäder zurückgehen, sehen ganz anders aus als solche, bei denen der Tabakqualm als eines der größten Risiken gilt. Die Autoren schauten sich 30 dieser genetischen Fingerabdrücke genauer an und fanden nur zwei mit einer deutlichen Alterskorrelation. Die restlichen scheinen unabhängig vom Lebensalter aufzutreten. Das wiederum erhärtet die These, dass äußere Einflussfaktoren – unabhängig vom „Pech-Prinzip“ – eine wesentlich stärkere Rolle spielen. Betrachtet man schließlich noch die Fehlerrate bei Zellteilungen genau, kommt man mit den Berechnungen der Möglichkeit einer Transformation zu einer bösartigen Tumorzelle auf weit geringere Raten als die von Vogelstein/Tomasetti vertretene These des Zufalls am Anfang der meisten Tumoren. Die Autoren wagten mit ihren Analysen auch die Aussage: 70 bis weit über 90 Prozent der äußeren Faktoren und ungünstigen Erbgut-Konstellationen führen schließlich zur Diagnose „Krebs“. Ob allerdings 95 Prozent bei Gehirntumoren, mehr als 99 Prozent bei Prostata- und mindestens 98 Prozent bei Schilddrüsenkarzinomen – wie nach Hannuns Rechnung – auf extrinsische Faktoren zurückzuführen seien, so die Antwort von Vogelstein und Tomasetti an ihre Herausforderer, sei fraglich. Bis jetzt könnten Epidemiologen bei keiner dieser Tumorformen die wirkliche äußere Gefahrenquelle benennen. Sind da also äußere Faktoren, von denen wir möglicherweise bislang noch gar nichts wissen? Der renommierte englische Onkologe Mel Greaves vermutet in einem Statement des Instituts of Cancer Research, dass „90 Prozent der häufigen Krebsarten vermieden oder verhindert“ werden könnten, geht man nach den dokumentierten Unterschieden in den TumorInzidenzraten. Geburt einer Tumorzelle Wie sieht jetzt aber die Geburt und die früheste Kindheit einer Tumorzelle aus? Im November erschien dazu im New England Journal of Medicine ein interessanter Bericht [Paywall] von Pathologen aus San Francisco, zu dem der bereits bekannte Bert Vogelstein einen ausführlichen Kommentar [Paywall] in der gleichen Ausgabe schrieb. Das Team um Boris Bastian und Hunter Shain analysierte Veränderungen von nahezu 300 Genen in den ersten Stadien einer Melanomzelle bis hin zum invasiven ausgewachsenen Tumor. Welche der Mutationen sind entscheidend, um sich den Wachstumsvorteil gegenüber der Umgebung zu sichern und nicht gleichzeitig wieder von den körpereigenen Wachsoldaten um die Ecke gebracht zu werden? Driver-Mutationen finden sich als charakteristische Mutationen bei Tumorzellen und dort vor allem in Genen für Mitogen-aktivierte Proteinkinasen. Als Precurser-Läsionen tauchen sie bei Vorstufen der eigentlichen Melanomzellen auf. Im fortgeschrittenen Stadium hat sich dann die DNA-Sequenz bei NRAS und TERT-Genen verändert. Invasive Tumorzellen zeichnen sich durch biallelische Aberrationen bei CDKN2a aus. TP53 Mutationen sind wiederum ein typisches Merkmal fortgeschrittener Melanome. Drei Treffer schieben den Krebs an Ähnliche Befunde bei Zervix-, Pankreas- und Kolonkarzinomen – allerdings mit jeweils anderen Driver-Mutationen – lassen den Schluss zu, dass drei Veränderungen in solchen „Drivern“ die normale Gewebezelle zu einem aggressiven Raubtier machen, das sich ständig vermehrt. Nur etwa 200 unserer rund 20.000 Gene sind für solche Veränderungen empfänglich. Alle anderen sind sogenannte „Passenger“; Passagiere, die mitfliegen, aber keinen Einfluss auf die Flugroute haben. Es scheint so, dass je nach Gewebe jeweils andere Veränderungen die Schlüssel zur Malignität sind. Drei spezifische Veränderungen in einer bestimmten Reihenfolge an den spezifischen „Achillesfersen“ der Zelle im Laufe ihres Lebens? Eher unwahrscheinlich. Vielmehr sieht es so aus, dass die ersten zwei Treffer zu einem leichten Wachstumsvorteil und veränderter Zellarchitektur führen, die auch für benigne Tumoren typisch ist. Besonders in dieser Frühphase scheint es sehr darauf anzukommen, dass die Treffer an der vorgegebenen „empfindlichen“ Stelle landen. Der dritte Treffer bringt die angeschossene Zelle oft erst zwei oder drei Generationen später dann völlig aus der Balance und ist wohl weit weniger spezifisch. Mit ihm beginnt die invasive Laufbahn der eigentlichen Tumorzelle. Angeschossene Zellen aufspüren Das bedeutet aber auch eine gute Chance für zukünftige Krebsdiagnostik und Prävention. Bei einem ausgewachsenen Tumor sind frühe Phasen von „Breakthrough“ und Expansion nur schwer zu finden, da sie von Zellen im späteren Stadium überwachsen werden. Entdeckte man die Zellen in der frühen Phase, so böte sich möglicherweise eine gute Chance, sie noch vor dem dritten Treffer aus dem System zu nehmen. Ob das alles als eine Reihe von Zufallsereignissen geschieht, ist auch nach der NaturePublikation vom Dezember umstritten. Äußere Einflüsse wirken sich sicher auf die Fehlerrate bei der Replikation von Stammzellen aus. Gelingt es dem Reparaturdienst nicht schnell, die Veränderung im Genom aufzudecken und auszubessern, so kann das den ersten Schritt zum Tumor bedeuten. Es lohnt sich sicher, die Trefferquote so klein wie möglich zu halten. Artikel von Erich Lederer






![Neue Gentests weisen Krebserkrankungen e[...]](http://s1.studylibde.com/store/data/001993105_1-09e03fcf258ccbf353ba79006f69da77-300x300.png)