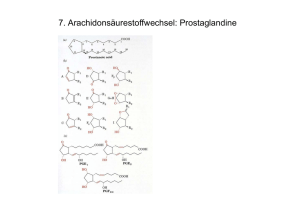
Zucker und Polysaccharide
Werbung

U. Albrecht BC1 Zucker und Polysaccharide (Voet Kapitel 10) 1. Monosaccharide 2. Polysaccharide 3. Glycoproteine U. Albrecht BC1 3. Glycoproteine Die meisten Proteine liegen als Glycoproteine vor. Die Kohlenhydratketten werden enzymatisch erzeugt ohne Beteiligung von nucleinsäure-Matrizen -> Glycoproteine haben heterogene Kohlenhydratzusammensetzung. A. Proteoglycane Proteoglycane = Mucoproteine aus Proteinen und Glycosaminoglycanen nicht kovalent zusammengesetzt. Struktur: Flaschenbürsten ähnlich Proteoglycan Untereineheitne alle 20-30 nm nichtkovalent an Hyaluronsäure-Rückgrat nichtkovalent befestigt. Mehrere Kernproteine -> Masse von bis zu 200 bis 300 kD pro Kernprotein -> Masse von Proteoglycan bis 10^6 D Kernprotein in 3 Regionen eingeteil (siehe nächste Abbildung) U. Albrecht BC1 Proteoglycane modulieren Funktion von Wachstumsfaktoren. Viele Wachstumsfaktoren binden an Heparin oder Heprarnsulfat-Kette eines Proteoglycans. Wachstumsfaktor wird von Rezeptor nur in dieser Form erkannt. -> Regionale Wirkung des Faktors. Bindung an Heparin oder Heparansulfat schützt den Faktor vor Proteolyse. Proteolyse der Kernproteine von ProteoGlycanen setzt Wachstumsfaktor (mit gebundenem Heprarnsulfat) frei -> Binden an Rezeptor Knorpel: Kollagen -> Zugfestigkeit Proteoglycane -> Elastizität wegen Hydrathülle. Ernährung des gefässlosen Gelenkknorpels durch Verschiebung der Flüssigkeit bei Bewegung -> Bewegungsarmut -> Gelenkknorpel wird dünn und brüchig. U. Albrecht BC1 B. Bakterienzellwand Bakterien von starrer Membran umgeben. Ihre Membranen sind ‚virulent‘ fürs Immunsystem von Säugern Die bakterielle Zellwand enthält also charakteristische Antigene. 2 Sorten von Bakterien: Gram-Positive und Gram-negative (Farbstoff Kristallviolett und Jod Behandlung) 25nm 3nm Die Zellwand beider Arten ist aus kovalent miteinander verknüpften Polysaccharid- und Proteinketten umhüllt. Die Bakterienzellwand ist netzartig aus Peptidglycanen aufgebaut U. Albrecht BC1 Lysozym (in Körperflüssigkeiten)spaltet ß(1->4) glykosidische Bindung-> Zertörung der Zellwand bei gram-positiven Bakterien (entdeckt durch Fleming Nasenschleim tropfte auf Baktereinkulturplatte-> Lyse beobachtet) HN-Gly-Gly-Gly-Gly-Gly-COOH 2 D-AS -> stabil gegen Proteasen Netzstruktur der Peptidglycane im gram-positiven Bakterium S. aureus = Murein U. Albrecht BC1 Penicillin hemmt Biosynthese der Zellwand -> tötet Bakterien ab Baktereinkultur kontaminiert mit Schimmelpilz -> Lyse der Bakterien die nahe an Schimmelpilz Verursacht durch Penicillin -> labiles Molekül -> 10 Jahre bis zur Isolation. Penicillin inaktiviert Enzyme die Peptidglycanmoleküle vernetzten. Das Gleichgewicht zwischen Zellwand Auf- und Abbau wird gestört -> Lyse des Bakteriums Penicillin bindet nicht an menschliche Enzyme -> therapeutisch einsetzbar. Penicillinresistente Bakterein sezernieren Penicillinasen -> inaktivierung von Penicillin Kann beeinflusst werden durch Veränderung der Penicillinseitenkette Natürlich vorkommend Benzylrest -> PenicillinG ; Aminobenzylrest -> Ampicillin Spaltung der Amidbindung U. Albrecht BC1 Bakterienzellwand ist gespickt mit Antigen-Strukturen Gram-positive Bakterien: Teichonsäuren Glycerin- Rückgrat Phosphdiester-Bindungen Verankerung an Peptidglycane (auch in Peripherie von Lipopolysaccharidmolekülen) Diese Oberflächenmolekule werden von einem Organismus in den ein Bakterium ist als Fremd erkannt -> Antikörper werden gebildet U. Albrecht BC1 Gram-negative Bakterien -> an Oberfläche ein komplexer Verbund von Lipopolysacchariden, Proteinen und Phospholipiden -> Barriere gegen Schadstoffe, weniger sensibel gegen Lysozym, Penicillin und andere Antibiotika. Ungewöhnliche Polysaccharide an der Oberfläche von gram-negativen Bakterien = O-Antigene Werden von Wirt als fremd erkannt.-> genet. Veränderung der Syntheseenzyme der O-Antigene hilft Bakterium einige Zeit dem Immunsystem des Wirtes zu entkommen. U. Albrecht BC1 C. Struktur und Funktion von Glycoproteinen N-Acetylgalactosamin wird ß-glycosidisch am Amid-N von Asparagin gebunden. ausser Pro und Asp N-glykosidisch verknüpfte Oligosaccharide besitzen Meist diesen verzweigten (Mannose)3-(NAG)2-Kern U. Albrecht BC1 Verschiedene N-Glykosidisch verknüpfte Oligosaccharide Oligosaccharide binden bevorzug in ß-Faltblatt Regionen Röntgenstrukturanalysen -> Zuckeranteile in gestreckter Form und mehr Wechselwirkung nach aussen (zum Lösungmittel) als zum Trägerprotein. -> entfernen von Oligosaccharidanteilen beeinträchtigt Konformation der Protein nur wenig. Kohlenhydratketten der Glycoproteine sind variabel U. Albrecht BC1 Frostschutz-Glycoproteine schützen Fische der Antarktis vor Gefrieren Bestehen aus sich bis zu 50fach wiederholenden tripeptiden Ala-Ala-Thr -> Proteinmolekül wird flexibler Stab, Mechanismus der Antifreeze eigenschaften nicht geklärt. Schleim enthält Mucine Glycoproteine im Schleim der Schleimhäute wirken benetzend Solche Mucine sind oft mit Sulfat verestert -> höherer Hydratisierungsgrad und thixotropes Verhalten U. Albrecht BC1 Glycoproteine in N-glycosidischer Bindung liegen in zahlreichen Glycoformen vor diese Mannose ist variabel in RNAse B Glycosylierung beeinflusst Konformation und biochemische Eigenschaften eines Proteins nur wenig. Dient aber als Erkennungsmarker innerhalb unterschiedlicher biochemischer Prozesse. U. Albrecht BC1 Oligosaccharid-Marker sind Mittler bei Zell-Zell Wechselwirkung Kohlenhydratanteil membrangebundener Glycoproteine auf äusseren Oberfläche der Zelle normale Mauszelle Krebszelle Glycoproteine mit Lectin-Ferritin visualisiert im EM Möglicherweise Funktion bei Kontaktinhibierung gesunder wachsender Zellen -> Krebszellen keine Kontaktinhibierung. Markierung eines Protens mit Zuckern kann über Kompartmentierung und Halbwertszeit des Proteins entscheiden.