BRAF V600E (mutationsspezifisch) - medac
Werbung

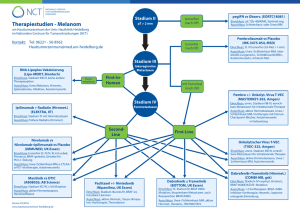
BRAF V600E mutationsspezifischer Antikörper (Klon VE1, Maus monoklonal) * Thymidin (T)-Adenosin (A) Basen-Austausch an der Nukleotid-Position 1799 des BRAF-Onkogens führt zum Aminosäure-Austausch Valin (V) zu Glutaminsäure (E) beim Braf-Protein an Position aa600. Der MAP Kinase-Pathway (auch als RAS-RAF-MEK-ERK-Signalweg bezeichnet) gehört zu den am häufigsten mutierten Signalwegen bei Krebs (bei ca. 30% aller Tumoren). Er spielt eine Schlüsselrolle bei der Übermittlung extrazellulärer Wachstumssignale durch Hormone, Zytokine oder Wachstums-Faktoren von Membranrezeptoren in den Zellkern. Die Serin/Threonin-Proteinkinase Braf ist der potenteste Aktivator des MAP Kinase-Pathways. Die aktivierende V600E-Mutation* des BRAF Onkogens ist die zweithäufigste somatische Mutation bei Krebs mit einer Mutationsfrequenz von ~8%. Etwa 50% aller Melanome sind durch Mutation des BRAF Onkogens charakterisiert, davon mehr als 95% durch BRAF V600E-Mutation, welche zu einer konstitutiven Aktivierung der Braf-Kinase führt. Braf V600E und die in der Signalkaskade nachfolgende Kinase Mek sind Ziele biologischer Therapien (KinaseInhibitoren). Vemurafenib (Zelboraf®, Roche) ist ein Mutations-spezifischer, oraler Braf-Kinaseinhibitor, der zur Therapie des metastasierten Melanoms zugelassen ist. Zur Auswahl von Patienten für die Therapie mit Vemurafenib ist der Nachweis der Braf V600E-Mutation im Tumorgewebe von entscheidender Bedeutung. Dieser Nachweis erfolgt normalerweise mit Hilfe von PCR/Sequenzierung. In Fällen, wo für die PCR/Sequenzierung nicht genügend Tumorgewebe zur Verfügung steht oder der DNA-basierte Nachweis aus anderen Gründen kein eindeutiges Ergebnis liefert (zu geringer Tumorzellanteil oder Inhibition der Amplifikation), kann der monoklonale, Braf V600E-mutationsspezifische Maus-Antikörper VE1 Tumorzellen mit der Braf V600E-Mutation sichtbar machen. VE1 färbt BRAF V600E-positive Tumoren in der großen Mehrzahl der Fälle zytoplasmatisch homogen an (97% Übereinstimmung mit BRAF Exon 15-Sequenzierung). Die Inhibition der Braf V600E-Kinase ist auch bei anderen Mutations-positiven Tumortypen Erfolg versprechend (Literatur umseitig): papilläres Schilddrüsenkarzinom (50-70% BRAF V600E-positiv) Haarzellleukämie (große Mehrzahl BRAF V600E-positiv, diagnostischer Marker) ZNS-Tumoren (BRAF V600E-positiv bei ~65-70% der pleomorphen Xanthoastrozytome, ~18% der Gangliogliome, ~10% der pilozytischen Astrozytome) Ovarialkarzinom (BRAF V600E frühes Mutationsereignis bei ~30% der serösen Karzinome mit niedrigem malignen Potenzial, Borderline-Tumoren) Kolonkarzinom (10-15%, v.a. sporadische MSI-Tumoren mit MLH1-Methylierung/CIMP) Lungenkarzinom (~2% der Adenokarzinome) Langerhans-Zell-Histiozytose (57% BRAF V600E-positiv, n=61) Gesellschaft für klinische Spezialpräparate mbH GE Diagnostika Theaterstrasse 6 D-22880 Wedel Telefon 04103/8006-342 Fax 04103/8006-359 www.medac-diagnostika.de [email protected] Die gegenüber alleiniger BRAF V600E- (oder EGFR-) Inhibition resistenten Kolonkarzinome (CRC) lassen sich offenbar mit kombinierter Inhibition von BRAF und EGFR synergistisch hemmen. Der Resistenzmechanismus beim CRC basiert auf einer Feedback-Aktivierung des EGF-Rezeptors durch das downstream aktivierte MEK-Protein. Es gibt erste Belege dafür, dass der EGFR-Expressionslevel ein nützlicher Biomarker für die Vemurafenib-Resistenz BRAF V600E-mutierter Tumoren sein könnte (Ref. 17). Die nächste Generation individualisierter Krebstherapien wird absehbar auf der Blockade mehrerer dominanter Signalwege basieren. Der MAP Kinase-Signalweg ist ein wichtiges therapeutisches Ziel (z.B. BRAF, MEK) und BRAF V600E ein wichtiger prognostischer und prädiktiver Biomarker. Bestell-Information Name BRAF V600E pan-BRAF EGFR EGFR EGFR Klon VE1 pBR1 EP38Y SP9 SP84 Spezies Verdünnung Maus 50 Ratte 100 Kaninchen 100 Kaninchen 100 Kaninchen 100 Tel. 04103/8006-111 0,1 ml E19290 E19300 --M3090 M3840 Literatur: Klon VE1 1. Long GV, et al. Immunohistochemistry is highly sensitive and specific for the detection of V600E BRAF mutation in melanoma. Am J Surg Pathol 2013; 37: 61-65. 2. Capper D, et al. Assessment of BRAF V600E mutation status by Immunohistochemistry with a mutation-specific monoclonal antibody. Acta Neuropathol 2011; 122: 11-19. 3. Capper D, et al. Immunohistochemical testing of BRAF V600E status in 1.120 tumor tissue samples of patients with brain metastases. Acta Neuropathol 2012; 123: 223-233. BRAF V600E Mutation 4. Davies H, et al. Mutations of the BRAF gene in human cancer. Nature 2002; 417: 949-954. 5. Cantwell-Dorris ER, et al. BRAF V600E: implications for carcino genesis and molecular therapy. Mol Cancer Ther 2011; 10: 385-394 (Review). Papilläres Schilddrüsenkarzinom 6. Caronia LM, et al. Role of BRAF in thyroid oncogenesis. Clin Cancer Res 2011; 17: 7511-7517 (Review). 7. Koperek O, et al. Immunohistochemical detection of the BRAF V600E-mutated protein in papillary thyroid carcinoma. Am J Surg Pathol 2012; 36: 844-850. 8. Nucera C, et al. Targeting BRAF V600E with PLX4720 displays potent anti-migratory and anti-invasive activity in preclinical models of human thyroid cancer. Oncologist 2011; 16: 296-309. ZNS-Tumoren/Gliome 9. Dougherty MJ, et al. Activating mutations in BRAF characterize a spectrum of pediatric low-grade gliomas. Neuro Oncol 2010; 12: 621-630. 10. Schiffman JD, et al. Oncogenic BRAF mutation with CDKN2A inactivation is characteristic of a subset of pediatric malignant astrocytomas. Cancer Res 2010; 70: 512-519. 11. Schindler G, et al. Analysis of BRAF V600E mutation in 1,320 nervous system tumors reveals high mutation frequencies in pleomorphic xanthoastrocytoma, ganglioglioma and extracerebellar pilocytic astrocytoma. Acta Neuropathol 2011; 121: 397-405. 12. Dias-Santagata D, et al. BRAF V600E mutations are common in pleomorphic xanthoastrocytoma: diagnostic and therapeutic implications. PLoS One 2011; 6(3): e17948 13. Nicolaides TP, et al. Targeted therapy for BRAF V600E malignant astrocytoma. Clin Cancer Res 2011; 17: 7595-7604. 14. Kleinschmidt-DeMasters BK, et al. Atypical teratoid / rhabdoid tumor arising in a ganglioglioma: genetic characterization. Am J Surg Pathol 2012; 35: 1894-1901. 15. Huillard E, et al. Cooperative interactions of BRAF V600E kinase and CDKN2A locus deficiency in pediatric malignant astrocytoma as a basis for rational therapy. PNAS 2012; 109: 8710-8715. konzentriert 0,5 ml E19292 E19302 --M3092 M3842 1 ml E19294 E19304 Z2037R M3094 M3844 gebrauchsfertig 1 ml 7 ml ------E19301 ------M3091 --M3841 Kolonkarzinom 16. Kopetz S, et al. PLX4032 in metastatic colon cancer patients with mutant BRAF tumors.J Clin Oncol 2010; 28(Suppl): abstract 3534. 17. Yang H, et al. Antitumor activity of BRAF inhibitor vemurafenib in preclinical models of BRAF-mutant colorectal cancer. Cancer Res 2012; 72: 779-789. 18. Prahallad A, et al. Unresponsiveness of colon cancer to BRAF (V600E) inhibition through feedback activation of EGFR. Nature 2012; 483: 100-103. 19. Corcoran RB, et al. EGFR-mediated re-activation of MAPK signaling contributes to insensitivity of BRAF mutant colorectal cancers to RAF inhibition with vemurafenib. Cancer Discov 2012; 2: 227-235. Haarzellleukämie 20. Andrulis M, et al. Application of a BRAF V600E mutation-specific antibody for the diagnosis of hairy cell leukemia. Am J Surg Pathol 2012; 36: 1796-1800. 21. Dietrich S, et al. Sensitivity of refractory hairy cell leukemia to BRAF inhibition. J Clin Oncol 2012; 30(Suppl): abstract 6519. 22. Dietrich S, et al. BRAF inhibition in refractory hairy cell leukemia. N Engl J Med 2012; 366: 2038-2040. 23. Tiacci E, et al. BRAF mutations in hairy-cell leukemia. N Engl J Med 2011; 364: 2305-2315. 24. Arcaini L, et al. The BRAF V600E mutation in hairy cell leukemia and other mature B-cell neoplasms. Blood 2012; 119: 188-191. 25. Tiacci E, et al. Simple genetic diagnosis of hairy cell leukemia by sensitive detection of the BRAF-V600E mutation. Blood 2012; 119: 192-195. 26. Burger JA. BRAF mutation: supporting diversity in HCL. Blood 2012; 119: 3193-3194. 27. Xi L, et al. Both variant and IGHV4-34-expressing hairy cell leukemia lack the BRAF V600E mutation. Blood 2012; 119: 3330-3332. 28. Blombery PA, et al. Detection of BRAF mutations in patients with hairy cell leukemia and related lymphoproliferative disorders. Haematologica 2012; 97: 780-783. 29. Langabeer SE, et al. Correlation of the BRAF V600E mutation in hairy cell leukaemia with morphology, cytochemistry and immunophenotype. Int J Lab Hematol 2012; 34: 417-421. 30. Ewalt M, et al. Real-time PCR-based analysis of BRAF V600E mutation in low and intermediate grade lymphomas confirms frequent occurrence in hairy cell leukaemia. Hematol Oncol 2012; 30: 190-193. 31. Lennerz JK, et al. Pyrosequencing of BRAF V600E in routine samples of hairy cell leukaemia identifies CD5+ variant hairy cell leukaemia that lacks V600E. Br J Haematol 2012; 157: 267-269. Langerhans-Zell-Histiozytose 32. Badalian-Very G, et al. Recurrent BRAF mutations in Langerhans cell histiocytosis. Blood 2010; 116: 1919-1923. Gesellschaft für klinische Spezialpräparate mbH GE Diagnostika Theaterstrasse 6 D-22880 Wedel Telefon 04103/8006-342 Fax 04103/8006-359 www.medac-diagnostika.de [email protected] REA_D66_BRAF - 12/2012 che