VL Hormone I Michael Altmann
Werbung

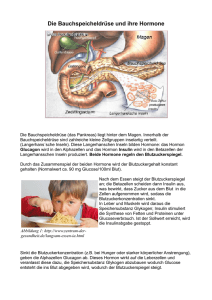
Institut für Biochemie und Molekularbiologie VL Hormone I Michael Altmann FS 2013 1 Vorlesung: Hormone I Einteilung extrazellulärer Signalmoleküle 1. Glanduläre Hormone werden in endokrinen Drüsen produziert, zB. in der Schilddrüse oder in der Hypophyse. Sie werden eingeteilt in hydrophile und hydrophobe Hormone. Hydrophile Hormone binden an Transmembranrezeptoren. Zu dieser Kategorie gehören Adrenalin und Noradrenalin, desweiteren endokrine Peptid- und Proteohormone. Zur Kategorie der hydrophoben Hormone gehören Steroidhormone, die Schilddrüsenhormon T3 und T4, Vit. D3 und Vit. A-Derivate. 2. Aglanduläre Hormone oder Gewebshormone werden von verstreuten Zellen in den unterschiedlichsten Geweben produziert. Einige Gewebshormone gelangen auch über die Blutbahn an das Zielgewebe, andere wirken para- oder autokrin. Beispiele für Gewebshormone sind Serotonin und Histamin (biogene Amine) oder gastrointestinale Hormone (für weitere Bsp., siehe L&P, Tab. 27.1). 3. Zytokine sind ohne Ausnahme Peptidhormone, die von den verschiedensten Zellen produziert und sezerniert werden, sie wirken meistens parakrin. Sie beeinflussen meist Wachstum, Proliferation und Differenzierung der Zielzellen. Als hydrophile Stoffe binden sie an Transmembranrezeptoren und lösen Signaltransduktionsketten aus. Die Unterscheidung zwischen Gewebshormonen und Zytokinen ist nicht immer einfach. Einteilung der Zytokine nach Funktion (Auswahl) Wachstumsfaktoren (Proliferation, Differenzierung) z.B. Wachstumshormon (GH), Insulin-like-growth factor (IGF), Erythropoietin (EPO) Interleukine (Immunabwehr, Entzündung) z.B. IL-1, 2, 3, 4, 6, 7, 9 Interferone (Virusabwehr, Proliferationshemmung)) z.B. α-, β-, χ-Interferon, IL-10 Chemokine (Migration, Chemotaxis) z.B. IL-8 2 Hormone der schnellen Stoffwechselregulation 1. Insulin Wege des Insulins im Körper - Insulin ist ein wichtiges anaboles Hormon, dass bei Überfluss an Glucose (aber auch an anderen Nährstoffen wie Aminosäuren) von den beta-Zellen der Langerhans schen Inseln im Pankreas ausgeschüttet wird und ins Blut abgegeben wird. -Nach einer kohlenhydratreichen Mahlzeit gelangt die durch Darmzellen aufgenommene Glucose via Pfortader zur Leber. Dort wird ein guter Teil verarbeitet (zB. zur Glycogen-Synthese), ein Glucose-Überschuss gelangt in den Pankreas. - In den beta-Zellen der Langerhans schen Inseln wird Insulin hergestellt und in Sekretgranula gespeichert (in den alpha-Zellen wird Glucagon, in den delta-zellen Somatostatin gespeichert). Bei Glucoseüberschuss kommt es zur Insulin-Ausschüttung. Insulin gelangt über die Pfortader direkt zur Leber, wo etwa 50% an Rezeptoren an der Membran von Hepatocyten binden. Das restliche Insulin gelangt an die peripheren Organe (vor allem Knochenmuskeln und Fettzellen), wo es an membranständige Rezeptoren bindet. 3 Hormone der schnellen Stoffwechselregulation 1. Insulin Biosynthese von Insulin -Insulin ist ein Peptidhormon aus 51 Aminosäuren bestehend, das bei allen Tierarten vorkommt. Auch wenn es aus 2 Peptidketten (A und B) besteht, die via S-S-Brücken kovalent miteinader gekoppelt sind, wird es aus einem einzigen einkettigen Vorläufermolekül (1 Gen) synthetisiert. -Nach Prozessierung des primären Transkriptes im Zellkern, wird im Cytoplasma das Präpro-Insulin von Ribosomen translatiert und simultan in das ER exportiert wird. -Die Präsequenz dient als Signal für das Einschleussen der Peptidkette in das Lumen des ERs. Dort wird sie von einer Protease entfernt. Das Proinsulin, das bereits die kovalenten SS-Brücken des fertigen Insulins aufweisst, wandert in den Golgi-Apparat. Dort (und zT. auch in den nachgelagerten Speichergranulas) wird mit Hilfe einer spezifischen Prohormon-Convertase das C-Peptid abgespalten, das bei Ausschüttung des Insulins auch an das Blut abgegeben wird. Das C-Peptid ist physiologisch inaktiv, kann aber zur Bestimmung vom körpereigenen Insulin (bei Diabetes IIPatienten, denen Insulin gespritzt wird) herangezogen werden. 4 1. Insulin Mechanismus der durch Glucose induzierten Insulinsekretion in beta-Zellen -Überschüssige Glucose wird von den beta-Zellen aufgenommen und wird durch Glykolyse, Citratzyklus und oxydative Phosphorylierung verstoffwechselt. Dies führt zu einer Steigerung des ATP/ADP-Quotienten. -Ein ATP-abhängiger K+-Kanal schliesst sich, was zu einer Depolarisierung im Zellinneren führt. Dies wiederum führt zur Öffnung eines spannungsabhängigen Ca2+-Kanals (Aussenkonz. 2.5 mM) und zum vorübergehenden Anstieg der Ca2+-Konzentration. -Die erhöhte Ca2+-Konzentration in der Zelle führt in einer komplexen Reaktion (nicht gezeigt) zum Verschmelzen der Speichergranula mit der Aussenmembran und zur Exocytose von Insulin und C-Peptid. 5 1. Insulin Intrazelluläre Insulin-Signalübertragung -Insulin gelangt durch das Blut an die Leber oder an die Peripherie, bindet dort an den membranständigen Insulin-Rezeptor. Mit Ausnahme von Erythrozyten, Nieren und Darmmukosa sprechen die meisten Gewebe auf Insulin an. Der Rezeptor besteht aus zwei alpha- und zwei beta-Ketten, die durch S-S-Brücken miteinader verbunden sind. Das Insulin bindet an die beiden alpha-Ketten des Rezeptors, die nicht in der Membran integriert und im äusseren Teil der Membran lokalisiert sind. Im cytoplasmatischen Teil der beta-Ketten befinden sich Tyrosin-Reste, die aufgrund von Konformationsänderungen des Rezeptors nach Bindung des Insulins autophosphoryliert (beide Ketten gegenseitig) werden. Durch die autokatalytische Phosphorylierung wird die Bindung von intrazellulären Substraten wie IRS1,2,4 an den Rezeptor ermöglicht, die wiederum an Tyrosinresten phosphoryliert werden. Je nach Zelltypus werden dadurch unterschiedliche Signalkaskaden ausgelöst. -PI3K bindet wiederum an Phosphotyrosinresten der Insulinrezeptorsubstrate und verwandelt PIP2 in PI-(3,4,5)P3, das wiederum die beiden Proteinkinasen PDK und PKB aktiviert, die wiederum gewebespezifisch (siehe nächste Seite) die GLUT-4 Translokation auslösen. Weitere Enzyme wie GSK3 (Glykogensynthase-kinase3) und PFK2 (Phosphofructokinase2) werden aktiviert, die Glycogen-Synthese und Glykolyse stimulieren. In Leber und Skelettmuskel aktiviert diese Signaltransduktionskette auch die cAMP-spezifische Phosphodieesterase-3B, wodurch der cAMP-Spiegel gesenkt wird. -Regulation der Genexpression: Als weiteres Substrat von phosphoryliertem IRS dient das Protein GRB2/SOS, das Ras aktiviert und somit die MAPK-Kaskade auslöst. 6 1. Insulin Biologische Wirkungen des Insulins -Besonders ins Gewicht fällt die Wirkung des Insulins auf Muskulatur, Fettgewebe und Leber. Insulin fördert die anabolen (aufbauenden) Stoffwechselvorgänge wie Fettsäuresynthese und Lipogenese (Leber und Fettgewebe), Glykogen-Synthese (Leber und Muskel), aber auch Proteinsynthese und die dazu erforderliche Glykolyse zur ATP-Gewinnung (Leber und Muskel). -Die bekannteste Wirkung von Insulin ist die gesteigerte Aufnahme von Glucose in Muskel- und Fettzellen (GLUT-4; siehe unten). -Die Leber verfügt nicht über ein insulinabhängig induzierbares Glucose-Transportsystem. Sie besitzt allerdings den Glucosetransporter GLUT-2, der einen sehr hohen Km-Wert für die Glucose-Aufnahme besitzt und somit auch eine gesteigerte Aufnahmegeschwindigkeit von Glucose bei sehr hohen Konzentrationen ermöglicht (dieser Vorgang wird auch als Teil des „Glucose-Sensors bezeichnet). GLUT-2 findet sich auch in der Membran der beta-Zellen des Pankreas. 7 1. Insulin Molekulare Wirkungen des Insulins -Die molekularen Stoffwechselwirkungen von Insulin sind je nach Zielgewebe sehr vielfältig. Man unterscheidet vor allem schnelle und langsame Wirkungen (für weitere Details, siehe L&P Tab. 29.2). -Bei Aktivierung durch Insulin findet in den Plasmamembranen von Fett- und Muskelzellen eine vermehrte Einlagerung von GLUT-4 statt, wodurch eine vermehrte Glucose-Aufnahme ermöglicht wird (Steigerung von Vmax bei konst. Km). GLUT-4 liegt bereits in Abwesenheit von Insulin synthetisiert in Vesikeln im Zellinneren vor, sodass eine schnelle Mobilisierung durch Einlagerung in die Membran stattfinden kann. -Weitere schnelle Wirkungen des Insulins: •Aktivierung der cAMP-spezifischen Phosphodiesterase -> cAMP sinkt; •Aktivierung der Glycogen-Synthese; •Steigerung des Aminosäuretransportes in Muskelzellen; •Induktion der Lipoprotein-Lipase (siehe weiter unten). -Langsame Wirkungen: Gesteigerte Expression der Enzyme der Glycolyse, Hemmung der Expression der Gene der Gluconeogenese. 8 2. Glukagon (Struktur) Glucagon (griech. „der Glucosebringer ) -Hauptfunktion des Glucagons ist es, auch zwischen den Mahlzeiten für einen ausreichenden Blutglucosespiegel zu sorgen (etwa 5 mM oder 80-120 mg/dl), es ist ein Antagonist des Insulins. -Für diese Aufgabe ist vornehmlich die Leber zuständig (Glykogenspeicher), entsprechend befinden sich die Rezeptoren für Glucagon auch an der Membran der Hepatocyten. -Glucagon besteht aus einer einzigen Kette von 29 Aminosäuren. Es wird in den alpha-Zellen der Langerhans schen Inseln des Pankreas synthetisiert. -Wie alle Peptidhormone wird auch Glucagon als Vorläuferpeptid „Präpro-Glukagon synthetisiert und anschliessend in Granula gespeichert, bis es bei Abfall der Glucosekonzentration in das Blut sekretiert wird. - Glucagon wird aus einer Protein-Vorstufe synthetisiert, aus der in den pankreatischen alphaZellen auch GRPP (glucagon-related polypeptide) und ein C-terminales Fragment produziert werden. - Die gleiche Protein-Vorstufe wird in neuroendokrinen Zellen des Dünndarms auch synthetisiert, aber durch Konvertasen (Proteasen) zu anderen Peptiden wie Glicentin, GLP-1, GLP-2 (glucagon-like peptide) und IP-2 (inhibitorisches Peptid) prozessiert. Interessanterweise wirkt GLP-1 antagonistisch zu Glucagon (senkt den Blutspiegel 9 durch Stimulation der Insulinsekretion). 2. Glukagon (Wirkung) - Gehemmt werden durch Glucagon: Glycogensynthese und Glykolyse, stimuliert Glykogenolyse und Gluconeogenese. -Der Glucagon-Rezeptor ist ein transmembranäres Protein, das vor allem in den Membranen von Leberzellen anzutreffen ist. Bei Aktivierung durch Glucagon wird ein intrazelluläres GProtein (Gs) aktiviert, das die Adenylatcyclase aktiviert und einen erhöhten cAMP-Spiegel auslöst. Dies führt zur Aktivierung der Proteinkinase A, die wiederum durch Phosphorylierung direkt oder indirekt zahlreiche Enzyme (oft Schlüsselenzyme) in ihrer Aktivität beeinflusst (schnelle Wirkung). - Proteinkinase A steuert durch Phosphorylierung von Transkriptionsfaktoren wie CRE-bindendem Protein (CREB) die Menge an Enzymen verschiedener Stoffwechselwege (langsame Wirkung). - Zusätzlich fördert Glucagon in der Leber die Lypolyse durch Hemmung von AcetylCoA-Carboxylase. Vermehrt gelangen Fettsäuren in die mitochondrielle Matrix, wo durch betaOxidation, Citratzyklus und oxydative Phosphorylierung ATP produziert wird. Bei länger anhaltendem Fasten werden Ketoverbindungen (beta-Hydroxybutyrat und Acetoacetat) hergestellt und anderen Organen für die Energiegewinnung zur Verfügung gestellt. 10 3. Adrenalin Wege des Adrenalins im Körper -Adrenalin ist das wichtigste Stresshormon, das bei Alarmbereitschaft aber auch bei körperlicher Arbeit ausgeschüttet wird. Bei einigen Spezies wird vornehmlich die Vorstufe Noradrenalin produziert und ausgeschüttet. Adrenalin und Noradrenalin werden als Katecholamine bezeichnet. -Der Sekretionsreiz für Adrenalin ist eine Ausschüttung präganglionärer Neurone (nervale Reize; vor allem durch Acetylcholin vermittelt), die vom ZNS (über das Rückenmark) an das Nebennierenmark weitergeleitet werden. -Die arterielle Versorgung der NN erfolgt über drei grössere Arterien. Kapillaren schlängeln sich von der Nebenniere-Rinde zum Mark und bilden dort ein Geflecht aus Sinusoiden. So kann das in der NN-Rinde produzierte Cortisol einen unmittelbaren Einfluss auf die adrenalinproduzierenden Zellen ausüben. -Neben Adrenalin wird auch Noradrenalin (Vorstufe) in Sekretgranula gespeichert und sekretiert. 11 3. Adrenalin Biosynthese der Catecholamine -Die Enzyme finden sich sowohl in den adrenergen postganglionären Nervenendigungen wie auch in den Zellen des NN-Marks. -Katecholamine sind Derivate der Aminosäuren Phenylalanin und Tyrosin. -Zusammengefasst kann man den Syntheseweg als das Ergebnis von 3 Hydroxylierungen (Phenylalanin -> Tyrosin; Tyrosin -> Dopa; Dopamin -> Noradrenalin), einer Decarboxylierung (Dopa -> Dopamin) und einer Methylierung (Noradrenalin -> Adrenalin) ansehen. •Die 3 Hydroxylierungsreaktionen werden von sog. Monooxygenasen katalysiert, die NADPH und O2 als Kosubstrate brauchen. •Die aromatische L-Aminosäure-Decarboxylase zeigt eine breite Spezifität für aromatische Aminosäuren. Sie ist auch an der Synthese anderer biogener Amine wie zB. Histamin und Serotonin beteiligt. •Für die N-Methylierung von Noradrenalin zu Adrenalin wird SAM (SAdenosylmethionin) als Methyl-Donor gebraucht. -Abbau: Vor allem in der Leber mittels Methylierung (Catecol-OMethyltransferase) und oxydativer Desaminierung (Monoaminooxidase / MAO). Es gibt zwei MAO-Isoenzyme: Typ A: kommt im ZNS vor, baut Noradrenalin ab; Typ B: findet man vornehmlich in der Leber und im Gehirn, baut zB. Dopamin ab. - MAO-Hemmstoffe finden Anwendung in der Psychiatrie oder auch bei der Behandlung des Morbus-Parkinson. 12 3. Adrenalin Wirkungen des Adrenalins auf die Blutgefässe -Adrenalin ist ein hydrophiles Hormon und wirkt somit über membranständige Rezeptoren. Adrenalin wirkt auf sehr verschiedene Organe und Zelltypen (siehe Abb.). -Man unterscheidet grundsätzlich alpha- und beta-Rezeptoren. Für beide Rezeptorenarten gibt es Subtypen: alpha1-, alpha2-, beta1-, beta2-, beta3-Rezeptoren. Die verschiedenen Rezeptoren befinden sich in unterschiedlichen Zielgeweben. Rezeptor-Typus und intrazelluläres Signalmolekül alpha1Rezeptor InsP3/ DAG; Ca2+ alpha2Rezeptor cAMPSenkung beta1/2/3Rezeptor cAMPSteigerung Wirkungen Deren Wirkungsweise ist sehr unterschiedlich, sogar antagonistisch wie im Fall des alpha1-Rezeptors (wirkt vasokonstriktorisch) und des beta2-Rezeptors (wirkt vasodilatatorisch). •Herz (beta1-Rezeptor): frequenzsteigend, höhere Kontraktionskraft; Anwendung: beta-Blocker als kompetitive Inhibitoren. •Bronchialmuskulatur (beta2-Rezeptor): dilatatorisch (antiasthmatisch.) •Blutgefässe: (alpha1-): vasokonstriktorisch (Haut; Darm); (beta2Rezeptor): vasodilatatorisch (->stärkere Durchblutung; zB. Muskel). •Stoffwechselwirkungen: Fettgewebe -> Lypolyse; Leber und Muskel 13 -> Glykogenabbau, in der Leber zusätzlich Gluconeogenese 3. Adrenalin Molekularer Mechanismus am Bsp. der Glycogen-Phosphorylase -Der aktivierte Adrenalin-Rezeptor (beta-Typus) aktiviert ein heterotrimäres G-Protein, cAMP steigt. -Proteinkinase A aktiviert indirekt (über eine Phosphorylase-Kinase) die GlycogenPhosphorylase durch Phosphorylierung. 14 Insulin versus Adrenalin Metabolische Aktivitäten der Fettzelle -Insulin induziert die Biosynthese der Lipoproteinlipase und stimuliert die Glucoseaufnahme, was zur vermehrten Triacylglycerin-Biosynthese führt. -Katecholamine (beim Menschen vor allem Adrenalin) steigern die cAMP-Konzentration und aktivieren die Proteinkinase A, die durch Phosphorylierung die Triacylglycerin-Lipase aktiviert (deshalb auch der Name hormonsensitive Lipase). -Dadurch wird der Triacylglycerin-Abbau in Fettsäuren und Glycerin eingeleitet. -Insulin wirkt dem TG-Abbau entgegen, indem es die cAMP-Phosphodiesterase aktiviert und somit (indirekt) die TG-Lipase inaktiviert. 15