Vinorelbin medac 10 mg/ml-Konzentrat zur
Werbung

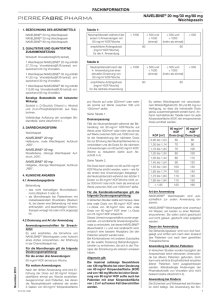
Vinorelbin medac 10 mg/ml-Konzentrat zur Herstellung einer Infusionslösung Qualitative und quantitative Zusammensetzung Vinorelbin (als Tartrat) 10 mg/ml Jede Durchstechflasche mit 1 ml Konzentrat enthält insgesamt 10 mg Vinorelbin (als Tartrat). Jede Durchstechflasche mit 5 ml Konzentrat enthält insgesamt 50 mg Vinorelbin (als Tartrat). Eine vollständige Auflistung der sonstigen Bestandteile fin-den Sie unter Abschnitt Sonstige Bestandteile. Darreichungsform Konzentrat zur Herstellung einer Infusionslösung. Klare, farblose bis hellgelbe Lösung. KLINISCHE ANGABEN Anwendungsgebiete Vinorelbin wird angewendet • als Monotherapie bei Patienten mit metastasierendem Mammakarzinom (Stadium 4), die nicht auf eine anthracyclin- oder taxanhaltige Chemotherapie angesprochen haben oder für die eine solche Therapie nicht geeignet ist. • bei nicht kleinzelligem Bronchuskarzinom (Stadium 3 oder 4). Dosierung, Art und Dauer der Anwendung Vinorelbin darf nur unter Aufsicht von Ärzten, die auf dem Gebiet der Chemotherapie erfahren sind, verabreicht werden. Streng intravenös über ein Infusionssystem. Eine intrathekale Gabe ist kontraindiziert. Erwachsene: Die übliche Dosis Vinorelbin beträgt 25 – 30 mg/m2 1mal wöchentlich. Bei der Kombination mit anderen Zytostatika muss die genaue Dosierung dem Behandlungsplan entnommen werden. Vinorelbin kann nach Verdünnung mit 20 – 50 ml isotonischer Natriumchloridlösung oder 50 mg/ml (5%iger) Glukoselösung als langsame Bolusinjektion (5 – 10 Minuten) oder nach Verdünnung mit 125 ml isotonischer Kochsalzlösung oder 50 mg/ml (5%iger) Glukoselösung als Kurzinfusion (20 bis 30 Minuten) verabreicht werden. Nach Verabreichung ist die Vene immer gut mit isotonischer Natriumchloridlösung nachzuspülen. Dosierungsänderungen: Metabolisierung und Clearance von Vinorelbin erfolgen größtenteils hepatisch: Nur 18,5% werden unverändert mit dem Urin ausgeschieden. Es ist keine prospektive Studie verfügbar, die eine geänderte Pharmakodynamik aufgrund einer veränderten Metabolisierung des Wirkstoffs belegt, um Empfehlungen für eine Reduktion der Vinorelbindosis bei eingeschränkter Leber- oder Nierenfunktion geben zu können. Eingeschränkte Leberfunktion Bei Patienten mit Brustkrebs und mäßigem Lebermetastasen (d.h. bis zu 75% der Leber sind befallen) ist die Vinorelbin-Clearance unverändert. Bei diesen Patienten besteht keine Notwendigkeit, aus pharmakokinetischen Gründen die Dosis zu reduzieren. Bei Patienten mit massiven Lebermetastasen (d.h. mehr als 75% der Leber sind befallen), wurde der tatsächliche Einfluss der verminderten Eliminationskapazität der Leber nicht untersucht. Es wird empirisch empfohlen, bei diesen Patienten die Dosis um 1/3 zu verringern und die hämatologischen Parameter sorgfältig zu überwachen. Eingeschränkte Nierenfunktion Es besteht keine Notwendigkeit, die Dosis bei Patienten mit eingeschränkter Nierenfunktion aus pharmakokinetischen Gründen zu reduzieren. Der dosisbegrenzende toxische Effekt ist meistens eine Neutropenie. Dieser Effekt tritt normalerweise zwischen dem 8. und 12. Tag nach Verabreichung auf, ist schnell reversibel und nicht kumulativ. Bei einer Neutropenie (<2000/ mm3) und/oder einer Thrombozytopenie (<75.000/mm3) sollte die Behandlung bis zur Normalisierung der Werte unterbrochen werden. Bei 35% der Behandlungen ist mit einer Unterbrechung von einer Woche zu rechnen. Maximal tolerierte Dosis pro Verabreichung: 35,4 mg/m2 Körperoberfläche Maximal tolerierte Gesamtdosis pro Verabreichung: 60 mg Die Sicherheit und Wirksamkeit bei Kindern und Jugendlichen wurde nicht geprüft. Gegenanzeigen – Überempfindlichkeit gegen Vinorelbin oder andere Vinca-Alkaloide – Neutropenie (<2000/mm3) oder schwere akute oder kürzlich (innerhalb der letzten 14 Tage) überstandene Infektionen – Thrombozytopenie (<75.000/mm3) – Schwere Einschränkung der Leberfunktion, wenn diese nicht auf die maligne Erkrankung zurückzuführen ist. – In Kombination mit Gelbfieberimpfstoffen – Schwangerschaft (siehe Abschnitt Schwangerschaft und Stillzeit) – Stillzeit (siehe Abschnitt Schwangerschaft und Stillzeit). Warnhinweise und Vorsichtsmaßnahmen für die Anwendung – Vinorelbin darf nur intravenös verabreicht werden. Eine intrathekale Gabe ist kontraindiziert. Der Verabreichung sollte immer eine Infusion mit isotonischer Kochsalzlösung folgen, um die Vene gut nachzuspülen. – Vinorelbin muss intravenös mit hoher Präzision verabreicht werden: Vor Beginn der Infusion muss sichergestellt sein, dass die Injektionskanüle korrekt intravenös platziert ist. Gelangt Vinorelbin während der Infusion in das paravasale Gewebe, kann es zu einer starken Lokalreaktion kommen. In diesem Fall ist die Infusion sofort zu unterbrechen, die Vene mit isotonischer Kochsalzlösung nachzuspülen und die verbleibende Dosis nach Punktion einer anderen Vene zu verabreichen. Im Fall eines Extravasats kann die intravenöse Gabe von Glucocorticoiden das Risiko einer Phlebitis verringern. – Bei der Behandlung sind engmaschige hämatologische Kontrollen notwendig (Bestimmung des Hämoglobingehalts, der Anzahl von Leukozyten, Neutrophilen und Thrombozyten vor jeder neuen Verabreichung). Wenn die Anzahl der Neutrophilen <2000/mm3 und/oder die Anzahl der Thrombozyten <75.000/mm3 liegt, sollte die Behandlung bis zur Normalisierung der Werte unterbrochen und der Patient sorgfältig überwacht werden (siehe Abschnitt Dosierung, Art und Dauer der Anwendung). – Zeigt der Patient Anzeichen oder Symptome einer Infektion, sollte eine sofortige Untersuchung erfolgen. – Bei schwerer Leberinsuffizienz sollte die Dosis reduziert werden: Besondere Vorsicht ist geboten und eine sorgfältige Überwachung der hämatologischen Parameter ist erforderlich (siehe Abschnitt Dosierung, Art und Dauer der Anwendung). – Eine Änderung der Dosis bei eingeschränkter Nierenfunktion ist nicht erforderlich, da Vinorelbin nur zu einem sehr geringen Teil über die Nieren ausgeschieden wird (siehe Abschnitt Dosierung, Art und Dauer der Anwendung und Pharmakokinetische Eigenschaften). – Eine Behandlung mit Vinorelbin sollte nicht gleichzeitig mit einer Strahlentherapie, bei der die Leber im bestrahlten Feld liegt, durchgeführt werden. – Dieses Arzneimittel sollte grundsätzlich nicht in Kombination mit Lebendimpfstoffen verabreicht werden. – Jeglicher Kontakt mit den Augen sollte streng vermieden werden: Es besteht das Risiko einer starken Reizung und sogar einer Ulzeration der Hornhaut, wenn das Arzneimittel unter Druck versprüht wird. Nach Augenkontakt ist sofort eine gründliche Spülung mit isotonischer Kochsalzlösung vorzunehmen. – Vinorelbin kann genotoxisch wirken. Daher sollten Männer, die mit Vinorelbin behandelt werden, während und bis zu sechs Monate nach der Behandlung kein Kind zeugen. Frauen im gebärfähigen Alter müssen während und bis zu drei Monate nach der Behandlung eine sichere Kontrazeption durchführen. Wechselwirkungen mit anderen Mitteln Die Kombination von Vinorelbin und Cisplatin (eine sehr häufige Kombination) zeigt keine pharmakokinetischen Wechselwirkungen. Allerdings ist die Inzidenz einer Granulozytopenie bei kombinierter Anwendung von Vinorelbin und Cisplatin höher als bei einer Monotherapie mit Vinorelbin. Da CYP3A4 an der Metabolisierung von Vinorelbin wesentlich beteiligt ist, können Induktoren (z.B. Phenytoin, Rifampicin) oder Inhibitoren dieses Enzyms (z.B. Itraconazol, Ketoconazol) die Pharmakokinetik von Vinorelbin verändern. Die Kombination von Vinca-Alkaloiden mit Mitomycin C erhöht das Risiko von Bronchospasmen und Atemnot. In seltenen Fällen, besonders in Kombination mit Mitomycin, wurde eine interstitielle Pneumonitis beobachtet. Vinorelbin ist ein P-Glycoprotein Substrat. Gleichzeitige Anwendung mit Inhibitoren oder Induktoren dieses Transportproteins kann die Vinorelbinkonzentration beeinträchtigen. Schwangerschaft und Stillzeit Schwangerschaft Es liegen keine hinreichenden Daten für die Verwendung von Vinorelbin bei Schwangeren vor. In tierexperimentellen Studien wirkte Vinorelbin embryo- und feto-letal sowie teratogen. Frauen dürfen während der Behandlung mit Vinorelbin nicht schwanger werden. Dieses Arzneimittel darf während der Schwangerschaft nicht angewendet werden. Tritt während der Behandlung dennoch eine Schwangerschaft ein, so soll die Möglichkeit einer genetischen Beratung angeboten werden. Frauen im gebärfähigen Alter müssen während der Therapie und bis zu drei Monate danach eine sichere Kontrazeption durchführen. Sie sollen sofort ihren Arzt informieren, wenn sie dennoch schwanger werden. Stillzeit Es ist nicht bekannt, ob Vinorelbin in die Muttermilch übergeht, daher ist vor einer Behandlung mit diesem Arzneimittel abzustillen. Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen Es wurden keine Untersuchungen zur Auswirkung auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt. Nebenwirkungen Knochenmarkstoxizität und gastrointestinale Symptome sind die häufigsten und bedeutsamsten Nebenwirkungen von Vinorelbin in Mono- und Kombinationstherapie. In der Kombinationstherapie von Vinorelbin mit anderen antineoplastischen Arzneimitteln muss beachtet werden, dass die angegebenen Nebenwirkungen häufiger und schwerer auftreten können als während und nach Monotherapie. Außerdem müssen die spezifischen Nebenwirkungen der anderen Arzneimittel berücksichtigt werden. Häufigkeiten Sehr häufig (>1/10), häufig (>1/100, <1/10), gelegentlich (>1/1000, <1/100), selten (>1/10000, <1/1000), sehr selten (<1/10000), einschließlich Einzelfälle. Infektionen und parasitäre Erkrankungen Häufig: Infektion Erkrankungen des Blutes und des LymphsysSehr häufig: Neutropenie, Anämie tems Häufig: Thrombozytopenie, febrile Neutropenie, neutropenische Sepsis mit möglicherweise tödlichem Ausgang Häufig: Allergische Reaktionen (Hautreaktionen, Atemwegsreaktionen) Selten: Schwere Hyponatriämie Sehr selten: SIADH-Syndrom Erkrankungen des Nervensystems Sehr häufig: Obstipation (siehe auch “Erkrankungen des Gastrointestinaltrakts”), Verlust der tiefen Sehnenreflexe Häufig: Parästhesie, neurosensorische und neuromotorische Störungen, Guillain-Barré-Syndrom Selten: Schwäche der unteren Extremitäten, paralytischer Ileus (siehe auch “Erkrankungen des Gastrointestinaltrakts”) Herzerkrankungen Selten:Kardiale Ischämien wie Angina Pektoris, transitorische Veränderungen des Elektrokardiogramms, Myokardinfarkte Erkrankungen der Atemwege, des Brustraums Häufig:Dyspnoe, Bronchospasmus und Mediastinums Selten: Interstitielle Lungenerkrankungen Erkrankungen des Gastrointestinaltrakts Sehr häufig: Obstipation (siehe auch “Erkrankungen des Nervensystems”), Übelkeit, Erbrechen, Diarrhöe, Stomatitis, Ösophagitis, Anorexia Selten: Pankreatitis, Paralytischer Ileus (siehe auch “Erkrankungen des Nervensystems”) Leber- und Gallenerkrankungen Sehr häufig: Anormale Leberfunktionswerte (Gesamt-Bilirubin erhöht, Alkalische Phosphatase erhöht, Aspartat Aminotransferase erhöht, Alanin Aminotransferase erhöht) Erkrankungen der Haut und des Unterhautzell- Sehr häufig: Alopezie gewebes Häufig: Hautreaktionen Selten: Generalisierte Hautreaktionen Skelettmuskulatur-, Bindegewebs- und KnoHäufig: Myalgie, Arthralgie chenerkrankungen Selten: Kieferschmerzen Erkrankungen der Nieren und Harnwege Häufig: Erhöhte Kreatininwerte Allgemeine Erkrankungen und Beschwerden Sehr häufig: Müdigkeit, Fieber, Schmerz an unterschiedlichen Stellen, Asthenie, Erytheme am Veam Verabreichungsort rabreichungsort, Schmerzen am Injektionsort, Verfärbung und Phlebitis am Verabreichungsort Selten: Nekrose am Verabreichungsort Grad (G) der Toxizität entsprechend WHO Klassifikation Infektionen und parasitäre Erkrankungen – Infektionen können häufig auftreten, meistens aufgrund von Knochenmarksdepression. Erkrankungen des Blutes und des Lymphsystems – Die Knochenmarksdepression ist der dosisbegrenzende toxische Effekt und führt hauptsächlich zu einer Neutropenie (G1: 9,7%; G2: 15,2%; G3: 24,3%, G4: 27,8%), die innerhalb von 5 – 7 Tagen reversibel und nicht kumulativ ist. Die stärkste Ausprägung liegt zwischen dem 7. und 14. Tag nach Anwendung. – Febrile Neutropenie, neutropenische Sepsis, die in einigen Fällen (1,2%) einen tödlichen Ausgang hatten. – Anämie (G1-2: 61,2%; G3–4: 7,4% in der Monotherapie) und Thrombozytopenie (G1-2: 5,1%; G3–4: 2,5% in der Monotherapie) können auftreten, sind jedoch selten schwerwiegend. Erkrankungen des Immunsystems – Allergische Reaktionen (Hautreaktionen, Atemwegsreaktionen) sind häufig. Stoffwechsel- und Ernährungsstörungen – Selten wurde über schwere Hyponatriämie und in sehr seltenen Fällen über das SIADH-Syndrom (Syndrom of inappropriate antidiuretic hormone secretion) berichtet. Erkrankungen des Nervensystems Peripheres Nervensystem Die neurologischen Störungen sind im Allgemeinen auf den Ausfall der tiefen Sehnenreflexe (G1: 17,2%; G2: 3,6%; G3: 2,6%; G4: 0,1%) beschränkt. Schwere Parästhesien mit neurosensorischen und neuromotorischen Symptomen treten gelegentlich auf (G2: 3,6%; G3: 2,6%; G4: 0,1%). Sehr selten wurde über das Guillain-Barré-Syndrom berichtet. Nach längerer Anwendung wurde über eine Schwäche in den unteren Extremitäten berichtet. Diese Symptome sind im Allgemeinen reversibel. Autonomes Nervensystem Das Hauptsymptom ist eine Obstipation (G1: 16,9%; G2: 4,9%; G3: 2%; G4: 0,7%), die selten zu einem paralytischen Ileus führt (siehe auch “Erkrankungen des Gastrointestinaltrakts”). Die Inzidenz dieser Reaktionen kann erhöht werden, wenn Vinorelbin mit anderen Chemotherapeutika kombiniert wird. Herzerkrankungen – Selten wurde über kardiale Ischämien (Angina pectoris oder transitorische EKG-Veränderungen, Myokardinfarkt) berichtet. Erkrankungen der Atemwege, des Brustraums und Mediastinums – Wie bei anderen Vinca-Alkaloiden können bei einer Therapie mit Vinorelbin medac Dyspnoe und Bronchospasmen auftreten. Selten wurde über interstitielle Pneumopathien berichtet, insbesondere bei Patienten, die eine Kombination von Vinorelbin medac mit Mitomycin erhielten. Erkrankungen des Gastrointestinaltrakts – Übelkeit und Erbrechen werden sehr häufig beobachtet (G1: 19,9%; G2: 8,3%). Schwere Übelkeit und starkes Erbrechen können häufig auftreten (G3: 1,9%; G4: 0,3%). Die Inzidenz von Übelkeit und Erbrechen kann erhöht werden, wenn Vinorelbin mit anderen Chemotherapeutika kombiniert wird. Die Häufigkeit kann durch Antiemetika beherrscht werden. – Obstipation und paralytischer Ileus (siehe auch “autonomes Nervensystem”). Nach Normalisierung der Darmtätigkeit kann die Behandlung fortgesetzt werden. – Stomatitis und Diarrhöe (G1: 7,6%; G2: 3,6%; G3: 0,7%; G4: 0,1%) und Ösophagitis können auftreten. Schwere Diarrhöe wurde gelegentlich beschrieben. – Anorexie wurde sehr häufig beobachtet (G1-2: 14%; G3: 1%) – Selten wurde über Fälle von Pankreatitis berichtet. Leber- und Gallenerkrankungen Eine vorübergehende Erhöhung der Leberwerte ohne klinische Symptome wurde beobachtet: Gesamt-Bilirubin, Alkalische Phosphatase, Aspartat Aminotransferase, Alanin Aminotransferase. Erkrankungen der Haut und des Unterhautzellgewebes Alopezie in leichter Ausprägung kann häufig auftreten. Sie kann sich bei weiterer Behandlung verstärken (G1-2: 21%; G3-4: 4,1% in Monotherapie). Vinorelbin kann häufig Hautreaktionen und in seltenen Fällen generalisierte Hautreaktionen auslösen. Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen Bei Patienten, die mit Vinorelbin behandelt wurden, wurde über Arthralgien einschließlich Kieferschmerzen und Myalgien berichtet. Erkrankungen der Nieren und Harnwege Häufig wurden erhöhte Kreatininwerte beobachtet. Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Patienten, die mit Vinorelbin medac behandelt wurden, können Müdigkeit, Asthenie, Fieber und Schmerzen an verschiedenen Stellen, wie z.B. thorakale Schmerzen und Tumorschmerzen zeigen. Reaktionen an der Injektionsstelle können Erytheme, brennende Schmerzen, eine Verfärbung der Vene und eine lokale Phlebitis (G1: 12,3%; G2: 8,2%; G3: 3,6%; G4: 0,1% in der Monotherapie) einschließen. Wie andere Vinca-Alkaloide hat Vinorelbin eine vesikante Wirkung. In seltenen Fällen wurde eine lokale Nekrose aufgrund von Extravasaten beobachtet. Durch korrekte intravenöse Positionierung der Kanüle oder des Katheters sowie durch Bolusinjektion und eine gute Nachspülung der Vene kann diese Nebenwirkung begrenzt werden. Überdosierung Über versehentliche akute Überdosierung beim Menschen wurde berichtet: Es kommt dabei zu einer Knochenmarkshypoplasie auch in Verbindung mit Infektionen, Fieber und paralytischem Ileus. Symptomatische Maßnahmen wie Bluttransfusionen oder Behandlung mit Breitbandantibiotika werden normalerweise auf Anweisung des Arztes begonnen. Ein Antidot ist nicht bekannt. Da ein spezifisches Antidot bei Überdosierung von intravenös verabreichtem Vinorelbin nicht bekannt ist, sind im Fall einer Überdosierung symptomatische Maßnahmen erforderlich, z.B.: – Fortlaufende Kontrolle der Vitalzeichen und sorgfältige Überwachung des Patienten – Tägliche Blutbildkontrollen, um die Notwendigkeit von Transfusionen, die Notwendigkeit einer Gabe von Wachstumsfaktoren und die Notwendigkeit einer intensivmedizinischen Betreuung rechtzeitig zu erkennen, um das Infektionsrisiko verringern zu können. – Maßnahmen zur Vorbeugung oder Behandlung eines paralytischen Ileus – Überwachung des Kreislaufsystems und Kontrolle der Leberfunktion – Infektionsbedingte Komplikationen können mit Breitbandantibiotika behandelt werden. Das Auftreten eines paralytischen Ileus kann eine Entlastung durch eine Sonde erforderlich machen. Erkrankungen des Immunsystems Stoffwechsel- und Ernährungsstörungen PHARMAKOLOGISCHE EIGENSCHAFTEN Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Antineoplastische und immunmodulierende Substanzen, Vinca-Alkaloide ATC-Code: L01CA04 Vinorelbin ist eine antineoplastische Substanz aus der Gruppe der Vinka-Alkaloide. Vinorelbin unterscheidet sich von den anderen Vertretern der VinkaAlkaloide durch einen strukturell veränderten Catharantin-Anteil im Molekül. Auf molekularer Ebene wirkt Vinorelbin auf das dynamische TubulinGleichgewicht im Mikrotubulussystem der Zelle. Vinorelbin verhindert die Polymerisation von Tubulin, wobei es sich vorzugsweise an mitotische Mikrotubuli anlagert. Axonale Mikrotubuli werden nur bei hohen Wirkstoffkonzentrationen beeinflusst. Die durch Vinorelbin induzierte Spiralisierung von Tubulin ist geringer ausgeprägt als bei Vincristin. Vinorelbin führt zu einer Blockierung der Mitose in der G2-/ M-Phase, wobei es in der Interphase oder der darauffolgenden Mitosephase zum Zelltod kommt. Pharmakokinetische Eigenschaften Nach intravenöser Bolusinjektion oder Infusion beim Patienten wird Vinorelbin aus dem Blut triexponentiell eliminiert. Darauf folgt eine langsame Eliminationsphase mit einer langen terminalen Halbwertszeit von mehr als 40 Stunden. Die Gesamt-Clearance von Vinorelbin ist hoch (0,97 – 1,26 l/ h/kg). Der Wirkstoff zeigt eine beträchtliche Gewebeverteilung. Hierbei reicht das Verteilungsvolumen von 25,4 – 40,1 l/kg. Vinorelbin reichert sich signifikant im Lungengewebe an. In einer Untersuchung an bioptisch gewonnenem Material war die Konzentration im Lungengewebe 300mal höher als im Serum. Die Bindung an Plasmaproteine ist schwach (13,5%). Allerdings bindet Vinorelbin stark an Thrombozyten (78%). Es hat sich gezeigt, dass intravenös verabreichtes Vinorelbin bis zu Dosen von 45 mg/m2 eine lineare Pharmakokinetik aufweist. Vinorelbin wird vorwiegend durch CYP3A4, eine Isoform vom Cytochrom P450, metabolisiert. Alle Metaboliten wurden identifiziert, und mit Ausnahme von 4O-Deacetylvinorelbin, dem Hauptmetaboliten im Blut, sind alle inaktiv. Die renale Elimination ist gering (<20% der Dosis). Geringe Konzentrationen von Deacetylvinorelbin wurden beim Menschen nachgewiesen, doch im Allgemeinen wird Vinorelbin unverändert mit dem Urin ausgeschieden. Die biliäre Ausscheidung stellt sowohl für die Metaboliten als auch für unverändertes Vinorelbin den vorherrschenden Eliminationsweg dar. Die Auswirkungen von Nierenfunktionsstörungen auf die Pharmakokinetik von Vinorelbin wurden nicht untersucht. Aufgrund der geringen renalen Ausscheidung ist jedoch die Notwendigkeit einer Dosisreduzierung bei Niereninsuffizienz nicht gegeben. Bei Patienten mit Metastasen in der Leber kam es erst bei einem Befall der Leber von über 75% zu einer Veränderung der durchschnittlichen Clearance von Vinorelbin. Bei 6 Patienten mit mäßiger hepatischer Dysfunktion (Bilirubin ≤2 x ULN und Aminotransferase ≤5 x ULN), die mit bis zu 25 mg/m2 behandelt wurden, und bei 8 Patienten mit schwerer hepatischer Dysfunktion (Bilirubin >2 x ULN und/ oder Aminotransferasen >>5 x ULN), die bis zu 20 mg/m2 erhielten, entsprach die mittlere Gesamtclearance derjenigen von Patienten mit normaler Leberfunktion. Diese Daten können allerdings für Patienten mit reduzierter Eliminationskapazität der Leber nicht repräsentativ sein. Daher ist bei Patienten mit schwerer Einschränkung der Leberfunktion Vorsicht geboten und eine sorgfältige Überwachung der hämatologischen Parameter erforderlich (siehe Abschnitt Dosierung, Art und Dauer der Anwendung und Warnhinweise und Vorsichtsmaßnahmen für die Anwendung). Präklinische Daten zur Sicherheit Die limitierende Toxizität in Tieren ist die Knochenmarksdepression. In Tierversuchen induzierte Vinorelbin Aneuploidien und Polyploidien. Es ist davon auszugehen, dass Vinorelbin auch im Menschen genotoxisch wirkt (Induktion von Aneuploidie und Polyploidie). Kanzerogenitätsstudien in Mäusen und Ratten verliefen negativ, allerdings wurden nur niedrige Dosen getestet. In Tierversuchen zur Reproduktionstoxikologie waren Auswirkungen bei subtherapeutischen Dosierungen zu beobachten. Vinorelbin war embryo- und fetotoxisch, es löste beispielsweise intra-uterine Wachstumsstörungen und verspätete Knochenbildung aus. Teratogenität (Fusion der Wirbel, fehlende Rippen) wurden bei für das Muttertier toxischen Dosen festgestellt. Zusätzlich waren Spermatogenese und Sekretion der Prostata und der Vesicula seminalis reduziert; jedoch war die Fruchtbarkeit der Ratten nicht vermindert. PHARMAZEUTISCHE ANGABEN Sonstige Bestandteile Wasser für Injektionszwecke. Inkompatibilitäten Vinorelbin medac 10 mg/ml-Konzentrat zur Herstellung einer Infusionslösung darf nicht mit alkalischen Lösungen verdünnt werden (Präzipitationsgefahr). Das Arzneimittel darf, außer mit den unter Abschnitt Hinweise für die Handhabung aufgeführten, nicht mit anderen Arzneimitteln gemischt werden. Dauer der Haltbarkeit 3 Jahre. Rekonstituierte Lösung: Die chemische und physikalische Stabilität der gebrauchsfertigen Lösung wurde über 24 Stunden bei Lagerung bei 2 bis 8° C und bei 25° C nachgewiesen. Vom mikrobiologischen Standpunkt aus sollte das Produkt sofort verwendet werden. Wird es nicht sofort verwendet, liegen Lagerzeit und -bedingungen in der Verantwortung des Verbrauchers und sollten normalerweise nicht länger als 24 Stunden bei 2 – 8° C betragen, es sei denn, das Öffnen und die Verdünnung haben unter kontrollierten und validierten aseptischen Bedingungen stattgefunden. Besondere Lagerungshinweise Im Kühlschrank lagern (2 – 8° C). In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen. Nicht einfrieren. Art und Inhalt des Behältnisses Durchstechflasche aus Glas Typ I mit fluoropolymerüberzogenem Bromobutylgummistopfen und Aluminiumverschluss. Packungsgrößen: 1 ml oder 5 ml Konzentrat in Packungen von 1 oder 10 Durchstechflaschen sind erhältlich. Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht. Hinweise für die Handhabung Die Herstellung und Verabreichung von Vinorelbin medac sollte nur von Fachkräften durchgeführt werden. Geeigneter Augenschutz, Einmalhandschuhe und Einmalschürze müssen getragen werden. Verschüttete oder ausgelaufene Substanz muss aufgewischt werden. Jeglicher Kontakt mit den Augen muss streng vermieden werden. Nach Augenkontakt ist sofort eine gründliche Spülung mit physiologischer Kochsalzlösung vorzunehmen. Nach der Zubereitung muss jede exponierte Stelle gründlich sauber gemacht sowie Gesicht und Hände gewaschen werden. Es sind keine Inkompatibilitäten zwischen Inhalt und Behälter für Vinorelbin medac und farblosem Neutralglas, PVC-Beutel, Vinylacetatbeutel oder PVCInfusionsbestecken bekannt. Es wird empfohlen, Vinorelbin medac als Infusion über eine Dauer von 5 – 10 Minuten nach Verdünnung mit 20 – 50 ml isotonischer Kochsalzlösung oder 50 mg/ml (5%) Glukoselösung oder als Kurzinfusion (20 – 30 Minuten) nach Verdünnung mit 125 ml isotonischer Kochsalzlösung oder 50 mg/ml (5%) Glukoselösung zu verabreichen. Nach der Infusion muss die Vene immer gut mit mindestens 250 ml isotonischer Lösung nachgespült werden. Nicht verwendete Arzneimittel sowie Abfall sind entsprechend den nationalen Anforderungen zu entsorgen. Zulassungsinhaber: medac, Hamburg, Deutschland. Zulassungsnummer: 1–26269 Zulassung: 23. März 2006. Stand der Information: März 2007. Abgabe: Rezept- und apothekenpflichtig, wiederholte Abgabe verboten. PKZ: 1ML 10 ST * (EKO: N) [394.85] , 5ML 10 ST * (EKO: N) [1815.20]