B. Unerwünschte Immunreaktionen
Werbung

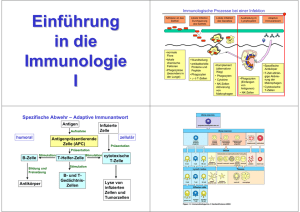
Immunpharmakologie A. Grundlagen des Immunsystems A.1. Immunantwort A.2. Erkennung von Antigenen durch T-Zellen A.3. Antikörper B. Unerwünschte Immunreaktionen B.1. Ablauf B.2. Ursachen B.3. Einteilung C. Pharmakotherapie von unerwünschten Immunreaktionen C.1. Hemmung von Immunreaktionen C.1.1. Hemmung der Freisetzung oder Wirkung von Entzündungsmediatoren C.1.2. Immunsupressive Pharmaka C.2. Förderung von Immunreaktionen (Mediatoren des Immunsystems) C.2.1. Granulocyten-Kolonie-stimulierender Faktor (G-CSF) C.2.2. Immunstimulantien 1 Immunpharmakologie A. Grundlagen des Immunsystems A.1. Immunantwort - unspezifische Abwehr im Plasma gelöste Abwehrstoffe: Lysozym, Komplementfaktoren, natürliche Killerzellen (NK), Phagocyten Anlocken durch Chemokine (Chemotaxis), Schädigung und Phagocytose des Erregers - spezifische humorale Abwehr Antikörper produziert von B-Lymphocyten nach Aktivierung - spezifische zelluläre Abwehr Aktivierung von T-Lymphocyten (T-Zellrezeptor): cytotoxische T-Zellen, T-Helferzellen (auch Aktivierung von B-Zellen) Cytotoxische T-Zellen (CD8 positiv): töten Zielzellen ab T-Helferzellen (CD4 positiv): TH1: sezernieren Interleukine, Interferon, TNF TH2: sezernieren Interleukine Aktivierung B-Zellen 2 MHC I Interferon TH2 TH1 Perforin MHC I humoral zellulär Vereinfachtes Schema der Immunantwort 3 A.2. Erkennung von Antigenen durch T-Zellen T-Zellrezeptor auf T-Zellen erkennt Antigenfragmente, die mit Hilfe von MHC-Molekülen (major histocompatibility complex) auf der Zelloberfläche von Antigen präsentierenden Zellen (APC) präsentiert werden. MHC I: auf allen Zellen Binden Peptide von Erregern Cytotoxische T-Zellen (CD8 Corezeptor) erkennen Peptid: MHC I MHC II: v.a. auf Immunzellen Binden Peptide aus phagocytierten Antigenen T-Helferzellen (CD4 Corezeptor) erkennen Peptid: MHC II T-Helferzelle (TH ) APC Cytotoxische T-Zelle APC 4 A.3. Antikörper Y-förmig: Fab-Fragment bindet Antigen Fc-Fragment bindet an Fc-Rezeptor von Phagocyten IgG, IgE, IgM, IgA, IgD Antikörpervielfalt: Gründe: multiple Gene, somatische Rekombination, somatische Mutation 1011 verschiedene AntikörperVarianten Funktion: Komplement: Neutralisierung, Opsonisierung, Komplementaktivierung System von Plasmaproteinen, die mit gebundenem Antikörper interagieren Wirkung: Chemotaxis ( Entzündung durch Anlocken von Leukocyten), Lyse, Opsonisierung 5 B. Unerwünschte Immunreaktionen (Allergische Reaktionen) Allergie (griech.: anders handeln), veränderte Immunreaktion B.1. Ablauf - - AG-Erstkontakt AK-Bildung T-Zellaktivierung Sensibilisierung Überschießende IA bei erneutem AG-Kontakt = allergische Reaktion (Typ I-IV) Entzündungsreaktionen (Zerstörung von Zellen und Geweben) klinische Erscheinung Allgemeine Therapie: -Allergenkarenz -symptomatisch z.B. Immunsuppression, Entzündungshemmung B.2. Ursachen 1. Reaktionen auf „harmlose“ Fremdsubstanzen z.B. Heuschnupfen, anaphylaktischer Schock, atopisches Ekzem, Kontaktekzem 2. Autoimmunerkrankungen: Reaktion gegen körpereigenen Antigene z.B. Rheumatoide Arthritis, Multiple Sklerose 3. Transplantatabstoßung: Reaktion gegen transplantierte Organe 6 B.3. Einteilung Allergische Reaktionen Typ I-IV Typ I (anaphylaktische allergische Reaktion) Sensibilisierung führt zur Bildung von IgE, Fc-Ende bindet an Mastzellen (basophile Granulocyten), beim 2. Kontakt Antigenbindung an IgEbesetzte Mastzellen rasche Ausschüttung von Entzündungsmediatoren Immunkomponente: IgE Antigen: löslich Effektor: Mastzellen (Gewebe), basophile Granulocyten (Blut); Ausschüttung von Mediatoren (Histamin, Leukotrien) z.B. Heuschnupfen, anaphylaktische Reaktion 7 Histamin in Natur weit verbreitet (Brennesselhaare, Insekten) im Menschen - Mastzellen, basophile Granulocyten - Magen: Speicherung in Schleimhaut stimuliert Magensäureproduktion - Gehirn: Überträgerstoff von histaminergen Neuronen Bildung aus Histidin Freisetzung aus Gewebsmastzellen und basophilen Granulocyten Rezeptor-Subtypen und Wirkungen Histamin aktiviert G-Protein gekoppelte Histaminrezeptoren (H1, H2, H3) H1-Rezeptor: Stimulation Aktivierung Phospholipase C Ca2+-Freisetzung Bronchokonstriktion, NO-vermittelte Vasodilatation, Gefäßpermeabilität (Rötung), Erregung sensibler Nervenendigungen Juckreiz H2-Rezeptor: Stimulation Aktivierung der Adenylylcyclase Aktivierung cAMP abhängiger Proteinkinasen Magensäure-Produktion steigt, Vasodilatation H3-Rezeptor: Hemmung der Adenylylcyclase (nicht genau bekannt) Hemmung der exocytotischen Transmitterfreisetzung (Gehirn) Klinische Bedeutung: H1 und H2- Blocker 8 Typ II (cytotoxische allergische Reaktion) Allergen bindet an Zelloberfläche (z.B Medikamente binden an Thrombocyten), körpereigene Zellen werden als fremde behandelt Immunkomponente: IgG oder IgM Antigen: Proteinkomplex an Zelloberfläche Effektor: komplement- oder antikörperabhängige zelluläre Mechanismen, Makrophagen z.B. Arzneimittelallergie Lupus erythematodes thrombocytopenische Purpura (Hautblutung) 9 Typ III (allergische Immunkomplexreaktion) Antikörperkomplex Ablagerung in Gefäßen Gefäßschädigung Entzündung Gewebeschädigung Immunkomponente: IgG oder IgM Antigen: löslich Effektor: Komplement, Phagocyten z.B. rheumatoide Arthritis, Reaktionen auf Tierseren („Serumkrankheit“) Therapie: symptomatisch (z.B. Glucocorticoide) Typ IV (T-Zell vermittelte allergische Reaktion) Bei „chronischer“ AG Exposition Immunkomponente: T-Zellen (TCR) Antigen: zellassoziert (MHC) Effektor: Cytotoxizität, Phagocytose z.B. Kontaktekzem, atopische Ekzem; Autoimmunerkrankungen, Abstoßung von Transplantaten 10 C. Pharmakotherapie von unerwünschten Immunreaktionen C.1. Hemmung von Immunreaktionen Jede Hemmung des IS hat negative Folgen Nebenwirkungen: - erhöhte Infektionsgefahr - Steigerung des Risikos für maligne Neoplasien C.1.1. Hemmung der Freisetzung oder Wirkung von Entzündungsmediatoren Anwendung: Prophylaxe und Therapie von allergischen Reaktionen Typ I Mastzelldegranulationshemmer (-stabilisatoren) Chromoglicinsäure, Nedocromil Hemmung der Freisetzung von Mediatoren (Histamin, Leukotrien) aus Mastzellen; Wirkmechanismus unbekannt Anwendung: Asthma bronchiale (Inhalation) H1-Rezeptor-Antagonisten (H1 Antihistaminika) 1. Generation: Promethazin, Clemastin - Spezifität NW z.B. im ZNS - Anwendung: bei allergischem Schock 2. Generation: Terfenadin, potenziell kardiotoxisch nicht mehr auf dem Markt, Nachfolger: Fexofenadin - ZNS NW Leukotrienrezeptor-Antagonisten Montelukast - perorale Verabreichung, gegen Entzündung der Bronchialschleimhaut Anwendung: Prophylaxe bei Asthma bronchiale 11 C.1.2. Immunsupressive Pharmaka Hemmung der Proliferation von Lymphocyten und anderen sich schnell teilenden Zellen NW (z.B. Krebs, Erkrankungen des Magen-Darmtrakts, Haarausfall) Anwendung allgemein: Autoimmunerkrankungen, Transplantationen Cyclosporin und ähnliche Pharmaka Cyclosporin A Cyclisches Peptid aus Pilzen 11 atypische AS, orale Gabe möglich Wirkung: Hemmung der Interleukin-2 -Bildung, Proliferation/Differenzierung von T-Zellen Tacrolimus (früher FK506), Wirkmechanismus ähnlich wie Cyclosporin Sirolimus blockiert Signaltransduction von IL-2 T-Zellproliferation Anwendung: Standardtherapie bei Organtransplantation (maßgeblich an Erfolgen beteiligt) 12 Cyclosporin Lipophiles, cyclisches Peptid (orale Gabe) Hemmt Synthese von Interleukin-2 Blockierung Proliferation/Differenzierung von T-Zellen 1. 2. 3. 4. Cyclosporin bindet an Cyclophilin Cyclosporin:Cyclophilin blockiert Calcineurin keine Aktivierung (Dephosphorylierung) von NF-Atc keineTranskription von Interleukin-2 13 Zytostatika Anwendung in relativ geringer Dosis Azathioprin Purin-Antimetabolit: metabolisiert zu Mercaptopurin falsches Nukleotid Cyclophosphamid kovalente Bindung an die DNS sehr stark immunsupressiv Methotrexat Hemmstoff der DihydrofolsäureReduktase, beteiligt an der Tetrahydrofolsäurebildung Mycophenolat-mofetil Hemmung der IPM-DH (InosinmonophosphatDehydrogenase) notwendig für Purin de novo Synthese 14 Glucocorticoide Steroidhormone, Regulation der Transkription und weitere Wirkmechanismen Anwendung bei unerwünschten Entzündungsreaktionen: Heuschnupfen, Asthma bronchiale, Ekzemen der Haut, rheumatoide Arthritis, Transplantatabstossung Nebenwirkungen bei systemischer/chronischer Applikation CushingSyndrom, Osteoporose durch Verminderung der Calciumresorbtion Weitere Hemmstoffe der Immunreaktion Antikörper Muromonab CD3 monoklonaler Antikörper gegen CD3 Daclizumab, Basiliximab Chimäre, monoklonale Antikörper gegen Rezeptor für Interleukin2 Fc: human, Fab: muringeringere Antigenität AK gegen CD4 (T-Helfer Zell-spezifisch) in klinischen Studien Antilymphocyten-Serum mit humanen T-Lymphocyten immunisierte Pferde oder Kaninchen produzieren IgG, diese besetzen oder schädigen T- Lymphocyten Interferon Therapie der multiplen Sklerose (Downregulation MHCII auf APC?) 15 C.2. Förderung von Immunreaktionen (Mediatoren des Immunsystems) C.2.1. Granulocyten-Kolonie-stimulierender Faktor (G-CSF) Filgrastim, Lenograstim Cytokine, Glycoproteine stimulieren im Knochenmark spezifisch die Bildung und Ausschüttung von neutrophilen Granulocyten Förderung der unspezifischen Immunantwort Anwendung: Ergänzung bei Zytostatikatherapie C.2.2. Immunstimulantien kaum effektive Maßnahmen zur Verfügung Anwendung: Steigerung der Immunabwehr gegen Tumorzellen häufig wenn Chemotherapie nicht mehr wirkt z.B. - Tuberkuloseimpfstoff BCG bei Melanomen - Anthelminthikum (Tetramisol) antineoplastische Effekte im Tierversuch - Interleukin 2 stimuliert cytotoxische T-Lymphocyten Therapie metastasierender Nierenzellkarzinome - monoklonale Antikörper (Edrecolomab, Rituximab) Therapie kolorektaler Karzinome, follikulärer Lymphome 16