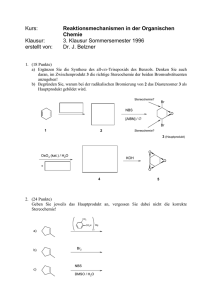
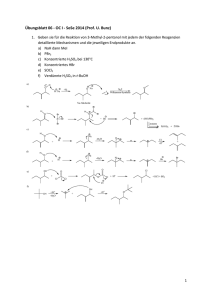
Inhaltsangabe als Word-Dokument
Werbung

1. Vorlesungsblock: Die chemische Struktur Organischer Verbindungen Lernziele Am Ende des 1. Vorlesungsblocks sollten Sie: definieren können, was Organische Chemie ist, Ihre Kenntnisse vom Aufbau der Atome und dem Aufbauprinzip des Periodischen Systems der Elemente aus der Vorlesung „Allgemeine und Anorganische Chemie“ des letzten Semesters aufgefrischt haben, die Begriffe Elektronegativität, Edelgaskonfiguration und die räumliche Verteilung der Elektronen in den verschiedenen Orbitalen kennen, die Charakteristika von ionischen, kovalenten und polaren Bindungen kennen den Begriff Hybridisierung kennen und an Beispielen erläutern können, verstehen können, wie die Bindungselektronen zwischen Kohlenstoff und anderen Atomen räumlich verteilt sind, die Unterschiede zwischen den verschiedenen Bindungstypen organischer Verbindungen kennen, den Zusammenhang zwischen den Bindungsverhältnisse und der räumlichen Struktur von Ethan, Ethen und Ethin detailliert verstehen können, die Elektronenverteilung in isolierten, kumulierten und konjugierten Mehrfachbindungen verstehen können, mit den verschiedenen Schreibweisen organischer Moleküle vertraut sein, mit dem Begriff der Valenz vertraut sein, mit den grundlegenden Begriffen der Energetik von chemischen Reaktionen vertraut sein: Enthalpie, freie Enthalpie, Reaktionsenthalpie, Entropie, ex- und endergonisch, mit den Grundbegriffen der Kinetik vertraut sein: Reaktionsgeschwindigkeit, Aktivierungsenergie, Reaktionsordnung, Molekularität. Katalysator und mit den Klassifizierungen der Organischen Verbindungen vertraut sein. Inhalt des 1. Vorlesungsblocks Was ist Organische Chemie? Aufbau der Atome Kovalente und ionische Bindungen Edelgaskonfiguration und Elektronegativität polare Bindungen Energetik chemischer Reaktionen Was macht das Kohlenstoffatom so besonders? Hybridisierung und die räumliche Struktur organischer Verbindungen Die verschiedenen Schreibweisen von Strukturformeln Organischer Verbindungen Die Klassifizierung Organischer Verbindungen nach Gerüst und funktionellen Gruppen Überblick über die verschiedenen funktionellen Gruppen 2. Vorlesungsblock: Alkane, Alkene & Alkine Am Ende des 2. Vorlesungsblocks sollten Sie: den Aufbau von linearen und verzweigten Alkane kennen, einfache Alkane nach den IUPAC-Regeln bennen können, den Begriff Struktur- bzw. Konstitutionsisomerie sicher beherrschen, die physikalischen Eigenschaften von Alkanen verstehen können (van der Waals Kräfte), den Begriff Konfomation auf das Ethan anwenden können, die chemischen Eigenschaften insbesondere die radikalische Halogenierung im Detail verstehen können, die Struktur und Nomenklatur der Cycloalkane verstehen und behrrschen können, die verschiedenen Konformationen des Cyclohexans beschreiben können, die verschiedenen Anordnungen von Substituenten am Cyclohexan energetische abschätzen können, die Ursachen der Isomerie von disubstituierten Cycloalkanen verstehen können, die elektronischen Verhältnisse der Doppel- und Dreifachbindung verstehen können, die cis-trans-Isomerie an Doppelbindungen erkennen und deuten können, die E-Z-Nomenklatur und das CIP-System beherrschen, den Charakter und den Verlauf von Additionsreaktionen an Doppelbindungen detailliert beherrschen können, die Stereochemie der Addition z.B. von Brom an Doppelbindungen verstehen und anwenden können, die Markownikow-Regel kennen, verstehen und anwenden können, die Additionsreaktionen von konjugierten Doppelbindungen verstehen können. Inhalt des 2. Vorlesungsblocks Die Struktur der Alkane Nomenklatur der Alkane, IUPAC Regeln Strukturisomerie in Alkanen Physikalische und chemische Eigenschaften von Alkanen Vorkommen in der Natur, technische Verwendung Van der Waals Wechselwirkung Konformation von Alkanen- Konformere, Energiediagramme Diastereomerie Radikalische Halogenierung von Alkanen Struktur von Cycloalkanen Nomenklatur der Cycloalkane Konformation der Cycloalkane, Sessel-Wannen-Form equatoriale und axiale Substituenten cis-trans-Isomerie in Cycloalkanen Hybridisierung und Nomenklatur von Doppel- und Dreifachbindungen Vorkommen und Rolle in der Natur cis-trans-Isomerie in Alkenen, Rotatioin um Doppelbindung E-Z-Regeln, CIP-System Sehvorgang elektrophile Additionsreaktionen an Doppelbindungen Stereochemie der Addition Markownikow-Regel und deren Deutung Konjugierte Doppelbindungen und deren Reaktionen 3. Vorlesungsblock: Aromaten Am Ende des 3. Vorlesungsblocks sollten Sie: den Begriff Aromatizität kennen, die chemischen Unterschiede zwischen Aromaten und Enen kennen, die Elektronenverteilung in Benzol kennen, die Hückel-Regeln kennen und anwenden können, die elektrophile Substitution im Mechanismus verstehen können, einfache Substitutionen selbstständig formulieren können, die Ursachen für die unterschiedliche Reaktivität von substituierten Aromaten kennen, mit den Grundlagen der Substituenteneffekte vertraut sein, I- und M-Effekte definieren können, sowohl die Reaktivität als auch die Orientierung bei Zweitsubstitution verstehen können. Inhalt des 3. Vorlesungsblocks Die Geschichte des Begriffs „Aromat“ Vergleich Benzol – „Cyclohexatrien“ Hybridisierung und Elektronenverteilung in Benzol Hückel-Regeln und deren Anwendung Elektrophile Substitution am Aromaten verschiedene Reaktionen: Nitrierung, Bromierung, Friedel-Crafts Substituenteneffekte auf die Geschwindigkeit von Zweitsubstitutionen I- und M-Effekte: Definition und Anwendung auf Substituenten Wer zeigt welchen Effekt Der orientierende Einfluß von Erst-Substituenten: ortho-para und meta Welcher Substituent dirigiert wohin Überblick der Substituenteneffekte Einige Aromaten in der Natur 4. Vorlesungsblock: Stereochemie Am Ende des 4. Vorlesungsblocks sollten Sie: den Begriff der Konstitutions- und Stereoisomerie kennen und anwenden können, die wichtigsten Begriffe der Stereochemie beherrschen, Diastereomere und Enantiomere auseinanderhalten können, den Begriff Chiralität kennen, das Phänomen der Rotation der Ebene des polarisierten Lichts kennen, strukturelle Voraussetzungen für das Auftreten von Enantiomeren definieren können, die Fischerschen Projektionsformeln richtig lesen und schreiben können, auf der Basis des CIP-Systems eindeutige Zuordnungen von R und S treffen können, aus einer Formel die Konfiguration eines asymmetrischen C-Atoms ableiten können, umgekehrt aus einer gegebenen Konfiguration die Formel ableiten können, mehrere Methoden der Racematspaltung kennen, wissen, was eine meso-Verbindung ist und die erythro- und threo-Nomenklatur beherrschen. Inhalt des 4. Vorlesungsblocks Die Begriffe Konstitution, Konfiguration und Konformation Konformere und Konfigurationsisomere Konstitutions- und Stereoisomere Diastereomere und Enantiomere Chiralität und ihr Vorkommen in der Natur Optische Aktivität spezifische Rotation Bedingungen für Chiralität optischer Drehsinn und Struktur Fischersche Projektionsformeln CIP-System: Prioritätsregeln und Drehsinn Biologische Eigenschaften von Enantiomeren Racemattrennung per Hand (und Kopf!) nach Pasteur (Weinsäure) weitere Methoden der Enantiomerentrennung Meso-Weinsäure 5. Vorlesungsblock: Nukleophile Substitution und Eliminierungen Am Ende des 5. Vorlesungsblocks sollten Sie: den Begriff nukleophile Substitution kennen, die verschiedenen Mechanismen an Beispielen formulieren können, den Einfluß der Substratstruktur auf den jeweiligen Substitutionsmechanismus kennen, den Einfluß von Nukleophil, Abgangsgruppe und Lösungsmittel verstehen können, die Energiediagramme von SN1 und SN2-Reaktionen kennen, den Einfluß des Mechanismus auf die Stereochemie der Produkte kennen, die Mechanismen im Detail verstehen und erläutern können, den Einfluß von experimentellen Variablen auf den ablaufenden Mechanismus kennen, die Mechanismen der Eliminierungen im Detail kennen, den Einfluß des ablaufenden Mechanismus auf die Stereochemie der Eliminierungsprodukte kennen, im Rückblick den Mechanismus der elektrophilen Addition durch Anwendung der Stereochemie im Detail verstehen können. Inhalt des 5. Vorlesungsblocks Die nukleophile Substitution SN1 und SN2 Mechanismen als Stereotypen der detaillierte kinetische und stereochemische Ablauf beider Mechanismen Zusammenhang zwischen Mechanismus und Substratstruktur Einfluß von Lösungsmittel, Abgangsgruppe und Nukleophil Reihung der Abgangsgruppen nach Leichtigkeit der Abspaltung Reihung der Nukleophile nach Stärke Vergleich der beiden Substitutionsmechanismen Eliminierung als Konkurrenzreaktion zur Substitution Die detaillierten Mechanismen der E1 und E2 Reaktionen Stereochemie beider Mechanismen Anwendung der Stereochemie auf die elektrophile Addition an Doppelbindungen 6. Vorlesungsblock: Alkohole, Phenole und Thiole Am Ende des 6. Vorlesungsblocks sollten Sie: den Substanzklasse Alkohole strukturell definieren können, die Begriffe primär, sekundäre und tertiäre Alkohole kennen, den Mechanismus der säurekatalysierten Hydratisierung von Oalkenen (Markownikow) im Detail verstehen können, die physikalsichen Eigenschaften von Alkoholen verstehen, eine Übersicht über die physiologischen Eigenschaften der Alkohole haben, die Oxidationsprodukte der verschiedenen Alkohole (prim.sek.tert.) kennen, die Substanzklasse der Ether erkennen können, die physikalsichen Eigenschaften der Ether erklären können, die Acidität von Phenolen erklären können, das Redoxsystem Hydrochinon/Chinon kennen und die Eigenschaften der Thiole insbesondere die Oxidationsprodukte kennen. Inhalt des 6. Vorlesungsblocks Die Hydroxylgruppe als funktionelle Gruppe Herstellung von Alkoholen Wiederholung: Hydratisierung von Enen (Markownikow) Physikalische Eigenschaften, Wasserlöslichkeit, Siedepunkte Physiologischen Eigenschaften von Alkoholen, Toxizitäten, Süßkraft, Abbau im Körper Diethylenglykol-Skandal Chemische Reaktionen von Alkoholen Oxidation von primären, sekundären und tertiären Alkoholen Dehydratisierung von Alkoholen Beispiele aus dem Citronensäurecyclus Ether, chemische und physikalischen Eigenschaften Pheole, chemische Eigenschaften insbesondere Acidität Das Hydrochinon/Chinon-Redoxsystem Anwendungen in der Photographie Thiole und Disulfide 7. Vorlesungsblock: Aldehyde und Ketone Am Ende des 7. Vorlesungsblocks sollten Sie: die Elektronenverteilung einer Ketogruppe kennen, die prinzipiellen Reaktionsweisen von Ketogruppen beherrschen, die Synthese durch Oxidation von Alkoholen bzw. Friedel-Crafts-Acylierung kennen, die nucleophile Addition von Basen an Ketogruppen mechanistisch verstehen, die Reaktionen Addition von Alkoholen und Aminen im Detail verstehen können, Halb- und Vollacetale kennen, eine Cyanhydrinsynthese beschreiben können, die Umsetzung mit Aminen zu Aminalen und Iminen kennen und verstehen können, die Acidität der –ständigen Wasserstoffatome erkennen und verstehen können und eine Aldolkondensation formulieren können. Inhalt des 7. Vorlesungsblocks Die Ketogruppe als funktionelle Gruppe Herstellung von Aldehyden und Ketonen Synthese von Aldehyden und Ketonen durch Oxidation von Alkoholen Angriff von Nukleophilen Hydratbildung und Struktur Mechanismus der Reaktion mit Alkoholen zu Halb- und Vollacetalen Cyanhydrinsynthese Mechnaismus der Reaktion mit Aminen zu Aminalen und Iminen (Schiffsche Basen) Transaminierung bei der Aminosäuresynthese CH-Acidität von Ketoverbindungen: strukturelle Ursachen Mechanismus der Aldoladdition und -kondensation 8. Vorlesungsblock: Carbonsäuren und Ester Am Ende des 8. Vorlesungsblocks sollten Sie: die grundsätzlichen Reaktionen einer Carboxylgruppe kennen, den Begriff pKa-Wert beherrschen und auf Carbonsäuren anwenden können, die Substituenteneffekte auf die Acidität klassifizieren können, den Zusammenhang zwischen Acidität und Substituenten erkennen und deuten können, eine Übersicht über die verschiedenen Carbonsäuren (aliphatisch, ungesättigt, Dicarbonsäuren) haben, die Struktur und Wirkunsweise von Seifen kennen, vertraut sein mit verschiedenen Säurederivaten und deren relative Reaktivitäten kennen, den Mechanismus der sauer katalysierten Esterbildung im Detail verstehen können, den Mechanismus der basischen Esterspaltung kennen, die grundsätzliche Struktur von Wachsen, Fetten und Ölen kennen, und die Struktur und Eigenschaften von Phospholipiden als Membranbestandteile kennen, mit der Claisen-Kondensation und deren Mechanismus vertraut sein, den allgemeinen Begriff der Tautomerie genau definieren können, und die Keto-Enol-Taumerie am Beispiel des Acetessigesters erläutern können. Inhalt des 8. Vorlesungsblocks Die Carboxylgruppe als funktionelle Gruppe Carbonsäure und Citratcyclus reaktive Zentren der Carboxylgruppe physikalische Eigenschaften der Carbonsäuren Acidität von Carbonsäuren Zusammenhang zwischen Struktur und Acidität Substituenteneinflüsse auf die Acidität aliphatischer und aromatischer Carbonsäuren Übersicht über gesättigte, ungesättigte und Dicarbonsäuren Arachidonsäure und Prostaglandin Synthese von Carbonsäuren Seifen als Detergentien, moderne Waschmittel Säurederivate und deren relative Reaktivitäten Acetyl Co A säurekatalysierte Veresterung, Isotopenmarkierung Estersynthese durch Umsetzung von Alkylhalogeniden mit Carboxylatanionen basenkatalysierte Esterspaltung (Verseifung) Ester als Duftstoffe Wachse, Fette und Öle Zusammensetzung natürlicher Fette Phospholipide und Membranstrukturen Keto-Enol-Tautomerie des Acetessigester Claisen-Kondensation 9. Vorlesungsblock: Kohlenhydrate Am Ende des 9. Vorlesungsblocks sollten Sie: die Systematik der Zucker beherrschen, mit der D,L-Nomenklatur der Zucker vertraut sein, die Begriffe epimere und anomere Zucker kennen, mit den verschiedenen Schreibweisen der Saccharide vertraut sein, die Mutarotation kennen und verstehen können, die wichtigsten Reaktionen der Zucker kennen, die glykosidische Bindung kennen und deren Stereochemie verstehen können, einige Disaccharide kennen und deren Struktur und Reaktivität (z.B. Mutarotation) erkennen und erklären können, die Rolle der Saccharide bei den Blutgruppen kennen, die Struktur der wichtigsten Polysaccharide kennen. Inhalt des 9. Vorlesungsblocks Systematik der Saccharide: Aldosen-Ketosen; Triosen-Tetrosen-Pentosen; Mono-, Oligo-, Polysaccharide Triosen: Glycerinaldehyd - Dihydroxy-aceton Stereochemie der Tetrosen (erythro/threo) D,L-Nomenklatur – Unterschied zu (+) – (-) und R,S Epimere Zuckerpaare, Anomere Zucker Mutarotation, Pyranosen und Furanosen Offenkettige Form – Fischer – Haworth Chemie der Monosaccharide: Oxidation, Reduzierende Wirkung von Ketosen (Fehling) Weitere Monosaccarid-Abkömmlinge (Desoxy-ribose, Vitamin C) Rolle der Zucker bei der Zuordnung zur AB0-Blutgruppen Disaccharide: Glykosidische Bindung, 1,2 und 1,4 und 1,6 Verknüpfung Ribonucleoside, Disaccharide: Cellobiose, Maltose, Saccharose Polysaccharide: Cellulose, Stärke, Glycogen, Chitin Natürliche und künstliche Süßstoffe 10. Vorlesungsblock: Organische Stickstoffverbindungen Am Ende des 10. Vorlesungsblocks sollten Sie: den grundlegenden stereochemischen Aufbau von Aminen kennen, die Definitionen von prim., sek. und tertiären Aminen beherrschen, die Zusammenhänge zwischen Basizität von Aminen und deren Struktur kennen, die Acidität von primären und sekundären Aminen qualitativ verstehen können, mit den wichtigsten Synthesen und Reaktionen von Aminen vertraut sein, den elektronischen Aufbau einer Amidbindung genau kennen, die einfachsten Heterocyclen und deren elektronische Eigenschaften kennen, mit der Substanzklasse der Alkaloide vertraut sein, den Aufbau von Nukleodiden und Nukleotiden kennen und mit der chemischen Struktur der DNA und RNA vertraut sein. Inhalt des 10. Vorlesungsblocks Struktur der Amine : Hybridisierung, Chiralität und Racemisierung, Nomenklatur der Amine, prim., sek., tertiäre Amine physikalische Eigenschaften Amine in der Natur Basizität von Aminen, pKA und pKB-Werte Zusammenhang zwischen Basizität und Struktur Acidität von Aminen Synthesen von Aminen Reaktionen von Aminen Bildung von N-Nitrosoaminen Amide Heterocyclen: Struktur und elektronische Eigenschaften Nukleoside, Nucleotide, ATP, Nucleinsäuren, Aufklärung der DNA Strukturunterschiede zwischen DNA und RNA 11. Vorlesungsblock: Aminosäuren, Peptide & Proteine Am Ende des 11. Vorlesungsblocks sollten Sie: den Zusammenhang zwischen pH und der Lösungsstruktur von AS kennen, die Begriffe Zwitterionen, Titrationskurve und Elektrophorese kennen und erklären können, wissen was ein isoelektrischer Punkt ist und den Zusammenhang zu den pK-Werten kennen, saure, basisceh und neutrale Aminosäuren auseinanderhalten können, wissen, was essentielle AS sind und einige benennen können, die Stereochemie der AS sicher beherrschen, einfache Nachweisreaktionen der AS kennen, den Begriff Peptid und Protein definieren können, die verschiedenen Strukturklassen (prim.,sek.,ter.,quart.) von Proteinen kennen, die Stereochemie der Peptidbindung genau kennen, die Probleme und Lösungen bei der gezielten Peptidsynthese kennen, verschiedene Schutzgruppen kennen und anwenden können und wissen, wie eine Merrifieldsynthese funktioniert. Inhalt des 11. Vorlesungsblocks Definition und Eigenschaften von Aminosäuren Struktur der Aminosäuren im Festkörper und in wäßriger Lösung Isoelektrischer Punkt, Elektrophorese Neutrale, basische und saure Aminosäuren Essentielle Aminosäuren Stereochemie der Aminosäuren, D,L und R,S Synthese von Aminosäuren technische Synthese und Racematspaltung Seltene Aminosäuren Peptidbindung (Geometrie und Hybridisierung) Strategie der Peptidsynthese Schutz der Aminogruppe Schutz der Carboxylgruppe Aktivierung der Carboxylgruppe Carbodiimid Methode Merrifield Synthese Sequenzanalyse, Sangers Reagenz, Edman Abbau Primär-, Sekundär-, Tertiär- und Quartärstruktur von Proteinen Nachweis von Proteinen (Ninhydrin, Xanthoprotein-Reaktion) 12. Vorlesungsblock: Terpene, Farbstoffe und Polymere Am Ende des 12. Vorlesungsblocks sollten Sie: den Begriff etherisch Öle definieren können und einige Beispiele kennen, das Bauprinzip von Terpenen und Steroiden kennen, ein Terpen klassifizieren und die Isoprenbausteine erkennen können, die wichtigsten Sesqui- und Diterpene kennen, das Prinzip der Biosynthese von Terpenen kennen und den grundlegenden Reaktionsmechanismen insbesondere die Claisenkondensation kennen, die natürlichen Polyisoprene kennen, einige Steroide kennen, wissen wie ein Farbstoff definiert ist, den Zusammenhang zwischen absorbierter Energie und der Wellenlänge kennen, den Zusammenhang zwischen Absorption und Größe des –Elektronensystems kennen, das Lambert-Beersche Gesetz sicher beherrschen, den Farbsehprozess verstehen, mit den wichtigsten Strukturelementen der natürlichen Farbstoffen vertraut sein, den Prozess der Küpe kennen, mit den Substanzklassen der synthetischen Farbstoffe vertraut sein und die Biodegradation der Blut- und Blattfarbstoffe kennen, den Begriff Polymer definieren können, mit den Begriffen Additions- und Kondensationpolymeren vertraut sein, die Mechanismen der kationischen und radikalischen Polymerisation beherrschen, charakteristische Strukturelemente hydrophiler Polymeren kennen und die Strukturen einiger technisch und biologisch wichtiger Polymere kennen. Inhalt des 12. Vorlesungsblocks Isoprenoide (Terpene und Steroide) Etherische Öle Isopren als universeller Baustein Monoterpene: acyclische, mono- und bicyclische Terpene Sequiterpene Diterpene: Phytol, Vitamin A, Retinal Triterpene, Steroide Biosynthese der Terpene und Steroide: Isopentenyl- und Dimethylallyl-pyrophosphat, Claisen Kondensation Biosynthese von Monterpenen: Farnesylpyrophosphat, Squalen Polyisopren: Kautschuk Biosynthese von Steroiden Östrogene und Gestagene, RU 486 Farbstoffe Definition von natürlichen und künstlichen Farbstoffen Wechselwirkung zwischen Materie und elektromagnetischer Strahlung, Plancksche Formel Farbe-Komplementärfarbe Lichtabsorption und Konjugation von Doppelbindungen Prinzip eines UV/VIS-Spektrometers Lambert-Beersches Gesetz Zusammenhang zwischen Absorption und -Elektronensystem Synthetische Farbstoffe: Azofarbstoffe, Triphenylmethanfarbstoffe Natürliche Farbstoffe: Anthocyane(Flavyliumfarbstoffe) Indigo als Küpenfarbstoff, Purpur Porphinfarbstoffe: Häm, Chlorophyll Biodegradation von Häm und Chlorophyll Synthetische Farbstoffe: Triphenylmethanfarbstoffe Polymere: Additions- und Kondensationspolymere Mechanismus der Polymerisation Beispiele für technisch und biologisch wichtige Polymere