1. Ziele
Werbung

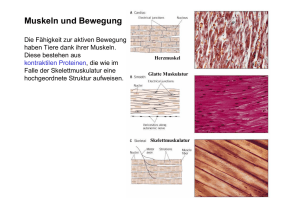
1 Praktikum „Methoden in der Neurobiologie“ 2010 Neuroanatomie des Insektennervensystems: „Backfill“ Wolfgang Mader, Wolfgang Stein Abb.1. Stabheuschrecke und allgemeine Darstellung des Nervensystems der Insekten. 1. Ziele Kennenlernen der Organisation des zentralen Nervensystems von Insekten am Beispiel der Stabheuschrecke. Es wird die Technik des Ni2+-Backfills vermittelt. Diese Technik ermöglicht die Darstellung der Verzweigungen von Neuronen - Motoneuronen oder Sinneszellen - im zentralen Nervensystem (ZNS) oder in den peripheren Zielgebieten, z. B. den Muskeln. Darstellung der Verzweigung von Motoneuronen im thorakalen ZNS der Stabheuschrecke am Beispiel der Motoneurone der Beinmuskulatur. 2. Allgemeine Voraussetzungen 2.1. Kenntnisse und Begriffe, die Sie sich vor dem Praktikum aneignen sollten Machen Sie sich mit der generellen Struktur eines Insektennervensystems vertraut. Jedes beliebige Zoologielehrbuch bietet die nötigen Informationen (genau wie die Vorlesung über den Lauf des Praktikums). Stichworte, die Ihnen etwas sagen müssen: Ganglion, Konnektiv, Kommissur, motorisches Neuron, sensorisches Neuron, Soma, Axon, Dendrit, Efferenz, Afferenz. 2.2. Das thorakale Nervensystem Das thorakale Nervensystem der Stabheuschrecke besteht aus 3 Ganglien (s. Abb.1). Die motorische und sensorische neuronale Versorgung ist in aller Regel segmental organisiert. Das heißt, dass die Somata (Zellkörper) und dendritischen Verzweigungen der Motoneurone der Mittelbeinmuskeln im Mesothorakalganglion liegen und die entsprechenden Neurone der Hinterbeinmuskulatur im Metathorakalganglion. Allerdings kommt es gelegentlich auch zu segmentüberschreitenden neuronalen Projektionen, gerade bei der Sensorik. Axone von Motoneuronen (Efferenzen) verlassen das ZNS durch Seitennerven der Ganglien. Durch dieselben Seitennerven treten Axone von Sinnesorganen der Flügel und Beine in das ZNS ein. Jedes thorakale Ganglion hat auf jeder Seite 6 Seitennerven, die sich in der Peripherie stark verzweigen. 1 2 2.3. Die Beinmuskulatur (Abb.2.) Die Muskulatur der Laufbeine wird unterschieden in intrinsische Muskulatur – im Bein gelegen – und extrinsiche Muskulatur – im Thorax gelegen und das Bein von dort aus bewegend. Abb.2. Bein der Stabheuschrecke, rechts mit anatomischen Details (Muskeln zur Bewegung der Tibia braun, Drehachsen der Gelenke rot). Nach Bässler, 1983. Bei der Stabheuschrecke sind praktisch alle Gelenke des Beins Scharniergelenke, die Bewegung nur um eine Rotationsachse erlauben. Machen Sie sich diesen Sachverhalt am lebenden Tier klar (Vorsicht, die Tiere werfen ihre Beine durch Autotomie ab, wenn diese stark gereizt oder beschädigt werden). Bei den zwei eng hintereinander liegenden Scharniergelenken an der Beinbasis erlaubt dies einen Bewegungsspielraum nahezu wie bei einem Kugelgelenk. Da wir Axone von Nervenzellen markieren, die im Femur des Laufbeins verlaufen (s.u.), können nur Motoneurone markiert werden, die intrinsische Muskeln versorgen. Ein Beinmuskel wird typischerweise von drei Motoneuronen innerviert, es können aber auch bis zu 14 Motoneurone sein (bei Wirbeltieren sind es dagegen meist mehrere tausend – weshalb?). Die Zellkörper (Somata) der Motoneurone und ihre dendritischen Verzweigungen liegen im ZNS. Eine Erregung der Motoneurone führt zur Kontraktion des entsprechenden Beinmuskels (bzw. der vom jeweiligen Motoneuron versorgten Muskelfaserpopulation in dem Muskel, der „motorischen Einheit“) und damit zu einer Bewegung des Beins im zugehörigen Gelenk. 3. Darstellung intrinsischer Motoneurone des Stabheuschreckenbeins mittels „Backfill“ von Nickelionen/Nickelrubeanat 2 3 Abb.3. Mesothorakalganglion der Stabheuschrecke mit ausgewählten Motoneuronen der Beinmuskulatur (Retractor coxae). Nach Bässler, 1983. 3.1. Die darzustellenden Neurone (Abb.3) Im Beinnerven verlaufen die Axone sämtlicher Motoneurone welche die intrinsische Beinmuskulatur innervieren, insgesamt knapp 100 relativ dicke Axone. Zudem verlaufen hier die Axone der Beinsensorik, von den verschiedensten Mechanorezeptoren bis hin zu Chemorezeptoren auf den Fusspolstern, insgesamt mehrere tausend z.T. sehr dünne Nervenfasern. Alle diese Axone laufen über den Beinnerven in das zum betreffenden Segment gehörige Ganglion (bzw. haben als Motoneurone ihren Ursprung dort... ). Im Fall der Beinmuskulatur liegen die Zellkörper der zugehörigen Motoneurone gleichseitig – ispilateral – im Segmentalganglion, entweder anterior oder posterior der Nerveneinmündung. Die Somata der sensorischen Nervenzellen liegen peripher in den Sinnesstrukturen. Ihre Axone verzweigen nach Eintritt in das Segmentalganglion typischerweise ebenfalls ipsilateral, und sie ziehen z.T. auch in benachbarte Ganglien, häufiger nach anterior als nach posterior und mitunter bis in das Gehirn. 3.2. Prinzip der Färbung Eine Nickelchlorid-Lösung wird an der durchtrennten Stelle eines Nerven von den dort eröffneten Axonen aufgenommen und innerhalb dieser Neurone - ggf. aktiv - transportiert. Die Färbung funktioniert daher nicht, wenn die Nerven mit der Pinzette gequetscht oder überdehnt wurden oder eingetrocknet sind. Auch der Kontakt des Nervenendes mit Vaseline kommt als Fehlerquelle in Frage. Mit verdünntem Dithiooxamid (Anhydrid der Rubeanwasserstoffsäure; Vorsicht: sehr giftig! Frage: was könnte der Grund für die Giftigkeit sein?) wird in diesen Neuronen Nickelrubeanat als blauer Niederschlag ausgefällt. Das Färbeverhalten beruht auf der Füllung von Neuronen lebender oder frisch getöteter Tiere mit Nickel- oder Kobaltsalzen. Verwendet werden hauptsächlich wässrige Lösungen von CoCl2 und NiCl2.Nach einer bestimmten Zeit, in der die Nickel bzw. Kobaltionen in das Neuron diffundieren können, werden diese mit Sulfidionen ausgefällt. Dadurch bildet sich im Falle von Kobalt ein schwarzer, schwer löslicher Niederschlag von Kobaltsulfid. Reaktion: Co2+ + S2- CoS Dieser schwarze Niederschlag kann durch die histologische Aufarbeitung nicht mehr gelöst werden. Die mit CoS markierten Neurone erscheinen deshalb in den Präparaten als schwarze bzw. bei schwächeren Füllungen als dunkelbraune Strukturen. Als Fällungsreagenz ist Dithiooaxmid geeignet (Rubeanwasserstoffsäure). 3 4 Möglichkeiten der Anwendung 1. Intrazelluläre Injektion zur Darstellung einzelner Neurone (z. B. Motoneurone: J. A. Wilson, J. of Neurobiol. 10, 153-167 (1979); Interneurone: M.V.S. Siegler und M. Burrows, J. of Comp. Neurol. 183, 212-147 (1979); Pflüger, J. Comp. Neurol. 222, 243-358 (1984) Glasmikroelektroden werden mit Kobaltsalzlösungen gefüllt (5 - 10%ig), und es wird dann von einzelnen Neuronen abgeleitet. Die Kobaltionen werden durch Applizierung eines Stromes durch die Elektrodenöffnung in das Neuron geschickt. (Richtwerte: Stromstärke 10 nA, Injektionsdauer: 15-30 min, Pulsdauer: 500 ms). Dabei wird die Mikroelektrode zum positiven, die indifferente Elektrode zum negativen Pol. 2. Extrazelluläre Injektion Auch hierzu werden Glasmikroelektroden verwendet, die mit Kobaltsalzlösungen gefüllt sind. Die Elektrodenspitze wird abgebrochen und die Elektrode an die gewünschte Stelle im ZNS gebracht. Ohne Anwendung eines Stroms diffundieren Co2+-Ionen aus der Pipettenspitze und bilden dort einen "Co2+-Vorrat". Durchziehenden verletzte Nervenfasern nehmen Co2+ auf. Diese Technik eignet sich für das Studium der Ganglien-Architektur, besonders für die Markierung von Axonbündeln und Trakten. (Richtwert: Diffusionsdauer 1-2 h für eine Strecke von 1 mm Variante dieser Methode: Stromapplikation [siehe unter 1.]) 3. Diffusionsmethode ("backfilling") Co2+-Ionen wandern in abgeschnittenen Axonen durch Diffusionsvorgänge bis sie die gesamte verbleibende Nervenzelle erfüllen. Voraussetzung ist, daß die Schnittstelle in einen Co2+-Ionenpool hineintaucht, der vom übrigen Gewebe gut isoliert ist. Auf diese Weise kann zur Peripherie und zur Zentrale hin gefärbt werden. Beispiele: a) Blöckchenmethode: Nervensystem wird herauspräpariert und gewünschtes Nervenende in einen CoCl2-Pool gehängt. Blöckchen wird dann für einige Zeit in eine feuchte Kammer gelegt (Diffusionsdauer: 5 - 24 h). b) Nervensystem wird im Tier belassen, gewünschter Nerv freipräpariert. Danach Bildung eines Vaselinepools um den Nerv. Vaselinepool wird zunächst mit Aqua dest. gefüllt damit evtl. gequetschte Nervenendigungen aufquellen. Das Aqua dest. wird dann durch CoCl2-Lösung ersetzt und der Nerv durchgeschnitten. Durch Aufbewahren in einer feuchten Kammer wird das Präparat vor dem Austrocknen geschützt (Diffusionszeit wieder 5 - 48 h). 4 5 5 6 Fehlerquellen 1. Beim Präparieren Quetschen oder Dehnen des Axons (keine Co2+-Diffuison mehr möglich). Dies kann im weiteren Verlauf der Behandlung ebenfalls passieren, vor allem, wenn das zu färbende Axonstück bei der Blöckchenmethode über den Paraffinkanal gehoben werden soll. 2. Nerv zu kurz herauspräpariert. 3. Das Axonende wurde nicht abgeschnitten sondern nur gequetscht (stumpfe Schere). 4. Versehentlich kommt das Axonende mit Vaseline oder Paraffinöl in Berührung. Auch dies kann dazu führen, daß die Co2+-Diffusion blockiert ist. Außerdem sollte die Vaseline nicht verfärbt sein (weiße Vaseline - vasel. album benutzen). 5. Ein Lecken oder Auslaufen der verdünnten Nickel-/Kobaltchloridlösung muß unbedingt vermieden werden, sonst wird das gesamte Präparat schwarz oder es kann keine Färbung erkannt werden. 6. Die Waschvorgänge, die im Skript beschrieben sind, sollten sehr sorgfältig ausgeführt werden. 4. Literatur Kükenthal, Leitfaden für das Zoologische Praktikum, Gustav-Fischer-Verlag Kästner, Lehrbuch der speziellen Zoologie, Gustav-Fischer-Verlag Seifert, Entomologisches Praktikum, Thieme-Verlag Altmann J.S., Tryer N.M.; Filling selected neurons with cobalt through cut axons. In: Strausfeld N.J., Miller T.A: Neuroanatomical Techniques, Chapter 19, Springer-Verlag Bässler, Neural basis of elementary behavior in stick insects, Springer-Verlag 1983 5. Aufgaben 5.1. Äußere Morphologie (da der Backfill möglichst früh angesetzt werden soll, um eine lange Transportzeit des Färbemediums zu erlauben, kann diese Aufgabe ggf. gut zu einem späteren Zeitpunkt mit einem frischen Tier erledigt werden) Legen Sie eine Skizze von der äußeren Gestalt der Stabheuschrecke an. Beschriften Sie die Abbildung. Betrachten Sie das Tier unter dem Binokular: Kopf mit Sinnesorgan (Augen, Antennen), Thorax mit Beinen (lösen Sie Reflexbewegungen aus, indem Sie mit einer Pinzette o.ä. Haare auf den Beinen berühren), Abdomen (haben Sie ein Weibchen oder Männchen vor sich?). Zeichnen Sie ein Detail, z. B. den Kopf, den Thorax, ein Bein. Beschriften Sie die Zeichnung. 5.2. Ansetzen eines „Backfill“ Sie können das Tier bei Bedarf durch Kühlung anästhesieren oder den Kopf abtrennen (dann ist das Tier offiziell „tot“, durch die Autonomie der Körpersegmente wird aber beispielsweise der Kopf ggf. noch tagelang mit den Fühlern spielen, Nahrung aufnehmen etc.). Dann legen Sie es auf einer Korkplattform fest, indem Sie an mehreren Stellen entlang der beiden Körperseiten Stecknadel schräg in den Kork stechen, so dass sich die Nadeln über dem Tier überkreuzen und den Körper eng auf der Unterlage fixieren. In gleicher Weise legen Sie die Beine fest. Nach Festlegen der Beine fixieren Sie die CoxaTrochanter-Gelenke aller zu untersuchenden Beine mit Zahnkleber (Protemp II). Achten Sie darauf, den Protemp Wall nicht zu hoch zu bauen, da Sie später noch den Thorax des Tieres aufpräparieren müssen. 6 7 Durchtrennen Sie den Femur des Beins, bei dem Sie einen Backfill durchführen möchten (Sie können dies ggf. nacheinander bei ein bis drei Beinen desselben Tiers tun). Dichten Sie den Untergrund (Kork) im Bereich der Schnittstelle durch Abdecken mit einer Folie ab Dann umgeben Sie die Schnittstelle mit einem Vaselinetrog, in den anschließend destilliertes Wasser gefüllt wird. Achten Sie bei dem Trog auf eine dichte Verbindung zum Beinstumpf, auch auf dessen Unterseite! Das eingefüllte destillierte Wasser darf nicht auslaufen. Es dient dem osmotisch verursachten Aufquellen des angeschnittenen Beingewebes, insbesondere der angeschnittenen Axone, die durch den Schnitt gequetscht sein könnten. Am besten schneiden Sie die Schnittkante noch einmal mit einer scharfen Mikroschere oder mit einer Rasierklinge im destillierten Wasser frisch an. So wird auch geronnene Hämolymphe entfernt und das Lumen der Axone sollte frei zugänglich für das Färbemedium sein. Nach etwa 10min wechseln Sie das destillierte Wasser gegen die Färbelösung aus (Absaugen des Wassers mit einem aus Fliesspapier gedrehtem Docht, einfüllen des NiCl2 mit einer ausgezogenen Spritze oder Spritzenkanüle). Verschließen Sie die Wanne mit einem Vaselinedeckel. Bedecken Sie das gesamte Präparat vorsichtig mit ringerfeuchtem saugfähigem Papier. Überführen Sie das Präparat mit der Präparierwanne in eine Plastikschachtel, die mit feuchtem Papier ausgelegt wurde (oder eine andere Form von „feuchter Kammer“). Stellen Sie die Schachtel für 12–18 Stunden an einen kühlen Ort. Die „feuchte Kammer“ verhindert das Austrocknen des Präparats und das Absterben des Gewebes. Sollte das Präparat über ein Wochenende „laufen“ gelassen werden, ist die Aufbewahrung im Kühlschrank bei 4-8°C besser. Normalerweise wäre es nötig, den zu füllenden Nerven frei zu präparieren und isoliert in die Vaselinewanne zu legen. Die beschriebene Methode funktioniert nur, weil unter dem Einfluss von Luftsauerstoff (und Schwermetallionen) die Hämolymphe im Beinstumpf so schnell gerinnt und so gut abdichtet, dass die Schwermetallionen nicht im Hämolymphraum bis in die Körperhöhle diffundieren können. 5.3. Fertigstellen und Auswerten des „Backfill“ Entfernen Sie zunächst die Vaselinewanne mit dem Nickelchlorid, und zwar so vorsichtig, dass keine Lösung das Tier oder die Unterlage kontaminiert (das Nickelchlorid ist nicht nur giftig, sondern würde bei Benetzung des Tiers auch andere Strukturen anfärben). Saugen Sie zunächst das Nickelchlorid mit einem Docht ab. Durchtrennen Sie dann das Bein zwischen Vaselinewanne und Körper und entfernen Sie das Beinstück mit Vaselinetrog und Unterlage (bitte auf etwaige Minutien achten, die z.B. die untergelegte Plastikfolie befestigt haben; diese sind im Müll sehr unangenehm und sollten zuvor entfernt, gesäubert und aufgehoben werden). Spülen Sie anschließend mit etwas Ringer nach. Präparieren Sie nun das Nervensystem frei. Dies können Sie bei genügend Zeit und verfügbaren Tieren zunächst an einem frischen Tier üben und sich gleichzeitig einen Überblick über die innere Anatomie verschaffen (wie auch die äußere Morphologie, s.o.). Dazu werden zunächst Kopf und Abdomenspitze abgetrennt. Dann können Sie mit einer flach geführten Schere den Körper dorsal der Länge nach Aufschneiden (gekreuzte Stecknadel hierbei ggf. rearrangieren). Anschließend spreizen Sie mit den Stecknadeln die Körperseitenwand von innen leicht auf und stecken die Nadeln so fest, dass der Körperinnenraum gut zugänglich ist. Mit etwas Ringer durchspülen und ggf. – beispielsweise bei der Übungspräparation - das Präparat mit 1%iger Methylenblau– Lösung überspülen, dadurch wird das Nervensystem (und v.a. auch Fettgewebe) angefärbt und hebt sich von anderem Gewebe ab. Darm, Fettkörper und Tracheen ausräumen. Ventral ist dann bereits das Strickleiternervensystem zu erkennen, stellenweise noch von einigen kleineren Muskeln überdeckt. Durchtrennen Sie diese Muskeln vorsichtig (ggf. mit Glashaken oder Präpariernadel erst etwas anheben und dann ohne Beschädigung des Nervensystems durchtrennen), genau wie alle Seitennerven. Beschädigen Sie jedoch nicht die 7 8 Konnektive zwischen den thorakalen Ganglien. Kritisch ist das Durchtrennen oder Abbrechen des zentralen Apodems, welches zwischen den Konnekitven von Meso- und Metathorakalganglien liegt; bitten Sie hier ggf. einen Assistenten um Hilfe. Dann ist das Nervensystem nur noch über die Tracheen in der Körperhöhle befestigt und kann leicht angehoben werden. Die Tracheen reißen entweder beim langsamen Abheben von selbst ab, oder sie können mit einer Schere beim Abheben durchschnitten werden. Anschließend das Nervensystem sofort in ein Blockschälchen mit Ringer überführen um jede Austrocknung zu verhindern. Evtl. können schon während der Präparation 2-3 Tropfen des Fällungsreagenz Dithiooxamid zugegeben werden. Da das Reagenz giftig ist, müssen in diesem Fall anschließend Besteck und Korkplattform gründlich gereinigt werden. Ansonsten entwickeln Sie die Färbungen nach dem angegebenen Rezept nun in dem Blockschälchen. Fertigen Sie eine Skizze des Präparats an; achten Sie dabei besonders auf Muskeln und Nervensystem. 6. Zeitplan für das Entwickeln der Färbung und die weitere Verarbeitung 6.1. Verarbeitung von Nickel-Färbungen im Detail 1. Ganglienkette in Blockschälchen mit frischem Ringer überführen 2. 1-2 Tropfen Dithiooxamid (in 100% Ethanol) zutropfen und 30 min entwickeln 3. 3 x 5 min in Ringerlösung waschen 4. 30 min Fixierung in Gemisch aus Eisessig-Alkohol (1:4) oder in Paraformaldehyd (4%) (oder über Nacht bzw. bis zu ein paar Tagen im Kühlschrank) 5. aufsteigende Alkoholreihe 1 x 5 min 30% 1 x 5 min 50% 2 x 5 min 70% (auch hier kann das Präparat aufbewahrt werden, grundsätzlich beliebig lange) 2 x 5 min 90% 2 x 5 min 96% 3 x 5 min 100% 6. Aufklaren und Aufbewahren in Methylsalicylat 7. Bei guten Präparaten kann eine Überführung in Canada Balsam erfolgen (Dauerpräparat, hier sind Hohlschliffobjektträger nötig). Dies sollte jedoch erst einige Stunden (am besten einen Tag) nach dem Aufklaren in Methylsalicylat erfolgen, da sonst eine erneute Eintrübung des Präparates die Folge ist. 7. Auswertung Zeichnen Sie die Ganglien mit den gefärbten Neuronen und machen Sie sich mit der Anatomie der Nervenzellen von Insekten vertraut. Am Ende des Praktikums sollten Sie zumindest 4 Zeichnungen angefertigt haben, jeweils mit Beschriftung und ggf. knappen Erläuterungen: das ganze Tier in einer Übersicht ein Detail, beispielsweise den Kopf ZNS und Muskulatur in einer Übersicht Ganglion mit gefärbten Neuronen (Mikroskop) eventuell einen Ganglienabschnitt oder ein typisches Neuron 8