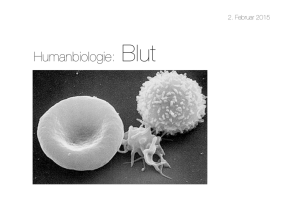
Erythrozyt
Werbung

Panzytopenie aus Wikipedia, der freien Enzyklopädie D61 Klassifikation nach ICD-10 Sonstige aplastische Anämien Panzytopenie ICD-10 online (WHO-Version 2006) Man spricht von einer Panzytopenie, wenn im Blutbild ein Mangel in allen drei Zellreihen (Trizytopenie) der Blutbildung, also eine Leukozytopenie, Anämie und Thrombozytopenie besteht. Als Ursachen für eine Panzytopenie kommt eine Knochenmarkschädigung durch Medikamente, Strahlentherapie oder Strahleneinwirkung genauso in Betracht wie eine Benzolintoxikation. Weitere Ursachen sind Knochenmarkerkrankungen wie z. B. eine aplastische Anämie (eventuell ebenfalls durch Benzol ausgelöst). Auch bei Leukämien kann es zu einer Panzytopenie kommen (z. B. Haarzellleukämie oder akute Leukämien), ebenso beim myelodysplastischen Syndrom oder Plasmozytom (=multiples Myelom). Folgen einer Panzytopenie sind eine Infektionsgefahr durch Mangel an Leukozyten, Schwäche durch Mangel an Erythrozyten (roten Blutkörperchen) und Blutungsneigung durch Mangel an Thrombozyten . Aplastische Anämie (gleiche wie Panzytopenie – Grund/Ursache ist Störung bei Bildung im Knochenmark) Wechseln zu: Navigation, Suche Klassifikation nach ICD-10 D60Erworbene isolierte aplastische Anämie [Erythroblastopenie] [pure red cell aplasia] D61Sonstige Aplastische Anämien ICD-10 online (WHO-Version 2006) Die Aplastische Anämie ist eine Sonderform der Anämie (Blutarmut). Man versteht darunter Knochenmarkversagen mit Panzytopenie, das heißt eine Verringerung der Anzahl aller Zellen des Blutes (Anämie + Leukopenie + Thrombozytopenie) aufgrund von erworbener (häufig) oder angeborener (selten) Knochenmarkaplasie. Zu den angeborenen Formen gehören die Fanconi-Anämie sowie das Diamond-Blackfan-Syndrom. Mit einer Häufigkeit von 0,2 – 0,3 Erkrankungen auf 100.000 Personen ist die Aplastische Anämie in Europa so selten, dass die meisten Mediziner mit dieser Erkrankung während ihrer gesamten Arbeitszeit nie konfrontiert werden. Myelodysplastisches Syndrom Wechseln zu: Navigation, Suche Klassifikation nach ICD-10 D46 Myelodysplastische Syndrome ICD-10 online (WHO-Version 2006) Unter dem Begriff Myelodysplastisches Syndrom (abgekürzt MDS, auch Myelodysplasie oder auch Pl. Myelodysplastische Syndrome) wird eine Gruppe von Erkrankungen des Knochenmarks zusammengefasst, bei denen die Blutbildung nicht von gesunden, sondern von genetisch veränderten Ursprungszellen ausgeht. Folge ist eine gestörte Bildung der roten Blutkörperchen (Erythrozyten), zum Teil auch der weißen Blutkörperchen (Leukozyten) und der Blutplättchen (Thrombozyten). In Erscheinung tritt die Erkrankung in erster Linie durch eine Blutarmut (Anämie), je nach Ausmaß der Veränderungen bei Blutplättchen und weißen Blutkörperchen können aber auch Blutungen und Infektionen mit Fieber auftreten. Sind alle drei Zellreihen, die roten Blutkörperchen, weißen Blutkörperchen und Blutplättchen vermindert, so wird hierfür der medizinische Fachbegriff Panzytopenie verwendet. Im Knochenmark von an Myelodysplasie Erkrankten finden sich fehlgeformte, an normale Blutzellen erinnernde und vorzeitig absterbende Zellelemente. Zur sicheren Diagnose von Myelodysplasie dient unter anderem die Analyse der Chromosomen, die charakteristische Veränderungen aufdecken kann. MDS tritt vorwiegend im Alter ab 60 Jahre auf, häufig auch sekundär nach einer Strahlen- oder Chemotherapie. Es gibt aber auch Betroffene jüngeren Alters. Die Krankheit führt unbehandelt im Allgemeinen nach 6 bis 100 Monaten zum Tod, verläuft also sehr unterschiedlich. In etwa 30% der Patienten geht die Erkrankung in eine akute myeloische Leukämie über. Abhilfe kann bisher wie bei den verschiedenen Formen von Leukämie nur eine Stammzelltransplantation schaffen − was allerdings nur bei jüngeren Patienten vom medizinischen Standpunkt aus sinnvoll ist. In Deutschland zählt man etwa 5.000 Erkrankte. An mehreren Hochschulen, zum Beispiel an der Universität Düsseldorf, laufen Forschungsprogramme zur Bekämpfung dieser Krankheit, die meist im Rahmen einer Blutuntersuchung entdeckt und durch eine Knochenmarkspunktion verifiziert wird. Multiples Myelom C90.0 Klassifikation nach ICD-10 Plasmozytom (Multiples Myelom) ICD-10 online (WHO-Version 2006) Ein multiples Myelom (syn. Plasmozytom, Kahler-Krankheit nach Otto Kahler, Huppert-Krankheit, sogenannte monoklonale Gammopathie mit pathologischer Produktion von Immunglobulinen) ist eine Krebserkrankung des Knochenmarks. Sie ist gekennzeichnet durch bösartige Vermehrung Antikörper-produzierender Zellen, der Plasmazellen. Die entarteten Plasmazellen produzieren in der Regel Antikörper oder Bruchstücke davon. Da alle malignen Plasmazellen von einer gemeinsamen Vorläuferzelle abstammen, sind sie genetisch identisch (Zellklon) und produzieren identische (= monoklonale) Antikörper. Das Ausmaß der Bösartigkeit (der Grad der Malignität) kann sehr unterschiedlich sein und reicht von Krebsvorstufen über nur langsam voranschreitende Krankheitsverläufe bis zu hochmalignen, ohne Behandlung schnell zum Tod führenden Erkrankungen. Krankheitssymptome entstehen entweder durch das bösartige Wachstum der Plasmazellen oder durch die Eigenschaften der gebildeten Antikörper oder Antikörperbruchstücke. Das Wachstum der Plasmazellen führt zu Knochenschmerzen und Auflösung der Knochen bis zu spontanen Knochenbrüchen, Anstieg des aus dem Knochen gelösten Calciums im Blut und Abnahme der im Knochenmark gebildeten roten Blutkörperchen. Die im Übermaß produzierten und oftmals abnormalen Antikörper können durch Ablagerung im Gewebe zu Funktionsstörungen vieler Organe, zu Nierenversagen und zur Beeinträchtigung der Durchblutung führen. Die Diagnose wird durch Blutuntersuchung, Röntgen der großen Knochen und Knochenmarkpunktion gestellt. Im Frühstadium der Erkrankung wird der Krankheitsverlauf nur beobachtet. Treten Symptome und Komplikationen auf, können Betroffene mit Chemotherapie, Medikamenten, die das Immunsystem beeinflussen, Medikamenten, die die Knochenauflösung hemmen, und Knochenmarktransplantation behandelt werden. Nach Auftreten von Komplikationen beträgt die Lebenserwartung ohne Behandlung im Mittel 6 Monate, mit Chemotherapie 3 Jahre und nach Knochenmarkstransplantation 5 Jahre. Erythrozyt Rote Blutkörperchen Die roten Blutkörperchen (Erythrozyten, Singular der Erythrozyt; von altgriechisch ἐρυθρός erythrós „rot“ sowie altgriechisch κύτος kýtos „Höhlung“, „Gefäß“, „Hülle“[1]) sind die häufigsten Zellen im Blut von Wirbeltieren. Erythrozyten wurden erstmals 1658 von Jan Swammerdam beschrieben. Sie erscheinen unter dem Mikroskop als ungefähr gleich große, blasse, runde Scheiben, die in der Mitte von beiden Seiten leicht eingedellt sind (bikonkav). Sie dienen dem Transport von Sauerstoff von der Lunge oder den Kiemen zu den diversen Körpergeweben. Zahlen zu den Erythrozyten beim Menschen Durchmesser: etwa 7,5 µm (Mikrometer) (7,5·10−6m) Dicke: 2 µm am Rand und 1 µm im Zentrum Durchschnittliche Konzentration im Blut: etwa 4,5–5,5 Mio/mm3 (also etwa 5·106/µl = 5·106/mm3 = 5·1012/l = 5 Tera/l = 5·1015/m3) im Blut bei Männern: 4,6–6,2·106/µl im Blut bei Frauen: 4,0–5,4·106/µl Gesamtanzahl im Blut: 24–30 Billionen = 24-30·1012 Entwicklungszeit: etwa 7 Tage durchschnittliche Lebensdauer: etwa 120 Tage oder 4 Monate Neuproduktion der Erythrozyten: etwa 1 %/Tag = etwa 200 Milliarden/Tag = etwa 2 Millionen/Sekunde Gesamtoberfläche: 4.000–4.500 m2 Aufbau [Bearbeiten] Normale (a und b) und deformierte Erythrozyten (c: Sphärozyten, d: Echinozyten) Die Scheibenform verdankt der Erythrozyt seinem Membranskelett. Dieses besteht aus einem flächigen Netz aus SpektrinFilamenten, die durch kurze Aktin-Filamente zusammen gehalten werden. Durch Vermittlung von Adaptorproteinen, wie Ankyrin und 4.1, ist das Netz an integralen Proteinen der Plasmamembran verankert. Zu den integralen Proteinen der Plasmamembran zählen das Bande-3-Tetramer und Glykophorin. Erythrozyten bestehen zu 90 % der Trockenmasse aus dem Sauerstoff bindenden Protein Hämoglobin. Dies entspricht ca. 35 % der Masse eines Erythrozyten bzw. 120 bis 160 g/l des Vollblutes bei Frauen und 140 bis 180 g/l bei Männern. Der Häm-Anteil dieses Proteins verleiht den Erythrozyten und somit auch dem Blut die rote Farbe. Die Erythrozyten von Säugetieren verwerfen im Verlauf ihrer Reifung, bevor sie in den Blutkreislauf eintreten, den Zellkern und ihre Organellen. Diese sind in den aktiven Vorstufen, den Retikulozyten, jedoch noch vorhanden. Auch junge Erythrozyten können noch Reste von Kernmaterial, Chromatin, enthalten, das im Verlauf des Alterungsprozesses verschwindet. Da Erythrozyten keine Mitochondrien besitzen, wird Energie über die Milchsäuregärung hergestellt. Die Glucoseaufnahme der Erythrozyten wird dabei nicht über Insulin reguliert, da der entsprechende Rezeptor fehlt. Stattdessen erfolgt die Aufnahme von Glucose durch sogenannte Glucosetransporter (hier: GLUT1). Da mit dem Zellkern auch die DNA fehlt, finden sich in den Erythrozyten ein „Vorrat“ an mRNA. Durch den Abbau der Organellen wird zusätzlicher Platz für Hämoglobin geschaffen. Das Fehlen von Zellkern und Organellen bei den reifen roten Blutkörperchen der Säugetiere (Mammalia) ist einzigartig im Tierreich. Bei anderen Wirbeltieren sind diese noch vorhanden. Die bikonkave Form ermöglicht es dem Erythrozyten, Sauerstoff schneller aufzunehmen, da die Diffusionsstrecke von der Zellmembran in das Innere der Zelle verkürzt ist (s. Abbildung b). Sehr wichtig für die Funktion der Erythrozyten ist auch ihre starke Verformbarkeit, die es ihnen erlaubt, auch kleinste Kapillaren zu durchqueren. Durch den engen Kontakt zwischen Erythrozyten und dem Endothel der Gefäße ist der Gasaustausch in den Kapillaren besonders effektiv. Unter speziellen Bedingungen können Erythrozyten in vitro auch andere Formen annehmen: die Becherform und die Stechapfelform. Becherförmige Erythrozyten (c) werden als Stomatozyten und stechapfelförmige (d) als Echinozyten bezeichnet. Echinozyten können durch nachlässige Verarbeitung des Blutbildes beispielsweise durch Austrocknung entstehen. Sind die Echinozyten jedoch trotz mehrfacher sorgfältiger Verarbeitung nachweisbar, so kann dies in einer Pyruvatkinaseinsuffizienz, einer Niereninsuffizienz, einem Vitamin-E-Mangel (Hypovitaminose) oder einer Vergiftung begründet sein.[2] Eine Schistozyte ist ein im Abbau befindlicher Erythrozyt bzw. ein Fragment eines Erythrozyten. Bei sehr niedriger Fließgeschwindigkeit des Blutes können einzelne Erythrozyten aneinander haften und Ketten bilden, man spricht dann von einer Geldrollenbildung oder Agglomeration. Auf der Oberfläche befinden sich Variationen von Glykoproteinen. Funktion und Lebenszyklus Die Aufgabe der roten Blutkörperchen ist der Sauerstofftransport im Blutgefäßsystem. Sie nehmen in den Lungenkapillaren oder Kiemen den Sauerstoff auf und transportieren ihn über den arteriellen Kreislauf bis in die arteriellen Kapillaren der Gewebe und Organe, von wo der Sauerstoff an die Zellen wieder abgegeben wird. Für die Bindung und den Transport des Sauerstoffs ist das Hämoglobin im Inneren der Erythrozyten verantwortlich. Hämoglobin transportiert teilweise auch das Kohlendioxid zurück aus den Geweben. Der Prozess, bei welchem die Erythrozyten entstehen, wird Erythropoese genannt. Im Embryo ist die Leber die Hauptproduktionsstätte der Erythrozyten. Später werden diese kontinuierlich im roten Knochenmark von größeren Knochen produziert. Sie entstehen hier aus teilungsfähigen Stammzellen, die zunächst kernhaltige Erythroblasten produzieren, aus denen dann zunächst unter Ausstoßung des Zellkerns die Retikulozyten und dann, die eigentlichen Erythrozyten hervorgehen. Die im Knochenmark stattfindende Reifung der Erythrozyten wird von Makrophagen, einer Gruppe der weißen Blutkörperchen (Leukozyten), unterstützt. Hierbei ordnen sich die unreifen roten Blutkörperchen in sogenannten "Inseln" (engl.: islands) um einen einzelnen Makrophagen an, der die Zellen versorgt und außerdem die ausgeschiedenen Zellorgane aufnimmt und verdaut. Dieser schon in den frühen 1940er-Jahren beobachtete Vorgang benötigt auf noch nicht näher bekannte Weise das Retinoblastom-(Rb)-Protein. Die Entwicklung eines Erythrozyten dauert ca. 7 Tage. Ihre durchschnittliche Lebensdauer beträgt ca. 120 Tage bzw. 4 Monate. Die alternden Zellen verlieren nach und nach ihre Verformbarkeit und werden dann von Phagozyten in Leber, Milz und Knochenmark (RES = Retikuloendotheliales System) abgebaut. In einem gesunden, erwachsenen Menschen befinden sich etwa 25 Billionen rote Blutkörperchen, mit einer Gesamtoberfläche von 4000 m2. Der Körper erneuert davon täglich ca. ein Prozent (200 Milliarden), was 2.000.000 in jeder Sekunde entspricht. Die Milz dient auch als Reservoir für rote Blutkörperchen, wobei dieser Effekt beim Menschen limitiert ist. In anderen Säugetieren, wie beim Hund oder Pferd, enthält die Milz eine große Zahl von roten Blutkörperchen, die bei Stress in den Blutkreislauf ausgeschieden werden und die Sauerstofftransportkapazität verbessern. Die Produktion von roten Blutkörperchen wird durch das Hormon Erythropoetin (EPO) stimuliert bzw. gesteuert, welches ständig von den Nieren neu gebildet wird, weil der Körper dieses Hormon nicht speichern kann. Die Synthese im Körper erfolgt durch das Messen der Oberflächenspannung der Erythrozyten und dem damit verbundenen Sauerstoffgehalt beim Durchfließen der Nieren. Dadurch erfolgt zum Beispiel eine Anpassung an den geringeren Sauerstoffgehalt in der Luft bei Aufenthalten über 1500 m über NN (Höhentraining von Leistungssportlern usw.). EPO kann bzw. wird auch als Dopingmittel in synthetischer Form eingesetzt. Die Verlagerung des sauerstoffbindenden Proteins, in diesem Fall Hämoglobin, in Zellen hinein, statt dieses direkt in der Körperflüssigkeit zu lösen, war ein wichtiger Schritt in der Evolution der Wirbeltiere. Es ermöglicht dünnflüssigeres Blut sowie längere Transportstrecken des Sauerstoffes. Nur so ist auch die Versorgung eines größeren Organismus (bis hin zum Blauwal) mit Sauerstoff gewährleistet. Andere sauerstoffbindende Proteine aus anderen Tieren wie Hämocyanin, Hämerythrin oder Erythrocruorin können diese Eigenschaften nur annähernd über ihre Molekülgröße kompensieren. Krankheiten Bei einer Anämie oder Blutarmut ist in der Regel die Anzahl der roten Blutkörperchen vermindert. Es gibt viele Ursachen für eine Anämie, wobei Eisenmangel der häufigste Grund in der westlichen Welt sein dürfte. Durch Eisenmangel wird die Häm-Synthese gehemmt. Als Folge sind die roten Blutkörperchen hypochrom (vor allem im Zentrum schwächer rot gefärbt) und mikrozytär (kleiner als normal). Bei einer Gruppe von Stoffwechselkrankheiten, den Porphyrien, fallen Enzyme der Hämgruppen-Synthese teilweise aus und drosseln dadurch die Hämoglobinmenge in den Erythrozyten. Vorhandenes Eisen kann nicht vollständig in die Häm-Vorläufersubstanzen (Porphyrine) eingebaut werden, die im Gewebe akkumulieren und verschiedene Symptome verursachen (Lichtempfindlichkeit der Haut, starke Bauchschmerzen u. a.). Bei der Polyglobulie – zum Beispiel der Polycythaemia vera, der Polycythaemia rubra hypertonica und der Polyglobulie des Neugeborenen – treten rote Blutkörperchen vermehrt auf. Durch die erhöhte Anzahl der Thrombozyten wird das Blut dickflüssiger. Es besteht die Gefahr einer Thrombose und in der Folge einer Embolie. Bei einer Hämolyse (verstärkter Abbau von roten Blutkörperchen), tritt eine Gelbsucht auf, verursacht durch das Hämoglobin-Abbauprodukt Bilirubin. Mutationen in den Globinketten sind mit verschiedenen Hämoglobinopathien verbunden, wie die Sichelzellenanämie und Thalassämie. Bei der Sichelzellenanämie handelt es sich um eine hauptsächlich in von Malaria betroffenen Gebieten vorkommende Krankheit. Bei ihr verformen sich die roten Blutkörperchen im Deoxy-, das heißt sauerstoffarmen Zustand sichelförmig. In dieser Form können sie die kleinen Kapillaren nur mit Schwierigkeiten passieren und es kommt vermehrt zur Zerstörung der Erythrozyten, der sogenannten Hämolyse. Homozygote Träger dieser Erbanlagen haben eine deutlich verkürzte Lebenserwartung, die heterozygoten Träger sind jedoch vor einer Malaria-Erkrankung geschützt, da der Erreger (Plasmodium falciparum) sich in derart deformierten Erythrozyten nicht vermehren kann. Die Kugelzellenanämie ist ein genetischer Defekt, bei dem kugelförmige Erythrozyten, so genannte Sphärozyten, durch ein gestörtes Zytoskelett auftreten. Beim Favismus führt der genetisch bedingte Mangel an einem Enzym (Glucose-6-phosphat-Dehydrogenase) nach Einnahme bestimmter Medikamente (Acetylsalicylsäure) oder Nahrungsmittel (Saubohnen) zum Platzen der Erythrozyten. Leukozyt Leukozyten oder weiße Blutkörperchen (von altgriechisch λευκός leukós „weiß“ sowie altgriechisch κύτος kýtos „Höhlung“, „Gefäß“, „Hülle“[1]) sind bestimmte Zellen des Körpers, die im Blut, im Knochenmark, in den lymphatischen Organen und anderen Körpergeweben zu finden sind. Morphologisch werden sie den Erythrozyten (roten Blutkörperchen) gegenübergestellt, da sie im Gegensatz zu diesen nicht den roten Farbstoff Hämoglobin enthalten. Die quantitative Zusammensetzung der Leukozyten im peripheren Blut wird im Differentialblutbild erfasst. Von links nach rechts: Erythrozyt (rotes Blutkörperchen), Thrombozyt und Leukozyt im Elektronenmikroskop. Leukozyten erfüllen spezielle Aufgaben in der Abwehr von Krankheitserregern und körperfremden Strukturen. Sie gehören zum Immunsystem und sind dort Teil der spezifischen und unspezifischen Immunabwehr, weshalb sie auch als Immunzellen oder Immunozyten bezeichnet werden. Bau der Leukozyten Schematisierter Knochenmarkabstrich unter anderem mit Abbildung von Vorstufen der Leukozyten, den Myelozyten Leukozyten sind, abhängig von ihrer Art, unterschiedlich in Gestalt und Aufbau. Die Größe der Leukozyten schwankt zwischen 7 µm bei Lymphozyten und 20 µm bei Monozyten. Die Roten Blutkörperchen sind etwa 7,5 µm groß. Die Lebensdauer der Zellen reicht von wenigen Tagen bis zu mehreren Monaten. Bestimmte Leukozyten sind amöboid beweglich und können aktiv aus dem Blut in die verschiedenen Zellgewebe einwandern. Bildung der Leukozyten Die Bildung der Leukozyten ist ein Vorgang, der beim Erwachsenen im roten Knochenmark (Medulla osseum rubrum) von Brustbein und Becken beginnt. Diesen Vorgang nennt man Leukopoese (auch Leukozytopoese). Bei Kindern befindet sich blutbildendes rotes Knochenmark zusätzlich in den langen Röhrenknochen der Arme und Beine. Die weißen Blutkörperchen werden dort aus so genannten Vorläuferzellen der Stammzellen gebildet und differenzieren anschließend innerhalb der unterschiedlichen Kategorien der Leukozyten weiter, je nach den ihnen zugedachten Aufgaben und Funktionen. Um diese erfüllen zu können, müssen Teile der Leukozyten nach ihrer Bildung in bestimmten Organen geprägt werden. Im Lymphsystem, das heißt in Lymphknoten, Thymus, Milz, Mandeln, Knochenmark, müssen sie lernen, welche Stoffe zum Körper des Organismus gehören und welche als fremd anzusehen sind. Die Stammzellen selbst besitzen weitreichende Möglichkeiten sich zu entwickeln, sie sind pluripotent. Bei ihrer Teilung entstehen nicht zwei gleiche Tochterzellen, sondern jeweils eine neue pluripotente Stammzelle und eine Vorläuferzelle der einzelnen Blutzellen (determinierte Stammzelle), welche anschließend weiter heranreift. Je nachdem, welcher Wachstumsfaktor (Zytokine) einwirkt, entstehen so die unterschiedlichen Arten entweder der Leukozyten oder der Erythrozyten oder der Megakaryozyten. Neutrophiler Granulozyt wandert aus dem Blutgefäß in das Gewebe ein, sezerniert proteolytische Enzyme, um interzelluläre Verbindungen zu lösen (zur Verbesserung seiner Beweglichkeit) und phagozytiert Bakterien Schematische Darstellung der Abläufe bei der Leukozytenmigration durch das Endothel. Aufgaben der Leukozyten Weiße Blutkörperchen haben die Aufgabe, für den Organismus unverträgliche Stoffe bzw. Krankheitserreger unschädlich zu machen. Dazu zählen Bakterien, Viren, Tumorzellen, Toxine, körperfremde Partikel, Würmer, Pilze und Protozoen (Einzeller). Die einzelnen Untergruppen der Leukozyten übernehmen dabei verschiedene Aufgaben innerhalb des Immunsystems – von der Phagozytose über die Markierung von Antigenen bis hin zur Bekämpfung von körpereigenen und körperfremden Zellen und Krebszellen. Neutrophile Granulozyten, Monozyten, Makrophagen und Dendritische Zellen zum Beispiel sind als Bestandteil der unspezifischen Abwehr zur Phagozytose fähig. Dabei nehmen sie Fremdmaterial auf und machen es unschädlich. Sie werden daher auch Fresszellen genannt. B-Lymphozyten hingegen produzieren nach geeigneter Stimulation speziell gegen bestimmte Erreger oder schädigende Stoffe gerichtete Antikörper. Sie gehören somit zur spezifischen Abwehr. T-Lymphozyten dienen unter anderem der Koordination zwischen spezifischer und unspezifischer Abwehr. Auch an Entzündungen sind Leukozyten beteiligt und in der Lage, durch freigesetzte Botenstoffe (Mediatoren) wie Zytokine und Leukotriene diese aufrecht zu halten, zu modulieren oder zu beenden. Leukozyten spielen außerdem eine wesentliche Rolle bei allen Autoimmunkrankheiten. Morphologie der Leukozyten Es gibt zahlreiche Möglichkeiten, die unterschiedlichen Leukozytenarten zu kategorisieren. Aufgrund ihrer Abstammung und Farbe in der Pappenheim-Färbung können sie wie folgt unterschieden werden. Alle Zellen der lymphatischen Reihe gehen auf lymphatische Vorläuferzellen zurück, die der myeloiden Reihe entwickeln sich aus myeloiden Vorläuferzellen. Auch die roten Blutkörperchen und die Blutplättchen entwickeln sich aus myeloiden Vorläuferzellen, diese werden aber nicht zu den Leukozyten gezählt und sind daher in der folgenden Tabelle nicht aufgeführt. lymphatische Reihe Lymphozyten myeloide Reihe Monozyten (Vorläufer der Makrophagen) Dendritische Zellen Mastzellen Granulozyten Granulozyten unterscheiden sich von den anderen Immunzellen (Agranulozyten) durch ihre unregelmäßig gelappten Zellkerne und durch das Vorhandensein kleiner Partikel im Cytoplasma. Die Agranulozyten besitzen dagegen runde oder bohnenförmige Zellkerne und keine Partikel im Cytoplasma. Lymphozyten und Granulozyten werden in weitere Zelltypen unterteilt: Lymphozyten Granulozyten B-Lymphozyten neutrophile Granulozyten T-Lymphozyten eosinophile Granulozyten NK-Zellen basophile Granulozyten Funktionen der einzelnen Leukozyten Die einzelnen Blutkörperchen übernehmen innerhalb des Immunsystems verschiedene Aufgaben, welche im folgenden kurz dargestellt sind. Nähere Informationen gibt es unter den entsprechenden Begriffen. Immunzellen Aufgabe und Funktion Monozyten Vorläufer der Makrophagen im Blut Makrophagen Phagozytose, im Gewebe und der Lymphflüssigkeit Mastzellen setzen nach Aktivierung Substanzen frei, die die Permeabilität der Blutgefäße beeinflussen Antigenpräsentierende Zellen (zum Beispiel Makrophagen, B-Zellen und Langerhanszellen) markieren Antigene und leiten damit die Immunantwort ein Granulozyten neutrophiler Granulozyten Phagozytose von Bakterien, Viren und Pilzen im Blut eosinophiler Granulozyten Abwehr von Parasiten, beteiligt an allergischen Reaktionen basophiler Granulozyten Abwehr von Parasiten, Auslöser allergischer Reaktionen, Entzündungsreaktionen, Juckreiz B-Zell-Gruppe B-Lymphozyten Vorläufer der Plasmazellen im Blut Plasmazellen Spezialisierung auf Antikörperproduktion B-Gedächtniszellen langlebige B-Zellen mit einem Gedächtnis für spezielle Antigene T-Zell-Gruppe T-Helferzellen aktivieren Plasmazellen und Killerzellen erkennen Antigene auf den Antigen präsentierenden Zellen T-Regulatorzellen bremsen die Immunantwort, hemmen die Funktion der B-Zellen und anderen TZellen T-Gedächtniszellen langlebige T-Zellen mit einem Gedächtnis für spezielle Antigene T-Killerzellen (zytotoxische T-Zellen) erkennen und zerstören von Viren befallene Körperzellen und Tumorzellen indem sie auf bestimmte Antigene der befallenen Zellen reagieren Killerzellen natürliche Killerzellen (NK) greifen unspezifisch Zellen an, die von Viren oder Tumoren befallen sind Bindung der Leukozyten an die Blutgefäße Die weißen Blutkörperchen sind sozusagen die Wächter des Immunsystems und patrouillieren ständig im gesamten Organismus auf der Suche nach Erregern oder zu zerstörenden Zellstrukturen. Dazu nutzen sie den Blutkreislauf, um von einem Ort zum anderen zu gelangen und tasten während dieser Phase die Wände der Gefäßzellen systematisch nach Stoppsignalen ab, die beispielsweise Krebszellen anzeigen. Des Weiteren dringen in jeder Minute hunderte von weißen Blutkörperchen in das Gewebe ein und suchen dort nach Verletzungen und Entzündungen. Dies tun sie, indem sie an den Wänden der Zellen entlang rollen und dort nach bestimmten Strukturen suchen, die einen solchen Zustand anzeigen. Zahlen und Werte Normalwerte häufig benutzt SI-Einheit Erwachsene 4 000 – 10 000 /µl (4-10 /nl) 4 – 10 · 109/l Schulkinder 5 000 – 15 000 /µl (5-15 /nl) 5 – 15 · 109/l Kleinkinder 6 000 – 17 500 /µl (6-17,5 /nl) 6 – 17,5 · 109/l Neugeborene 9 000 – 30 000 /µl (9-30 /nl) 9 – 30 · 109/l Eine die Normwerte übersteigende Anzahl von Leukozyten pro Volumen wird als Leukozytose bezeichnet. Eine Unterschreitung der Normwerte der Leukozyten pro Volumen wird als Leukopenie bezeichnet. prozentualer Anteil der Untergruppen an der Gesamtzahl der Leukozyten im Organismus Leukozytenuntergruppen Anteil in % Monozyten 2–8 Lymphozyten 20 – 45 Neutrophile Granulozyten segmentkernig 50 – 70 Neutrophile Granulozyten stabkernig 3–5 Eosinophile Granulozyten 2–4 Basophile Granulozyten 0–1 auf siebenhundert rote Blutkörperchen kommt unter normalen Bedingungen etwa ein weißes Blutkörperchen Krankheiten im Zusammenhang mit Leukozyten [Bearbeiten] Leukämie Bei den Leukämien verändern sich einzelne Untergruppen der Leukozyten zu Tumorzellen. Am häufigsten betroffen sind die Lymphozyten. Der Entstehungsort der Krankheit ist das Knochenmark, wo die Tumorzellen mit dem Blutstrom in Kontakt kommen und dadurch im ganzen Körper verteilt werden. Durch ihr massenhaftes Auftreten rufen die Tumorzellen Krankheitssymptome in allen Organen hervor. Vor allen Dingen im Knochenmark verdrängen sie die Erythrozyten, normalen Leukozyten und Thrombozyten und hemmen auf diese Weise deren Bildung. Die Betroffenen fallen durch Müdigkeit, Blässe, Blutungsneigung und allgemeines Krankheitsgefühl auf. Gleichzeitig entsteht eine Anfälligkeit für Infektionen, weil die entarteten Leukozyten ihre eigentliche Aufgabe der Immunabwehr nicht erfüllen. HIV Das Humane Immundefizienz-Virus vermehrt sich vorwiegend über T-Helferzellen. [2] Mit der Zeit sinkt die Anzahl der vorhandenen T-Helferzellen bis schließlich die komplette Immunabwehr zusammenbricht, es treten die Symptome des AIDS' auf. Die Erkrankten sterben oft an opportunistischen Infektionen. Ein typisches Beispiel für eine solche Infektion ist eine Lungenentzündung durch Pneumocystis jirovecii, an der gesunde Menschen nur sehr selten erkranken. Adhäsionsdefizit Hierbei handelt es sich um eine Gruppe (seltener) erblicher Glykoproteinbiosynthese-Störungen, die zu geistigen und körperlichen Behinderungen und einer vermehrten Infektanfälligkeit führen können. Derzeit sind neun verschiedene Subtypen der Erkrankung bekannt. Die Zahl der Erkrankten wird in Europa auf 300 geschätzt. Typisch ist eine Leukozytose ohne ersichtlichen Grund. Die Adhäsionsfähigkeit der Leukozyten an die Blutgefäßwand ist bei diesem Krankheitsbild erheblich eingeschränkt.[3] Das Krankheitsbild ist auch in der Veterinärmedizin bekannt.[4] Thrombozyt Von links nach rechts: Erythrozyt (rotes Blutkörperchen), Thrombozyt (aktiviert) und Leukozyt Thrombozyten (von altgriechisch θρόμβoς thrómbos „Klumpen“ sowie altgriechisch κύτος kýtos „Höhlung“, „Gefäß“, „ Hülle“[1]) oder Blutplättchen sind die kleinsten Zellen des Blutes. Sie spielen eine wichtige Rolle bei der Blutgerinnung, indem sie sich bei einer Verletzung des Blutgefäßes an das umliegende Gewebe anheften („Thrombozytenadhäsion“) oder aneinanderheften („Thrombozytenaggregation“), so dass die Verletzung verschlossen wird. Zusätzlich setzen sie dabei gerinnungsfördernde Stoffe frei. Blutplättchen haben weder Zellkerne noch Erbinformation (DNA) und können sich deshalb nicht wie andere Zellen teilen. Struktur und Funktion Thrombozyten entstehen im Knochenmark, wo sie von Megakaryozyten, riesigen thrombozyten-bildenden Zellen, abgeschnürt werden. Bis zu 8000 Thrombozyten können sich im Laufe eines Lebens von solch einer Knochenmarkszelle abschnüren. Dieser Vorgang wird Thrombopoese genannt und durch das Hormon Thrombopoietin unterstützt. Thrombozyten haben einen Durchmesser von 1,5 µm bis 3,0 µm und sind scheibenartig flach (discoid). Während der Blutgerinnung ändern die Thrombozyten durch Aktivatoren wie ADP, Kollagen und Thrombin ihre Form (shape change). Es erfolgt die Ausstülpung von Pseudopodien, was mit einer mehrfachen Oberflächenvergrößerung einhergeht. Dies begünstigt die Thrombus-Bildung durch fibrin-vermittelte Bindung mit anderen Thrombozyten. Dieser Vorgang beschreibt die Funktion von Thrombozyten und wird Thrombozytenaggregation genannt. Bei gesunden Personen gilt eine Thrombozytenanzahl von 150.000–380.000 pro µl Blut als Normalwert. Die durchschnittliche Lebensdauer von Thrombozyten beträgt acht bis zwölf Tage. Der Abbau erfolgt hauptsächlich in der Milz sowie in der Lunge und, in geringerem Maße, in der Leber. Zelluläre Aspekte Trotz Fehlens eines Zellkerns wurde in Thrombozyten mRNA aus Megakaryozyten gefunden. Sie sind daher, wenn auch begrenzt, zur Neusynthese von Proteinen befähigt. Sie besitzen wie andere Zellen Mitochondrien, jedoch eine spezielle Form des rauhen Endoplasmatischen Retikulums (rER), das kanalikuläre System. Es dient als Calciumionen-Speicher, dessen rasche Entleerung ins Cytosol eine essentielle Voraussetzung für die physiologische Thrombozytenaggregation ist. Als weitere Kompartimente sind bei Thrombozyten die Speicher-Granula bedeutsam: Sie werden in α-Granula, elektronendichte Granula und Lysosomen unterteilt und enthalten aggregationsfördernde Substanzen und Proteine, deren Sekretion (Ausschüttung) für die Thrombozytenfunktion notwendig ist. Die Plasmamembran von Thrombozyten enthält unter anderem das Protein Thromboplastin (engl. tissue factor). Man geht davon aus, dass sich Vesikel mit diesem Protein abschnüren und nun als zirkulierende Mikropartikel im Blut zu finden sind. [2] Durch diese Fähigkeit, die sie mit Monozyten gemein haben, unterstützen sie die Blutgerinnung. Primäre Erkrankungen, die die Thrombozytenanzahl beeinträchtigen Erkrankungen, die auf einen Mangel an Thrombozyten zurückzuführen sind, heißen Thrombozytopenien. Eine Milzvergrößerung (Splenomegalie), sowie eine Immunthrombozytopenie, führen zu einer Verringerung der durchschnittlichen Thrombozytenlebensdauer, was bei einer gleichbleibenden Produktionsrate zu einer insgesamt geringen Thrombozytenkonzentration führt. Umgekehrt kommt es nach Entfernung der Milz (Splenektomie), zu einem starken Anstieg der Thrombozytenanzahl durch das Fehlen des Milz-vermittelten Abbaus. Auch die krankhafte Veränderung des Knochenmarks als Bildungsort führt bei einer essentiellen Thrombozythämie zur Überproduktion von Thrombozyten. Einige weitere seltene Erkrankungen, die mit einem Mangel an Thrombozyten einhergehen sind: TAR-Syndrom Wiskott-Aldrich-Syndrom Gray Platelet-Syndrom Jacobsen-Syndrom Morbus Gaucher Primäre Erkrankungen, die die Thrombozytenfunktion beeinträchtigen Erkrankungen, die die Funktion der Thrombozyten beeinträchtigen, heißen Thrombozytopathien. Dazu zählen unter anderem: Bernard-Soulier-Syndrom Willebrand-Jürgens-Syndrom hereditäre Thrombasthenie Storage pool disease (Verminderung der dichten Granula mit Störung der irreversiblen Thrombozytenaggregation) Thrombozytopenie Thrombozytopenie (kurz: Thrombopenie) bezeichnet einen Mangel an Thrombozyten (Blutplättchen) im Blut. Der Mensch verfügt normalerweise über ca. 150 000 - 380 000 Thrombozyten pro µl Blut; wird dieser Wert unterschritten, spricht man von einer Thrombozytopenie. Allerdings toleriert der menschliche Körper auch weit niedrigere Thrombozytenzahlen ohne merkliche Schäden oder Ausfallserscheinungen. Wenn es zu Symptomen kommt, bemerkt der Patient u. a., dass Blutungen bei Verletzungen länger als üblich dauern, bevor sie zum Stillstand kommen. Die gemessene Blutungszeit überschreitet den Normwert (> 6 Minuten). Die partielle Thromboplastinzeit (PTT) wird von einer Thrombopenie nicht beeinflusst, da für diese Laboruntersuchung das u.a. von den Thrombozyten stammende Phospholipid (veraltet: Plättchenfaktor 3) hinzugegeben wird. Meist erst bei einer Thrombozytenzahl unter 30 000/µl kann es zu mitunter gefährlichen Spontanblutungen kommen (Hämorrhagische Diathese). Thrombozyten zu ersetzen, d. h. mittels einer Transfusion dem Blutkreislauf hinzuzufügen, ist eine sehr teure medizinische Maßnahme mit einem Risiko von Unverträglichkeitsreaktionen und der Übertragung von Infektionen und wird nur bei wenigen Indikationen als notwendig erachtet. Eine solche kann z. B. eine Thrombozytopenie im Rahmen einer Chemotherapie sein. Das Gegenteil der Thrombozytopenie ist die Thrombozytose. Funktionsstörungen der Thrombozyten werden als Thrombozytopathien bezeichnet. Thrombozytopathie D69.x[1] lassifikation nach ICD-10 Thrombozytopathie ICD-10 online (WHO-Version 2006) Eine Thrombozytopathie, auch Thrombopathie genannt, ist eine Funktionsstörung der Thrombozyten (Blutplättchen). Beschreibung Die Funktionsstörung der Thrombozyten kann sich durch Aggregation, Ausbreitung oder Adhäsion äußern. Die Anzahl der Thrombozyten ist dagegen normal oder nur geringfügig verändert (Abgrenzung zur Thrombozytopenie). Eine Thrombozytopathie ist eine spezielle Form einer hämorrhagischen Diathese. Thrombozyten sind Zellbestandteile im Blut, die bei der Blutgerinnung eine wichtige Rolle spielen. Entsprechend führt eine Thrombozytopathie zu einer erhöhten Bereitschaft für Blutungen, wie beispielsweise Nasenbluten, Zahnfleischbluten, lange blutende Schnittverletzungen. Auch petechiale Blutungen sind möglich. Für eine Thrombozytopathie können sowohl exogene (äußere) als auch endogene (innere) Einflüsse verantwortlich sein. Exogene Ursachen Eine Reihe von Medikamenten, wie beispielsweise Acetylsalicylsäure, Diclofenac, Heparin, Penicillin sowie verschiedene Chemotherapeutika, schränken die Funktion der Thrombozyten ein. Endogene Ursachen Eine Reihe erblich bedingter Syndrome können die Ursache für eine Thrombozytopathie sein Willebrand-Jürgens-Syndrom Bernard-Soulier-Syndrom [2] hereditäre Thrombasthenie Storage pool disease (Verminderung der dichten Granula mit Störung der irreversiblen Thrombozytenaggregation); Typ I (d-Granula), Typ II (a-Granula), Typ III (d- und a-Granula) Therapie [Bearbeiten] Eine Therapie erfolgt in der Regel nur bei klinischer Indikation, beispielsweise mit Desmopressin. Hämorrhagische Diathese Klassifikation nach ICD-10 D65.xKoagulopathien, Purpura und sonstige D69.xhämorrhagische Diathesen D68.xKoagulopathien Unter einer hämorrhagischen Diathese versteht man eine krankhaft gesteigerte Blutungsneigung. Sie ist eine spezifische Form der Diathese. Symptome einer hämorrhagischen Diathese kann jede abnormale Blutung sein wie z. B. eine verlängerte Blutungszeit (> 6 Min.), Blutergüsse (Hämatome) ohne Gewalteinwirkung oder nach Bagatellverletzungen, Zahnfleischbluten und Blutungen im Verdauungstrakt oder in die Gelenke. Krankheiten, die mit vermehrter Blutungsneigung einhergehen sind vor allem Störungen der Blutgerinnung (Koagulopathien), Verminderung der Anzahl (Thrombopenie) oder Erkrankungen der Blutplättchen (Thrombozytopathie), der Mangel an Blutgerinnungsfaktoren (z. B. Hämophilie) oder Vergiftungen mit Blutgerinnungshemmern (Rattengift, z. B. Dicumarol). Übersicht über Gerinnungsfaktoren und Inhibitoren Die meisten Gerinnungsfaktoren sind Eiweißstoffe (Proteine). Jedem Faktor ist eine römische Zahl zugewiesen. Ein kleines a hinter der Zahl bedeutet, dass er in der aktiven Form vorliegt. Aus historischen Gründen (siehe unten, Forschungsgeschichte) ist die Zahl VI nicht (mehr) vergeben, der entsprechende Faktor ist identisch mit Va. Nummer Name(n) Funktion I Fibrinogen Bildet das Fibrinnetz. II Prothrombin Die aktive Form Thrombin (IIa) aktiviert die Faktoren I, V, VII und XIII. III (Gewebe-)Thromboplastin, Tissue factor (TF) Im subendothelialen Gewebe, Kofaktor von VIIa. IV Calcium Viele Faktoren benötigen das Calcium-Kation Ca2+, um an die negativ geladenen Phospholipide der Plasmamembranen zu binden. V Proaccelerin Kofaktor von X, mit dem es einen Komplex bildet. VII Proconvertin Aktiviert IX und X, wird durch Kontakt mit TF aktiviert. VIII Antihämophiles Globulin A Kofaktor von IX, mit dem es einen Komplex bildet. IX Christmas-Faktor, Antihämophiles Globulin B Aktiviert X, bildet einen Komplex mit VIII. X Stuart-Prower-Faktor Aktiviert Prothrombin, bildet einen Komplex mit VII. XI Rosenthal-Faktor, Plasma Thromboplasmin Antecedent (PTA) Aktiviert XII und IX. XII Hageman-Faktor Aktiviert die Fibrinolyse. XIII Fibrinstabilisierender Faktor Stabilisiert Fibrin durch Bildung von Quervernetzungen. Um eine Gerinnung in der Abwesenheit von Verletzungen zu vermeiden, enthält das Blutplasma verschiedene hemmende Substanzen (Inhibitoren). Proteaseinhibitoren hemmen die Bildung von Fibrin. Antithrombin hemmt mehrere Gerinnungsproteasen in der Aktivierungsphase und Koagulationsphase. Die inhibitorische Wirkung wird durch seinen Kofaktor, das Heparin, deutlich verstärkt. Heparin wird von Endothelzellen und Mastzellen gebildet. Thrombomodulin, das ebenfalls aus dem Endothel stammt, bindet an Thrombin und aktiviert Protein C, das nach Bindung an Protein S die Cofaktoren Va und VIIIa inaktiviert. Wird der Faktor XI bei einem Individuum nicht gebildet, hat dies keine bedeutende Störung der Gerinnung zur Folge, im Gegensatz zum Mangel des Faktors VIII und IX, die zur Hämophilie A/B führen Zwischen den Systemen der Blutgerinnung und dem System der Fibrinolyse, welches den roten Thrombus im Gefäßsystem wieder auflöst, bestehen abgestimmte Gleichgewichte. Geringfügige Störungen dieser Gleichgewichte können zu schwerwiegenden Blutungen oder zur Bildung von Thromben an Orten führen, an denen keine Verletzung vorliegt (siehe auch Thrombose). Medikamentöse Gerinnungshemmung Vor, während und nach Operationen sowie bei Bettlägerigkeit aus anderer Ursache werden häufig vorübergehend gerinnungshemmende, „blutverdünnende“ Medikamente zur Vermeidung von Thrombosen und Lungenembolien eingesetzt. Diese Vorgehensweise wird Thromboseprophylaxe genannt. Häufigster Grund für eine längerfristige therapeutische Antikoagulation ist heutzutage das Vorhofflimmern oder -flattern. Bei dieser Herzrhythmusstörung besteht ein erhöhtes Embolierisiko, das bei vielen Patienten durch die Blutverdünnung gesenkt werden muss. Zweithäufigster Grund sind Thrombosen, meist der Beinvenen. Hier soll die Gerinnungshemmung in der Akutphase die weitere Ausdehnung der Thrombose und später ein Wiederauftreten (Rezidiv) verhindern. Im folgenden werden einige entsprechende Medikamente vorgestellt. Heparin Zur medikamentösen Gerinnungshemmung in vivo können Heparin und Heparinoide eingesetzt werden. Es handelt sich um eine extrem stark negativ geladene Kette aus Zuckern, die sich an das schon erwähnte Protein Antithrombin heftet. Dieser Komplex bindet nun wirksamer die Faktoren Thrombin und Xa, die außer Kraft gesetzt werden: Die Gerinnungskaskade kommt zum Erliegen. Die Wirkung setzt nach intravenöser Gabe sofort ein. Heparin zur medikamentösen Verwendung wird üblicherweise aus tierischen Geweben gewonnen. Cumarin Eine weitere Möglichkeit sind sogenannte Vitamin-K-Antagonisten wie die Cumarinderivate Phenprocoumon (Handelsnamen: Marcumar, Falithrom) und Warfarin. Vitamin K wird zur Synthese der meisten Gerinnungsfaktoren als Coenzym benötigt. Cumarin wirkt in der Leber und verhindert die Reduktion von Vitamin K (Phyllochinon). Dieses wirkt bei der γ-Carboxylierung der Gerinnungsfaktoren (II, VII, IX, X) mit und wird dabei selbst oxidiert (Abgabe von Elektronen). Ohne eine darauffolgende Reduktion (Aufnahme von Elektronen) bleibt Vitamin K funktionslos. Die Wirkung setzt zwar erst nach einer gewissen Zeit ein, dafür kann die Gabe oral erfolgen. Thrombozytenaggregationshemmer Acetylsalicylsäure (Aspirin) kann in die Thrombozytenaggregation, also in die zelluläre Hämostase, eingreifen. Eine Cyclooxygenase (COX), die für die Synthese des Plättchenfaktors Thromboxan A2 benötigt wird, wird irreversibel durch Anheftung eines Essigsäure-Restes gehemmt. Ebenfalls auf die Aggregation der Blutplättchen wirkt Clopidogrel, das eine Hemmung der ADP-abhängigen Thrombozytenaktivierung durch eine irreversible Rezeptor-Blockierung bewirkt. Abciximab ist ein rekombinanter monoklonaler Antikörper, der das Glykoprotein IIb/IIIa der Thrombozyten blockiert und dadurch gleichfalls die Thrombozytenaggregation unterbindet. Denselben Angriffsort hat Tirofiban. Fibrinolytika Fibrinolytika aktivieren Plasminogen und fördern so die Auflösung von Thromben (Thrombolyse). Dies wird zur Therapie von Herzinfarkten, Lungenembolien, Beinvenenthrombosen, peripheren Verschlusskrankheiten und innerhalb eines dreistündigen Zeitfensters auch bei akuten Hirninfarkten genutzt. Während Wirkstoffe wie Streptokinase und Urokinase unspezifisch sowohl auf Fibrinogen als auch auf Fibrin wirken, weisen neuere Stoffe wie Alteplase (recombinant tissue type plasminogen activator, rt-PA) eine Selektivität für vernetztes Fibrin in Thromben auf, was systemische Nebenwirkungen, insbesondere Blutungen, vermindern soll. Die Anwendung der Fibrinolytika unterliegt einer strengen Indikationsstellung. Hemmung in vitro In vitro, z. B. in Blutröhrchen, kommen häufig EDTA und Citrat zum Einsatz, Chelatoren, die einen unlöslichen Komplex mit den zur Gerinnung nötigen Calcium-Kationen bilden. Eine Gerinnungshemmung mit Heparin ist in vitro ebenfalls möglich. Die Auswahl des Gerinnungshemmers erfolgt nach dem Gesichtspunkt, welche Untersuchung später mit dem ungerinnbar gemachten Blut geplant ist. Für Untersuchungen der Gerinnung selbst wird fast ausschließlich Citrat als Gerinnungshemmer verwendet, indem die Blutprobe im Verhältnis 9+1 mit einer 3,8%igen Natriumcitrat-Lösung verdünnt wird. Man verwendet dazu in der Regel industriell vorgefertigte Röhrchen, die bereits 0,3 ml Natriumcitratlösung enthalten und dann mit 2,7 ml Blut aufgefüllt werden. Für die Zuverlässigkeit der daraus erstellten Analysen ist es wichtig, dass dieses Mischungsverhältnis genau eingehalten und die Blutprobe sofort nach Gewinnung sorgfältig mit der Natriumcitrat-Lösung vermischt wird. Medikamentöse Verstärkung der Hämostase Es liegt nahe, die Hämostase auch in umgekehrter Richtung beeinflussen zu wollen und z. B. bei lebensbedrohlichen Blutungen Medikamente zu verabreichen, die zu einer verstärkten Hämostase führen. Die Entwicklung derartiger Medikamente, in der Fachsprache Hämostyptika genannt, war in der Vergangenheit – verglichen mit den die Hämostase hemmenden Medikamenten – von geringerem Erfolg gekrönt. Für die medizinische Behandlung wichtig geworden sind hier vor allem Präparate, die einen angeborenen oder erworbenen Mangel von Gerinnungsfaktoren beheben, z. B. Faktor-VIII-Konzentrat bei Bluterkrankheit (Hämophilie A), Vitamin K und PPSB bei Blutungen unter Cumarintherapie oder gefrorenes Frischplasma bei disseminierter intravasaler Gerinnung. Bei einem ausgeprägten Mangel an Blutplättchen können diese in Form von Thrombozyten-Konzentraten ersetzt werden. Die Wirkung von Heparin kann durch Protamin aufgehoben werden. Weiterhin kann die Hämostase verstärkt werden, indem der natürliche Gegenspieler der Gerinnung, die Fibrinolyse, gehemmt wird. Medikamente mit diesem Wirkmechanismus werden Antifibrinolytika genannt. Als Wirkstoffe kommen Tranexamsäure, Para-Aminomethylbenzoesäure und Aminokapronsäure zur Anwendung, das früher häufig verwendete Aprotinin wurde im November 2007 wegen erhöhter Sterblichkeit bei der Behandlung vom Markt genommen.[11] Gerinnungsuntersuchungen Blutplasma nach Zugabe von Thromboplastin (Quick-Test). Das entstandene Gel ist stark genug, um eine Stahlkugel zu halten. Zur Messung der Gerinnungsfähigkeit des Blutes dienen in der labormedizinischen Diagnostik der Quick-Wert zur selektiven Funktionsbestimmung des exogenen Systems durch Zugabe von Tissue-Faktor und Ca2+ zur Blutprobe und anschließender Bestimmung der Gerinnungszeit im Vergleich zu Normalblut, beispielsweise bei einer Cumarintherapie, sowie die daraus abgeleitete INR (International Normalized Ratio), die den Quick-Test zunehmend ersetzt. Die INR bietet eine bessere Vergleichbarkeit zwischen verschiedenen Laboratorien als der QuickWert. Allerdings sind beide Werte bei einer Hämophilie normal. die PTT (Partial Thromboplastine Time) zur selektiven Funktionsbestimmung des endogenen Systems und des gemeinsamen Weges der Blutgerinnung.[12] Dieser Wert liegt bei einer Hämophilie über dem Standardwert von ca. 30 Sekunden. Diese Untersuchungen werden als Globalteste der Gerinnung bezeichnet. Sie können nur eine reduzierte Gerinnung (Blutungsrisiko) erkennen und zur Überwachung einer Behandlung mit gerinnungshemmenden Medikamenten wie beispielsweise Marcumar dienen, nicht jedoch ein Zuviel (Thrombophilie). Weitere, seltener eingesetzte Tests zur Messung der Gerinnungsfähigkeit des Blutes sind Thrombinzeit und die funktionelle Fibrinogenbestimmung nach Clauss. Der Aktivierungszustand des Gerinnungssystem im gesamten Körper kann durch die Messung der D-Dimere (Fibrinspaltprodukte) bestimmt werden. So können bestimmte zum Zeitpunkt der Blutentnahme vorhandene Krankheitszustände, die mit einer Aktivierung der plasmatischen Gerinnung einhergehen, erkannt werden (z. B. Thrombosen, Lungenembolien, disseminierte intravasale Gerinnung und Heparin-induzierte Thrombozytopenie Typ II). Eine Unterscheidung zwischen verschiedenen möglichen Ursachen einer Gerinnungsaktivierung sowie eine zuverlässige Einschätzung eines zukünftigen Risikos (Thrombophilie) ist durch die Bestimmung der D-Dimere nicht möglich. Ein geeigneter Suchtest für die Thrombophilie existiert zur Zeit nicht, vielmehr müssen bei entsprechendem Verdacht alle möglichen Ursachen einzeln ausgeschlossen werden. Eine Beurteilung des Quick-Werts und der PTT im Zusammenhang mit einer Blutungsneigung sollte immer eine eingehende Blutungsanamnese, die Zahl und ggf. auch die Funktion der Blutplättchen (Thrombozyten) mit einbeziehen. Die zelluläre Hämostase ist dabei wesentlich schwieriger einzuschätzen als die plasmatische. Einfach und zuverlässig bestimmbar ist nur die Zahl der Blutplättchen, nicht aber deren Funktion. Die für diesen Zweck vorgesehenen Tests sind entweder unzuverlässig (Blutungszeit) oder aufwändig und daher nicht überall verfügbar (Thrombelastogramm, Platelet Function Analyzer). Vor Operationen wird auch bei Patienten, die keine blutverdünnenden Medikamente einnehmen, häufig eine grobe Einschätzung der Gerinnungssituation anhand dieser drei Parameter (Quick, PTT und Thrombozytenzahl) vorgenommen, um nichtmedikamentös bedingte Hämostasestörungen festzustellen. Diese Praxis ist mittlerweile in Expertenkreisen umstritten, da hier nur rund 13% der Hämostasestörungen erkannt werden[13] und bei Ärzten ein Gefühl falscher Sicherheit erzeugt wird. Die epidemiologisch betrachtet häufigsten Gerinnungsstörungen, die die Thrombozytenfunktion bzw. den Von-Willebrand-Faktor betreffen, werden durch die drei Standardtests nicht erfasst, so dass die Durchführung nur noch bei positiver Blutungsanamnese empfohlen wird.[14][15] Andere Autoren halten dies wiederum für fahrlässig und empfehlen auch bei negativer Blutungsanamnese die routinemäßige präoperative Bestimmung von Thrombozytenzahl, aktivierter partieller Thromboplastinzeit (aPTT), Quick-Wert und Fibrinogen[16], so dass weitere Studien hierzu nötig erscheinen. Arterielles Blut gerinnt schneller als venöses, was auf die Differenzen im Gasgehalt zurückzuführen ist. Die Gerinnung arteriellen Bluts kann durch Zuführung von Kohlensäure verlangsamt, die des Venenbluts aber durch Vermehrung seines Sauerstoffgehalts beschleunigt werden. Die Verschiedenheiten in der Temperatur der beiden Blutarten sind viel weniger regelmäßig, denn während in Organen mit sehr lebhaftem Stoffwechsel (etwa Drüsen und Muskeln) das abfließende Blut wärmer ist als das eintretende, zeigen Organe mit nur unbedeutenden Wärmebildungsvermögen (beispielsweise die äußere Haut) ein umgekehrtes Verhalten. Thrombophilie Es gibt eine Vielzahl an angeborenen und erworbenen Krankheiten, bei denen eine erhöhte Gerinnungsneigung besteht. Alle haben gemeinsam, dass es vermehrt zu Gefäßverschlüssen wie Thrombosen und Embolien kommt. Bei manchen Erkrankungen ist das Hochdrucksystem der Schlagadern (Arterien) stärker betroffen, bei anderen das Niederdrucksystem der Venen. Die häufigsten und wichtigsten Thrombophilien sind: Faktor-V-Leiden (zu > 90 % Ursache der APC-Resistenz) Prothrombinmutation G20210A Antiphospholipid-Syndrom Mangel an Inhibitoren der Gerinnung, insbesondere Protein C, Protein S und Antithrombin (auch veraltet Antithrombin III genannt) erhöhtes Homocystein erhöhter Gerinnungsfaktor VIII. Eine Sonderform der Thrombophilie kann im Rahmen der Behandlung mit dem gerinnungshemmenden Medikament Heparin auftreten. Durch dieses Medikament werden in einigen Fällen paradoxerweise die Blutplättchen aktiviert, so dass diese verklumpen und die Gerinnungskaskade in Gang setzen. Dies kann zu schweren Thrombosen im gesamten Körper führen. Messbar ist dabei der Abfall der Zahl der Blutplättchen, daher wird das Krankheitsbild als Heparin-induzierte Thrombozytopenie (Typ II) bezeichnet.