doc
Werbung

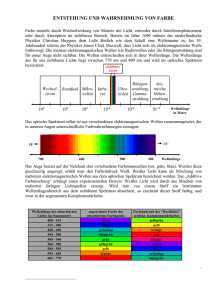
Philipps-Universität Marburg Fachbereich Chemie Veranstaltung: Übungen im Experimentalvortrag WS 2007/08 Protokoll zum Experimentalvortrag Textilfärberei vom 29.11.2007 vorgelegt von Franziska Behrmann Zwischenhausen 5 35037 Marburg Hinweis: Dieses Protokoll stammt von der Seite www.chids.de (Chemie in der Schule). Dort können unterschiedliche Materialien für den Schulunterricht heruntergeladen werden, unter anderem hunderte von Experimentalvorträgen so wie der vorliegende: http://www.chids.de/veranstaltungen/uebungen_experimentalvortrag.html Inhaltsverzeichnis: 1. Einleitung S. 03 2. Geschichte der Textilfärberei S. 03 3. Textilfarbstoffe und Färbeverfahren S. 05 3.1. Küpenfärbung S. 09 3.2. Direktfärbung S. 14 3.3. Entwicklungsfärbung S. 16 3.4. Reaktivfärbung S. 19 3.5. Transferdruck S. 23 4. Waschen S. 24 5. Schulrelevanz S. 26 6. Literatur S. 26 2 1. Einleitung: Die Textilfärberei ist eines der Themen, die die Menschen schon seit langer Zeit interessieren und welches noch heute von enormer Bedeutung für das alltägliche Leben ist. Dieser Vortrag soll einen Einblick in die geschichtliche Entwicklung der Textilfärberei geben und zudem verschiedene Färbeverfahren explizit vorstellen. 2. Geschichte der Textilfärberei: Schon sehr früh gab es bei den Menschen den Wunsch, dass die Kleidung neben Schutz auch Farben besitzt. So wird vermutet, dass Beobachtungen, dass Früchte, Beeren, Wurzeln und ähnliches bleibende Flecken auf Fasern und Gewebe hinterlassen, zur Erforschung der Textilfärberei führten. Zunächst war es jedoch nur möglich, zum Färben Pflanzen- und Tierextrakte zu verwenden. Die Entwicklung der Textilfärberei bis heute sei in der folgenden Übersicht gezeigt. 3000 Färbung von Textilien und Leder mit Pflanzen- und Tierextrakten in v. Chr. Ägypten (z.B. Indigo = blau, Safran = gelb) 1100 v. Chr. Verbreitung der Farbengewinnung im Mittelmeerraum (Karmin (rot) aus Kermesschildläusen, Purpur aus Purpurschnecken, Schellack aus asiatischen Lackschildläusen) 550 farbig bedrucktes Gewebe in Persien ab Anlegung von Rezeptsammlungen (Vorschriften zur Herstellung und 8. Jh. Anwendungen von Farbstoffen) 1400 1600 1771 1828 ab 1827 Entdeckung neuer Rohstoffe für Farbgewinnung Pikrinsäure als erster synthetischer Farbstoff Patent auf die Abscheidung eines roten Farbstoffes aus Krappwurzeln = Alizarin Industrielle Verfahren zur Gewinnung von Naturfarbstoffen aus Naturprodukten = Extraktion Entstehung der ersten Extraktionsfabriken für Farbstoffe ( MERCK in Darmstadt, RIEDEL in Berlin, GEIGY in Basel) 1834 Anilin aus Schwarzkohleteer 1856 Entdeckung des leuchtend violetten Farbstoffes Mauvein aus Teer 3 1859 Entdeckung der färbenden Wirkung von Diazoverbindungen (ab 1861 industrielle Herstellung) 1863 Gründung der Farbwerke Hoechst bei Frankfurt 1864 Synthese des ersten Nitrofarbstoffs 6. April Gründung der Aktiengesellschaft „Badische Anilin- und Soda-Fabrik“ 1865 (BASF) in Mannheim 1870 Technische Synthese von Krapprot oder Alizarin 1871 Entdeckung des Fluoresceins (BAEYER) 1877 Erstes deutsches Farbstoff-Patent (Methylenblau) 1880 BAEYER erhält das erste Patent zur Herstellung von Indigo 1901 1925 1950 BASF entdeckt neuen blauen Farbstoff Indanthren-Blau, der Indigo in Wasch- und Lichtechtheit übertrifft Erste Rapidecht-Entwicklungsfarben für Textildruck Erste Oniumfarbstoffe (Entwicklungsfarbstoffe), die direkt auf der Faser erzeugt werden können 1954 Einsatz der ersten Reaktivfarbstoffe 1960 Entwicklung neuer Farbstoffe für vollsynthetische Fasern 1966 Cottestren-Farbstoffe für Mischgewebe aus Baumwolle und Polyester Heute Etwa 7000 Farbstoffe bekannt (für spezielle Einsatzzwecke abgestimmt) 545000 t Textilfarbstoffe zum Färben von Fasern verbraucht, 1990 2/3 davon allein für Baumwolle lediglich 46000 t Farbstoffe zum Färben von Papier 4 3. Textilfarbstoffe und Färbeverfahren: Um über Textilfarbstoffe reden zu können braucht man jedoch zunächst eine Definition: Ganz allgemein kann alles, was dem menschlichen Auge farbig erscheint, zu den Farbstoffen gezählt werden. Genauer betrachtet können die Farbstoffe als eine Sammelbezeichnung für in einem Anwendungsmedium lösliche Farbmittel, die sich mit den zu färbenden Stoffen verbinden, aufgefasst werden. Dabei handelt es sich bei den Farbstoffen meist um organische Substanzen Im Gegensatz dazu stehen die Pigmente. Sie sind unlösliche anorganische oder organische Substanzen und den Farbstoffen an Strukturvielfalt, Anzahl und Leuchtkraft, jedoch nicht absatzmäßig unterlegen. Es sind heutzutage beispielsweise über 7000 Farbstoffe, jedoch nur etwa 100 Pigmente bekannt. Zusätzlich unterscheidet man die Farbstoffe nach ihrer Herkunft in synthetische oder natürliche Farbstoffe. Doch wie kommt die Farbe überhaupt zustande? Dazu gibt es eine Theorie der Farbe und Konstitution. Farbigkeit entsteht zunächst durch Absorption von Licht einer bestimmten Wellenlänge. Das restliche Licht wird reflektiert, wobei nun der absorbierte Anteil fehlt, so dass das menschliche Auge die Komplementärfarbe wahrnimmt. Zudem überträgt das absorbierte Licht Energie auf das Molekül ( E h ). Dadurch kommt es zur Anregung von Elektronen. Elektronen aus Bindungen anzuregen benötig sehr viel Energie, wohin gegen die Anregung von Elektronen aus -Bindungen leichter ist. Farbigkeit ist demzufolge eine Anregung von -Elektronen aus dem HOMO in das LUMO. Benötigt werden dafür konjugierte Doppelbindungen im Molekül. Je ausgedehnter das -Elektronensystem ist, also je mehr Doppelbindungen in Konjugation zueinander stehen, desto geringer sind die HOMO-LUMO-Abstände und desto leichter können die Elektronen angeregt werden (s. Bild 1: Vergleich zwischen Ethylen und Butadien). 5 Butadien Ethylen * * LUMO HOMO * * Bild 1: geringerer HOMO – LUMO- Abstand bei ausgedehnterem -System Zudem bestimmt der HOMO-LUMO-Abstand die längerwellige Absorption, das heißt je geringer die HOMO-LUMO-Abstand sind, desto längerwellig ist das absorbierte Licht. Dadurch wird eine Verschiebung der Wellenlängen in den für das menschliche Auge sichtbaren Bereich erzielt, so dass Farbe wahrnehmbar wird (bathochromer Effekt). Heutzutage sind über 7000 Farbstoffe bekannt. Um diese einzuteilen gibt es verschiedene Möglichkeiten. a) Chemiker nehmen eine Einteilung der Farbstoffe nach rein chemischen Aspekten vor. Dabei achten sie auf chromophoren, also farbgebenden, Gruppen und nehmen keine Rücksicht auf den Verwendungszweck. z.B.: Azo-, Anthrachinon-, Cyaninfarbstoffe, etc. b) In der Färbepraxis werden Farbstoffe hingegen nach ihrem Verhalten gegenüber der Faser eingeteilt, ohne auf die Konstitution zu achten. z.B.: Direkt-, Dispersions-, Entwicklungsfarbstoffe, etc. c) Der Colour-Index gibt in einer fünfstelligen Zahl und / oder einer Buchstabenfolge ebenfalls Informationen über Konstitution, Namen oder Trivialnamen von Farbstoffen wieder. d) Im Vertrieb können Farbstoffe nach ihren Handelnamen eingeteilt werden. Dieser Vortrag wird sich im Folgenden an der Einteilung, die in der Färbepraxis gängig ist, orientieren. 6 Dabei gibt es verschiedene Färbetechniken, für die sich unterschiedliche Farbstoffe eignen. a) Färbebad: unter anderem geeignet für Küpen-, Entwicklungs- und Reaktivfarbstoffe. b) Auftrag: geeignet für Dispersions- und Pigmentfarbstoffe. c) Direkte Einfärbung: einzig für substantive Farbstoffe geeignet. Jedoch sind nicht alle Farbstoffe und Färbetechniken für jede Faserart geeignet. Um dies zu verdeutlichen folgt Versuch 1: Xanthoproteinreaktion Geräte: 2 Demoreagenzgläser Glasstab Pinzette Baumwolle Wolle Chemikalien: Konz. Salpetersäure Durchführung: In das erste Demoreagenzglas gibt man eine Probe des Baumwollstoffs und in das zweite Reagenzglas ein Stück der Wolle. Anschließend werden beide Proben jeweils mit 50 mL konzentrierter Salpetersäure übergossen. Beobachtung: Während bei der Wolle eine Gelbfärbung eintritt bleibt der Baumwollstoff unverändert. 7 Auswertung: Es werden zunächst die in diesem Vortrag verwendeten Fasern Wolle, Baumwolle und Polyester betrachtet. 1) Baumwolle: Baumwolle ist eine Cellulosefaser oder genauer ein Polysaccharid. Diese ist aus ß-D-Glucosemolekülen aufgebaut, welche durch 1, 4 – Verknüpfungen zu faserförmigen Makromolekülen verbunden sind. HO O O OH HO O O OH HO OH Bild 2: Ausschnitt aus einer Cellulosefaser 2) Polyester: Bei Polyester handelt es sich um durch Polykondensation mehrbasiger Säuren mit mehrwertigen Alkoholen hergestellte makromolekulare Stoffe mit der Gruppe –O-CO-. O O O R1 R2 O n Bild 3: Ausschnitt einer Polyesterfaser wobei z.B.: R 1= -CH2-CH2- oder R2= -C6H4- 3) Wolle: Wolle ist ein Polypeptid mit folgendem Aufbau (s. Bild 3), wobei es sich bei den Resten um jeweils unterschiedliche Aminosäurereste handelt. O ... R O NH NH O R O NH NH R O ... R Bild 4: Ausschnitt einer Wollfaser Bei der Xanthoproteinreaktion handelt es sich nun um eine Proteinnachweisreaktion, das heißt es ist eine Nachweisreaktion für aromatische Reste. Wie oben gezeigt besitzt Baumwolle keine aromatischen Reste, so dass keine Reaktion mit dieser Faser stattfindet. 8 Bei der Wolle jedoch sind 3 aromatische Aminosäurereste bekannt, so dass die Nachweisreaktion in diesem Fall positiv ausfällt. NH OH Phenylalanin Tryptophan Tyrosin Bild 5: Die drei bekannten aromatischen Aminosäurereste Der Mechanismus der Xanthoproteinreaktion soll im Folgenden am Beispiel von Tyrosin erklärt werden, wobei die restliche Cellulosefaser durch R ersetzt sei. OH OH + NO2 + R f arblos OH NO 2 H R NO 2 H R - Komplex + OH OH NO 2 H R R OH NO 2 H NO 2 - H+ R gelb Diese Reaktion ist eine elektrophile aromatische Substitution. Zunächst kommt es zu einem nukleophilen Angriff des Aromaten an das Nitrosylkation, welches in der konzentrierten Salpetersäure enthalten ist. Dadurch kommt es zur Ausbildung des σ – Komplexes, in dem das Kation in vier mesomeren Grenzformeln vorliegen kann. Durch anschließende Deprotonierung kommt es zur Rearomatisierung und zur Ausbildung der gelben Farbe. 9 3.1 Küpenfärbung: Der bekannteste Küpenfarbstoff ist Indigo, welcher jedoch Anfang des 20.Jahrhunderts durch die Indanthrenfarbstoffe in Licht- und Waschechtheit übertroffen wurde. Im Mittelalter gab es eine so genannte Blaulücke, das es nicht möglich war, klare und tiefe Blautöne aus Pflanzen- oder Tierextrakten zu gewinnen. Die einzige Möglichkeit solche Farbtöne zu erzielen war, Lapislazuli-Halbedelsteine aus Übersee zu Pulver zu zermalen. Diese Halbedelsteine waren jedoch sehr teuer und schwer zu beschaffen, so dass kräftige Blautöne eine Exklusivität waren, welche für Madonnenfiguren oder Königsmäntel verwendet wurden. Die Anfänge der Blaufärberei mit Indigo sind auf dem indischen Subkontinent zu verzeichnen, daher stammt auch der Begriff Indigo = „der Indische“. Die Portugiesen brachten das klare tiefe Blau des Indigos schließlich nach Europa. Zu dieser Zeit war das Blau ein sehr kostbares Handelsgut und sogar wertvoller als Gold. Gewonnen werden kann Indigo dabei aus verschiedenen Pflanzen, in denen eine Vorstufe des Indigos enthalten ist. Zum einen gibt es die Indigopflanze, welche in tropischen – subtropischen Gebieten wächst und zum anderen den Färberwaid, der auch in gemäßigten Zonen wie Deutschland wächst. Jedoch ist der Farbstoffgehalt in der Indigopflanze ungefähr 30-mal höher als in der Färberwaidpflanze. So war der indische Indigo noch immer billiger als der Indigo, der aus dem heimischen Färberwaid gewonnen wurde, und es kam zum Ende des 18. Jahrhunderts zur vollkommenen Verdrängung des Waidbaus durch den Kolonial-Indigo. Die Geschichte der Synthese beginnt im Jahre 1870 mit einem Wettstreit um die erste Indigosynthese, da Indigo zu dieser Zeit sogar wertvoller als Gold war. Adolf Baeyer gelang 1878 als erster die Indigosynthese. Jedoch war zu diesem Zeitpunkt die Indigoformel noch nicht einmal entschlüsselt. Diese wurde erst 1883 aufgeklärt. Zwischen 1880 und 1883 gab es zwei Verfahren von Adolf Baeyer zur Synthese von Indigo, zum einen auf Basis von Zimtsäure und zum anderen mit ortho-Nitrobenzaldehyd. Jedoch waren beide Verfahren zu unwirtschaftlich, da zum Beispiel der Ausgangsstoff für ortho-Nitrobenzaldehyd Toluol ist und davon lediglich 5000 – 6000 Tonnen pro Jahr zu Verfügung standen, aber bereits 4 Tonnen Toluol für 1 Tonne Indigo benötigt wurde. 10 Im Jahre 1890 fand Karl Heumann heraus, dass beim Verschmelzen von Phenylglycin oder auch Phenylglycin-ortho-carbonsäure mit festem Kaliumhydroxid ebenfalls Indigo entsteht. BASF erwarb beide Patente und konnte diese Verfahren sehr schnell umsetzten, da alle Ausgangsstoffe von ihnen selbst produziert wurden. Jedoch stellte sich bald heraus, dass das Verfahren mit Phenylglycin lediglich eine Indigoausbeute von 10 % ergab. So konnte am 10. Juli 1897 nach über 17 Jahren Forschungs- und Entwicklungsarbeit das erste synthetisch hergestellte Indigo auf dem Markt käuflich erworben werden. Das synthetische Indigo kostete bei der Markteinführung 16 Mark / kg, das raffinierte Indigo hingegen 20 Mark / kg. BASF hatte bis zu diesem Zeitpunkt bereits 18 Millionen Goldmark, mehr als das gesamte Grundkapital, in die Erforschung von Indigo investiert, jedoch nach bereits fünf Jahren wurden 30 % des BASF-Gesamtumsatzes durch die Indigofabriken erwirtschaftet. Kurz darauf fand Johannis Pfleger eine entscheidende Verbesserung des Heumann-Verfahrens, indem er durch Einsatz von Natriumamid als Kondensationsmittel den Ringschluss zum Indoxyl ermöglichte und somit eine höhere Ausbeute ermöglichte. Dieses Verfahren nach Heumann und Pfleger wird noch heute verwendet und die Weltjahresproduktion liegt bei 17000 Tonnen. Davon werden 40 % bei BASF hergestellt und 99 % der gesamten Indigoproduktion gehen in die Jeansindustrie. Versuch 2: Indigosynthese nach Baeyer Geräte: 50 mL Erlenmeierkolben Messpipette Glasstab Chemikalien: Ortho-NItrobenzaldehyd Aceton Dest. Wasser Natronlauge (w = 10 %) 11 Ethanol Diethylether Durchführung: In dem Erlenmeierkolben werden zunächst 1 g ortho-Nitrobenzaldehyd in 3 mL Aceton gelöst und anschließend unter Umschwenken 3 mL ention. Wasser zugegeben. Unter ständigem Umrühren mit dem Glasstab werden tropfenweise 4 mL Natronlauge zugegeben. Die entstehenden Kristalle werden abfiltriert und mit Ethanol und Diethylether gewaschen. Beobachtung: Die zunächst grüne Lösung wird dunkelblau – violett, erwärmt sich kräftig und es fallen violette Kristalle aus. Auswertung: O O OH O O O + H H3C CH3 CH3 + O N O O + O + N - O O H H O N - O O - H O O CH3 + HO O - O - O CH3 - H2O N CH3 OH N CH3 O N O OH N + O- CH3 H N 2 N N H O Zunächst reagiert das ortho-Nitrobenzaldehyd in einer Aldolreaktion mit dem Aceton und nach einer intramolekularen Redox-Reaktion wird das orthoNitrophenylmilchsäureketon gebildet. Nach zweimaliger Wasserabspaltung kommt es anschließend zu einem Ringschluss. Unter Einfluss von Hydroxidionen wird Acetat abgespalten und es entsteht Indoxyl, welches zum gewünschten Produkt Indigo dimerisiert. 12 Wie die Färbung mit Indigo anschließend durchgeführt werden kann, zeigt der nächste Versuch. Versuch 3: Küpenfärbung mit Indigo Geräte: Porzellanmörser Pipette Messpipette 600 mL Becherglas Magnetrührer mit Thermofühler und Rührfisch Chemikalien: Indigo Ethanol Natronlauge (c = 2 mol / L) Ention. Wasser Natriumdithionit Baumwolle Durchführung: 0,3 g Indigo werden im Porzellanmörser mit etwas Ethanol verrieben und anschließend 10 mL Natronlauge zugegeben. Diese Suspension wir in ein Becherglas mit 100 mL 70 ° C warmen ention. Wasser gegeben. Zusätzlich werden 2 g Natriumdithionit zugefügt. Die Stoffprobe wird kurze Zeit in der gelbgrünen Lösung getränkt und anschließend unter fließendem Wasser gewaschen. Beobachtung: Nach kurzer Zeit fängt der Farbstoff an, sich zu lösen und die zuvor blaue Lösung färbt sich gelb – grün. Die so genannte Indigoküpe ist entstanden. Taucht man die Baumwollstoff in diese Lösung, so verfärbt er sich zunächst ähnlich gelb – grün, jedoch beim Waschen unter fließendem Wasser nimmt der Stoff zunehmend die typische blaue Farbe des Indigos an. 13 Auswertung: Reduktion O +2 N H - O Na+ Na2S2O4 H N 0 +2 O N H O2 Indigo: Oxidation H N 0 - + O Na Leuko - Indigo: blau, unlöslich in Wasser grün-gelb, löslich in Wasser Bei der Küpenfärbung mit Indigo tritt das Problem auf, dass Indigo selbst wasserunlöslich ist und somit nicht auf die Faser im Färbebad aufgezogen werden kann. Daher muss eine wasserlösliche Form des Indigos, das so genannte Leuko-Indigo, erreicht werden. Dies geschieht durch Reduktion mit Natriumdithionit. Die Leuko-Form hat eine gelbe – grüne Farbe und kann im Färbebad auf die Faser aufziehen. In der Faser wird der Farbstoff durch starke van-der-Waals-Kräfte gebunden und durch den Luftsauerstoff schließlich wieder zum blaugefärbten Indigo zurück oxidiert. Dieser Farbstoff ist schließlich sehr wasch- und lichtecht, jedoch nicht sonderlich reibecht. farblose Faser gefärbte Faser Oxidation Reduktion Indigo Leuko - Indigo Indigo Bild 6: Schematische Darstellung der Küpenfärbung 14 3.2 Direktfärbung: Ein weiteres Färbeverfahren ist die direkte Einfärbung, die in der nächsten Demonstration näher betrachtet werden soll. Demonstration 1: Direktfärbung mit Kongorot Geräte: 600 mL Becherglas Magnetrührer mit Rührfisch und Thermofühler Baumwolle Wolle Polyester Chemikalien: Kongorot Natriumchlorid Natriumcarbonat Durchführung: In 100 mL 60 ° C warmen Wasser 0,25 g Kongorot lösen. Anschließend 15 g Natriumchlorid und 0,5 g Natriumcarbonat zugeben. Die Fasern in die Lösung geben, die Lösung zum Kochen erhitzen und die Fasern 30 Minuten drin belassen. Danach die Fasern unter fließendem Wasser abwaschen. Beobachtung: Die Baumwoll- und Wollefasern werden tiefrot gefärbt, wohingegen die Polyesterfaser nur blassrot wird. 15 Auswertung: Kongorot ist der erste substantive Azofarbstoff, der technisch von Bedeutung war. Heute wird er jedoch als Abkömmling des Benzidins als krebserregend eingestuft und daher nicht mehr verwendet. Kongorot ist ein koplanarer Farbstoff, das bedeutet alle vier aromatischen Systeme liegen in einer Ebene. Dadurch kann eine sehr große gegenseitige Anziehung zwischen den Farbstoffmolekülen entstehen, so dass der Farbstoff sehr gut für dieses Färbeverfahren geeignet ist. + Na + SO 3 Na O 3S N N N N NH2 H2N Bild 7: Kongorot Im Färbebad ist ein direktes Aufziehen des Farbstoffs ohne Vorbehandlung der Faser möglich, da der Farbstoff in der Lösung in kolloidaler Form vorliegt. Dabei lagern sich die Farbstoffmoleküle in den intermicellaren Räumen der Faser ein und bilden dort so genannte Farbstoffassoziate, eine Zusammenlagerung mehrere Farbstoffmoleküle zu größeren Molekülen. Jedoch ist der Farbstoff nur durch schwache van-der-Waals-Kräfte in der Faser gebunden, so dass „freies“ Wasser die Assoziate aufheben kann und der Farbstoff relativ leicht aus der Faser gewaschen werden kann. Aufgrund dieser geringen Waschechtheit ist das Verfahren der Direktfärbung in der Industrie rückläufig. farblose Faser eingefärbte Faser Aufziehen Kongorot Bild 8: Schematische Darstellung der Direktfärbung 16 3.3 Entwicklungsfärbung: Ein weiters Färbeverfahren ist die Entwicklungsfärbung, welche im nächsten Versuch näher betrachtet werden soll. Versuch 4: Entwicklungsfärbung Geräte: Messzylinder 2 Bechergläser 250 mL Eisbad Magnetrührer mit Rührfisch Baumwolle Wolle Polyester Chemikalien: ß-Naphthol Ethanol Natronlauge (c = 2 mol/L) Sulfanilsäure Natriumnitrit Salzsäure (c = 2 mol/L) Ention. Wasser Durchführung: In dem ersten Becherglas wird eine Spatelspitze ß-Naphthol in 10 mL Ethanol gelöst. Es werden 40 mL ention. Wasser und 10 mL Natronlauge zugefügt. In dem zweiten Becherglas wird zunächst eine Spatelspitze Sulfanilsäure in 10 mL Natronlauge gelöst. Zu dieser Lösung gibt man 1 Spatelspitze Natriumnitrit, welches zuvor in 20 mL ention. Wasser gelöst wurde. Diese Lösung ist anschließend auf unter 5 ° C zu kühlen. Ohne Überschreitung dieser Temperatur werden langsam 20 mL Salzsäure zugefügt. 17 Alle Stoffproben sind nun gleichzeitig zunächst in das erste Becherglas und danach in das zweite Becherglas zu geben und anschließend unter fließendem Wasser zu waschen. Beobachtung: Aus den zuvor farblosen Lösungen entsteht nach Eintauchen der Stoffproben eine orange Farbe im zweiten Becherglas, welche die Baumwoll- und Wollfaser gut färbt, jedoch für die Polyesterfaser ungeeignet ist. Auswertung: Die Entwicklungsfärbung umfasst zunächst alle Verfahren, bei denen Farbstoffe entstehen. In der Literatur wird jedoch häufig nur die Zweikomponentenfärbung in diesem Zusammenhang erwähnt. Dabei wird durch Reaktion von zwei verschiedenen Komponenten ein Farbstoff auf der Faser erzeugt, häufig handelt es sich dabei um Erkupplung von Azofarbstoffen. Der neu gebildete Farbstoff wird dabei durch Adsorption auf der Faser gebunden und somit entsteht eine hohe Wasch- und Lichtechtheit. In diesem Versuch wird die Faser zunächst in dem ersten Becherglas mit der Kupplungskomponente ß-Naphthol getränkt. HO Bild 9: ß-Naphthol In dem zweiten Becherglas wird zunächst ein Nitrosylkation gebildet. HCl N - O O Na + -NaCl O N H+ OH O N O + H H N O O + H N + O N + O + H2O H Dabei wird das Natriumnitrit durch Säurezugabe zweimal protoniert und nach anschließender Wasserabspaltung entsteht das Nitrosylkation, welches in zwei mesomeren Grenzformeln vorliegt. 18 Gibt man nun Sulfanilsäure in die Lösung mit dem Nitrosylkation, so kommt es zu einem nukleophilen Angriff. Anschließend finden zunächst eine Deprotonierung und danach ein Protonentransfer satt, so dass nach erneuter Protonierung und anschließender Wasserabspaltung das Diazoniumkation entsteht. Dieses liegt wiederum in zwei mesomeren Grenzformeln vor. H H HO 3S + N N + O + HO 3S N H N O H -H+ HO 3S N HO 3S N N N O H + H+ HO 3S N - H+ - H2O H N + O OH + HO 3S N N + H2O H + HO 3S N N HO 3S N + N Trifft die mit der Kupplungskomponente ß-Naphthol getränkte Faser in diese Lösung, so kommt es nach dem Mechanismus einer elektrophilen aromatischen Substitution am aktivierten Aromaten zu einer Azokupplung und der orange Azofarbstoff wird direkt auf der Faser erzeugt. HO HO N HO 3S HO 3S + N N + N H HO HO 3S - H+ N N 19 3.4 Reaktivfärbung: Ein weiteres Färbeverfahren, die Reaktivfärbung, wird im nächsten Versuch erläutert. Versuch 5: Reaktivfärbung Geräte: 2 600 mL Bechergläser 2 Magnetrührer mit Thermofühler und Rührfischen Pipette Glasstab Baumwolle Polyester Chemikalien: LEVAFIX Brillantblau Eisessig Natriumchlorid Natriumcarbonat Durchführung: Es werden jeweils 0,5 g LEVAFIX Brillantblau in 100 mL Wasser bei Raumtemperatur gelöst. 1. Becherglas: Zu dem gelösten Farbstoff werden 4 - 5 Tropfen Eisessig (pH = 4 – 5), die Faserproben und 5 g Natriumchlorid gegeben. Unter gelegentlichem Rühren wird die Lösung 10 Minuten bei Raumtemperatur stehen gelassen. Danach wird die Lösung auf 40 – 50 ° C gewärmt und erneut 20 Minuten stehen gelassen. 2. Becherglas: Zu der Farbstofflösung werden die Stoffproben und 5 g Natriumchlorid gegeben und das Ganze unter gelegentlichem Umrühren 10 Minuten bei Raumtemperatur stehen gelassen. 20 Anschließend werden 2 g Natriumcarbonat (pH = 6 – 7) zugegeben, die Lösung auf 40 – 50 ° C erhitzt und erneut 20 Minuten stehen gelassen. Danach werden die Stoffproben jeweils unter fließendem kaltem Wasser gewaschen und danach kurz in kochendem Wasser aufgekocht, bevor sie erneut unter fließendem Wasser gewaschen werden. Beobachtung: Die Baumwollfaser wird in dem ersten Becherglas, in dem die saure Lösung enthalten ist, hellblau gefärbt, in dem zweiten Becherglas, welches eine alkalische Lösung enthält, wird die Faser hingegen tiefblau gefärbt. In beiden Fällen jedoch ist das Färbeverfahren für Polyester ungeeignet. Auswertung: Reaktivfarbstoffe sind nach folgendem Prinzip aufgebaut: hydrophile Brückenglied/ Chromophor Elektrophil Abgangsgruppe direkte Bindung Gruppe farbgebende Komponente Reaktivkomponente Bei dem hier verwendeten LEVAFIX Farbstoff gilt: Hydrophile Gruppe = Sulfonsäuregruppe Chromophor = Anthrachinongerüst Brückenglied = aromatisches Amin Reaktivgruppe = Schwefelsäureester O NH2 SO 3H O HN O HO S O O S O O Bild 10: LEVAFIX Brillantblau 21 Es genügt für den Reaktionsmechanismus die Reaktivkomponente zu betrachten (restlicher Farbstoff wird mit F abgekürzt). F H F + OH OH O S O - S S O - HSO4 O O S O CH2 + H CH2 O F HO F O - O O S H OH H O H H O H O OH O H OH H H H OH Im basischen Milieu kommt es zuerst zu einer Eliminierung von Hydrogensulfat, so dass das Vinylsulfon gebildet wird. Dieses ist der Reaktivanker des Farbstoffs und reagiert im nächsten Schritt in einer Additionsreaktion unter Ausbildung eine Etherbrücke mit der Cellulosefaser. In dieser Ausbildung einer kovalenten Bindung zwischen dem Farbstoff und der Faser besteht zudem der Unterschied zu den zuvor vorgestellten Färbeverfahren. O NH2 SO3H Farbstoff O HN HO O OO HO OH S OO O O H OH OH OO HO OH OH OH OH H OO Cellulosefaser O OH Bild 11: Prinzip der Reaktivfärbung Damit es zu einer solchen Reaktion kommen kann, benötigen die Fasern reaktive Gruppen. Somit ist es notwendig die unterschiedlichen Fasern auf ihre Tauglichkeit hin zu betrachten. Baumwolle besitzt primäre und sekundäre Alkoholgruppen. Jedoch sind die primären Alkoholgruppen reaktiver, so dass dies die reaktiven Stellen der Baumwolle sind. 22 Wolle besitzt ebenfalls sekundäre und primäre Alkoholgruppen und zudem noch Amingruppen, welche die reaktiven Stellen der Wollfaser darstellen. Polyester jedoch besitzt keine reaktiven Gruppen, so dass es zu keiner Färbung kommen kann. HO OH OH OH NH OO OH OH HO O OO NH O O O NH NH NH2 , OH CH3 O O R1 R2 O n , Bild 12: Reaktive Gruppen der Baumwolle, Wolle und des Polyesters Neben den Vinylsulfonen, die wie oben erläutert nach einer Additions-Reaktion mit der Faser reagieren, gibt es noch weitere Reaktivanker. Halogensubstituierte Heterocyclen gehen Substitutionsreaktion mit der Faser ein, wobei Halogenide als Abgangsgruppe abgespalten werden. Cl F F NH S O N CH2 O Bild 13: Vinylsulfon F F N N NH N N Cl Cl F Bild 14: Halogensubstituierte Heterocyclen 23 3.5 Transferdruck: Nachdem die zuvor erwähnten Färbeverfahren jeweils für Polyester ungeeignet waren, soll im Folgenden ein Verfahren für diese Faserart vorgestellt werden. Demonstration 2: Transferdruck Geräte: Bügeleisen Polyester Chemikalien: Edding T-Shirt-Marker Durchführung: Mit den Markern wird eine Polyesterfaser eingefärbt. Anschließend wird eine Hälfte der Faser mit dem Bügeleisen gebügelt und die Faser unter warmem Wasser gewaschen. Beobachtung: Die ungebügelte Hälfte der Faser wird beim Waschen entfärbt, wohingegen die gebügelte Hälfte gefärbt bleibt. Auswertung: Das Verfahren des Transferdrucks ist besonders für Synthetikfasern geeignet. Der Polyester zum Beispiel ist eine hydrophobe Faser ohne jene funktionellen Gruppen, mit denen eine Reaktion mit den obigen Farbstoffen stattfinden würde. In diesem Fall werden kleine unpolare Farbstoffmoleküle verwendet (Pigmentoder Dispersionsfarbstoffe). Diese werden zunächst in einem Farbfilm auf die Faser aufgetragen. Durch Bügeln, also Einwirken von Druck und Hitze, wird Energie übertragen, so dass die Farbstoffmoleküle in die Faser hineinsublimieren und dort gelöst werden. 24 Druck + Wärme Farbfilm farblose Faser eingefärbte Faser Bild 15: Schematische Darstellung des Transferdrucks 4. Waschen: Nachdem nun ausführlich die verschiedenen Verfahren zur Färbung von Textilien eingegangen wurde, so sollte der Aspekt, dass bunte Kleidung doch möglichst lange so frisch und leuchtend bleiben soll, nicht vernachlässigt werden. Demonstration 3: Waschen von Bunt- und Weißwäsche Geräte: Bechergläser Magnetrührer mit Thermofühler und Rührfischen Bunte Stoffproben Weiße Baumwolle Weiße Wolle Chemikalien: Vollwaschmittel Durchführung: In zwei Bechergläsern werden jeweils 2 g Vollwaschmittel in 200 mL Wasser gelöst und jeweils bunte und weiße Stoffproben zugegeben. Das erste Becherglas wird nun auf 95 ° C erhitzt und das zweite Becherglas lediglich auf 40 ° C. Die Lösungen werden anschließend 30 Minuten unter ständigem Rühren bei den entsprechenden Temperaturen belassen. 25 Beobachtung: Im ersten Fall tritt eine deutliche bunte Färbung der Waschflotte auf, zudem sind die zuvor weißen Fasern stark gefärbt und die bunten Fasern haben deutlich an Farbe verloren. Im zweiten Fall tritt ebenfalls eine Verfärbung der Waschflotte, sowie der Kleidungsstücke ein, jedoch in deutlich geringerem Maße. Auswertung: Durch Einwirken von Wärme und Bewegung werden Farbpigmente beim Waschvorgang von den Stoffoberflächen gelöst. Diese gelangen in die Waschflotte und verursachen dort eine Verfärbung. Zudem setzen sich die gelösten Farbpigmente auf anderen Fasern wieder ab, so dass es zum einen zum Ergrauen oder Verfärben von hellen oder weißen Stoffen kommt und zum anderen die Farbbrillanz der zuvor bunten Stoffe verloren geht. Daher ist es notwendig, dass Weiß- und Buntwäsche vor dem Waschgang getrennt wird. Zudem ist es sinnvoll neben umwelttechnischen Aspekten auch aus Rücksicht auf die Farben der Kleidungstücke die Waschtemperatur niedrig zu halten. Bild 16: Schematische Darstellung eines Waschvorgangs 26 5. Schulrelevanz: Obwohl nach dem hessischen G8-Lehrplan im LK 11G.2 der zweite Teil der Kohlenstoffchemie behandelt werden soll, ist das Thema der Textilfarbstoffe dort nur fakultativ erwähnt. Ebenso gibt es in Klassenstufe 12 einen Bereich der angewandten Chemie, doch auch hier muss die Textilfärberei nicht behandelt werden. Diese Tatsache finde ich persönlich sehr schade, da das Thema nicht nur einen hohen Alltagsbezug bietet, sondern durch einfache Anwendung und wunderbar schönen und bunten Ergebnissen die Schüler motivieren wird und ihr Interesse am Chemieunterricht sicher gut wecken könnte. Sicherlich ist nicht zu verachten, dass eine gewisse chemische Vorkenntnis bestehen muss, um die einzelnen Mechanismen verstehen zu können, doch zudem bietet das Thema viel Möglichkeiten bereits bekannte Themen, wie van-der-Waals-Kräfte, Löslichkeiten oder ähnliches, zu wiederholen und mit praktischen Bezügen zu festigen. Und es besteht zusätzlich die Möglichkeit fächer- und themenübergreifend zu arbeiten. So könnten die Bedeutung der Farbstoffe in Geschichte und Wirtschaft oder angrenzende Themen wie Waschmittel in diesem Zusammenhang besprochen und recheriert werden. Leider dauern die einzelnen Versuche relativ lange, so dass sie in einer Einzelstunde nicht und in einer Doppelstunde immer noch schwer zu schaffen sind, wenn man die Versuche und Mechanismen mit den Schülern ordentlich vor- und nachbereiten möchte. Daher denke ich, dass es zwei sehr schöne Alternativen gäbe, indem man entweder einen Lernzirkel oder eine Projektwoche oder –arbeit zu diesem Thema veranstalten würde. Denn es wäre sehr schade, dieses schöne und auch dankbare Thema im Schulunterricht völlig zu vernachlässigen. 6. Literatur: Addendum 2: Unterricht Chemie – Textilien und Kleidung, S. 75 – 95 Karl, Paul: Einfache chemischen Experimente für die Schule, Klett 1993 Chemie in unserer Zeit, 31/1997: Indigo – 100 Jahre industrielle Synthese Ullmanns Enzyklopädie der technischen Chemie, Bd. 22, 1982 Römpp – Chemie Lexikon, Thieme 27