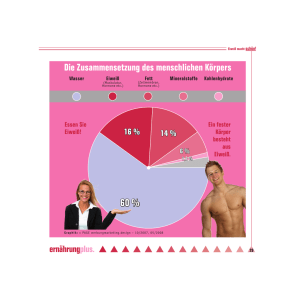
Eiweiß
Werbung

Mag. Adelheid Weidlinger, HLFS Elmberg April 2010 Fragen rund ums Eiweiß… Wie wird Eiweiß gebildet? - Eiweiße bestehen aus Aminosäuren diese bestehen aus Kohlenstoff (C), Wasserstoff (H), Sauerstoff (O) und Stickstoff (N) evtl. Auch Schwefel od. Phosphor! Es wird in Pflanzen (Photosynthese) gebildet. Wie viele Aminosäuren sind für den menschlichen Körper unentbehrlich? Neun Nenne die räumlichen Strukturen von Aminosäuren Primärstruktur Sekundärstruktur Tertiärstruktur Quartärstruktur Beschreibe eine davon Die Quartärstruktur ist die Zusammenfügung mehrerer Tertiärer Eiweißketten. Wie sind die einfachen Proteine unterteilt? In Globuläre und Fibrilläre Proteine. Wozu dienen Glykoproteine und wo kommen sie vor? - Glykoproteine dienen als Gelenksschmiere Sie sind Bestandteil der Schleimhautsekrete, Eiweißstoffe erfülle im Körper wichtige Funktionen als …….. - Enzyme Hormone Transporteiweiß Schutzeiweiß Struktureiweiß Was versteht man unter dem Begriff Denaturierung? Denaturierung ist das Gerinnen von Eiweiß Geronnenes Eiweiß ist leichter verdaulich Wie viel körpereigenes Eiweiß kann aus 100g Sojabohnen gebildet werden, wenn sie Biologische Wertigkeit 72% beträgt? Eiweißgehalt der Sojabohne 37 g. 37g…..100% ?g…….72% 37*72 = 26,64g 100 Welche Arten von Proteinen gibt es? a. Einfache Proteine b. Komplexe Proteine Mag. Adelheid Weidlinger, HLFS Elmberg April 2010 Was versteht man unter biologische Wertigkeit? Sie gibt an wie viel % des Nahrungseiweißes in Körpereiweiß umgebaut werden kann. Entscheidend dabei ist der Gehalt an unentbehrlichen AS. Jene unentbehrliche AS, die in einem LM am wenigsten vorkommt, bestimmt seine biologische Wertigkeit. Sie wird als limitierende AS bezeichnet. Bei der Ernährung ist nicht nur die aufgenommene Menge, sondern auch die Qualität der Eiweißstoffe zu beachten. Am besten kann der Körper nämlich die Eiweißstoffe verwerten, die dem Körpereiweiß am ähnlichsten sind. Nenne 5 einfache Proteine. c. Albumine d. Globuline e. Kollagene f. Actin g. Myosin Wie viele Aminosäuren gibt es und wie viele sind davon unentbehrlich? Es gibt 20 Aminosäuren und 9 davon sind unentbehrlich. Nenne die Unterschiede der Eiweißverbindungen mit der jeweiligen Anzahl an Aminosäuren. Dipeptide mit zwei Aminosäuren Tripeptide mit drei Aminosäuren Polypeptide mit vielen Aminosäuren Proteine mit hunderten bis mehreren tausenden Aminosäuren Erkläre die Eigenschaften und die Vorkommen von Myosin und Actin. Eigenschaften: Notwendig für das Zusammenziehen der Muskeln. Hohe Biologische Wertigkeit. Vorkommen: Im Köper Muskulatur, Fleisch in der Nahrung Was benötigen die Pflanzen zur Eiweißbildung? Einfachzucker aus der Fotosynthese und wasserlösliche Stickstoffverbindungen aus dem Boden. Erkläre ein Fibrilläres und ein Globuläres Protein: Globulär: Kleber: Bestandteile sind Prolamine und Gluteline, sind wasserlöslich und gerinnen bei 70°C und es ermöglicht die Backfähigkeit von Mehl. Es kommt vor in Weizen, Roggen, Hafer und Gerste. Fibrilläres: Elastine: ist unlöslich- unverdaulich und für die Ernährung unbedeutend. Es kommt in Fleisch und Bindegewebe vor. Eiweißstoffe haben eine räumliche Struktur, erkläre diese! (alle 4) Primärstruktur – ergibt sich durch die Reihenfolge der Aminosäuren in der Kette, sind genetisch festgelegt Sekundärstruktur – Aminosäuren Kette ist geformt, meist gefaltet (Faltblatt) oder schraubenförmig (Helix) Tertiärstruktur – knäuelförmige (globuläre) oder faserförmige (fibrilläre) Gebilde Quartärstruktur – Zusammenfügung mehrerer Eiweißketten mit verschiedener Tertiärstruktur Mag. Adelheid Weidlinger, HLFS Elmberg April 2010 Welche Eigenschaften hat Eiweiß? Denaturierung – gerinnen von Eiweiß durch Einwirkung von Hitze, Säuren und Lab wird der Zustand von Eiweiß verändert, nicht mehr Rückgängig zu machen, leicht verdaulich Wasserbindungsvermögen – Eiweißstoffe können Wasser binden, dadurch werden im Wasser gelöste Stoff im Blut weiter transportiert Pufferwirkung – können wegen chemischen Aufbau als Basen & Säuren reagieren, pH Wert des Blutes muss konstant gehalten werden Gib einen Überblick: Küchentechnische Bedeutung von Eiweiß Denaturierung, d.h._________________ Wasserbindungsvermögen, d.h._______________________ Löslichkeit, d.h._____________________ Bräunungsvermögen (Maillard-Reaktion!), d.h._______________________ Verderb, d.h.__________________________ Was sind die Aufgaben vom Eiweißstoffwechsel? Aufbau/Abbau von körpereigenem Eiweiß (in den Zellen und in der Leber) Energiegewinnung (in Niere und Leber) Umbau zu anderen Nährstoffen (in der Leber) Zähle die Komplexen Proteine auf Phosphoproteine, Lipoproteine, Glykoproteine, Chromoproteine, Nukleoproteine, Metallproteine Nenne die Einfachen Proteine Globuläre Proteine: Albumine, Globuline, Klebereiweiß Fibrilläre Proteine: Kollagene, Myosin, Actin, Elastin, Keratine, Fibrinogen Beschreibe den Eiweiß-Bedarf und die Bedarfsdeckung für Erwachsenen 8-10% des täglichen Energiebedarfs soll mit EW gedeckt werden 0,8g EW pro kg Körpergewicht Kinder benötigen etwas mehr EW In Stresssituationen und bei bestimmten Erkrankungen steigt der Bedarf 2/3 sollen durch pflanzliche 1/3 durch tierische LM gedeckt werden Erkläre den Unterschied zwischen Peptiden und Proteine Proteine mit hundert bis mehreren tausend Aminosäuren; Peptide sind kürzer Wie unterscheiden sich komplexe von einfachen Proteinen? Mag. Adelheid Weidlinger, HLFS Elmberg April 2010 Komplexe Proteine enthalten neben dem EW zusätzlich einen anderen Stoff wie z.B Fett, KH = NichtEiweiß-Anteil (prosthetische Gruppe) Zu welcher komplexen Proteingruppe gehört das Hämoglobin? Beschreibe es kurz Zu den Chromoproteinen Ermöglicht Sauerstofftransport im Blut, roter Blutfarbstoff. Welche wichtige Rolle spielt die Hitzegerinnung bei Eiweiß? -Für die Teiglockerung -Abbraten vom Fleisch -Brotherstellung -Blanchieren von Gemüse -Kochen von Milch Wie viel Energie liefert 1g Eiweiß? 17 kJ/ 4 kcal Nenne 7 eiweißhaltige NM! Tierisch: Fleisch, Fisch, Milch- und Milchprodukte, Eier Pflanzlich: Bohnen, Getreide, Brot, Mehl, Kartoffeln, Nüsse Erkläre Biologischer Ergänzungswert! Durch Mischen von Eiweißstoffen (LM) kann die biologische Wertigkeit erhöht werden und die Qualität der Eiweißzufuhr so verbessert werden Finde dazu Beispiele!