Reaktionen - Fachdidaktik Chemie ETH
Werbung
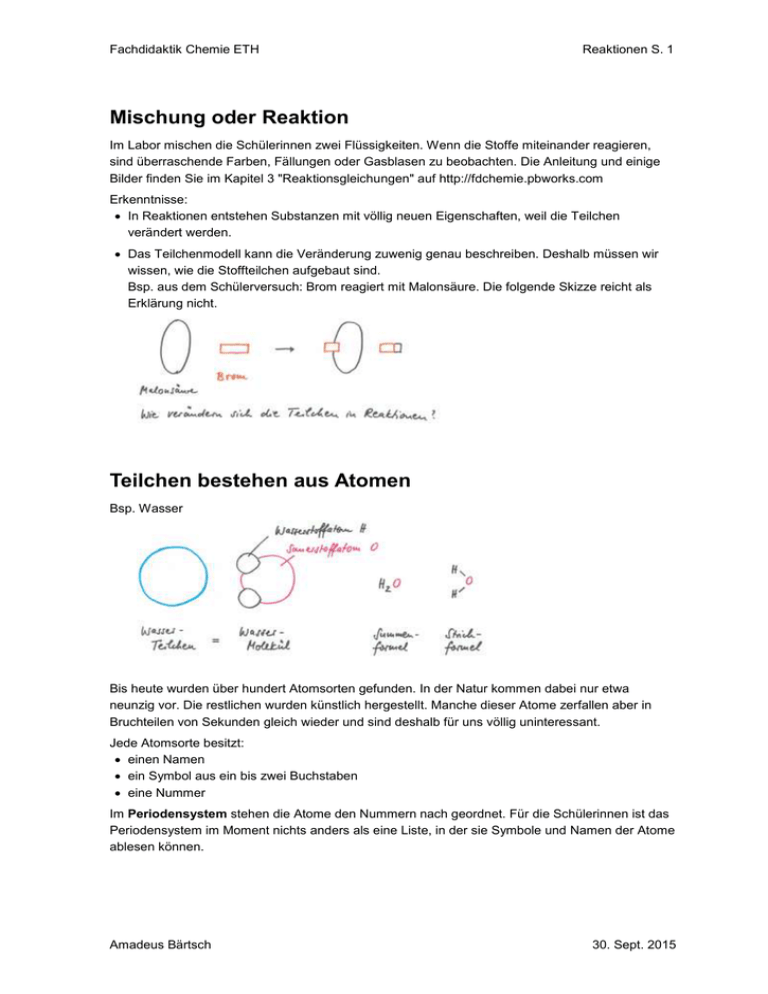
Fachdidaktik Chemie ETH Reaktionen S. 1 Mischung oder Reaktion Im Labor mischen die Schülerinnen zwei Flüssigkeiten. Wenn die Stoffe miteinander reagieren, sind überraschende Farben, Fällungen oder Gasblasen zu beobachten. Die Anleitung und einige Bilder finden Sie im Kapitel 3 "Reaktionsgleichungen" auf http://fdchemie.pbworks.com Erkenntnisse: In Reaktionen entstehen Substanzen mit völlig neuen Eigenschaften, weil die Teilchen verändert werden. Das Teilchenmodell kann die Veränderung zuwenig genau beschreiben. Deshalb müssen wir wissen, wie die Stoffteilchen aufgebaut sind. Bsp. aus dem Schülerversuch: Brom reagiert mit Malonsäure. Die folgende Skizze reicht als Erklärung nicht. Teilchen bestehen aus Atomen Bsp. Wasser Bis heute wurden über hundert Atomsorten gefunden. In der Natur kommen dabei nur etwa neunzig vor. Die restlichen wurden künstlich hergestellt. Manche dieser Atome zerfallen aber in Bruchteilen von Sekunden gleich wieder und sind deshalb für uns völlig uninteressant. Jede Atomsorte besitzt: einen Namen ein Symbol aus ein bis zwei Buchstaben eine Nummer Im Periodensystem stehen die Atome den Nummern nach geordnet. Für die Schülerinnen ist das Periodensystem im Moment nichts anders als eine Liste, in der sie Symbole und Namen der Atome ablesen können. Amadeus Bärtsch 30. Sept. 2015 Reaktionen S. 2 Fachdidaktik Chemie ETH Verschiedene Moleküle bedeuten verschiedene Substanzen Viele Moleküle bestehen aus folgenden Atomsorten: H Wasserstoff-Atom O Sauerstoff-Atom C Kohlenstoff-Atom Cl Chlor-Atom N Stickstoff-Atom S Schwefel-Atom Amadeus Bärtsch 30. Sept. 2015 Reaktionen S. 3 Fachdidaktik Chemie ETH Aufgabe 1 a) Bei Abgabe einer Schwarz-Weiss-Kopie: Die Atome gemäss Konvention färben. b) Summenformeln angeben. Gleiche Atome haben dieselbe Farbe. Die Reihenfolge c) Aus welcher Substanz kann Ether hergestellt werden? Welches Molekül auf diesem Blatt muss nur wenig umgebaut werden, damit es zu einem Ether-Molekül wird. Bitte erkläre die Veränderung mit einer Skizze. Aufgabe 2 a) Strichformeln zeichnen. Wenn die Lehrperson die Aufgabe am Beispiel von Wasser und Sauerstoff vormacht und betont, dass jede Atomsorte eine bestimmte Anzahl Bindungen eingeht, verstehen die Schüler wie sie vorgehen können. Aus H2O weiss man, dass Sauerstoffatome 2 Bindungen machen. Deshalb muss es bei O2 eine Doppelbindung geben. b) Erkläre mit Strichformeln, wie Alkohol- zu Ethermolekülen werden. Lösung der Aufgaben Abb. ohne Eintragung und Farbe Amadeus Bärtsch 30. Sept. 2015 Fachdidaktik Chemie ETH Reaktionen S. 4 Auswertung Die Summenformel gibt die Zusammensetzung des Moleküls an. Die Strichformel zeigt, wie sich Atome verbinden. Jede Atomsorte macht eine bestimmte Anzahl Bindungen. Wenn die Moleküle eines Stoffs aus gleichen Atomen aufgebaut sind, bezeichnen wir den Stoff als elementaren Stoff. Wenn die Moleküle eines Stoffes aus verschiedenen Atomen aufgebaut sind, bezeichnen wir den Stoff als Verbindung. Beispiele von elementaren Stoffen: ............................................................................................................................................................. Beispiele von Verbindungen: ............................................................................................................................................................. Mit Strichformeln können Reaktionen beschrieben werden. Sie zeigen welche Bindungen gebrochen und wo neue Bindungen gebildet werden. Die Strichformeln zeigen beispielsweise, dass Alkohol in Ether und Wasser verwandelt werden kann. Diese Voraussage ist mit Stoffteilchen nicht möglich. Deshalb verwenden Chemikerinnen Strichformeln und Summenformeln, wenn sie Reaktionen studieren und die Veränderung der Moleküle verstehen wollen. Amadeus Bärtsch 30. Sept. 2015 Fachdidaktik Chemie ETH Reaktionen S. 5 Reaktionen 1. Wasserstoff verbrennen Exp. Abgase kondensieren: Die Flamme erzeugt Wasserdampf Vorgehen 1. Ziel bekannt geben: Wir untersuchen die Abgase bei der Verbrennung von Wasserstoff 2. Apparatur vorstellen und Experiment starten. Die Glaswaren sind von weitem recht klein und viele Schüler durchschauen die Apparatur nicht auf Anhieb. 3. Apparatur an der Tafel skizzieren. 4. Schülerinnen nach vorn bitten, damit sie die Apparatur gut sehen. 5. Experiment beenden, U-Rohr entfernen und einem Schüler zum Trocknen geben. Weil er das U-Rohr aussen trocknet ist es immer noch nass. Die Lehrperson kann ihn auffordern besser zu trocknen und so allen klar machen, dass sich innen Tropfen gebildet haben. 6. Optional kann wenig wasserfreies Kupfersulfat ins U-Rohr gegeben werden. Welche Flüssigkeit könnte es sein? Reagenzgläser mit einigen Tropfen Alkohol, Ether und Wasser mit wasserfreiem Kupfersulfat versetzen und so nachweisen, dass sich Wassertropfen im U-Rohr gebildet haben. Die Schüler nehmen wieder Platz. 7. Also muss bei der Verbrennung Wasserdampf entstehen. Der Sauerstoff kommt aus der Luft. 8. Erst jetzt Wasserdampf und Sauerstoff in die Skizze eintragen. 9. Bemerkung: Experimente zeigen wie sich Substanzen in einer Reaktion verändern. Ohne den Nachweis der Produkte könnte man die Reaktion nicht herausfinden. Amadeus Bärtsch 30. Sept. 2015 Reaktionen S. 6 Fachdidaktik Chemie ETH Wie kann Wasserdampf entstehen? Die Flamme ist so heiss, dass die Moleküle zerrissen werden und die Atome sich neu verbinden. In der Flamme findet eine chemische Reaktion statt Die Reaktionsgleichung beschreibt die Veränderung der Moleküle: Die Animation Wasserstoff verbrennen.osx von Kurt Pfefferkorn ist auf der Plattform zu finden, kann allerdings nur mit einem alten Betriebssystem auf Mac abgespielt werden. Experimente mit Wasserstoff Wasserstoff brennt. Inszenierung 1. Wasser in einer grosse Schale mit etwas Spülmittel versehen 2. Wasserstoff einleiten und so viele Blasen wie möglich erzeugen 3. Wasserstoffflasche schliessen und die Blasen mit einem sehr langen Zündholz entzünden 4. Oft sind die Schüler beeindruckt und wünschen lautstark eine Wiederholung. Ohne dass es die Klasse merkt Sauerstoff in die Schale leiten und eine Schülerin auffordern, die Blasen zu entzünden. Wenn die Gasflaschen nebeneinander stehen, sehen die wenigsten, dass jetzt Sauerstoff eingesetzt wird. Amadeus Bärtsch 30. Sept. 2015 Reaktionen S. 7 Fachdidaktik Chemie ETH 5. Zeigen, dass die Flamme in den Spülmittelblasen viel grösser ist und erklären, dass sie Sauerstoff enthalten. Je mehr Sauerstoff, desto stärker das Feuer 6. Wie könnte man eine besonders heftige Verbrennung erreichen? Wasserstoff und Sauerstoff müssen gemischt werden. Die Reaktionsgleichung gibt das optimale Verhältnis an. In einer Kunststoffspritze 30 ml Wasserstoff und 15 ml Sauerstoff aufziehen, im Spülmittel ganz wenig Blasen erzeugen und anzünden. Gehörschutz tragen. Der Knall ist unangenehm. Knallgas: Eine Mischung von 2 Teilen Wasserstoff und einem Teil Sauerstoff explodiert am heftigsten. Der singende Trichter Den Auslauf eines grossen Kunststofftrichters mit Aluminiumfolie auf 2 mm Durchmesser verkleinern. Den Trichter wie in der Abbildung gezeigt auf den Experimentiertisch stellen und mit einem Schlauch von unten her genügend Wasserstoff einfüllen. Den Schlauch entfernen. Sofort die Stahlflasche schliessen und den Wasserstoff entzünden, der aus dem kleinen Loch strömt. Zuerst passiert 10 bis 15 Sekunden gar nichts. Dann beginnt der Trichter zu singen und endlich explodiert das Gas im Trichter mit lautem Knall. Es ist kein Gehörschutz nötig. Vorschlag: Sie schildern der Klasse alles was geschehen wird und führen dann das Experiment durch. Obwohl alle den Verlauf kennen und gewarnt sind, erschrecken die Schülerinnen und Schüler bei der Explosion. Amadeus Bärtsch 30. Sept. 2015 Reaktionen S. 8 Fachdidaktik Chemie ETH 2. Elektrolyse von Wasser Das Experiment kann mit dem Hofmann-Apparat ausgeführt werden Abbildung aus Wikipedia Was ist gut dargestellt? Unnötiges ist weggelassen Die Apparatur ist leicht verständlich Was sollte verbessert werden? Die Zahl der Gasblasen ist verschieden Die Pfeile weglassen, die den geschlossenen Stromkreis andeuten. Grund: Elektronen können nicht schwimmen Wasser mit einer Farbe angeben Die Elektroden müssen weiter oben enden Plus- und Minuspol statt Kathode und Anode verwenden Die Vorgänge an den Elektroden können auf dieser Stufe nicht genau erklärt werden, weil Elektronen und Ionen den Schülern noch nicht bekannt sind. Erkenntnisse: Reaktionen können umgekehrt werden Die Reaktionsgleichung erklärt, warum doppelt so viel Wasserstoff wie Sauerstoff entsteht. Amadeus Bärtsch 30. Sept. 2015 Fachdidaktik Chemie ETH Reaktionen S. 9 3. Erdgas verbrennen Exp. Kohlendioxid und Wasserdampf im Abgas nachweisen Abbildung von K. Pfefferkorn, Kantonsschule Oerlikon. Kalkwasser ist eine gesättigte Lösung von Calciumhydroxid. Reaktionsgleichung Damit CH4 zu CO2 und H2O wird, wird Sauerstoff aus der Luft benötigt. Amadeus Bärtsch 30. Sept. 2015 Fachdidaktik Chemie ETH Reaktionen S. 10 4. Fossile Brennstoffe Lernaufgabe Lernaufgaben gliedern sich in 4 Phasen: Input, Lernaufgabe, Diskussion und sichern der Erkenntnisse. A) Input: 1. Bsp. vorlösen und alle Überlegungen laut vordenken. Da die Aufgabe nicht im Klassengespräch erarbeitet wird ist der Input kurz und bleibt übersichtlich. Die Schülerinnen wissen anschliessend, was zu tun ist 1. Bsp. Feuerzeuge enthalten Propan. Propan C3H8 brennt B) Lernaufgabe Auftrag: Die Reaktionsgleichung mit Summenformeln aufstellen 2. Bsp. Benzin C7H16 brennt 3. Bsp. Heizöl C17H36 brennt 4. Bsp. Butan C4H10 brennt 5. Bsp. Kerosin C14H30 brennt 6. Bsp. Alkohol C2H6O brennt In der Lernaufgabe verarbeiten die Schüler das, was im Input vorgestellt wurde. Sie setzen sich mit der Aufgabe aktiv auseinander und treffen auf neue Herausforderungen. Die Lehrperson geht von Schüler zu Schüler und sieht die Schwierigkeiten. Fragen zu den gewählten Beispielen: 1. Warum wurden die oben genannnten Substanzen in die Lernaufgabe aufgenommen? 2. Weshalb diese Reihenfolge? 3. Welche Herausforderungen müssen die Schülerinnen meistern? Amadeus Bärtsch 30. Sept. 2015 Fachdidaktik Chemie ETH Reaktionen S. 11 C) Diskussion In der Lernaufgabe treffen die Schülerinnen auf alle Schwierigkeiten, die sich beim Aufstellen von Reaktionsgleichungen ergeben. Sie merken, wo es Probleme gibt und können diese teilweise lösen. Nach der Lernaufgabe folgt deshalb eine Diskussion in der die Lösungen gezeigt und alle Fragen beantwortet werden. Wenn die Schüler grösstenteils erfolgreich waren, kann die Diskussion kurz gehalten werden. Wenn sie aber an vielen Aufgaben scheiterten, so entsteht ein grosses Bedürfnis, die richtige Lösung zu erfahren. Alle sind froh, wenn die Lehrperson alle Aufgaben verständlich erklärt und folgen den Ausführungen aufmerksam. D) Die Erkenntnisse festhalten Verbrennungen sind Reaktionen mit Sauerstoff: Wenn der Brennstoff Kohlenstoff- und Wasserstoffatome enthält, entstehen Kohlendioxid und Wasserdampf. In Reaktionen werden Bindungen gebrochen und die Atome verbinden sich neu. Die Zahl der Atome jeder Sorte verändert sich nicht. Übung 4: Atommodelle Aufgabe 1: Das Bohr'sche Atommodell kommt in jedem Lehrbuch vor a) Weshalb müssen Gymnasiasten das Bohr'sche Atommodell kennen? b) Wie kann das Bohr'sche Atommodell bei 15-jährigen Schülerinnen und Schülern im Grundlagenfach eingeführt werden? Gesucht ist eine sinnvolle Abfolge von Erkenntnissen und eine stufengerechte Begründung für das Konzept von Bohr. c) Wo sind die Grenzen des Bohr'schen Atommodells? In welchen Bereichen von Atombau und Bindungslehre kann das Bohr'sche Atommodell nicht verwendet werden? d) Warum ist das Bohr'sche Atommodell falsch? Eine kurze Antwort genügt. Aufgabe 2: Das Kern-Hülle-Modell a) Phantasieloser Unterricht: Sie nehmen das rechts abgedruckte Bild und erklären damit den Streuversuch von Rutherford. Wie könnten Sie den Unterricht interessanter machen? Machen Sie einen Vorschlag. b) Werden Sie das Kern-Hülle-Modell im Unterricht vorstellen? Bitte begründen Sie Ihre Antwort kurz. Umfang: Grössenordnung 2 Seiten. Dokument: kleiner ist als 2 MB. Am liebsten als WordDokument, im Notfall als PDF. Abgabe bis Donnerstag, 16. Okt. 2014 14 Uhr, per Mail an [email protected] Amadeus Bärtsch 30. Sept. 2015 Fachdidaktik Chemie ETH Reaktionen S. 12 Was machen ChemikerInnen? aus Primo Levi: Der Ringschlüssel Amadeus Bärtsch 30. Sept. 2015