Katalyse - Fachdidaktik Chemie ETH
Werbung
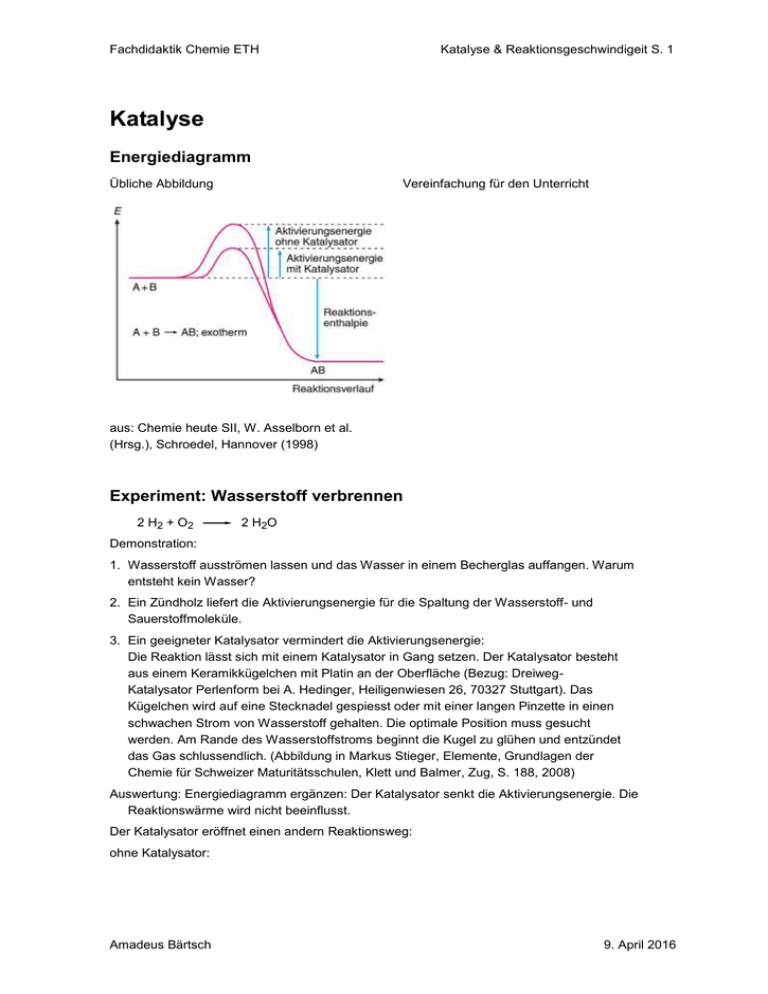
Katalyse & Reaktionsgeschwindigeit S. 1 Fachdidaktik Chemie ETH Katalyse Energiediagramm Übliche Abbildung Vereinfachung für den Unterricht aus: Chemie heute SII, W. Asselborn et al. (Hrsg.), Schroedel, Hannover (1998) Experiment: Wasserstoff verbrennen 2 H2 + O 2 2 H2O Demonstration: 1. Wasserstoff ausströmen lassen und das Wasser in einem Becherglas auffangen. Warum entsteht kein Wasser? 2. Ein Zündholz liefert die Aktivierungsenergie für die Spaltung der Wasserstoff- und Sauerstoffmoleküle. 3. Ein geeigneter Katalysator vermindert die Aktivierungsenergie: Die Reaktion lässt sich mit einem Katalysator in Gang setzen. Der Katalysator besteht aus einem Keramikkügelchen mit Platin an der Oberfläche (Bezug: DreiwegKatalysator Perlenform bei A. Hedinger, Heiligenwiesen 26, 70327 Stuttgart). Das Kügelchen wird auf eine Stecknadel gespiesst oder mit einer langen Pinzette in einen schwachen Strom von Wasserstoff gehalten. Die optimale Position muss gesucht werden. Am Rande des Wasserstoffstroms beginnt die Kugel zu glühen und entzündet das Gas schlussendlich. (Abbildung in Markus Stieger, Elemente, Grundlagen der Chemie für Schweizer Maturitätsschulen, Klett und Balmer, Zug, S. 188, 2008) Auswertung: Energiediagramm ergänzen: Der Katalysator senkt die Aktivierungsenergie. Die Reaktionswärme wird nicht beeinflusst. Der Katalysator eröffnet einen andern Reaktionsweg: ohne Katalysator: Amadeus Bärtsch 9. April 2016 Fachdidaktik Chemie ETH Katalyse & Reaktionsgeschwindigeit S. 2 mit Katalysator: Experiment: Katalysatoren greifen in die Reaktion ein, werden aber nicht verbraucht. Demonstration: Wasserstoffperoxid reagiert mit Tartrat (Die genaue Anleitung finden Sie in der "Versuchssammlung_3", die unter "Experimentierkurs" auf der Plattform eingestellt ist http://fdchemie.pbworks.com/w/page/47971610/Experimentierkurs) Erläuterung: Auf die Reaktionsgleichung gehe ich nicht ein. In einer Skizze halten die Schülerinnen fest, dass die Reaktion erst mit der Zugabe von Co2+ einsetzt (weil der Kat. die Aktivierungsenergie senkt), die Mischung grün wird (weil der Kat. eingreift) und schlussendlich wieder die ursprüngliche rosa Farbe zu sehen ist (weil Katalysatoren nicht verbraucht werden). Die Reaktion ist in der alten Ausgabe von Chemie heute SII besprochen (M. Jäckel et al. (Hrsg.), Chemie heute SII, Schroedel, Hannover, S. 85, 1988) Ein Arbeitsblatt von Marc Stieger ist auf www.fdchemie.pbworks.com zugänglich Skizze: Anwendungen 1. Der Abgaskatalysator im Auto Da diese Anwendung sehr wichtig ist, ist eine ausführliche Darstellung angezeigt. Der Film "Der Autoabgas-Katalysator", der unter unter http://www.fwu-shop.de bezogen werden kann, erklärt die Funktion ausgezeichnet, ist aber alt. (Direkter Link: http://www.fwu-shop.de/der-autoabgaskatalysator-4602450.html; Inhalt im Begleitmaterial http://dbbm.fwu.de/fwu-db/prestoimage/beihefte/46/024/4602450.pdf). Eine aktuellere Erklärung mit dem Titel "Catalytic Converter Deconstructed" ist auf youtube zu sehen http://www.youtube.com/watch?v=rmtFp-SV0tY. Wenn Sie einen guten, aktuellen Film finden, bin ich froh um einen Hinweis. Leider laufen Filme sehr schnell ab und die meisten Schüler können sich später kaum mehr an den Inhalt erinnern. Vor dem Film lasse ich die Schülerinnen deshalb folgendes Blatt bearbeiten. Amadeus Bärtsch 9. April 2016 Katalyse & Reaktionsgeschwindigeit S. 3 Fachdidaktik Chemie ETH A. Vor dem Film Arbeitsblatt: Automotor und Katalysator 1. Wichtige Moleküle in den Autoabgasen Zeichnen Sie die Lewisformeln der angegebenen Moleküle, die in den Abgasen von Fahrzeugen vorkommen. Die Lösung ist in grauer Schrift angegeben. Substanz Kohlendioxid CO2 Lewisformel O C O Erklärung Kohlendioxid ist für Menschen harmlos; Es wird vielen Getränken zugesetzt. Stickoxide: Stickstoffmonoxid NO Stickstoffdioxid NO2 Kohlenmonoxid CO N O N O C O O Beide Moleküle sind Radikale. Das ungepaarte Elektron möchte Bindungen eingehen. Deshalb ist es reaktiv und greift die Schleimhäute an. Kohlenmonoxid bindet an Hämoglobin und unterbricht den Sauerstofftransport der roten Blutkörperchen. Es führt in geringen Konzentrationen zum Tod. Bei Rauchern sind 10 bis 20 % der roten Blutkörperchen mit Kohlenmonoxid belegt, was die verminderte sportliche Leistungsfähigkeit erklärt. 2. Reaktionen im Automotor Der Automotor verbrennt das Benzin (bspw. Hexan C6H14) und wandelt die Reaktionswärme in mechanische Energie um: Zum weitaus grössten Teil verbrennt Benzin zu Kohlendioxid und Wasserdampf: Input: vormachen.......................................................................................................... Daneben laufen auch folgende Reaktionen ab: Benzin und Sauerstoff werden zu Kohlenmonoxid und Wasserdampf: ..................................................................................................................................... Amadeus Bärtsch 9. April 2016 Fachdidaktik Chemie ETH Katalyse & Reaktionsgeschwindigeit S. 4 Benzin wird in der Hitze in kürzere Kohlenwasserstoffe zerlegt: Hexan wird zu Ethan C2H6 und Ethen C2H4: ..................................................................................................................................... Stickstoff reagiert mit Sauerstoff zu Stickstoffmonoxid: ..................................................................................................................................... 3. Reaktionen im Auto-Katalysator Stickstoffmonoxid und ein Teil des Kohlenmonoxids werden zu Stickstoff und Kohlendioxid: ..................................................................................................................................... Das verbleibende Kohlenmonoxid reagiert mit Sauerstoff zu Kohlendioxid: ..................................................................................................................................... Unverbrannte Kohlenwasserstoffe (bspw. C2H6) werden mit Sauerstoff zu Kohlendioxid und Wasserdampf: ..................................................................................................................................... Erkenntnisse Stickoxid reizen die Schleimhäute, weil sie Radikale sind. Die Lewisformel kann nur mit Formalladungen gezeichnet werden. Wenn die giftigen Stoffe in den Reaktionsgleichungen rot und die harmlosen grün unterstrichen werden, sieht man, dass der Katalysator Gifte in harmlose Stoffe umwandelt. B. Geeigneter Ausschnitt aus dem Film zeigen. Persönlicher Grundsatz: Nie länger als 10 Minuten Film zeigen. Wenn nötig einen Film in 2 Etappen ansehen und zwischendurch etwas arbeiten. Ausschnitt für die Fachdidaktik 3'20'' und 11' Amadeus Bärtsch 9. April 2016 Fachdidaktik Chemie ETH Katalyse & Reaktionsgeschwindigeit S. 5 C. Nach dem Film Bedeutsames aus dem Film festhalten: Der Katalysator im Auto 1. a) Welche Schadstoffe gelangen in den Katalysator? Welche Gase verlassen den Katalysator? Zeichnen Sie die Formeln in die unten stehende Abbildung. b) Wo berühren die Abgase das Platin? Markieren Sie die Kontaktfläche. 2. Warum gibt es derart viele Kanäle? 3. Wozu dient die Lambdasonde? 4. Warum darf nur bleifreies Benzin getankt werden? 2. Kontaktlinsen desinfizieren Oft werden Linsen mit 3 % Wasserstoffperoxid desinfiziert. Wasserstoffperoxid wird anschliessend katalytisch zersetzt. In kommerziellen Produkten, die bei Optikern erhältlich sind, wird eine heterogene Katalyse mit Platin und eine homogene mit Katalase eingesetzt, die sich auf dem Hellraumprojektor gut zeigen lässt. Andere Hersteller verwenden geringe Konzentrationen von Desinfektionsmitteln, die nicht zersetzt werden müssen. Demonstration: Kleine Kristallisierschalen werden 1,3 cm hoch mit 3 % Wasserstoffperoxid gefüllt. Ein Platinstern wird in die eine und Katalase in die andere Schale gegeben. Platinstern ist ein Begriff der Werbung. Es handelt sich um einen Kunststoff, der mit Platin beschichtet ist und dessen Form entfernt an einen Stern erinnert. Amadeus Bärtsch 9. April 2016 Fachdidaktik Chemie ETH Katalyse & Reaktionsgeschwindigeit S. 6 Die folgende Abbildung stammt aus den Notizen einer Schülerin und zeigt das Experiment auf dem Hellraumprojektor. Wenn die Schüler mitschreiben muss man damit leben, dass sie mit fehlerhaften Unterlagen nach Haus gehen. Das können Sie hier beispielhaft sehen. Amadeus Bärtsch 9. April 2016 Katalyse & Reaktionsgeschwindigeit S. 7 Fachdidaktik Chemie ETH Die Reaktionsgeschwindigkeit Definition 1 i (i) RG = t RG (i) : : [i] : t : Reaktionsgeschwindigkeit in molL-1s-1 Stöchiometrischer Koeffizient des Reaktanden i in der Reaktionsgleichung Änderung der Konzentration des Reaktanden i in molL-1 Zeit-Intervall in s Probleme Die Reaktionsgeschwindigkeit wird in der Chemie diskutiert bevor die Ableitung in Mathematik erklärt wird Die Reaktionsgeschwindigkeit nimmt im Lauf der Reaktion ab. Von einer mittleren Reaktionsgeschwindigkeit ∆c/∆t zu sprechen ist deshalb irreführend. Die Konzentration und nicht die Teilchenzahl ist die Messgrösse Die stöchiometrischen Faktoren müssen berücksichtigt werden Die Änderung der Eduktkonzentration muss mit einem negativen Vorzeichen versehen werden Vorschlag Die Reaktionsgeschwindigkeit nicht definieren. Intuitiv ist klar, dass die Reaktionsgeschwindigkeit hoch ist, wenn Edukte schnell zu Produkten werden. Bsp. Eine Explosionen ist eine sehr schnelle, das Rosten von Eisen dagegen eine langsame Reaktion Was tun, wenn sich ein Konzept nicht vereinfachen lässt? Qualitative Aussagen machen. Die zentrale Frage für den Unterricht lautet: Wie lässt sich die Reaktionsgeschwindigkeit beeinflussen? Warum ändert sich die Reaktionsgeschwindigkeit mit Temperatur, Konzentration und Oberfläche? Für die kinetische Herleitung des dynamischen Gleichgewichts muss die Konzentrationsabhängigkeit quantitativ angegeben werden: RG = k · [A] · [B] Amadeus Bärtsch 9. April 2016 Fachdidaktik Chemie ETH Katalyse & Reaktionsgeschwindigeit S. 8 Vorschlag von Georg Lambert Reaktionsgeschwindigkeit mit Legosteinen Vorlesungen in Berkeley: Chemistry 1A, 001 - Fall 2011 Angelica Stacy and Michelle Douskey https://www.youtube.com/playlist?list=PLBBECFE1D170D35F4 Lego macht sie das erste Mal in der 12. Vorlesung, etwa bei Minute 20. 40 rote und 40 gelbe Duplo sind in einer Kiste Eine Schülerin greift 8 Mal mit beiden Händen hinein und bildet AB. Dann wird das Ergebnis tabelliert wie es oben rechts zu sehen ist Für die Simulation des chemischen Gleichgewichts muss eine Rückreaktion erfolgen: Ab kann sich spalten. Neben der Schülerin, die einzelne rote und gelbe Duplo verbindet, braucht es einen Schüler der mit einer Hand in die Kiste greift und AB trennt. Amadeus Bärtsch 9. April 2016 Fachdidaktik Chemie ETH Katalyse & Reaktionsgeschwindigeit S. 9 1. Temperatur und Reaktionsgeschwindigkeit Exp. "Sonnenuntergang" Eine Lösung von Natriumthiosulfat reagiert mit Salzsäure. Drei Bechergläser auf dem Hellraumprojektor enthalten die Mischungen bei 25, 35 und 45 °C. Die Zeit wird gemessen, bis das Becherglas ganz dunkel ist. Die Anleitung finden Sie in der "Versuchssammlung" unter "Experimentierkurs" auf der Plattform http://fdchemie.pbworks.com/w/page/47971610/Experimentierkurs Das Arbeitsblatt "Abhängigkeit der Reaktionsgeschwindigkeit von der Temperatur (RGT-Regel)" von P. Zimmermann ist ebenfalls auf www.fdchemie.pbworks.com zugänglich. Mit diesem Experiment lässt sich die RGT-Regel einführen: Bei vielen Reaktionen verdoppelt sich die Geschwindigkeit, wenn die Temperatur um 10 K steigt. Warum nimmt die Reaktionsgeschwindigkeit beim Erwärmen zu? Je wärmer, desto schneller sind die Teilchen. Es gibt mehr Zusammenstösse. Die Zusammenstösse sind heftiger und führen damit viel häufiger zu einer Reaktion. Die Änderung der kinetischen Energie erhöht die Reaktionsgeschwindigkeit weit stärker als die Zahl der Zusammenstösse. Allen muss klar werden, dass die absolute Temperatur und nicht die Celsius-Skala mit der Brown'schen Bewegung verknüpft ist. Erkenntnis: Je heisser, desto viel schneller sind Reaktionen, weil die Teilchen heftiger zusammenstossen. Amadeus Bärtsch 9. April 2016 Katalyse & Reaktionsgeschwindigeit S. 10 Fachdidaktik Chemie ETH Abbildung: Bei tiefer Temperatur sind die Moleküle zu langsam und prallen aufeinander ohne eine Reaktion auszulösen. Bei hoher Temperatur führen Zusammenstösse zu einer Umordnung der Atome (R. E. Dickerson & I. Geis, Chemie - eine lebendige und anschauliche Einführung, Verlag Chemie, Weinheim, S. 362, 1981) Anwendungen in der Küche Dampfkochtopf oder eine Pfanne mit Deckel? Warum werden Kartoffeln in einem Dampfkochtopf schneller gar? In einem Dampfkochtopf wird eine Temperatur von 120 °C erreicht. Gemäss RGT-Regel ist der Inhalt ungefähr 4 Mal schneller gekocht. Lebensmittel haltbar machen Weshalb verderben Lebensmittel? Reaktionen mit Sauerstoff aus der Luft. Mikroorganismen vermehren sich auf den Lebensmitteln. Damit sind chemische Reaktionen in den Mirkoorganismen für den Verderb verantwortlich. Aufgabe: Notieren Sie 5 Methoden mit denen Lebensmittel konserviert werden und geben Sie an, warum die Lebensmittel haltbarer sind. Als Input können Sie erklären, warum Speisen im Kühlschrank länger haltbar sind. Die Lösung ist in grauer Schrift angegeben. Methode der Konservierung Erklärung für die längere Haltbarkeit Kühlschrank 5 °C Die Temperatur ist ungefähr 20 K unter der Raumtemperatur. Gemäss RGT-Regel sind die chemischen Reaktionen ungefähr 4 Mal langsamer und die Lebensmittel deshalb 4 Mal länger haltbar. Amadeus Bärtsch 9. April 2016 Katalyse & Reaktionsgeschwindigeit S. 11 Fachdidaktik Chemie ETH Tiefkühler -20 °C Bei - 20 °C sind die Lebensmittel fest. Die Reaktionen sind sehr langsam und die Lebensmittel sehr lange haltbar. Hier ist die RGT-Regel fehl am Platz. Vakuumieren, unter Schutzatmosphäre verpacken, mit Frischhaltefolie bedecken Sauerstoff von den Lebensmitteln fernhalten. Pasteurisieren Die Hitze tötet Mikroorganismen. Zucker oder Salz zugeben Die Mikroben schrumpfen aus Gründen der Osmose. Trocknen Mikroben können sich ohne Wasser nicht teilen. 2. Konzentration und Reaktionsgeschwindigkeit Definition: Konzentration = Stoffmenge pro Volumen Einheit: mol/L oder M Ein Beispiel: Es wird 2 M Natronlauge hergestellt: Experiment: Landolt-Reaktion (1886) Beobachtung: Iodat und Sulfit reagieren miteinander. Die farblose Lösung wird nach einiger Zeit plötzlich dunkel. Die Reaktionszeit ist umgekehrt proportional zur Konzentration von Iodat. Die Anleitung zum Experiment findet sich in der Versuchssammlung. [IO3-] = [SO32-] = Reaktionszeit ca. 138 s 64 s Wahrscheinlichkeit für einen Zusammenstoss 1·6 2·6 Amadeus Bärtsch 32 s 16 s 4·6 8·6 9. April 2016 Fachdidaktik Chemie ETH Katalyse & Reaktionsgeschwindigeit S. 12 Erkenntnis: Je grösser die Konzentration, desto häufiger die Zusammenstösse, desto schneller die Reaktion. Die Reaktionsgeschwindigkeit ist proportional zur Konzentration. RG = k · [IO3- ] · [SO32- ] Auftrag: Erklären Sie das Geschwindigkeitsgesetz. a) Weshalb werden die Konzentrationen multipliziert? b) Weshalb braucht es die Geschwindigkeitskonstante? c) Wie kommt man auf die Konstante k? d) Welche Bedingungen müssen eingehalten werden, dass k konstant ist? e) Was ändert sich in der obigen Gleichung, wenn die Temperatur steigt? Die Anleitung zum Experiment findet sich in der Versuchssammlung http://fdchemie.pbworks.com/w/page/47971610/Experimentierkurs. Es sind mehrere Reaktionen, die aus Iodat Iod erzeugen, welches mit Stärke violett wird. In Wikipedia ist die Verzögerung gut erklärt (http://de.wikipedia.org/wiki/Landolt-Reaktion). Allerdings sind so viele Prozesse beteiligt, dass ich im Unterricht selten darauf eingehe. Oberfläche und Reaktionsgeschwindigkeit 1. Exp. Aluminiumpulver verbrennen Demonstration: Aluminiumfolie schmilzt in der Flamme. Aluminiumpulver - z.B. Aluminium feinst von Erne - verbrennt, wenn eine Portion in ein gebogenes Glasrohr gegeben und von unten in die Flamme geblasen wird. Amadeus Bärtsch 9. April 2016 Katalyse & Reaktionsgeschwindigeit S. 13 Fachdidaktik Chemie ETH 2. Exp. Staubexplosion Wie in der Versuchssammlung ersichtlich, kann das Experiment in einem Silo oder in einer präparierten Kaffeedose demonstriert werden. Hier die Version mit der Kaffeedose: 3. Exp. Kerosin verbrennen. Feuerspucken Demonstration: Im Gegensatz zu Benzin lässt sich Kerosin in einer Glasschale nicht entzünden. Kerosin, das aus einer Sprühflasche in den Bunsenbrenner gelangt, erzeugt dagegen eine Stichflamme. 4. Exp. Feinteiliges Schwarzpulver verpufft schneller. Wenn es nicht bereits bei der Stöchiometrie diskutiert wurde, kann dieses Experiment im Zusammenhang mit der Reaktionsgeschwindigkeit gezeigt werden. 16 KNO3 + S8 + 24 C 8 K2S + 24 CO2 + 8 N2 In einer stöchiometrischen Rechnung kann die Zusammensetzung von Schwarzpulver bestimmt werden: 1,64 g Kaliumnitrat, 0,26 g Schwefel und 0,29 g Holzkohle. Schwarzpulver kann selber gemischt und eine geringe Menge in einer Glasschale auf dem Brenner erhitzt werden. Das käufliche Schwarzpulver verpufft demgegenüber viel schneller, weil es feinteiliger und besser gemischt ist. Waffengeschäfte verkaufen Schwarzpulver. Erkenntnis: Je grösser die Kontaktfläche, desto schneller die Reaktion Anwendungen im Alltag Wo wird die Oberfläche vergrössert, damit Reaktionen schneller ablaufen? Zähne zerkleinern die Nahrung Darmzotten und Lungenbläschen vergrössern die Kontaktfläche Kaffeebohnen werden gemahlen Feinkristallzucker löst sich schneller als Kandiszucker Zum Anfeuern wird Kleinholz verwendet Der Autokatalysator hat eine riesige Oberfläche Amadeus Bärtsch 9. April 2016 Fachdidaktik Chemie ETH Katalyse & Reaktionsgeschwindigeit S. 14 Geschwindigkeitsverteilung Animationen http://phet.colorado.edu/en/simulation/gas-properties http://astro.unl.edu/naap/atmosphere/distribution.html Phänomene, die mit der Geschwindigkeitsverteilung erklärt werden können 1. Flüssigkeiten verdunsten. Sie werden gasförmig, obwohl der Siedepunkt noch nicht erreicht ist 2. Verdunstungskälte: Wenn Ether auf der Hand verdunstet, fühlt es sich kalt an. 3. Mit nassen Haaren friert man im Winter 4. Wenn es heiss ist, schwitzen die Menschen. 5. Wenn alle Moleküle dieselbe Geschwindigkeit hätten, würde eine Flüssigkeit schlagartig verdampfen 6. Die Reaktionsgeschwindigkeit nimmt beim Erwärmen stark zu Visualisierungen der Studierenden von H. Schwertner von A. Ryser Amadeus Bärtsch 9. April 2016 Fachdidaktik Chemie ETH Katalyse & Reaktionsgeschwindigeit S. 15 C. Wullschleger V. Cervetto Amadeus Bärtsch 9. April 2016 Fachdidaktik Chemie ETH Katalyse & Reaktionsgeschwindigeit S. 16 Andrea Lindblom Die Geschwindigkeitsverteilung der Teilchen Ich finde die Geschwindigkeitsverteilung der Teilchen sehr interessant und wichtig, da man damit Folgendes zeigen kann: - Reaktionsgeschwindigkeiten sind eigentlich nie gleich null (ausser theoretisch beim absoluten Nullpunkt…), da es auch bei ganz tiefen Temperaturen immer ein paar Teilchen hat, die sich viel schneller als der Durchschnitt bewegen und also die benötigte Aktivierungsenergie aufbringen. Ich finde es sehr beeindruckend, mir vorzustellen, dass also z.B. ein Knallgasgemisch aus Sauerstoff und Wasserstoff auch bei Raumtemperatur ohne Entzündung irgendwann wegreagieren würde, und zwar dann eben so langsam, dass man dabei nie einen Knall hören würde… - Genau weil nicht alle Teilchen gleich schnell sind, beginnt eine Reaktion auch nie schlagartig bei einer bestimmten Temperatur. - Mit der Geschwindigkeitsverteilung wird klar, dass es sehr schwierig, wenn nicht unmöglich ist, den absoluten Nullpunkt, 0 Kelvin, zu erreichen. Denn für den absoluten Nullpunkt muss man aus dieser wilden Menge von unterschiedlich schnellen Teilchen auch noch das hinterletzte zum Stillstehen bringen! (Man stelle sich eine Schulklasse aus ungefähr 1023 Schülern vor…). - Da es immer ein paar Teilchen hat, die mehr Bewegungsenergie hat als andere ist es z.B. auch möglich, Wäsche bei Temperaturen unter 0°C zu trocknen. Die Mehrheit der Teilchen gefriert dann zwar, aber ein paar wenige schaffen es auch immer noch in die Gasphase, und solange nicht 100% Luftfeuchtigkeit herrscht, wird die Wäsche langsam trocken. Lukas Sigrist Vergleich zur Geschwindigkeitsverteilung Sprachliche Erklärung: Teilchen bewegen sich unterschiedlich schnell. Wie bei einem Velorennen mit Massenstart kommen einige Fahrer schneller am Ziel an, einige haben etwas länger. Meist findet sich die Mehrheit der Fahrer aber im Feld ein, d. h. sie sind praktisch gleich schnell. Der Sieger jedoch ist meist alleine, danach kommen einige Verfolger, die ebenfalls schneller sind als das Feld. Hinter dem Feld folgen einzelne Gruppen von Fahrern, die einen Defekt hatten, oder einfach nicht mehr mithalten konnten. Genauso verhält es sich auch mit den Teilchen. Einige sind schneller, einige langsamer, doch die Mehrheit bewegt sich fast gleich schnell. Wie gewohnt spielt auch die Temperatur eine Rolle: Wenn die Teilchen zusätzliche Energie durch Wärme gewinnen, sind sie noch schneller als bei kälteren Temperaturen (Bild zeigen, Erklärungen,...). Amadeus Bärtsch 9. April 2016 Fachdidaktik Chemie ETH Katalyse & Reaktionsgeschwindigeit S. 17 Übung 4: Chemisches Gleichgewicht 1. Der Holzapfelkrieg: Eine Bildergeschichte von R. E. Dickerson & I. Geis, Chemie - eine lebendige und anschauliche Einführung, Verlag Chemie, Weinheim, S. 321f. (1981). a) Erfinden Sie eine Geschichte, die Sie im Unterricht zu den Bildern erzählen können. b) Welche Erkenntnisse sollten die Schülerinnen mit dieser Geschichte gewinnen? c) Wie können Sie das Prinzip von Le Châtelier mit dem Holzapfelkrieg veranschaulichen? d) Jeder Vergleich hinkt. Was ist in diesem Modell anders als in der Chemie? Bild 1: Bild 2: Bild 3: Amadeus Bärtsch 9. April 2016 Katalyse & Reaktionsgeschwindigeit S. 18 Fachdidaktik Chemie ETH Bild 4: 2. Welcher Zusammenhang besteht zwischen Reaktionsenthalpie und Reaktionsgeschwindigkeit? Bitte geben Sie eine einfache, kurze Antwort, die eine Schülerin versteht. 3. Experiment N2O4 2 NO2 a) Erklären Sie die Beobachtung so, dass es Schüler verstehen. b) Skizzieren Sie das Experiment auf der Modellebene. c) Warum ist die Spaltung von N2O4 endotherm? Erwartung: Dokument von 1 bis 2 Seiten Länge, das kleiner als 2 MB ist. Am liebsten im WordFormat, im Notfall als PDF. Abgabe bis spätestens Donnerstag, 14. April 2016, 15 Uhr per Mail an [email protected]. Amadeus Bärtsch 9. April 2016