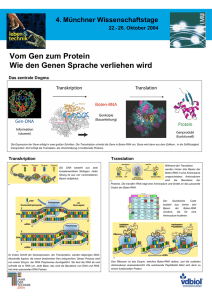
RNA Synthese und Splicing (Kapitel 28)
Werbung

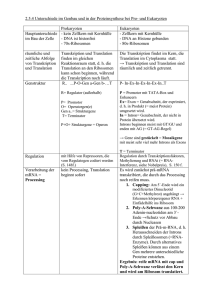
RNA Synthese und Splicing (Kapitel 28) 28.1 Transkription ist von der RNA-Polymerase katalysiert In E.coli: Die Untereinheitskomposition vom gesamten Enzym (-> Holoenzym ) ist ' Die -Untereinheit hilft eine Promoterstelle, wo die Transkription beginnt, zu finden. Die RNA Polymerase ohne diese Untereinheit (') heisst Kernenzym (core enzyme), sie hat eine katalytische Stelle. Die Transkription beginnt an den Promotern auf der TemplateDNA (Promotoren: DNASequenzen, die die RNAPolymerase an die richtige Initiationsstelle für die Transkription dirigieren.) Footprinting: Möglichkeit diese und andere Proteinbindungsstellen auf der DNA zu Charakterisieren. Zuerst wird ein Strang des DNAFragmentes am einen Ende mit 32P markiert. RNAPolymerase wird zugegeben. Der Komplex macht im Durchschnitt einen Schnitt pro Strang. Die entstehenden DNAFragmente werden auf Grund ihrer Grösse mit Elektrophorese separiert. Eine Serie Bände, die in der Kontrollprobe vorhanden sind, fehlen in dem mit der RNAPolymerase, weil RNAPolymerase DNA von Spalten abschirmt, welche die korrespondierenden Fragmente entstehen lassen. Zwei gebräuchliche Motive sind auf der 5'Seite an der Startseite vorhanden: 10Sequenz und 35Sequenz (positioniert bei ungefähr 10 resp.35 Nucleotiden aufwärts vom Start weg). Der Template Strang der DNA ist komplementär zum RNATranskript. Der kodierende Strand hat dieselbe Sequenz wie das RNATranskript, ausser Thymin (T) an Stelle von Uracil (U). Kodierender Strang: Sense-(+)-Strang, Template Strang: Antisense-(-)Strang. Der ' Kern der RNAPolymerase ist nicht im Stande eine Transkription an den Promoterstellen zu beginnen. Die -Untereinhait steuert die spezifische Initiation auf zwei Arten bei: 1. Senkt sie die Affinität der RNAPolymerase für generelle Regionen der DNA mit dem Faktor 104. 2. Befähigt die -Untereinheit die RNAPolymerase Promoterstellen zu erkennen. Die Promoterstelle wandert willkürlich in eine Dimension statt in drei. Die s-Untereinheit wird abgespalten, wenn die ursprüngliche RNAKette 9 oder 10 Nucleotide in der Länge ereicht hat. Danach kann es bei der Initiation eines anderen Kernenzymes helfen -> -Untereineit handelt katalytisch. Die -Untereinheit spielt also eine wesentliche Rolle in der Festlegung, wo die RNAPolymerase die Transkription beginnt. Jedes gebundene Polymerase Molekül entwindet ein 17bp-Segment der DNA, das zu 1.6 Umdrehungen der DNAHelix korrespondiert. Die Umwandlung vom geschlossenen Promoterkomplex (DNADopplelhelix) zum offenen Promoterkomplex (DNASegment entwunden) ist ein wichtiger Schritt in der Transkription. Die RNASynthese kann von Neuem starten auch ohne einen Primer. Die neusynthetisierten RNAKetten tragen einen destinktiven Tag am 5'Ende (pppG / pppA) -> RNAKetten wachsen in 5'-3'- Richtung. Die RNAPolymerase bleibt an sein Template gebunden, bis ein Terminationassignal erreicht wird. Die Region, die RNAPolymerase, DNA und ursprüngliche RNA enthält wird Transkriptionsblase genannt. Etwa 17bp der DNA werden entwunden während der Elongationsphase. Die Transkriptionsblase bewegt sich mit einer Geschwindigkeit von 170 Å (17nm)/sec fort. -> Elongationsrate von etwa 50 Nucleotiden/sec. Die RNAPolymerase korrigiert die ursprüngliche Polynucleotidkette nicht, folglich ist die Genauigkeit der Transkription viel tiefer als die der Replikation. In der Terminationsphase der Transkription, die Formation von Phosphodiesterverbindungen hört auf, der RNADNAHybrid dissoziert, die verschmolzene Region der DNA faltet sich wieder und die RNAPolymerase entlässt die DNA. Die transkriptierenden Regionen der TemplateDNA enthalten Stoppsignale, das einfachste: Palindromische GC-reiche Region gefolgt von einer AT-reichen Region. Die RNATranskription von diesem DNAPalindron ist selbstkomplementär, die Basen können sich zu einer Haarnadel mit Stiel und Kopf paaren. Guanin-Cytosin-Bindungen sind stabiler als A-T, weil sie eine H-Brücke mehr bilden -> die stabile Haarnadel ist gefolgt von einer Sequenz mit 4 oder mehr Uracilresten, welche auch entscheidend für die Termination sind -> die RNATranskriptase endet während oder gerade nach ihnen. Einige RNAMoleküle, die in vitro von RNAPolymerase synthetisiert wurden sind länger als die in vivo. Das fehlende Protein, welches die korrekte Termination verursacht wurde lokalisiert und Rho () genannt. Das Template enthält zumindest drei Terminationssstellen, die zu passt und eine die nicht zu passt. entdeckt zusätzliche Terminiationsstellen, die von der RNAPolymerase alleine nicht erkannt werden. hydrolisiert ATP in Gegenwart von einer EinzelstrangRNA, aber nicht in Gegenwart von DNA oder einer doppelten RNA. wird aktiviert durch Sequenzen in der ursprünglichen RNA, die reich an Cytosin und arm an Guanin sind. Eine Gemeinsamkeit von Proteinabhängiger und -unabhängiger Termination ist, dass die funktionierenden Signale in der neusynthetisierten RNA und nicht in der TemplateDNA liegen. In Prokaryonten wird die mRNA fast oder gar nicht modifiziert nach der Synthese durch die RNAPolymerase. Die tRNA und rRNA Moleküle hingegen werde durch die Clevage und andere Modifikationen der ursprünglichen RNAKetten generiert. Eine 2. Art von Vorgehen ist die Zufügung von Nucleotiden zu den Enden einiger RNAKetten. Eine 3. Art ist die Modifikation von Basen und Riboseeinheiten der rRNA. In Prokaryonten sind einige Basen der rRNA methylisiert. Ungewöhnliche Basen werden in allen tRNA Molekülen gefunden, sie werden geformt durch ein enzymatisches Modell eines Standard Ribonucleotides in einem tRNA Vorläufer. 28.2 Eukaryontische Transkription und Translation sind räumlich und zeitlich getrennt Die räumliche und zeitliche Trennung von Transkription und Translation ermöglicht Eukaryonten die Genexpression in viel mehr verwickelten Wegen zu regulieren. Fast alle mRNA Vorläufer in höheren Eukaryonten sind gespliced. Introns sind präzise ausgeschnittene kontinuierliche Informationen, Exons sind angehängt um reifen mRNAs mit kontinuierlichen Informationen zu formen. RNAPolymeraseI in den Nucleoli, wo es das Tandemaufgebot der Gene für 18S, 8S und 28SrRNA überschreibt. Alle anderen rRNAMoleküle und alle tRNAMoleküle sind durch RNAPolymeraseIII synthetisiert, im Nucleoplasma. RNAPolymeraseII, auch im Nucleoplasma synthetisiert die Vorläufer der mRNA und etliche kleine RNAMoleküle. In Prokaryonten sind Promotoren immer auf demselben Molekül der DNA des Genes, das sie regulieren -> Promotoren sind cis-handelnde Elemente. Eukaryonten und ihre Viren enthalten auch Enhancer, die die Effektivität der Promoteren enorm Steigern können. Die Position der Enhancers relativ zu den Promoterne ist nicht fixiert. Die DNASequenz der cis-handelnden Elementen sind Bindungsstellen für Proteine, Transkriptionsfaktoren. Es sind transhandelnde Faktoren, weil sie durch ein Gen auf einem DNAMolekül kodiert sein können, statt dass sie das Gen zur Regulation enthalten. Die TATABox ist das wichtigste cis-handelnde Element für die meisten Gene, die durch RNAPolymeraseII transkriptiert werden. Die TATABox ist notwendig aber nicht ausreichend für eine starke Promotorenaktivität. Viele Promotoren enthalten eine CAATBox, einige eine GCBox. Diese beiden können effektiv sein, wenn sie auf dem TemplateStrang sind. Die RNAPolymeraseII wird zur Startstelle von einem Set Transkriptionsfaktoren, TFII, begleitet. Die Initiation beginnt mit der Bindung TFIID (die einzelnen Faktoren werden TFIIA, TFIIB,... genannt) an die TATABox. Das wichtigste Startereignis ist die Erkennung der TATABox vom TATABox-bindenden-Protein (TBP). TBP ist ein sattelförmiges Protein mit zwei gleichen Domains. Die TATABox der DNA bindet an die konkave Oberfläche des TBP. TBP, das an die TATABox gebunden ist, ist das "Herz" des Initiationskomplexes. TFIIA ist rekrutiert, gefolgt von TFIIB und dann TFIIF- eine ATPabhängige Helicase, die die DNADuplex für die Polymerase separiert. Schliesslich folgen RNAPolymeraseII und dann TFIIE den anderen Faktoren und bilden den sog. Basal Transkriptionskomplex Die Aktivität vieler Promotoren in höheren Eukaryonten wird stark erhöht durch einen anderen Typ von einem cis-handelden Element, einem Enhancer. Enhancers haben keine eigene Promoteraktivität, sie können aber über mehrere 1000 Basenpaare hinweg stimulieren, egal ob upstream, downstream oder in Mitten eines transkiptierenden Genes. 28.3 Die Transkriptionsprodukte aller 3 eukaryontischen Polymerasen sind progressiv Das Zwischenprodukt einer RNAPolymerase wird pre-mRNA genannt. Die meisten pre-mRNA werden gespliced um Introns zu entfernen. Das 5'Triphosphatende der ursprünglichen RNAKette wird sofort modifiziert. Zuerst wird ein Phosphat durch Hydrolyse entlassen. Das 5'Diphosphatende greift dann das -Phosphoratom vom GTP an, um eine ungewöhnliche 5'-5'-Triphosphatbindung zu bilden -> dieser Terminus wird 5'Cap genannt. Caps tragen zur Stabilität der mRNAs bei, indem sie das 5'Ende vor Phosphatasen und Nucleasen schützen. Die meisten eukaryontischen mRNAs enthalten ein Polydenylat-(Poly(A))-Schwanz am 3'Ende. Die DNA kodiert diesen Poly(A)-Schwanz nicht. RNAEditing steht für die Änderung in der Basensequenz der RNA nach der Transkription durch andere Prozesse als RNASplicing. RNAEditing ändert ein einziges Codon (CAG) in der mRNA für den Glutamatrezeptor zu Arginin (CGG) Beim Splicing werden die Introns entfernt und die Exons zusammengehängt, um die finale mRNA zu bilden. Die korrekte Splicestelle muss klar gekennzeichnet sein: die Basensequenz eines Introns beginnt immer mit GU und endet immer mit AG. Die folgende Sequenz am 5'Splice ist AGGUAAGU (vergl. Figur 28.27). Am 3'Splice ist es eine Strecke von 10 Pyrimidinen, gefolgt von irgendeiner Base und dann einem C und schliesslich dem invariablen AG. Introne haben auch intern wichtige Stellen bei 20 und 50 Nucleotiden aufwärts von der 3'Splicestelle, die sog. Branch Stellen. Es wurde herausgefunden, dass Mutationen, die die Splicestellen betreffen 15% aller genetischen Krankheiten verursachen. Das Splicen der ursprünglichen RNA ist auf die Kooperation mehrerer kleine RNAs und Proteine angewiesen, die zusammen einen Komplex -> ein Spliceosom, bilden. Splicing beginnt mit der Spaltung der Phosphosdiesterbindung zwischen dem upstream Exon (Exon1) und dem 5'Ende des Introns. Eine 2',5'Phosphodiesterbindung wird zwischen diesen A Rest und dem 5'terminalen Phosphat des Introns gebildet. Der 3'-OH Terminus von Exon1 greift die Phosphodiesterbindung zwischen dem Intron und dem Exon2 an. Exon1 und Exon2 werden verbunden. Beide diese Reaktionen sind Transveresterungen, die Anzahl der Phosphordiesterverbindungen bleibt gleich während dieser Schritte. Der Nucleus enthält verschiedene Typen von kleine RNAs mit weniger als 300 Nucleotiden, welche snRNA (small nuclear RNA) genannt werden. Diese RNAMoleküle werden mit spezifischen Proteinen assoziiert um sog. SnRNPs zu bilden (small nuclar ribonucleoprotein particles; snurps). In Tierzellen beginnt das Splicing mit der Erkennung des 5'Splice durch U1snRNP. U2snRNP bindet dann an die brach Stelle im Intron, ein U4-U5U6-Komplex folgt diesem U1-U2-Komplex und dem mRNAVorläufer und bildet so ein vollständiges Spliceosom. U5 interagiert mit Exonsequenzen an der 5'Splicestelle und folglich mit dem 3'Exon. Dann löst sich U6 vom U4 und wird einer intermolekularen Neuanordnug unterzogen, welche eine Basenpaarung mit U2 erlaubt und U1 vom Spliceosom entfernt, durch interagieren mit dem 5'Ende des Introns. U2 und U6snRNPs sind wahrscheinlich die katalytischen Zentren des Spliceosoms. Alternative Splicing besorgt einen energiereichen Mechanismus um die Wendigkeit von Genomsequenzen auszudehnen und eine Möglichkeit für kombinatorische Kontrolle zu besorgen. 28.4 Entdeckung der katalytischen RNA Einige RNAMoleküle, wie 26SrRNAvorläufer der Tetrahymena, machen Selfsplicing in Abwesenheit von Proteinen. Self-Splicing Reaktionen benötigen ein zusätzliches Guansinnucleotid. G wirkt nicht als Angriffsgruppe sondern wird vorübergehend in der RNA aufgenommen. Das Intron bringt den Guanosincofaktor und die 5'Splicestelle so zusammen, dass die 3'-OHGruppe vom G nucleophil das Phosphoratom an der Splicestelle angreifen kann. -> Gruppe1-self-splicing. Gruppe2-self-splicing: die 2'-OH Gruppe von einem spezifischen Adenylat vom Intron wird angegriffen (vergl. Figur 28.37)