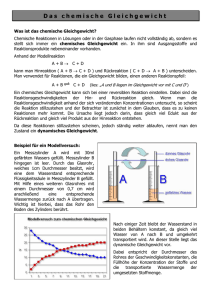
doc - ChidS
Werbung

Hinweis: Dieses Protokoll stammt von der Seite www.chids.de (Chemie in der Schule). Dort können unterschiedliche Materialien für den Schulunterricht heruntergeladen werden, unter anderem hunderte von Experimentalvorträgen so wie der vorliegende: http://online-media.uni-marburg.de/chemie/chids/veranstaltungen/uebungen_experimentalvortrag.html Philipps-Universität Marburg Fachbereich Chemie Sommersemester 2006 Seminar: Übungen im Experimentalvortrag Leitung: Prof. Dr. M. Bröring, Prof. Dr. U. Koert, Prof. Dr. B. Neumüller, Dr. P. Reiß Das chemische Gleichgewicht Von der unvollständigen Reaktion bis zur Gleichgewichtskonstante Vorgetragen am 29.06.2006 Vorgelegt von: Hanna Tuszynski Inhaltsverzeichnis 1 Einleitung............................................................................S.3 2 Reaktionsverständnis im Wandel der Zeit - Von der unvollständigen Reaktion bis zur Reversibilität...................S.4 Experiment 1: Fällung von Bariumchlorid a) Unvollständige Reaktion b) Umkehrbarkeit der Reaktion Berthollets Entdeckung 3 Einflüsse auf das Gleichgewicht - Das Prinzip vom kleinsten Zwang...............................................................................S.10 Demonstration 1: Reaktion von Kohlenstoffdioxid und Wasser Experiment 2: pH-Abhängigkeit der Löslichkeit von Kohlenstoffdioxid in Wasser Experiment 3: Druck-Abhängigkeit der Löslichkeit von Kohlenstoffdioxid in Wasser Sodawasser Experiment 4: Temperatur-Abhängigkeit der Löslichkeit von Kohlenstoffdioxid in Wasser Das Prinzip vom kleinsten Zwang 4 Das Massenwirkungsgesetz.............................................S.19 Experiment 6: Bestimmung der Dissoziationskonstante von Essigsäure Das Massenwirkungsgesetz: Geschichte, Herleitung und Anwendung 5 Ausblick.............................................................................S.26 Experiment 6: Verteilungsgleichgewicht Demonstration 2: Chromatographie 6 Schulrelevanz 7 Quellenverzeichnis............................................................S.31 2 1 Einleitung Das Wort Gleichgewicht begegnet uns in unserem Alltag in vielfältiger Bedeutung. In der Zeitung lesen wir davon, dass das ökologische Gleichgewicht gestört sei oder dass die UNO sich um ein machtpolitisches Gleichgewicht bemüht; wir können uns im seelischen Gleichgewicht befinden; Angebot und Nachfrage bestimmen das wirtschaftlichen Gleichgewicht. Der Begriff wird also in so unterschiedlichen Disziplinen wie Physik, Biologie, Psychologie, Politik, Wirtschaft und eben auch der Chemie verwendet. „Der Ausdruck Gleichgewicht bezeichnet den ausgeglichenen Zustand eines Systems bzw. ein System mit vernachlässigbaren Schwankungen. Das Wort kommt von der Balkenwaage, deren Waagbalken bei gleichem Gewicht auf beiden Seiten horizontal steht.“ 1 Es wird üblicherweise zwischen einem stationären und einem dynamischen Gleichgewicht unterschieden. Das chemische Gleichgewicht gehört zu letzteren Gruppe. „Ein dynamisches Gleichgewicht liegt stets dann vor, wenn in einem System zwei entgegengesetzt verlaufende Prozesse sich in ihrer Wirkung gerade aufheben.“ 2 Das chemische Gleichgewicht kann man wie folgt charakterisieren: „[...] ein Zustand, bei dem keine weitere Änderung der Zusammensetzung des Reaktionsgemisches erfolgt [...] nennt man chemisches Gleichgewicht“.bei dem keine weitere Änderung der Zusammensetzung des Reaktionsgemisches erfolgt 3 [...] nennt man chemisches Gleichgewicht“ Die üblicherweise erste Assoziation - zum Thema „Gleichgewicht“ – ganz im Sinne der Wortherkunft- ist die Balkenwaage. Da sich dort aber ein statisches Gleichgewicht einstellt und daher also nicht als Modell für die hier betrachteten dynamischen Vorgänge taugt, erscheint es auch nicht sinnvoll, die Balkenwaage wie häufig üblich als Symbol zu verwenden. 1 wikipedia.de (27.07.2006) ebd. 3 Riedel, 1999. S. 264f 2 3 Stattdessen wurde das Bild „Schwankendes Gleichgewicht“ des Deutsch-Schweizer Kunstmalers Paul Klee gewählt. (*1879 †1940). Paul Klee, der sich ausgiebig mit dem Begriff „Gleichgewicht“ auseinander setzte, sagte dazu: „Das Gleichgewicht ist eine Bewegung von der Lotrechten weg, welcher immer eine ent-sprechende Gegenbewegung gegenübersteht.“ 4 Abb. 1 Klee: Schwankendes Gleichgewicht (1922) 2 Reaktionsverständnis im Wandel der Zeit -Von der unvollständigen Reaktion bis zur Reversibilität Um den schwierigen Weg bis Erkenntnis des Gleichgewichtscharakters von chemischen Reaktion zu verstehen, muss man einen Blick zurück in die Vergangenheit werfen. Bis zum 18. Jahrhundert war die Vorstellung vom Ablauf chemischer Prozesse durch die alchemistische Sichtweise geprägt. Die Alchemie ist eine Naturphilosophie und chemische Reaktionen wurden dementsprechend von ihren Anhängern als mystische Stoffumwandlungen verstanden. Die Reaktionen wurden häufig in Analogie zum menschlichen Leben Abb. 2 S. Michelspacher: Cabala, Spiegel der Kunst und Alchymia ..., 1615 gesetzt – so sprach man von der „chemischen 4 www.kah-bonn.de (27.07.2006) 4 Hochzeit“. Im 18. Jahrhundert kam es dann zu einer Verwissenschaftlichung und zur Ausbildung der heutigen Naturwissenschaften. Vor allem in der Physik wurden bahnbrechende Entdeckungen gemacht. Chemische Reaktionen wurden nun anhand der Affinitätstheorie bzw. Verwandtschaftslehre erklärt. Der Begriff der Affinität wurde wohl schon im 13. Jahrhundert von Albertus Magnus eingeführt, gelangte aber erst im 18. Jahrhundert zu folgender Bedeutung: Unter der Affinität einen Stoffes bzw. Elementes verstand man eine stoffspezifische, von anderen Parametern unabhängige Größe. Man stellte sie sich analog zur von Newton entdeckten Anziehung von Massen vor. Man tabellierte die relativen Affinitäten, wie in Abb. 4 zu sehen ist. Die in Abb. 3 J. D. Mylius: Anatomiae auri sive tyrocinium medicoChymicum ..., 1628 den Spalten stehenden Elemente sollen in absteigender Affinität mit dem jeweiligen Element der obersten Reihe reagieren. Aus der Affinitätstheorien ergaben sich, vor allem aus heutiger Sicht, zwei sehr interessante Konsequenzen für die Natur von chemischen Reaktionen: I. Chemische Reaktionen laufen immer vollständig ab. II. Chemische Reaktionen laufen nur in eine Richtung ab. Diese zwei Grundpfeiler werden nun im ersten Experiment untersucht. Abb. 4 Enzyklopädie (18. Jh.) oben: Labor; unten: Affinitätstabelle 5 Experiment 1: Fällung von Bariumchlorid a) Unvollständige Reaktion Chemikalien: Substanz Gefahrenzeichen R-Sätze S-Sätze K2CrO4(aq) T, N* 49-46-36/37/38-43- 53-45-60-61* 50/53* (c = 0,1 mol/L) K2Cr2O7(aq) T+, N* (c = 0,2 mol/L) 49-46-E21-E25- 53-45-60-61* E26-37/38-41-4350/53* BaCl2(aq) T* 20-25* 45 -- -- -- (c = 0,5 mol/L) Wasser Geräte: 4 (6) Demonstrationsreagenzgläser, Demonstrationsreagenzglasständer, 4 Messzylinder (25 mL), Wasserbad (heizbarer Magnetrührer, Becherglas (300 mL)), Durchführung: In je 2 Reagenzgläser wird mithilfe eines Messzylinders 20 mL der Kaliumchromatbzw. Kaliumdichromat-Lösung eingefüllt. Nun gibt man wiederum mithilfe eines Messzylinders in je ein Reagenzglas mit Kaliumchromat- bzw. KaliumdichromatLösungen 20 mL Bariumchlorid-Lösung. Die beiden mit Bariumchlorid versetzen Reagenzgläser werden in ein vorgeheiztes Wasserbad gegeben. Man vergleicht die Farbigkeit der ursprünglichen Lösungen mit denen, die mit Bariumchlorid versetzt und im Wasserbad erhitzt wurden. Da der Vorgang eine Weile dauert, empfiehlt es sich – wie im Vortrag – letztgenannte Lösungen schon vorbereitet griffbereit zu haben. * Die Angaben beziehen sich auf die Reinsubstanz. 6 Beobachtungen: Kaliumchromat-Lösung weist eine gelbe und Kaliumdichromat-Lösung eine orange Färbung auf. Nach der Zugabe von BariumchloridLösung ist in beiden Reagenzgläsern eine deutliche Niederschlagsbildung zu erkennen. Diese wird durch Erhitzen beschleunigt. Nach dem Erhitzen und Absetzen des Niederschlages erkennt man, dass der Überstand in dem ursprünglich mit gelber Kaliumchromat-Lösung gefüllten Reagenzglas farblos ist, wohingegen der Überstand in dem ursprünglich mit oranger Abb. 5 links: K2CrO4 rechts: + BaCl2. Kaliumdichromat-Lösung gefüllten Reagenzglas deutlich orange gefärbt ist. Auswertung: Chromat bzw. Dichromat sind aufgrund einer Charge-TransferAbsorption stark farbige Ionen. Bei der Reaktion von Chromat bzw. Dichromat mit BariumKationen, fällt das schwerlösliche Bariumchromat aus. (KL = 1,17 · 2 10-10 mol2/L ). (1) Ba 2+ (aq) + (2) 2 Ba 2(aq) CrO4 2+ (aq) + BaCrO4(s) 2(aq) + Cr2O7 + (aq) H2O(l) 2 BaCrO4(s) + 2H Abb. 6 links: K2Cr2O7 rechts: + BaCl2. Die unterschiedliche Stöchiometrie der Reaktionen wird durch die Verwendung doppelt so konzentrierter Dichromat-Lösung ausgeglichen. Bei der Reaktion von Kaliumchromat mit Bariumchlorid bleibt ein farbloser Überstand zurück. Dies ist ein Indiz dafür, dass so gut wie keine Chromat-Ionen mehr in Lösung sind und somit die Reaktion nahezu vollständig abgelaufen ist. Dies wäre also eine Reaktion, die im Einklang mit der Affinitätstheorie stünde. Bei der Reaktion von Kaliumdichromat mit Bariumchlorid allerdings bleibt der Überstand orange gefärbt. Es sind also immer noch eine größere Anzahl DichromatIonen in Lösung. Die Reaktion verläuft nur unvollständig und dass obwohl ein Überschuss an Barium-Kationen vorhanden war. Diese Beobachtung widerlegt Behauptung I der Affinitätstheorie. 7 Experiment 1: Fällung von Bariumchlorid b) Umkehrbarkeit der Reaktion Chemikalien: Substanz Gefahrenzeichen R-Sätze S-Sätze C 34-37 26-36/37/39-45 s. Experiment 1a HCl(aq) (konz.) Geräte: s. Experiment 1a; 1 Glasstab, 1 Schliffflasche mit Stopfen (50 mL) Durchführung: In das Reagenzglas aus Experiment 1a, in dem Bariumchromat aus einer Kaliumchromatlösung gefällt worden ist, gibt man ca. 20 mL konz. Salzsäure hinzu. Man rührt mit dem Glasstab um. Beobachtungen: Der Niederschlag löst sich nach Zugabe der Salzsäure auf und der vormals klare Überstand wird orange. Es ist die gleiche Farbe wie in der Vergleichsprobe mit Kaliumdichromat-Lösung. Auswertung: Durch das Ansäuern gehen Dichromat-Ionen in Lösung, deutlich erkennbar an der orangen Farbe (Chromat-Ionen sind nur bis zu einem pH > 6 vorhanden.) (3) 2 BaCrO4(s) + 2H (2) Ba 2+ (aq) + + (aq) BaCrO4(s) 2(aq) + Cr2O7 + (aq) H2O(l) 2 BaCrO4(s) + 2H Vergleicht man diese Reaktionsgleichung mit der Reaktionsgleichung (2) aus Experiment 1 a so fällt auf, dass genau die gleichen Reaktionspartner in gleicher Stöchiometrie miteinander reagieren – nur sind Edukte und Produkte vertauscht. Die Reaktion kann also in beide Richtungen ablaufen. Daher kann man die Reaktion auch mit einem Gleichgewichtspfeil beschreiben: 8 (4) Ba 2+ (aq) + 2(aq) + Cr2O7 + (aq) H2O(l) 2 BaCrO4(s) + 2H Somit ist auch Behauptung II widerlegt. Die Affinitätstheorie ist falsch! Berthollets Entdeckung Claude Louis Berthollet (*1748 †1822), ein französischer Chemiker und Arzt begleitete Napoleon 1798 nach Ägypten und machte dort folgenschwere Beobachtungen an Natronseen. Er erkannte, dass sich Natriumcarbonat als Krusten am Ufer dieser in Hitzeperioden häufig austrocknenden Seen abschied. Er formulierte folgende Reaktion - wenn auch natürlich nicht in der erst später eingeführten Formelschreibweise: Abb. 7 C.L. Berthollet (5) 2 NaCl(aq) + CaCO3(aq) Na2CO3 + CaCl2 Natriumchlorid + Kalkstein Natriumcarbonat + Calciumchlorid (Seewasser) (Seegrund) (Krusten am Ufer) (See) Abb. 8: Natronsee in Ägypten (Modell) Das Entscheidende an dieser Beobachtung Berthollets war, dass zwar eine Reaktion der verschiedenen Reaktionspartner bekannt war, aber laut der Affinitätstheorie die Reaktion ausschließlich in die andere Richtung verlaufen sollte. Berthollet verfolgte diesen Gedanken weiter und zog neben vielen falschen Schlüssen auch den richtigen, dass die Reaktionsrichtung von äußeren Parametern beeinflussbar ist. Er identifizierte die „Masse“ der an der Reaktion beteiligten Stoffe als einen solchen Parameter – heute würde man präziser von Konzentration bzw. Aktivität sprechen. Seine Erkenntnisse veröffentlichte Berthollet in seinen Büchern „Recherches sur le lois de l‘affinité“ (1801) und „Essai de statique chimique“ (1805). 9 Den Vorgang am Natronsee würde man heute so erklären: Auch hier liegt natürlich – wie bei allen chemischen Reaktionen – ein Gleichgewicht vor. Zwar liegt dieses unter Standardbedingungen weit auf der linken Seite, wenn aber das Natriumcarbonat kontinuierlich aus dem Gleichgewicht entfernt wird – was durch die Krustenbildung der Fall war – so verschiebt sich das Gleichgewicht nach rechts. Abb. 9 Erkundung der Natronseen im Januar 1799 3 Einflüsse auf das Gleichgewicht - Das Prinzip vom kleinsten Zwang Berthollet hatte die „Masse“ als beeinflussenden Parameter erkannt; in den folgenden Experimenten soll die Verschiebung der Gleichgewichtslage durch unterschiedliche Faktoren anhand des Systems Kohlenstoffdioxid/Wasser untersucht werden. Demonstration 1: Reaktion von Kohlenstoffdioxid und Wasser Chemikalien: Substanz Gefahrenzeichen R-Sätze S-Sätze CO2(g) - - - Lebensmittelfarbe - - - Wasser - - - 10 Geräte: Gasflasche, Gaswaschflasche, Spritze mit Kanüle (20 mL), Schlauch, Eudiometer, Kristallisierschale ( 19 cm), Stativmaterial Durchführung: Das Eudiometer und die Kristallisierschale werden mit angefärbten Wasser gefüllt und als pneumatische Wanne aufgebaut. Die Spritze wird mit Kohlenstoffdioxid befüllt. Mithilfe des Schlauches wird nun das Kohlenstoffdioxid langsam in das Eudiometer eingeleitet. Beobachtungen: Im Eudiometer kann man aufsteigende Blasen beobachten. Nach der Einleitung kann man ein Gasvolumen von ca. 5 mL ablesen. Auswertung: Da nur ein Teil des durchgeleitenden Kohlenstoffdioxids als Gasblase im Eudiometer zu erkennen ist, muss das restliche Gas mit dem Wasser reagiert haben. Kohlenstoffdioxid und Wasser reagieren in folgender Weise miteinander: (6) CO2(g) CO2(aq) (7) CO2(aq) + 2 H2O(l) HCO3- (aq) + H3O+(aq) (8) HCO3- (aq) + H2O(l) CO32- + H3O+(aq) Die eigentlich zu erwartende Kohlensäure H2CO3 lässt sich in wässriger Lösung nicht isolieren und dissoziiert sofort in die Carbonate. Daher wird sie bei den Betrachtungen in dieser Arbeit außer Acht gelassen. 99,8 % des in Wasser gelösten Kohlenstoffdioxid liegen als physikalisch gelöste Moleküle vor. (Gleichung (6)). Nur die restlichen 0,2 % dissoziieren in Carbonat und Hydrogencarbonat, sind also chemisch gelöst. Für den massen- dementsprechend und auch volumenmäßig nicht das größten Anteil der Massenwirkungsgesetz Löslichkeit des gilt chemischen Gleichgewichts, sondern das Henry-Gesetz, das die Löslichkeit von Gasen in Abhängigkeit des Partialdruckes und der Konzentration beschreibt. 11 (9) KH = cw/p (KH = Henry-Koeffizient; cw = Konzentration in der Lösung; p = Partialdruck Da es aber in diesem wie in den folgenden Experimenten nur um qualitative Betrachtungen geht, die bei diesem Gleichgewicht die gleiche Anwendung finden, wird dieser Umstand vernachlässigt. Experiment 2: pH-Abhängigkeit der Löslichkeit von Kohlenstoffdioxid in Wasser Chemikalien: Substanz Gefahrenzeichen R-Sätze S-Sätze CO2(g) - - - NaOH(aq) C 34 26-36/37/39-45 Xi 36/37/38 26 c = 1 mol/L HCl(aq) c = 1 mol/L Geräte: Gasflasche, Gaswaschflasche, Saugflasche (100 mL), Stopfen, Kolbenprober mit Hahn (100 mL), Schlauch, Silikon, Magnetrührer, Rührfisch, Spritze mit Kanüle (10 mL), Messpipette (10 mL), Peleusball, Stativmaterial Durchführung: Der Kolbenprober wird mit 100 mL Kohlenstoffdioxid befüllt und mithilfe eines Schlauchstücks luftdicht mit der Saugflasche verbunden. Der Hahn ist geschlossen. Zur Verbesserung der Abdichtung werden die Übergänge mit Silikonmasse bestrichen. In die Saugflasche werden 10 mL Natronlauge pipettiert und ein Rührfisch gegeben. Nun wird der Hahn so geöffnet, dass eine Verbindung zwischen Kolbenprober und Saugflasche besteht. Die Apparatur wird mit 50 mL des im Kolbenprober vorhandenen Kohlenstoffdioxids gespült. Nun wird die Saugflasche mit 12 einem Stopfen verschlossen und der unter der Saugflasche befindliche Magnetrührer angestellt. Nach der ersten Reaktion wird mit der Spritze schnell 10 mL Salzsäure in die Saugflasche hinzugegeben. Beobachtungen: Sobald die Saugflasche verschlossen und der Magnetrührer eingeschaltet ist, wird der Stempel in den Kolbenprober hineingezogen. Nach der anschließenden Zugabe von Salzsäure wird er wieder herausgedrückt. Auswertung: Hier liegen wieder die in Demonstration 1 betrachteten Gleichgewichte zwischen ungelösten und (physikalisch) gelösten Kohlenstoffdioxid, letzterem und Hydrogencarbonat und Carbonat vor. In den Gleichungen (7) und (8) sind jeweils Oxonium-Ionen beteiligt. Diese werden durch die Hydroxid-Ionen der Natronlauge neutralisiert. (10) OH-(aq) + H3O+(aq) 2 H2O Dadurch verschieben sich die Gleichgewichte (7) und (8) auf die rechte Seite und in Folge davon auch (6). Durch den nun entstehenden Unterdruck wird der Stempel in den Kolbenprober hineingezogen. (11) CO2(g) CO2(aq) (12) CO2(aq) + 2 H2O(l) HCO3- (aq) + H3O+(aq) (13) HCO3- (aq) + H2O(l) CO32- + H3O+(aq) Gibt man nun Salzsäure hinzu, sind wieder mehr Oxonium-Ionen im Reaktionssystem vorhanden und die Gleichgewichtslage wird wieder mehr nach links verschoben. Der Stempel wird herausgedrückt. 13 Experiment 3: Druck-Abhängigkeit der Löslichkeit von Kohlenstoffdioxid in Wasser Chemikalien: Substanz Gefahrenzeichen R-Sätze S-Sätze Sodawasser - - - Lebensmittelfarbe - - - Geräte: Saugflasche (100 mL), Stopfen, Kolbenprober (100 mL), Schlauch, Silikon, Stativmaterial Durchführung: Der Kolbenprober wird mithilfe eines Schlauchstücks luftdicht mit der Saugflasche verbunden. Zur Verbesserung der Abdichtung werden die Übergänge mit Silikonmasse bestrichen. In die Saugflasche werden ca. 50 mL mit Lebensmittelfarbe angefärbtes Sodawasser gegeben und diese anschließend mit einem Stopfen verschlossen. Nun zieht man kräftig am Stempel des Kolbenprobers. Beobachtungen: Beim Herausziehen des Stempels, das eine gewisse Kraftanstrengung erfordert, kann man eine Blasenbildung im Sodawasser erkennen. Diese kommt zum Stillstand, wenn man keine Kraft mehr auf den Kolbenprober ausübt. Auswertung: In diesem Experiment wird eigentlich nur das Gleichgewicht zwischen ungelösten und (physikalisch) gelösten Kohlenstoffdioxid betrachtet. (Gleichung (6)) Durch den erzeugten Unterdruck verringert sich der Partialdruck des Kohlenstoffdioxids und das gelöste Kohlenstoffdioxid geht vermehrt in die Gasphase (Blasen) über. Das Gleichgewicht verschiebt sich nach links. Natürlich verschieben sich auch die „chemischen“ Gleichgewichte (7) und (8), dies kann aber im Experiment nicht direkt beobachtet werden. 14 (14) CO2(g) CO2(aq) (15) CO2(aq) + 2 H2O(l) HCO3- (aq) + H3O+(aq) (16) HCO3- (aq) + H2O(l) CO32- + H3O+(aq) Sodawasser Dem gebürtigen Engländer und späteren Amerikaner Joseph Priestley (*1733 † 1804) verdankt die Menschheit die Erfindung des mit „Kohlensäure“ versetzen Mineralwassers. Der Theologe, Philosoph, Chemiker und Physiker entwickelte das Verfahren, wobei man mithilfe von Druck Wasser „sprudelig“ macht. Er bekam dafür Copley Medal der englischen Royal Society. Heute kann jeder Verbraucher, sofern er das möchte, sein eigenes Mineralwasser herstellen Abb. 10 J. Priestley - es gibt zahlreiche Trinkwassersprudler wie den WasserMaxx oder SodaStream. Das Kohlenstoffdioxid muss dabei in kleinen, unter Druck stehenden Gaspatronen erworben werden. Abb. 11 links: Apparatur zur Bereitung künstlicher Mineralwässer aus dem 18./19. Jh. rechts: moderner Trinkwassersprudler 15 Experiment 4: Temperatur-Abhängigkeit der Löslichkeit von Kohlenstoffdioxid in Wasser Chemikalien: Substanz Gefahrenzeichen R-Sätze S-Sätze CO2(g) - - - NaOH(aq) Xi 36/38 26 - - c = 0,01 mol/L Methylrot (pH 4,4 – 6,2) NaCl(s) - - - Eis - - - ention. Wasser - - - Geräte: Gasflasche, Gaswaschflasche, Stativmaterial, 2 Erlenmeyerkolben (100 mL), 2 Luftballons, Kolbenprober mit Hahn (100 mL), Becherglas (300 mL), 2 Pasteurpipetten, Saughilfe, Glasstab, Messzylinder (50 mL), Bunsenbrenner, Feuerzeug, Dreifuß, Drahtnetz; Kristallisierschale ( 19 cm), Durchführung: In dem Becherglas werden 200 mL entionisiertes Wasser mit ca. 1 mL Indikatorlösung versetzt. Nun tropft man so lange verdünnte Natronlauge hinzu, bis der Indikator von rot nach gelb umgeschlagen ist. Von dieser Lösung werden jetzt je 30 mL in die Erlenmeyerkolben gefüllt. Ein Erlenmeyerkolben wird mit einem Luftballon verschlossen und zum Farbvergleich beiseite gestellt. Der Kolbenprober wird mit 5 mL Kohlenstoffdioxid befüllt und dann auf 50 mL mit Luft aufgezogen. Diese Kohlenstoffdioxid-Luft-Mischung gibt man nun in den zweiten Erlenmeyerkolben, der dann umgeschwenkt und auch mit einem Luftballon verschlossen wird. Dieser Kolben wird nun mithilfe des Bunsenbrenners erhitzt. Anschließend wird er in ein Eisbad (Kristallisierschale mit Kältemischung aus Eis und Natriumchlorid) gestellt. 16 Beobachtungen: Der Indikator der Lösung im Erlenmeyerkolben schlägt nach der Zugabe von Kohlenstoffdioxid nach rot um. Nachdem man das Reaktionsgefäß eine Weile erhitzt hat kann man eine Blasenbildung in der Flüssigkeit beobachten. Außerdem bläht sich der Luftballon und der Indikator schlägt wieder nach gelb um. Nachdem man den Kolben nun in der Kältemischung gestellt hat, fällt der Luftballon wieder in sich zusammen und die Indikatorfarbe wechselt erneut nach rot. Auswertung: Die Löslichkeit von Gasen ist stark temperaturabhängig. Sowohl die Massenwirkungs- wie auch die Henry-Konstante sind temperaturabhängig. Die meisten Gase, und so auch Kohlenstoffdioxid, lösen sich bei höherer Temperatur schlechter, wobei hier v.a. die Henry-Konstante zu beachten ist. Der Lösungsvorgang ist also exotherm. Die gelbe Farbe der ursprünglichen Lösung zeigt einen pH-Wert von über 6,2 an. Durch die Zugabe von Kohlenstoffdioxid nimmt die Oxonium-Ionen-Konzentration zu (Gleichgewichte (7) und (8)) und der Indikator schlägt nach rot um. Durch eine Erhöhung der Temperatur wird das Gleichgewicht auf die linke Seite verschoben. Gelöstes Gas wird wieder frei und kann als Blasen beobachten werden bzw. füllt den Luftballon. (Gleichung (14)) Dadurch verschieben sich auch die Gleichgewichte (15) und (16) und die Oxoniumkonzentration nimmt wieder ab. Der Indikator schlägt wieder nach gelb um, (14) CO2(g) CO2(aq) H<0 (15) CO2(aq) + 2 H2O(l) HCO3- (aq) + H3O+(aq) (16) HCO3- (aq) + H2O(l) CO32- + H3O+(aq) Bei der Abkühlung verläuft dann die Reaktion genau in umgekehrter Richtung und der Indikator wird wieder rot. 17 Das Prinzip vom kleinsten Zwang „Übt man auf ein chemisches System im Gleichgewicht einen Zwang aus, so reagiert es, indem sich der Zwang verkleinert.“bei dem keine weitere Änderung der 5 Zusammensetzung des Reaktionsgemisches erfolgt [...] nennt man chemisches Gleichgewicht“ Das Prinzip vom kleinsten Zwang hat Henry Louis Le Chatelier 1884 in seinem Aufsatz „Sur un énoncé général des lois de équilibres chimique“ veröffentlicht. Zwar fasste er dort eigentlich nur Erkenntnisse anderer Forscher zusammen, aber ein universell gültiges Prinzip, das dazu noch durch seiner Einfachheit und leichte Anwendbarkeit besticht, war noch nicht formuliert worden. 1888 findet der deutsche Physiker Ferdinand Braun eine griffigere Formulierung als Le Chatelier, deshalb wird es in Folge auch manchmal Le-Chatelier- Abb. 12 H. Le Chatelier Braun-Prinzip genannt. Als „Zwänge“ auf ein System können angesehen werden a) Konzentrationsänderung (Experiment 2) b) Druckänderung (Experiment 3) c) Temperaturänderung (Experiment 4) Als Beispiel sei hier die Temperaturänderung erläutert. Im Experiment 4 ist die Reaktion exotherm, wenn sie von rechts nach links abläuft. Erhöht man nun die Temperatur, so verschiebt sich das Gleichgewicht nach rechts, da das System dem „Zwang“ Wärmezufuhr dadurch verkleinert, das nun die endotherme Reaktionsrichtung bevorzugt abläuft. 5 wikipedia.de (21.07.2006) 18 4 Das Massenwirkungsgesetz Experiment 6: Bestimmung der Dissoziationskonstante von Essigsäure Chemikalien: Substanz Gefahrenzeichen R-Sätze S-Sätze Essigsäure (konz.) C 10-35 23.2-26-36/37/39- c = 17,49 mol/L) ention. Wasser 45 - - - Geräte: Becherglas (250 mL), Bürette (25 mL), pH-Elektrode, Vollpipette (50 mL), Peleusball, Glastrichter ( 3,5 cm), Magnetrührer, Rührfisch, Stativmaterial, Haushaltsfolie Durchführung: Es werden 100 mL entionisiertes Wasser in das Becherglas pipettiert. Muss dieses, wie im Vortrag, längere Zeit stehen, so wird es mit Haushaltsfolie verschlossen, um die Verdunstung möglichst gering zu halten. Nun wird die Bürette mit konzentrierte Essigsäure mithilfe des Glastrichters befüllt. Das Becherglas wird auf einem Magnetrührer unter die Bürette gestellt und mittels eines Rührfisches gerührt. Nun wird 1 mL Essigsäure aus der Bürette in das Becherglas gegeben und der pHWert der Lösung wird mit einem pH-Meter gemessen. Jetzt werden 2 weitere mL dazugegeben, so das sich dann also 3 mL konz. Essigsäure in der Lösung befinden. Es wird erneut der pH-Wert gemessen. Ebenso verfährt man bei Zugabe von weiteren 2, 5, und 10 mL bzw. insgesamt 5, 10 und 20 mL. Bei der Durchführung im Labor wurden noch zwei weitere Messwerte aufgenommen. Beobachtungen: Folgende Messwerte wurden während des Vortrages bzw. im Sommersemester 2007 im Labor aufgenommen: 19 Messreihe Vortrag V(HOAc) / mL c(HOAc) / (mol/L) pH c(Protonen)/ (10-3 mol/L) 1 0,17 2,47 3,39 3 0,51 2,19 6,46 5 0,83 2,05 8,91 10 1,59 1,87 13,5 20 2,92 1,67 21,4 V(HOAc) / mL c(HOAc) / (mol/L) pH c(Protonen)/ (10-3 mol/L) 1 0,17 2,50 3,16 3 0,51 2,30 5,01 5 0,83 2,22 6,03 7 1,14 2,15 7,08 10 1,59 2,09 8,13 15 2,28 2,01 9,77 20 2,92 1,96 12,2 Messreihe Labor Die Errechnung der Konzentration der Essigsäure c(HOAc) erfolgte mittels der Formel: V ( HOAc) 17 , 49mol / L i. c ( HOAc) 100mL V ( HOAc) Die Messwerte können auch graphisch aufgetragen werden. Die Wurzel der Konzentration der Essigsäurekonzentration wird dabei auf die Abszisse, die Konzentration der Protonen auf die Ordinate eingetragen. 20 Diagramm 1 Vortrag Diagramm 2 Labor 21 Auswertung: Essigsäure dissoziiert in Wasser zu Protonen bzw. Oxonium-Ionen und Acetat. CH3COOH H+ + CH3COO- (17) Dieses geschieht aber nicht vollständig, da Essigsäure eine schwache Säure ist. Wie man aber aus den Diagrammen 1 und 2 erkennen kann, besteht ein linearer Zusammenhang zwischen der Wurzel der Essigsäurekonzentration und dem pHWert bzw. der Protonenkonzentration. Es lässt sich eine Ausgleichsgerade durch den Nullpunkt legen. Eine Gerade, die durch den Nullpunkt geht, lässt sich durch folgende allgemeine Gleichung beschreiben: ii. y m x In dem hier untersuchten Fall gilt dann also: iii. c (H ) m c ( HOAc) Formt man nun nach der Konstanten um und quadriert die Gleichung, erhält man: iv. m 2 c 2 ( H ) c ( HOAc) Nun gilt für die Reaktion (17) aber wegen der Ladungsneutralität, dass v. c(H+) = c(Ac-) ist. Setzt man nun Gleichung v. in iv. ein so erhält man: vi. m 2 c ( H ) c ( Ac ) c ( HOAc) Da m eine Konstante ist, enspricht vi. der Massenwirkungsgesetz-Gleichung. Man kann nun die Dissoziations- bzw. Säurekonstante für Essigsäure ausrechnen. vii. K s c ( H ) c ( Ac ) m 2 c ( HOAc) Für die Messreihe während des Vortrages erhält man: 22 viii. K v s 1 , 3 10 4 mol / L und für die im Labor erstellte: ix. K L s 4 , 4 10 5 mol / L Der Literaturwert für die Dissoziationskonstante von Essigsäure beträgt 1,76 10-5 mol/L. Zumindest im Laborversuch wurde also die gleiche Größenordnung gefunden, bei beiden Versuchen Essigsäure als schwache Säure charakterisiert. Der bessere Wert im Labor lässt sich wohl durch die höhere Anzahl der Messpunkt sowie sorgfältigeres Arbeiten erklären; auch Raumtemperaturunterschiede könnten eine Rolle gespielt haben. Abgesehen von solchen technischen Fehlerquellen beinhalten die Herleitung des Massenwirkungsgesetzes auf diese Art und Weise eine didaktische Vereinfachung, die nicht unerwähnt bleiben soll. Im „richtigen“ Massenwirkungsgesetz steht die Gleichgewichtskonzentration der Essigsäure und nicht die Ausgangskonzentration wie in diesem Experiment. Der numerische Unterschied sollte aber so gering sein, dass er vernachlässigbar ist. Das Massenwirkungsgesetz: Geschichte, Herleitung und Anwendung Für eine chemische Reaktion mit der Reaktionsgleichung (18) aA + bB cC + dD gilt, dass der Quotient des Produkts der Konzentrationen der Produkte und des Produkts der Konzentrationen der Edukte konstant ist. Die stöchiometrischen Koeffizienten fungieren hierbei als Exponenten. Diese Gesetzmäßigkeit nennt man das Massenwirkungsgesetz. 23 x. K c c ( C ) c d (D ) c a ( A ) c b (B ) Die französischen Chemiker L. Péan de Saint-Gilles und Marcelin Berthelot unternahmen in den Jahren 1860 bis 1865 zwar die ersten umfassenden Studien zum chemischen Gleichgewicht- sie untersuchten dazu die Bildung und den Zerfall von Estern - die Formulierung eines allgemein gültigen Gesetzes gelang ihnen jedoch noch nicht. Dazu waren erst die beiden Norweger Cato Maximilian Guldberg, Chemiker und Mathematiker, und sein Schwager Peter Waage, Chemiker, in der Lage. Erst sie hatten die Idee, nicht die absoluten Abb. 13 C. Guldberg und P. Waage Massen der Edukte, sondern nur die Stoffmengenkonzentration, im damaligen Sprachgebrauch „aktive Masse“ genannt, zu verwenden. Im Schulunterricht wird das Massenwirkungsgesetz häufig auf kinetischem Weg abgeleitet. Im Gleichgewicht gilt für die Reaktion (18): xi. v hin v rück Daraus folgt, wenn die stöchiometrischen Koeffizienten gleich 1 sind: xii. k hin c ( A ) c (B ) k rück c ( C ) c (B ) Durch Umformung erhält man das Massenwirkungsgesetz: xiii. K c ( C ) c (D ) c ( A ) c (B ) k k hin rück 24 Guldberg und Waage haben das Massenwirkungsgesetz zwar empirisch auch auf dem kinetischen Weg gefunden, korrekt ist die Herleitung trotzdem nicht. Die Stöchiometrie einer Reaktionsgleichung und die Ordnung der Reaktion sind nicht zwingend miteinander verknüpft und daher lässt sich über den kinetischen Weg der Zusammenhang zwischen den stöchiometrischen Koeffizienten und den Exponenten im Massenwirkungsgesetz nicht allgemeingültig herleiten. Dies ist aber auf thermodynamischen Wege möglich. Mithilfe eines Gedankenexperiments zu adiabatischen Kompression bzw. Expansion eines Gases kommt man von der Definition der freien Enthalpie xiv. G H TS zu der Beziehung xv. G 0 RT ln p c ( C ) p d (D ) p a ( A ) pb ( B ) RT ln K p Es gibt also eine einfache Beziehung zwischen der freien Enthalpie und der Gleichgewichtskonstanten. Diese Beziehung gilt selbstverständlich auch für nicht gasförmige Reaktanden, dort wird wie bekannt statt des Partialdruckes die Konzentration bzw. die Aktivitäten als Variablen eingesetzt. Die Gleichgewichtskonstante hat eine große praktische Bedeutung. Sie findet sich z.B. im Löslichkeitsprodukt oder in der Säurekonstante wieder. Betrachtet man das Löslichkeitsprodukt von Bariumchromat, so ist es nichts anderes als die Massenwirkungskonstante der Dissoziationsreaktion: BaCrO4 Ba2+ + CrO42- (19) xvi. K L c ( Ba 2 ) c ( CrO 2 4 ) 1 ,17 10 10 mol / L 25 5 Ausblick Die Anwendung von Gleichgewichten beschränkt sich im chemischen Schulunterricht nicht nur auf die Herleitung des Massenwirkungsgesetzes. Ein häufig „verwendetes“ Gleichgewicht soll in dem folgenden Experiment bzw. Demonstration erläutert werden. Experiment 6: Verteilungsgleichgewicht Chemikalien: Substanz Gefahrenzeichen Thymolblau (pH 1,2- - R-Sätze S-Sätze - - 34-37 26-36/37/39-45 - - 2,8 und pH 8,0-9,6) HCl(aq) (konz.) C NaOH(aq) (c = 0,002 mol/L) Geräte: 2 Petrischalen, 2 Uhrgläser, Filterpapier (passend zu Petrischalen), Becherglas (250 mL), Glasstab, Pasteurpipette, Saughilfe, Messzylinder (50 mL), Overhead-Projektor, Pinzette Durchführung: In dem Becherglas werden ca. 100 mL Natronlauge mit ca. 1 mL Indikatorlösung versetzt bis die Lösung kräftig blau erscheint. 50 mL dieser Lösung füllt man nun in Petrischale Nr.1. In die zweite Petrischale gibt man ca. 50 mL konzentrierte Salzsäure. Die Schale wird mit einem Filterpapier und einem Uhrglas bedeckt, ohne dass das Filterpapier die Flüssigkeit berührt. Man lässt mind. 5 –10 Minuten stehen. Stellt man nun Petrischale Nr.1 auf einen angeschalteten Overhead-Projektor, so erscheint an der Wand ein blauer Kreis. Nun wird das Filterpapier vorsichtig von Petrischale Nr.2 auf Petrischale Nr.1 gehoben, wieder ohne die Flüssigkeiten zu 26 berühren. Die Petrischale wird mit dem zweiten Uhrglas verschlossen. Nach wenigen Minuten wird das Filterpapier entfernt. Beobachtungen: Am Ende des Versuches kann man gelbe Schlieren in der vormals blauen Flüssigkeit entdecken. Auswertung: Folgende Reaktionen finden statt: Petrischale Nr.1: (20) H3O+(aq) + Cl-(aq) HCl(aq) + H2O(l) (21) HCl(aq) HCl(g) (22) HCl(g) HCl(ad) Petrischale Nr.2: (23) HCl(ad) HCl(g) (24) HCl(g) HCl(aq) (25) HCl(aq) + H2O(l) H3O+(aq) + Cl (aq) (26) H3O+(aq) + OH (aq) 2 H2O(l) (27) Ind (aq) + H2O(l) HInd(aq) + OH (aq) - - - - In der ersten Petrischale stellt sich ein Gleichgewicht zwischen der dissoziierten und nicht dissoziierten Salzsäure ein. Letztere steht wieder im Gleichgewicht mit dem gasförmigen Chlorwasserstoff. Dieser befindet sich wiederum im Gleichgewicht mit den am Filter adsorbierten Teilchen. In der zweiten Petrischale stellen sich nach der Überführung des Filterpapiers die gleichen Gleichgewichte ein; nur in umgekehrter Reihenfolge. Durch die OxoniumIonen der dissoziierten Salzsäure werden Hydroxid-Ionen der Natronlauge neutralisiert. Dadurch wird der vorher blaue, deprotonierte Indikator Thymolblau protoniert und schlägt nach gelb um. 27 Demonstration 2: Chromatographie Chemikalien: Substanz Gefahrenzeichen R-Sätze S-Sätze Al2O3 - - - 4-Methoxyazobenzen - - 22,24/25 Sudan-Gelb Xn 20/22 24/25 trans-Azobenzen T,N 20/22,45,48/22,50/ 45,53,60,61 53 Petrolether T,F 11,38,48/20,62,65 16,23,24,33,36/37, 62 Toluen Xn,F 11,20 16,25,29,33 ention. Wasser - - - Geräte: Chromatographierohr mit Hahn (l = 50 cm; 2 cm), Glaswolle, Glastrichter, Glasflasche mit Schliffstopfen, Messpipette (10 mL), Peleusball, Messzylinder (100 mL) Schlauch, Becherglas (300 mL), Becherglas (100 mL), Pasteurpipette, Saughilfe, Stativmaterial Durchführung: 75 g Aluminiumoxid werden mit 3 mL Wasser vermischt und in der geschlossenen Glasflasche 2 h stehen gelassen. Man stellt ein Petrolether/ Toluen-Gemisch im Verhältnis 4:1 her und schlämmt das aktivierte Aluminiumoxid mit 75 mL auf. Anschließend wird das aufgeschlämmte Aluminiumoxid in das senkrecht eingespannte Chromatographierohr, das unten mit Glaswolle verschlossen wurde, gefüllt. Um Hohlräume zu vermeiden wird vorsichtig mit einem Schlauchstück gegen das Chromatographierohr geschlagen. Das Lösungsmittelgemisch wird nun in das unter der Säule befindliche kleine Becherglas gelassen bis sich der Flüssigkeitspegel in dem Chromatographierohr etwas oberhalb der Aluminiumoxid-Oberfläche befindet. Nun wird ca. 3 mL des Farbstoffgemisches der drei Farbstoffe mit einer Pasteurpipette vorsichtig oben auf die Säule gegeben, wobei eine Aufwirbelung der Aluminiumoxidschicht zu vermeiden ist. 28 Anschließend wird der Hahn so weit geöffnet, dass das Lösungsmittel langsam raustropft. Man spült mehrfach mit 50 mL Petrolether/ Toluen-Gemisch nach. Für die Demonstration wird der Hahn geschlossen, wenn die erste Farbstoffzone im unteren Drittel der Säule angelangt ist. Man lässt die Säule bei geschlossenem Hahn trocknen. Beobachtungen: Das Farbstoffgemisch, das eine orange-bräunliche Farbe hat, wird in drei Komponenten aufgetrennt. Im unteren Drittel der Säule befindet sich eine gelbe, darüber eine weitere gelbe und oben eine orange Farbstoffzone. Auswertung: Chromatographie ist ein Verfahren, dass die Trennung von Stoffgemischen in ihre Einzelteile erlaubt. Dazu bringt man es in ein System mit einer stationären und einer mobilen Phase, die sich in ihren chemisch-physikalischen Eigenschaften unterscheiden. Nun stellt sich zwischen mobiler und stationärer Phase wiederholt ein Gleichgewicht ein. So verteilen sich die verschiedenen Bestandteile des Gemisches unterschiedlich in den beiden Phasen und die Wanderungsgeschwindigkeiten sind verschieden. Man kann also ein ähnliches Prinzip, ein Verteilungsgleichgewicht, wie in Experiment 6 beobachten. In dieser Demonstration war Aluminiumoxid die polare stationäre Phase und das Petrolether/ Toulen-Gemisch das unpolare Laufmittel bzw. die unpolare mobile Phase. Die Polarität der drei Farbstoffe nimmt in der Reihenfolge transAzobenzen > 4-Methoxyazobenzen > Sudan-Gelb zu. Dies entspricht daher auch der Reihenfolge der Auftrennung. Das unpolare trans- Abb. 14 Säulenchromatographie Azobenzen wird am schnellsten durch die Säule transportiert, da es am wenigsten Wechselwirkungen mit dem Aluminiumoxid eingeht. 29 OH OMe NH N N N trans-Azobenzen NH N 4-Methoxyazobenzen Sudan-Gelb 6 Schulrelevanz Der hessische Lehrplan (2006) für das Gymnasium schreibt das Thema „Das Chemische Gleichgewicht“ sowohl im Leistungs- wie auch im Grundkurs verbindlich als Unterrichtseinheit für die 13 Jahrgangsstufe vor. Im Leistungskurs ist das Thema eingebettet in „Antrieb und Steuerung von chemischen Reaktionen: GK 13.1: Das Chemische Gleichgewicht/ LK 13.1: Antrieb und Steuerung chemischer Reaktionen o Umkehrbare Reaktionen und chemisches Gleichgewicht (Experiment 1) o Massenwirkungsgesetz (Experiment 5) o Prinzip vom Zwang (Demonstration 1, Experiment 2-4) o Anwendungen des Massenwirkungsgesetzes Die Löslichkeit und das Chromatographieverfahren können schon in der Klasse 8 thematisiert werden: 8.1: Verbindliche Unterrichtsinhalte/ Aufgaben: o Lösungen und Löslichkeit (Experiment 1 u. 4) Fakultative Unterrichtsinhalte/ Aufgaben o Chromatographie (Demonstration 2) 30 8 Quellenverzeichnis Bücher/ Zeitschriften/ Skripte: Braun, Thomas M: Das Massenwirkungsgesetz – eine Alternative Ableitung. In: Praxis der Naturwissenschaften – Chemie 5. 1987, S.17-19 Küng, Hans Ulrich: Chemisches Gleichgewicht. In: Berg, Hans Christoph/ Schulze Theodor (Hrsg.): Berner Lehrkunststücke ... im Didaktikdiskurs. Luchterhand. Neuwied [u.a.]. 1998. S.29-136 Krätz, Otto: 7000 Jahre Chemie. Alchemie, die schwarze Kunst. Schwarzpulver. Sprengstoffe. Teerchemie. Farben. Kunststoffe. Biochemie und mehr. Von den Anfängen im Orient bis zu den neuesten Entwicklungen im 20. Jahrhundert. Nikol. Hamburg. 1999. Merck Chemikalien Reagenzien 2002. Parzeller. Fulda. 2002 Paeske, Arnold: Das chemische Gleichgewicht. Eine didaktisch motivierte Analyse der historischen Entwicklung seiner Theorie und Überlegungen zur Einführung der Thematik in der gymnasialen Oberstufe. Waxmann. Münster [u.a.]. 1992 Pasch, Eberhard: Experimente zum chemischen Gleichgewicht. In: Chemie in der Schule 8. 1980. S.361f Paschmann, Antje/ De Vries, Tömjes/ Lüchtenborg, Katrin/ Arshadi, Noushin/ Parchmann, Ilka: Die Bedeutung der Ozeane im Kohlenstoffkreislauf. Eine Hinführung zum Begriff des Chemischen Gleichgewichts im Rahmen der Konzeption Chemie im Kontext – Teil 1. In: Zeitschrift des Vereins zur Förderung des mathem.-naturw. Unterrichts 3. 2000. S. 170-175 Ralle, Bernd/ Jansen, Walter: Zur Behandlung des chemischen Gleichgewichts und des Massenwirkungsgesetzes in der Sekundarstufe II der Gymnasien unter Einbeziehung der geschichtlichen Entwicklung Teil 1. In: Zeitschrift des Vereins zur Förderung des mathem.-naturw. Unterrichts 3. 1986. S. 161-168 Reichhardt, C./ Carell, T./ Auel, C./ Schween, M.: Skriptum zum Organischchemischen Grundpraktikum. Fachbereich Chemie der Philipps-Universität Marburg. 2001. 2. überarb. Aufl. S.43-46 Riedel, Erwin: Anorganische Chemie. de Gruyter. Berlin [u.a.]. 1999. 4. Aufl. 31 Weißenhorn, R.G.: Verteilungs- und – Säure-Base-Gleichgewichte Lernprozesse an einem „Chemischen Kabinettstück“ [1]. In: Praxis der Naturwissenschaften 1. 1994. S. 2-5 Winterstein, Christel/ Felber, Wolfram: Zwei Experimente zum Druckeinfluß auf das chemische Gleichgewicht. In: Chemie in der Schule 10. 1981. S.427 Internetquellen: http://de.wikipedia.org/wiki/Chemisches_Gleichgewicht (27.07.2006) http://de.wikipedia.org/wiki/Chromatographie (27.07.2006) http://de.wikipedia.org/wiki/Berthollet (27.07.2006) http://de.wikipedia.org/wiki/Henry-Gesetz (27.07.2006) http://de.wikipedia.org/wiki/Joseph_Priestley (27.07.2006) http://de.wikipedia.org/wiki/Le_Chatelier (27.07.2006) http://dc2.uni-bielefeld.de/dc2/mwg/mwg-ther.htm (27.07.2006) http://www.kah-bonn.de/index.htm?ausstellungen/klee/sonderfuehrungen.htm (27.07.2006) http://lernarchiv.bildung.hessen.de/archiv/lehrplaene/gymnasium/chemie (27.07.2006) Abbildungsnachweis: Küng, 1998 [Abb. 9] Krätz, 1999 [Abb. 2-4, 11 (links)] http://www.cultuurnetwerk.org/bronnenbundels/2000/2000_60b.jpg (27.07.2006) [Abb. 1] http://dbhs.wvusd.k12.ca.us/webdocs/Gallery/Guldberg&Waage.GIF (27.07.2006 ) [Abb. 13] http://de.wikipedia.org/wiki/Bild:Lechatelier.jpg (27.07.2006 ) [Abb. 12] http://de.wikipedia.org/wiki/Bild:Joseph_Priestley.jpeg (27.07.2006 ) [Abb. 10] http://i4.discount24.de/4/prod/920000/920502_lm.jpg (27.07.2006) [Abb. 11 (rechts)] http://isimabomba.free.fr/biographies/chimistes/berthollet.jpg (27.07.2006) [Abb. 7] Hinweis: Nicht aufgeführte Abbildungen sind Werke der Autorin. 32