Ozon - Fluch und Segen?
Werbung

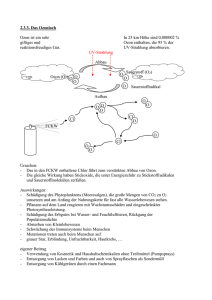
Ozon-Fluch und Segen? Seite 1 Ozon – Fluch und Segen ? Einleitung Das Ozonloch über der Antarktis, eine durch den Menschen verursachte Umweltzerstörung, gehört wohl zu den beunruhigendsten Entdeckungen der Moderne. Es ist bekanntlich nicht die einzige dieser Art. Aber die Vorstellung, der glühenden Sonne ohne den schützenden Ozonschild voll ausgesetzt zu sein, scheint doch sehr beängstigend. Ein wenig früher als das Ozonloch ist eine andere Umweltverschmutzung festgestellt worden: der Ozonsmog oder Sommersmog. In Los Angeles war er schon länger bekannt. Bald wurde jedoch erkannt, daß es sich nicht um ein lokales Phänomen handelt, sondern daß es fast in allen Weltgegenden auftritt, sowohl in Städten als auch auf dem Land. Auch wenn neuere Erkenntnisse und Prognosen den Ozonabbau in der Stratosphäre nicht mehr ganz so dramatisch sehen wie noch vor 10 Jahren, bleibt die Tatsache bestehen, daß die Ozonkonzentration in der Stratosphäre wegen der FCKWs weiter abnehmen wird. Wie schlimm die Folgen für die Menschheit und alle Lebewesen sein werden, darüber gehen die Meinung der Experten weit auseinander. Es herrscht eine gewisse Unsicherheit, weil dem Laien nicht einleuchtet, daß Ozon hier am Boden dem Menschen schaden soll und in der Stratosphäre nützen. Und wenn es doch bei uns zuviel hat, wieso ist es nicht möglich, damit das Ozonloch zu stopfen? Die Lufthülle - Aufbau der Erdatmosphäre Siehe Anhang 1: Die "Stockwerke" der Atmosphäre Wie ist die Erdatmosphäre aufgebaut? Wo sind die Grenzen der verschiedenen Schichten? Abb. Zusammensetzung der Atmosphäre in Bodennähe (trockene Luft) Volumenanteil Prozent ml/m³ (ppm) Gas Stickstoff Sauerstoff N2 O2 78,08 20,95 Argon Kohlenstoffdioxid Ar CO2 0,93 0,0357 Neon Helium Ne He 18,2 5,2 Methan Krypton CH4 Kr 1,7* 1,1 Wasserstoff Distickstoffoxid H2 N2O 0,5 0,3* Xenon Ozon Xe O3 0,09 0,03 FCKW usw. 357* 0,0008* *ansteigende Tendenz Da für das Verständnis der Ozonproblematik die Begriffe Strahlung (spez. UV-Strahlung), Wellen und Energie sehr wichtig sind, solltet ihr vor dem Kapitel "Was ist Ozon?" unbedingt die Kopie II.5 (elektromagnetische Strahlung, aus der Sonderwoche) wiederholen. Was ist Ozon? Ozon ist eine Verbindung, die aus drei Sauerstoffatomen besteht ("normaler" molekularer Sauerstoff - O2 ist zweiatomig). Daniela Weber Kantonsschule Trogen 2000 Ozon-Fluch und Segen? Seite 2 Ozon- "Steckbrief" Name: Entdecker: Formel: Schmelztemperatur: Siedetemperatur: Farbe: Geruch: Giftigkeit: Löslichkeit: Oxidationswirkung: Ozon, von griech ozein, nach etwas riechen Ch. F. Schönbein 1840 bei der Elektrolyse von verdünnter Schwefelsäure O3 - 192,5°C - 112°C O3(g) blau, O3(l) blauviolett, O3(s) schwarzviolett O3(l) und O3(s) explodieren bei Berührung Ozon erzeugt einen charakteristischen Geruch In hohen Konzentration riecht Ozon süßlich und sticht in der Nase. Der Geruch von verdünntem Ozon erinnert dagegen an den von Halogenen oder Stickoxiden (NOx) stark toxisch (siehe "Wirkung auf den Menschen") schlecht löslich in Wasser eines der stärksten Oxidationsmittel Ozon entsteht aus der Reaktion von molekularem mit atomarem Sauerstoff. Da Sauerstoff eine sehr stabile Verbindung ist, neigen Ozonmoleküle dazu, ihr "überflüssiges" Sauerstoffatom durch Oxidation abzugeben, um den stabilen Zustand des Sauerstoffs zu erreichen. Ozon ist deshalb chemisch sehr reaktiv, greift also viele andere Stoffe an und kann Menschen, Pflanzen und Materialien (zum Beispiel Kunststoffe und Metalle) schädigen. Darüber hinaus ist Ozon ein Treibhausgas, trägt also zur Erwärmung der Erdatmosphäre bei. Ozon gehört zu den Spurengasen, die keine eigene Quelle auf der Erdoberfläche besitzen, sondern ausschließlich über photochemische Prozesse (durch intensives Sonnenlicht ausgelöste Reaktionen) in der Atmosphäre gebildet werden. Es ist eines der wenigen Spurengase, die sowohl Strahlen im UV- als auch im infraroten Bereich absorbieren können. Wo entsteht Ozon natürlich? Durch UV-Strahlung Durch Blitze Wo entsteht Ozon künstlich? Im Lichtbogen (Schweißen) Bei Hochspannungsleitungen Bei UV-Lampen Bei gewissen chemischen Reaktionen Wo wird Ozon verwendet? Zur Entkeimung von Trinkwasser, Badewasser Zur Sterilisation Für gewisse chemische Reaktionen (Ozonlyse) Zusatz zu Raketentreibstoffen Anmerkung zum praktischen Teil: Die Darstellung von Ozon erfolgt durch Elektrolyse von verdünnter Schwefelsäure im Hoffmannschen Wasserzersetzungsapparat. Der an der Anode gebildete Sauerstoff enthält zu 1-2 Promille Ozon. Das Anodengas enthält soviel Ozon, daß man es riechen kann und sogar die Reizung der Nasenschleimhäute bemerkt. Die Abnahme des Ozons erfolgt deshalb im Abzug. Suche dir 2 KlassenkameradInnen, führe die Versuche durch und notiere deine Beobachtungen. Entsorge die Chemikalien nach Anleitung! Die Versuchsanleitung findest du im Praktikum. Versuch1: Schönbeins einfacher Ozonnachweis Versuch 2: Oxidationswirkung von Ozon auf anorganische Substanzen Daniela Weber Kantonsschule Trogen 2000 Ozon-Fluch und Segen? Seite 3 a) Oxidation von Mangan(II)-Salzen b) Enteisen von Mineralwasser (Fällung von Eisen(III)-Hydroxid) Versuch 3: Ozon bleicht Farbstoffe ( oder : Wie Ozonteströhrchen funktionieren) Die Versuchsanleitung findest du im Praktikum. Versuch 4: Ozon zerstört Gummi Ozonschicht - "Die Sonnenbrille der Erde" oder Ozon in der Stratosphäre Ohne Ozon kein Leben! Dies gilt gewiß für die Erde. 90% des Ozons in der Atmosphäre befinden sich in der unteren Stratosphäre in einer Höhe zwischen 20 und 30 Kilometer. Diese Bereich wird Ozonschicht genannt. Streng genommen handelt es sich hierbei nicht um eine Schicht, sondern lediglich um einen Schleier. Denn selbst in dieser Höhe beträgt die Ozonkonzentration nur 5-10 parts per million (ppm), das heißt, unter einer Million Gasteilchen befinden sich jeweils 5-10 Ozonmoleküle. Die gesamte Ozonschicht wäre unter "irdischen" Luftdruckbedingungen gar nur 3,5 mm dick! Für die Bildung von Ozon aus Sauerstoff ist energiereiche Strahlung nötig. Die kurzwelligen UV-Strahlen passieren die oberen Schichten der Atmosphäre ungefiltert. In der Stratosphäre sorgen dann die UV-CStrahlen dafür, daß Sauerstoffmoleküle (O2) durch photochemische Reaktion in Sauerstoffatome (O) aufgespalten werden, die mit anderen O2-Molekülen zu Ozon (O3) reagieren. Auf der anderen Seite wird ein Teil des Ozons durch UV-Strahlen wieder in ein Sauerstoffmolekül und ein Sauerstoffatom gespalten. Diese Reaktionsketten absorbieren einen großen Teil der in die Atmosphäre gelangten kurzwelligen UV-Strahlen. Das Ozon hat dort die lebenswichtige Funktion eines Filters gegen den schädlichen ultravioletten Anteil der Sonnenstrahlung (UV-B und UV-C) Aufgabe: Notiere die Reaktionsgleichungen für die Bildung und den Zerfall von Ozon „Schutzschild“ Ozon: Die UV-Absorption des Ozons schliesst die Lücke zwischen 240 und 310 nm Gleichzeitig sorgt die bei der Absorption (der UV-Strahlung) freiwerdende Wärme für vergleichsweise hohe Temperaturen (zwischen 0 bis -20°C) in der Stratosphäre. Damit ist die Stratosphäre wesentlich wärmer als die Tropopause (Grenzbereich zwischen Troposphäre und Stratosphäre). Da warme Luft bekanntlich nach oben steigt, kalte dagegen absinkt, durchmischen sich die beiden Atmosphärenschichten nur sehr langsam. Die photochemische Bildung von Ozon findet hauptsächlich in der Stratosphäre über dem Äquator statt. Hier herrscht im Jahresverlauf eine hohe, nahezu gleichbleibende Sonnenintensität, so daß die Ozonproduktion nicht wesentlich schwankt. Auch in höheren geographischen Breiten wird Ozon photochemisch gebildet, die Hauptmenge fließt aber über atmosphärische Transporte aus der äquatorialen Stratosphäre in Richtung der Pole. Dieser Transport ist im Winter infolge stärkerer Daniela Weber Kantonsschule Trogen 2000 Ozon-Fluch und Segen? Seite 4 Zirkulation am intensivsten. Der polwärtige Ozontransport sorgt dafür, daß die Ozonmenge vom Äquator zu den Polen ständig zunimmt. Ozonschicht, UV-Strahlen und FCKWs Nur ca. 15% der von uns ausgestossenen FCKW (Fluorchlorkohlenwasserstoffe) und andere halogenhaltige Stoffe werden in der Troposphäre abgebaut, die restlichen 85% steigen in einer Zeitdauer von 2 -3 Jahren in die Stratosphäre auf. Erst dort wird die stabile Kohlenstoff-Chlor-Bindung von kurzwelligem UV-Licht gespalten und Chlorradikale (Cl) werden frei. Diese Chlorradikale reagieren dann mit den Ozonmolekülen und bauen so Ozon ab. Und so funktioniert`s Die Chemiker CRUTZEN, MOLINA und ROWLAND (Nobelpreis 1995) kämpften seit 1974 für einen Stopp der FCKW-Produktion. Erst 13 Jahre später reagierten die Politiker mit dem "Montrealer Protokoll". Im „Montreal Protokoll“ von 1987 und folgenden internationalen Konferenzen sind weltweite Vereinbarungen getroffen worden, um die Emissionen dieser Stoffe zu verringern. Seit Ende 1995 dürfen weltweit keine FCKW mehr hergestellt und verwendet werden (Ausnahmen gelten für Entwicklungsländer). In den nächsten 5 bis 10 Jahren ist noch mit einer Zunahme der Größe der "Ozonlöcher" zu rechnen. Der stärkste Ozonabbau (ca. 50 %) wird über der Antarktis im Zeitraum von September bis November, dem antarktischen Frühling, beobachtet (das sogenannte Ozonloch). In unseren Breiten findet ein verstärkter Abbau in den Winter- und Frühjahrsmonaten statt. Während des Zeitraums von 1968 bis 1992 betrug der Ozonrückgang über Europa im Durchschnitt drei Prozent pro Jahrzehnt. Dieser Trend hatte sich seit Ende der siebziger Jahre verschärft. Derzeit wird in den Monaten Januar bis März mit einem Ozonrückgang von vier Prozent pro Jahrzehnt gerechnet. Daniela Weber Kantonsschule Trogen 2000 Ozon-Fluch und Segen? Seite 5 Demonstrationsversuch 1: Ozon absorbiert UV-Strahlung Demonstrationsversuch 2: Spektrum von Ozon und Sonnenschutzmittel im Vergleich Sommersmog/ Los Angeles Smog - Bodennahes Ozon 1. Entstehung von bodennahem Ozon Während der Sommermonate treten bei schönem Wetter häufig erhöhte Ozonkonzentrationen infolge der Luftverschmutzung auf. Ozon ist Hauptbestandteil des Sommersmogs. Es entsteht unter Einwirkung von Sonnenstrahlen aus Stickoxiden und Kohlenwasserstoffen (Vorläufersubstanzen). Die drei Hauptquellen der Stickoxide und Kohlenwasserstoffe sind der motorisierte Straßenverkehr, die Industrie- und Gewerbebetriebe sowie Haushalte. In der Schweiz hat der Ausstoß von Stickoxiden und Kohlenwasserstoffen seit den fünfziger Jahren stark zugenommen. Als folge davon wurde im gleichen Zeitraum auch ein Anstieg des Ozongehalts in der Luft festgestellt. Aufgabe (zu Emissionsquellen der Vorläufersubstanzen): Studiere die Abbildungen in der Broschüre "Luftpost": S:6 zur NO x-Emission, S.9/10 zur VOC-Emission; (Notiere die Hauptverursacher der oben genannten Emissionen.) Erhöhte Ozonkonzentrationen kommen im Sommerhalbjahr bei Schönwetterlagen - vorwiegend am Nachmittag - in allen Gegenden der Schweiz vor. Dabei werden nicht etwa in den Städten, sondern am Stadtrand und in den ländlichen Gegenden die höchsten Ozonkonzentrationen gemessen. Die höhere Ozonbelastung auf dem Land kommt daher, daß so gut wie kein Stickstoffmonoxid (NO) vorhanden ist um das Ozon abzubauen. Die Ozonkonzentration ist daher am Ende des Tages in den Reinluftgebieten höher als in den Innenstädten. Sommersmog ist somit ein überregionales und nicht nur ein lokales Problem, was bei der Beurteilung der Ozonlage zu beachten ist. Natürlicherweise kommen in bodennahen Luftschichten maximale Ozonkonzentrationen von 60 bis 80 g/ m³ vor. In der schweizerischen Luftreinhalte-Verordnung ist der Grenzwert für Ozon auf einen maximalen Stundenwert von 120 g/ m³ Luft festgelegt. An Hochsommertagen wird dieser Grenzwert bei uns täglich rund 5-10 mal überschritten. Beispielhafter Tagesgang (siehe Abb.) der Ozonbelastung an einem Sommertag bei bedecktem und unbedecktem Himmel. Deutlich erkennbar ist die starke Bedeutung der Sonneneinstrahlung als „Motor“ für die Ozonbildung. An einem sonnigen Sommertag steigt die Konzentration in der Luft mit Beginn der Sonneneinstrahlung sehr stark an und erreicht ihr Maximum in den Nachmittagsstunden. Bei Temperaturen über 25°C ist mit einer Überschreitung des Grenzwerts zu rechnen. Bei bedecktem Himmel ist die Ozonbelastung deutlich geringer. Daniela Weber Kantonsschule Trogen 2000 Ozon-Fluch und Segen? Seite 6 Aufgabe: Lies S.23 (in "Luftpost") - Bildung von Ozon und regionale Belastungsunterschiede und studiere den Tagesgang der Ozonbelastung für die Städte Basel und Lugano. Sonderteil Appenzell A.Rh.: S:III 2. Wirkungen auf den Menschen Das für den Sommersmog typische Photooxidantiengemisch enthält eine Vielzahl von Reizstoffen, allerdings nicht in konstanter Zusammensetzung. Die starke Reizwirkung des "photochemischen Smogs" auf die Augen und Schleimhäute der oberen Atemwege (Nasen-Rachen-Raum) kommt nur zu einem geringen Teil durch Ozon zustande, hauptsächlich aber durch andere Photooxidantien, die als Nebenprodukt der atmosphärischen Ozonbildung entstehen, zum Beispiel Peroxiacetylnitrat (PAN), Peroxibenzoylnitrat (PBN), Acrolein und Formaldehyd. Diese Substanzen sind - im Gegensatz zu Ozon gut wasserlöslich. Im Hinblick auf ihre gesundheitlichen Wirkungen sind sie allerdings weniger bedeutend als Ozon, da sie in geringeren Konzentrationen auftreten und weniger toxisch (giftig) sind als Ozon. Ozon selbst reagiert durch seine hohe Reaktionsbereitschaft fast ausschließlich am Auftreffort, das heißt an den Oberflächen des Atemtraktes. Durch seine geringe Wasserlöslichkeit wird es in viel geringerem Maße als beispielsweise Schwefeldioxid in den oberen Atemwegen zurückgehalten. Folglich dringt Ozon viel weiter in die Lunge ein. In der Lungenperipherie trifft es auf Gewebe, das nicht durch eine Schleimschicht geschützt ist. Hier kann es zur Schädigung der Zellmembran mit den damit verbundenen entzündlichen Prozessen kommen. WIE SCHÄDLICH IST OZON? Bei den schädlichen Wirkungen des Ozons stehen im Vordergrund Reizerscheinungen an den Augen und Schleimhäuten sowie Husten, Kopfschmerzen und Atembeschwerden. Letztere können sich unter körperlicher Belastung verstärken. Ozon dringt (wie oben beschrieben) mit der Atemluft tief in die Lunge ein und verursacht in den Lungenbläschen eine Entzündung, die sich nach Beendigung der Ozonwirkung in der Regel im Verlauf weniger Stunden folgenlos zurückbildet. Lediglich extrem hohe und lange einwirkende Ozonkonzentrationen, wie sie in Los Angeles, USA häufig vorkommen (werden in Schweiz und Deutschland nie erreicht), können zu bleibenden Einschränkungen der Lungenfunktion führen. Die Schädlichkeit des Ozons hängt hauptsächlich von drei Einflussgrößen ab: Höhe der Ozonbelastung Je höher die Ozonkonzentration ist, desto stärker ist die giftige Wirkung. Dauer der Einwirkung Je länger eine bestimmte Ozonkonzentration einwirkt, desto stärker und nachhaltiger ist die giftige Wirkung. Ort der Ozonwirkung/ Höhe des Atemminutenvolumens Das Ozon entfaltet an den Bindehäuten der Augen seine "einfache" Reizwirkung, während es in der Lunge durch verstärktes Atmen unter körperlicher Anstrengung eine wesentlich stärkere Giftigkeit zeigt. (Atemminutenvolumen = Luftvolumen, das während einer Minute ein-oder ausgeatmet wird) Die individuelle Empfindlichkeit gegenüber Ozon ist sehr unterschiedlich. Da sich die Wirkung des Ozons nicht von den Wirkungen der übrigen Sommersmog-Bestandteile trennen läßt, kann nicht exakt bestimmt werden, welchen ursächlichen Anteil die verschiedenen Schadstoffe an den beobachtbaren Schadwirkungen haben. Als gesichert gilt aber, dass die Hauptursache gesundheitlicher Schadwirkungen im Ozon begründet ist. Etwa 10% der Bevölkerung reagieren besonders empfindlich auf Ozon. Körperliche Aktivität bzw. Anstrengung steigern wegen der verstärkten Atmung die schädigende Wirkung an der Lunge. Durch Ozon besonders betroffen sind daher Personen, die während Sommersmog-Episoden bei Spiel, Sport oder Arbeit häufig längerdauernde, anstrengende körperliche Tätigkeiten im Freien ausüben. Aus Vorsorgegründen müssen grundsätzlich alle Säuglinge und Kleinkinder als Risikogruppe eingestuft werden, weil sie im Vergleich zu Erwachsenen "mehr" atmen müssen. Auch Menschen mit einer bereits bestehenden Funktionsstörung der Lunge können durch Ozoneinwirkung besonders stark beeinträchtigt werden. Daniela Weber Kantonsschule Trogen 2000 Ozon-Fluch und Segen? Seite 7 WIE KANN MAN SICH SCHÜTZEN? Der beste Schutz vor schädlichen Ozonwirkungen besteht darin, die Exposition gegenüber hohen Ozonkonzentrationen zu vermeiden oder zu begrenzen: Während der Tageszeiten mit hohen Ozonkonzentrationen - in Ballungsgebieten in den Nachmittags- und frühen Abendstunden, auf dem Land von spätnachmittags bis spätabends - sollten sich sensible Personen möglichst im Haus aufhalten und körperliche Anstrengungen meiden. Notwendige Aufenthalte im Freien und körperliche Aktivitäten sollten so kurz wie möglich gehalten werden oder nach Möglichkeit dann erfolgen, wenn die Ozonwerte unkritisch sind. MÜSSEN KÖRPERLICHE AKTIVITÄTEN EINGESCHRÄNKT WERDEN? Körperliche Aktivitäten sollten während der Tageszeiten mit hohen Ozonkonzentrationen eingeschränkt werden. Dies gilt für gesunde Erwachsene erst bei wesentlich höheren Werten als für ozonsensible Menschen, Säuglinge, Kleinkinder und Patienten mit eingeschränkter Lungenfunktion. Keinesfalls muss gerade dann, wenn das Wetter am schönsten ist, auf jeden Sport im Freien verzichtet werden. Einerseits können sportliche Aktivitäten auf "unkritische" Tageszeiten verlegt werden. So besteht in ländlichen Regionen z.B. keine Veranlassung, Schulsport am Vormittag bzw. am frühen Nachmittag ausfallen zu lassen, weil hier erst spätnachmittags hohe Ozonwerte erreicht werden. Andererseits haben wissenschaftliche Untersuchungen gezeigt, dass erst eine mehrstündige körperliche Belastung unter hohen Ozonwerten zu gesundheitlichen Störungen führt. Somit lassen sich eine Reihe Sportarten finden, die selbst bei hoher Ozonbelastung (bis 360 µg/m³) ausgeübt werden dürfen: z.B. Leichtathletik wie Springen, Werfen und Kurzstreckenläufe, aber auch Mannschaftsspiele von kurzer Dauer und Techniktraining, z.B. beim Fußball. Ausdauersportarten wie z.B. Mittel- und Langstreckenlauf, Mannschaftsspiele mit Ausdauerleistungen und Ausdauertraining sollten dagegen ab Ozonwerten von 180µg/m³ unterlassen oder auf unkritische Tageszeiten verlegt werden. SCHWELLENWERTE Zur Beurteilung der Ozonkonzentration sind im Gebiet der Europäischen Union (EU) Schwellenwerte festgelegt worden: Schwellenwert für den Gesundheitsschutz: 110 µg/m³ als 8-Stunden-Mittelwert Solange dieser Schwellenwert nicht überschritten wird, muss mit gesundheitlichen Beeinträchtigungen auch im Falle länger andauernder körperlicher Belastung nicht gerechnet werden. Oberhalb des Schwellenwertes müssen ozonempfindliche Menschen nach langdauernder körperlicher Belastung mit reversiblen gesundheitlichen Beeinträchtigungen rechnen. Schwellenwert für die Unterrichtung der Bevölkerung: 180 µg/m³ als1-Stunden-Mittelwert Bei Überschreitung dieses Schwellenwertes müssen besonders ozonempfindliche Menschen auch bei kurzzeitiger Einwirkdauer mit begrenzten und reversiblen gesundheitlichen Beeinträchtigungen rechnen. Schwellenwert für den Schutz der Vegetation: 200 µg/m³ als 1-Stunden-Mittelwert und 65 µg/m³ als 24-Stunden-Mittelwert Oberhalb dieser Schwellenwerte ist mit Schäden an Pflanzen in Form von Braunverfärbungen bis zum Absterben von Blättern und mit Wachstumsminderung zu rechnen. Schwellenwert für die Auslösung des Frühwarnsystems: 360 µg/m³ als 1-StundenMittelwert Ab dieser Ozonkonzentration wird der gesamten Bevölkerung empfohlen, länger andauernde und körperlich anstrengende Tätigkeiten im Freien insbesondere nachmittags und abends zu vermeiden. Bereits bei Erreichen eines Schwellenwertes von 180 µg/m³(D) sieht das Ozongesetz einen Appell an die Bevölkerung vor, Kraftfahrzeuge, motorgetriebene Rasenmäher und andere nicht gewerbliche Verbrennungsmotoren nicht zu benutzen. Immissionsgrenzwerte für Ozon in der Schweiz: 100 µg/m³ 98% der Halbstunden-Mittelwerte eines Monats müssen darunter liegen. 120 µg/m³ 1-Stunden-Mittelwert darf höchstens einmal pro Jahr überschritten werden Daniela Weber Kantonsschule Trogen 2000 Ozon-Fluch und Segen? Seite 8 Wirkung von Ozon und EU-Schwellenwerte 3. Wirkungen auf Pflanzen Zur Wirkung von Ozon auf Pflanzen liegen hauptsächlich Untersuchungen an landwirtschaftlichen Nutzpflanzen und an Waldbäumen vor. Einige wenige Untersuchungen wurden an Wildpflanzen durchgeführt. Sobald Ozon von der Pflanze direkt über die Spaltöffnungen aufgenommen wird, greift es hier wegen seiner oxidativen Wirkung die Zellstruktur des Pflanzengewebes an. Bei einer gezielten Begasung sind sowohl Zuwachsminderungen als auch sichtbare Schädigungen wie Blattnekrosen (abgestorbene Blätter) oder Verfärbungen zu verzeichnen. Untersucht worden sind vor allem Sommerweizen, Klee, Bohnen und Mais sowie Buche, Eiche, Fichte und Kiefer. Das Ausmaß der Schädigung hängt nicht allein von der einwirkenden Konzentration, sondern auch von der Dauer der Belastung ab. Versuch 5: Wirkung von Ozon auf Pflanzen Die Versuchsanleitung findest du im Praktikum. Suche dir 3 KlassenkameradInnen führe den Versuch durch und notiere deine Beobachtungen. Entsorge die Chemikalien nach Anleitung! Daniela Weber Kantonsschule Trogen 2000 Ozon-Fluch und Segen? Seite 9 Anhang 1 Daniela Weber Kantonsschule Trogen 2000