ppt - ChidS
Werbung

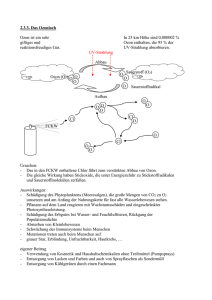
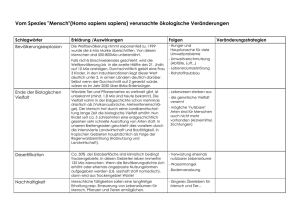
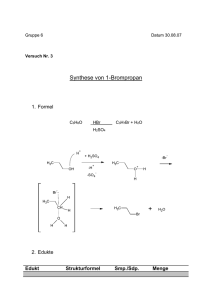
Experimentalvortrag zum Thema: „Einführung in die Halogenalkane“ Philipps-Universität Marburg Elmar Schneider Datum: 26.06.2008 Gliederung Allgemeine Informationen Physikalische Eigenschaften Synthesemöglichkeiten in der Schule Möglichkeiten der Weiterreaktion Verwendung Umweltproblematik Allgemeine Informationen Was macht ein Halogenalkan aus? Wasserstoffatome eines Alkans werden durch Halogenatome ersetzt Mehrere Wasserstoffatome können ausgetauscht werden Unterschiedliche Halogenatome können in ein Molekül eingefügt werden Ab drei C-Atomen Möglichkeit der Isomerie Allgemeines Versuch 1: Beilsteinprobe als Nachweis von Halogenen in Halogenalkanen Allgemeines Beilstein-Probe: Physikalische Eigenschaften Polare C-X Bindung Dipol-Dipol-WWK C-X Bindungsstärke nimmt mit zunehmender Größe von X ab Bindung wir länger und schwächer Physikalische Eigenschaften Demo 1: Dipolcharakter von Dichlormethan Physikalische Eigenschaften Dipolcharakter von Dichlormethan: Physikalische Eigenschaften Polare C-X Bindung Dipol-Dipol-WWK C-X Bindungsstärke nimmt mit zunehmender Größe von X ab Bindung wir länger und schwächer Physikalische Eigenschaften Polarisierbarkeit nimmt von R-F zu R-I zu Synthesemöglichkeiten in der Schule Elektrophile Addition von HX/X2 an Alkene Radikalische Halogenierung der Alkane Reaktion von Alkoholen mit HX Synthesemöglichkeiten in der Schule Versuch 2: Iodierung von π-Systemen Synthesemöglichkeiten in der Schule Iodierung von ∏-Systemen: δδ+ I I I I I I Synthesemöglichkeiten in der Schule Versuch 3: Radikalische Halogenierung von Heptan Synthesemöglichkeiten in der Schule Radikalische Halogenierung von Heptan: Möglichkeiten der Weiterreaktion Substitution SN1 SN2 Eliminierung E1 E2 Möglichkeiten der Weiterreaktion SN1: SN2: Möglichkeiten der Weiterreaktion SubstitutionsMöglichkeiten: Ether Thiole Alkohole Thioether Carbonsäureester andere Alkylhalogenide Nitrile Amine Phosphoniumsalze Möglichkeiten der Weiterreaktion E1: E2: Möglichkeiten der Weiterreaktion Überblick: Typ des Nucleophils (Base) stark basisches, ungehindertes Nu(z.B. CH3O-) stark basiches, gehindertes Nu(z.B. (CH3)3CO-) Typ des Halogenalkans schwaches Nu(z.B. H2O) schwach basisches, starkes Nu(z.B. I-) Methyl - SN2 SN2 SN2 primär - SN2 SN2, E2 E2 sekundär langsame SN1, E1 SN2 E2 E2 tertiär SN1, E1 SN1, E1 E2 E2 Verwendung Name Trichlormethan Tetrachlormethan Trivialname Formel Chloroform Tetrachlorkohlenstoff Triiodmethan Iodoform Dichlordifluormethan Frigen 12 Freon 12 Verwendung HCCl3 Lösungsmittel, Narkosemittel (krebserregend) CCl4 Lösungsmittel, Feuerlöschmittel, Reinigungsmittel (krebserregend) HCI3 Desinfektionsmittel CCl2F2 Kühlmittel, Treibgas (früher) Verwendung (1) Leitungsschlange (2) Kompressor (3) Kühlrippen (4) Lüftungsschlitze (5) Ventil (6) Thermostat Verwendung Demo 2: Kondensation bei Druckerhöhung Verwendung Kondensation bei Druckerhöhung: Je höher der Druck, je höher der Siedepunkt einer Substanz Gas wird flüssig (wenn kritische Temperatur nicht überschritten ist) Verwendung (1) Leitungsschlange (2) Kompressor (3) Kühlrippen (4) Lüftungsschlitze (5) Ventil (6) Thermostat Verwendung Demo 3: Verdunstungskälte Verwendung Verdunstungskälte: Joule-Thomson-Effekt: Bei der Expansion wird Arbeit gegen die intermolekularen Anziehungskräfte geleistet Energie wird der kinetischen Energie der Moleküle entnommen Abkühlung Verwendung Name Monochlorethan Bromtrifluormethan Brommethan Trivialname Formel Ethylchlorid Freon FE 13 B 1 Verwendung H5C2Cl Kälte-Anästhetikum BrCF3 H3CBr Feuerlöschmittel (6-12mal so effektiv wie „Tetra“, 4-7mal so effektiv wie CO2) Insektizid, Fungizid (!Methylierung!) Verwendung Brommethan-Unterschied: Methylierung von Aminen und Thiolen: Verwendung Name Trivialname Formel Verwendung Polyvinylchlorid PVC Rohre, Bodenbeläge, ... Polytetrafluorethylen PTFE Teflon Pfannen, Töpfe, Gore-Tex Umweltproblematik Ozonschicht: Verwendung Versuch 4: Absorption von UV-Strahlung durch Ozon Verwendung Absorption von UV-Strahlung durch Ozon: UV-Licht: UV-Licht wird absorbiert Umweltproblematik FCKW zerstören Ozon: Verwendung Versuch 5: Zerstörung von Ozon durch halogenierte Kohlenwasserstoffe Verwendung Zerstörung von Ozon durch halogenierte KW: Umweltproblematik Konsequenz: Montreal-Abkommen (1987) 31.12.1995 Produktionsstop Regenerierung bis 2010??? Summenformel CFCl3 CF2Cl2 C2F4Cl2 Lebensdauer in der Atmosphäre 50 Jahre 102 Jahre 300 Jahre Schulrelevanz (G8-Lehrplan) GK 11.G1 Kohlenstoffchemie I: Mechanismus der Addition von Molekülen des Typs X2 LK 11.G1 Kohlenstoffchemie I: Typ und Mechanismus der Addition von Molekülen des Typs X2 und HX und der Eliminierung; Alkanole: Reaktionstypen (Substitution) 10.G2 Einführung in die Kohlenstoffchemie: Halogenkohlenwasserstoffe (Halogenalkane): Eigenschaften und Reaktionen / Nachweisreaktion; Umweltgefährdung durch FCKW in der Atmosphäre Schulrelevanz (G8-Lehrplan) 10.G2 Einführung in die Kohlenstoffchemie: Mechanismus der radikalischen Substitution 9.G2 Säuren und Laugen: Nachweis ausgewählter Kationen 8.G2 Ordnung in der Vielfalt Atombau und Periodensystem: Verwendung verschiedener Halogene in Alltag und Technik 7.G1 Stoffe unterscheiden und isolieren: Aggregatzustände eines Stoffes in Abhängigkeit von der Temperatur deuten Vielen Dank für Ihre Aufmerksamkeit! Versuch 1: Beilsteinprobe als Nachweis von Halogenen in Halogenalkanen Versuch 2: Iodierung von π-Systemen Versuch 3: Radikalische Halogenierung von Heptan Versuch 4: Absorption von UV-Strahlung durch Ozon Versuch 5: Zerstörung von Ozon durch halogenierte Kohlenwasserstoffe Demo 1: Dipolcharakter von Dichlormethan Demo 2: Kondensation bei Druckerhöhung Demo 3: Verdunstungskälte