Malatbestimmung an CAM
Werbung

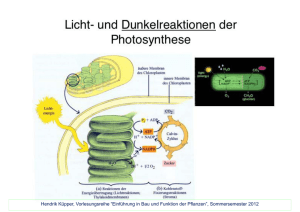
20.08.06 Melanie Thompson (Autor) Gruppe 4 Pflanzenphysiologischer Kurs Sommersemester 2006 Teil Stoffwechselphysiologie Versuch: Malatbestimmung an CAM-Pflanzen Einleitung In diesem Versuch soll die Malatkonzentration einer Pflanze bestimmt werden, die den sog. Crassulaceen-Säuremetabolismus oder CAM (crassculacean acid metabolism) betreibt. Um die Besonderheit des Stoffwechsels von CAM-Pflanzen verstehen zu können, muss man sich zunächst mit dem der C3- und C4-Pflanzen auseinander setzen. Die Kohlenstoff-Assimilation bei den weitaus am häufigsten vorkommenden C3-Pflanzen findet am Tage während der Lichtphase statt. Das Enzym Ribulose-1,5-bisphosphatCarboxylase/Oxygenase (kurz: RubisCO) überträgt das über die Stomata aufgenommene CO2 auf den Akzeptor Ribulose-1,5-bisphosphat (RubP). Das entstandene Reaktionsprodukt 2Carobxy-3-keto-D-arabinit-1,5-bisphosphat ist extrem instabil und zerfällt nach Wasseranlagerung in zwei Moleküle: 2-Carboxy-D-arabinit-1-phosphat und das erste fassbare Produkt der Photosynthese, der C3-Körper: D-3-Phosphoglycerat..Dieser wird anschließend in den Calvin-Zyklus eingespeist, bei dem aus dem assimilierten Kohlenstoff Hexosen gebildet werden. Diese Vorgänge geschehen alle in derselben Zelle. Die RubisCO ist ein sehr charakteristisches Enzym für die Photosynthese. Sie kommt in den Chloroplasten vor und besteht aus je 8 großen und 8 kleinen Untereinheiten, wobei die kleinen Untereinheiten im Kern, die großen im Chloroplasten selbst codiert werden. Die Affinität der RubisCO für CO2 ist groß, sinkt jedoch mit steigender Temperatur bei gleichzeitiger Abnahme der Löslichkeit des CO2 im Wasser. So kommt es bei intensiver Belichtung und/oder hohen Temperaturen vor, dass die RubisCO anstelle von CO2 O2 auf das hier ebenfalls als Akzeptor dienende Ribulose-1,5-bisphosphat überträgt, wobei nur ein Molekül D-3-Phosphoglycerat und zusätzlich ein C2-Körper, das 2-Phosphoglykolat, entsteht. Die Pflanze betreibt mit Hilfe der Photorespiration (so genannt, da es dabei zu einem Sauerstoffverbrauch unter Bildung von CO2 kommt) einen erheblichen Aufwand um den, durch den C2-Körper, dem Calvin-Zyklus entzogenen Kohlenstoff zurückzugewinnen. Bei den C4-Pflanzen verläuft die Kohlenstoff-Assimilation nach einem anderen Prinzip. Wie bei den C3-Pflanzen wird Kohlenstoff während der Lichtphase aufgenommen, jedoch entsteht als erstes Produkt ein C4-Körper: Oxalacetat. Das Oxalacetat wird in den Mesophyllzellen der C4-Pflanzen aus Phosphoenolpyruvat und HCO3--Ionen gebildet und anschließend zu Malat oder Aspartat umgesetzt. Diese Stoffe werden dann in den Calvin-Zyklus eingespeist, dieser findet jedoch nicht in den Mesophyllzellen, sondern in den Bündelscheidenzellen der C4Pflanzen statt. Damit sind die CO2-Vorfixierung und die Endfixierung, die durch das Enzym RubisCO vollführt wird, räumlich voneinander getrennt. Die Reaktionsfolge der CAM-Pflanzen vollzieht sich in ähnlicher Weise, wie die der C4Pflanzen, sie ist ebenfalls malatbildend und auch die CO2-Vorfixierung verläuft von der durch RubisCO geleisteten Endfixierung von Kohlenstoff getrennt, hier jedoch nicht räumlich, sondern zeitlich. Dieser Prozess wurde zunächst bei Crassulaceen entdeckt, darum auch als Crassulaceen-Säuremetabolismus oder CAM (crassculacean acid metabolism) bezeichnet. Bei allen CAM-Pflanzen wird nachts aus Stärke Phosphoenolpyruvat (PEP) gebildet und anschließend daraus unter Fixierung von CO2 durch die PEP-Carboxylase Oxalacetat hergestellt. Das daraus von der cytoplasmatischen, NAD-abhängigen Malatdehydrogenase gebildete Malat wird über einen Malatkanal in die Vakuole transportiert. Getrieben wird dieser Transport durch die transmembrane protonmotorische Kraft, die durch eine wasserstoffionentranslozierende ATPase am Tonoplasten erzeugt wird und zugleich die Gegenionen zum Malat-Anion liefert. Mit der Zeit sinkt der pH-Wert des Vakuoleninhalts ab, weshalb Malat in der Dunkelperiode zunehmend als protonierte Äpfelsäure vorliegt, diese permeiert im Vergleich zum Malat2--Anion besser über die Tonoplastenmembran, wodurch die steigende Wasserstoffionenkonzentration die Speicherkapazität für Malat in der Vakuole begrenzt. Da die Speicherkapazität in der Vakuole begrenzt ist, steigt der cytoplasmatische Malatgehalt an und hemmt daraufhin die PEP-Carboxylase, was mit zunehmender Dauer der Dunkelperiode die CO2-Vorfixierung limitieren. Am Tage wird das nachts gespeicherte Malat über den Malatkanal aus der Vakuole entlassen. Bei der Decarboxylierung am Tage gibt es drei Typen: NADP-Malatenzym-Typ (Cactaceae, Agavaceae) NAD-Malatenzym-Typ (Crassulaceae) PEP-Carboxykinase-Typ (Aclepiadaceae, Bromeliaceae, Liliaceae) Eine erneute Fixierung des im Licht durch eines dieser drei Enzyme freigesetzten CO2 durch die PEP-Carboxylase statt durch die RubisCO wird dadurch verhindert, dass die PEPCarboxylase im Licht von der aktiven (= phosphorylierten) „Nacht“-Form mit geringer Hemmbarkeit durch Malat in eine sehr schwache (= dephosphorylierte) „Tag“-Form mit großer Malatempfindlichkeit überführt wird. Damit hemmt also das aus der Vakuole austretende Malat das ohnehin am Tag schwach katalytisch aktive Enzym so stark, dass es keine CO2-Fixierung durchführen kann, damit steht das aus dem Malat freigesetzte CO2 also vollständig für die RubisCO zur Verfügung. Ökologische Vorteile des CAM sind, dass die CO2-Aufnahme durch geöffnete Stomata in der Nacht bei sehr viel tieferen Temperaturen und dementsprechend höherer Luftfeuchtigkeit als am Tage ablaufen kann, große Wasserverluste bei diesem Vorgang also vermieden werden. Am Tag ist bei guter Wasserversorgung nicht nur die Verwertung des CO2, das beim Malatabbau frei wird, möglich, sondern bei Erschöpfung des Malatspeichers auch die Öffnung der Stomata und Fixierung externen CO2. Herrscht Dürre schränken CAM-Pflanzen die Stomataöffnung und die damit verbundene Fixierung von externem CO2 in der Lichtphase viel schneller ein als im Dunkeln. CAM-Pflanzen erreichen durch ihre spezielle Reaktionsfolge unter Wassermangel sehr niedrige Transpirationskoeffizienten, haben damit einen geringeren Wasserbedarf als C3-Pflanzen. Die Speicherkapazität der Vakuole für Malat ist jedoch begrenzt, damit ist der tägliche Zuwachs an Biomasse bei ausschließlicher CO2Fixierung im Dunkeln sehr gering. CAM-Pflanzen sind v.a. auf trockenen Standorten konkurrenzfähig, bei denen kühle Nächte die Malatbildung und -speicherung fördern und gelegentliche, wenn auch seltene, dann aber sehr ausgiebige Niederschläge die Auffüllung der Wasserspeicher ermöglichen. Einige CAM-Pflanzen führen bei ausreichender Wasserversorgung eine normale C3-Photosynthese durch. Wassermangel oder auch Salzstress induziert die Bildung der Enzyme des CAM. Im Extremfall halten Wüstenpflanzen mit CAM bei großer Wasserknappheit ihre Stomata auch nachts geschlossen und refixieren das durch die zelluläre Atmung freigesetzte CO2. Um dennoch effektiv Kohlenstoff zu fixieren benötigen CAM-Pflanzen eine besondere Zellstruktur, großlumige Vakuolen in chloroplastenführenden Zellen sind ein entscheidender Faktor für Pflanzen mit CAMStoffwechsel. Um nun CAM-Pflanzen von anderen Pflanzen, vornehmlich den häufig vorkommenden C3Pflanzen, zu unterscheiden kann man als einfachen Versuchsansatz den Malatgehalt der Pflanzen experimentell bestimmen. Auch die Entwicklung des Malatgehalts im Laufe des Tages kann Aufschluss darüber geben, ob es sich um eine CAM-Pflanze, oder eine ebenfalls Malat-bildende C4-Pflanze handelt. Dies sind die diesem Versuch zu Grunde liegende Überlegung, wobei als Versuchspflanzen die Brutblattkindel (Bryophyllum daigremontiana), eine Pflanze , die unter normalen Bedingungen einen C3-Stoffwechsel, jedoch nach einem dreiwöchigen Trockenstress nun vermeintlich den CAM-Stoffwechsel betreibt, und die Hainbuche (Carpinus bétulus), als C3-Pflanze untersucht werden. Die Hainbuche dient dabei als Kontrollpflanze, die nicht unter Trockenstress stand und vor dem Versuch frisch „geerntet“ wurde. Material und Methoden Die für diesen Versuch eingesetzten Pflanzen waren zum einen die Brutblattkindel Bryophyllum daigremontiana, deren systematische Zuordnung wie folgt lautet: Abteilung: Spermatophyta o Unterabteilung: Angiospermae Klasse: Dicotyledoneae Unterklasse: Rosidae o Ordnung: Saxifragales Familie: Crassuláceae Gattung: Bryophyllum o Art: Bryophyllum daigremontiana (Brutblattkindel) und zum anderen die Hainbuche Carpinus bétulus, deren systematische Zuordnung folgende ist: Abteilung: Spermatophyta o Unterabteilung: Angiospermae Klasse: Dicotyledoneae Unterklasse: Hamamelididae o Ordnung: Fagales Familie: Coryláceae Gattung: Carpinus o Art: Carpinus bétulus (Hainbuche) Die genaue Vorgehensweise wurde dem Skript des „Pflanzenphysiologischen Praktikums, Sommersemester 2006“ der Johann Wolfgang Goethe Universität, Frankfurt am Main, entnommen. Vorgenommene Änderungen betrafen den letzten Teil des Versuches, das Bestücken der Photometerküvetten. Zum einen wurden die Küvetten zur Bestimmung des Blindwertes statt mit dem entnommenem Extrakt der Pflanzen mit derselben Menge (also 0,10ml) 3-Amino-1propanol-Puffer bestückt. Zum anderen wurden die Küvetten, die den Pflanzenextrakt enthielten zunächst nur mit 0,01ml MDH, und nach erfolgter Grundwertmessung mit 0,01ml GOT bestückt um die Reaktion zu starten. Nach Reaktionsablauf, der sich auf 10 Minuten belief, erfolgte die zweite Messung. Ergebnis Die nach erfolgter Messung zusammengefassten Messwerte sind in Tabelle 1 wiedergegeben. Tab. 1 zeigt die Zusammenfassung der Messergebnisse des Versuches. Dargestellt sind die einzelnen Proben der CAM-Pflanze entnommen zu verschiedener Uhrzeiten, sowie die Kontrollpflanzen. Festgehalten wurden die eingesetzten Gramm Frischgewicht, die Menge des abzentrifugierten Überstandes (z) und die zur pH-Wert-Einstellung benötigte Menge an K2CO2 (y) jeder Probe. Die vor Beginn der enzymatischen Reaktion gemessene Extinktion (E1) und die nach Start der Reaktion und Ablauf von 10min festgehaltene Extinktion (E2) jeder Probe. Der daraus ermittelt Wert E ergibt die schlussendliche Extinktion E, anhand derer die Malatkonzentration in molMalat/gFg der jeweiligen Probe errechnet wurden. B1 und B2 stellen die benötigten Blindwerte dar. Probe CAM Blätter entnommen zu verschied. Uhrzeiten gFg [g] z [ml] y [ml] 5 8 11 14 17 20 Kontrolle Blindwert K1 (Gr. 4) K2 (Gr. 3) B1 (Gr. 4) B2 (Gr. 3) E E molMalat gFg 1,41 -0,098 -0,085 0,013 0,013 4,935 1,78 -0,068 -0,053 0,015 0,015 6,31 1,53 0,036 0,056 0,2 0,2 43,19 1,9 0,065 0,058 -0,007 -0,007 -1,28 bzw. 0 2,4 0,08 0,085 0,005 0,005 0,0996 1,7 0 0,007 0,007 0,007 2,2 ca. 1,6 0,024 0,015 -0,009 -0,009 -8,41 bzw. 0 14,25 17,28 14,87 15 15,1 14,8 13,2 0,5 16,1 1,95 0,102 0,118 0,016 0,016 18,4832 - - - 0 0 0 - - - - - 0 0 0 - - Rechnung bestimmt: Mit: E2 1,32 1,45 2,43 2,95 2,81 1,68 0,5 Die Malatkonzentration in c E1 E ( z y ) 10 20 (d gFg ) molMalat gFg der Versuchspflanzen wurden anhand folgender B B2 E = Extinktion, zusammengesetzt aus E E 1 ; E wiederum 2 berechnet sich aus E E2 E1 . (z + y), wobei z das Gewicht des abgenommenen Überstandes und y die Menge an zugegebenem K2CO2 ist. Die 10 ist bedingt durch die 1:10 Verdünnung des Filtrates, was wiederum den Extrakt ergibt Die 20 rührt daher, dass 0,1ml Extrakt in 2ml Gesamtvolumen in der Küvette der 20te Teil von 2ml entspricht, es handelt sich also um eine erneute Verdünnung des Extraktes um das 20fache d = Schichtdicke der Küvette (hier: 1cm) = Molarer Extinktionskoeffizient ( von NADH+H+ bei 340nm: 6,25cm2/Mol) gFg = Gramm Frischgewicht, wichtig, da die Konzentration des Malates in dem verwendeten Gramm Frischgewicht ermittelt wird Da in diesem Fall die Differenz zwischen B1+B2 gleich Null ist, entspricht E = E. So berechnet sich bspw. die Malatkonzentration für die 5Uhr Probe wie folgt: c E ( z y) 10 20 0,013 (14,25 g 1,41ml) 10 20 40,716 4,935 (d gFg ) 8,25 cm 2 (1cm 6,25 1,32 g ) Mol In Abbildung 1 wurde die ermittelten Malatkonzentrationen im Tagesverlauf dargestellt: Malatkonzentration 50 45 43,19 40 µmolMalat/gFg 35 30 25 Malatkonzentration 20 15 10 5 4,935 6,31 2,2 0 0 5 0 15 10 0,0996 20 25 Uhrzeiten Abb. 1: Die Graphik zeigt die Malatkonzentration im Verlauf eines Tages. Die einzelnen Proben wurden zu den verschiedenen Uhrzeiten (5, 8, 11, 14, 17 und 20Uhr) entnommen und anschließend für 20Stunden eingefroren bevor sie weiter verarbeitet und der jeweilige Malatgehalt experimentell ermittelt wurde. Der Graphik nach zu urteilen, ist der Malatgehalt pro Gramm Frischgewicht um 5Uhr niedrig und steigt anschließend leicht an, sodass sich ein geringfügig höherer Wert um 8Uhr ergibt. Daraufhin steigt die Konzentration rapide an, bis sie laut Graphik um 11Uhr ihr Maximum erreicht, bis 14Uhr auf 0 absinkt und danach bis 20Uhr wieder leicht ansteigt. Diskussion Nach genauerer Betrachtung der Graphik und Vergleich mit den Literaturwerten, lässt sich erkennen, dass der Versuchsdurchlauf wohl nicht optimal funktioniert hat. Laut Literatur liegt der Malatgehalt bei CAM-Pflanzen morgens bei ca. 140Mol/gFg und sinkt im Laufe des Tages auf ca. 40Mol/gFg am Abend ab. Dies ist, verglichen mit dem Reaktionsmechanismus des CAM-Stoffwechsels, auch ein nachvollziehbares Ergebnis, denn die CAM-Pflanzen bilden das Malat aus Oxalacetat während der Nacht und bauen den Malatspeicher im Laufe des Tages ab, indem sie das Malat abbauen und das daraus freigesetzte CO2 in den Calvin-Zyklus einschleusen. So müsste der Malatgehalt also am Morgen maximal sein, und dann einen stetigen Abfall im Laufe des Tages zeigen, bis der Gehalt abends fast auf 0 fällt. In der hier dargestellten Graphik liegen also vor allem die Werte um 5Uhr und 8Uhr viel zu niedrig, sie müssten eigentlich über dem Wert von 11Uhr liegen. Dass der Malatgehalt ab 11Uhr rapide abfällt ist nachvollziehbar, da die Sonneneinstrahlung ab 11Uhr am stärksten ist, der Photosyntheseapparat hier am intensivsten arbeitet und am meisten CO2, und damit eben auch das Malat, verbraucht. Es ist sehr ungewöhnlich, dass der Malatgehalt um 14Uhr auf 0 fällt, dies wäre möglich, wenn die Sonneneinstrahlung überaus stark war und der Malatspeicher vollständig aufgebraucht wurde. In diesem Fall würde die Pflanze, sofern sie genügend Wasser zur Verfügung hat die Stomata öffnen um externes CO2 aufzunehmen. Steht ihr nicht genügend Wasser zur Verfügung wird sie eventuell das bei der Zellatmung entstehende CO2 refixieren. Also, im Grunde ist es schon möglich, dass die Malatkonzentration um 14Uhr auf 0 fällt, danach dürfte sie aber nicht mehr ansteigen, da Malat nur in der Dunkelphase gebildet wird. Die Malatkonzentration dürfte also erst wieder bei Einsetzen der Dunkelheit ansteigen, da CAM-Pflanzen nur während der Dunkelperiode CO2 in Form von Malat fixieren. Weiterhin ist ungewöhnlich, dass die Malatkonzentration der Versuchspflanze K2 ungewöhnlich hoch liegt. Eventuell wurden Fehler bei der Herstellung der Proben begangen, oder aber Werte wurden vertauscht, dies lässt sich jedoch im Nachhinein nicht mehr nachvollziehen. Alles in allem scheint dieser Versuch nicht vollkommen fehlerfrei verlaufen zu sein, da die Werte, vor allem die Werte am Morgen, stark von den Literaturwerten abweichen und auch im Bezug auf das Prinzip des CAM-Stoffwechsels nicht so erwartet wurden. Literaturhinweis Skript des „Pflanzenphysiologischen Praktikums, Sommersemester 2006“ der Johann Wolfgang Goethe Universität, Frankfurt am Main Peter Sitte, Elmar W. Weiler, Joachim W. Kadereit, Andreas Bresinsky, Christian Körner, Strasburger – Lehrbuch der Botanik für Hochschulen, 35. Auflage, Spektrum Akademischer Verlag, Heidelberg – Berlin, 2002 Wilhelm Nultsch, Allgemeine Botanik, 11. Auflage, Thieme Verlag, Stuttgart – New York, 2001 Karlheinz Senghas, Siegmund Seybold, Schmeil-Fitschen Flora von Deutschland, 91. Auflage, Quelle & Meyer Verlag, Wiebelsheim, 2000