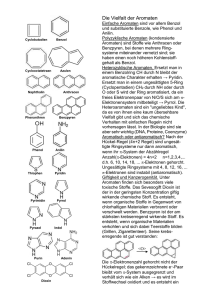
Aromatenchemie
Werbung
Philipps- Universität Marburg FB 15 Chemie Organisches Grundpraktikum für Lehramt Christian Achenbach, Anna-Lena Eicke, Arne Löcherbach CH3 O 2N NO 2 NO 2 Aromaten- Ein cyclisches System OH + N 1 Aromatenchemie Bei organischen Verbindungen, die das Molekülgesrüst des Benzols aufweisen, handelt es sich um Aromaten, die auch Arene genannt werden. Der Name Aromat geht auf die Benzol-Derivate zurück, das in vielen Pflanzen vorkommt und einen „aromatischen“ Geruch hat. Dies führt jedoch schnell zu einem Trugschluss, denn die meisten Arene zeigen keinen angenehmen Geruch. Der einfachste Aromat ist das Benzol. Darin sind sechs Kohlenstoffatome cyclisch miteinander verbunden und liegen ebenso wie die Wasserstoffatome in einer Ebene, sind also planar. Die Bindungswinkel betragen jeweils 120 °. Die C-C-Bindung liegt mit einer Länger von 139 pm genau zwischen der C-C-Einfachbindung mit 154 pm und der C-C-Doppelbindung mit 133 pm. Die elektronische Struktur des Benzols kann durch zwei theoretische mesomere Grenzformeln (auch Resonanzformeln) beschrieben werden. Tatsächlich liegt es jedoch in einer Mischform vor und wird deshalb durch einen Kreis, anstellen der Doppelbindungen gezeichnet: H H H H H H H H H H H H H H H H H H Alle Kohlenstoffatome des Benzols sind sp2-hybridisiert. Die s-Orbitale jedes Kohlenstoffatoms gehen je eine Bindung mit den benachbarten Kohlenstoffatomen, sowie einem Wasserstoffatom ein. Außerdem überlappt eine jedes p-Orbital des Kohlenstoffs gleichmäßig mit seinen beiden Nachbarn. Über- bzw. unterhalb der Kern-Kern-Bindungsachse bilden sich so kreisförmige π-Wolken, das delokalisierte π-Gerüst. Zusammen mit der δ-Gerüst, sind diese beiden Bindungsachsen für die Bildung des regelmäßigen Sechsecks verantwortlich. Abb. 1: Orbitaldarstellung der Bindungen im Benzol[5] Durch die Delokalisation der π-Elektronen erhält das Benzol seine hohe thermodynamische und kinetische Energie. Vergleicht man die Bindungsenergie vom Benzol mit der einer der theoretischen Grenzformeln, so ist die Bindungsenergie um 151 kJ/mol niedriger, wodurch das Benzol eine größere Stabilität ausweist. Diese Energiedifferenz wird als Mesomerie- oder Resonanzenergie bezeichnet. 2 Ein Aromat unterliegt der HÜCKEL-Regel. Diese besagt, dass ein aromatischer Zustand dann vorliegt, wenn (4n + 2) π-Elektronen im Molekül vorliegen mit (n = 0, 1, 2, 3, …), d.h., dass in dem Molekül 2, 6 oder 10 (…)π-Elektronen vorliegen müssen. Ein Aromat, der eine gerade Anzahl von π-Elektronen besitzt, aber nicht der HÜCKEL-Regel entspricht, ist ein Antiaromat, also kein Aromat. Diese sind nicht immer planar. Wie jede Regel hat auch die HÜCKEL-Regel ihre Ausnahmen. Das Corannulen hat 20 π-Elektronen, entspricht also nicht der HÜCKEL-Regel. Die Verbindung zeigt jedoch spektroskopisch und chemisch die gleichen Eigenschaften. Corannulen Nicht aromatische cyclische Kohlenstoffverbindungen gehören zu den Aliphaten. Kriterien für aromatische Verbindungen 1. Das Molekül ist cyclisch planar und besitzt konjugierte Doppelbindungen mit einem Bindungsabstand von 139 pm. 2. Das Molekül ist resonanzstabilisiert. 3. Das Molekül besitzt (4n + 2) π-Elektronen und entspricht damit der HÜCKEL-Regel. 4. An dem Molekül finden vorzugsweise Substitutionsreaktionen und nicht Additionsreaktion statt. CH3 Aromat Antiaromat Antiaromat 3 Aromat Reaktionen von Aromaten Elektrophile aromatische Substitution Elektronenreiche π-Systeme werden bevorzugt von Elektrophilen angegriffen. Dieses Elektrophil lagert sich an die Stelle eines Wasserstoffatoms an, welches dann substituiert wird. Die Reaktion ist mehrstufig (Additons-Eliminierungsreaktion). Zu erst addiert sich das Elektrophil an den Aromaten an, wodurch dieser Elektronendichte auf das Elektrophil überträgt und ein so genannter π-Komplex entsteht. Die so entstandene positive Ladung wird durch mesomere Grenzsturkturen stabilisiert. Durch die Abspaltung eines Protons wird das delokalisierte π-System und somit die Aromatizität wieder hergestellt. Das Proton wird von dem Gegenion des Elektrophils übernommen. Die Geschwindigkeit und die Position der elektrophilen Substitution, werden von anderen Substituenten des Aromaten beeinflusst. Beispiele für die elektrophile aromatische Substitution sind die Nitrierung von Phenol und die Kernbromierung von Toluol in diesem Heft. Nucleophile aromatische Substitution Die nucleophile aromatische Substitution wird von einem Nucleophil, also eine negativ geladenen Teilchen ausgelöst. Dies kann z.B. eine Lewis-Base sein. Ähnlich wie in der elektrophilen Substitution wird hier das Nucleophil gegen einen nucleophilen Substituenten ausgetauscht. Das sich lösende Nucleophil wird wiederum von dem Gegenion des angreifenden Nucleophils gebunden. Auch hier verläuft die Reaktion nach dem Additions-Eliminierungs-Mechanismus. Sie wird durch elektronenziehende Substituenten erleichtert. Beispiel: Cl OH NO 2 NO 2 Na2CO3, HOH + NO 2 NaCl NO 2 Radikalische Substitution Bei der radikalischen Substitution wird zu erst eine Verbindung homolytisch gespalten. Anschließend kommt es zur Startreaktion, der Kettenfortpflanzung und dem Kettenabbruch. Ein Beispiel für eine radikalische Substitution in diesem Heft, ist die Oxidation von Benzaldehyd. Zweitsubstitution an Benzol Zweifach substituierte Benzole treten in drei verschiedenen Konstitutionsisomeren auf. Als Beispiel dient hier Dimethylbenzol. Der zweite Substituent wird vom ersten in ortho-, meta- oder para-Stellung dirigiert (o-, m- bzw. p-). 4 CH3 CH3 CH3 CH3 CH3 o-Dimethylbenzol m-Dimethylbenzol CH3 p-Dimethylbenzol Aromaten bevorzugen Substitutionsreaktionen gegenüber Additionsreaktionen, weil eine Addition zum Verlust der Mesomeriestabilisierung führen würde. Mit Hilfe von Katalysatoren, Druck und Temperatur können sie jedoch gut hydriert, unter Einstrahlung von UV-Licht, halogeniert werden. Dirigierende Effekte Wie oben beschrieben dirigieren Substituenten des Benzols angreifende Substituenten in ortho-, meta- oder para-Stellung. Verantwortlich hierfür sind die induktiven und mesomeren Effekte. Ein induktiver Effekt wird ausgelöst durch die Elektronegativitätsunterschiede zwischen den Kohlenstoffatomen und den Substituenten. Diese Elektronegativitätsunterschiede sind für die asymmetrische Verteilung der Elektronen in der Atombindung verantwortlich und führen zu einer Polarisierung. Gruppen, die elektronenschiebend wirken, üben einen +I-Effekt aus, Gruppe, die elektronenziehend wirken, einen –I-Effekt. Der +I-Effekt schiebt Elektronen zum Kohlenstoffatom hin und erhöht an dieser Stelle somit die Elektronendichte, wodurch das Atom stabilisiert wird. Der –IEffekt hingegen zieht Elektronendichte vom Kohlenstoffatom ab und wirkt somit destabilisierend. Der induktive Effekt kann sich über bis zu zwei Bindungen auswirken, ist also lokal begrenzt. Der mesomere Effekt tritt immer dann auf, wenn ein Molekül konjugierte Doppelbindungen, also ein delokalisiertes π-System, besitzt. Wenn sich der Substituent mit einem freien Elektronenpaar an der Mesomerie beteiligen kann, spricht man von einem Mesomeren Effekt. Beim +M-Effekt erhöht sich die Elektronendichte des π-Systems und somit die Reaktivität des Moleküls. Es wird ein elektrophiler Angriff in ortho- oder para-Stellung erleichtert. Der –M-Effekt hingegen entzieht dem π-System Elektronendichte, da der Substituent Mehrfachbindungen enthält und somit Ladungsdichte des πSystems aufnimmt. Hier wird ein nucleophiler Angriff in ortho- oder para-Stellung erleichtert. Tabelle 1: Induktive und mesomere Effekte +I-Effekt -I-Effekt +M-Effekt -M-Effekt -CH3 -SO3H -Cl, -Br -C(=O)R -CO2- -NH3+ -OH -NO2 -O- -NO2 -NH2 -CN 5 Die I- und M-Effekte eines Substituenten sind entweder gleichgerichtet, oder konkurrieren. Der MEffekt wirkt sich stets stärker aus, als der I-Effekt. Literaturangaben: [1] Fachinformationszentrum Chemie, http://www.chemgapedia.de (letzter Zugriff: 23.11.08, 15:09 Uhr) [2] Kirste, B., Substitutionsreaktionen an Aromaten, Institut für Chemie und Biochemie, Freie Universität Berlin, http://www.chemie.fu-berlin.de/chemistry/oc/oc2/aromaten.html#1 (letzter Zugriff: 9.12.08, 20:04) [3] Vollhardt, K. Peter C., Schore, Neil E., Organische Chemie, Vierte Auflage, Wiley-VCH, Weinheim, 2005 [4] Wikimedia Foundation Inc., http://de.wikipedia.org (letzter Zugriff: 8.12.08, 15:09 Uhr) Bildquelle: [5] CompuChem, Software Chemie, http://www.compuchem.com/gif2003/umorb.gif, (letzter Zugriff: 8.12.08, 15:09 Uhr) 6 Station 1 Nitrierung von Phenol Sicherheitsvorkehrung: Kittel, Schutzbrille, Handschuhe, Arbeiten im Abzug Chemikalien Phenol T, C Schwefelsäure (w = 96 %) C Salpetersäure (w = 65 %) C, O Natronlauge (c = 2 mol/L) C Wichtig: Du arbeitest mit stark ätzender H2SO4 , also Handschuhe tragen! Materialien/Geräte Reagenzglas, Reagenzglasständer, Pipette Versuchsdurchführung 1. Kittel, Schutzbrille und Handschuhe anziehen!!! 2. Löse eine Spatelspitze Phenol in wenig Ethanol. 3. Gib 5 Tropfen Schwefelsäure dazu. 4. Gib tropfenweise Salpetersäure hinzu. Entsorgung Die Lösungen werden mit Natronlauge neutralisiert und in den Behälter für organische Lösungsmittel gegeben. Aufgabe: 1. Notiere deine Beobachtungen. 2. Zeichne und beschreibe den Mechanismus der Nitrierung von Phenol! Nach welchem Mechanismus verläuft die Reaktion? 7 Theorie zur Nitrierung von Phenol Zuerst protoniert die Schwefelsäure die Salpetersäure: H2NO3+ + HSO4- HNO3 + H2SO4 Im nächsten Schritt zerfällt H2NO3+ in Wasser und das Nitroniumion: H2NO3+ H2O + NO2+ Das positiv geladene Stickstoffatom des Nitroniumions addiert sich unter Aufbrechen einer Doppelbindung an den Ring des Phenols an. Dadurch klappt eine Doppelbindung im Nitroniumion auf und das entsprechende Sauerstoffatom ist negativ geladen, das Stickstoffatom, aufgrund seiner Vierbindigkeit, positiv. Entweder eins der beiden meta-Kohlenstoffatome des Phenols oder das Kohlenstoffatom, an das die Hydroxygruppe selbst gebunden ist, ist ebenfalls positiv geladen. Es entsteht also im Übergangszustand ein Carbokation, dessen positive Ladung durch das Ringsystem und die Hydroxygruppe stabilisiert wird. Unter Abspaltung des Wasserstoffatoms, das an das Kohlenstoffatom gebunden war, welches wiederum das Nitroniumion gebunden hat, bildet sich die Doppelbindung und damit der so genannte π-Komplex wieder aus. OH OH + O H + N + N O + OH OH H O + + - O N -H OH O + O N O Abb. 2: ortho-Nitrierung des Phenols 8 H + N O- - O O + OH H + N O - O Die Nitrierung des Phenols in para-Position erfolgt analog: OH OH + OH OH + OH + O N + O + - O N + + - O H N - + O H N O O - + O H + H O O -H N + OH N O O Abb. 3: para-Niterierung des Phenols Da bei einer meta-Substitution keine Mesomeriestabilisierung des Cyclopentadienylkations durch den Sauerstoff möglich ist, findet keine meta-Substitution statt: OH OH OH + + H H + + N O H + - N O O + - N O O O - Abb. 4: meta-Mesomeriestabilisierung In der Zweit- und Drittsubstitution wird die Nitrogruppe erneut wieder in ortho- und para-Position dirigiert. Es entstehen nach gleichem Mechanismus folgende Produkte: OH O OH OH N N N O O o-Nitrophenol O p-Nitrophenol O O O N O O N OH O N O N N N O OH O O O O 2,4-Dinitrophenol 9 O 2,4,6-Trinitrophenol 2,6-Dinitrophenol O Die Nitrierung von Phenol verläuft nach dem Mechanismus der elektrophilen aromatischen Substitution, da sie durch ein starkes Elektrophil ausgelöst wird. Das elektrophile Nitroniumion wird dabei gegen ein Wasserstoffatom ausgetauscht bzw. substituiert. Da die Nitrogruppe des o- bzw. p-Nitrophenols einen –M- und –I-Effekt ausüben, also das delokalisierte π-System destabilisieren, deaktivieren sie den Aromaten gegenüber einer erneuten elektrophilen Substitution. Aus diesem Grund erhält man bei der Nitrierung von Phenol häufig nur ound p-Nitrophenol. Phenol Phenol wirkt im Allgemeinen desinfizierend. Da es jedoch ätzend und außerdem ein Nerven- und Zellgift ist, wird es nicht zur Wunddesinfektion eingesetzt. Benutzt wird es jedoch zu Herstellung einiger Medikamente, wie beispielsweise der Synthese von Acetylsalicylsäure (Aspirin). Ebenso dient es zur Unkrautvernichtung und Herstellung von Kunstharzen wie z.B. Bakelit, welches eines der ersten hergestellten Kunstharze darstellt. Eine Mischung aus Phenol, Chloroform und Isoamylalkohol hilft Mikrobiologen, aus organischem Gewebe hochreine DNA zu gewinnen. Im zweiten Weltkrieg benutzen KZ-Ärzte Phenolinjektionen, um Häftlinge zu töten. 2,4,6-Trinitrophenol, auch Pikrinsäure genannt, ist als Sprengstoff bekannt. Sie explodiert trocken auch schon ohne Sauerstoffzufuhr. Aus diesem Grund muss die Pikrinsäure zur Aufbewahrung mit Wasser versetzt werden. Kommerzielle Anwendung findet die Pikrinsäure in Streichhölzern, in der Lederindustrie und für elektrische Batterien. Fazit Zuerst muss ein elektrophiles Teilchen hergestellt werden, welches im nächsten Schritt den Aromaten angreift. Durch Abspaltung eines H-Atom, welches durch das Gegenion des Elektrophils gebunden wird, entsteht der Aromat mit dem neuen Substituenten. Literaturangaben Versuchsquelle: [1] Cornelsen GmBH, Nitrierung von Phenol, http://www.chemieunterricht.de/dc2/phenol/v06.htm (letzter Zugriff: 23.11.08, 10:03 Uhr) Fachquellen: [2] Unfallkasse Hesse (UKH), Hessisches Kultusministerium, Hessisches GefahrstoffInformations System Schule (HessGISS), Version 11.0, 2006/2007 [3] Lehrplan Chemie für die Jahrgansstufen G7 bis G12 des hessischen Kultusministeriums, 2005 (http://www.kultusministerium.hessen.de/irj/HKM_Internet?uid=3b43019a-8cc6-1811-f3efef91921321b2) [4] Fachinformationszentrum Chemie, http://www.chemgapedia.de (letzter Zugriff: 23.11.08, 15:09 Uhr) [5] Vollhardt, K. Peter C., Schore, Neil E., Organische Chemie, Vierte Auflage, Wiley-VCH, Weinheim, 2005 [6] Wikimedia Foundation Inc., http://de.wikipedia.org (letzter Zugriff: 23.11.08, 15:09 Uhr) 10 Station 2 Herstellung von Orange II- Ein Azofarbstoff mit Geschichte Sicherheitsvorkehrung: Kittel, Schutzbrille, Handschuhe, Arbeiten im Abzug Chemikalien Wichtig Sulfanilsäure Xi ß-Naphtol Xn,N Natriumcarbonat Xi Natriumnitrit T,O,N Natronlauge (30%ge) C Ethanol F Du arbeitest mit stark basischer Natronlauge, deshalb Handschuhe tragen! Materialien/Geräte Waage, 2 Magnetrührer mit Rührfisch, Becherglas (300 mL), Messzylinder, Spatel, Glasstab, 2 Bechergläser (100 mL), 2 Eiswannen, Thermometer, Tropfpippeten, Indikatorpapier Versuchsdurchführung 1. Arbeite nur mit Handschuhe, Kittel und Schutzbrille 2. In das mit ein wenig Eis gefüllte Becherglas (300 mL) werden 2 g Sulfanilsäure und 15 mL entionisiertes Wasser gegeben. 3. Stelle den Magnetrührer an (ca. 200 Umdrehungen) und warte bis die beiden Stoffe sich vermischt haben. 11 4. Gebe 2 bis 3 Spatelspitzen Natriumcarbonat hinzu. 5. Prüfe mit dem pH-Papier nach, ob das Gemisch neutral ist (pH 6-7). 6. Säuere das Gemisch nun mit mehreren Tropfen Salzsäure an. Überprüfe mit dem pH-Papier (pH 1) 7. Füge dem Gemisch 0,7 g Natriumnitrit zu. 8. Miss die Temperatur, sie sollte nicht mehr als 5 °C übersteigen. 9. Fülle in ein 100 mL Becherglas etwa 50 mL entionisiertes Wasser und erhitze dieses auf dem zweiten Magnetrührer. 10. Vermische in einem weiteren Becherglas (100 mL) mit einem Glasstab 1,6 g β-Naphthol und 2 mL Ethanol mit 3 mL Natronlauge 11. Füge gerade soviel heißes entionisiertes Wasser hinzu, bis der entstandene Brei sich löst und stelle das Becherglas mit dem Inhalt vorsichtig in die Eis/Salzmischung zum Abkühlen. 12. Schütte nun die kalte Naphthol-Lösung vorsichtig in das Becherglas mit der SufanilsäureLösung und rühre um. Entsorgung Die Lösungen werden neutral im organischen Abfall entsorgt. Aufgabe: 1. Notiere die Versuchsbeobachtungen 2. Im ersten Schritt des Mechanismus wird ein Nitrosylkation (NO +) benötigt. Dieses bildet sich durch Protonierung der salpetrigen Säure (HNO2). N HNO2 + H+ + O + H2O Betrachte die Chemikalien des Versuches. Durch welche Stoffe kommt es zur Reaktion, bei der die salpetrigen Säure das Produkt ist? 3. Wichtiges Zwischenprodukt der Reaktion ist das Diazonium-Ion. Dies entsteht unter Abspaltung von Wasser. Überlege dir, aus welchen Edukten es gebildet wird. N + N + H O H HO 3S Diazonium-Ion 4. Nach der Bildung des Diazonium-Ions komm es zu einer so genanten Azokupplung mit dem angesprochenen Diazonium-Ions und dem ß-Naphtol. Durch eine elektrophile aromatische 12 Substitution werden die beiden aromatischen Systeme Verbunden. Überlege dir, welches Produkt entsteht. OH N + N HO 3S Diazonium-Ion -Naphthol Auswertung zu Orange II- Ein Farbstoff mit Geschichte Orange II gehört zur Stoffklasse der Azofarbstoffe. Diese Farbstoffe werden synthetisch hergestellt und finden in vielen Bereichen der Industrie Verwendung. Charakteristisch für alle Azofarbstoffe ist eine oder mehrere Stickstoffdoppelbindungen, die sich meist in der Mitte des Moleküls befinden. R R N N Durch die Industrialisierung kam es zu einem Aufschwung aller Industriezweige. In der Textilindustrie reichten durch die rasante Entwicklung die natürlich gewonnenen Farbstoff nicht mehr aus. Somit wurde in der Farbforschung rege nach synthetischen Farbstoffen geforscht. 1859 wurde durch den Engländer W. Perkins aus Steinkohleteer der erste synthetische Farbstoff entwickelt. Er synthetisiert Mauvein, welches aber kein Azofarbstoff ist. Durch diesen Erfolg wurde noch mehr Geld in die Erforschung von Farbstoffen gesteckt. Schnell wurden mit Anilingelb und Bismarckbraun die ersten Azofarbstoffe synthetisiert, welche auch aus Steinkohleteer synthetisiert wurde. Anilingelb ist bis heute ein wichtiger Ausgangstoff zur Synthese verschiedener weiterer Azofarbstoffe. Die Azofarbstoffe sind bis heute die am meisten synthetisierte Stoffklasse der Farbstoffe. Charakteristisch sind neben der Stickstoffdoppelbindung auch aromatische Reste, die sich an den - Elektronen System für die charakteristische Farbe. Bei der industriellen Herstellung der Azofarbstoffe wird wie in unserem Versuch verfahren. Zuerst wird ein Diazonium-Ion hergestellt. Meist sind hier Amine und Natriumnitrit-Lösung, die mit Säure versetzt werden, die Edukte der Reaktion. In unserem Versuch kommt es zu folgender Reaktion. 13 OH N O NH2 N H + O + N Tautomerie N HO 3S N H -H+ HO 3S O S OH O N H +H+ N O N HO 3S + N + H + -H2O H O H HO 3S Zu Beginn der Reaktion kommt es zu einer Addition der beiden Edukte. Durch Abspaltung eines Protons und Tautomerie ( Wanderung eines Wasserstoff-Ions innerhalb des Moleküls), entsteht eine weitere Zwischenstufe. Durch das wiederholte Aufnehmen des Protons, kommt es zur Bildung von Wasser, welches rasch abgespalten wird. Das entstandene Diazonium- Ion reagiert dann rasch mit einem anwesenden aromatischen System weiter, welches in unserem Versuch das ß- Naphtol ist. + OH OH N + N H N N SO 3H -Naphtol -H HO 3S + OH N N SO 3H Orange II Durch die vielfältigen Möglichkeiten der Synthese werden Azofarbstoffe in vielen verschiedenen Teilen der Farbindustrie eingesetzt. So sind sie beliebte Indikatoren von Säure-Base Reaktionen. Bekannte Azofarbstoffe sind hier das Methylrot oder auch das Methylorange. Diese Farbstoffe ändern bei Protonenzugabe ihre Farbe. Oft wird an den Stickstoffdoppelbindungen protoniert. Derweil finden Azofarbstoffe auch Anwendung in der Lebensmittelindustrie, ausgewählte Farbstoffe sind noch bis heute zugelassen. Diese besitzen Sulfongruppen, um die Löslichkeit in Wasser zu erhöhen, sodass die Löslichkeit in Fetten vermindert wird, womit es keine Aufnahme in den menschlichen Körper gibt. 14 Auch das im Versuch synthetisierte Orange II war bis 1995 als Farbstoff in Lebensmitteln zugelassen. Doch die gesamte Klasse der Sudanfarbstoffe, zu dem Orange II gehört, wurde wegen der erwiesenen Abspaltung von Aminen im menschlichen Organismus verboten. Des Weiteren, werden Azofarbstoffe Diesel beigemischt, da dieser neben dem Gebrauch als Kraftstoff auch als Heizöl in unseren Wohnungen verwendet wird. Die Verwendung als Heizöl ist staatlich subventioniert. So ist das Befüllen von Heizöl in ein Auto in Deutschland eine Straftat. Es kann zur Anklage wegen Steuerhinterziehung kommen. Um diesen Missbrauch einzudämmen, wird dem Heizöl Sudan III und Solvent Yellow 124 beigemischt. N N N N N N CH3 HO N O O CH3 Sudan III CH3 CH3 Solvent Yellow 124 Sudan III ist ein roter Farbstoff, Solvent Yellow 124 hingegen gelb. Letzterer wird zusätzlich zugemischt, da Sudan III relativ leicht zu entfernen wäre. Beide Farbstoffe spielen aber bei der Verbrennung im Auto oder Heizung keine störende Rolle. Fazit Auch hier greift ein Elektrophil den Aromaten an, wobei, durch die Azokopplung, ein intensiv gefärbter Azofarbstoff mit einer N=N-Bindung entsteht. Versuchsquelle: [1] Organische Chemie, Schulbuch für die Sek II, Schroedel-Verlag, Hannover, 1993 Fachquellen: [2] Unfallkasse Hesse (UKH), Hessisches Kultusministerium, Hessisches GefahrstoffInformations System Schule (HessGISS), Version 11.0, 2006/2007 [3] Lehrplan Chemie für die Jahrgansstufen G7 bis G12 des hessischen Kultusministeriums, 2005 (http://www.kultusministerium.hessen.de/irj/HKM_Internet?uid=3b43019a-8cc6-1811-f3efef91921321b2) [4] Breitmaier,E./Jung, G., Organische Chemie, 4. Auflage, Thieme, Stuttgart/New York. 2001 [5] Vollhardt, K. Peter C., Schore, Neil E., Organische Chemie, Vierte Auflage, Wiley-VCH, Weinheim, 2005 [6] Wikimedia Foundation Inc., http://de.wikipedia.org (letzter Zugriff: 07.12.08, 9.34 Uhr) 15 Station 3 Herstellung von Aspirin oder wenn der Kopf mal wieder brummt. Sicherheitsvorkehrung: Kittel, Schutzbrille, Handschuhe, Arbeiten im Abzug Chemikalien Salicylsäure Xn Essigsäureanhydrid C Schwefelsäure (konz.) C Wichitg Du arbeitest mit stark ätzender H2SO4 , also Handschuhe tragen! Materialien/Geräte Waage, Messpipette, Peleusball, Erlenmeyerkolben, Becherglas, Wasserbad, Magnetrührer, Filter, Glastrichter, Reagenzglas, Reagenzglasklammer, Tropfpipetten Versuchsdurchführung 5. Kittel, Schutzbrille und Handschuhe anziehen!!! 6. Wiege 2 g Salicylsäure und vermische diese mit 5 mL Essigsäureanhydrid in einem Reagenzglas 7. Füge zum Gemisch nun 5 Tropfen Schwefelsäure hinzu. 8. Erwärme das Reagenzglas nun im Wasserbad. 9. Füge zur Hydrolyse des überschüssigen Anhydrids einige Tropfen Wasser hinzu. 10. Schütte den Inhalt des Reagenzglases nun in ein Becherglas, welches mit 100 mL entionisiertem Wasser gefüllt ist. 11. Filtriere nun den Niederschlag mit einem Filter. Entsorgung Die entstandene Acetylsalicylsäure (Aspirin) kann in der Feststofftonne entsorgt werden. Das Filtrat wird neutral im organischen Abfall entsorgt. 16 Aufgabe: 1. Schreibe deine Versuchsbeobachtung auf. 2. Zur Reaktion wird Salicylsäure und Essigsäureanhydrid benutzt. Überlege dir, nach welchem Mechanismus die Reaktion ablaufen muss. Mit welchem Stoff wird die Reaktion katalysiert? Welches Produkt entsteht neben der Acetylsalicylsäure (Aspirin). O O OH O OH OH O O + + H3C Salicylsäure CH3 O ??? O CH3 Acetylsalicylsäure Essigsäureanhydrid (Aspirin) Auswertung zu Aspirin oder wenn der Kopf mal wieder brummt In der Steinzeit wurde der Kopfschmerz als Dämon angesehen, der sich in den Kopf eingenistet hatte. Somit musste dem Patienten logischerweise der Kopf aufgebohrt werden, damit der böse Geist aus der Schädeldecke entweichen konnte. Die Griechen, wie auch die Ägypter, waren in ihren Behandlungsmethoden schon etwas fortgeschrittener. Diese beruhte vor allem auf der Verwendung von pflanzlichen oder alkoholhaltigen Drogen. So wurden zum Beispiel die Blätter und Rinde eines Weidenstrauches abgekocht und zur Schmerzlinderung eingenommen. Auch die Mediziner des Mittelalters griffen auf diese Methode zurück. Doch die Gewinnung dieses bitteren aber zugleich schmerzlindernden Extraktes wurde verboten. Somit geriet das Heilmittel in Vergessenheit. Stattdessen wurde jetzt ein Extrakt aus der Chinarinde gewonnen, welche aus Peru extra importiert wurde. Als aber 1806 Napoleon die Kontinentalsperre verhängte, wurde in heimischen Gefilden wieder die Weidenrinde verwendet. Schon 1828 extrahierte der Pharmazeut J. A. Buchner aus der Rinde eine gelbe, kristalline Masse. Diese nannte er Salicin. 1838 entstand aus dieser Substanz durch den Mediziner R. Piria die Salizylsäure. 1853 wurde dann durch Charles Gerhardt die Acetylsalicylsäure entwickelt, diese war aber leider chemisch stark verunreinigt und somit als Medikament nicht zu verwenden. Erst 1859 entschlüsselte der Chemieprofessor H. Kolbe die Struktur der Salicylsäure. Er erkannte, dass sie aus Phenol, Kohlenstoffdioxid und Natronlauge herzustellen ist. Diese Synthese wurde später von R. Schmitt weiterentwickelt und ist somit als Kolbe- Schmitt- Synthese bekannt. 17 Leider war die Salicylsäure ein übel schmeckendes Produkt. Zusätzlich verursachte es nach Einnahme Brechreiz und Übelkeit. Zudem wurden Mund, Rachen und Magen stark gereizt. Somit war es als Medikament völlig untauglich. Doch schon 1897 gelang es Felix Hoffmann, einem jungen Chemiker, die Acetylsalicylsäure rein und haltbar aus Salicylsäure und Essisäureanhydrid zu gewinnen. Hier wurden die Aufzeichnungen von Charles Gerhardt als Grundlage benutzt. Acetylsalicylsäure (kurz ASS) wurde alsbald klinisch getestet. Schnell wurde es unter dem Namen Aspirin in den Handel gebracht. Der Name entstand aus den Kürzeln Acetyl und Spir von Spirsäure, welche aus der Spirstaude gewonnen wurde und die gleiche Substanz wie die Salicylsäure darstellt. Schnell wurde Aspirin zum führenden Schmerzmittel, da die Effektivität sehr hoch war und die Nebenwirkungen gering. Erst 1971 entdeckte J. A. Vane, dass ASS die Bildung verschiedener Botenstoffe im Körper hemmt. Diese Botenstoffe sind zur Regulierung der Blutgefäße und der Aktivität der Blutplättchen verantwortlich. Sie sind so an der Entstehung von Fieber, Schmerz und Entzündungsvorgängen im menschlichen Körper verantwortlich. Die Herstellung der Acetylsalicylsäure läuft heute wie zu Zeiten von Charles Gerhardt ab. Die Salicylsäure wird durch eine Carboxylierung von Natriumphenolat durchgeführt. Durch die Wechselwirkungen des Natriums mit dem Phenolat und dem Kohlenstoffdioxid kommt es zur Reaktion. Durch Tautomerie, Wanderung von Wasserstoffatomen innerhalb des Moleküls, im letzten Schritt, entsteht das Natriumsalicylat, ein Salz der Salicylsäure. + O - Na - O ........... Na +........ O O- Na O +CO2 + O C H O 0 OH Tautomerie O Na O Dies ist die erwähnte Kolbe- Schmidt- Synthese. Die eigentlich wichtige Reaktion läuft nach dem Protonieren des Essigsäureanhydrids ab. H3C O O CH3 + + H H3C O O O Diese protonierte Form reagiert sofort mit der Salicylsäure. 18 + C OH CH3 O O OH OH OH + O O C H3C O OH + HO + CH3 CH3 O + C HO CH3 O OH + -H + O HO O O CH3 CH3 Es entsteht Acetylsalicylsäure (ASS) und Essigsäure. Fazit Aus der Salicylsäure erhält man mit CO2 das Salz der Salicylsäure, welches dann mit der protonierten Form des Essigsäureanhydrid zur Acetylsalicylsäure (ASS) reagiert. Versuchsquelle: [1] Organische Chemie, Schulbuch für die Sek II, Schroedel-Verlag, Hannover, 1993 Fachquellen: [2] Unfallkasse Hesse (UKH), Hessisches Kultusministerium, Hessisches GefahrstoffInformations System Schule (HessGISS), Version 11.0, 2006/2007 [3] Lehrplan Chemie für die Jahrgansstufen G7 bis G12 des hessischen Kultusministeriums, 2005 (http://www.kultusministerium.hessen.de/irj/HKM_Internet?uid=3b43019a-8cc6-1811-f3efef91921321b2) [4] Breitmaier,E./Jung, G., Organische Chemie, 4. Auflage, Thieme, Stuttgart/New York. 2001 [5] Vollhardt, K. Peter C., Schore, Neil E., Organische Chemie, Vierte Auflage, Wiley-VCH, Weinheim, 2005 [6] Wikimedia Foundation Inc., http://de.wikipedia.org (letzter Zugriff: 07.12.08, 10:49 Uhr) 19 Station 4 Oxidation von Benzaldehyd Sicherheitsvorkehrung: Kittel, Schutzbrille, Handschuhe Wichtig Chemikalien Benzaldehyd Xn Natriumcarbonat Xi Kaliumpermanganat O Ethanol F Salzsäure konz. C Du arbeitest mit stark ätzender H2SO4 , also Handschuhe tragen Wasser Materialien/Geräte Reagenzglasständer, 2 Reagenzgläser, Spatel, 3 Pipetten, Magnetrührer, Becherglas, Trichter, Faltenfilter Versuchsdurchführung 12. Kittel, Schutzbrille und Handschuhe anziehen!!! 13. Gib in ein Reagenzglas eine Spatelspitze Natriumcarbonat. 14. Gib einige Kristalle Kaliumpermanganat hinzu und löse die Mischung in Wasser. 15. Verteile die Lösung auf zwei Reagenzgläser. 16. Gib eine Pipettenfüllung Benzaldehyd in eines der Reagenzgläser und erwärme das Gemisch 3 min im Wasserbad. 17. Gib 15 Tropfen Ethanol hinzu und lass die Lösung abkühlen. 18. Filtriere über dem Faltenfilter ab. 19. Versetzt die klare Lösung mit konzentrierter Salzsäure. Entsorgung Die Lösungen werden mit Natronlauge neutralisiert und in den Behälter für organische Lösungsmittel gegeben. Der Filter wird getrocknet und im Behälter für Feststoffabfälle entsorgt. 20 Aufgabe: 3. Notiere deine Beobachtungen. 4. Zeichne die Strukturformeln von Benzaldehyd. 5. Die Reaktion des Benzaldehyds mit Kalumpermangant erfolgt über einen Radikalmechanismus: O O + H MnO 4 C - O C + + + H MnO 4 2- O + + MnO 4 C - + MnO 4 2- Was passiert im nächsten Schritt, wenn sich ein Molekül Wasser an das Carbeniumion anlagert? Welches Produkt erhältst du? 6. Die Benzoesäure kann erst durch die Salzsäure gefällt werden. Was passiert da genau? Tipp: Es wird zwischenzeitlich ein Salz, das Benzolat, gebildet und das Natriumcarboant liegt im Wasser in folgendem Gleichgewicht vor: Na2 CO3 + H2O NaHCO3 + NaOH 7. Welche Substanz ist für die Braunfärbung verantwortlich? Theorie zur Oxidation von Benzaldehyd Die Reaktion erfolgt über einen Radikalmechanismus. Das Permanganat sorgt dafür, dass sich das Wasserstoffatom der Aldehyd-Gruppe abspaltet, wodurch das Kohlenstoffatom zum Radikal wird. Das Permanganat selber nimmt ein Elektron auf und wechselt die Oxidationsstufe von (+VII) zu (+VI) O O H + MnO 4 C - + + H + MnO 4 2- Im nächsten Schritt gibt ein Permanganat-Ion in der Oxidationsstufe (+VII) ein Elektron an das Kohlenstoffatom der ehemaligen Aldehyd-Gruppe ab, wodurch dieses positiv geladen ist. 21 O O + C + MnO 4 C - + MnO 4 2- Durch Anlagerung eines Wassermoleküls und Abspaltung eines Wasserstoffatoms entsteht die Benzoesäure. Die entstehenden Protonen werden von der alkalischen Lösung abgefangen. O + C O O + C C H2 O + O H Das entstehende MnO42- disproportioniert OH H unter -H + Sauerstoffentwicklung zu Braunstein und Permanganat: + VI + IV 3 MnO42- Das Natriumcarbonat, welches zu + VII MnO2 + 2 MnO4- + O2 Beginn gelöst wurde, reagiert mit Wasser zu Natriumhydrogencarbonat und Natronlauge: Na2 CO3 + H2O NaHCO3 + NaOH Die Natronlauge sorgt dafür, dass die Benzoesäure als Salz vorliegt und dieses Salze ist in Wasser löslich: O O C C - + Na + OH + OH NaOH + H2O Durch Zugabe der Salzsäure bildet sich die Benzoesäure zurück und sie fällt als weißer Niederschlag aus: 22 O - + Na O + C OH C HCl OH + NaCl + + H Fazit Benzaldehyd wird durch das Kaliumpermanganat oxidiert, welches in einer Hydrolyse zu Benzoesäure weiter reagiert. Benzaldehyd Benzaldehyd ist Hauptbestandteil von Bittermandelöl in Form von Amygdalin. Bittermandelöl besteht zu 95 % aus dem nach Marzipan riechenden Benzaldehyd. Wird dieses mit Ethanol stark verdünnt, so bildet sich ein Geruch nach Wildkirsche. Benzaldehyd wird vorrangig als Duftstoff in Parfüms und in der Lebensmittelindustrie als Aromastoff eingesetzt. Es kann jedoch auch künstlich durch radikalische Chlorierung bzw. Bromierung von Toluol hergestellt werden. Da Brom jedoch sehr teuer ist, wird es durch die radikalische Chlorierung synthetisiert. Vor dem Verkauf muss es jedoch chlorfrei sein, um den Ansprüchen des Food Chemicals Codex zu erfüllen, die sich darum kümmern, dass alle Produkte richtig hergestellt werden und keine gesundheitsschädigenden Substanzen enthalten. Benzaldehyd wird als Lösungsmittel eingesetzt und dient als Ausgangsstoff für viele Synthesen, z.B. auch von Farbstoffen. Bei Licht- und Luftzutritt, oxidiert Benzaldehyd schnell zur Benzoesäure. Aus diesem Grund sollte die Lösung stets in abgedunkelten, verschlossenen und annähernd vollen Gefäßen aufbewahrt werden. Benzoesäure Die Benzoesäure ist eine Carbonsäure und der Hauptbestandteil des Benzoe-Harzes der Baumarten Siam-Benzoe und Suamtra-Benzoe. Abbildung 1: Benzoe-Harz[4] Ebenso kommt die Benzoesäure in verschiedenen Früchten, wie z.B. Preiselbeeren, Heidelbeeren und Pflaumen vor. Auf natürlichem Weg entsteht die Benzoesäure bei Sublimation des BenzoeHarzes. Technisch wird sie jedoch durch Luftoxidation von Toluol hergestellt. 23 Die Benzoesäure wird vor allem für die Herstellung von Benzoesäureestern verwendet, die wiederum in der Parfüm- und Farbstoffherstellung eine wichtige Rolle spielen. Außerdem dient sie als Konservierungsmitte,l z.B. in Ketchup, Soßen, Senf etc.. In einer Konzentration von 0,05 – 0,1 % wirkt die Benzoesäure gut gegen Thyphus und Milzbrandbakterien (beides Infektionskrankheiten). Dies beruht auf der Hemmung von Enzymen, die reaktive Sauerstoffverbindungen abbauen, und schließlich absterben. Literaturangaben Versuchsquelle: [1] Blume, R., Die klassische Atemalkoholprobe, Cornelsen Verlag GmBH, Berlin, http://www.chemieunterricht.de/dc2/auto/a-v-007.htm (letzter Zugriff: 8.12.08, 17:22 Uhr) Fachquellen: [2] Bauer, M., www.uni-protokolle.de, Die Adresse von Ausbildung, Studium und Beruf, Oxidation von Toluol, http://www.uni-protokolle.de/foren/viewt/112434,0.html, (letzter Zugriff: 8.12.08, 17:22 Uhr) [3] Mertens, S., Chemie Online, http://www.chemieonline.de/forum/archive/index.php/t-87490.html, (letzter Zugriff: 8.12.08, 17:22 Uhr) [4] Wikimedia Foundation Inc., http://de.wikipedia.org (letzter Zugriff: 8.12.08, 15:09 Uhr) [5] Unfallkasse Hesse (UKH), Hessisches Kultusministerium, Hessisches GefahrstoffInformations System Schule (HessGISS), Version 11.0, 2006/2007 24 Station 5 Herstellung von Bakelit- oder Plastik aus Oma´s Zeiten Sicherheitsvorkehrung: Kittel, Schutzbrille, Handschuhe, Arbeiten im Abzug Chemikalien Phenol T, C Salzsäure konz. C Formaldehyd-Lösung T 37%ig Wichtig Du arbeitest mit stark ätzender H2SO4 , also Handschuhe tragen! Materialien/Geräte Reagenzglas, Reagenzglasklammer, Reagenzglashalter, Wasserbad, Magnetrührer, 2 Pipetten Versuchsdurchführung 20. Kittel, Schutzbrille und Handschuhe anziehen!!! 21. Mische 1,5 g Phenol und 2 mL Formaldehyd-Lösung in einem Reagenzglas. 22. Gib 2 mL konz. Salzsäure dazu. 23. Erhitze mit äußerster Vorsicht und der Öffnung des Reagenzglases in den Abzug das Gemisch im Wasserbad bis ein festes Produkt entstanden ist. Entsorgung Der Feststoff kann in die Feststofftonne gegeben werden. Aufgabe: 1. Schreibe deine Beobachtungen auf. 2. Überlege dir zuerst die Strukturformel von Formaldehyd! 25 3. Wie reagiert der Formaldehyd mit der Salzsäure? 4. Nach welchem Mechanismus reagiert das entstandene Molekühl mit Phenol weiter? Auswertung zu Herstellung von Bakelit oder Plastik aus Oma´s Zeiten Bakelit wurde im Jahre 1907 durch den Chemiker Leo Hendrik Baekeland zum ersten Mal synthetisiert. Es handelt sich bei Bakelit um einen der ersten entdeckten Kunststoffe. Auf Grund der einfachen Herstellung war er der erste industriell produzierte Kunststoff. Durch Formpressen und Aushärten verschiedener Phenolharz/Füllstoffmischungen werden die Bakelit-Teile in die gewünschte Form gebracht. Durch die Aushärtung und Abkühlung sind diese Kunststoffteile gegen mechanische Einwirkungen, Hitze und auch Säure sehr widerstandsfähig. Im Gegensatz zu anderen Kunststoffen, wie den Thermoplasten lassen sich Bakelite durch Erwärmen nicht mehr verformen. Industriell werden meist dunkle bis schwarze Farbtöne des Bakelit verwendet. Seit den 30er Jahren wurde Bakelit gerne als Werkstoff in vielen verschiedenen Haushalts und Küchengegenständen verwendet. So wurden Telefonen, Radiogeräte oder auch Büroartikel aus Bakelit hergestellt. Heute sind die Produkte aus Bakelit auf Grund des Designs und der Industriegeschichte gesuchte und geschätzte Sammlerstücke. Abb.1: Ein Telefon sowie ein Radio aus Bakelit. Auch heute noch wird Bakelit in der Industrie als Werkstoff verwendet, wenn mechanische und auch thermische Belastbarkeit geforderte Bedingungen an den Werkstoff sind. Heute wie damals läuft die Herstellung nach dem gleichen Mechanismus ab. Diesen haben wir schon im Versuch kennen gelernt. Durch Säure kommt es zu einer Protonierung des Formaldehyds. 26 Cl - H O H + O O + + H Cl - C HCl H H H H H Formaldehyd Da Phenol in ortho- und para- Position dirigiert kommt es dort zur Reaktion mit dem protonierten Formaldehyd OH OH H + H OH C O H + H + .... C H H Phenol Nach der Abspaltung eines Protons kommt es zur Reaktion eines Weiteren Phenol-Teilchens mit dem entstandenen Übergangszustand. H OH H HO - H+ + HO Phenol OH OH- OH + C 27 Nun reagiert das H+-Ion mit dem OH-Ion zu Wasser. + H + - H2O HO Des Weiteren kommt es nun zu einer Polykondensation. Die Reaktion wiederholt sich und es kommt zu einer Vernetzung der einzelnen Moleküle. Es entsteht Bakelit. OH OH Reaktion wiederholt sich, Vernetzung erfolgt ..... OH .... .... .... OH .... Bakelit OH OH .... Fazit Das Formaldehyd reagiert mit dem Phenol. Durch Polykondensation und Polymersaiton zu Bakelit, einem Phenolharz. Versuchsquelle: [1] Chemie heute, Sekundarbereich II, Schroedel-Verlag, Hannover 1993 Fachquellen: [2] Unfallkasse Hesse (UKH), Hessisches Kultusministerium, Hessisches GefahrstoffInformations System Schule (HessGISS), Version 11.0, 2006/2007 28 [3] Lehrplan Chemie für die Jahrgansstufen G7 bis G12 des hessischen Kultusministeriums, 2005 (http://www.kultusministerium.hessen.de/irj/HKM_Internet?uid=3b43019a-8cc6-1811-f3efef91921321b2) [4] Breitmaier,E./Jung, G., Organische Chemie, 4. Auflage, Thieme, Stuttgart/New York. 2001 [5] Vollhardt, K. Peter C., Schore, Neil E., Organische Chemie, Vierte Auflage, Wiley-VCH, Weinheim, 2005 [6] Wikimedia Foundation Inc., http://de.wikipedia.org (letzter Zugriff: 7.12.08, 10:11Uhr) 29 Station 6 Bromierung von Toluol Sicherheitsvorkehrung: Kittel, Schutzbrille, Handschuhe, Arbeiten im Abzug Chemikalien Toluol F, Xn Bromwasser T, Xi Natriumthiosulfat-Lösung Wichtig Du arbeitest mit Bromwasser, was sehr giftig ist! Also Handschuhe tragen und Dämpfe nicht einatmen! Materialien/Geräte 3 Erlenmeyerkolben mit Stopfen, Messzylinder (10 mL), Pasteurpipette mit Hütchen, Becherglas (250 ml) Overhead- Projektor, PH- Papier Versuchsdurchführung 24. Kittel, Schutzbrille und Handschuhe anziehen!!! 25. Mische in drei Reagenzgläsern jeweils 5 ml Toluol mit 3 ml Bromwasser (drei Pipetten). 26. Erste Reagenzglas über Overhead-Projektor halten, Reagenzglasständer stehen lasen, drittes in Alufolie einwickeln. 27. Entstehende Dämpfe mit feuchtem PH-Papier überprüfen 30 zweite im Entsorgung Die Lösungen werden mit Natriumthiosulfat versetzt, neutralisiert und in den Behälter für organische Lösungsmittel gegeben. Aufgabe: Notiere deine Beobachtungen. Zeichne und beschreibe den Mechanismus der Bromierung von Toluol! Nach welchen Mechanismen verlaufen die Reaktion in den Reagenzgläsern? Auf welche Weise beeinflusst Licht die Reaktion? Formuliere diesen Mechanismus in Worte. Theorie zur Bromierung von Toluol Der Grund, dass Aromaten mit Elektrophilen unter Substitution reagieren liegt in der Mesomeriestabilisierung dieser Moleküle. Der in Abb. 2 gezeigte Reaktionsmechanismus beschreibt den allgemeinen Ablauf einer elektrophilen aromatischen Substitution. Der Aromat wechselwirkt mit dem Elektrophil E +. Erfolgt diese Wechselwirkung zunächst lediglich mit dem π-System des Aromaten, so kann sich ein π-Komplex 2a herausbilden. Aus diesem, aber auch direkt aus den Ausgangsstoffen, bildet sich unter Aufhebung der Aromatizität von der σ-Komplex 2b, der auch Arenium-Ion oder Wehland- Komplex genannt wird. Unter Deprotonierung dieses Komplexes findet eine Rearomatisierung des Systems statt, und das Endprodukt wird freigesetzt. Die Bildung eines π-Komplexes mag dem σKomplex vorausgehen, ist aber weder zwingend noch für die Erklärung der Reaktion notwendig. 31 Abbildung 2 Mechanismus der elektrophilen aromatischen Substitution In Abb. 3 ist ein Energieschema der elektrophilen aromatischen Substitution gezeigt. Für die Zweistufigkeit gibt es viele Belege. Beispielsweise gelang es, die als Zwischenprodukt, nicht als Übergangszustand, auftretenden Arenium-Ionen 2b in Reinsubstanz zu isolieren und diese zu charakterisieren. Die Bildung des σKomplexes ist der geschwindigkeitsbestimmende Schritt, während die nachfolgende Deprotonierung im Vergleich dazu schnell abläuft. Abbildung 3 Energiediagramm der elektrophilen aromatischen Substitution 32 In unserem Fall ist Brom das Elektrophil, der Aromat heißt Toluol. Die Methylgruppe am Phenylring übt einen +I- Effekt auf das konjugierte Ringsystem aus. Die Elektronendichte wird erhöht und die Reaktivität des Systems nimmt zu. Selbiger Effekt dirigiert Zweitsubstituenten in ortho- und para- Stellung. Die Reaktion verläuft demnach nach folgender Reaktionsgleichung: Seitenkettenbromierung Startreaktion h 2 Br Br Kettenreaktion Br H CH2 + HBr Br + CH2 CH2 CH2 CH HC CH Mesomerie-Stabilisierung des Benzylradikals Br . Br Br + Br 33 Kettenabbruch . 1. 2 Br CH2 2. Br 2 Br 3. Br Br Benzylbromid kann noch weiter bromiert werden: Br Br Br Br2, h + HBr Kernbromierung Bildung des Katalysators Die Bildung des eigentlichen Katalysators Eisen(III)-bromid erfolgt durch die Oxidation von Eisen mit Brom und der Bildung des Elektrophils Br+ durch heterolytische Spaltung des Brommoleküls in Gegenwart von Eisen(III)-Bromid. 3+ 2 Fe FeBr3 + 3 Br2 + Br2 2 FeBr3 + Br + FeBr4 - Formal wandert also Br+ Elektrophile Aromatische Substitution nach der KKK-Regel: 34 CH3 CH3 CH3 H + FeBr3 Br Br Br Br + - Br -HBr Ortho-Bromtoluol (40%) Meta- und Para-Bromtoluol reagieren analog zu dem Ortho-Bromtoluol. CH3 CH3 + Br Br Para-Bromtoluol (60%) Metha-Bromtoluol (<1%) Aus sterischen Gründen wird das Para-Bromtoluol am meisten gebildet. Fazit Der Einsatz von Licht läuft ein anderer Mechanismus ab. Durch das Licht entsteht ein Radikal, welches in einer radikalischen Substitution am Kern des Aromaten angreift. Ohne Licht läuft eine elektrophile Substitution ab, wobei das Brom an der Seitenkette angreift. Toluol CH3 Toluol, (Methylbenzol, Phenylmethan) ist eine farblose, charakteristisch riechende, flüchtige Flüssigkeit, die in vielen ihrer Eigenschaften dem Benzol ähnelt. Toluol ist ein aromatischer Kohlenwasserstoff, häufig ersetzt es als Lösungsmittel das giftige Benzol. Es ist unter anderem auch im Benzin enthalten. In der Industrie wird es hauptsächlich aus Erdöl gewonnen. Während des Zweiten Weltkrieges kam es in Deutschland wegen des fehlenden Erdöls zu Engpässen bei der Toluolherstellung, weswegen es auch aus Benzol und Methanol hergestellt wurde. Außerdem fällt es bei der Herstellung von Ethen und Propen an. 35 Literaturangaben Versuchsquelle: [1] http:// http://www.chids.de/ (letzter Zugriff: 5.12.2008) Fachquellen: [2] Unfallkasse Hesse (UKH), Hessisches Kultusministerium, Hessisches GefahrstoffInformations System Schule (HessGISS), Version 11.0, 2006/2007 [3] Lehrplan Chemie für die Jahrgansstufen G7 bis G12 des hessischen Kultusministeriums, 2005 (http://www.kultusministerium.hessen.de/irj/HKM_Internet?uid=3b43019a-8cc6-1811f3ef-ef91921321b2) [4] Fachinformationszentrum Chemie, http://www.chemgapedia.de (letzter Zugriff: 23.11.08, 15:09 Uhr) [5] Vollhardt, K. Peter C., Schore, Neil E., Organische Chemie, Vierte Auflage, WileyVCH, Weinheim, 2005 [6] Wikimedia Foundation Inc., http://de.wikipedia.org (letzter Zugriff: 23.11.08, 15:09 Uhr) 36 Station 7 Zeichnen mit ChemSketch Aufgabe Zeichne Anhand des Versuches “Bromierung von Toluol” den Reaktionsmechanismus für die Kernsubstitution. Theorie zu ChemSketch 1 7 8 9 10 11 2 3 4 5 6 1.) 2.) 3.) Pfeil Periodensystem Häufigsten Elemente 37 12 13 4.) 5.) 6.) 7.) 8.) 9.) 10.) 11.) 12.) 13.) Einfügen eines Textes Einfügen eines Restes „R“ oder löschen der Endung an einer Kette Ladung Zeichnen Bindung, die nach oben geht Bindung, die nach hinten geht Löschen Reaktionsgebunden Plus Reaktionspfeil Reaktionspfeil-Beschriftung 14 15 14.) 15.) Tabelle der Reste Häufig verwendete Reste 38



![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)