Test 1
Werbung
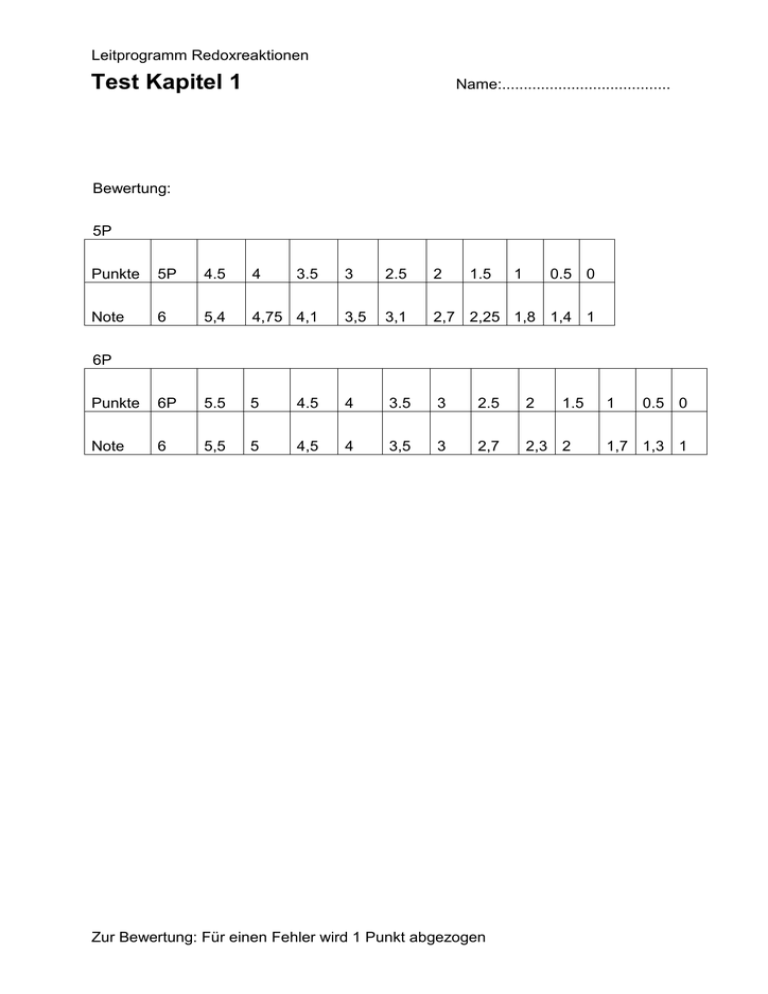
Leitprogramm Redoxreaktionen Test Kapitel 1 Name:....................................... Bewertung: 5P Punkte 5P 4.5 4 Note 6 5,4 Punkte 6P Note 6 3.5 3 2.5 2 1.5 1 0.5 0 4,75 4,1 3,5 3,1 2,7 2,25 1,8 1,4 1 5.5 5 4.5 4 3.5 3 2.5 2 5,5 5 4,5 4 3,5 3 2,7 2,3 2 6P Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen 1.5 1 0.5 0 1,7 1,3 1 Leitprogramm Redoxreaktionen Test Kapitel 1 Test 1.1: Name:....................................... a) Erklären Sie den Begriff Reduktion! Ein Satz reicht. (1 P) b) Formulieren Sie die Gleichungen für die Reaktion von Iod mit Natrium. (3 P) Reduktion: Oxidation: Gesamtreaktion: c) Weshalb kann eine Reduktion nicht ohne gleichzeitige Oxidation ablaufen? Antworten Sie in 2 - 3 Sätzen. (2 P) Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen Leitprogramm Redoxreaktionen Test Kapitel 1 Test 1.2: Name:....................................... a) Was ist ein Redoxvorgang? Ich erwarte einen Satz. (1 P) b) Formulieren Sie die Gleichungen für die Reaktion von Chlorgas mit Magnesium. (3 P) Reduktion: Oxidation: Gesamtreaktion: c) Betrachten Sie folgende Reaktion und beantworten Sie die beiden Fragen: 2 Cu + O2 2 CuO Wie viele Elektronen werden ausgetauscht? (1 P) Welche Atome nehmen Elektronen auf? (1P) Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen Leitprogramm Redoxreaktionen Test Kapitel 1 Test 1.3: Name:....................................... a) Erklären Sie den Begriff Oxidation! Ich erwarte einen Satz. (1 P) b) Formulieren Sie die Gleichungen für die Reaktion von Sauerstoff mit Aluminium. (3 P) Reduktion: Oxidation: Gesamtreaktion: c) Beschreiben Sie den Vorgang einer Redoxreaktion! Antworten Sie in zwei bis drei Sätzen. (2 P) Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen Leitprogramm Redoxreaktionen Test Kapitel 1 Test 1.4: Name:....................................... a) Ist die folgende Reaktion eine Redoxreaktion? 2 K + Br2 2 KBr Begründen Sie Ihre Antwort in 1 - 2 Sätzen. (2 P) b) Wie heisst der Fachausdruck für den Vorgang der Elektronenaufnahme? Ein Stichwort reicht. (1 P) c) Formulieren Sie Oxidation, Reduktion und Gesamtreaktion, wenn Fluorgas mit Calcium in Kontakt kommt. (3 P) Reduktion: Oxidation: Gesamtreaktion: Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen Leitprogramm Redoxreaktionen Test Kapitel 2 Test 2.1: Name:....................................... a) Chrom reagiert mit Fluorgas. Schreiben Sie die Gleichung für diese Reaktion auf. (1 P) b) Sie halten ein Fe-Blech in wässrige Lösungen der unten angegebenen Salze. Wo gibt es eine Reaktion? Wie lauten die Redoxgleichungen? (3 P) MgCl2 AgCl PbSO4 NaI (Natriumiodid) c) Womit können Sie Na+-Ionen reduzieren? Erklären Sie dies in zwei bis drei Sätzen. Nennen Sie einen Stoff. (1 P) d) Sie haben eine wässrige Lösung, die CaCl2 und Hg(NO3)2 enthält und tauchen ein Stück Blei hinein. Welche Redoxreaktion läuft ab? (1 P) Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen Leitprogramm Redoxreaktionen Test Kapitel 2 Test 2.2: Name:....................................... a) Silber reagiert mit Fluorgas. Schreiben Sie die Gleichung für diese Reaktion auf. (1 P) b) Sie halten ein Stück Blei in wässrige Lösungen der unten angegebenen Salze. Wo gibt es eine Reaktion? Wie lautet jeweils die Redoxgleichung? (3 P) CuSO4 K2SO4 AgNO3 CaCl2 c) Womit würden Sie Quecksilber (Hg) oxidieren? Nennen Sie einen Stoff und dessen chemische Formel. (1 P) d) Sie haben eine wässrige Lösung, die LiNO 3 und ZnBr2 enthält. Welche Reaktion läuft ab, wenn ein Streifen metallisches Magnesium hineingetaucht wird? (1 P) Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen Leitprogramm Redoxreaktionen Test Kapitel 2 Test 2.3: Name:....................................... a) Kaliummetall reagiert mit Chlorgas: Schreiben Sie die Gleichung für diese Reaktion auf. (1 P) b) Sie tauchen ein Ni-Blech in wässrige Lösungen der folgenden Substanzen. Wo gibt es eine Reaktion? Wie lauten die Redoxgleichungen? (3 P) FeSO4 AuCl3 Hg(NO3)2 ZnI2 c) Was bedeutet es für einen Stoff, wenn er in der Redoxreihe ganz oben in der linken Spalte steht? Antwort in 2 - 3 Sätzen. (1 P) d) Sie haben eine wässrige Lösung, die CaBr2 und Pb(CH3COO)2 enthält. Was geschieht, wenn Sie ein Stück Kupfer eintauchen? (1 P) Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen Leitprogramm Redoxreaktionen Test Kapitel 2 Test 2.4: Name:....................................... a) Aluminium reagiert mit Chlorgas. Schreiben Sie die Gleichung für diese Reaktion auf. (1 P) b) Sie halten ein Cu-Blech in wässrige Lösungen der unten angegebenen Salze. Wo gibt es eine Reaktion? Wie lauten die Redoxgleichungen? (3 P) NaCl AgNO3 MgSO4 FeCl3 c) Wieso liegt Natrium in der Natur ausschliesslich in der oxidierten Form vor? Ich erwarte 2 - 3 Sätze. (1 P) d) Sie haben eine wässrige Lösung, die KI (Kaliumiodid) und CuCl 2 enthält und halten ein Nickel-Blech hinein. Welche Reaktion läuft ab? (1 P) Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen Leitprogramm Redoxreaktionen Test Kapitel 3 Test 3.1: Name:....................................... a) Welche Ionen wandern zum Minus-Pol ? (1 P) b) Sie führen eine Elektrolyse von gelöstem Magnesiumbromid durch. Welche Reaktion erwarten Sie am Plus-Pol, welche am MinusPol? Schreiben Sie die Reaktionsgleichungen auf. Welche Beobachtungen wird man machen? (2 P) c) Sie haben Kupfer verzinkt und dabei Elektroden aus Kupfer und Zink verwendet. Zeichnen Sie die Versuchsanordnung und schreiben Sie die Teile an. (1 P) Wäre das Experiment auch mit zwei Kupferelektroden gelungen? Bitte begründen Sie Ihre Antwort. (1 P) Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen Leitprogramm Redoxreaktionen Test Kapitel 3 Test 3.2: Name:....................................... a) Welche Ionen wandern zum Plus-Pol ? (1 P) b) Sie führen eine Elektrolyse einer wässerigen Lösung von AuCl3 durch. Welche Reaktion erwarten Sie am Plus-Pol, welche am Minus-Pol? Schreiben Sie die Reaktionsgleichungen auf. Welche Beobachtungen wird man machen? (2 P) c) Während einer Elektrolyse wird elektrische Energie verbraucht. Wozu? Antworten Sie in zwei bis drei Sätzen. (2 P) Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen Leitprogramm Redoxreaktionen Test Kapitel 3 Test 3.3: Name:....................................... a) Welcher Reaktionstyp erfolgt während einer Elektrolyse am MinusPol? (1 P) b) Sie führen eine Elektrolyse von geschmolzenem PbCl2 durch. Welche Reaktion erwarten Sie am Plus-Pol, welche am MinusPol? Schreiben Sie die Reaktionsgleichungen auf. Welche Beobachtungen wird man machen? (2 P) c) Eine Eisenplatte soll mit Nickel überzogen werden. Wie würden Sie diese Aufgabe angehen? Ich erwarte eine Antwort in vier bis fünf Sätzen. (2 P) Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen Leitprogramm Redoxreaktionen Test Kapitel 3 Test 3.4: Name:....................................... a) Welcher Reaktionstyp erfolgt während einer Elektrolyse am PlusPol? (1 P) b) Sie führen eine Elektrolyse einer wässerigen Lösung von NiBr2 durch. Welche Reaktionen erwarten Sie am Minus- und am Plus-Pol? Schreiben Sie die Gleichungen auf. Welche Beobachtungen wird man machen? (2 P) c) Zur Nickel(II)bromid-Lösung wird etwas Natriumchlorid gegeben. Welchen Einfluss hat dies auf die Elektrolyse? Begründen Sie Ihre Antwort in drei bis vier Sätzen. (2 P) Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen Leitprogramm Redoxreaktionen Test Kapitel 4 Test 4.1: Name:....................................... a) Welches ist die (chemisch reine) Ausgangssubstanz für die Herstellung von Aluminium? Nennen Sie den Namen und die chemische Formel dieses Stoffes. (1 P) b) Aluminium entsteht in einer Elektrolyse. Warum wird diese Elektrolyse bei hoher Temperatur durchgeführt? Antworten Sie in 2 - 3 Sätzen. (2 P) c) Warum kann man Aluminiummetall nicht aus Blei und Aluminiumchlorid herstellen? Ich erwarte eine Reaktionsgleichung und eine Begründung in 2 - 3 Sätze. (2 P) Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen Leitprogramm Redoxreaktionen Test Kapitel 4 Test 4.2: Name:....................................... a) Skizzieren Sie eine Elektrolysezelle für die Aluminiumherstellung. Nennen Sie mindestens 3 Bestandteile mit ihren Funktionen. (3 P) b) Schwefel und Aluminium können miteinander zu einem Salz reagieren. Stellen Sie die Teilgleichungen und die Reaktionsgleichung auf. Welcher Stoff wird oxidiert, welcher reduziert? (2 P) Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen Leitprogramm Redoxreaktionen Test Kapitel 4 Test 4.3: Name:....................................... a) Weshalb gab es im Kanton Wallis lange Zeit viele Aluminiumfabriken? Ein Satz genügt als Antwort. (1 P) b) Eisen(III)oxid reagiert heftig mit Aluminium zu Alumniumoxid und Eisen. Formulieren Sie Reduktion, Oxidation und Gesamtreaktion. Warum wird bei der Reaktion viel Wärme frei? (2P) c) Warum lohnt sich die Wiederverwertung von Aluminium? Ich erwarte zwei bis drei Sätze. (2 P) Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen Leitprogramm Redoxreaktionen Test Kapitel 4 Test 4.4: Name:....................................... a) Wie stellte Wöhler das Aluminium her? Stellen Sie alle Gleichungen auf und benennen Sie die Reaktionen. (2 P) b) Wie wird Aluminium heute hergestellt? Beschreiben Sie die wichtigsten Schritte. Ich erwarte 2 bis 4 Sätze und zwei Reaktionsgleichungen. (3 P) Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen Leitprogramm Redoxreaktionen Test Kapitel 4 Name:....................................... Weitere Fragen zum 4. Kapitel: Zählen Sie fünf Gegenstände aus Ihrem Alltag auf, die aus Aluminium gemacht sind. Verpackungsmaterial gilt nicht! Beschriften Sie das Schema der Aluminium-Elektrolysezelle. Ich erwarte mindestens 4 Punkte. (2 P) + Abbildung: Schema einer Aluminium-Elektrolysezelle Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen Leitprogramm Redoxreaktionen Test Kapitel 5 Test 5.1: Mittel aller Tests: ............ Name:....................................... a) Wird Kohle verbrannt, reagiert Kohlenstoff (C) mit Sauerstoff zu Kohlendioxid. Formulieren Sie Reduktion, Oxidation und Gesamtreaktion. (2P) b) Unter welcher Bedingung besitzt Wasserstoff die Oxidationszahl +I ? (1 P) c) Bestimmen Sie die Oxidationszahlen aller Atome von Glycerin (CH2OHCHOHCH2OH). (2P) Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen 15.05.2016 Leitprogramm Redoxreaktionen Test Kapitel 5 Test 5.2: Mittel aller Tests: ............ Name:....................................... a) Warum sind Oxidationszahlen keine Ladungen ? (1 P) b) Bestimmen sie die Oxidationszahlen aller Atome in Acetaldehyd (CH3CHO). (2 P) c) Warum besitzt Fluor meistens die Oxidationszahl -I ? (2 P) Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen 15.05.2016 Leitprogramm Redoxreaktionen Test Kapitel 5 Test 5.3: Mittel aller Tests: ............ Name:....................................... a) Warum bestimmt man Oxidationszahlen ? (1 P) b) Warum unterscheiden sich die Oxidationszahlen der Sauerstoffatome in H2O und H2O2? (2 P) c) Bestimmen sie die Oxidationszahl aller Atome der Kohlensäure (H2CO3). (2 P) Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen 15.05.2016 Leitprogramm Redoxreaktionen Test Kapitel 5 Test 5.4: Mittel aller Tests: ............ Name:....................................... a) Warum hängt die Oxidationszahl von der Elektronegativität ab? (1 P) b) Bestimmen sie die Oxidationszahl aller Atome in Aceton (CH3COCH3). (2 P) c) Im Periodensystem sind für ein Atom oft verschiedene Oxidationszahlen angegeben. Warum kann ein Atom verschiedene Oxidationszahlen besitzen? Bitte argumentieren Sie mit einem Beispiel. (2P) Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen 15.05.2016 Leitprogramm Redoxreaktionen Test Kapitel 5 Test 6.1: Mittel aller Tests: ............ Name:....................................... a) Nickelmetall reagiert mit Kupferionen zu Nickelionen und Kupfermetall. Wieviele g Kupfer erhalten Sie, wenn Sie von 413 g Nickel ausgehen? (2 P) b) Warum entstehen aus 10 g Natrium und 10 g Chlor nicht 20 g Natriumchlorid? (1P) c) Aluminiummetall kann man gewinnen, indem man Lithiummetall mit Aluminiumchlorid zu Aluminiummetall, Lithiumionen und Chloridionen reagieren lässt. Wieviele t Lithium muss man einsetzen, um 27 t Aluminiumfolien zu gewinnen? (2 P) Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen 15.05.2016 Leitprogramm Redoxreaktionen Test Kapitel 5 Test 6.2: Mittel aller Tests: ............ Name:....................................... a) Kupferionen reagieren mit Natriummetall zu Natriumionen und Kupfermetall. Wieviele g Natrium müssen Sie einsetzen, um 384 g Kupfer zu erhalten? (2 P) b) Warum entstehen bei der Reduktion von 100 g Aluminiumionen auch 100 g Aluminiummetall? Ist das ein Zufall? c) Aluminiummetall kann man gewinnen, indem man Aluminiumchlorid mit Magnesiummetall zu Aluminiummetall, Magnesiumionen und Chloridionen reagieren lässt. Wieviele kg Aluminiummetall gewinnt man beim Einsatz von 528 kg Aluminiumchlorid? (2 P) Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen 15.05.2016 Leitprogramm Redoxreaktionen Test Kapitel 5 Test 6.3: Mittel aller Tests: ............ Name:....................................... a) Warum müssen Sie bei der mengenmässigen Betrachtung von Redoxreaktionen die g zuerst in mol umrechnen? (1 P) b) Säuren enthalten H3O+(aq), das mit Magnesiummetall zu Wasserstoffgas, Wasser und Magnesiumionen reagiert. Wieviele g Wasserstoff erhalten Sie beim Einsatz von 5 mol Magnesium? (2 P) c) Aluminiummetall kann man gewinnen, indem man Aluminiumchlorid mit Natriummetall zu Aluminiummetall, Natriumionen und Chloridionen reagieren lässt. Wieviele kg Aluminiummetall gewinnt man, wenn man 207 kg Natriummetall einsetzt? (2 P) Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen 15.05.2016 Leitprogramm Redoxreaktionen Test Kapitel 5 Test 6.4: Mittel aller Tests: ............ Name:....................................... a) Bei einer Redoxreaktion sind Teilchenverhältnisse ablesbar. Was bedeutet das für die Stoffe, die in g gegeben sind und mit denen man rechnen möchte? (1 P) b) In Wasser reagieren Kupferionen mit Wasserstoffgas zu Kupfermetall und H3O+(aq). Wieviele g Kupfermetall erhalten Sie beim Einsatz von 152g Wasserstoffgas? (2 P) c) Aluminiummetall kann man gewinnen, indem man Aluminiumchlorid mit Kaliummetall zu Aluminiummetall, Kaliumionen und Chloridionen reagieren lässt: Wieviele t Aluminiumchlorid müssen eingesetzt werden, um 135 t Aluminiummetall zu gewinnen? (2 P) Zur Bewertung: Für einen Fehler wird 1 Punkt abgezogen 15.05.2016