Aufgabe 1
Werbung

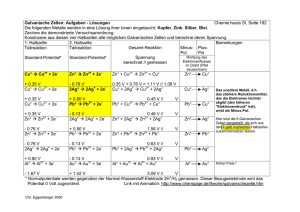
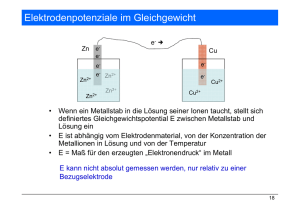
Leitprogramm "Redoxreaktionen" Lösungen zu den Aufgaben des 1.Kapitels Aufgabe 1.1: a) K K+ + e Oxidation: Das K-Atom gibt ein Elektron ab. b) Br2 + 2e- 2 BrReduktion: Jedes Br-Atom nimmt ein Elektron auf. Aufgabe 1.2: 2 Na + F2 2 Na+ + 2 F- Aufgabe 1.3: Reaktion a und c. Nur bei diesen Reaktionen findet eine Elektronenübertragung zwischen den Atomen statt. Aufgabe 1.4: a) Mg2+ d) Ag+ b) O2 e) Cu2+ c) Cl2 f) H+ Aufgabe 1.5: 1. Mg Oxidation Mg2+ 2. F2 + 2e- 2 F- Reduktion 3. Ca Ca2+ + 2 e- Oxidation 4. O2 + 4e- 2 O2- Reduktion 5. Br2 + 2e- 2 Br- Reduktion ETH Institut für Verhaltenswissenschaft 1 + 2e- Leitprogramm “Redoxreaktionen” Leitprogramm "Redoxreaktionen" Lösungen zu den Aufgaben des 2.Kapitels Aufgabe 2.1: Reduziert wurden die Cu2+-Ionen: Cu2+ + 2 e- Cu Eisen wurde oxidiert: Fe Fe2++ 2 eBei der rotbraunen Schicht auf den Nägeln handelt es sich also um metallisches Kupfer. Aufgabe 2.2: • Zink (Zn) reagiert sowohl mit Cu2+ -Ionen, als auch mit Fe2+-Ionen • Eisen (Fe) reagiert nur noch mit Cu2+ -Ionen. • Kupfer vermag weder mit Zn2+ -Ionen noch mit Fe2+-Ionen zu reagieren. Die Hitliste sieht folgendermassen aus: reduzierte Form Zn Fe Cu oxidierte Form + Elektronen Zn2+ Fe2+ Cu2+ 2 e2 e2 e- + + + Aufgabe 2.3: Gold liegt am unteren Ende in der Redoxreihe und nimmt deshalb eher Elektronen auf. Man findet Gold deshalb in der Natur meistens als Gold-Metall (Au). Aufgabe 2.4: Die Reaktion läuft in dieser Richtung nicht ab. Die Reaktionspartner (Ag und Zn2+) stehen nicht in S-Stellung. Aufgabe 2.5: Es findet eine Reaktion statt. Oxidation: Zn Zn2+(aq) + 2eReduktion: Cu2+ + 2 e- Cu ETH Institut für Verhaltenswissenschaft 2 Leitprogramm “Redoxreaktionen” Leitprogramm "Redoxreaktionen" Lösungen zu den Aufgaben des 2.Kapitels Aufgabe 2.6: Mg Mg2+(aq) + 2e2e- + 2H3O+(aq) H2+ 2H2O ---------------------------------------------------------------------Mg + 2H3O+(aq) Mg2+(aq) + H2+ 2H2O Aufgabe 2.7: (Fe2+(aq) Fe3+(aq) + e-)•2 2e- + Cl2(g) 2Cl-(aq) --------------------------------------------------------------2 Fe2+(aq) + Cl2 2Fe3+(aq) + 2Cl-(aq) Das ist die Redoxreaktion. (Die Oxidationsreaktion wurde mit 2 multipliziert, damit man die Elektronen wegkürzen konnte). Aufgabe 2.8: Weil die Elektronen nur übertragen werden. Sie sind immer in dem Stoff enthalten, der reduziert vorliegt. Aufgabe 2.9: 2Li 2Li+ + 2e2e- + Cu2+ Cu ------------------------------------Cu2+ + 2Li 2Li+ + Cu (Die Oxidationsreaktion wurde mit 2 erweitert, damit man die Elektronen wegkürzen konnte). Aufgabe 2.10: CuSO4 MgCl2 CaCl2 AgNO3 Reaktion keine keine Reaktion Zn + Cu2+ + SO42- Cu + Zn2+ + SO42Zn + 2•(Ag+ + NO3-) 2 Ag + Zn2+ + 2 NO3SO42- und NO3- nehmen an der Reaktion nicht teil. Aufgabe 2.11: F2 kommt in der Natur nicht vor, da es unten rechts in der Redoxreihe steht. F2 nimmt ungeheuer leicht Elektronen auf. Es reagiert mit praktisch allen Stoffen. Man findet Fluor deshalb in der Natur als Fluorid-Ion (F-). ETH Institut für Verhaltenswissenschaft 3 Leitprogramm “Redoxreaktionen” Leitprogramm "Redoxreaktionen" Lösungen zu den Aufgaben des 2.Kapitels Aufgabe 2.12: Nein, denn laut Redoxreihe ist Silber nicht im Stande, mit Pb 2+Ionen zu reagieren. Möglich wäre dies zum Beispiel mit den Metallen Ni, Fe, Cr, Zn, Al. Aufgabe 2.13: Es geschieht nichts. Gold (Au) und die in der Salzsäure enthaltenen Ionen befinden sich in der Redoxreihe nicht in der S-Stellung. Aufgabe 2.14: Kalium oder Lithium; die Reaktionen lauten: Ca2+ + 2 Li Ca + 2 Li+ oder Ca2+ + 2 K Ca + 2 K+ ETH Institut für Verhaltenswissenschaft 4 Leitprogramm “Redoxreaktionen” Leitprogramm "Redoxreaktionen" Lösungen zu den Aufgaben des 3.Kapitels Aufgabe 3.1: Der Elektrolyt enthält Cu2+ und Cl--Ionen. Aufgabe 3.2: Im Kabel und in den Elektroden werden Elektronen verschoben. Im Elektrolyt erfolgt der Ladungstransport durch das Verschieben von Ionen. Die Anionen wandern zum Plus-Pol. Die Kationen wandern zum Minus-Pol. Skizze: Aufgabe 3.3: Am Plus-Pol Oxidation: Am Minus-Pol Reduktion: 2 CI- (aq) Cl2 + 2e-. Cu2+ (aq) +2e- Cu (s) ETH Institut für Verhaltenswissenschaft 5 Leitprogramm “Redoxreaktionen” Leitprogramm "Redoxreaktionen" Lösungen zu den Aufgaben des 3.Kapitels Aufgabe 3.4: Eine Reduktion: Zn2+ (aq) + 2e- Zn (s) Aufgabe 3.5: a) Ein Elektrolyt ist ein Stoff, der bewegliche Ionen enthält und deshalb elektrisch leitend ist. b) Salzschmelzen sowie wässerige Lösungen von Salzen und anderen Stoffen, die beim Kontakt mit Wasser Ionen ausbilden (z.B. Säuren). Aufgabe 3.6: Elektrolysen sind chemische Reaktionen, die unter Verbrauch von elektrischer Energie ablaufen. Aufgabe 3.7: a) Negativ geladene Ionen b) Zum Plus-Pol/Anode Aufgabe 3.8 a) am Plus-Pol erfolgt eine Oxidation: 2Br- Br2 + 2eb) am Minus-Pol erfolgt eine Reduktion: K+ + e- K Gesamtvorgang: 2Br- + 2K+ Br2 + 2 K Aufgabe 3.9: Am Plus-Pol erfolgt eine Oxidation: 2I- (aq) I2 + 2eAm Minus-Pol erwartet man eine Reduktion: Zn2+ (aq) +2e- Zn (s) Gesamtvorgang: 2I- + Zn2+ (aq) I2 + Zn (s) ETH Institut für Verhaltenswissenschaft 6 Leitprogramm “Redoxreaktionen” Leitprogramm "Redoxreaktionen" Lösungen zu den Aufgaben des 6.Kapitels ETH Institut für Verhaltenswissenschaft 7 Leitprogramm “Redoxreaktionen”