Einteilung von Stoffen - HMTC - Halbmikrotechnik Chemie GmbH
Werbung

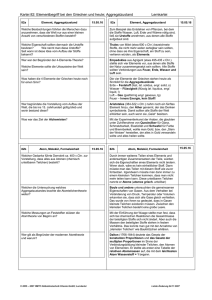
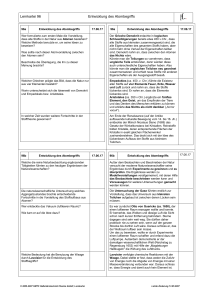
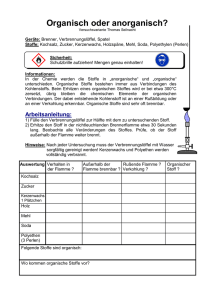
L 48: Erscheinungsform und Einteilung der Stoffe Lehrbuch Chemie Erscheinungsform und Einteilung der Stoffe Alle Stoffe1 haben eine Masse (Gewicht), einen Platzbedarf (Volumen) und eine Innere Energie (Temperatur). Stoff Es gibt begriffliche Unterschiede zwischen Masse – Gewicht; Platzbedarf – Volumen und Innerer Energie - Temperatur Stoffe können in drei verschiedenen Erscheinungsformen (Aggregatzuständen2) vorkommen. Man unterscheidet den festen, den flüssigen und den gasförmigen Zustand. Feste Stoffe haben festes Volumen und feste Form, flüssigen Stoffe haben variable Form und festes Volumen, gasförmige Stoffe haben variable Form und variables Volumen. Die noch mögliche Kombination von fester Form mit variablem Volumen, also eine Art Luftballon-Stoff, gibt es nicht. Der Aggregatzustand eines Stoffes hängt von den äußeren Bedingungen wie Druck und Temperatur ab. Aggregatzustand In der Natur gibt es Millionen von Stoffen. Gewöhnlich kommen die Stoffe als Mischungen vor. Mischungen, oder auch Gemische genannt, sind ungeordnete Zusammenlagerungen von reinen Stoffen. Reine Stoffe erkennt man daran, dass sie trotz weiterer Trenntechniken immer die gleichen Eigenschaften besitzen. Naturstoffe Stofftrennung Man kann die Bestandteile eines Gemisches (Komponenten3) an Hand ihrer Eigenschaften erkennen und trennen. Gemische zeigen die Eigenschaften der reinen Stoffe entsprechend dem Anteil an Gemisch. Es ist daher einfacher, die Eigenschaften der reinen Stoffen zu kennen und danach die natürlich vorkommenden Gemische zu beschreiben, als die Eigenschaften unendlich vieler Stoffgemische einzeln zu erfassen. – Darin steckt ein wissenschaftliches Prinzip: Man versucht in der Wissenschaft immer die durch Zerlegen die Grundlagen zu erforschen und dann durch Zusammensetzen die Eigenschaften des Ganzen zu erschließen. In vielen Dingen erweißt sich diese Vorgehensweise vorteilhaft, jedoch gibt es auch hierfür Grenzen. Diese werden durch den Erfahrungsgrundsatz beschrieben: „Das Ganze ist mehr als die Summe der Teile!“ Komponenten Eine der wesentlichen Aufgaben eines Chemikers ist die Auftrennung von Gemischen in reinen Stoffe, Reinstoffe. Dazu nutzt man die unterschiedlichen Eigenschaften der Stoffe in den sogenannten Stofftrennverfahren. Beispiele hierfür sind das Lösen in Wasser oder anderen Flüssigkeiten, das trennen von unlöslichem von Löslichem (Filtrieren), das Trennen nach Größe (Sieben), das Absitzen lassen von Unlöslichem (Sedimentieren), das Abgießen einer Lösung vom Bodensatz (Dekantieren). Man erhält so eine Auftrennung von Stoffgemischen. Sind sich die Stoffe sehr ähnlich, so ist eine Auftrennung mitunter sehr arbeitsaufwendig. Die weitere Arbeit des Chemikers befasst sich dann mit der Charakterisierung der Eigenschaften der reinen Stoffe. Reine Stoffe haben an allen Stellen die gleiche Eigenschaft, zum Beispiel die Schmelztemperatur, die Siedetemperatur, die Dichte. Reine Stoffe lassen sich noch weiter unterteilen in Elemente und Verbindungen. Elemente sind reine Stoffe, die aus gleichartigen kleinsten Teilchen bestehen. Diese werden Atome4 genannt. Gemischtrennung Def. Reinstoff Def. Element - Atom Besonderheit: Nur Edelgase kommen in der Natur wirklich als einatomige Teilchen vor. Alle anderen Elemente bilden kleinste Teilchen aus zwei oder mehr gleichartigen Atomen bestehen bis hin zu den Metallen, bei denen ein Kristall aus einer riesigen Zahl miteinander verbundener gleichartiger Teilchen aufgebaut ist. Verbindungen sind reine Stoffe, die aus verschiedenartigen Atomen in geordneter Weise zusammengesetzt sind. Die kleinsten Teilchen einer Verbindung nennt man Moleküle. Innerhalb eines Moleküls sind die Atome mit besonders kurzen, festen Bindungen aneinander gebunden. Zwischen den Molekülen sind die Abstände größer und daher die Bindungskräfte kleiner. Beispiel: Wasser H 2O...... H2O...... H2O, kurz H2O) Def. Verbindung – Molekül Vereinfachtes Definitionsschema Daneben gibt es auch andere Verbindungstypen, bei denen die Abstände überall annähernd gleich groß sind. Dazu zählen die Salze und die Metalle. Hier gibt es keine räumlich voneinander abgesetzten Baueinheiten. Um einen solchen Stoff zu beschreiben, benutzt man sie sogenannte Formeleinheit. Die Formeleinheit ist einfach die kleinste Summe der Teilchen, die durch nahezu unendlicher Wiederholung den Stoff bilden. (Beispiel Kochsalz ...Na-Cl-(Na-Cl)-Na-Cl... kurz NaCl 1 Stoff http://de.wikipedia.org/wiki/Stoff_%28Chemie%29 2 Ad lat. zusammen; grex, gregis, lat. die Herde 3 componere lat. zusammensetzen 4 atomos griech. unteilbar Def. Formeleinheit