Das Experiment im Chemie-Unterricht:
Werbung
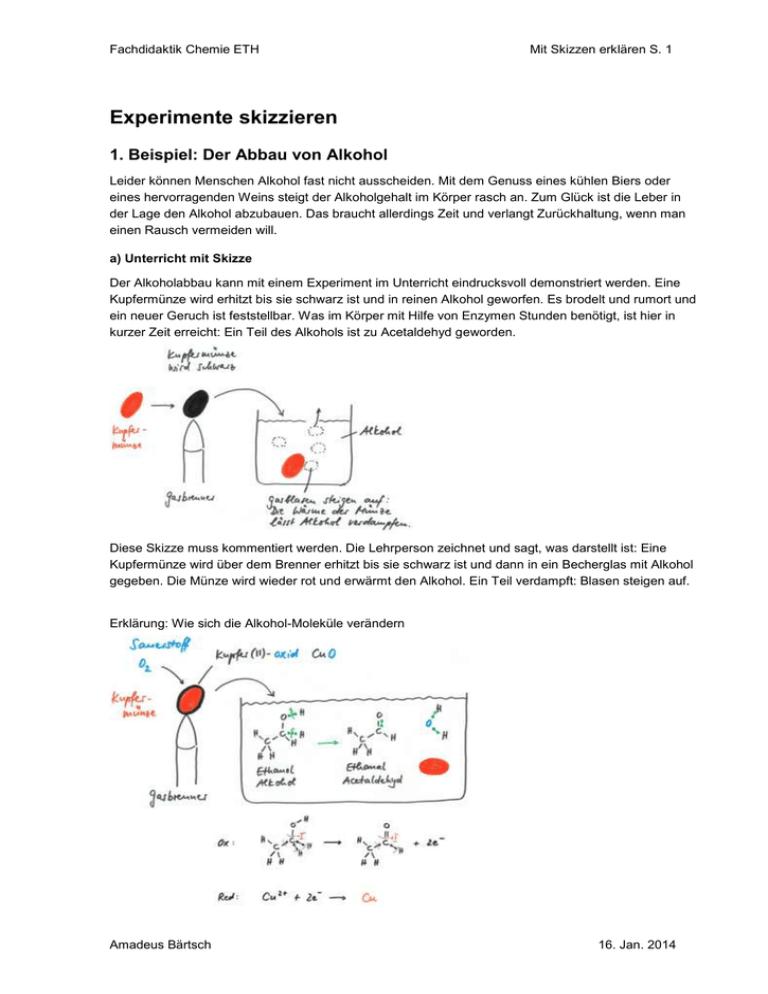
Fachdidaktik Chemie ETH Mit Skizzen erklären S. 1 Experimente skizzieren 1. Beispiel: Der Abbau von Alkohol Leider können Menschen Alkohol fast nicht ausscheiden. Mit dem Genuss eines kühlen Biers oder eines hervorragenden Weins steigt der Alkoholgehalt im Körper rasch an. Zum Glück ist die Leber in der Lage den Alkohol abzubauen. Das braucht allerdings Zeit und verlangt Zurückhaltung, wenn man einen Rausch vermeiden will. a) Unterricht mit Skizze Der Alkoholabbau kann mit einem Experiment im Unterricht eindrucksvoll demonstriert werden. Eine Kupfermünze wird erhitzt bis sie schwarz ist und in reinen Alkohol geworfen. Es brodelt und rumort und ein neuer Geruch ist feststellbar. Was im Körper mit Hilfe von Enzymen Stunden benötigt, ist hier in kurzer Zeit erreicht: Ein Teil des Alkohols ist zu Acetaldehyd geworden. Diese Skizze muss kommentiert werden. Die Lehrperson zeichnet und sagt, was darstellt ist: Eine Kupfermünze wird über dem Brenner erhitzt bis sie schwarz ist und dann in ein Becherglas mit Alkohol gegeben. Die Münze wird wieder rot und erwärmt den Alkohol. Ein Teil verdampft: Blasen steigen auf. Erklärung: Wie sich die Alkohol-Moleküle verändern Amadeus Bärtsch 16. Jan. 2014 Fachdidaktik Chemie ETH Mit Skizzen erklären S. 2 b) Lehrbuch Dieses Experiment wird in vielen Lehrbüchern vorgestellt. Als Beispiel dient das Buch "Elemente" von Markus Stieger (M. Stieger, Elemente, Klett und Balmer, Zug, S. 335, 2008) Vergleich von Unterricht und Lehrbuch Die Schülerinnen und Schüler müssen wissen, weshalb sie sich mit der Chemie auseinandersetzen. Der Bezug zum Abbau des Alkohols im Körper gibt dem Experiment Bedeutung. Das Lehrbuch befasst sich dagegen mit den Reaktionen, die verschiedene Alkohole eingehen können. Es orientiert sich an der Systematik der Organischen Chemie, der Unterricht an der Alltagsrelevanz des Experiments. Der Unterricht verzichtet auf den Farbnachweis. Wenn sich der Geruch ändert und die Schüler zum Vergleich an einem Fläschchen Acetaldehyd riechen können, ist die Bildung dieser Substanz direkter beweisen als mit einer unbekannten Farbreaktion. Lewisformeln, Oxidationszahlen und etwas organische Chemie werden für den Text im Lehrbuch vorausgesetzt. Die Leserin müsste also das ganze Buch durcharbeiten, damit sie die Erklärung auf Seite 335 wirklich verstehen kann. Das Lehrbuch benützt viel mehr Fachworte und nimmt das Experiment zum Anlass Begriffe zu erklären. Die Ausführung im Lehrbuch ist nur dann verständlich, wenn der Leser Substanzen, Abbildung und Molekülformeln miteinander verknüpft. Oben ist mit unterschiedlichen Farben dargestellt, was zusammen gehört. In Skizzen können Namen und Formeln der Substanzen nahe beim Bild plaziert werden. Bild und Text gehören zusammen. Eine Lehrperson kann dieses Problem im Unterricht einfach lösen: Sie zeigt mit Stab oder Pointer auf die Formel oder das Bild von dem gerade die Rede ist. Amadeus Bärtsch 16. Jan. 2014 Fachdidaktik Chemie ETH Mit Skizzen erklären S. 3 Fazit Im Unterricht kann die Lehrperson die Oxidation von Alkohol wesentlich verständlicher erklären als es ein Schulbuch beschreiben kann 2. Beispiel: Eliminierung a) Darstellung im Lehrbuch (aus W. Asselborn et al. (Hrsg.), Chemie heute SII, Schroedel, Braunschweig, S. 312, 2009) Der Text beschreibt die Veränderung eines Moleküls und zeigt ein Foto des Experiments. Leider ist das Molekül nicht dargestellt. Ohne Kenntnisse der Nomenklatur organischer Moleküle kann die Eliminierung nicht verstanden werden. Viele Gymnasiastinnen, die die Eliminierung in diesem Lehrbuch nachschlagen, werden die schwarz eingerahmten Substanzen nicht in eine Molekülformel umsetzen können. Für sie bleibt der Text unverständlich. b) Skizze Mit einer Skizze lässt sich der Vorgang sehr einfach durchschauen: Bei der Eliminierung wird ein kleines Molekül abgespalten Bsp: Aus einem Alkohol entsteht ein Alken und Wasser Alkohol 2-Methylpropan-2-ol Amadeus Bärtsch Alken 2-Methylpropen 16. Jan. 2014 Fachdidaktik Chemie ETH Mit Skizzen erklären S. 4 Die Skizze fokussiert auf die Veränderung des Moleküls und verzichtet auf den Mechanismus der Reaktion. Im Sinne einer didaktischen Vereinfachung könnten die Bindungen homolytisch gespalten und die einsamen Elektronen zu neuen Bindungen verknüpft werden. Diese Erklärung ist zwar wissenschaftlich nicht korrekt, wird aber von den Schülern gut verstanden. Den Mechanismus im Anfangsunterricht der Organischen Chemie vorzustellen ist keine Alternative, weil er mehr Verwirrung stiften als Klärung bringen wird. Fazit: Ohne Abbildung der Moleküle ist der Text wertlos. Welcher Schüler ist schon in der Lage, die Substanznamen in Moleküle zu übersetzen und sich die Abspaltung von Wasser vor dem geistigen Auge vorzustellen? Übung 3. Bsp. Fällungsreaktionen Sie demonstrieren die Fällung von Kalk und erklären die Reaktion an der Wandtafel. Die Schülerinnen und Schüler schreiben mit. Entwerfen Sie die Wandtafeldarstellung. 4. Bsp. Salzhydrate Kupfer(II)-sulfat Pentahydrat wird erhitzt. Skizzieren Sie das Experiment. Amadeus Bärtsch 16. Jan. 2014 Fachdidaktik Chemie ETH Mit Skizzen erklären S. 5 Meine Skizzen zum 3. und 4. Beispiel 3. Bsp. Fällungsreaktionen Sie demonstrieren die Fällung von Kalk und erklären die Reaktion an der Wandtafel. Die Schülerinnen und Schüler schreiben mit. Vorschlag für die Wandtafeldarstellung. Schwer lösliche Salze im Alltag 1. Experiment: Früher verwendeten die Kunstmaler giftige Farben Lösungen von wenig Blei(II)-nitrat und wenig Kaliumchromat mischen. Das ausgefallene Chromgelb abfiltrieren. Kommentar zu oben stehender Skizze, die von einer Schülerin stammt SuS schreiben falsch ab. Die oben stehende Skizze stammt von einer Schülerin. Sie hat dem Kalium eine falsche Ladung gegeben und ein Salz aus Anionen kreiert. Die Giftigkeit von Schwermetallen kann thematisiert werden 2. Experiment: Rhabarber enthält recht viel Oxalat, das zu Nierensteinen führen kann 70 g Rhabarber in Stücke schneiden, 200 ml Wasser zugeben, aufkochen und einige Minuten warten. Filtrieren. 10 ml Filtrat mit 10 ml Wasser verdünnen und mit 4 ml gesättigter Calciumhydroxid-Lösung versetzen. Nach 1 bis 2 Minuten ist gegen das Tageslicht eine leichte Trübung feststellbar. Vorgehen gemäss G. Schwedt, Experimente mit Supermarktprodukten, WileyVCH, Weinheim, S. 62 (2001). Amadeus Bärtsch 16. Jan. 2014 Fachdidaktik Chemie ETH Mit Skizzen erklären S. 6 4. Bsp. Viele Salze enthalten Kristallwasser CuSO4 · 5 H2O CuSO4 + 5 H2O Kupfer(II)-sulfat Pentahydrat wird zu wasserfreiem Kupfer(II)-sulfat und Wasser 5. Bsp. Salze lösen sich in Wasser Diese Darstellung beschränkt sich auf die Modellebene und stellt einen Zusammenhang zur Reaktionsgleichung her. Weil die Abbildung Modell- und Wirklichkeitsebene trennt, geht der experimentelle Vorgang verloren. Ich persönlich ziehe die folgende Darstellung vor, weil sie mit geringstem Aufwand alle Aspekte einfängt: Amadeus Bärtsch 16. Jan. 2014 Fachdidaktik Chemie ETH Mit Skizzen erklären S. 7 Skizzen haben viele Vorteile Flaschen müssen nicht angeschrieben werden Graphiken sind prägnant Die Erklärung kann entwickelt werden Schreibende Schüler, befassen sich länger mit dem Thema Jetzt oder nie! Mein Grundsatz: Experimente immer skizzieren! Schülerinnen haben das Experiment in den Unterlagen Ich setze einen Titel, beschrifte die Geräte und vergesse die Ziele nicht Es wird klar wo die Substanzen sind und die chemischen Reaktionen ablaufen. Skizzen vermitteln zwischen Beobachtung und Reaktionsgleichung, zwischen Wirklichkeits- und Modellebene Nachteile Beobachtungs- und Modellebene sind vermischt. Die Darstellung muss gut überlegt werden Skizzieren muss geübt werden Tipps Die Skizze gut überlegen und so lange verbessern, bis sie übersichtlich ist und mit wenig Text viel aussagt. Schüler übernehmen die Skizze unverändert. Ist sie nach 2 Wochen immer noch verständlich? Amadeus Bärtsch 16. Jan. 2014 Fachdidaktik Chemie ETH Mit Skizzen erklären S. 8 Apparaturen skizzieren Destillation Selten passen die Abbildungen aus dem Netz zur tatsächlich demonstrierten Apparatur Statt selber eine Abbildung zu entwerfen oder die Bilder zu bearbeiten, fordere ich die SchülerInnen auf, die Apparatur zu skizzieren. Vorgehen IU: Rotweinflasche zeigen. Wir wollen herausfinden, woraus Wein besteht. Alle nach vorn bitten Sagen, dass die Apparatur skizziert werden muss Aufbau und Funktion der Apparatur erklären Amadeus Bärtsch 16. Jan. 2014 Fachdidaktik Chemie ETH Mit Skizzen erklären S. 9 Destillation starten Schüler gehen an den Platz und skizzieren mit Bleistift. Einige erhalten Folie und Filzstifte. Die Lehrperson geht durch die Klasse, hilft und kritisiert individuell und zeigt manchmal einen Kühler. Die Folien werden projiziert und die Apparaturen im Plenum verglichen. Für den Fall, dass keine brauchbare Skizze dabei ist, zeige ich meine eigene Folie. Folie mit Fachbegriffen ergänzen Veresterung: Erwärmen unter Rückfluss Lektion 1: Edukte mischen, Apparatur zeigen und Reaktion ansetzen. Übung verschiedene Ester lösen. Lektion 2: Inszenierung: Lehrperson gibt allen Schülerinnen und Schülern etwas Nagellack auf einen Finger. Dann wird die Aufarbeitung erklärt und der Essigester in kleine Pillengläser abgefüllt. Alle benützen den Essigester als Nagellackentferner. Wer will darf ein Pillenglas nach Hause nehmen. Amadeus Bärtsch 16. Jan. 2014 Fachdidaktik Chemie ETH Mit Skizzen erklären S. 10 Übung verschiedene Ester Markieren und benennen Sie die funktionellen Gruppen Zeichnen Sie die Skelettformeln der fehlenden Substanzen. O O H H O O O H H O CH3OH O O H O H2O O O O H 2O Warum eignet sich die Veresterung im gymnasialen Unterricht besonders gut als Beispiel für eine organisch-chemische Reaktion? Die Reaktion lässt sich ohne grossen Aufwand in einem Experiment demonstrieren. Der Erfolg des Experiments lässt sich anhand des angenehmen Geruchs ohne weiteres feststellen. 3 funktionelle Gruppen kommen in der Reaktionsgleichung vor Die Umwandlung der funktionellen Gruppen ist leicht zu verstehen. Im Labor können die SuS verschiedene Ester herstellen. Das macht die Arbeit interessanter. Mit der Polykondensation kann die Bedeutung der Veresterung gezeigt werden. Neben Polyestern entstehen Polyamide und Proteine in einer sehr ähnlichen Reaktion. Auch die Umkehrreaktion spielt bei der Herstellung von Seife und der Verdauung von Fetten eine grosse Rolle. Die Veresterung ist ein wichtiges Beispiel einer Gleichgewichtsreaktion Wasserabscheider Renato Galli, Kantonsschule Zürcher Oberland, hat ein ausgezeichnetes Arbeitsblatt zum Wasserabscheider entworfen. Es ist auf www.fdchemie.pbworks.com im Kapitel Chemisches Gleichgewicht eingestellt. Direkter Link: http://fdchemie.pbworks.com/w/page/5 2263492/Chemisches Gleichgewicht Amadeus Bärtsch 16. Jan. 2014 Fachdidaktik Chemie ETH Mit Skizzen erklären S. 11 Was bringen Skizzen von Apparaturen? Skizzen zwingen zur Vereinfachung: Die SuS lernen Wichtiges von Unwichtigem zu unterscheiden. Skizzen werden entwickelt. Abbildungen verraten oft das Resultat, bevor man nachgedacht hat. Bild und Text stehen nahe beieinander. Ideen und Fragen der Klasse können jederzeit eingebaut werden Einfache Skizzen können von den Schülerinnen und Schülern ohne weiteres übernommen werden. Sind die Abbildungen zu perfekt, müssen oft Kopien abgegeben werden. Wenn Schülerinnen und Schüler selber skizzieren, setzen sie sich aktiv mit dem Unterrichtsgegenstand auseinander. Sie müssen ein Gerät durchschauen, wenn sie eine Skizze entwerfen und genau beobachten, wenn sie ein Experiment festhalten. Die Lehrperson braucht nur in der Klasse zu zirkulieren, wenn sie feststellen will, was in den Köpfen angekommen ist. Anders als bei einem Text genügt schon ein Blick auf die Skizzen. Einführung von Reaktionsgleichungen Wasserstoff verbrennen Nachweisreaktionen, Skizze, Strichformeln, Reaktionsgleichung, Text 1. Wasserstoff verbrennen Exp. Abgase kondensieren: Die Flamme erzeugt Wasserdampf Vorgehen 1. Ziel bekannt geben: Wir untersuchen die Abgase bei der Verbrennung von Wasserstoff 2. Apparatur vorstellen und Experiment starten 3. Apparatur an der Tafel skizzieren 4. Schülerinnen nach vorn bitten, damit sie die Apparatur gut sehen. 5. Experiment beenden, U-Rohr entfernen und einem Schüler zum Trocknen geben. Weil er das URohr aussen trocknet ist es immer noch nass. Die Lehrperson kann ihn auffordern besser zu trocknen und so allen klar machen, dass sich innen Tropfen gebildet haben. 6. Optional kann wenig wasserfreies Kupfersulfat ins U-Rohr gegeben werden. Welche Flüssigkeit könnte es sein? Reagenzgläser mit einigen Tropfen Alkohol, Ether und Wasser mit wasserfreiem Kupfersulfat versetzen und so nachweisen, dass sich Wassertropfen im U-Rohr gebildet haben. 7. Also muss bei der Verbrennung Wasserdampf entstehen. Der Sauerstoff kommt aus der Luft. 8. Erst jetzt Wasserdampf und Sauerstoff in die Skizze eintragen. Amadeus Bärtsch 16. Jan. 2014 Fachdidaktik Chemie ETH Mit Skizzen erklären S. 12 In der Flamme findet eine chemische Reaktion statt Die Reaktionsgleichung beschreibt die Veränderung der Moleküle: Die Animation Wasserstoff verbrennen.osx von Kurt Pfefferkorn ist unter http://fdchemie.pbworks.com/w/page/46481480/Reaktionsgleichungen zugänglich 2. Erdgas verbrennen Exp. Kohlendioxid und Wasserdampf im Abgas nachweisen Abbildung von K. Pfefferkorn, Kantonsschule Oerlikon. Kalkwasser ist eine gesättigte Lösung von Calciumhydroxid. Damit CH4 zu CO2 und H2O wird, wird Sauerstoff aus der Luft benötigt. Amadeus Bärtsch 16. Jan. 2014 Fachdidaktik Chemie ETH Mit Skizzen erklären S. 13 Skizzen in Prüfungsfragen 1. Zu Beginn der Prüfung wird ein Experiment mit dem Thermoskop gezeigt. Die Schülerinnen und Schüler sehen dieses Gerät zum ersten Mal. Anschliessend erhalten alle die Prüfung. a) Zeichne die Apparatur. b) Was ist zu beobachten? c) Wie ist die Beobachtung zu erklären? Lösung a) (Apparatur 2P; pro Fehler 1P Abzug) b) Die Flüssigkeit wird ein wenig nach innen gesaugt (1/2 P) c) Das Eis kühlt die eingeschlossene Luft: die Teilchen beruhigen sich, die Luft zieht sich zusammen und die Flüssigkeit wird angesaugt (11/2 P). Das Eis ist viel zu weit weg, als dass es eine Adhäsion zur farbigen Flüssigkeit geben könnte. 2. a) Zeichne Nebel im Teilchenmodell und schreibe die Teilchen an. b) Warum verschwindet der Nebel um die Mittagszeit häufig und macht der Sonne Platz? Voraussetzung: In der Stunde wurde Luft im Teilchenmodell dargestellt Lösung: a) Gasförmige Teilchen haben grosse Abstände. Im Nebel gibt es Luft und Wasser (1P). Luft besteht aus Stickstoff und Sauerstoff (1P). Im Nebel gibt es winzige Wassertröpfchen (1P), die die Sicht behindern. Stickstoff Sauerstoff Wasser b) Die Sonne erwärmt den Nebel. Die Teilchen werden schneller. Das Wasser verdunstet und die Tröpfchen werden zu Wasserdampf. Einzelne Teilchen sind nicht sichtbar (1P) Amadeus Bärtsch 16. Jan. 2014 Fachdidaktik Chemie ETH Mit Skizzen erklären S. 14 3. Benzin, Wasser, Öl und Zucker werden gemischt. Zeichne die Mischung im Teilchenmodell und schreibe die Teilchen an. Lösung Benzin und Öl vermischen sich. Zucker löst sich in Wasser. Benzin Öl Wasser Zucker 4. Wie viele Phasen entstehen in der Mischung a) und der Mischung b)? Skizzieren Sie die Mischungen so, dass die Phasen zu sehen sind und begründen Sie Ihre Angaben in Stichworten. a) H2O, CaCO3 und NaOH b) Cu, Cu(NO3)2, CH4O, H2O und C8H9OH 5. Silbernitrat und Kupfer werden mit Wasser gemischt. a) Formulieren Sie Reaktionsgleichung, Reduktion und Oxidation. b) Erklären Sie die Vorgänge mit einer Skizze Lösung: 6. Wie kann man mit Silber und Kupfer eine Batterie basteln? a) Zeichnen Sie die Batterie, schreiben Sie alle Bestandteile an und benennen Sie alle nötigen Materialien. b) Welche Reaktionen laufen ab? c) Welche Spannung erreicht die Batterie? 7. Eine Batterie arbeitet mit Kupfer, Zink, Zink- und Kupfer(II)-sulfat. a) Skizzieren Sie die Batterie, markieren Sie Plus- und Minuspol und zeichnen Sie die Prozesse ein. b) Welche Reaktionen laufen an den Polen ab? c) Welche Spannung erzeugt Ihre Batterie? Amadeus Bärtsch 16. Jan. 2014 Fachdidaktik Chemie ETH Mit Skizzen erklären S. 15 8. Verbessern Sie alle Fehler in folgender Darstellung: 9. In einer Elektrolyse wird Kupfer mit Gold überzogen. a) Skizzieren Sie das Experiment und beschriften Sie die wesentlichen Teile. b) Formulieren Sie Reduktion und Oxidation. Lösung: a) b) Die Batterie oder eine andere Stromquelle überträgt Elektronen auf das Kupfer. Dort findet die Reduktion statt: Au3+ + 3 e Au Der Plus-Pol der Batterie saugt Elektronen ab: Ox: Au Au3+ + 3 e Der Plus-Pol besteht aus Gold und löst sich allmählich auf. In der Lösung bleibt die 3+ Konzentration von Au konstant. 6. Aluminium und Brom reagieren heftig miteinander. Das Experiment ist einfach, aber nicht ungefährlich: Im Abzug beide Stoffe in ein Reagenzglas geben und warten. Nach kurzer Zeit setzt die Reaktion ein. a) Formulieren Sie Reduktion, Oxidation und Gesamtreaktion. b) Erklären Sie mit einer Skizze den mikroskopischen Aufbau von Ausgangs- und Endstoffen. Amadeus Bärtsch 16. Jan. 2014 Fachdidaktik Chemie ETH Mit Skizzen erklären S. 16 Aufgaben im Chemieunterricht 1. Skizzen um einen Text zu vertiefen Die Wärmebewegung Stoffteilchen wie Ionen oder Moleküle lassen sich infolge ihrer Kleinheit (...) visuell (mit den Augen) nicht erfassen. Trotzdem gibt es viele Fakten – nachstehend werden einige erwähnt –, die unmißverständlich zeigen, daß diese kleinen Stoffteilchen in fortwährender, ungeordneter Eigenbewegung sein müssen! Öffnet man z.B. in einem Zimmer eine Flasche, die eine stark riechende Stoffart enthält, so stellt man nach und nach diesen Geruch im ganzen Zimmer fest, auch wenn keine feststellbare Luftbewegung vorhanden ist. Dabei bemerkt man den Geruch zuerst in der Nähe der Flasche, später aber auch in weiterer Entfernung. Riechen kann man einen Stoff nur dann, wenn dessen Teilchen auf die Sinneszellen der Nasenschleimhaut gelangen; sie provozieren dort Reaktionen, welche über die Nervenbahnen ins Gehirn "gemeldet" werden; dieses erzeugt dann die von uns wahrgenommene Geruchsempfindung. Ohne Eigenbewegung der Stoffteilchen wäre es völlig undenkbar, daß diese "von selbst" die Flasche verlassen, sich durch die Luft hindurch ausbreiten und auf die Nasenschleimhaut gelangen könnten! Auch der Gasdruck läßt sich ohne die fortwährende Eigenbewegung der Gasteilchen nicht erklären. Eingeschlossene Gase üben auf die Gefäßwände eine Druck-Kraft aus, was ohne weiteres an prallen Bällen oder Autoreifen erkannt wird. In Gasen liegen aber die Teilchen nicht beisammen! Beweis: könnte man denn einen Ball oder einen Autoreifen (deren Volumen vorgegeben sind) noch stärker aufpumpen, d.h. noch mehr Gasmoleküle einfüllen, wenn kein Platz mehr da wäre? Wenn nun also Gasteilchen, die nicht beisammen liegen, trotzdem fortwährend (auch "oben"!) auf die Gefäßwände drücken, so müssen sie infolge ihrer Eigenbewegung "wie ein Hagelwetter" auf die Gefäßwände prasseln, an denen sie zurückprallen; diese fortwährenden Stöße erzeugen die beobachtbare und meßbare Druck-Kraft. Die Intensität der Eigenbewegung der Stoffteilchen hängt von der Temperatur (Wärmezustand) ab; daher spricht man von der Wärmebewegung oder thermischen Bewegung (thermos: Wärme) der Stoffpartikeln. Erwärmt man z.B. ein Gefäß, das ein Gas enthält, so wird die Druck-Kraft größer (Bälle oder Autoreifen werden praller). Da also bei höherer Temperatur die gleiche Gasteilchenzahl im vorgegebenen Volumen eine größere Druck-Kraft erzeugt, heißt dies, daß die Gasteilchen heftiger auf die Gefäßwände prallen. – Kühlt man hingegen ab, so nimmt auch der Gasdruck ab, was zeigt, daß die Intensität der Wärmebewegung der Stoffteilchen mit sinkender Temperatur abnimmt. Quelle: Arnold Arni, Grundkurs Chemie I, Wiley-VCH, Weinheim (1998) Der Text verzichtet auf Fachworte und beschreibt in eindrucksvollen Bildern, wie sich die Moleküle bewegen. Das Verständnis kann vertieft werden, wenn die Schülerinnen in einer Aufgabe selber Moleküle skizzieren. So setzen sie sich aktiv mit der Wärmebewegung auseinander und müssen ihre Modellvorstellung konkretisieren. Aufgabe Zeichnen Sie die Moleküle und deuten Sie die Wärmebewegung mit Pfeilen an: Luft Velopneu: Moleküle innerhalb und ausserhalb Heissluftballon: Moleküle innen und aussen Amadeus Bärtsch 16. Jan. 2014 Fachdidaktik Chemie ETH Mit Skizzen erklären S. 17 Im Unterricht lohnt es sich, wenn die Lehrperson das erste Beispiel vormacht und einige Moleküle von Luft skizziert. Da Luft im wesentlichen aus 4/5 Stickstoff N2 und 1/5 Sauerstoff O2 besteht müssen N2 und O2 im Verhältnis 4:1 gezeichnet werden. Die Moleküle sind weit voneinander weg und bewegen sich mit ähnlicher Geschwindigkeit. Dann können die Schüler selbständig arbeiten. Die Lehrperson kann Folien für den Hellraumprojektor verteilen und im Anschluss einige Vorschläge im Plenum zur Diskussion stellen: Welche der folgenden Skizzen zeigt die Teilchen in einem Heissluftballon am besten? Vorschlag 1 Vorschlag 2 Vorschlag 3 Vorschlag 2 offenbart eine Fehlvorstellung: Die Moleküle sollten wild durcheinander fliegen und zufällig auf die Ballonhülle treffen. Die Luft innerhalb des Ballons ist heisser als aussen. Deshalb sind die Moleküle innen mit längeren Pfeilen versehen um die grössere Geschwindigkeit anzudeuten. Wenn sie schneller sind haben weniger Moleküle im Ballon Platz und die Abstände werden grösser, ähnlich einer Tanzfläche, die bei einer lebhaften Musik weniger Paare aufnehmen kann. Vorschlag 3 zeigt grössere Abstände und damit eine geringere Dichte des Ballons. Dieser Ballon kann wegen der geringeren Dichte abheben. Der Ballon 1 hingegen würde sinken, weil seine Dichte grösser ist als die Dichte in der Umgebung. Vorschlag 3 zeigt die Situation in einem Hessluftballon am besten. Es ist allerdings zu bemängeln, dass die Moleküle in der Umgebung allzu nah beieinander dargestellt. Die Abstände zwischen den Molekülen müssten wesentlich grösser sein. Fazit: Wenn Schülerinnen selber skizzieren, setzen sie sich aktiv mit der Modellvorstellung auseinander. Die Skizzen geben Anlass zu einer Diskussion verschiedner Vorschläge, die die Erkenntnisse sichern. 2. Reaktionsgleichung zu einer Skizze formulieren Kalk auflösen Salzsäure, Putzessig, WC-Ente und Schnellentkalker mit Sulfamin- oder Zitronensäure lösen Kalk auf 1. Experiment auf dem Hellraumprojektor demonstrieren. Ein Stück Marmor mit ca.0,5 M Salzsäure bedecken. Die Gasblasen sind nur dann gut zu erkennen, wenn der Kalk unter dem Flüssigkeitsspiegel liegt. Amadeus Bärtsch 16. Jan. 2014 Fachdidaktik Chemie ETH Mit Skizzen erklären S. 18 2. Erklärung mit einer Skizze Aufgabe: Geben Sie die Edukte und Produkte an und formulieren Sie die Reaktionsgleichung, die zur Skizze passt. CaCO3(s) + 2 HCl(g) Ca2+(aq) + CO2(g) + H2O + 2 Cl- Wenn Sie den Prozess schrittweise beschreiben, wird es sehr unübersichtlich. Mir gefällt deshalb die oben stehende pauschale Reaktionsgleichung besser. HCl(g) Cl-(aq) + H3O+(aq) CaCO3(s) Ca2+(aq) + CO32-(aq) H3O+(aq) + CO32-(aq) HCO3-(aq) + H3O (aq) + HCO3 (aq) H2CO3(aq) H2CO3(aq) CO2(g) + H2O 3. Erklärung mit einer Skizze weiterführen Puffer Bei Zugabe einer Säure nimmt die Konzentration von H 3O+ zu und der pH-Wert in Wasser sinkt stark: Säure, die in eine Pufferlösung gegeben wird mit der vorhandenen Base. Es entsteht kein H 3O+ und der pH bleibt nahezu konstant. Aufgabe: a) Was geschieht, wenn Base in eine Pufferlösung gelangt? Erklären Sie die Vorgänge mit einer Skizze. b) Es wird immer mehr Base zugesetzt. Wie lange kann der Puffer den pH konstant halten? Amadeus Bärtsch 16. Jan. 2014 Fachdidaktik Chemie ETH Mit Skizzen erklären S. 19 4. Eine anspruchsvolle Skizze in Worte fassen Antibiotika Antibiotika sind ausgezeichnete Medikamente, weil sie sehr gut wirken und die Bakterien im menschlichen Körper – also die Ursache der Infektion – bekämpfen. Erklärung mit einer Skizze Dieses Skript ist auf www.fdchemie.pbworks.com unter "Mit Skizzen unterrichten" zugänglich. Direkter Link: http://fdchemie.pbworks.com/w/page/69720328/Mit%20Skizzen%20unterrichten Amadeus Bärtsch 16. Jan. 2014 Fachdidaktik Chemie ETH Mit Skizzen erklären S. 20 Skizzen zu Säure-Base-Reaktionen Was sind Säuren und Basen? Experiment Beobachtung: Deionisiertes Wasser leitet den Strom praktisch nicht. Der Leitfähigkeitsprüfer leuchtet nicht. Wird Chlorwasserstoff zugegeben, beginnt die Lampe zu leuchten. Auswertung: Wenn gasförmiger Chlorwasserstoff in Wasser geleitet wird, entstehen aus ungeladenen Molekülen Ionen. Eine Lösung von Ionen leitet den Strom. Definition: Säuren sind Protonenspender. Sie können H + an eine Base abgeben. Die Säurestärke Experiment Amadeus Bärtsch 16. Jan. 2014 Fachdidaktik Chemie ETH Mit Skizzen erklären S. 21 Titration Experiment: Titration von Ammoniak mit 1 M Salzsäure Den Äquivalenzpunkt mit in einer Skizze erklären Required parameters are missing or incorrect. Skizze von Christopher Latkoczy im Rahmen des Experimentierkurses 2013 Die gesamte Anleitung kann heruntergeladen werden: http://fdchemie.pbworks.com/w/page/73043645/Demonstrationsexperimente%20HS%202013 Amadeus Bärtsch 16. Jan. 2014 Fachdidaktik Chemie ETH Mit Skizzen erklären S. 22 Teilchenmodell Substanzen im Teilchenmodell zeichnen 1. Auftrag: Stellen Sie Rotweinessig, Olivenöl und Salatsauce im Teilchenmodell dar und benennen Sie die Teilchen. 2. Input: Die Lehrperson zeigt Rotweinessig, Olivenöl und Salz und mischt sie zu einer Salatsauce. Alle müssen sehen, dass eine Emulsion entsteht. Damit die Schülerinnen die Aufgabe verstehen, skizziert die Lehrperson das Teilchenmodell von Rotweinessig und teilt der Klasse alle Überlegungen mit: Zuerst muss man die Zusammensetzung kennen. Rotweinessig besteht zur Hauptsache aus viel Wasser, wenig Essigsäure und ganz wenig Farbstoff. Olivenöl enthält dagegen nur Ölteilchen. 3. Anschliessend entwickeln die Schüler das Teilchenmodell von Olivenöl und Salatsauce. Einige erhalten Folien und Schreiber, damit ihre Vorschläge am Hellraumprojektor gezeigt und zur Diskussion gestellt werden können. Oft entstehen Darstellungen, die sich deutlich unterscheiden. 4. Diskussion der Darstellungen. Die hier gezeigten Skizzen von Salatsauce stammen von verschiedenen Autorinnen. Deshalb sind die Wasser-Teilchen von Abbildung zu Abbildung verschieden. Dieselben Teilchen sollten in allen Abbildungen identisch sein. Abb.1 Abb. 2 Abb. 3 Abb. 4 Das Öl bildet Tröpfchen, die sich oben sammeln, wenn man die Substanzen vorsichtig mischt. Wenn man richtig schüttelt entsteht eine trübe Mischung. Die Tröpfchen sind so klein, dass es sehr lange dauert, bis sie oben aufschwimmen. Fehler: Die Ölteilchen sollten Tröpfchen bilden Fehler: Die Ölteilchen sollten Tröpfchen bilden. Es ist ein Kristall und nicht eine Flüssigkeit dargestellt. Einige Experimente zum Teilchenmodell Die folgenden Experimente zeigen, dass die Beobachtungen mit Teilchenmodell gedeutet werden können. Die Schüler sollen erkennen, dass das Teilchenmodell viele Phänomene überzeugend erklären kann und es sich lohnt, das Prinzip und nicht die Beispiele zu lernen. Amadeus Bärtsch 16. Jan. 2014 Fachdidaktik Chemie ETH Mit Skizzen erklären S. 23 1. Demonstration mit einer 100 ml Wegwerfspritze oder einem Kolbenprober aus Glas Inszenierung: Ein kräftiger Schüler erhält eine Spritze voll Wasser. Eine Schülerin erhält eine Spritze voll Luft. Ich sage nicht, dass der Inhalt verschieden ist und gebe vor, dass die Spritzen identisch sind. Wer kann besser drücken? Zuerst hält der Schüler seine Spritze zu und komprimiert, dann die Schülerin. Warum kann die Schülerin das Volumen vermindern? Auswertung mit Skizzen von Paolo Hsiung, Physiker an der Kantonsschule Freudenberg Ein Gas lässt sich komprimieren Eine Flüssigkeit lässt sich nicht komprimieren 2. Experiment: Es braucht Zeit, bis Gegenstände warm werden Inszenierung: Wer möchte Fr. 2.-- gewinnen? Eine Schülerin hält einen Zweifränkler auf der einen Seite und die Lehrperson erwärmt die andere Seite mit einem Zündholz. Die Wette: Lässt die Schülerin die Münze fallen, weil sie heiss wird, bleibt das Geld bei der Lehrperson. Die Schülerin erhält die Münze, wenn das Zündholz erlischt und sie die Münze immer noch mit den Fingern hält. 3. Experiment: Butan-Gas wird beim Komprimieren flüssig. Die Gasverflüssigungspumpe ist bei phywe.de als Artikel 08173-00 zum Preis von ungefähr Fr. 400 erhältlich. Bezug bei http://www.pro-lehrsysteme.ch. Campinggas enthält Propan und Butan und eignet sich für diesen Versuch nicht. (Skizze von P. Hsiung) Amadeus Bärtsch 16. Jan. 2014