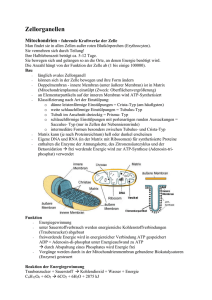
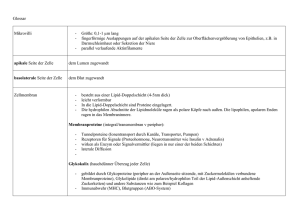
G-Protein-gekoppelte Rezeptoren
Werbung

Diese Zusammenfassung richtet sich ausschliesslich nach dem Stoff im Buch zu Bio112 ‚Lehrbuch der Molekularen Zellbiologie‘ 3. Auflage (Essential Cell Biology). Erstellt: Herbstsemester 2009. Kapitel 1: Einführüng in die Zelle (S. 1- 38) Obwohl Zellen sich stark in ihrem Aussehen und ihren Funktionen unterscheiden, sind sie alle sehr ähnlich aufgebaut und stammen alle von der gleichen Urzelle ab. In vielzelligen Organismen haben sich die Zellen spezialisiert, sodass sie auf anders spezialisierte Zellen abgewiesen sind, um selbst überleben zu können. Man unterscheidet Eukaryoten und Prokaryoten, welche sich noch in Eubakterien und Archaea unterteilen lassen. Zellen sind entweder dicht gepackt oder durch extrazelluläre Matrix, also in ein Polysaccharidgel eingelagerte Proteinfaser, voneinander getrennt. Mit dem Lichtmikroskop bis zu 200nm kleine Punkte unterschieden werden, mit einem Elektronenmikroskop 0.2nm kleine Punkte. Die Prokaryotenzelle Prokaryoten besitzen keine Organellen und keinen Zellkern. Dabei unterscheidet man die Eubakterien und die Archaea (Archaebakterien). Archaea können auch in lebensfeindlichen Umgebungen leben, welche den Lebensbedingungen der noch Sauerstofffreien, frühen Erde ähneln. Bakterien besitzen häufig eine Zellwand, welche die Plasmamembran umgibt und ein einziges Kompartiment bildet. Unter geeigneten Bedingungen kann sich eine Prokaryotenzellen innert 20 Minuten verdoppeln. Es gibt aerobe und anaerobe Prokaryoten, aus welchen sich vermutlich die Mitochondrien entwickelt haben. Die Eukaryotenzelle Eukaryoten besitzen Organellen und einen Zellkern. Anders als die einzelligen Prokaryoten sind die überwiegende Mehrheit der Eukaryoten Mehrzeller. Zellkern Der Zellkern enthält die Chromosomen (DNA Moleküle) und wird von zwei Membranen, der Kernhülle eingeschlossen. Mitochondrien Kommen in (fast) allen Eukaryoten vor.Sie haben eine wurstartige/ wurmartige Struktur und werden von zwei unterschiedlichen Membranen umhüllt. Die innere Membran durchzieht den Innenraum mit vielen Falten. Mitochondrien stammen vermutlich von einem Bakterium ab, das einst vom Vorläufer der heutigen Eukaryotenzellen verschlungen wurde und eine Symbiose einging. Sie haben daher ihre eigene DNA und vermehren sich durch Zweiteilung. Mitochondrien erzeugen chemische Energie für die Zelle, welche sie aus der Oxidation von Nahrung wie Zuckern ziehen und daraus Adenosintriphosphat ATP herstellen. Während dieser Reaktion wird O2 verbraucht und CO2 freigesetzt. Chloroplasten Kommen ausschliesslich in Pflanzen- und Algenzellen vor, nicht aber in Tieren oder Pilzen. Chloroplasten besitzen ähnlich den Mitochondrien zwei Aussenmembranen, aber haben noch eine weitere, welche stapelweise im Innenraum angeordnet sind. In diesen Membranstapeln ist das Chlorophyll enthalten. Während Tiere und Pilze ihre Energie nur aus den Mitochondrien beziehen, können Pflanzen Energie auch aus der in den Chloroplasten stattfindenden Photosynthese herstellen. Dabei entsteht aus CO2 und H mithilfe des Sonnenlichts CH2O und H2O. Auch Chloroplasten stammen vermutlich von Bakterien ab, welche von dem Vorgänger der eukaryotischen Zelle verschlungen wurde und besitzen daher ihre eigene DNA. Endoplasmatisches Retikulum Das ER ist ein unregelmässiges Labyrinth aus untereinander verbundenen, membranumhüllten Kammern. Hier werden die meisten Bestandteile der Zellmembran und der Vesikel hergestellt. Es gibt die Unterteilung zwischen dem rauen ER und dem normalen ER. Golgi Apparat Besteht aus abgeflachten, membranbegrenzten, stapelförmig angeordneten Säckchen. Der Golgi Apparat nimmt die im ER synthetisierten Moleküle auf und gibt sie an Orte innerhalb der Zelle weiter. Lysosomen Organelle, in denen die intrazelluläre Verdauung stattfindet. Dabei werden Nährstoffe freigesetzt und unerwünschte Moleküle abgebaut. Peroxisomen Kleine membranumhüllte Vesikel, welche ein geeignetes Milieu für chem. Reaktionen bieten, bei denen Wasserstoffperoxid abgebaut/ erzeugt wird. Vesikel Kleine „Membranbeutel“, welche z.b. Nährstoffe zwischen den Organellen einer Zelle transportieren. Oft verschmelzen Vesikel mit den Lysosomen, wo die importierten Materialien verdaut werden. Bei der Exocytose verschmelzen Vesikel aus dem Zellinnern mit der Plasmamembran und setzen dabei ihre Inhaltsstoffe in die Umgebung frei. Endocytose ist der gegensätzliche Vorgang. Cytosol Inhalt der Zelle abzüglich aller Organellen und Membranen. Das Cytosol ist eine eigentlich wässrige Lösung, welche aber so viele eng gedrängte kleinere und grössere Moleküle enthält, dass es die Konsistenz eines Gels hat. Hier findet ein Teil des Auf-/Abbau von Nährstoffmolekülen oder die Herstellung von Proteinen statt. Ribosomen Sind kleine Partikel im Cytosol, welche häufig an die cytosolische Seite des ER geheftet sind. Sie synthetisieren die Proteine. Cytoskelett Durchzieht das Cytosol in Form von langen, dünnen Proteinfilamenten. Es gibt Actinfilamente, Intermediärfilamente und Mikrotubuli. Das Cytoskelett verleiht der Zelle ihre mechanische Festigkeit, bestimmt ihre Form, ermöglicht Transportvorgänge und die Bewegungen der Zelle. Eine Zelle ist keinesfalls statisch. Das Cytoskeltett verändert sich ständig. Filamente bauen sich innert Minuten auf und wieder ab, Vesikel und Organellen bewegen sich zielgerichtet hin und her, Proteine völlig zufällig. Entstehung der eukaryotischen Zelle Eukaryotenzellen sind allgemein 10x grösser als Prokayotenzellen (also 1000x Volumen). Die Eukaryotenzelle lebte vermutlich räuberisch, da sie sich dank dem Cytoskelett und der flexiblen Membran bewegen kann und fressen kann. Die Abtrennung der Chromosomen vom Rest der Zelle durch die Zellmembran schützt die DNA während der ständigen Bewegung. Die Mitochondrien und Chloroplasten sind auch so entstanden. Protozoen Didinium ist ein Beispiel für Protozoen. Didinium ist ein Einzeller, der ca 10x grösser ist als eine menschliche Zelle. Es ist kugelförmig mit zwei Ciliengürtel zur Fortbewegung. Trifft es auf eine Beute (oft eine andere Protozoenart) schiesst es aus der Schnauze lähmende Pfeile ab und frisst sie dann indem es sie umstülpt. Protozoen können Photosynthese betreiben oder räuberisch leben, sich frei bewegen oder festsitzend sein. Kapitel 2: Chem. Bestandteile der Zelle (S.41-82) Chemische Bindungen Vgl. Chemie 170 Modul. Tafeln im Buch S. 52-55, 60-61, 64-65, 68-71, 74-75 Die Moleküle in Zellen Nahezu alle Moleküle der Zelle sind Verbindungen von Kohlenstoff. C hat die einzigartige Fähigkeit, Makromoleküle durch Ring- und Kettenstrukturen zu bilden. Kohlenstoffverbindungen liegen frei in Lösung im Cytoplasma vor. Nur Silicium hat diese Eigenschaft ebenfalls in beschränktem Masse. Hier die wichtigsten Verbindungen von organische Molekülen: - Methylgruppe: CH3 - Hydroxylgruppe: OH - Carboxylgruppe: COOH - Carbonylgruppe: C=O - Phosphorylgruppe: PO32- Aminogruppe: NH2 Zellen enthalten 4 Grundtypen kleiner organischer Moleküle, welche folgende Zellbestandteile bilden: - Zucker Polysaccharide - Fettsäuren Fette, Lipide, Membranen - Aminosäuren Proteine - Nucleotide Nucleinsäuren Zucker Zucker und die aus ihnen gebildeten Moleküle nennt man aufgrund ihrer einfachen Formel auch Kohlenhydrate. Zucker kommen in der L- und D- Form vor, welche spiegelbildlich zueinander sind (Isomere). Zucker sind durch ihre OH Gruppe miteinander verknüpft, was man Kondensationsreaktion nennt, da ein H2O Molekül abgespalten wird. Dessen Umkehrreaktion (unter Aufnahme eines H 2O) nennt man Hydrolyse. Jedes Monosaccharid verfügt über 5 freie Hydroxylgruppen, durch welche sie mit weiteren Monosacchariden verknüpft werden können. Dadurch entstehen stark verzweigte Zuckerpolymere. Zucker dienen neben der Erzeugung und Speicherung von Energie auch als mechanisches Hilfsmittel. Beispielsweise Cellulose, aus dem Pflanzenzellwände gebildet werden oder Chitin, aus welchem das Exoskelett von Insekten und die Zellwand von Pilzen aufgebaut ist. Auch kommt Zucker in Schleim und Knorpel vor. Fettsäuren Fettsäuren Moleküle haben zwei chemisch unterschiedliche Bereiche: Eine lange, hydrophobe und chemisch kaum reaktive Kohlenstoffkette und eine hyrophile, stark reaktive Carboyxlgruppe, welche sich als Carbonsäuren verhalten. Fettsäuren einer Zelle sind über ihre Carboxylgruppe kovalent mit anderen Molekülen verbunden. Gesättigte Fettsäuren haben keine Doppelbindungen zwischen den Kohlenstoffatomen und enthalten die maximale Anzahl H-Atome. Ungesättigte Fettsäuren enthalten Doppelbindungen. Diese Doppelbindungen beeinflussen die Gestalt der Moleküle, wodurch sie sich nicht mehr zu einer festen Masse zusammenlagern können, was den physikalischen Zustand der Membran beeinflusst. Fettsäuren braucht es nicht nur als Bestandteil der Zellmembran, sondern auch als Energievorrat. Durch ihren Abbau erhält man 6mal so viel nutzbare Energie wie beim Glucoseabbau. Diese Energiereserven ins im Cytoplasma der Zelle in Form von Tröpfchen von Triacylgylcerin- Molekülen gespeichert. Fettsäuren und ihre Derivate sind Beispiele für Lipide. Lipide sind dadurch definiert, dass sie unlöslich in Wasser aber löslich in Fett und organischen Lösungsmitteln (Benzol) sind. Wichtiger als ihre Funktion als Energiespeicher ist aber, dass Fettsäuren die Zellmembranen aufbauen. Dafür werden hauptsächlich Phospholipide benötigt. Phospholipide haben zwei hydrophobe Schwänze aus Fettsäureketten und einen einen stark hydrophilen Kopf mit einer Phosphatgruppe. Aminosäuren Aminosäuren verbindet, dass sie alle eine Carbonsäuregruppe und eine Aminogruppe, die beide an den α- Kohlenstoff gebunden sind, besitzen. Aus diesen Aminosäuren werden Proteine gebildet. Benachbarte Aminosäuren sind über eine kovalente Peptidbindung verbunden. Diese werden durch Kondensationsreaktionen gebildet. Ein Polypeptid besitzt immer eine Aminogruppe am N-Terminus und eine Carboxylgruppe am C-Terminus. Dies gibt dem Protein seine strukturelle Polarität. Es gibt 20 Aminosäuren, welche sich nur durch ihre angehängte Seitenkette unterscheiden. Wie die Zucker, kommen auch Aminosäuren in der optisch isomeren D- und L-Form vor. In Proteinen findet aber nur die L-Form Verwendung. Nucleotide Ein Nucleosid besteht nur aus dem Zucker (Ribose/ Deoxyribose). Ist der Zucker mit Phosphatgruppen verbunden, heisst es Nucleotid. Cytosin, Thymin und Uracil sind Pyrimidine, Adenin und Guanin Purine. Nucleotide können kurzfristig als Träger von ATP dienen. Makromoleküle Kovalente Einfachbindungen in einem Makromolekül ermöglichen durch Rotation, dass es sich nahezu beliebig formen kann. Durch schwächere, nicht-kovalente Bindungen (Ionenbindungen, VdWKräfte, Wasserstoffbrücken) sind mögliche Konformationen aber stark eingeschränkt. Fast alle Proteine und RNA Moleküle in Zellen falten sich deshalb nur in eine einzige Konformation. Kapitel 5: DNA ünd Chromosomen (S. 179-203) Alle grundlegenden Informationen zum Thema DNA/ Chromosomen sind bereits in BIO111 behandelt. Das Nachfolgende ist lediglich ergänzend zu BIO111. - Bakterien haben ihre Gene auf einem einzigen, zirkulären DNA- Molekül untergebracht. Die DNA ist, wie bei Eukaryoten, mit Proteinen assoziiert. Chromatin= DNA und Protein Nucleosin= Mitosechromosomen sind hoch kondensiert, Interphasechromosomen sind schwach kondensiert Zellkern ist von zwei konzentrischen Membranen umgeben Die Kernlamina kleidet die Innenseite der Kernmembran aus und besteht aus Filamenten Nucleolus ist der Bereich, in dem sich die Teile der Chromosomen befinden, welche für ribosomale RNA codieren Die positive Ladung der Histone trägt zur Bindung der Histone an das negativ geladene Zucker- Phosphat Gerüst bei Für die „30nm Chromatinfaser“ Struktur wird ein 5. H1- Histon benutzt Kapitel 11: Membranstrüktür (S. 387-409) Lipiddoppelschicht Membranlipide Jedes Lipid hat einen hydrophilen Kopf und ein/ zwei lipophile Kohlenwasserstoffschwänze, sind also amphiphatisch. Die meisten in der Zellmembran vorkommenden Lipide sind Phospholipide, welche eine Phosphatgruppe zwischen Kopf und Schwänzen haben. - Phosphatidylcholin: Häufigstes Phospholipid - Sterole (z.B. Cholesterin) - Glykolipide: Haben Zucker in der hydrophilen Kopfgruppe Hydrophile Moleküle lösen sich gut in Wasser, da sie, wie Wasser selbst, polar sind. Lipophile Moleküle sind apolar. Hydrophobe Moleküle können keine H- Brücken mit Wasser bilden, und zwingen die Wassermoleküle in eine käfigartige Struktur. Die Bildung dieser Struktur kostet Energie, wodurch es günstiger ist, wenn die hydrophoben Moleküle sich zusammenlagern. Darum sind lipophile Stoffe in Wasser als Tropfen vorhanden. Amphipathische Moleküle wie Lipide unterliegen zwei unterschiedlichen Kräften: Die hydrophilen Köpfe treten bei der Lipiddoppelschicht an beiden Seiten nach aussen, während sich die Schwänze vor Wasser geschützt innen befinden. Fluidität Die Lipiddoppelschicht einer Zellmembran verhält sich wie eine 2dimensionale Flüssigkeit, in welcher sich die Lipide innerhalb ihres Layers frei bewegen können. Die Fluidität hängt davon ab, wie dicht und regelmässig die Schwänze gepackt sind. Die Dichte hängt von der Länge und vom Sättigungsgrad (Anzahl der Doppelbindungen) der Schwänze ab. Durch Doppelbindungen in einem der ein oder zwei Schwänzen entstehen Knicke, was die Dichte verringert. Die Fluidität in Tierzellen kann durch den Einschluss des Sterols Cholesterin moduliert werden. Cholesterin füllt die Zwischenräume zwischen den Phospholipidmolekülen, die durch die Knicke entstehen. Die Membranfluidität ist sehr wichtig, da durch sie Membranproteine in der Ebene der Doppelschicht diffundieren können und dadurch zelluläre Signalübertragung ermöglichen. Lipiddoppelschicht ist asymmetrisch Zellmembranen sind generell asymmetrisch, denn die zwei Hälften der Doppelschicht haben oft eine verschiedene Zusammensetzung an Phospholipiden und Glykolipiden. Lipidasymmetrie beginnt bei der Herstellung der Lipide. In Eukaryoten werden neue Phopholipidmoleküle von Enzymen synthetisiert, die an die cytosolische Seite des ER gebunden sind. Als Substrate werden Fettsäuren benutzt. Neu gebildete Phospholipide werden im gleichen Layer eingesetzt (also cytosolische Seite). Damit die Membran gleichmässig wächst, muss ein Teil der Lipide in den gegenüberliegenden Monolayer eingesetzt werden, was von Flippasen katalysiert wird. Diese Flippasen sind selektiv, wodurch verschiedene Typen in den Monolayern angereichert werden. In eukaryotischen Zellen werden praktisch alle Membranmoleküle im ER synthetisiert. Über Vesikeltransport gelangen Lipidmoleküle zu anderen Zellmembranen. Während diesem Transportvorgang bleibt die Orientierung der Doppelschicht erhalten. Deshalb haben sämtliche Membranen unterscheidbare Seiten: Die cytosolische und die nicht-cytosolische Seite. Glykolipide erhalten ihre Zucker im Golgi-Apparat durch Enzyme, welche nur im Inneren des GolgiApparats vorkommen. So werden die Zucker nur an die Lipidmoleküle der nicht-cytosolischen Seite geknüpft werden. Hier gibt es KEINE Flippasen, wodurch die Glykolipide in dem Monolayer gefangen bleiben. Da beim Transport die Orientierung beibehalten wird, sind alle Zucker auf der Zellaussenseite. Inositolphospholipide kommen spärlich in der cytosolischen Plasmamembran vor und spielen eine Rolle bei der Signalübertragung. Membranproteine Bei Tieren besteht die Plasmamembran ca. zu 50% aus Membranproteinen. Es gibt folgende Klassen: Funktionsklasse Proteinbeispiel Spezifische Funktion Transportproteine Na+-Pumpe Ankerproteine Integrine Rezeptoren PDGF- Rezeptor Enzyme Adenylat- Cyclase Pumpt Na+ aus der Zelle raus und K+ raus Verbinden intrazelluläre Actinfilamente mit extrazellulären Matrixproteinen Bindet PDGF und erzeugt als Folge intrazelluläre Signale Katalysiert Bildung von ATP zu cAMP Membranproteine sind mit der Lipiddoppelschicht verbunden Einige Membranproteine durchqueren die Doppelschicht von innen nach aussen, wobei auf jeder Seite ein Teil des Proteins herausragt. Die hydrophoben Teile des Moleküls befinden sich im Innern bei den Lipiden, die hydrophilen Bereiche aussen bei den Enden in wässriger Umgebung. Andere Membranproteine sind vollständig ausserhalb der Membran und über ihre α- Helix mit der Oberfläche verbunden. Eine dritte Gruppe von Membranproteinen sind nur kovalent an die Membran geknüpft. Die letzte Gruppe von Membranproteinen wird durch Wechselwirkungen mit Proteinen, welche mit der Membran verbunden sind, an ihrem Platz gehalten Eine Polypeptidkette durchzieht die Lipiddoppelschicht in Form einer αHelix Die Teile eines Transmembranproteins, die sich ausserhalb der Lipiddoppelschicht befinden, werden durch (in der Membran verlaufende) spezialisierte Abschnitte der Polypeptidkette verbunden. Die Seitenkette dieser Teile sind hydrophob, sodass sie sich in der Lipiddoppelschicht wohl fühlen. Die Peptidbindungen des Polypeptidrückgrat sind aber polar. Da kein Wasser in der Membran vorhanden ist, bilden die Atome des Rückgrats untereinander H- Brücken, woraus eine α- Helix resultiert. Bei der α- Helix sind die Seitenketten aussen angeordnet, wobei sie die Lipidschwänze berühren. Andere Transmembranproteine bilden aufgrund ihrer Anordnung hydrophobe Poren, durch welche wasserlösliche Moleküle diffundieren können. Diese Poren entstehen, indem eine ganze Reihe von αHelices die Doppelschicht mehrere Male durchquert (Genant β- Faltblatt). Diese α- Helices enthalten sowohl hydrophobe wie auch hydrophile Seitenketten. Die hydrophoben Seitenketten liegen an einer Seite der Helix, während die hydrophilen Seitenketten an der Anderen Seite liegen und die Pore auskleiden. Damit eine Pore entsteht, müssen mehrere solcher α- Helices dicht nebeneinander zu einem Ring angeordnet sein. Diese Struktur heisst β- Fass. Β- Fässer können, im Gegensatz zu αHelices, nur weite Kanäle bilden. Die Struktur vom Membranprotein Bacteriorhodopsin Bacteriorhodopsin arbeitet als Membrantransportprotein, das H+ aus dem Bakterium hinauspumpt. Die dafür benötigte Energie liefert das Sonnenlicht, welches vom Retinal eines jeden Bacteriorhodopsinmoleküls absorbiert wird. Wenn Retinal Licht absorbiert, verursacht es eine Reihe von Konformationsänderungen, durch welche das Proton vom Retinal zur Aussenseite des Bakterims übertragen wird. Durch Aufnahme eines Protons aus seinem Inneren, kehrt das Protein wieder in den Anfangszustand zurück und der Zyklus kann von neuem beginnen. Ziel dieses Vorgangs inst der Transport von Protonen aus dem Bakterium, wodurch deren Konzentrantion erniedrigt wird. Indem die Protonen wieder zurückfliessen ins Zellinnere, kann Energie in Form von ATP erzeugt werden. Der Zellcortex verstärkt die Plasmamembran Der Zellcortex ist ein Geflacht von faserigen Proteinen, welches über Anker- Proteine mit der Membran verknüpft ist und sie stärkt. Hauptkomponente vom Zellcortex ist das Protein Spectrin. Anomalien der Spectinstruktur haben Sichelzellenanämie zur Folge, da dann die Erythrocyten kugelförmig und sehr zerbrechlich sind. Einige Zellen benutzen den Cortex, um ihre Gestalt aktiv zu ändern und sich fortzubewegen. Kohlenhydrate überziehen die Zelloberfläche Viele Membranproteine der Plasmamembran sind kovalent mit Zucker verbunden. Glykoproteine mit kurzen Polysaccharidketten, Proteoglykane mit langen Zuckerketten. Mit Zucker verbundene Proteine sind ausschliesslich auf der nicht-cytosolischen Seite zu finden und bilden dort die Glycocalyx (Kohlenhydratschicht). Diese Schicht schützt wie Zelloberfläche vor mechanischen und chemischen Beschädigungen und sorgt für eine schleimige Oberfläche, durch welche bewegliche Zellen (wie weisse Blutkörperchen) sich besser durch enge Räume pressen können. Ausserdem ist die Kohlenhydratschicht wichtig für die Zell- Zell- Erkennung, da Lektinproteine darauf spezialisiert sind, besondere Zuckerketten zu erkennen und zu binden. Die Bewegung von Membranproteinen ist eingeschränkt Membranproteine können sich ja zweidimensional in ihrem Monolayer bewegen, aber diese Bewegung ist eingeschränkt. So können sie extrazellulär an befestigte Strukturen oder intrazellulär an den Zellcortex gebunden werden. Kapitel 13: Energiegewinnüng aüs Nahrüng (S. 453456) Tierische Zellen können ATP auf zwei Weisen herstellen: Ein Prozess nutzt die Energie der aktivierten Trägermoleküle für die ATP- Produktion, was direkt in den Mitochondrien geschieht (Siehe Kapitel 14). Der andere Prozess besteht aus einer Reihe von Reaktionen (durch Enzyme katalysiert), die direkt an die energetisch ungünstige Reation ADP+ Pi ATP gekoppelt sind. Dieser Prozess produziert nur einen Teil des benötigten ATP’s, aber es entstehen aktivierte Trägermoleküle, die durch oben erwähnten Prozess (Kap. 14) viel grössere Mengen ATP produzieren. Die Nahrungsmoleküle müssen erst verdaut werden, was im Magen-Darm-Trakt und in den Lysosomen geschieht. Die Membran der Lysosomen verhindert, dass die Verdauungenzyme körpereigene Moleküle verdauen. Proteine Aminosäuren Lipide Fettsäuren und Glycerin Polysaccharide Zucker Nach der Verdauung gelangen die monomeren Bausteine ins Cytosol von Zellen, wo sie schrittweise Oxidiert werden. Der Vorgang Glykolyse wandelt jedes Glucosemolekül in 2 Pyruvatmoleküle um. Bei diesem Vorgang entstehen auch noch ATP und NADH. Das Pyruvat gelangt dann in die Mitochondrien, wo es zu CO2 und einer Acetylgruppe umgewandelt. Die Acetylgruppe wird an Coenzym A gebunden, wodurch Acetyl-CoA, was wie ATP und NADH ein aktiviertes Trägermolekül ist. Die Acetylgruppe wird anschliessend auf das Oxalacetat übertragen. Daraufhin erfährt die Acetylgruppe eine Reihe von Reaktionen, genannt Zitronensäurezyklus, wodurch sie zu CO 2 oxidiert wird und dabei viel NADH entsteht. Dessen Elektronen gelangen in die Innenmembran der Mitochondrien und treibt dabei einen Prozess an, bei dem ATP entsteht und O 2 verbraucht wird. Das erzeugte ATP wird aus den Mitochondrien ins Cytosol gebracht, wo es der Zelle zur Verfügung steht. In jeder Zelle sind jederzeit 109 ATP- Moleküle vorhanden und werden alle 1-2 Minuten umgesetzt. Insgesamt wird bei obigem Vorgang ca 50% der Energie verwertet, der Rest wird als Wärme frei. Kapitel 14: Energieümwandlüng in Mitochondrien ünd Chloroplasten (S. 481-506) Bei der Glykolyse in eukaryotischen Zellen werden nur geringe Mengen ATP hergestellt. Das Gros wird über Membran-gebundene Prozesse in den Mitochondrien hergestellt (bei Pflanzen und Algen auch in den Chloroplasten). In den Mitochondrien entstehen für jedes oxidierte Glucosemolekül 30 Moleküle ATP. In der Glykolse alleine nur 2 ATP pro Glucosemolekül. Das Mitochondrium Jedes Mitochondrium enthält eigene DNA, RNA und Transkriptions-/ Translationsapparat, einschliesslich der Ribosomen. Sie verändern ständig ihre Form und Position und können in Verbindung mit Mikrotubuli lange, bewegliche Ketten bilden. In anderen Zellen verharren sie genau dort, wo ein sehr hoher Energieverbrauch stattfindet (z.B. Herzmuskelzelle, Spermium). Ein Mitochondrium hat zwei hochspezialisierte Membranen. Diese erzeugen zwei Kompartimente: Die Matrix und den Intermembranraum. Die Aussenmembran enthält viele Porin- Transportproteine und wirkt daher wie ein Sieb. Jedes Molekül bis zu 5000Dalton kann hindurch. Die Innenmembran, welche zur Oberflächenvergrösserung in viele Cristae gefaltet ist, ist undurchlässig. Nur spezifische Moleküle können durch ihre Membrantransportproteine hindurch gelangen. In der Innenmembran finden der Elektronentransport und das Pumpen von Protonen statt und sie enthält die ATP- Synthase. Der Zitronensäurezyklus Mitochondrien verwenden sowohl Pyruvat als auch Fettsäuren als Brennstoff. Beide werden über die innere Mitochondrienmembran transportiert und dann von in der Matrix sitzenden Enzymen in AcetylCoA umgewandelt. Deren Acetylgruppen werden dann im Zitronensäurezyklus oxidiert. Hierbei werden die C Atome von Acetyl-CoA in CO2 umgewandelt, welches als Abfallprodukt ausgeschieden wird. Ausserdem entstehen dabei energiereiche Elektronen, die von NAD+ und FAD+ aufgenommen werden, wobei NADH und FADH2 gebildet wird, welche die Elektronen dann an die Innenmembran übertragen, wo sie in die Elektronentransportkette eintreten. Dabei wird ein H- Atom mit einem zusätzlichen Elektron von NADH entfernt und in ein Proton und 2 energiereiche Elektronen umgewandelt: H-H++2e- Die Elektronentransportkette Die Elektronentransportkette, welche die oxidative Phosphorylierung ausführt, wird auch als Atmungskette bezeichnet und enthält über 40 Proteine, von denen 15 direkt am Elektronentransort beteiligt sind. Die meisten dieser Proteine sind in die Lipiddoppelschicht eingebettet. Grundsätzlich fasst man die Proteine in drei Atmungsenzymkomplexe zusammen: 1) NADH Dehydrogenase- Komplex 2) Cytochrom b-c1- Komplex 3) Cytochrom- Oxidase- Komplex Der Elektronentransport beginnt mit der Entfernung des H- aus NADH, wobei 2 e- freiwerden. NADH Dehydrogenase- Komplex katalysiert diese Reaktion und nimmt die 2 freien e- auf. Die Elektronen werden dann per Elektronen- Carriern entlang der Kette an die anderen Komplexe weitergegeben. Dieser Transfer ist energetisch begünstigt. Der Elektronentransport erzeugt einen Protonengradienten Jede Elektronenübertragung ist eine Redox- Reaktion. Der Elektronendonor wird oxidiert, der Elektronenakzeptor reduziert. NADH hat wegen seiner energiereichen e- eine niedrige Elektronenaffinität und gibt daher seine e- leicht ab. Bei jeder Elektronenübertragung wird die freigesetzte Energie an die Aufnahme von Protonen aus (in der Matrix befindlichem) Wasser gekoppelt, welche dann in den Intermembranraum abgegeben werden. Dadurch wird ein Protonengradient über der Innenmembran aufgebaut (erhöhte H+- Konzentration im Intermembranraum) und als Folge des Protonenflusses entsteht ein Membranpotenzial über der Innenmembran. Der Protonengradient treibt die ATP- Synthese an ATP- Synthase erzeugt einen hydrophilen Durchgang durch die Innenmembran, durch den Protonen entlang ihres elektrochemischen Gradienten zurückströmen können. Dabei werden sie genutzt, um die energetisch ungünstige Reaktion ADP+ Pi ATP anzutreiben. Die ATP- Synthase besteht aus grob aus zwei Teilen: Ein kugelförmiger Teil, der auf der Matrixseite aus der Innenmembran herausragt. Aus der „Kugel“ ragt ein Stiel, der mit einem Protonen- Carrier in der Membran verbunden ist. Wenn Protonen den engen Kanal im Stiel passieren, treibt das den Stiel zu schnellen Drehungen innerhalb des Kopfteils an, wodurch Konformationsänderungen ausgelöst werden. So wird die mechanische in chemische Energie umgewandelt, die für die ATP- Produktion gebraucht wird. Die ATP- Synthase ist reversibel: Ist der Gradient zu niedrig für die ATP Produktion, wird ATP von der ATP- Synthase hydrolisiert, um den Gradienten wieder aufzubauen. Protonengradient treibt den aktiven Transport über die Innenmemb ran an In den Mitochondrien müssen z.B. Pyruvat, ADP und Pi vom Cytosol in die Matrix gepumpt werden, während ATP herausgepumpt werden muss. Carrier- Proteine binden an diese Moleküle und koppeln ihren Transport an den Fluss von H+ in die mitochondriale Matrix. ADP wird mit ATP zusammen von einem einzigen Carrier- Protein in die jeweils entgegengesetzte Richtung kotransportiert. Elektronentransportkette und Protonenpumpe Wird ein Molekül durch Aufnahme eines Elektrons reduziert, wird es negativ geladen. Diese Ladung wird rasch durch Aufnahme eines Protons aus dem umliegenden Wasser neutralisiert. Es wird also ein ganzes H- Atom übertragen. Ähnlich wird bei der Oxidation ein H- Atom in seine Bestandteile zersetzt. Dies ermöglicht die getrennte Übertragung des e- auf ein Elektronenakzeptormolekül, während das Proton an Wasser abgegeben wird. In der Elektronentransportkette muss der Elektronen- Carrier in der Membran so angeordnet sein, dass er auf der einen Seite ein Proton aufnehmen kann, sobald ein e- auf ihn übertragen wird, aber das Proton auf der anderen Seite abgibt, wenn das e - zum nächsten Carrier wandert. Das Redoxpotenzial ist ein Mass für Elektroaffinitäten Ein Säure wird durch Verlust eines Protons in eine Base verwandelt werden. NADH und NAD+ werden als Redoxpaar bezeichnet. Elektronen werden sich spontan von einem Redoxpaar mit niedrigem Redoxpotenzial (also einer geringen Elektronenaffinität) wie NADH/ NAD + zu einem Redoxpaar mit hohem Redoxpotenzial wie O2/ H2O bewegen. Zellen führen die Reaktion: 2H+ + 2e- + 0.5O2 H2O zwar aus, aber schrittweise, indem die Elektronen des NADH über eine ganze Reihe von ElektronenCarriern bis zum Sauerstoff laufen lassen. Andernfalls würde alle Energie in Form von Wärme verpuffen. An Proteine gebundene Metallatome sind vielseitige e - - Carrier Innerhalb der drei Enzymkomplexe bewegen sich die Elektronen zwischen Metallatomen, die fest an Proteine gebunden sind. Zwischen den Komplexen werden sie Elektronen von Molekülen übertragen, die in der Lipiddoppelschicht entlang diffundieren und Elektronen bei einem Komplex aufnehmen und beim nächsten abgeben. Ubichinon ist der einzige carrier, der nicht Teil eines Proteins ist. Ubichinon nimmt ein oder zwei Elektronen vom NADH- Dehydrogenase- Komplex auf und gibt sich beim Cytochrom b-c1- Komplex an. Für jedes aufgenommene e- nimmt Ubichinon ein H+ aus der Umgebung auf. Der Cytochrom- Oxidase- Komplex katalysiert die Reduktion von O 2 Die Cytochrom- Oxidase empfängt die e- vom Cytochrom c und gibt sie in der folgenden Reaktion an den Sauerstoff ab: 4H+ +4e- + O2 2H2O. Die Protonen stammen von der wässrigen Umgebung. Zusätzlich wurden bei der Elektronenübertagung, wie oben erwähnt, Protonen über die Membran gepumpt, was den Gradienten zusätzlich erhöht. Hier wird nun der Sauerstoff durch bindung der Elektronen verbraucht. Bindet jedoch ein O2 ein e-, entsteht sehr reaktives O2-, das auch Elektronen von der DNA/ Proteinen usw. anziehen und dadurch diese beschädigen würde. Darum muss der Sauerstoff so lange von den Elektronen getrennt bleiben, bis alle 4 benötigten Elektronen bereitstehen zur Umwandlung in H2O. Durch diesen Vorgang verursachte Schäden werden als Hauptalterungsgrund des Menschen angesehen. Kapitel 15: Intrazellülare Kompartimente ünd Transport (S. 529- 560) Membranumschlossene Organellen Zellkern: Von Doppelmembran umgeben, kommuniziert per Kernporen mit Cytosol, äussere Kernmembran setzt sich in der ER- Membran fort ER: Hauptort der Membranneubildung, grosse Regionen auf cytosolischen Seite mit Ribosomen bedeckt (rauses ER), glattes ER entgiftet Alkohol und entfernt Ca 2+ aus Cytosol Ribosomen: Synthetisieren Proteine Golgi- Apparat: Befindet sich gewöhnlich in Nähe Zellkern, erhält vom ER Proteine und Lipide und modifiziert sie und sendet sie weiter Lysosomen: Kleine Säckchen mit Verdauungsenzym bauen alte Organellen sowie durch Endocytose erhaltene Makromoleküle ab Endosomen: Sortieren aufgenommene Stoffe aus und führen einige zur Plasmamembran zurück Peroxisomen: Enthalten Enzyme, die eine Vielzahl oxidativer Reaktionen katalysieren Viele membranumschlossene Organellen werden durch Verknüpfung mit Mikrotubuli an ihrem Platz in der Zelle gehalten. Ribosomen sind NICHT von einer Membran umschlossen, gelten also nach ursprünglicher Definition nicht als Organell. Die Ur- Prokaryotenzelle hatte nur Plasmamembran. Diese musste alle alle membranabhängigen Funktionen (inkl. ATP- und Lipidsynthese) erfüllen müssen. Aufgrund ihres hohen Oberflächen zu Volumen Verhältnisses ging das. Heutige eukaryotische Zellen haben aber ein zu grosses Volumen dafür. Membranumschlossene Organellen sind auf zwei Arten entstanden: 1) Durch Einstülpung der Plasmamembran (Membranen von: Zellkern, ER, Golgi- Apparat, Endosomen, Lysosomen). 2) Mitochondrien und Chloroplasten waren anaerobe Bakterien, welche verschluckt wurden. Dies erklärt, wiso diese Organellen von zwei Membranen umschlossen sind. Proteine müssen sortiert werden Die meisten Organellen entstehen aus bereits existierenden, die wachsen und sich teilen.Die Kernhülle, das ER und der Golgi- Apparat zerfallen bei der Teilung in kleine Vesikel, die in den Tochterzellen wieder miteinander verschmelzen. Auch in sich nicht teilenden Zellen werden permanent Proteine hergestellt. Diese müssen zielsicher zu den Organellen gelangen. Mitochondrien, Chloroplasten, Peroxisomen und dem Kerninneren werden die Proteine direkt aus dem Cytosol geliefert, Golgi-Apparat, Lysosomen, Endosomen und Kernmembran erhalten sie indirekt über das ER. Im Cytosol hergestellte Proteine enthalten in ihrer Aminosequenz einen Bereich, der als Lieferadresse dient. Proteine werden über 3 versch. Weisen in Organellen transportiert Synthese aller Proteine beginnt in den Ribosomen im Cytosol. Einzige Ausnahme sind die wenigen Mitochondrien- und Chloroplasten- Proteine, die an den eigenen Ribosomen hergestellt werden. Das Sortierungssignal lenkt Proteine in das passende Organell. Wie kann ein hydrophiles Makromolekül durch hydrophobe Membranen in die Organellen gelangen? 1) Für den Zellkern bestimmte Proteine finden durch die Kernporen Einlass, durch welche Makromoleküle aktiv befördert werden und kleine Moleküle frei diffundieren 2) Für ER, Mitochondrien, Chloroplasten und Peroxisomen bestimmte Proteine werden mithilfe von (in der Membran sitzenden) Proteintranslokatoren befördert. Dazu muss das Protein entfaltet sein 3) Proteine, die vom ER weiterverschickt werden oder von einem Kompartiment innerhalb des ER zum nächsten gelangen müssen, werden per Vesikel transportiert Signalsequenzen als Lieferadresse Die Signalsequenz besteht aus einer kontinuierlichen Abfolge von 15 – 60 Aminosäuren, die nach erfolgreicher Zustellung gewöhnlich entfernt werden. Die Signalsequenzen, die an den gleichen Bestimmungsort führen, variieren teilweise so stark, dass wohl eher ihre physikalischen Eigenschaften als ihre genaue Abfolge bestimmend sind. 1)Proteine dringen durch Kernporen in Zellkern ein Die Kernhülle wird aus zwei konzentrischen Membranen gebildet. Die innere Membran enthält Proteine, die als Bindungsstellen für die Chromosomen und die Kernlamina dienen. Die äussere Membran ähnelt der Zusammensetzung der ER- Membran, mit der sie verbunden ist. Diese Kernhülle ist von Poren durchzogen, über die ein beidseitiger Transport von Proteinen möglich ist. Neu synthetisierte Proteine betreten den Kern, RNA verlässt ihn. Wobei unvollständige RNA den Kern nicht verlassen kann (Qualitätskontrolle). Jede Pore enthält wassergefüllte Kanäle, durch die wasserlösliche Proteine diffundieren können. Grössere Moleküle benötigen ein Sortiersignal- das Kernlokalisationssignal NLS- das es in den Zellkern lenkt. Damit ein solches, für den Kern bestimmtes Protein, mit der Kernpore in Wechselwirkung treten kann, werden Kernimportrezeptoren –Proteine gebraucht. Diese binden ans NLS und lotsen das neue Protein zur Pore, indem sie mit deren Fibrillen in Wechselwirkung treten. Ist das geschehen, wird das Protein aktiv in den Kern befördert, wobei durch Hydrolyse von GTP stammende Energie verbraucht wird. Nach erfolgreichem Transport ins Innere des Zellkerns kehren die Kernimportrezeptoren durch die Poren zurück für den nächsten Einsatz. Durch Kernporen können auch vollständig gefaltete Proteine transportiert werden! 2)Ungefaltete Proteine gelangen in Mitochondrien und Chloroplasten Während Mitochondrien zwei Membranen haben, gibt es bei Chloroplasten mit der Thylakoidmembran eine dritte. Für diese Organellen bestimmte Proteine werden gleichzeitig durch die äussere und innere Membran befördert. Dies an bestimmten Stellen, bei denen die Membranen miteinander in Verbindung stehen. Jedes Protein wird nur im entfalteten Zustand befördert und nach der Überführung wird die Signalsequenz abgespalten. Chaperone (Proteine) helfen beim Transmembrantransport und bei der Faltung danach. Der weitere Transport erfordert zusätzliche Sortiersignale im Protein, die oft erst nach Abspaltung der ersten in Erscheinung treten. Bereits während ihrer Synthese gelangen Proteine ins ER Das ER ist das ausgedehnteste Membransystem der Zelle und dient als Anlaufstelle von Proteinen für den Weitertransport. Vom ER aus werden die Proteine nur noch per Vesikel transportiert. Es sind zwei Arten von Proteinen zu unterscheiden, die vom Cytosol ins ER übertragen werden: 1) Wasserlösliche Proteine werden vollständig durch die ER- Membran geschoben und im Lumen freigesetzt 2) Zukünftige Transmembranproteine werden nur teilweise durch die ER- Membran geführt und bleiben in sie eingebettet. Beide Proteinarten werden durch eine ER-Signalsequenz zum ER geführt. Für das ER bestimmte Proteine werden bereits durch die ER- Membran gefädelt, wenn die Plypeptidkette noch im Entstehen ist. Das macht es erforderlich, dass die Protein synthetisierenden Ribosomen direkt an die ERMembran geheftet sind. Diese an die cytosolische Seite der ER- Membran gefundene Ribosomen heissen membrangebundene Ribosomen (raues ER) und stellen für das ER bestimmte Proteine her. Freie Ribosomen sind ungebunden und stellen all die anderen Proteine her. Sie sind aber strukturell und funktionell identisch. Lösliche Proteine werden ins ER- Lumen abgegeben Damit eine wachsende Polypeptidkette mit einer ER- Signalsequenz zur ER- Membran gelangt, braucht es zwei Dinge: 1) Signalerkennungspartikel SRP aus dem Cytosol, die an die ER- Signalsequenz bindet 2) In der ER- Membran verankerte SRP- Rezeptoren, die SRP erkennen Die Bindung des SRP an eine Signalsequenz verlangsamt die Synthese, bis das Ribosom mit dem gebundenen SRP an den SRP- Rezeptor andockt. Nach dieser Bindung wird SRP wieder freigesetzt, die Synthese wieder voll fortgesetzt und die wachsende Polypeptidkette durch einen Translokationskanal in der ER- Membran ins Lumen geführt. Zusätzlich zur Lenkung ins ER hat die Signalsequenz die Aufgabe, den Translokationskanal zu öffnen. Die Signalsequenz bleibt mit dem Kanal verbunden, während der Rest der Proteinkette durch die Membran gefädelt wird. Später wird die Signalsequenz per Signalpeptidase abgespalten und abgebaut, während das Protein ins ER- Lumen entlassen wird. Start- und Stopp- Signale bestimmen die Anordnung des Proteins in der Membran Nicht alle Proteine, die ins ER gelangen, werden ins ER- Lumen entlassen. Einige bleiben als Transmembranproteine in der ER- Membran. Das ist komplizierter, da einige Teile der Polypeptidkette durch die Lippiddoppelschicht weitergeleitet werden, während andere in der Membran haften bleiben. Im einfachsten Fall initiiert die Signalsequenz die Translokation, aber der Transfer wird mithilfe einer zusätzlichen Transfer- Stoppsequenz angehalten. Diese zweite Sequenz wird vom Translokationskanal freigesetzt und schiebt sich seitwärts in die Membran. Dort bildet sie eine αHelix, die die Membran durchzieht. Gleichzeitig wird auch die Signalsequenz vom Kanal freigelassen und abgespalten. Transmembranproteine haben eine fixe Ausrichtung: Carboxylende Richtung Cytosol, Aminoende Richtung ER- Lumen. Dazwischen, in der Membran, die Transfer- Stoppsequenz als Ankerpunkt. Bei manchen Transmembranproteinen dient eine innenliegende anstatt N-terminale Signalsequenz als Transfer- Startsequenz. Diese wird natürlich nicht Abgespalten! Dies bei Proteinen, die die Membran mehrmals durchziehen. 3)Vesikulärer Transport Die Aufnahme ins ER ist gewöhnlich nur der erste Schritt auf dem Weg. Zunächst gelangen die Proteine per Vesikeltransport vom ER zum Golgi- Apparat und von dort aus weiter. Vesikel befördern lösliche Proteine und Membransegmente Ein wichtiger, nach aussen gerichteter sekretorischer Transportweg beginnt mit der Synthese von Proteinen in den Ribosomen, und ihrer Aufnahme ins ER. Von dort zum Golgi- Apparat und seine Kompartimente entweder zur Zelloberfläche oder durch Endsomen zu den Lysosomen. Bei wichtiger, ins Zellinnere verlaufender endocytotischer Transportweg, der für die Aufnahme und Abbau von extrazellulären Molekülen verantwortlich ist, befördert Material von der Plasmamembran durch Endosomen zu den Lysosomen. Jedes Transportvesikel darf nur die für das jeweilige Ziel bestimmten Proteine mitnehmen und nur mit der Zielmembran verschmelzen. Ausserdem muss das Organell trotz des ständigen Zu- und Abflusses seine Protein- und Lipidzusammensetzung bewahren. All dies hängt von Proteinen ab, die mit der Membran der Transportvesikel verknüpft sind. Die Vesikelknospung Die Vesikel, die sich von Membranen abknospen, haben gewöhnlich eine charakteristische Proteinhülle auf ihrer cytosolischen Oberfläche = Beschichtete Vesikel. Nach beendeter Abknospung vom Herkunftsorganell legt das Vesikel seine Hülle ab, damit es mit der Zielmembran verschmelzen kann. Jede Zellart bildet eine eigene Proteinbeschichtung, welche vermutlich zwei Funktionen erfüllt: 1) Formt sie die Membran zu einer Knospe 2) Trägt dazu bei, Moleküle für den Transport einzufangen Nachfolgendes bezieht sich auf das Beispiel von mit Clathrin beschichteten Vesikel. Diese Vesikel schnüren sich beim sekretorischen Transport vom Golgi- Apparat ab und beim endocytotischen Transport von der Plasmamembran. Bei der Plasmamembran beginnt jedes Vesikel als eine clathrinbeschichtete Vertiefung. Clathrinmoleküle lagern sich auf der cytosolischen Seite zu einem Geflecht zusammen, was die Formung eines Vesikels initiiert. Das Dynamin – Protein lagert sich als Ring um den Hals jeder bereits tief eingeschnürten, clathrinbeschichteten Vertiefung. Der Ring zieht sich zusammen und zwickt das Vesikel ab. Wie kann ein Transportvesikel eine besondere Fracht auswählen?: Adaptine stellen sowohl die Clathrinbeschichtung sicher als auch die Auswahl der Frachtmoleküle. Moleküle tragen spezifische Transportsignale, die von Frachtrezeptoren auf der Membran des Kompartiments erkannt werden. Adaptine helfen beim Beladen, indem sie die Frachtrezeptoren einfangen (welche die Transportsignale der Moleküle binden). Es gibt drei verschiedene Typen von beschichteten Vesikeln: Beschichteter Vesikeltyp clathrinbeschichtet Hüllprotein Herkunft Zielort Clahtrin+ Adaptin 1 Golgi- Apparat clathrinbeschichtet COP- beschichtet Clathrin+ Adaptin 2 COP- Proteine Plasmamwmbran ER/ Golgi- Apparat Lysosomen (per Endosomen) Endosomen Golgi- Apparat/ ER Spezifität des Andockens von Vesikels ist von SNAREs abhängig Nach der Abschnürung der Vesikeln von der Membran, muss es seinen Weg zum richtigen Bestimmungsort finden. Meistens werden Vesikel durch Motorproteine aktiv befördert, die sich an Cytoskelettfilamenten entlang bewegen. Nach Erreichen des Zielorganells muss es dieses erkennen und andocken. Jeder Transportvesikeltyp hat auf seiner Oberfläche v-SNAREs (Marker), die das Vesikel entsprechend seiner Herkunft und Fracht kennzeichnen. Diese v-SNAREs müssen von komplementären Rezeptoren, den t-SNAREs, auf der entsprechenden Zielzellmembran erkannt werden. Jedes Organell und jeder Transportvesikeltyp tragen ein einzigartiges SNARE. Hat ein Transportvesikel seine Zielmembran erkannt und dort angedockt, kommt es zur Fusion. Dabei wird nicht nur der Vesikelinhalt ins Innere des Zielorganells geliefert, sonder fügt auch die Vesikelmembran der Organellmembran hinzu. Damit die Membranfusion geschieht, braucht es ein spezifisches molekulares Signal. Die Fusion benötigt eine sehr enge Annäherung des Vesikels an die Membran, damit sich die Lipiddoppelschichten vermischen können. Damit das geschieht, muss das Wasser verdrängt werden, was energetisch ungünstig ist, und daher von Proteinen katalysiert werden muss. Die v-SNAREs und t-SNAREs wickeln sich umeinander und bilden eine Winde, wodurch die sehr enge Annäherung vorangetrieben wird. Sekretorische Transportwege: Exocytose Exocytose heisst der Vorgang, bei dem Vesikel mit der Membrane verschmelzen. Die meisten Proteine werden im ER kovalent modifiziert Die meisten Proteine, die ins ER gelange, werden dort chemisch verändert. So bilden sich Disulfidbrücken, welche die Struktur jener Proteine stabilisieren, die pH- Wert- Änderungen ausgesetzt sein könnten oder auf verdauende Enzyme ausserhalb der Zelle stossen können. Viele Proteine, die ins ER- Lumen oder die ER- Membran gelangen, werden glykolisiert (Anheftung von kurzen Oligosaccharid- Seitenketten). Oligosaccharide können das Protein vor Abbau schützen, oder festhalten, bis es richtig gefaltet ist oder mithelfen, es zum richtigen Organell zu lenken. Diese Glykolisierung findet in einem Stück statt, es werden vorgefertigte Oligosaccharidstücke angefügt. Die Oligosaccharid- Prozessierung beginnt im ER und setzt sich im Golgi- Apparat fort. Qualitätskontrolle beim Verlassen des ER Diejenigen Proteine, die im ER selbst ihre Aufgabe haben, werden vom ER- Retentionssignal festgehalten und zurückgeholt, wenn sie zum Golgi- Apparat entwischen. Denn das ERRetentionssignal werden von einem membrangebundenen Rezeptorprotein im ER und Golgi- Apparat erkannt. Alle anderen Proteine sind dazu bestimmt, zu einem anderen Organell zu gelangen. Damit nur funktionsfähige Proteine ausgeliefert werden, findet eine Funktionsprüfung statt. Falsch gefaltete und sonstig defekte Proteine werden aktiv durch Chaperone in ER zurückgehalten. Tritt die korrekte Faltung nicht ein, wird es entsorgt. Cystische Fibrose ist eine dominante Mutation, bei der ein Protein sich zu langsam faltet und daher entsorgt wird, bevor es bereit wäre. Weitere Modifikationen und Sortierung um Golgi - Apparat Der Golgi- Apparat, der sich in der Nähe des Zellkerns befindet, besteht aus einer Ansammlung aufgestapelter, abgeflachter, membranumschlossener Säckchen Genannt Golgi- Stapel. Jeder GolgiStapel hat zwei Seiten: Einen Zugang, die Cis- Seite und einen Ausgang, Trans- Seite. Die Cis- Seite grenzt an das ER, die Trans- Seite zeigt zur Plasmamembran. Im Golgi- Apparat werden den glykolisierten Proteinen Zucker hinzugefügt oder entfernt. Sekretorische Enzyme werden von der Zelle durch Exocytose nach aussen abgegeben Der konstitutive Exocytoseweg liefert Lipide und Proteine, die für das Wachstum der Zelle benötigt werden. Dies ist ein stetiger Fluss, der nicht selektiv ist und keine besondere Signalsequenz erfordert. Der geregelte Exocytoseweg wird nur von auf Sekretion spezialisierten Zellen benutzt. Sekretorische Zellen bilden grosse Mengen an Hormonen, Schleim oder Verdauungsenzyme, die in sekretorischen Vesikeln zur späteren Freisetzung aufbewahrt werden. Diese Vesikel schnüren sich vom Trans- GolgiNetz ab und sammeln sich in der Nähe der Plasmamembran an und warten auf das extrazelluläre Signal zur Fusion und Freisetzung. Proteine, die für sekretorische Vesikel bestimmt sind, haben die besondere Eigenschaft, dass sie sich trotz saurem pH- Wert und hoher Ca2+ Konzentration zusammenlagern können und so in hohen Konzentrationen in die Vesikel gepackt werden. So können grosse Mengen auf ein Mal freigesetzt werden. Die Zunahme an Membranoberfläche durch Exocytose wird durch die Abnahme durch Endocytose ausgeglichen. Endocytose Endocytose heisst der Vorgang, bei dem Zellen fortwährend Flüssigkeit und grössere/ kleinere Moleküle aufnimmt. Das aufzunehmende Material wird zunehmend von einem kleinen Plasmamembranteil umschlossen, das sich nach innen stülpt und dann abschnürt. Dann wird es zu den Lysosomen geführt und dort verdaut. Es gibt zwei Haupttypen der Endocytose: Pinocytose umfasst die Aufnahme von Flüssigkeiten und kleinen Moleküle, die Phagocytose beinhaltet die Aufnahme grosser Partikel. Pinocytose wird fortwährend von allen eukaryotischen Zellen betrieben, während Phagocytose hauptsächlich über Phagocyten geschieht. Phagocyten nehmen grosse Partikel auf Bei Mikroorganismen dient die Phagocytose der Nahrungsaufnahme. Sie verleiben sich grosse Partikel ein, indem sie diese in Phagosomen aufnehmen. Anschliessend verschmelzen die Phagosomen mit Lysosomen, wo sie verdaut werden. In vielzelligen Organismen wie Tieren ist der Aspekt der Nahrungsaufnahme nebensächlich. Phagocyten (Fresszellen) einschliesslich Makrophagen verteidigen uns gegen Infektionen, indem sie eindringende Mikroorganismen aufnehmen. Die Partikel müssen an die Oberfläche der Phagocyten binden und einen Oberflächenrezeptor aktivieren, um von ihm aufgenommen zu werden. Diese Bindung verursacht die Ausbildung von Membranfortsätzen namens Scheinfüsschen, die das Bakterium umfliessen. Flüssigkeiten und kleinere Moleküle werden per Pinocytose aufgenommen Eukaryotische Zellen nehmen ständig kleine Stücke ihrer Plasmamembran in Form pinocytotischer Vesikeln auf, die später wieder zur Zelloberfläche zurückkehren. Die Aufnahme (Endocytose) und Abgabe (Exocytose) halten sich dabei im Gleichgewicht. Die Pinocytose wird hauptsächlich von clathrinbeschichteten Vertiefungen und Vesikeln ausgeführt. Rezeptorvermittelte Endocytose Die Pinocytose nimmt jedes Molekül auf, ist also nicht spezifisch. In den meisten tierischen Zellen ist die Pinocytose mithilfe clathrinbeschichteter Vesikel ein wirksamer Mechanismus, um spezifische Makromoleküle aus der extrazellulären Flüssigkeit aufzunehmen. Die Makromoleküle binden an die komplementären Rezeptoren auf der Zelloberfläche und gelangen in die Zelle als RezeptorMakromolekül- Komplexe in clathrinbeschichteten Vesikeln. Dieser Prozess heisst rezeptorvermittelte Endocytose und kann bestimmte Makromoleküle selektiv anreichern. Cholesterin wird so aufgenommen, das zur Herstellung neuer Membranen benötigt wird. Die Rezeptorvermittelte Endocytose wird vom Influenza- Virus und von HIV missbraucht. Cholesterin ist extrem unlöslich und wir im Blut proteingebunden in Form von Partikeln transportiert, die als LDL- Partikel (low density lipoproteins) bezeichnet werden. LDL bindet an Rezeptoren auf der Zelloberfläche und werden so als Komplex durch die Endocytose aufgenommen und zu den Endosomen gebracht. Deren saures Milieu dissoziiert das LDL von seinem Rezeptor, der dann zur Wiederverwendung zurückgebracht wird, während das LDL an die Lysosomen übergeben wird. Dort wird LDL abgebaut, wobei das Cholesterin ins Cytosol freigesetzt wird. Die LDL- Rezeptoren werden permanent per Vesikel zu den Endosomen gebracht und wieder zurück- egal ob LDL gebunden ist. Ist das Gen für die LDL- Rezeptoren defekt, kann das Cholesterin nicht in per Lysosomen ins Cytosl und häuft sich im Blut an und verursacht Arteriosklerose. Per Endcytose aufgenommene Moleküle werden in Endosomen sortiert Extrazelluläres Material, das per Pinocytose aufgenommen wurde, gelangt zuerst in die frühen Endosomen, welche direkt unter der Plasmamembran sind. danach gelangen sie in die späten Endosomen in der Nähe des Zellkerns. Frühe Endosomen reifen allmählich zu späten Endosomen. Das endosomale Kompartiment fungiert als die wichtigste Sortierstation auf dem Endocytosetransportweg. Das saure Mileu spielt dabei eine wichtige Rolle, da es viele Rezeptoren veranlasst, ihre gebundene Fracht freizusetzen. Die Rezeptoren gehen dann verschiedene Wege: Die meisten gehen wieder zur Plasmamembran zurück, von wo sie gekommen sind. Andere werden in den Lysosomen verdaut. Eine dritte Gruppe setzt ihren Weg zu verschiedenen Bereichen der Plasmamembran fort. Dieser Vorgang nennt sich Transcytose. Wenn die Fracht an den Rezeptor gebunden bleibt, passiert ihr das gleiche wie dem Rezeptor. Wie Moleküle von Endosomen zu Lysosomen transportiert werden, ist noch unklar. Vllt. per Vesikeltransport oder dadurch, dass sich Endosomen zu Lysosomen verwandeln. Zelluläre Verdauung findet in den Lysosomen statt Lysosomen sind Membransäckchen, die mit hydrolytischen Enzymen angefüllt sind und die intrazelluläre Verdauung von extrazellulärem Material sowie ausgedienten Organellen im sauren Milieu ausführen. Die Lysosomenmembran hält dabei normalerweise die zerstörerischen Enzyme vom Cytosol fern, aber auch aufgrund der Säureabhängigkeit der Enzyme ist das Cytosol geschützt. Die Lysosomenmembran enthält Transportproteine (Abtransport von Verdautem) sowie eine ATP getriebene p+ -Pumpe (sorgt für saures Milieu). Die meisten lysosomalen Membranproteine sind stark glykolisiert, weil die Zucker die Proteine vor der Verdauung schützen. Die spezialisierten Verdauungsenzyme und Membranproteine der Lysosomen werden im ER hergestellt und durch den Golgi- Apparat zum Trans- Golgi- Netz befördert. Im Golgi- Apparat werden sie glykolisiert, damit sie von einem Rezeptor erkannt werden. Diese Markierung erlaubt die Sortierung und Verpackung der Enzyme in Transportvesikel, die den Inhalt mittels später Endosomen zu den Lysosomen bringen. Kapitel 16: Zellkommünikation (S. 565- 602) Sowohl tierische wie auch pflanzliche Zellen stehen in ständigem Kontakt miteinander, was lebensnotwendig ist. Denn erhält eine Zelle keine Signale mehr, begibt sie sich in die Apoptose (Selbstzerstörung). Grundlagen der zellulären Signalübertragung Bei der Zellkommunikation bildet die signalisierende Zelle Signalmoleküle, die von den Rezeptorproteinen der Zielzelle wahrgenommen werden. Die Signaltransduktion (Nachrichtenumwandlung) beginnt, wenn ein Rezeptor der Zielzelle ein eintreffendes, extrazelluläres Signal erhält und es in intrazelluläre Signale umwandelt. Verschiedene Arten der Signalübertragung Signalmoleküle können ganz verschiedener Art sein: Proteine, Peptide, Aminosäuren, Nucleotide, Steroide, Gase … Verschiedene Kommunikationsarten gibt es aber nur vier: 1. Endokrin Bei der gebräuchlichsten Kommunikationsart wird das Signal per Blutkreislauf oder den Saft (bei Pflanzen) durch den ganzen Körper versendet. Auf diese Weise arbeitende Signalmoleküle heissen Hormone, welche von den endokrinen Zellen gebildet werden. 2. Parakrin Hier diffundieren Signalmoleküle lokal durch das extrazelluläre Medium (treten NICHT in den Blutstrom ein) und bleiben daher in der Nachbarschaft der Zelle, die sie abgegeben hat. Sie wirken als lokale Mediatoren auf Zellen in der Umgebung. 3. Neuronal Hier wird das Signal durch neuronale Nervenzellen über weite Entfernungen spezifisch an die Zielzelle übertragen. Wird ein Neuron durch Signale stimuliert, sendet es elektrische Impulse aus. Beim Erreichen des Endes vom Axon wird das el. Signal wieder in ein chemisches umgewandelt, wodurch ein Neurotransmitter freigesetzt wird. Diese Neurotransmitter diffundieren dann durch den engen Spalt zwischen Membran der Axonendigung und der Membran der Zielzelle. 4. Kontaktabhängig Bei der Signalvermittelten Zell-Zell- Kommunikation stellen die Zellen über Signalmoleküle in ihrer Plasmamembran einen direkten Kontakt her. Bindet ein Signalmolekül, das in der Plasmamembran der signalisierenden Zelle verankert ist, an ein Rezeptormolekül, das in die Plasmamembran der Zielzelle eingebettet ist, wird die Nachricht übertragen. Die kontaktabhändige Zellkommunikation spielt eine wichtige Rolle bei der Embryonalentwicklung. Einzelne Zellen im Embryo beginnen, sich zu Neuronen zu entwickeln. Damit sich nicht alle anderen Zellen auch zu Neuronen entwickeln, senden zukünftige Neuronen ein hemmendes Signal zu den Zellen in ihrer nahen Umgebung. Hormone: - Adrenalin - Cortisol - Insulin - Testosteron - … Lokale Mediatoren: - Blutplättchen- Wachstumsfaktor - Nerven- Wachstumsfaktor - Stickstoffmonoxid NO - Histamin - … Neurotransmitter: - Acetylcholin Kontaktabhängige Signalmoleküle: - Delta Jede Zelle antwortet auf ein beschränktes Signalsortiment Zellen sind hunderten von verschiedenen Signalmolekülen in der Umgebung ausgesetzt. Daher muss jede Zelle selektiv auf gewisse Signale antworten, gewisse aber ignorieren. Dies hängt davon ab, ob die Zelle für das Signal ein Rezeptor besitzt. Jede Zelle hat nur ein beschränktes Rezeptorsortiment. Diese beschränkte Signalbreite kann aber das Verhalten der Zelle auf komplexe Weise steuern: Erstens kann ein an ein Rezeptor gebundenes Signal vielfältig Einfluss nehmen, indem es die Zellgestalt, Zellbewegung, Metabolismus und Genexpression beeinflusst. Die Signale werden vom Oberflächenrezeptor durch ein intrazelluläres Relaissystem ins Zellinnere gelenkt. Dieses Relaissystem variiert von Zelltyp zu Zelltyp, sodass das gleiche Signal auf unterschiedliche Zellarten unterschiedliche Reaktionen zur Folge haben. Zweitens wird die Komplexität durch den Umstand mitverursacht, dass jede Zelle eine ganze Sammlung verschiedener Rezeptoren besitzt. Das macht die Zelle für viele extrazelluläre Signale gleichzeitig empfindlich. Wenn die Signale zusammenwirken, können sie Reaktionen auslösen, die stärker als die Summe der einzelnen Signalwirkungen sind. Die Anwesenheit eines Signales verändert die Reaktion auf ein anderes. Rezeptoren übermitteln Signale auf intrazellulären Signalwegen Das Ziel von Signalmolekülen ist praktisch immer ein Rezeptorprotein. Ein solcher Rezeptor kann genau von einem Signaltyp aktiviert werden und verrichtet den ersten Übertragungsschritt, indem es nach Erhalt des extrazellulären Signals ein neues, intrazelluläres Signal erzeugt. Diese intrazelluläre Nachricht wird nun von einem Signalmolekül zum nächsten übergeben, bis es ein Stoffwechselenzym aktiviert. Diese Signalkaskaden der intrazellulären Signalmoleküle haben wichtige Funktionen: 1) Umwandlung Wandeln Signal in eine geeignete Form um 2) Übermittlung Übermitteln Signal von einem Punkt zum nächsten 3) Verstärkung Signalkaskaden verstärken oft das erhaltene Signal 4) Verteilung Signalkaskaden verteilen das Signal durch Verzweigungen zw. den Schritten 5) Modulation In jeden Schritt der Signalkaskade kann modulierend eingegriffen werden NO durchquert Plasmamembran und aktiviert direkt intrazelluläre Enzyme Es gibt 2 Klassen von extrazellulärem Signalmolekülen: Moleküle, die zu gross oder hydrophil sind, um die Plasmamembran zu durchqueren und kleine oder hydrophobe, die durch die Plasmamembran können. Die grossen, hydrophilen Signalmoleküle benötigen Rezeptoren auf der Zelloberfläche, um ihr Signal weiterzugeben. Die zweite Klasse von kleinen, hydrophilen Moleküle aktivieren im Zellinnern intrazelluläre Enzyme oder binden an intrazelluläre Rezeptoren. Stickstoffmonoxid NO diffundiert aus der Zelle, die es hergestellt hat und gelangt in benachbarte Zellen. Das Gas hat eine örtlich stark begrenzte Wirkung, da es innert 5-10 Sekunden zu Nitrat und Nitrit umgewandelt wird. Wird Acetylcholin in der Blutgefässwand freigesetzt, veranlasst dies Endothelzellen zur Freisetzung von NO. NO entspannt dann Herzkranzgefässe oder sorgt für eine örtliche Blutgefässerweiterung. Im Inneren vieler Zielzellen bindet NO an das Enzym GuanylatCyclase, wodurch cyclisches GMP gebildet wird, welches selbst ein kleines intrazelluläres Signalmolekül ist. Manche Hormone passieren die Plasmamembran und bi nden an intrazelluläre Rezeptoren Auch hydrophobe (aber kleine) Signalmoleküle wie die Steroidhormone (Cortisol, Testosteron) durchqueren die Plasmamembran. Doch anstatt wie NO dort Enzyme zu aktivieren, bindet es an im Cytosol oder Zellkern vorhandene Rezeptoren. Diese Rezeptorproteine können die Gentranskription regulieren, sind aber im Normalzustand inaktiv. Bei der Bindung des Hormons, erfährt der Rezeptor eine Konfomationsänderung was durch Aktivierung führt. Es gibt 3 Klassen von Zelloberflächen- Rezeptoren Im Gegensatz zu NO und Steroidhormonen kann die Mehrheit der Signalmoleküle nicht durch die Membran, weil zu gross/ hydrophil. Diese binden an Transmembranrezeptoren der Plasmamembran. Es gibt drei Klassen dieser Zelloberflächen- Rezeptoren: - Ionenkanal- gekoppelte Rezeptoren - G- Protein- gekoppelte Rezeptoren - Enzymgekoppelte Rezeptoren Bei Ionenkanal Rezeptoren besteht das intrazelluläre Signal aus einem Ionenfluss durch die Membran, was einen el. Strom erzeugt. Durch diesen Strom ändert der Rezeptor seine Konformaiton und öffnet den Ionenkanal. G-Protein Rezeptoren aktivieren die membrangebundenen G- Proteine, die dann freigesetzt werden. Enzymgekoppelte Rezeptoren arbeiten als Enzyme oder sind mit solchen verknüpft. Viele extrazelluläre Signalmoleküle wirken über mehr als einen Rezeptortyp. Acetylcholin z.B. wirkt auf Skelettmuskelzellen per Ionenkanal Rezeptor, aber in Herzmuskelzellen per G-Protein Rezeptor. Auch viele Medikamente/ Drogen/ Nikotin wirken, indem sie an den Rezeptor binden und ihn blockieren oder überstimulieren. Ionenkanal- gekoppelte Rezeptoren Diese Rezeptoren sind für die schnelle Signalübertragung an den Synapsen des Nervensystems verantwortlich. Sie überführen chemische Signale (Neurotransmitter), welche die Aussenseite der Zielzelle erreichen, in elektrische Signale, in Form einer Spannungsänderung an der Plasmamembran der Zielzelle. Bindet ein Neurotransmitter, ändert dieser Rezeptortyp seine Konformation, wodurch sich ein Kanal für den Durchfluss von Ionen durch die Plasmamembran öffnet. Durch den elektrochemischen Gradienten strömen Ionen in die Zelle rein oder raus und erzeugen dadurch innert Millisekunden eine Änderung des Membranpotentials, was einen Nervenimpuls auslöst. Diese Art von Rezeptoren gibt es nur im Nervensystem und in Muskelzellen. Viele intrazelluläre Signalübertragungsproteine sind molekulare Schalter Von G- Protein- gekoppelten und enzymgekoppelten Rezeptoren empfangene Signale werden an Kaskaden intrazellulärer Signalmoleküle weitergeleitet. Diese intrazellulären Signalmoleküle sind normal Proteine, wobei aber cAMP, cGMP und Ca2+ auch mitwirken. Die wichtigsten dieser Proteine verhalten sich wie molekulare Schalter: Beim Eintreffen des Signals werden sie aktiviert und können dadurch weitere Proteine der Signalkette aktivieren. Sie bleiben so lange aktiv, bis sie durch ein zweites Signal abgeschaltet werden. Für eine erneute Übertragung eines Signals müssen diese Schalter erst wieder inaktiviert (und dann reaktiviert) werden, um zu regenerieren. Bei der Hauptklasse der molekularen Schalter gibt es zwei Unterklassen: 1) Proteine, deren Aktivität durch Phosphorylierung (per Kinasen) und Dephosphorylierung (Phosphatase) an-/abgeschaltet wird. Viele dieser dadurch gesteuerten Schalter sind selber Kinasen. Eine durch Phosphorylierung aktivierter Proteinkinase- Schalter phosphoryliert die nächste Proteinkinase usw. 2) Aus GTPbindenden Proteinen bestehende Schalter. Bei gebundenem GTP aktivieren sie, wird das GTP zu GDP umgewandelt, deaktiviert der Schalter. Eine spezielle Klasse GTP- bindender Proteine sind die G- Proteine, welche für G-Protein- gekoppelte Rezeptoren wichtig sind. G-Protein-gekoppelte Rezeptoren G- Protein- gekoppelte Rezeptoren bilden die grösste Familie unter den Zelloberflächen- Rezeptoren. Sie vermitteln eine Antwort auf eine enorme Vielfalt extrazellulärer Signalmoleküle wie Hormone, lokale Mediatoren, Neurotransmitter. Für jedes Signalmolekül gibt es einen oder gleich mehrere Rezeptoren. Jeder dieser Rezeptoren hat eine änhliche Struktur: Jeder besteht aus einer einzigen Polypeptidkette, die sich 7x vor- und rückwärts durch die Lipiddoppelschicht zieht. Stimulierung: Aktivierung durch G- Proteinuntereinheiten Wie gesagt, erfährt das Rezeptorprotein bei Bindung eines extrazellulären Signalmoleküls eine Konformationsänderung, wodurch das G- Protein auf der Innenseiten der Plasmamembran aktiviert wird. Obwohl es mehrere Varianten von G- Proteinen gibt, sind alle ähnlich aufgebaut: Ein G- Protein besteht aus der α-, β- und ϒ- Untereinheit. β und ϒ sind durch ihre kurzen Lipidschwänze an die Plasmamembran gebunden. Die α- Untereinheit hat im unstimulierten Zustand GDP gebunden. Bindet ein Signalmolekül an den Rezeptor, wird die Affinität für GDP verringert und GTP gebunden, wodurch die α- Untereinheit sich von β und ϒ abspaltet. Die beiden Komplexe wandern nun voneinander unabhängig an der Plasmamembran entlang und können direkt mit den in der Plasmamembran vorhandenen Zielproteinen in Kontakt treten. Die α- Untereinheit hat eine GTP- hydrolysierende Aktivität, wodurch innert Sekunden GTP wieder zu GDP hydrolysiert wird und sich die beiden Teile wieder zusammenfügen und inaktivieren. Bei der Cholera Krankheit vermehrt sich ein Bakterium im Darm und bildet das Protein Choleratoxin. das gelangt in die den Darm auskleidenden Zellen und verändert die α- Untereinheit eines GProteins. dadurch kann die Alpha- Untereinheit ihr GTP nicht mehr hydrolysieren und bleibt unberentzt aktiv, was im Darm zu einem Ausstrom von Cl- und H2O führt.-->Schwerer Durchfall und Wasserverlust. Bei Keuchhusten ändert das Pertussistoxin die α- Untereinheit und macht das GProtein arbeitsunfähig, da es kein GTP binden kann. Einige G- Proteine regulieren Ionenkanäle Ziele für die Untereinheiten des G- Proteins sind entweder Ionenkanäle oder membrangebundene Enzyme. Bindet Acetylcholin an den G- Protein- gekoppelten Rezeptor auf der Oberfläche von Herzmuskelzellen, wird das G- Protein aktiviert und der βϒ- Komplex bindet an die intrazelluläre Seite eines K+- Kanals in der Plasmamembran. Dies öffnet den Kanal und K+ strömt aus der Zelle. Dadurch wird die Aktivität der Herzmuskelzelle gehemmt. Das G- Protein wird dann durch Hydrolyse selber wieder deaktiviert. Einige G- Proteine regulieren membrangebundene Enzyme Häufige Zielproteine der G- Proteine sind die Adenylat- Cyclase, die für die Bildung des kleinen intrazellulären Signalmoleküls cAMP zuständig ist sowie die Phospholipase C (bildet ebenfalls kleine Signalmoleküle). Diese kleinen Signalmoleküle werden oft als Second Messenger bezeichnet. Sie werden in grossen Mengen gebildet, wenn ein membrangebundenes Enzym durch das G- Protein aktiviert wird. Die Second Messenger diffundieren rasch vom Bildungsort weg und verteilen dabei das Signal in der ganzen Zelle. Cyclisches AMP kann Enzyme und Gene aktivieren Viele extrazelluläre Signale, die über G- Proteine wirken, beeinflussen die Aktivität der AdenylatCyclase und verändern dadurch die Konzentration des Botenmoleküls cAMP in der Zelle. Oft aktiviert die α-Untereinheit die Adenylat- Cyclase, wodurch die cAMP Konzentration stark steigt. Um das Signal wieder abzustellen, wird cAMP wieder in AMP umgewandelt. cAMP ist ein gutes Botenmolekül, da es wasserlöslich ist. Bei Angst setzt die Nebenniere das Hormon Adrenalin frei, das im Blut zirkuliert und an G- Protein- gekoppelte Rezeptroen bindet. Im Skelettmuskel löst Adrenalin ¨bern den Anstieg der cAMP- Konzentration den Abbau von Glykogen aus, in den Fettzellen stimuliert es den Abbau von Triglsceriden zu Fettsäuren usw. Die Wirkung von cAMP basiert hauptsächlich auf der Aktivierung der cAMP- abhängigen Proteinkinase. Indem cAMP an es bindet, erfährt es eine Konformationsänderung, wodurch die Kinaseuntereinheiten freigesetzt werden, die dann die Phosphorylierung in den Zeilproteinen katalysiert und somit deren Aktivität ändert. In verschiedenen Uellarten werden unterschiedliche Sortimente von Zielproteinen phosphoryliert, was erklärt, wieso die Wirkung von cAMP je nach Zielzelle variiert. Inositolphospholipid- Weg löst den Anstieg von intrazellulärem Ca 2+ aus Einige extraz. Signalmoleküle binden an G- Protein- gekoppelte Rezeptoren, deren Untereinheiten dann Phospholipase C anstatt Adenylat- Cyclase aktiviert. Das aktivierte Phospholipase C- Enzym verbreitet ihr Signal, indem sie ein Inositolphospholipid- Molekül der Zellmembran spaltet. Dabei entstehen zwei kleine Botenmoleküle. Eines öffnet im ER die Ca2+- Kanäle in der Membran. Ca2+ strömt dann aus dem ER ins Cytosol aus, wo es aufgrund der erhöhten Konzentration zusammen mit Diacylglycerin die Proteinkinase C an die Plasmamembran rekrutieren hilft. Intrazelluläre Signalkaskaden An G- Proteine gekoppelte Signalkaskaden benötigen oft nur Sekunden zur Ausführung ihrer Funktionen. Eine der schnellsten G- Protein vermittelte Reaktion ist die Reaktion des Auges auf helles Licht. Photprezeptoren veranschaulichen gut die Vorteile intrazellulärer Signalkaskaden. Sie erlauben eine Verstärkung des eingehenden Signals und ermöglichen es Zellen, sich bei stark schwankenden Signalen anzupassen. In den Photozellen wird das Kicht von Rhodopsin, einem G- Proteingekoppelten Lichtrezeptor, eingefangen, wodurch das G- Protein Transducin aktiviert wird. Dessen αUntereinheit aktiviert eine Kaskade, die Na+- Kanäle in der Plasmamembran der Photorezeptorzelle zum Schliessen veranlasst. Dadurch wird die Spannung an der Zellmembran verändert und ein Nervenimpuls ins Gehirn geschickt. Enzymgekoppelte Rezeptoren Wie G- Protein- gekoppelte Rezeptoren sind auch diese Transmembranproteine in der Plasmamembran. Anstatt mit einem G- Protein verknüpft, arbeitet die cytoplasmatische Seite des Rezeptors entweder selbst als Enzym oder ist Teil eines als Enzym arbeitenden Komplexes. die meisten durch die Enzyme ausgeschütteten Signalproteine sind lokale Mediatoren. Die Zellantworten auf diese Signale erfolgen langsam, da sie die Genexpression zur Entfaltung ihrer Wirkung ändern, wobei es auch rasch wirkende Signale gibt, die die Zellbewegung und –gestalt ändern. Die grösste Klasse der enzymgekoppelten Rezeptoren bilden die Rezeptor- Tyrosin- Kinasen, die an ausgesuchten intrazellulären Proteinen Tyrosinseitenketten phosphoryliert. Rezeptor- Tyrosin- Kinasen sammeln einen Komplex aus Signalproteinen Dieser Rezeptortyp unterscheidet sich von den Siebenpfad- G- Protein- gekoppelten Rezeptoren, da sie sich nur einmal als α- Helix durch die Lipiddoppelschicht zieht. Der Rezeptor aktiviert seine Enzymaktivität seiner intrazellulären Domäne, wenn ein externes Signalprotein bindet. Dies geschieht, indem die Bindung zwei Rezeptormoleküle in der Membran zusammenkommen und ein Dimer bilden lässt. der Kontakt zwischen den zwei Rezeptorschwänzen aktiviert die Kinasefunktion, wodurch jeder Rezeptor den anderen an bestimmten Tyrosinen phosphoryliert. Die Phosphorilierung ist der Beginn für die Zusammenagerung eines Signalkomplexes an den Rezeptorschwänzen. Die Angelagerten Proteine werden dadurch aktiviert. So sendet der Komplex sein Signal über mehrere Routen gleichzeitig. Um den Komplex zu inaktivieren, enthält die Zelle Protein-Tyrosin-Phosphatasen. Manchmal werden die Komplexe aber auch per Endocyse zur Verdauung in den Lysosomen gebracht. Rezeptor-Tyrosin-Kinasen aktivieren das GTP-bindende Protein Ras Aktivierte Rezeptor-Tyrosin-Kinasen viele Arten intrazellulärer Signalproteine. Einige dieser funktionieren nur als physkalische Adaptoren: Sie helfen, ein grosses Signalaggregat zu bilden, indem sie den Rezeptor an andere Proteine koppeln, die ihrerseits an andere Proteine binden und aktivieren und dadurch die Nachricht weiterleiten können. Eine Schlüsselrolle hierbei spielt das kleine Protein Ras, das durch einen Lipidschwanz an die cytoplasmamtische Seite der plasmamembran gebunden ist und durch nahezu jede Rezeptor-Tyrosin-Kinase aktiviert wird. Ras ähnelt der α- Untereinheit eines G- Proteins und arbeitet genauso als molekularer Schalter. Ras ist aktiv bei gebundenem GTP und inaktiv bei GDP. Auch hat es eine Hydrolyse- Aktivität, um es zu inaktivieren. Aktives Ras setzt eine Phosphorylierungskaskade in Gang, bei der sich einige Proteinkinasen gegenseitig und nacheinander phosphorylieren und aktivieren. Dieser Vorgang wird MAP- KinaseKaskade genannt, da das letzte Glied in dieser Kette die MAP- Kinase ist, das Serine und Threonine auf bestimmten Genregulatorproteinen ändert, was Einfluss nimmt auf die Transkription. Einige enzymgekopptelte Rezeptoren aktivieren Pfad zum Zellkern Nicht alle enzymgekoppelten Rezeptoren gehen den Weg über Signalkaskaden, um die Genexpression zu steuern. Die Cytokine binden an die Cytokin- Rezeptoren. Diese haben keine eigene Enzymaktivität, sind aber an JAK- Tyrosin- Kinasen gebunden, welche aktiviert werden. Die aktivieren JAKs phosphorylieren und aktivieren STATs (Cytoplasmamtische Genregulatorproteine). Diese STATs bewegen sich zum Zellkern und stimulieren die Transkription spezifischer Zielgene. das Cytokin- Signal wird per Proteinphophatasen wieder abgeschaltet. Ein noch direkter.er Weg stellen die Rezeptor-Serin/Thereonin- Kinasen dar, die direkt SMADs (cytoplasmatische Genregulatorproteine) phophorylieren und aktivieren. Die Komplexität erhöht sich noch, da die erwähnten Haupt- Signalübertragungskaskaden untereinander in Wechselwirkung treten. Pflanzen benutzen hauptsächlich Enzymgekoppelte Rezeptoren, aber nur wenige G- Protein-gekoppelte Rezeptoren. Kapitel 17: Das Cytoskelett (S. 607- 642) Das Cytoskelett durchzieht das ganze Cytoplasma und ist beispielsweise verantwortlich für die Kontraktion von Muskelzellen sowie Formänderungen von Zellen. Auch steuert es die Lage der Organellen, die Verteilung der Chromosomen usw. man unterscheidet 3 Proteinfilamenttypen: Intermediärfilamente, Microtubuli und Actinfilamente. Intermediärfilamente Hauptaufgabe: Zellen gegenüber mechanischen Belastungen widerstandsfähig zu machen. Intermediärfilamente ist der robusteste und haltbarste Typ von Filamenten und kommen im Cytoplasma der meisten tierischen Zellen vor, wo sie ein Netzwerk bilden. Verankert ist dieses Netzwerk an Desmosomen, also an Zell-Zell-Verbindungen in der Plasmamembran. Intermediärfilamente sind auch im Zellkern anzutreffen, wo sie die Kernlamina unterhalb der Kernhülle bilden, welche verstärkend wirkt. Aufbau der Intermediärfilamente Die Untereinheiten bestehen aus langgestreckten, fibrillären Proteinen, welche eine NH2- Kopfdomäne und eine COOH- Schwanzdomäne hat. Die Kopfdomäne beinhaltet eine α- Helix, mit der zwei filamentproteine stabile Dimere bilden können. Zwei dimere lagern sich unter nicht-kovalenter Bindung zusammen und bilden Tetramere, die sich wiederum Ende an Ende/ Seite an Seite zusammenlagern. Intermediärfilamente erhöhen die Widerstandsfähigkeit Die oft im Cytoplasma vorkommende Filamentart findet sich u. A. in grosser Zahl entlang der Nervenzellaxome oder in Muskel-/ Epithelzellen. Wenn diese Zellen nun Scherkräften ausgesetzt sind, dehnen sich die Filamente und verteilen die Wirkung der punktuell ansetzenden Kraft. Die Intermediärfilamente können weiter in 4 Gruppen eingeteilt werden: - Keratinfilamente - Vimentin/ -verwandte Filamente - Neurofilamete - Kernlamine Keratine sind in der Epithelauskleidung des Darm, in den Epidermisschichten der Haut oder auch in Haren, Federn und Nägeln anzutreffen. Viele Intermediärfilamente sind zusätzlich durch Hilfsproteine, welche die Filamente untereinander quervernetzen, stabilisiert. Ein solches quervernetzendes Hilfsprotein ist Plectin. Eine weitere Funktion dieser Hilfsproteine ist es, Intermediärfilamente mit Mokrotubuli/ Actinfilamenten/ Desmosomen zu verknüpfen. Die Kernlamina Während die cytoplasmatischen Intermediärfilamente seilartige Strukturen bilden, sind die im Kern als zweidimensionales Geflecht angeordnet. Diese Intermdiärfilamente setzen sich aus einer anderen Klasse von Intermediärproteinen, den Laminen zusammen. Bei jeder Zellteilung zerfällt die Kernlamina und bildet sich danach neu, gesteuert über Proteinkinasen und Proteinphosphatasen. Mikrotubuli Mikrotubuli sind lange, relativ steife Proteinröhren, die an einer Seite rasch zerfallen und an einer anderen schnell wieder aufgebaut werden können. Bei tierischen Zellen entspringen Mikrotubuli den Centrosom, einem Gebilde nahe dem Zellzentrum. Von dort aus erstrecken sie sich nach aussen bis zur Zellpheripherie und bilden ein Schienensystem für den Transport von Vesikeln, Organellen und anderen Zellbestandteilen. Bei der Mitose zerfallen die cytoplasmatischen Mikrotubuli und lagern sich danach zu einer Struktur namens Mitosespindel zusammen. Mikrotubuli können auch dauerhafte Strukturen bilden, wie Cilien oder Flagellen. Für die Organisation des Cytoplasmas benötigen Mikrotubuli Hilfsproteine, besonders Motorproteine, die die Organellen auf den Mikrotubuli- Schienen entlangbewegen. Aufbau von Mikrotubuli Mikrotubuli sind aus den Tubulin- Molekülen aufgebaut, welche aus Dimeren aus den zwei strukturell sehr ähnlichen α-Tubulin und β-Tubulin bestehen. Die röhrenartige Struktur kommt zustande, indem 13 parallele Protofilamente einen Zylinder bilden. Jedes Protofilament besteht aus einer linearen Kette von den Tubulin-Untereinheiten, die sich abwechseln. Durch α-Tubulin an einem Ende und β-Tubulin am anderen, besitzt jedes Protofilament eine Polarität und dadurch auch das ganze Mikrotubuli. Durch diese chemische Polarität ist der Grund, warum sich Tubulindimere am Plus- Ende schneller anlagern können als am Minus- Ende, was für den gerichteten intrazellulären Transport wichtig ist. In tierischen Zellen ist das Centrosom das wichtigste Organisationszentrum der Mikrotubuli Centrosomen organisieren die Anordnung von Mikrotubuli, die von hier aus nach aussen ins Cytoplasma ausstrahlen. Centrosomen enthalten unter anderem γ-Tubulin, das als Ausgangspunkt für das Wachstum eines Mikrotubulus dient. Das Minus-Ende ist im γ-Tubulinring eingebettet während am Plus-Ende Wachstum stattfindet. Keimbildungsstellen wie γ-Tubulinringe sind wichtig, da Mikrotubuli sich kaum von alleine neu aufbauen können. Wachsende Mikrotubuli sind dynamisch instabil Bei der Neubildung eines Mikrotubuli wächst es normalerweise minutenlang, bis sich unerwartet Untereinheiten vom Ende wieder ablösen und der Mikrotubulus dadurch schrumpft. Es kann sein, dass er nur wenig schrumpft und dann weiterwächst oder ganz verschwindet. Der Grund für diese dynamische Instabilität ist, dass jedes freie Tubulindimer ein fest gebundenes GTP- Molekül trägt, das zu GDP hydrolysiert wird, kurz nachdem die Untereinheit an den wachsenden Mikrotubulus angefügt wurde. Bei einer raschen Polymerisierung erfolgt die Bindung der Tubulinmoleküle an das Mikrotubulusende schneller als die Hydrolyse des gebundenen GTP, wodurch eine „GTP-Kappe“ am freien Ende entsteht. Die Tubulinmoleküle, welche schon etwas länger gebunden sind und somit hinter der „GTP- Kappe“ sind, werden aber alle hydrolysiert. Wird nun aber das GTP hydrolysiert, bevor eine neue Untereinheit angesetzt wurde, beginnt der Abbau, der sich dann weiter fortsetzt, da der restliche Mikrotubulus aus GDP –Tubulin besteht. Die freigesetzten GDP- Tubulinmoleküle gelangen zum Vorrat unpolymerisierter Moleküle im Cytosol. Dort wird GDP gegen GTP ausgetauscht. Gleichgewicht zwischen Auf- und Abbau Die relative Instabilität erlaubt eine fortwährende, schnelle Umformung, was wichtig ist für die Ausübung ihrer Funktionen. Das Gift Colchizin bindet an freies Tubulin und verhindert dessen Bindung ans Mikrotubuli, wodurch sich beispielsweise wie Mitosespindel rasch zurückbildet. Die Mitosespindel wird also durch einen fortwährenden, ausgewogenen An- und Abbau aufrechterhalten. Die Inaktivierung oder Zerstörung der Mitosespindel tötet letztlich sich teilende Zellen. Deshalb können Krebszellen, welche sich viel öfter teilen als gesunde Zellen, durch solche Gifte abgetötet werden, ohne dass die anderen Zellen zu sehr geschädigt werden. Ein Mikrotubulus kann aber auch permanent bestehen, indem sein freies Ende an das Plus-Ende eines anderen Moleküls oder eine andere Zellstruktur bindet. Mikrotubuli organisieren das Zellinnere Beim Eintritt in die Mitose, verhalten sich die Mikrotubuli dynamischer, um die Mitosespindel auszubauen. Wenn sich andererseits eine Zelle spezialisiert hat und eine bestimmte fixierte Struktur angenommen hat, wird die dynamische Instabilität ihrer Mikrotubuli durch Proteine unterdrückt. Motorproteine treiben den intrazellulären Transport an Moleküle führen ständig kurze, sprunghafte Bewegungen aus- die saltatorische Bewegung. Diese ist im Gegensatz zur Brown’schen Bewegung gerichtet und anhaltend und sowohl die Mikrotubuli als auch die Actinfilamente sind an ihr beteiligt. Die Bewegungen werden durch Motorproteine erzeugt, welche an Actinfilamente oder Mikrotubuli binden und die Energie aus der ATP- Hydrolyse nutzen, um sich in einer Richtung auf den Filamenten fortzubewegen. Die Motorproteine haben aber auch Fracht gebunden, welche sie durch ihre eigene Bewegung mittransportieren. Es gibt zwei Arten von Motorproteinen: - Kinesine Wandern zum Plus-Ende, also vom Centrosom weg - Dyneine Wandern zum Minus-Ende, also zum Centrosom hin Kinesine und Dyneine haben jeweils 2 globuläre ATP-bindende Köpfe, welche mit den Mikrotubuli in Wechselwirkung tritt und einen Schwanz, der an die Fracht (Vesikel, Organell) bindet. Organellen wandern an Mikrotubuli entlang Sowohl der Golgi-Apparat als auch das ER werden durch Mikrotubuli ausgerichtet und platziert. Die Membranen des ER erstrecken sich nach aussen und richten sich dabei an den Mikrotubuli aus, die vom Centrosom bis zur Plasmamembran reichen. Während der Entfaltung des ER bewegen sich Kinesine, die mit der Aussenseite des ER verknüpft sind, entlang den Mikrotubuli und dehnen dabei das Er wie ein Netz aus. dyneine ziehen den Golgi-Apparat an den Mikrotubuli entlang in die entgegengesetzte Richtung zum Zentrum der Zelle. die korrekte Lage dieser Organellen wird durch rezeptorproteinen in ihren Membranen vermittelt. Cilien und Flagellen enthalten stabile Mikrotubuli Hauptaufgabe einer Cilie ist es, Flüssigkeit über die Oberfläche einer Zelle zu bewegen oder einzelne Zellen durch die Flüssigkeit zu bewegen. Flagellen, die Spermien und viele Protozoen vorwärts bewegen, ähneln stark den Cilien in ihrem inneren Aufbau, aber sind viel länger. Die sind dafür konzipiert, die ganze Zelle zu bewegen. Die Mikrotubuli in Flagellen und Cilien sind in neun Mikrotubulipaare, die ringförmig um zwei einzelne Mikrotubuli angeordnet sind, angeordnet. Nahezu alle Cilien und Flagellen besitzen dieses 9+2 Muster. Cilien haben das Motorprotein Ciliendynein, das mit seiner Schwanzdomäne mit einem Mikrotubuli verknüpft ist und mit seinen Kopfdomänen mit einem benachbarten Mikrotubulus in Wechselwirkung tritt. Durch die relative Bewegung dieser zwei Mikrotubuli werden sie gebogen, was in einer wellenartigen Bewegung resultiert und die Cilie/ das Flagellum vorwärts treibt. Actinfilamente Actinfilamente kommen in allen eukaryotischen Zellen vor und sind unentbehrlich für viele ihrer Bewegungen. Wie Mikrotubuli sind auch Actinfilamente instabil, können aber auch stabile Strukturen ausbilden, wie bei den Muskeln. Abhängig davon, mit welchen Proteinen die Actinfilamente verknüpft sind, können sie steife und ziemlich beständige Strukturen ausbilden oder kleine und kontraktile Bündel ähnlich den Muskeln. Actinfilamente sind dünn und beweglich Actinfilamente sind ca. 7nm durchmessende Fäden, welche je aus einer verdrillten Kette identischer, globulärer Actinmoleküle besteht. Wie die Mikrotubuli sind sie polar aufgebaut. Actin und Tubulin polymerisieren nach ähnlichen Mechansmen Actinfilamente wachsen, indem an beiden Enden Actinmonomere binden. Die Wachstumsrate ist am Plus-Ende grösser als am Minus-Ende. Ein nacktes Actinfilament, ohne assoziiertes Protein ist instabil und kann an beiden Enden zerfallen. Jedes freie Actinmonomer hat ein ATP gebunden. Dieses wird kurz nach dem Einbau ins Filament zu ADP hydrolisiert. Dies verringert die Bindungsstärke zwischen den Monomeren und damit die Stabilität des Polymers. damit fördert die Hydrolyse die Depolymerisierung. Die Funktion der Actinfilamente hängt von einem dynamischen Gleichgewicht zwischen den Actinfilamenten und dem Vorrat an Actinmonomeren ab, denn die Lebensdauer vieler Filamente beträgt nur wenige Minuten. Proteine binden an Actin und verändern seine Eigenschaften Ca. die Hälfte des in der Zelle vorhandenen Actin ist in Actinfilamente eingebaut, die andere Hälfte liegt als Actinmonomere frei im Cytosol vor. der Grund, wieso nicht alles Actin verbaut wird: Zellen enthalten kleine Proteine, z.B. Thymosin, Profilin, die an die freien Actinmonomere binden und sie hindern, sich an Filamente anzulagern. Dies dient dazu, ein Reservelager zu erhalten. Die meisten Actin- bindende Proteine binden aber an intakte Actinfilamente und steuern deren Verhalten. Einige quervernetzen, andere halten das Geflecht innerhalt des Zellcortex zusammen, wieder andere funktionieren als Motorproteine. Actinreiche Schicht unterhalb der Plasmamembran: Der Zellcortex In den meisten eukaryotischen Zellen findet sich direkt unterhalb der Plasmamembran eine Actinreiche Schicht, bei der die Actinfilamente mittels Actin- bindender Proteine zu einem Geflecht verknüpft ist: Der Zellcortex. Dieser stützt die äussere Zelloberfläche und verleiht ihr mechanische Festigkeit. Der Zellcortex bestimmt auch die Gestalt der Zelle. Die Kriechbewegung einer Zelle ist actinabhängig Viele Zellen bewegen sich durch Kriechbewegung über Oberflächen, anstatt mit Cilien und Flagellen zu schwimmen. Grob umrissen funktioniert die Kriechbewegung einer Zelle folgendermassen: 1) An der „Vorderseite“ oder ihrem Leitsaum stülpt die Zelle Fortsätze aus 2) Diese Fortsätze haften an der Oberfläche, über welche die Zelle kriecht 3) Der Rest der Zelle zieht sich durch Zugkräfte selbst hinterher Bei allen drei Vorgängen ist Actin beteiligt. Bei 1) wird das Vorwärtsschieben der Zelloberfläche durch die Polymerisation von Actin angetrieben. Bei 2) wird die Zugkraft durch die Wechselwirkung von Actinfilamenten mit Motorproteinen erzeugt, den Myosinen. Actin bindet an Myosin, um Kontraktionen auszuführen Alle actinabhängigen Motorproteine gehören zur Familie der Myosine. Sie binden und hydrolysieren ATP. Myosine der Unterfamilien I und II sind am weitesten verbreitet. Mysosin-I kommt in alle Zelltypen vor. Diese haben eine Kopfdomäne und einen Schwanz. Der Kopf tritt mit Actinfilamenten in Wechselwirkung und hydrolysiert ATP. Sie ist für die Wanderung des Myosin-I-Moleküls am Filament verantwortlich. Die unterschiedlichen Myosin-I-Arten haben unterschiedliche Schwanzregionen. der Schwanz bestimmt, welche Zellbestandsteile vom Motorprotein entlang gezogen werden. Extrazelluläre Signale steuern die Anordnung der Actinfilamente Die Aktivität der actinabhängigen Motorproteine kann durch extrazelluläre Signale geregelt werden, was dann Umordnungen zur Folge hat. Diese Umordnungen werden durch die Aktivierung vieler in der Plasmamembran eingebetteter Rezeptorproteine ausgelöst. Alle diese Signale treffen dann auf eine Gruppe monomerer GTP bindender Proteine, die als Rho- Proteinfamilie bezeichnet wird. Diese verhalten sich als molekulare Schalter, die zelluläre Vorgänge steuern, indem sie zwischen aktivem GTP Zustand und inaktivem GDP Zustand wechseln. Muskelkontraktion Bei den hoch spezialisierten Muskelzellen hängen viele Zellbewegungen von der Wechselwirkung zwischen Actin und Myosin ab. Muskelkontraktion beruht auf Actin- und Myosinbündeln Das Myosin des Muskels gehört zur Myosin-II- Unterklasse. Diese haben alle 2 Köpfe inkl. ATPaseAktivität und einen langen, stäbchenförmigen Schwanz. Myosin-II bildet mit Actinfilamenten kontraktile Strukturen, welche aber nicht nur in Muskelzellen vorkommen. Büschel von Myosin-II- Molekülen binden über ihre Schwanzstrukturen aneinander. Das Myosinfilament ist wie ein doppelköpfiger Pfeil, bei dem die beiden Kopfgruppen nach aussen zeigen. Sie binden Actinfilamente, die eine entgegengesetzte Ausrichtung aufweisen und bewegen sie in entgegengesetzte Richtungen: Die Actinfilamentgruppen gleiten in entgegengesetzter Ausrichtung aneinander vorbei. Actin- und Myosinfilamente gleiten aneinander vorbei Ein Grossteil des Cytoplasmas besteht aus Myofibrillen, den kontraktilen Elementen der Muskelzelle. Eine Myofibrille besteht aus einer Kette identischer, winziger kontraktilen Einheiten, de Sarkomeren. Sarkomere wiederum sind aus Actinfilamenten und Filamenten aus Myosin-II aufgebaut. Die dickeren Myosinfilamente befinden sich in der Mitte des Sarkomers, die dünneren Actinfilamente gehen von den Sarkomerenden nach innen und überlappen dort mit den Enden der Myosinfilamente. Die Muskelkontraktion geschieht durch die gleichzeitige Verkürzung aller Sarkomere. Diese wird dadurch bewirkt, dass innerhalb der Sarkomere die Actinfilamente, durch die Hydrolyse ihrer Myosinköpfe angetrieben, an den Myosinfilamenten vorbeigleiten. nach Beendigung der Kontraktion verlieren die Myosinköpfe vollständig den Kontakt mit den Actinfilamenten, was zur Entspannung führt. Kontraktion wird durch den Anstieg der Ca 2 + Konzentration ausgelöst Die Muskelkontraktion benötigt ein Signal. Dieses kommt vom Nervensystem und löst in der Plasmamembran der Muskelzelle eine elektrische Erregung aus, die sich durch die Transversaltubuli ausbreitet. Das Signal wird dann auf das Sarkoplasmatisch Reticulum übertragen, was eine angrenzende Sicht aus miteinander verbundenen Vesikeln ist, die jede Myofibrille wie ein Netzstrumpf umgibt. Das SR enthält eine sehr hohe Ca2+- Konzentration. Bei der Stimulierung wird per Ionenkanäle viel Ca2+ ins Cytosol freigesetzt. Dann bindet das Ca2+ an Troponin, was eine Gestaltänderung hervor ruft, was es den Myosinköpfen ermöglicht, an die Actinfilamente zu binden und die Kontraktion auszulösen. nach Beendigung des Signals steigt die Konzentration nicht mehr weiter und das vorhandene Ca2+ wird mittels Pumpen ins SR zurück befördert. Kapitel 19: Die Zellteilüng (S. 677- 696) Der Zellzyklus besteht aus der Interphase und der Teilung, M- Phase genannt. Die M-Phase besteht aus der Mitose und Cytokinese. Die Interphase aus G1, S, G2. Der ganze Zellzyklus wird vom ZellzyklusKontrollsystem koordiniert, dessen wichtigste regulierenden Proteine die Cdk’s sind (cyclinabhängigen Kinasen). Für die M-Phase ist M-Cdk (MPhase Cdk) am wichtigsten. Durch deren Aktivierung startet die M-Phase und mit seiner Inaktivierung endet auch die M-Phase. Überblick über die M-Phase Für die Zelle ist es von zentraler Bedeutung, dass jede Tochterzelle eine identische Kopie des Genoms erhält. Für die korrekte Trennung ist die Mitosespindel zuständig. Damit das klappt, müssen die Chromosomen korrekt ausgerichtet sein, was bereits in der S-Phase beginnt. Vorbereitung auf die M-Phase: DNA bindende Proteine formen die replizierten Chromosomen Nach der Chromosomenduplikation in der S-Phase bleiben die 2 Kopien als Schwesterchromatiden per Cohesinen verbunden. Beim Eintritt in die M-Phase kondensieren die Chromosomen, wobei die Condensine helfen. Die M-Cdk löst dabei den Aufbau der Condensinkomplexe durch Phophorylierung seiner Untereinheiten aus. Somit arbeiten Cohesin und Condensin bei der Kondensation zusammen. Das Cytoskelett spielt eine zentrale Rolle in der M -Phase Die Trennung der replizierten Chromosomen geschieht durch die Mitosespindel, die aus den Mikrotubuli sowie vieler assoziierter (Motor-) Proteine aufgebaut ist. Für die Cytokinese ist der kontraktile Ring verantwortlich. Mitosespindel und kontraktiler Ring sind Cytoskelettstrukturen. der kontraktile Ring beginnt sich gegen Ender der Mitose unter der Plasmamembran zusammenzulagern. Wenn sich der Ring dann zusammenschnürt, zieht er die Plasmamembran wie eine Irisblende zu. der Aufbau der Mitosespindel in tierischen Zellen geschieht durch die Centrosomen, die sich VOR Beginn der M-Phase verdoppeln. Die verdoppelten Centrosomen bilden die Pole der Mitosespinde Zwei Dinge müssen vor Beginn der M-Phase erledigt sein: 1. Vollständige DNA- Replikation 2. Verdopplung der Centrosomen Um die zwei Pole der Mitosespindel bilden zu können, müssen die Centrosomen sich vorher bereits mithilfe der Cdk’s verdoppelt haben. Ausserdem braucht es zwei, damit jede Tochterzelle eines erhält. Die Verdopplung geschieht in der Interphase. Nach der Verdopplung bleiben die zwei zusammen an einer Seite des Zellkerns. erst bei Mitosebeginn trennen sie sich und senden strahlenförmig Mikrotubuli aus, Aster genannt. Dann wandern sie zu den entgegengesetzten Seiten. Wenn die Kernhülle verfallen ist, fangen die Spindel die Chromosomen ein. Die M-Phase in sechs Schritten Mitose 1. 2. 3. 4. 5. Prophase Prometaphase Metaphase Anaphase Telophase Replizierte Chromosomen kondensieren und Mitosespindel bildet sich Auflösung der Kernhülle, Anheftung der Chromosomen an Mikrotubuli Chromosomen sammeln sich in Metaphaseplatte Schwesterchromatiden trennen sich und werden zu Polen gezogen Chromosomen dekondensieren, neue Kernhülle, Beginn Cytoplasmateilung Cytokinese 6. Cytokinese Der kontraktile Ring zieht sich zusammen und trennt die Zelle. Dieser Vorgang beginnt mit der Anaphase und beendet, sobald abgeschlossen, die Mitose. Die Mitose Instabilität der Mikrotubuli erleichtert Bildung der Mitosespindel Zu Mitosebeginn zerfallen die Mikrotubuli, welche die cytoplasmatische Anordnung bilden und beginnen mit dem Aufbau einer Mitosespindel. Diese Mitose-Mikrotubuli sind in grösserer Zahl vorhanden, kürzer und viel dynamischer als die wenigen, langen und spärlich aktiven InterphaseMikrotubuli. Diese Verhaltensänderung wird durch MAPs (Mikrotubuli-assoziierte Proteine) angetrieben. Prophase: Mitosespindel bildet sich Mit dem einsetzen trennen sich die zwei Centrosomen, bilden die Mikrotubuli aus und wandern zu den Zellpolen. Diese Bewegung wird teilweise durch Centrosomen-assoziierte Motorproteine angetrieben (Relativbewegung zu Mikrotubuli). Während der Prophase dann treten einige der Mikrotubuli der zwei gegenüberliegenden Spindelteilen in Kontakt als Schutz vor dem Abbau. Diese miteinander verknüpften Mikrotubuli heissen interpolare Mikrotubuli. Pflanzenzellen haben keine Centrosomen, bilden aber trotzdem bipolare Mitosespindeln aus, da dort die Chromosomen keimbildend für die Mikrotubuli sind. Mithilfe Motorproteine wird dann auch eine Spindel ausgebildet. Man unterscheidet drei Mikrotubuliarten: - Astralmikrotubuli Freiliegende Mikrotubuli, keine Funktion - Kinetochor- Mikrotubuli Sind an Kinetochor der Chromosomen gebunden - Interpolare Mikrotubuli Überlappen sich gegenseitig Prometaphase: Chromosomen heften sich an Mitosespindel Die Prometaphase beginnt mit der plötzlichen Auflösung der Kernhülle, die in Membranvesikel zerfällt. Die Spindelmikrotubuli können nun an die Chromosomenpaare binden. Dies geschieht dank den Kinetochoren (Proteinkomplexe), welche kurz vor Auflösung der Kernhülle am Centromer der Chromosomen gebildet werden- eins pro Schwesterchromatid. Die Mikrotubuli können dann an diese Kinetochore binden. Da jedes Chromosomenpaar zwei nach aussen gerichtete Kinetochore hat, binden Mikrotubuli der einen Spindelhälfte an ein Kinetochor, Mikrotubuli der anderen Hälfte an das andere. je nach Spezies bindet dabei ein oder mehrere Mikrotubuli an ein Kinetochor. Metaphase: Chromosomen bilden Metaphaseplatte sind die Chromosomen mit der Spindel verknüpft, werden sie durch diese am Äquator der Spindel angeordnet. Auf die Chromosomen in dieser Phase wirkt ein starker Zug. Anaphase: Tochterchromosomen trennen sich Die Anaphase beginnt mit der Auflösung der Cohesinbindung, wodurch diese zu den Polen wandern. Die Auflösung der Cohesinbindung geschieht durch den APC (anaphase promoting complex), der ein hemmendes Protein spaltet, wodurch das bisher gehemmte Enzym die Cohesinbindung trennt. Die Ehemaligen Schwesterchromatiden heissen nun Tochterchromosomen. Die Polwanderung der Chromosomen geschieht durch zwei unabhängige Vorgänge: - Anaphase A: Die Kintetochormikrotubuli werden durch Abbau verkürzt. Der Verlust der Tubulinuntereinheiten hängt mit dem Protein Catastrophin zusammen, das unter ATPVerbrauch Tubulin entfernt. - Anaphase B: Die Spindelpole selbst rücken auseinander, indem sich die interpolaren Mikrotubuli verlängern und sich dadurch von einander wegdrücken. Telophase: Kernhülle wird wiederhergestellt Um jede Chromosomengruppe wird wieder eine Kernhülle aufgebaut. Zunächst gruppieren sich Kernmembranvesikel um einzelne Chromosomen und verschmelzen dann zu einer Kernhülle. Dabei werden die Kernporen wieder in die Hülle eingebaut und die Kernlamine lagern sich wieder zur Kernlamina zusammen. Ist die Kernhülle erst gebildet, werden noch die restlichen Kernproteine durch die Poren hineinbefördert. Die Chromosomen dekondensieren und die Gentranskription kann wieder einsetzen. Organellen zerfallen während Mitose in Einzelstücke Organellen wie Mitochondrien, Chloroplasten, Golgi-Apparat oder ER können nicht neu erschaffen werden, nur von bestehenden Teilen aufgebaut werden. Die Organellen sind gewöhnlich in so grosser Zahl vorhanden, dass ihre Weitervererbung sichergestellt ist, wenn sie sich 1x pro Zellzyklus teilen. Nach Eintritt in die M-Phase zerfällt das ER mit der Kernmembran in Einzelstücke. Ebenso der GolgiApparat. Bruchstücke der Organellen binden per Motorproteine an die Spindel-Mikrotubuli und werden in die neuen Zellen gezogen. Die anderen Zellbestandteile inkl. Proteine werden nach Zufall vererbt. Die Cytokinese Mitosespindel bestimmt die Teilungsebene Die Cytokinese beginnt in der Anaphase, wenn sich die Plasmamembran beginnt zu runzeln und furchen. Die Furchung erfolgt immer senkrecht zur Längsachse der Mitosespindel. Verschiebt man die Position der Metaphaseplatte, bildet sich die Furchung zurück und beginnt dann wieder von vorne, senkrecht zur Längsachse. Der kontraktile Ring besteht aus Actin und Myosin Der kontraktile Ring besteht aus sich überlappenden Actin- und Myosinfilamenten. Er baut sich in der Anaphase auf und ist mit den membranassoziierten Proteinen auf der cytoplasmatischen Seite der Plasmamembran verknüpft. Die Kräfte werden durch die Relativbewegung von Actin- und Myosinfilamenten erzeugt. Sobald die Zelle geteilt ist, verschwindet der Ring wieder. In Pflanzenzellen wird eine neue Zellwand gebildet Die Tochterzellen in Pflanzen werden nicht durch einen kontraktilen Ring getrennt, sondern durch die Ausbildung einer neuen Zellwand innerhalb der Zelle. zu Beginn der Telophase beginnt sich eine neue Zellwand im Cytoplasma zwischen den beiden Chromosomensätzen zu bilden. Der Aufbauvorgang wird durch den Phragmoplasten gelenkt. Dieser entsteht aus den Überresten der interpolaren Mikrotubuli. Kleine membranumschlossene Vesikel vom Golgi-Apparat werden entlang der Mikrotubuli zum Äquator des Phragmoplasten transportiert. Hier verschmelzen die Vesikel und bilden eine scheibenförmige membranumhüllte Struktur. Diese Struktur breitet sich aus, bis sie die Plasmamembran und die Zellwand erreicht und die Zelle dann zweiteilt. Später werden noch Mikrofibrillen aus Cellulose in die Wand eingelagert. Kapitel 21: Gewebe (S.741- 773) Die meisten Zellen in vielzelligen Organismen sind in Gewebe genannten Zellverbänden organisiert. Gewebe bestehen nicht nur aus durch ihr inneres Cytoskelett gestützte Zellen, sondern auch aus einer extrazellulären Matrix. Extrazelluläre Matrix und Bindegewebe Tiere brauchen Gewebe, die zu rascher Bewegung fähig sind. Also müssen deren Zellen Kraft erzeugen und übertragen können. Pflanzen dagegen sind festsitzend und ihr Gewebe steif. Ihre Festigkeit kommt von den Zellwänden, was eine Art von extrazellulärer Matrix ist, welche die Zelle selbst bildet und in ihre Umgebung absondert. Pflanzenzellen Die Zellen an sich sind sehr fragil. Schon eine kleine Abweichung von den osmotischen Konzentrationen kann sie zum Platzen bringen: Ihrem Cytoskelett fehlen die spannungstragenden Intermediärfilamente. Deshalb braucht die Pflanzenzelle eine Zellwand, welche stabil, aber nicht unbedingt starr sein muss. Denn ein osmotisches Anschwellen der Zelle, begrenzt durch den Widerstand der Zellwand bildet ein halbstarres Gewebe. Die meisten neu gebildeten Pflanzenzellen bilden zunächst dünne Primärwände, die sich beim Wachstum noch anpassen können. der Antrieb hierbei ist ein osmotisches Ungleichgewicht. Nach beendetem Wachstum bildet sich die Sekundärwand- entweder durch Verdickung der Primärwand oder durch Anlagerung neuer, steiferer Schichten an die Primärwand. Cellulosefasern sorgen für Festigkeit Pflanzenzellwände erhalten ihre Zugfestigkeit durch lange, in Belastungsrichtung ausgerichtete Cellulosefasern. Diese sind mit anderen Polysacchariden und einigen Strukturproteinen verwoben. In holzigem Gewebe durchsetzt ein stark vernetztes Lignin- Gitter die Matrix, wodurch sie noch steifer wird. Da sich die Cellulosefasern keine Streckung zulassen, bestimmt ihre Ausrichtung die mögliche Wachstumsrichtung und somit auch die Gestalt. Cellulose wird aussen auf der Zelloberfläche mithilfe von Enzymkomplexen in der Plasmamembran hergestellt. Die Enzymkomplexe transportieren Zuckermonomere durch die Membran und bauen sie in eine Gruppe wachsender Polymerketten an deren Kontaktpunkte mit der Membran ein. Die Enzymkomplexe bewegen sich in der Membran und spinnen dabei neue Polymere. Dabei hinterlassen sie eine Spur von ausgerichteten Cellulosefasern. Die Enzymkomplexe bewegen sich entlang der unterhalb der Plasmamembran verlaufenden Mikrotubuli. Somit steuert das Cytoskelett indirekt die Form der Pflanzenzelle. Tierisches Bindegewebe besteht aus extrazellulärer Matrix Man unterscheidet 4 Hauptgewebetypen: - Bindegewebe - Epithelgewebe - Nervengewebe - Muskelgewebe Architektonisch unterscheidet sich Bindegewebe vom Rest. Bindegewebe hat viel extrazelluläre Matrix, die die mechanische Beanspruchung übernimmt. In den anderen Geweben ist die extrazelluläre Matrix spärlich vorhanden und die Zellen sind direkt miteinander verbunden und tragen selbst die mech. Belastung. Kollagen verleiht dem Bindegewebe Zugfestigkeit Kollagen kommt in allen vielzelligen Tieren vor und sind die Hauptbestandteile von Knochen, Sehnen und Haut. Drei helikal umeinandergewickelte Kollagenpolypeptidketten bilden eine Kollagenfibrille, die zu Kollagenfasern zusammengelagert sind. Hergestellt wird Kollagen von Fibroblasten/ Osteoblasten intrazellulär und dann per Exocytose in die extrazelluläre Matrix befördert, wo es sich zu grossen Aggregaten zusammenlagert. Abgebaut wird die Matrix durch Matrixproteasen. Zellen ordnen Kollagen organisiert an Die Bindegewebszellen steuern die Ausrichtung der Kollagenfibrillen teils durch Ablagerung des Kollagens in einer gerichteten Art und Weise und durch anschliessende Neuordnung. Die Fibroblasten bearbeiten ihr ausgeschiedene Kollagen, indem sie sich entlang der nebeneinander liegenden Kollagenfasern bewegen und an ihnen ziehen. Integrine koppeln die Matrix ans Cytoskelett Damit die Fibroblasten überhaupt über die Matrix hinüberkriechen können. Fibronectin schafft eine Verknüpfung: Ein Teil des Fibronectin bindet an Kollagen, ein anderer Teil trägt die Bindungsstelle für die Zelle. Die Zelle heftet sich an die spezifische Bindungsstelle am Fibronectin mittels dem Integrinrezeptorproteins, das die Plasmamembran durchzieht. Der extrazelluläre Bereich des Integrins bindet an Fibronectin, der intrazelluläre an Actinfilamente. Polysaccharid- Protein- Gele Proteoglykane sind eine völlig andere Gruppe in der extrazellulären Matrix und helfen, Druckkräften zu widerstehen und dient als Füllmaterial. Die Proteiglykan- Proteine sind mit Glykosaminoglykanen (GAGs) verbunden. Da diese stark negativ geladen sind, suaen sie grosse Wassermengen in die Matrix. Bei der Knorpelmasse ist kollagenreich und hat viel GAGs. Proteiglykane dienen nicht nur als Wasserbindene Raumfüller um Zellen, sondern können auch Gele bilden, die als Filter für den Durchgang von Molekülen dienen. Epithelgewebe und Zell-Zell- Verbindungen Seite 754, Teil 21.2: Epithelgewebe und Zell- Zell- Verbindungen sowie Teil 21.3: Erhaltung und Erneuerung von Geweben fehlt in dieser Zusammenfassung.