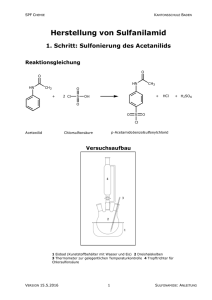
Bei Phaeobacter inhibens DSM 17395 handelt es sich um ein
Werbung

Carl von Ossietzky Universität Oldenburg Bachelorstudiengang: Biologie Praktikumsprotokoll: Titel : Untersuchung des Wachstums von Phaeobacter inhibens DSM 17395 als Batch-Kultur im Erlenmeyerkolben und im Bioreaktor. Vorgelegt von: XXX Betreuer: Dipl.-Ing. Reiner Hulsch M. Sc. Daniel Wünsch Oldenburg, den 05.04.2015 1 Inhaltsverzeichnis Abbildungs- und Tabellenverzeichnis 4 Abkürzungen/Nomenklatur 6 1. Zusammenfassung 7 2. Einleitung 7 3. Material und Methoden 8 3.1 Geräteliste 8 3.2 Vorbereitungen der Versuche 9 3.3 Anzucht von P. inhibens DSM 17395 12 3.4 Durchführung der Experimente 13 3.4.1 Probennahme Erlenmeyerkolben 13 3.4.2 Probennahme Bioreaktor 13 3.4.3 Biotrockenmassebestimmung 14 3.4.4 Ausstreichen auf MB-Medium 14 3.4.5 Mikroskopische Untersuchung 15 3.4.6 HPLC 15 3.4.7 Elementaranalyse 15 3.4.8 DOC 15 4. Ergebnisse 16 4.1 Wachstumskurven 16 4.2 Substratverbrauch 20 4.3 Abgase 22 4.4 Kulturbetrachtung 23 4.5 Sterilkontrollen 24 5. Diskussion 24 5.1 Wachstum 24 5.2 Substratverbrauch 24 5.3 Abgase 25 5.4 Fazit 26 2 6. Referenzen 26 7. Anlagen 27 7.1 Aufbau und Bestandteile des Bioreaktors 27 7.2 Berechnung der Einwaage für Seewassermedium 28 7.3 Einwaageberechnung MB-Medium 29 7.4 Berechnung von NaOH und HCl 30 7.5 OD-Messungen der Vorkulturen 30 7.6 Daten der Experimente 31 7.6.1 Daten des Bioreaktors 31 7.6.2 Daten des Erlenmeyerkolben 41 7.7 Bilder des MB-Ausstrichs 43 7.8 Bilder der Agar-Slides 44 7.9 Berechnung von µmax und tD 46 3 Abbildungs- und Tabellenverzeichnis Abbildung 1 Anzucht des Bakteriums, Volumen zum Animpfen abhängig von der vorherigen OD 12 Abbildung 2 Ausstrichmuster "13-Strichprinzip" der Zellsuspension zu Sterilkontrolle 14 Abbildung 3 Wachstum im Bioreaktor (3) über 62,9 Stunden anhand von OD-Messung bei 600 nm 16 Abbildung 4 Wachstum im Erlenmeyerkolben über 62,9 Stunden anhand von OD-Messungen bei 600 nm 17 Abbildung 5 Vergleich des Wachstums im Erlenmeyerkolben und Bioreaktor anhand der OD bei 600 nm über eine Zeit von 62,9 Stunden 18 Abbildung 6 Biotrockenmasse aus dem Bioreaktor 3 aufgetragen gegen die Zeit als Konzentration in g/l 19 Abbildung 7 Korrelation der OD bei 600 nm zur BTM in g/l 19 Abbildung 8 Fumaratkonzentration in mM aus der HPLC im Bioreaktor 3 über die Kulturzeit von 62,9 Stunden 20 Abbildung 9 Zulauf von HCl im Vergleich zur Fumaratkonzentration 20 Abbildung 10 Wachstum im Bioreaktor durch OD bei 600 nm im Vergleich zur Konzentration der BTM und des Substrates 21 Abbildung 11 Aufnahme von O2 und Produktion von CO2 im Vergleich 22 Abbildung 12 Vergleich der Abgasparameter im Bioreaktor 3 23 Abbildung 13 Agar-Slide 1: Bioreaktor 3 nach 20 h 1000x –Vergrößerung, unverdünnt 23 Abbildung 14 Agar-Slide 2: Bioreaktor 3 nach 46 h 400x- Vergrößerung, unverdünnt 23 Abbildung 15 Aufbau und Beschriftung eines Laborrührkessel-Fermenter, hier: als Bioreaktor verwendet, Seitenansicht [6] 27 Abbildung 16 Aufbau und Beschriftung eines Bioreaktors Aufsicht 28 Abbildung 2 MB-Ausstrich Nahaufnahme (HK2 I) 43 Abbildung 3 MB-Ausstrich: oben: Bioreaktor 3, unten von links nach rechts: HK I, HK II, HK III 43 Abbildung 4 Agarslide 1: Bioreaktor 3 nach 20 h 1000x unverdünnt 44 Abbildung 5 Agarslide 2: Bioreaktor 3 nach 46 h 400x- Vergrößerung unverdünnt 44 4 Abbildung 6 Agarslide 3: Erlenmeyerkultur (HK exemplarisch) nach 31 h 1000x Vergrößert, unverdünnt 45 Abbildung 7 Agarslide 4: Erlenmeyerkultur (exemplarisch) nach 46 h 400x Vergrößerung, unverdünnt 45 Abbildung 8 Berechnung von µmax und tD im Bioreaktor 46 Abbildung 9 Berechnung von µmax und tD im Erlenmeyerkolben 46 Tabelle 1 Liste der verwendeten Geräte für die Versuche 8 Tabelle 2 Einwaage für 1 l Seewassermedium 10 Tabelle 3 Einwaage für 1 l MB-Medium 11 Tabelle 4 Berechnung der Einwaage des Seewassermediums 28 Tabelle 5 Einwaageberechnung des MB-Mediums 29 Tabelle 6 OD-Messungen der Vorkulturen 30 Tabelle 7 Daten des Reaktors 1: Volumen, pO2, pH 31 Tabelle 8 Daten des Reaktors 2: Photometrische Daten 32 Tabelle 9 Daten des Reaktors 3: Abgas und Zuluft 33 Tabelle 10 Daten des Reaktors 4: Pumpenvolumen und Rührerdrehzahl 34 Tabelle 11 Daten des Reaktors 5: QCO2, QO2, RQ, CO2, O2 35 Tabelle 12 Daten des Reaktors 6: Biotrockenmasse 36 Tabelle 13 Analyse-Werte des Reaktors1: DOC 37 Tabelle 14 Analyse-Werte des Reaktors 2: HPLC, Fumarat 39 Tabelle 15 Analyse-Werte des Reaktors 3: Elementaranalyse 40 Tabelle 16 Daten des Erlenmeyerkolben 1: OD-Messung 41 Tabelle 17 Daten des Erlenmeyerkolben 2: BTM 42 Tabelle 18 Daten des Erlenmeyerkolben 3: pH 42 5 Abkürzungen/ Nomenklatur N2, molekularer Stickstoff %, Prozent N-Stock, Stickstoff-Stock-Lösung °C, Grad Celsius O2, molekularer Sauerstoff BR, Bioreaktor OD, optische Dichte BTM, Biotrockenmasse pO2 , partieller O2-Anteil c, Konzentration P-Stock, Phosphor-Stock-Lösung CO2, Kohlenstoffdioxid R², Bestimmtheitsmaß C-Quelle, Kohlenstoffquelle rpm, rounds-per-minute, DOC, Dissolved organic carbon DSM, Deutsche Sammlung von Umdrehungen die Minute RQ, Respirationsquotient Mikroorgansimen SWM, Seewasser-Medium Fum, Fumarat TDA, Tropodithietic Acid g, Gramm VD, Verdünnungsreihe h, Stunden VK1, Vorkultur 1 HK, Hauptkultur VK2 Vorkultur 2 HPLC, High performance liquid chromatography l/ml/µl, Liter/Milliliter/Mikroliter M/mM, molar 𝑚𝑜𝑙 𝑙 / millimolar 𝑚𝑚𝑜𝑙 𝑙 MB, Marine Broth MW, Mittelwert 6 1. Zusammenfassung Bei Phaeobacter inhibens DSM 17395 handelt es sich um ein Bakterium der Ordnung der Roseobacter. In diesem Praktikum sollte sein Wachstum im Erlenmeyerkolben und im Bioreaktor mit Fumarat als C-Quelle und Seewasser-Medium untersucht werden. Dies geschieht im Rahmen der Untersuchung des Wachstums von P. inhibens DSM 17395 im Chemostaten mit verschiedenen C-Quellen. Die folgenden Wachstumsversuche werden als Referenzkultur dafür herangezogen. Das Wachstum im Bioreaktor ist schneller als im Erlenmeyerkolben aufgrund der Regelung des Milieus. Das Wachstum ist in beiden Fällen größtenteils linear. Die maximal gemessene OD, die abgesehen von den letzten Stunden der Messung mit dem Wachstum korreliert, beträgt 2,14 bei einer BTM von 0,5 g/l. Trotz Absinken der O2Aufnahme und der CO2-Produktion gegen Ende der Messung steigt die OD, was auf Bildung von Aggregaten zurückzuführen ist. Aufgrund der Entfernung des Fumarats, welches dissoziiert als Fumarsäure vorliegt, kommt es zur Alkalisierung des Milieus. Fumarat wurde im gleichen Maße verbraucht wie die Kultur wächst. Das Pigment TDA wird gebildet. Durchschnittlich Die maximale werden pro Wachstumsrate Substrat bis zu beträgt 0,24 0,2015 Zellen Zellen/Stunde. gebildet. Als Bilanzgleichung wird mit Fumarsäure 1,3275 C4H4O4 + 0,215 NH3 + 2,5 O2 + 3,485 H+ C4,31O2,34H7,5N0,215 +CO2 + 5,97 H2O angenommen. 2. Einleitung Das Praktikum ist thematisch in den Sonderforschungsbereich „Transregio 51; Roseobacter“ speziell im Themenschwerpunkt: „Die systembiologische Untersuchung des Wachstums von Phaeobacter inhibens DSM 17395 im Chemostaten unter Limitation von verschiedenen C-Quellen“ eingebunden. In diesem Rahmen wurden im Praktikum vergleichende Untersuchungen zum Wachstum von Phaeobacter inhibens DSM 17395 in Erlenmeyer- und Bioreaktorkulturen durchgeführt. Als C- und Energiequelle diente hierbei Na2-Fumarat. Bei P. inhibens DSM 17395 handelt es sich um ein Meeresbakterium der Ordnung Roseobacter. Roseobacter gehören zu den Prokaryoten und sind einer der häufigsten Vertreter im marinen System (bis zu 25%). 7 Sie sind physiologisch sehr vielseitig und spielen wichtige Rollen in globalen Stoffwechselprozessen im Meer beispielsweise durch Remineralisierung.[1,2] Eine weitere Besonderheit ist die Bildung von antibakteriellen Produkten, weshalb sie als Kandidat für weitere Antibiotika angesehen werden. [3] Es ist zu untersuchen, weshalb diese Gruppe ein so hohes Durchsetzungsvermögen hat. Weiterhin wird versucht die evolutionären, genetischen und physiologischen Hintergründe zu verstehen. Die Doktorarbeit von Daniel Wünsch beschäftigt sich mit der Untersuchung auf systembiologischer Ebene von P. inhibens DSM 17395. Hierfür sollen Bakterienkulturen dieses Stammes in einem Chemostaten mit verschiedenen C-Quellen kultiviert werden. In diesem Praktikum wird das Wachstum ohne Limitation als Referenzkultur betrachtet. 3. Material und Methoden 3.1 Geräteliste Tabelle 3 Liste der verwendeten Geräte für die Versuche Geräteart Hersteller Gerät Clean-Bench Heraeus HERAsafe Clean-Bench Heraeus HERAsafe KS 12 Benutzungshinweisen OD–Messung: bei 600nm Absorption des Pigments: Photometer SHIMADZU Uvmini-1246 Bioreaktoren Infors AG Infors HT Temperatursonde Infors AG PT100 pO2-Sonde Mettler Toledo InPro 6000 bei 398 nm Easyferm Plus pH-Elektrode Hamilton K8 8 Carl-von-OssietzkyUniversität Anti-Foam-Sonde Oldenburg Bioreaktoren-AnalyseSoftware Infors AG IRIS Massenspektrometer IPI GAM200 MassenspektrometerSoftware IPI Schüttler GFL 3020 100 rpm Autoklav Tecnomara FVS3 121°C, 20 min Autoklav tuttnauer 2540 ELV 121°C, 20 min Rotor: 20.1, 15.000 rpm, 20 Zenrifuge Beckman Avanti J-25 min, 4°C Verwendete Säule: Eurokat HPLC Dionex Durchgeführt DOC von Charlotte H, Hersteller: Knauer Versteegen, ICBM, AG Geo- AG Geo- Mikrobiologie, Carl-von-Ossietzky-Universität-Oldenburg Durchgeführt Elementaranalyse Ultimate 3000 von Charlotte Versteegen, ICBM, Mikrobiologie, Carl-von-Ossietzky-Universität-Oldenburg 3.2 Vorbereitung der Versuche Die Erlenmeyerkolbenversuche wurden von 3 Betreuergruppen in je 3 Kolben durchgeführt, wodurch es für den Versuch 9 biologische Kopien gibt. Der Bioreaktorversuch wurde in 4 Bioreaktoren (4 biologische Kopien) durchgeführt. (Abbildung und Auflistung der Bestandteile in Anlage 1). Die Auswertung bezieht sich auf die Kolben G2 und den Bioreaktor 3. Die Versuche wurden wie folgt durchgeführt: 9 Ansetzen des Mediums: künstliches, definiertes Seewassermedium (SWM) nach Hajo Zech: 1,8 l Medium für den Bioreaktor und 1,5 l Medium für die Vorkultivierung und die Erlenmeyerkulturen. Einwaage für 1l in Tabelle 2. [4] (Einwaageberechnung Anlage 2) Tabelle 4 Einwaage für 1 l Seewassermedium Stoff Einwaage für 1l H2Omp 900 ml NaSO4 4g KH2PO4 0,2g NH4Cl 0,25g NaCl 20g MgCl2x6H2O 3g KCl 0,5g CaCl2x2H2O 0,15g NaHCO3 0,19g H2Omp 100ml Trace-Stock 1ml Fumarat (20 mM) 19,4 ml Fumarat, N-Stock, P-Stock und Spurenelementlösung werden aufgrund ihrer Hitzeempfindlichkeit erst nach dem Autoklavieren hinzugegeben. NaHCO3 separat in 100 ml entionisiertem Wasser lösen, autoklavieren und später steril dem SWM hinzugegeben. Waschen und Autoklavieren aller benötigten Materialien (pro Gruppe): - 4x 100 ml Schikane-Erlenmeyerkolben mit Wattestopfen - 4x 250 ml Schikane-Erlenmeyerkolben mit Wattestopfen - 5x 1000 ml Schikane-Erlenmeyerkolben mit Wattestopfen - 1x 1l Schottflasche - 1x 100 ml Messzylinder - 1x 250 ml Messzylinder - 2x Plastiktrichter 10 - 2x 2l Schottflaschen mit Medium; für Erlenmeyerkolben-Versuch mit 1,8 l Medium; für den Bioreaktor-Versuch: 1,4 l Medium (+100ml Reaktorvolumen) - 2x 100 ml Schottflaschen mit NaHCO3 - Glas-Pipetten mit den Volumen 1 ml, 5 ml, 10 ml und 20 ml wurden steril gestellt. Lagerung der Medien bis zur Benutzung bei 4°C. Ansetzen von 400 ml MB-Medium zum späteren Ausstreichen für Sterilkontrolle: Tabelle 2: Einwaage für 1 l MB-Medium (Berechnung: Anlage 3) Tabelle 3 Einwaage für 1 l MB-Medium Stoff Einwaage für 1 l Pepton 5g Hefeextrakt 1g Eisen-III-Citrat 0,1 g Magnesiumchlorid x 6H2O 12,6 g Natriumsulfat 3,24 g Natriumchlorid 19,45 g Calciumchlorid x 2 H2O 2,38 g Kaliumchlorid 0,55 g Natriumhydrogencarbonat 0,16 g Di-Natriumhydrogen-phosphat x2H2O 0,01 g Agar-agar 15 g Spurenelementlösung 10 ml Externe Kalibrierung der pH-Elektrode mit Stocklösungen von pH 4 und pH 7. Autoklavierung des Bioreaktors mit 100 ml Reaktorvolumen entionisiertem Wasser. Ansetzen von 0,75 M NaOH- und HCl-Lösungen zur pH-Regulierung (Berechnung: Anlage 4). Separate Autoklavierung. Kalibrierung und Einstellung der restlichen Sonden: - Antischaum: Position: knapp unter dem Deckel. - PH-Wert: über das Steuerungssystem auf 7,2 eingestellt 11 - PO2-Kalibrierung: längere Begasung des Reaktors mit N2 als Nullpunkt im System, längere Begasung mit Luft als 100% pO2 gesetzt. -Drehzahl des Rotors: 600 rpm eingestellt, maximalen Regelung: 300 rpm, ab pO2 35% Beginn der Regelung -Kalibrierung des Abgassystems/ Massenspektrometers mit Testgasen. Benötigte, im Molbruch bekannte Bestandteile: für O2 und CO2 , Ar als Vergleichsgas -Temperatur auf 28 °C eingestellt. Vorpumpen der Schläuche für die Regelung des pHs und des Antischaums. Beim Anschließen des Antischaums gelangten 20 ml des Mittels in das Medium. 3.3 Anzucht von P. inhibens DSM 17395 Um den optimalen Punkt für das Wachstum Hauptkulturen in und den dem Bioreaktor zu erreichen, wird die Verdünnungsreihe zu 3 verschiedenen Zeitpunkten angesetzt mit 3 h Differenz. Die Anzucht erfolgt nach dem Schema in Abbildung 1. (Zwischenzeitliche OD Messungen: Anlage 5) Animpfen des ersten 100 ml Erlenmeyerkolben der Verdünnungsreihe VD mit 1,5 ml Glycerolstock Cleanbench Abbildung 10 Anzucht des Bakteriums, Volumen zum Animpfen abhängig von der vorherigen OD unter der entsprechend einer 1:10 Verdünnung (VD 10-1) in 13,5 ml Medium. Nach gutem Durchmischen: von der VD 10-1 1,5 ml entnehmen und in den zweiten Erlenmeyerkolben geben: VD 10-2. Mit diesem Muster wird weiter verfahren, bis eine 12 10-4 –Verdünnung (VD 10-4) erreicht ist. Hierbei wird das störende Glycerol stark verdünnt. Die Kulturen in den Schüttler bei 28 °C stellen. Steriles Animpfen Vorkultur (VK1) mit den ODs: 0,03 für VD0h, 0,02 für VD3h und 0,01 für VD6h in 50 ml Medium. Nach 29 h: Animpfen von VK2 steril auf eine Start-OD von 0,01 höher als Start-OD der VK1 in 250 ml Medium. Nach 26,5 h: Animpfen des Bioreaktors (1,5l Medium), der HKs (250 ml Medium) und mit VK2 (G2-Kolben2) auf eine OD von 0,02. Animpfen von Sterilkontrolle 1: 250 ml Erlenmeyerkolben mit 50 ml Medium ohne CQuelle, Sterilkontrolle 2: 250 ml Erlenmeyerkolben mit 50 ml Medium mit C-Quelle, ohne Inoculum. 3.4 Durchführung der Experimente Die Beobachtung der Kulturen erfolgte über 62,9 h. Das Zeitintervall der Probennahme war anfangs 2 Stunden und nach 25 h alle 3 Stunden. Alle Daten der Proben befinden sich in Anlage 6. Über das Computersystem für den Bioreaktor werden die Abgas-, Zuluft-, Pumpen- und pH-Werte aufgezeichnet. 3.4.1 Probennahme Erlenmeyerkolben: - Sterile Entnahme von 1 ml Probe - OD-Messung, falls notwendig mit einer 1:10 Verdünnung 3.4.2 Probennahme Bioreaktor: Bei vorheriger OD von unter 0,3: Entnahme von 10 ml Probe steril unter einem Bunsenbrenner über Unterdruck auf das Probennahmerohr. Verwurf der ersten Probe, da sie im Entnahmerohr war und nicht repräsentativ für den Reaktor ist. Entnahme von 11 ml Probe. 1ml zur OD-Bestimmung, 10 ml zentrifugieren. Aus dem Überstand 3x 1,8 ml in Eppendorf-Caps überführen und bei -80°C für Folgeanalysen einfrieren. Mit 1 ml Überstand Absorption des Pigments TDA messen. 13 Bei vorheriger OD von über 0,3: 10 ml Probe, die verworfen wird. Entnahme von 31 ml Probe, 1ml zur OD-Bestimmung, 3x 10 ml zentrifugieren. Mit dem Überstand wie vorher verfahren. Mit den Pellets die BTM bestimmen. 3.4.3 Biotrockenmassenbestimmung Letze Probe der Erlenmeyerkolben, beim Bioreaktor jede Probe ab OD=0,3: 10 ml Probe zentrifugieren, Überstand verwerfen. Pellet mit 5 ml Ammonium-Acetat (50 mM) waschen, resuspendieren Eppendorf-Caps nach und erneut zentrifugiert. Pellet in vorher gewogene Waschen mit 100 µl Ammonium-Acetat Zentrifugenröhrchen und die verwendete Eppendorfpipettenspitze mit füllen. 100 µl Ammonium-Acetat spülen und Flüssigkeit in das Cap gegeben. Caps zum Trocknen in den Trockenschrank legen. Das Ammonium-Acetat verdampft und die reine Biotrockenmasse bleibt zurück. 3.4.4 Ausstreichen auf MB-Medium Letzte Probe des Erlenmeyerkolbens und des Bioreaktors. Steriles Ausstreichen nach dem 13-Strich-Prinzip auf MB-Medium nach Muster in Abbildung 2 .150 µl Suspension den auf Nährboden tropfen und mit 13 Strichen, wobei nach jedem dritten Strich ausgeflammt Abbildung 2 Ausstrichmuster "13-Strichprinzip" der Zellsuspension zu Sterilkontrolle 14 wird, die Suspen-sion auf der Platte verteilen. Dadurch werden die Zellen vereinzelt und bilden Kolonien, die auch weiter untersucht werden können. P. inhibens DSM 17395 sollte braune Kolonien bilden, ansonsten handelt es sich um eine Kontamination. (Bilder in Anlage 7) 3.4.5 Mikroskopische Untersuchung An ausgewählten Punkten des Versuches Bioreaktorversuchs: Ein Tropfen der Kultur auf einen Agar-Slide geben, mit einem Deckgläschen bedecken, mit 1000-facher Vergrößerung bei Phasenkontrast 3 und mit dem 400-facher Vergrößerung bei Phasenkontrast 2 beobachten. Durch den Agar-Slide, wird die Feuchtigkeit aufgesogen und die Zellen können sich nicht mehr bewegen und befinden sich in einer Ebene. Anlage 8 : Aufnahmen der Kulturen. 3.4.6 HPLC Überstandsprobe 50-fach mit Wasser verdünnen, filtern und in Analysator geben. Dort werden die Bestandteile, gelöst in einem Trägermaterial, hier Schwefelsäure, in einem Säulenofen über ein modifiziertes organisches Polymer gedrückt. Aufgrund ihrer Ladung werden die Moleküle verscheiden stark zurück gehalten und kommen versetzt an einem Detektor an, der die Quantität der verschiedenen Teilchen bestimmt. Hier von Interesse: Anteil an Fumarat. 3.4.7 Elementaranalyse Eine bestimmte Menge an BTM wird in einen Zinnbecher gewogen und bei 1150° C in ein Quarz-Oxidation-Rohr gegeben. Durch Oxidation des Zinks wird die Temperatur auf 1800° C gebracht. Aus der BTM entstehenden aus den einzelnen Elementen Gase. Das Gas gelangt in nachgeschaltete Trennsäulen, in denen jeweils nur ein Gas zurück gehalten wird. Die Säulen werden nach einander geöffnet, sodass das Gas ausströmen kann. Ein Detektor ermittelt den Prozentanteil des jeweiligen Gases und somit des Elements. 15 3.4.8 DOC Die Überstandsprobe wird verdünnt, sodass der zu messende Kohlenstoff ungefähr im Bereich von 5 bis 15 mg/l liegt. Die Probe wird durch Ansäuern von anorganischem und partikulärem Kohlenstoff bereinigt. 400µl der Probe werden in Gegenwart eines Katalysators in einen Ofen bei 850 °C gestellt und mit O2 oxidiert. Die entstandenen Kohlenstoffverbindungen werden von einem Infrarot-Detektor aufgezeichnet. 4. Ergebnisse Für beide Kulturen konnten Wachstumskurven anhand der OD erfasst werden. Die Korrelation zwischen der OD und der Biotrockenmasse konnte bestimmt werden. Weiterhin wurden der Substratverbrauch sowie die Zu- und Abluftwerte analysiert. Die zur Analyse verwendeten Werte befinden sich in Anlage 6. 4.1 Wachstumskurven Man erkennt typische eine Wachs- tumskurve für eine Bakterienkultur einem in geschlos- senen System. Die lag-Phase dauert ~6 Stunden und geht dann über in eine kurze Abbildung 3 Wachstum im Bioreaktor (3) über 62,9 Stunden anhand von OD-Messung bei 600 nm exponentielle Phase, gefolgt von einer linearen Phase von 36h. Die OD-Steigung verlangsamt sich ab 45h. Die Absterbephase wurde in der OD nicht beobachtet. Die maximaleTeilungsrate µmax beträgt 0,24 Zellen/Stunde und die Verdopplungszeit in der Phase tD beträgt 2,9 Stunden. Die maximale Teilungsrate tritt am Anfang der exponentiellen Phase bei ungefähr 6 Stunden auf. Die maximale gemessene OD liegt bei 2,14. 16 Das Wachstum im Erlenmeyerkolben ergibt ebenfalls typische kurve eine Wachstumsim geschlos- senem System. Die lagPhase der Erlenmeyerkultur beträgt ungefähr Abbildung 4 Wachstum im Erlenmeyerkolben über 62,9 Stunden anhand von ODMessungen bei 600 nm 6,2 Stunden, gefolgt von einer kurzen exponentiellen Phase. Der restliche Verlauf erfolgt linear. Die maximale Teilungsrate µmax beträgt 0,213 Zellen/ Stunde. Die Verdopplungszeit tD in der Phase beträgt 3,25 Stunden. Die maximale Verdopplungsrate findet sich hier am Anfang der exponentiellen Phase bei ~6 Stunden. Der pH-Wert der Erlenmeyerkultur steigt von 7,5 auf 8,8 an: Nach 4 h Kulturzeit: pH = 7,5 Nach 25 h Kulturzeit: pH = 8,0 Nach 34 h Kulturzeit: pH = 8,5 Nach 62 h Kulturzeit: pH = 8,8 17 Abbildung 5 Vergleich des Wachstums im Erlenmeyerkolben und Bioreaktor anhand der OD bei 600 nm über eine Zeit von 62,9 Stunden Im Vergleich der Systeme erkennt man, dass die OD des Bioreaktors über der des Erlenmeyerkolbens liegt. Beide Systeme verlaufen linear. µmax ist im Bioreaktor größer als im Erlenmeyerkolben. Allerdings sinkt die Steigung der OD gegen Ende des Versuches, während die Erlenmeyerkultur auch nach Versuchsende noch weiter linear wächst. (Berechnungen von tD und µmax befinden sich in Anlage 9) 18 Abbildung 6 Biotrockenmasse aus dem Bioreaktor 3 aufgetragen gegen die Zeit als Konzentration in g/l Die Biomasse wurde erst ab der 10. Probe gemessen. Sie verhält sich wie die Wachstumskurve der OD. Ihr Maximum beträgt: 0,5 g/l. Der Zusammenhang zwischen der OD und der BTM ist linear und zeigt sich in seiner Korrelation, in Abbildung 5 Der lineare Zusammen- hang zwischen den Größen hat ein Bestimmt- heitsmaß 0,9575. von Setzt man in die sich ergebene Gleichung die StartOD ein, ergibt Abbildung 7 Korrelation der OD bei 600 nm zur BTM in g/l sich eine theo- retische Anfangs-BTM von 0,013 g/l. Die Absorption bei 398 nm steigt durchgehend über den Versuch hinweg auf bis zu 1. Das Pigment TDA wurde durchgehend gebildet. 19 4.2 Substratverbrauch Die Substratkonzentra- tion im BR sinkt nach einem Plateau von ~10 Stunden exponentiell und strebt gegen Null. Die Anfangskonzentration liegt bei 20,812 mM. Nach 50 Stunden ist die Konzentration nahezu Null. Die Abbildung 8 Fumaratkonzentration in mM aus der HPLC im Bioreaktor 3 über die Kulturzeit von 62,9 Stunden graphische Analyse zeigt einen linearen Abbau. Abbildung 9 Zulauf von HCl im Vergleich zur Fumaratkonzentration Das zur Regelung benötigte Volumen von HCl ist gegenläufig zu dem Verbrauch an Fumarat. 20 Abbildung 10 Wachstum im Bioreaktor durch OD bei 600 nm im Vergleich zur Konzentration der BTM und des Substrates Die OD steigt in gleichem Maße, wie die Biotrockenmasse. Der Substratverbrauch ist gegenläufig zu den beiden anderen Funktionen. Im gleichen Maße, wie OD und BTM steigen, sinkt das Substrat. Es besteht ein antiproportionaler Zusammenhang. Der sich ergebene Yield von Zellen zu Substrat YX/S beträgt 0,2015 Zellen pro Substrat, bei einer theoretischen Anfangskonzentration der BTM von 0,013 g/l und Endkonzentration von 0,5 g/l und dem Verbrauch an Fumarat von 2,41 g/l. Anhand der DOC erkennt, man dass gegen Ende der Kultur noch organisches Material im Medium gelöst ist, das nicht Fumarat ist. Am Ende sind noch 2,71 mol/l organisches Material gelöst, während kein Fumarat mehr festgestellt werden kann. Es ergibt sich aus der Elementaranalyse folgende Bilanzgleichung: 1,3275 C4H4O4 + 0,215 NH3 + 2,5 O2 + 3,485 H+ C4,31O2,34H7,5N0,215 +CO2 + 5,97 H2O 21 4.3 Abgase Abbildung 11 Aufnahme von O2 und Produktion von CO2 im Vergleich Sowohl die O2-Verbrauchsrate als auch die CO2-Produktionsrate sind anfangs nahezu konstant bzw. sinken ein wenig aufgrund von Messungenauigkeiten. Ab ungefähr 10 Stunden steigen beide Raten. Es ergibt sich ein Scheitelpunkt bei 31h. Insgesamt ist die CO2-Abgabe bis zu 2x höher als die Aufnahme von O2. 22 Abbildung 12 Vergleich der Abgasparameter im Bioreaktor 3 Der SCO2 und SO2 als das Integral vom QCO2 und QO2 verlaufen in der Form einer Wachstumskurve. Man erkennt, dass der RQ anfangs über 2 liegt und kurzzeitig sinkt. Bis zum Ende der Kultur steigt der RQ bis auf 4 und fällt dann wieder. 4.4 Kulturbetrachtung Abbildung 13 Agar-Slide 1: Bioreaktor 3 nach 20 h 1000x Vergrößerung unverdünnt Abbildung 14 Agar-Slide 2: Bioreaktor 3 nach 46 h 400xVergrößerung unverdünnt Man erkennt anhand der Agar-Slides, dass die Bakterien zu Beginn eher vereinzelt vorkommen. Im Laufe der Kulturzeit bilden sich mehr Aggregate, Bakterienkolonien, die sich Rosettenförmig zusammenlagern. 23 4.5 Sterilkontrollen In beiden 250 ml Erlenmeyerkolben als Sterilkontrolle ist nichts gewachsen. Ebenso waren auch den MB-Medien nur die braunen Kulturen von Phaeobacter inhibens DSM 17395 zu sehen. Es wurde steril gearbeitet. 5. Diskussion 5.1 Wachstum Anhand der OD-Kurven, sowie an µmax und tD erkennt man, dass die Bakterien im geregelten Medium besser wachsen als im ungeregelten. Dies kann vor allem mit dem pH-Wert zusammenhängen, welcher bis auf im Erlenmeyerkolben steigt, während er im Bioreaktor auf ungefähr 7,2 gehalten wird. Die Alkalisierung des Milieus rührt von der Entfernung des Fumarat her, welche dissoziiert als Fumarsäure vorliegt. Bei dessen Verbrauch, wird die Säure entfernt und das Medium wird basisch. Dies erkennt man daran, dass im geregelten System der Verbrauch von HCl zum Senken des pH gegenläufig zur Konzentration von Fumarat ist. Ob das Wachstum nur verlangsamt wird oder auch ODmax beeinflusst wird, geht aus den Daten nicht hervor, da die Erlenmeyerkultur nicht bis ODmax betrachtet wurden. Das Wachstum wurde in beiden Fällen limitiert, da es sich nur um lineares Wachstum handelt. Zur Analyse um welchen Faktor es sich handelt müssen weitere Untersuchungen angesetzt werden. Zur Analyse wurde die OD verwendet unter der Annahme, dass sie mit der BTM korreliert. Diese Annahme wurde bestätigt, da die Korrelation zwischen der BTM und der OD einen linearen Zusammenhang ergibt. Dieser hat einen R2 von 0,9579, weshalb ein starker Zusammenhang angenommen wird. 5.2 Substratverbrauch Man erkennt, dass der Substratverbrauch im direkten Zusammenhang mit dem Wachstum steht. In gleichem Maße wie die Kultur, gemessen an der OD, steigt, sinkt auch die Fumaratkonzentration. Das Fumarat wird also zum Wachstum verwertet. Anhand des Yields kann man erkennen, dass pro Substrat 0,2015 Zellen gebildet wurden. Für die Umsetzung des Substrates in Zellmasse ergibt sich die Bilanzgleichung 1,3275 C4H4O4 + 0,215 NH3 + 2,5 O2 + 3,485 H+ C4,31O2,34H7,5N0,215 24 +CO2 + 5,97 H2O. Allerdings ist am Ende der Messung kein nachweißbares Fumarat mehr vorhanden, während die OD dennoch weiter ansteigt, allerdings mit einer geringeren Steigung. Eine Erklärung hierfür ist, dass gegen Ende der Beobachtung sich Aggregate bilden, wie auf den mikroskopischen Aufnahmen beobachtet, welche eine andere optische Dichte haben als nicht kolonial verbundene Bakterien . Von daher kann man sagen, dass gegen Ende der Beobachtung die optische Dichte nicht mehr das Wachstum anzeigt, sondern die morphologische Veränderung. Weiterhin wurde festgestellt, dass sich gegen Ende noch anderes organisches Material als Fumarat im Medium befindet. Bei diesem kann es sich um das produzierte Pigment TDA handeln, welches auch nach dem Sinken des O 2-Gehaltes noch weiter steigt. 5.3 Abgase O2 wurde immer dann verbraucht, wenn CO2 gebildet wurde. Beim Ansteigen der OD steigen auch die beiden Größen und stehen damit im direkten Zusammenhang mit dem Wachstum, wobei die CO2-Produktionsrate höher steigt als die O2Verbrauchsrate. Das Verhältnis der beiden Größen zeigt sich im RQ, welcher der Quotient aus produzierten CO2 zu verbrauchten O2 darstellt und ein Indikator für den Stoffwechsel ist. Der RQ beträgt hier 2 bis 4, was auf einen sehr effizienten Stoffwechsel schließen lassen würde. Eine Erklärung hierfür ist, dass ein Fehler bei der Messung oder Berechnung passiert ist. Der größte RQ ist in der Mitte des Wachstums, was bedeutet, dass hier am meisten verstoffwechselt wurde. Daran, dass beide Größen beginnen zu sinken, während die OD noch steigt, was ein Indikator für Lyse ist, lässt sich die Theorie der Aggregatbildung bestätigen. Es werden weniger neue Zellen produziert als absterben, wodurch die Stoffwechselgrößen sinken. Allerdings steigt die OD auf Grund von morphologischen Veränderungen. SCO2 und SO2 steigen in ihrem Verlauf wie die Wachstumskurve und können somit bei weiteren Versuchen als Kriterium für das Wachstum verwendet werden. 25 5.4 Fazit P.inhibens DSM 17395 wächst unter kontrollierten Bedingungen besser als unter unkontrollierten. Bei diesem wird das Wachstum verlangsamt, vermutlich aufgrund des Abbaus von Fumarat, welches als Fumarsäure vorliegt und durch Stoffwechsel entfernt wird. Es ergibt sich in beiden Fällen eine typische Wachstumskurve im geschlossenen System. Die C-Quelle wird mit einer antiproportionalen Korrelation zum Wachstum abgebaut. Es ergibt sich ein YieldX/S von 0,2015 Zellen pro Substrat im Reaktor. Die OD korreliert größtenteils mit dem Wachstum der Bakterien gemessen an der BTM. Gegen Ende handelt es sich allerdings um eine OD-Änderung aufgrund von morphologischen Änderungen, da sowohl das Fumarat aufgebraucht, als auch weniger CO2 produziert sowie O2 aufgenommen wird. Es bilden sich mikroskopisch Aggregate. Es ergibt sich für das Wachstum folgende Bilanzgleichung: 1,3275 C4H4O4 + 0,215 NH3 + 2,5 O2 + 3,485 H+ C4,31O2,34H7,5N0,215 +CO2 + 5,97 H2O 6. Referenzen 1) http://www.roseobacter.de/ 16.03.15 21:34 Uhr 2) http://www.icbm.de/wissenschaftliche-projekte/sfb-roseobacter/ 16.03.15 21:45 Uhr 3) http://www.google.de/imgres?imgurl=http%3A%2F%2Fwww.galathea3.dk%2Fdk %2FMenu%2FForskning%2FRoseobacterbakterier%252B%2525E2%252580%252593%252Bhavets%252Bstjerner%2FM ateriale%2FSEM%252Bstar.jpg&imgrefurl=http%3A%2F%2Fwww.galathea3.dk %2Fdk%2FMenu%2FForskning%2FRoseobacterbakterier%2B%25E2%2580%2593%2Bhavets%2Bstjerner%2FProject%2BSpecif ication&h=236&w=273&tbnid=dEKCjTC6t89wuM%3A&zoom=1&docid=jvOTB5h dt_IzWM&ei=NwkEVd6OBIPYOKmjgYAL&tbm=isch&iact=rc&uact=3&dur=3269& page=1&start=0&ndsp=31&ved=0CDwQrQMwCQ 16.03.15 22:00 Uhr 4) Fuchs, G. & Schlegel, H.G. (1969) „Allgemeine Mikrobiologie“ 8. Auflage, S. 290 f., 208 f., 366 f. Thieme-Verlag, Stuttgart 26 5) Zech, H. - Thole, S. - Schreiber, K. – Kalhöfer, D. – Voget, S. – Brinkhoff, T. – Simon, M. – Schomburg, D. & Rabus, R. (2009) „Growth phase-dependent global protein and metabolite profiles of Phaeobacter gallaeciensis strain DSM 17395, a member oft he marine Roseobacter-clade“ – ICBM Oldenburg - Max Plank Institut for Marine Microbiology, Bremen – Institue for Biochemistry and Biotechnology, Braunschweig – Genomics Labotatory , Göttingen 6) Hulsch, R. – Rabus, Ralf (2015) „Labor-Rührkesse-Fermenter“ - ICBM Oldenburg 7. Anlagen 7.1 Aufbau und Bestandteile des Bioreaktors Abbildung 15 Aufbau und Beschriftung eines Laborrührkessel-Fermenter, hier: als Bioreaktor verwendet, Seitenansicht [6] 27 Abbildung 16 Aufbau und Beschriftung eines Bioreaktors Aufsicht 7.2 Berechnung der Einwaage für Seewassermedium Tabelle 4 Berechnung der Einwaage des Seewassermediums Stoff Einwaage für 1 l 1,8 l 1,5 l H2Omp 900 ml 1658 ml 1265 ml Bemerkung 1,5 l: 100ml als Reaktor- vorlage eingerechnet NaSO4 4g 7,2 g 6g KH2PO4 0,2 g 0,11 ml 0,09 ml Separat angesetzt ins Volumen eingerechnet NH4Cl 0,25 g 3,6 ml 3 ml Separat angesetzt ins Volumen eingerechnet NaCl 20 g 36 g 30 g MgCl2x6H2O 3g 5,4 g 4,5 g KCl 0,5 g 0,9 g 0,75 g CaCl2x2H2O 0,15 g 0,27 g 0,23 g 28 NaHCO3 0,19 g 0,342 g 0,285 g H2Omp 100 ml 100 ml 100 ml Trace-Stock 1 ml 1,8 ml 1,5 ml Separat angesetzt ins Volumen eingerechnet Fumarat (20 mM) 19,4 ml 35 ml 30 ml Separat Volumen angesetzt ins eingerechnet. Endkonzentration: 20 mM/l Berechnung erfolgte über 3-Satz. [5] 7.3 Einwaageberechnung MB-Medium Tabelle 5 Einwaageberechnung des MB-Medium Stoff Einwaage für 1 l Einwaage für 400 ml Pepton 5g 2g Hefeextrakt 1g 0,49 g Eisen-III-Citrat 0,1 g 0,049 g Magnesiumchlorid x 6H2O 12,6 g 5,04 g Natriumsulfat 3,24 g 1,296 g Natriumchlorid 19,45 g 7,78 g Calciumchlorid x 2 H2O 2,38 g 0,952 g Kaliumchlorid 0,55 g 0,22 g Natriumhydrogencarbonat 0,16 g 0,064 g di-Natriumhydrogen- 0,01 g 0,0046 g Agar-agar 15 g 6g Spurenelementlösung 10 ml 4 ml phosphat x2H2O Die Berechnung erfolgte über 3-Satz. 29 7.4 Berechnung von NaOH und HCl 1 l NaOH: 𝑔 Gegeben: M = 40 𝑚𝑜𝑙 ; Dichte= 1,36 𝑔 𝑐𝑚3 ; Prozentanteil: 32% Gesucht: c(NaOH) = 0,75 M 1360 40 𝑔 𝑙 𝑔 𝑚𝑜𝑙 34 = 34 𝑚𝑜𝑙 𝑙 𝑉𝑖𝑠𝑡 = 𝑚𝑜𝑙 𝑙 ∗ 0,32 = 10,88 10,88 𝑚𝑜𝑙 𝑙 0,75 𝑀 𝑚𝑜𝑙 𝑙 = 0,068 l 1 l HCl : Berechnung nach dem Schema von NaOH: 𝑔 𝑔 Gegeben: M = 36,46 𝑚𝑜𝑙; Dichte: 1,18 𝑐𝑚³ ; Prozentanteil: 37 % 𝑉𝑖𝑠𝑡 = 0,063 𝑙 7.5 OD-Messungen der Vorkulturen Die Prozesszeit gilt ab dem Zeitpunkt des Ansetzens der jeweiligen Kultur. Tabelle 6 OD-Messungen der Vorkulturen Kultur Prozesszeit OD bei 600 pH nm VD 10-3 69,5 h 1,974 VD 10-4 69,5 h 2,13 VK1 I 0h 0,0125 VK1 II 0h 0,0125 VK1 I 29 h 0,646 8,5 VK1 II 29 h 0,721 8,5 VK2 I 0h 0,0192 7 VK2 II 0h 0,0278 7 VK1 I 44 h 1,98 9 VK1 II 44 h 1,833 9 30 VK2 I 15 h 0,266 7,5 VK2 II 15 h 0,276 7,5 VK2 I 23 h 0,869 8,5 VK2 II 23 h 0,879 8,5 VK 2 I 26 h 1,163 8,5 VK2 II 26 h 1,247 8,5 7.6 Daten der Experimente 7.6.1 Daten des Bioreaktors Tabelle 7 Daten des Reaktors 1: Volumen, pO2, pH Proben- Zeitpunkt Proben- Reaktor- pO2 in % nummer in h volumen in volumen ml in ml pH intern pH extern 8,20 8,30 0 0,00 22,5 1477,5 1 0,63 22 1480,5 95,00 7,23 2 2,01 19 1486,5 93,90 7,15 3 4,00 18 1493,5 92,00 7,20 4 6,00 21 1497,5 88,00 7,28 5 8,18 20 1502,5 83,30 7,29 6 10,00 21 1506,5 78,50 7,24 7 12,00 20 1511,5 76,90 7,17 8 14,00 22 1514,5 75,00 7,23 9 16,00 23 1516,5 73,70 7,34 10 18,02 44 1497,5 74,80 7,32 11 20,13 42 1480,5 76,50 7,32 12 22,08 51 1454,5 79,00 7,31 13 25,16 40 1439,5 79,50 7,39 14 28,16 44 1420,5 80,10 7,25 6,50 31 15 30,98 43 1402,5 81,70 7,39 16 34,00 42 1385,5 81,90 7,29 17 36,84 43 1367,5 82,20 7,40 18 40,16 44 1348,5 82,80 7,40 19 43,00 43 1330,5 83,10 7,37 20 46,00 44 1311,5 84,30 7,42 21 62,20 45 1291,5 88,80 7,24 Tabelle 8 Daten des Bioreaktors 2: Photometrische Daten Probennummer OD bei 600 nm OD1 Pigment OD2 Verdünnung Mittelwert OD Absorption 398 nm 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 0,05 0,0508 0,0323 0,06 0,0555 0,0406 0,06 0,0569 0,0072 0,06 0,0630 0,0076 0,11 0,1062 0,0018 0,12 0,1243 0,0171 0,16 0,1604 0,0901 0,21 0,2123 0,9860 0,28 0,2750 0,2303 0,36 0,3619 0,3123 0,23 0,2339 0,3512 0,58 0,5807 0,4518 0,08 0,06 01:10 0,7060 0,5839 0,10 0,10 01:10 1,0005 0,6852 0,11 0,13 01:10 1,2370 0,7660 0,13 0,13 01:10 1,2830 0,8330 0,14 0,14 01:10 1,3845 0,9082 0,16 0,16 01:10 1,5930 0,9226 32 19 20 21 0,19 0,19 01:10 1,8630 0,9456 0,19 0,19 01:10 1,9370 1,0017 0,22 0,21 01:10 2,1370 0,9342 Tabelle 9 Daten des Bioreaktor 3: Abgas und Zuluft Probennummer Abgas Begasung CO2 in % O2 in % Ar in % Zuluft CO2 in % Zuluft O2 in % Zuluft Ar in % 0,1821 21,2500 0,9291 0,0476 21,2492 0,9295 0,1674 21,2541 0,9287 0,0490 21,2189 0,9291 0,1669 21,2456 0,9282 0,0479 21,2589 0,9308 0,1574 21,2223 0,9281 0,0483 21,2481 0,9295 0,1699 21,1707 0,9274 0,0485 21,2237 0,9265 0,1699 21,1707 0,9274 0,0499 21,2391 0,9267 0,2916 21,0182 0,9270 0,0529 21,2292 0,9270 0,3826 20,9675 0,9258 0,0540 21,2300 0,9243 0,4472 20,9358 0,9247 0,0483 21,2624 0,9272 0,5278 20,8992 0,9239 0,0473 21,2653 0,9267 0,5743 20,9008 0,9237 0,0465 21,2546 0,9260 0,6143 20,9668 0,9228 0,0464 21,2505 0,9260 0,6825 20,9079 0,9212 0,0448 21,2606 0,9241 0,7022 20,9018 0,9223 0,0500 21,2403 0,9239 0,7081 20,9120 0,9223 0,0517 21,2364 0,9242 0,6683 20,9442 0,9225 0,0503 21,2454 0,9239 0,6390 20,9671 0,9221 0,0479 21,2402 0,9233 0,5836 21,0111 0,9205 0,0478 21,2624 0,9230 0,5594 21,0204 0,9208 0,0459 21,2734 0,9232 0,4959 21,0597 0,9205 0,0447 21,2656 0,9242 0,1760 21,2196 0,9220 0,0446 21,2773 0,9218 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 33 Tabelle 10 Daten Bioreaktors 4: Pumpenvolumen und Rührerdrehzahl Probennummer Pumpen Antischaum in ml HCL in ml NaOH in ml Rührerdrehzahl in rpm 14,9 2,2 0,0 303,0 14,9 2,9 0,0 308,0 14,9 3,4 0,0 318,0 14,9 3,8 0,0 337,0 14,9 4,2 0,0 361,0 14,9 4,4 0,0 382,0 14,9 5,5 0,0 391,0 14,9 6,5 0,0 403,0 14,9 8,2 0,0 409,0 14,9 10,6 0,0 403,0 14,9 13,4 0,0 395,0 14,9 16,6 0,0 382,0 14,9 21,9 0,0 379,0 14,9 25,2 0,0 376,0 14,9 32,4 0,0 369,0 14,9 36,9 0,0 366,0 14,9 43,0 0,0 365,0 14,9 48,0 0,0 362,0 14,9 51,4 0,0 361,0 14,9 55,9 0,0 355,0 14,9 63,6 0,0 335,0 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 34 Tabelle 11 Daten Bioreaktors 5: QCO2, QO2, RQ, CO2, O2 QCO2 in mmol/l*h QO2 in mmol/l*h RQ SCO2 in SO2 in mmol/l mmol/l 0 0 0 0 0,2740 -0,013413016 0,0863 -0,0042251 0,2550 -0,06700804 -3,80571795 0,4509 -0,05964727 0,2569 -0,069331173 -3,70585766 0,9607 -0,19542068 0,2462 -0,008313921 1,4638 -0,27306577 0,2701 0,11461764 2,3569327 2,0273 -0,15703526 0,2742 0,135635677 2,02159247 2,5219 0,07031988 0,4776 0,346932492 1,37650765 3,2736 0,55288805 0,6380 0,494568038 1,29001813 4,3892 1,39438858 0,7557 0,460476955 1,64122459 5,7829 2,34943357 0,9226 0,532598668 1,73219935 7,4747 3,3504538 1,0386 0,544759429 1,90648013 9,5476 4,48922131 1,1579 0,395803407 2,92542016 11,6924 5,40768092 1,3322 0,562093459 2,37006499 15,5235 6,88140524 1,4278 0,616015879 2,31776505 19,6634 8,64856925 1,4982 0,597535101 2,50727862 23,7890 10,3596761 1,4734 0,594669785 2,47763726 28,2761 12,1599055 1,4719 0,566125094 2,59990723 32,4583 13,8082342 1,4063 0,4670415 3,01107056 37,2361 15,5232908 1,4139 0,502200603 2,81550445 41,2408 16,8996146 1,3175 0,325262369 4,05046583 45,3380 18,140809 0,4960 0,174989116 2,83446526 60,0270 22,1928461 35 Tabelle 12 Daten des Bioreaktors 6: Biotrockenmasse Proben- Leerwert der Gesamt- nummer Eppen-dorfcaps gewicht in g in g Konzen- Mittelwert Stadartab- tration in Konzentration weichung g/l in g/l in % 0,077 31,8841 0,123 25,2252 0,123 35,7430 0,213 8,3333 0,253 9,6491 0,293 1,5152 0,260 17,9487 0,217 82,0513 0,357 6,8536 10a 1,0257 1,0267 0,100 10b 1,0229 1,0233 0,040 10c 1,0184 1,0193 0,090 11a 1,0375 1,0386 0,110 11b 1,0217 1,0234 0,170 11c 1,0309 1,0318 0,090 12a 1,0163 1,0170 0,070 12b 1,0123 1,0134 0,110 12c 1,0242 1,0259 0,189 13a 1,0233 1,0252 0,190 13b 1,0261 1,0285 0,240 13c 1,0233 1,0254 0,210 14a 1,0126 1,0155 0,290 14b 1,0123 1,0148 0,250 14c 1,0383 1,0405 0,220 15a 1,0231 1,0261 0,300 15b 1,0421 1,0450 0,290 15c 1,0228 1,0257 0,290 16a 1,0190 1,0214 0,240 16b 1,0444 1,0477 0,330 16c 1,0241 1,0262 0,210 17a 1,0381 1,0376 -0,050 17b 1,0378 1,0413 0,350 17c 1,0042 1,0077 0,350 18a 1,0045 1,0077 0,320 18b 1,0237 1,0274 0,370 18c 1,0310 1,0348 0,380 36 19a 1,0426 1,0469 0,430 19b 1,0250 1,0285 0,350 19c 1,0424 1,0467 0,430 20a 1,0229 1,0277 0,480 20b 1,0378 1,0415 0,370 20c 1,0371 1,0416 0,450 21a 1,0387 1,0437 0,500 21b 1,0194 1,0247 0,530 21c 1,0151 1,0198 0,470 0,403 8,8154 0,433 9,7436 0,500 4,0000 Tabelle 13 Analysewerte des Reaktors 1: DOC Analyse Parameter Resultat AW Integral TC 120,56 42087,42707 Konzentration TC 0 SD Best. 1 Best. 2 Best. 3 110,38 121,77 129,53 0 0 0 0 0 0 0 0 in mg/l Konzentration 0 TOC in mg/l 5 ppm Integral TC 2546,52 2534,79 2547,24 2557,54 42087,44289 Konzentration TC 5,27415 0,02527 5,24812 5,27574 5,29859 0,02527 5,24812 5,27574 5,29859 3606,39 3654,09 3608,81 0,05961 7,62554 7,73137 7,63091 0,05961 7,62554 7,73137 7,63091 in mg/l Konzentration 5,27415 TOC in mg/l 7,5 ppm Integral TC 3623,1 42087,45764 Konzentration TC 7,66261 in mg/l Konzentration 7,66261 TOC in mg/l 37 15 ppm Integral TC 7106,73 7057,14 7150,64 42087,47361 Konzentration TC 15,39129 0,10429 15,28128 15,48872 7112,4 15,40388 in mg/l Konzentration 15,39129 0,10429 15,28128 15,48872 15,40388 4161,56 4157,01 4161,5 4166,18 Konzentration TC 8,85724 0,01017 8,84713 8,8571 8,86748 0,01017 8,84713 8,8571 8,86748 4389,95 4410,47 4424,79 0,03885 9,36393 9,40945 9,44122 9,40487 0,03885 9,36393 9,40945 9,44122 3217,79 3224,11 3214,45 3214,81 Konzentration TC 6,76341 0,01215 6,77743 6,756 6,7568 6,76341 0,01215 6,77743 6,756 6,7568 6264,08 6243,84 6260,44 6287,95 TOC in mg/l Clim-1-3-a-1 Integral TC zu 100 42087,52675 in mg/l Konzentration 8,85724 TOC in mg/l Clim-1-3-1-a- Integral TC 4408,4 1 zu 100 42087,59074 Konzentration TC 9,40487 in mg/l Konzentration TOC in mg/l Clim-1-1-3- Integral TC 12-a-1 zu 100 42087,67848 in mg/l Konzentration TOC in mg/l Clim-1-3-15- Integral TC a-1 zu 50 42087,73954 Konzentration TC 13,52181 0,04943 13,47692 13,51374 13,57478 in mg/l Konzentration 13,52181 0,04943 13,47692 13,51374 13,57478 TOC in mg/l 38 Clim-1-3-18- Integral TC 94,29 97,84 90,66 94,38 0 0 0 0 0 0 0 0 773,99 753,45 744,39 0,03365 1,34166 1,29609 1,27599 0,03365 1,34166 1,29609 1,27599 a-1 zu 50 42087,7981 Konzentration TC 0 in mg/l Konzentration 0 TOC in mg/l Clim-F3-21-1 Integral TC 757,28 zu 50 42087,88498 Konzentration TC 1,30458 in mg/l Konzentration 1,30458 TOC in mg/l Tabelle 14 Analysewerte des Reaktors 2: HPLC, Fumarat t (h) Probe RT 1 Fum RT 2 Fum Mw (min) (mM) (min) (mM) (mM) 0 3-0_1 6,950 20,812 6,950 20,813 20,812 0,63 3-1_1 6,950 20,333 6,947 20,271 20,302 2,08 3-2_1 7,023 19,463 7,023 19,462 19,463 4,00 3-3_1 7,023 20,012 7,023 20,037 20,025 6,00 3-4_1 6,943 20,237 6,940 20,230 20,233 8,18 3-5_1 7,020 19,006 7,020 19,005 19,005 10,00 3-6_1 7,020 19,802 7,020 19,807 19,805 12,00 3-7_1 7,020 17,775 7,017 17,777 17,776 14,00 3-8_1 7,017 16,801 7,017 16,790 16,795 16,00 3-9_1 7,017 15,281 7,017 15,279 15,280 18,02 3-10_1 7,017 14,557 7,017 14,555 14,556 20,13 3-11_1 7,013 12,883 7,013 12,885 12,884 22,08 3-12_1 7,013 12,277 7,013 12,280 12,278 25,17 3-13_1 7,013 9,719 7,013 9,717 9,718 28,17 3-14_1 7,013 7,507 7,013 7,510 7,509 Fum 39 31,20 3-15_1 7,013 5,478 7,010 5,479 5,478 33,92 3-16_1 7,010 4,244 7,010 4,244 4,244 36,92 3-17_1 7,010 2,596 7,010 2,597 2,596 40,08 3-18_1 7,010 1,350 7,010 1,351 1,351 43,00 3-19_1 7,007 0,475 7,007 0,474 0,475 62,90 3-21_1 n.a. n.a. n.a. n.a. n.a. Tabelle 15 Analysewerte des Bioreaktors: Elementaranalyse Name WeightVol Method Percent1 Reaktor3 1,559999 5mg90s 4,359694 7/3 943 Reaktor3 2,009999 7/3 99 Reaktor3 2,160000 7/3 086 Reaktor3_ 3,650000 12/3 095 Reaktor3_ 3,400000 12/3 095 Reaktor3_ 3,069999 12/3 933 958 5mg90s 4,496635 914 5mg90s 4,327248 573 5mg90s 2,978094 816 5mg90s 2,998370 647 5mg90s 2,870797 634 Percent2 Percent3 Percent4 50,88605 7,866481 0,622788 881 304 787 49,20870 7,638182 0,557015 972 163 836 49,23361 7,620579 0,513113 206 72 26 52,57215 7,148811 0,458299 118 817 011 50,62421 7,569021 0,433623 417 225 97 52,04351 7,781005 0,426274 044 383 568 40 7.6.2 Daten des Erlenmeyerkolben Tabelle 16 Daten des Erlenmeyerkolbens 1: OD-Messung Probe Zeitpunkt in OD h 1 Nr. 2 3 MW MW Abw. [-] 0 0,00 0,0200 0,0200 0,0200 0,0200 0,00 1 0,25 0,0198 0,0201 0,0222 0,0207 4,50 2 2,50 0,0222 0,0232 0,0229 0,0228 1,65 3 4,00 0,0232 0,0220 0,0227 0,0226 1,86 4 6,25 0,0266 0,0242 0,0240 0,0249 4,63 5 8,16 0,0381 0,0387 0,0356 0,0375 3,50 6 10,16 0,0717 0,0603 0,0725 0,0682 7,23 7 12,33 0,1190 0,1140 0,1222 0,1184 2,40 8 14,13 0,1544 0,1395 0,1522 0,1487 4,03 9 16,06 0,1979 0,1808 0,2024 0,1937 4,25 10 18,25 0,2540 0,2194 0,2595 0,2443 6,40 11 20,43 0,2965 0,2572 0,3024 0,2854 6,21 12 22,25 0,3613 0,3207 0,3750 0,3523 5,62 13 25,00 0,5035 0,4325 0,5220 0,4860 6,83 14 28,33 0,5920 0,5165 0,6570 0,5885 7,31 15 31,00 0,7310 0,6060 0,7780 0,7050 8,48 16 34,03 0,8545 0,6975 0,8850 0,8123 8,65 17 37,06 0,9540 0,7770 0,9993 0,9101 8,88 18 40,22 1,1350 0,9290 1,2190 1,0943 9,04 19 43,25 1,2620 1,0570 1,2580 1,1923 7,17 20 46,00 1,2620 1,0470 1,2580 1,1890 7,53 21 62,20 1,8410 1,5520 1,8890 1,7607 7,36 41 Tabelle 17 Daten des Erlenmeyerkolbens: BTM Kolben Leerwert der Gesamtgewicht Eppendorfcaps in g c in MW c in g/l Standardg/l in g abweichung in % 1.1 0,9999 1,0040 0,41 0,41 1.2 1,0110 1,0151 0,41 1.3 1,0227 1,0269 0,42 2.1 1,0291 1,0327 0,36 0,36 2.2 1,0227 1,0264 0,37 2.3 1,0142 1,0178 0,36 3.1 1,0108 1,0150 0,42 0,40 3.2 1,0169 1,0203 0,34 3.3 1,0111 1,0155 0,44 1,08 1,22 10,00 Tabelle 18 Daten des Erlenmeyerkolbens 3: pH Kulturzeit pH 4h 7,5 25 h 8,0 34 h 8,5 62 h 8,8 42 7.7 Bilder des MB-Ausstrichs Abbildung 11 MB-Ausstrich Nahaufnahme (HK2 I) Abbildung 12 MB-Ausstrich: oben: Bioreaktor 3, unten von links nach rechts: HK I, HK II, HK III 43 7.8 Bilder der Agar-Slides Abbildung 13 Agar-Slide 1 :Bioreaktor 3 nach 20 h, 1000x unverdünnt Abbildung 14 Agar-Slide 3: Bioreaktor 3 nach 46 h, 400x- Vergrößerung unverdünnt 44 Abbildung 15 Agar-Slide 3: Erlenmeyerkultur (HK exemplarisch) nach 31 h, 1000x Vergrößert, unverdünnt Abbildung 16 Erlenmeyerkultur (exemplarisch) nach 46 h, 400x Vergrößerung, unverdünnt 45 7.9 Berechnung von µmax und tD µmax liegt in dem Bereich, wo bei halb-logarithmischer Auf- tragung die Steigung am steilsten ist, in der Abbildung im orangenen Bereich. Abbildung 17 Berechnung von µmax und tD im Bioreaktor Die Formel wurde anhand einer exponentiellen Ausgleichsgrade bestimmt, wodurch sich für µmax ein Wert von 0,2392 Zellen/Stunde ergibt. TD für diesen Zeitpunkt ergibt sich aus der Formel: 𝑡𝐷 = ln(2) µ𝑚𝑎𝑥 . Daher beträgt tD = 2,898 Stunden. Abbildung 18 Berechnung von µmax und tD im Erlenmeyerkolben Erlenmeyer-kultur werden tD und µmax gleichermaßen bestimmt. Daher gilt für µmax = 0,2132 Zellen/Stunde und für tD = 3,251 Stunden. 46