Capacitor
Werbung

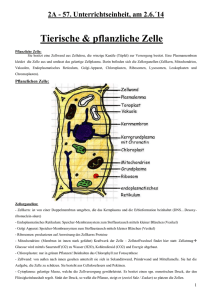
Direkte Speicherung elektrischer Energie in Superkondensatoren Institut für Technische Chemie und Umweltchemie (ITUC) der FSU Jena Experiment 3 1. Superkondensator Motivation Elektrochemische Kondensatoren, auch bekannt als Super- oder Ultrakondensatoren sind sehr vielversprechende Speichermedien für elektrische Energie. Neben ihrer hohen spezifischen Leistung zeigen sie darüber hinaus eine sehr lange Lebensdauer in Ladungs-/Entladungsprozessen, welche innerhalb von Sekunden erfolgen.[1] Im Vergleich zu Batterien, besitzen Superkondensatoren eine höhere Leistungsdichte, jedoch eine niedrigere Energiedichte,[2] weshalb es erforderlich ist, diese mit Batterien zu kombinieren um eine ununterbrochene Energieversorgung auch über längere Zeit hinweg zu gewährleisten und weitere Wege zur Verbesserung der Energiedichte dieser Speichermedien zu erforschen um Werte vergleichbar derer von Batterien zu erhalten. [1] Superkondensatoren bieten jedoch noch einen anderen sehr wichtigen Vorteil gegenüber Batterien, da sie aus einer Vielzahl verschiedener Materialien hergestellt werden können, wie beispielsweise Metalloxide, leitfähige Polymere oder auch umweltfreundlicher Komponenten wie Kohlenstoffe oder aus einer Kombination verschiedener Stoffe. Hierbei bestimmen die zur Herstellung verwendeten Materialien auch den Prozess, wie Energie im Medium gespeichert wird (Abbildung 1, links). [2] Doppelschichtkondensator – Energie wird durch die Akkumulierung von Ladung an der Grenze zwischen dem Elektrodenmaterial (verschiedene Kohlenstoffallotrope) und dem Elektrolyten gespeichert. Dies resultiert in dem Aufbau einer elektrischen Doppelschicht. Pseudokondensator – Energie wird durch Redoxprozesse an der elektroaktiven Oberfläche des Materials (elektroaktives Polymer, Metalloxide) auf der Elektrode gespeichert.[1,3] Abbildung 1: Übersicht von Superkondensatorentypen (links),[4] kommerziell zu erwerbende Superkondensatoren(rechts).[4,5] 2 Institut für Technische Chemie und Umweltchemie (ITUC) der FSU Jena Experiment 3 2. Superkondensator Was werden die Studierenden lernen? Die Studierenden werden ihre eigenen Superkondensatoren unter Verwendung verschiedener elektroaktiver Materialien herstellen und werden mit Hilfe der Form der Kurve des Cyclovoltammograms in der Lage sein, den Typ des Superkondensators zu bestimmen. Sie werden Ladungs-Entladungs-Prozesse messen und nachvollziehen wie diese zur Berechnung der spezifischen Kapazität sowie der Energie- und Leistungsdichte herangezogen werden können. 3. Theoretischer Hintergrund Die Kapazität eines Kondensators kann gemäß Gleichung 1 errechnet werden: C= Aε0 εr d (1) C stellt dabei die Kapazität des Kondensators dar, ε0 und εr sind die elektrische Permittivität des dielektrischen Materials bzw. des Luftspaltes, d die Distanz zwischen den Kondensatorplatten und A ihre Oberfläche. Die Gleichung verdeutlicht, dass es möglich ist die Kapazität durch Herabsetzen der Distanz d und durch Vergrößerung der Oberfläche A zu erhöhen.[1] Exakt darauf wird bei der Konstruktion von Superkondensatoren abgezielt. Gleichzeitig repräsentiert der unterschiedliche Mechanismus der Energiespeicherung (im elektrischen Feld im Fall von klassischen Kondensatoren) die Unterschiedlichkeit der beiden Energiespeichermedien.[1,2] Die Leistung eines Superkondensators kann im Wesentlichen durch drei verschiedene Eigenschaften beschrieben werden: seine spezifische Kapazität Cs (Gleichung 3 und 4), seine Energiedichte E und seine Leistungsdichte P (Gleichung 5 und 6) sowie sein Verhalten in cylcovoltammetrischen Messungen und in Ladungs-Entladungs-Prozessen, etc.[1,2,6] Hierbei ist es mögich die Kapazität des Kondensators mit Hilfe dreier unterschiedlicher Methoden zu untersuchen: 1. Durch Cyclovoltammetrie (CV, Abbildung 2 links, Gleichung 3), galvanostatische Ladungs-EntladungsMessungen (CC, Abbilung 2 rechts, Gleichung 4) und electrochemische Impedanzspektroskopie (EIS).[1] 3 Institut für Technische Chemie und Umweltchemie (ITUC) der FSU Jena Experiment 3 Superkondensator ΔV Abbilung 2: Cyclovoltammogramme verschiedener Kondensatortypen,[4] Ladungs-Entladungskurve mit IR drop.[1] Berechnung der Kapazität, Energie- und Leistungsdichte (Gleichung 3 – 6): Aus CV: Cs = Aus CC: a 2 ∙ m ∙ ∆U ∙ sr Cs = i ( dV )·m dt E= Cs U2 2 (5) P= U2 4R (6) (3) (4) Hierbei stellt Cs [F/g] wiederum die spezifische Kapazität des Kondensators dar, , a [V·A] ist die Fläche des Cyclovoltammograms, m [g] die Masse des aktiven Materials auf der Elektrodenoberfläche , ΔU [V] die Differenz der angelegtem Spannung während der CV Messung und sr die verwendete scanrate.[7] i [A] ist der constant bleibende Entladungsstrom, dV/dt [V/s] ist die Steigung der erhaltenen Ladungs-Entladungskurve (Abbildung 1). U [V] stellt die angelegte Spannung dar und R [Ω] der interne Wiederstand. [1,2,6] Der interne Wiederstand kann aus Gleichung 7 berechnet werden: R= ∆ViR i (7) ΔV [V] ist der Spannungsabfall (iR drop) zwischen den ersten beiden Punkten der Entladungskurve iR (Abbildung 2), i [A] ist der angelegte Strom.[8] 4 Institut für Technische Chemie und Umweltchemie (ITUC) der FSU Jena Experiment 3 4. Superkondensator Materialien und Geräte 1 M KCl (wässrig) Isopropanol (IPA) Polyvinylidenfluorid (PVDF) MnO2Pulver Kohlenstoff mit großer Oberfläche für kommerzielle Superkondensatoren (SC) Kohlenstoffpulver Norit GSX (N-GSX) Kohlenstofffilz Separatorpapier aus Zellulose 2-Elektroden-Münzzellen aus rostfreiem Edelstahl (CR2032) Distanzstück aus rostefreiem Edelstahl Wellenscheibe aus rostfreiem Edelstahl Zellhalter Potentiostat/Galvanostat Ultraschallbad Waage Lampe Lochstanzer (16 und 20 mm) Eppendorf Pipette und Spitzen, Spatel, Wiegeschiffchen, Probengläschen, 2 Bechergläser, 4 Petrischalen, Schere 5. Konstruktion der Kondensatorzelle 5.1 Präparation der Elektrodenscheiben und der Separatoren Zunächst werden mit dem Lochstanzer (16 mm) 4 Scheiben aus dem Kohlenstofffilz ausgestanzt und zwei davon abgewogen. Die beiden nicht abgewogenen Scheiben werden in eine Petrischale mit Ethanol gegeben, sodass der Kohlenstofffilz aktiviert wird. Darin verbleiben sie bis zum Gebrauch. Dann werden 6 Separatoren mit dem zweiten Lochstanzer (20 mm) aus dem Zellulosepapier ausgestanzt und in eine zweite Petrischale mit Elektrolyt (KCl) gelegt, sodass sie bis zu ihrem Gebrauch mit Elektrolyt durchtränkt sind. 5.2 Präparation der Elektrodentinte Bereiten Sie zwei verschiedene Superkondensatortypen vor: Tinten für die positiven Elektroden der beiden Zelle 1: Lösen Sie 5 mg PVDF in 0.5 ml IPA und stellen Sie die Suspension für 15 min in einem wassergefüllten Becherglas ins Ultraschallbad. Dann geben Sie 50 mg des Kohlenstoffes für Superkondensatoren (SC) zu und stellen die Suspension erneut für 15 min ins Ultraschallbad. 5 Institut für Technische Chemie und Umweltchemie (ITUC) der FSU Jena Experiment 3 Superkondensator Zelle 2: Lösen Sie wie für Zelle 1 beschrieben 5 mg PVDF in 0.5 ml IPA und stellen Sie die Suspension für 15 min ins Ultraschallbad. Dann geben Sie 65 mg MnO2 und 30 mg des Norit Kohlenstoffes (NGSX) zu und behandeln die Suspension erneut 15 min im Ultraschallbad. 5.3 Auftragen der Elektrodentinte Nehmen Sie die beiden abgewogenen, trockenen Kohlenstoffscheiben und tragen Sie mit der Eppendorfpipette die erste bzw. zweite Tinte in einer dünnen, gleichmäßigen Schicht auf der gesamten Oberfläche der Scheibe auf (Sie müssen nicht die gesamte Tinte verwenden, ungefähr 250 µL sind ausreichend). Dann lassen Sie die Tinte für 30 min unter der Lampe trocknen und wiegen die beiden beschichteten Kohlenstoffscheiben erneut ein um die Menge an aufgetragenem aktivem Material zu ermitteln. 5.4 Zusammensetzen der Zelle Für Zelle 1 nehmen Sie ein Distanzstück und legen Sie es in die positiv markierte Kondensatorschale, dann geben Sie die beschichtete Kohlenstoffscheibe darauf mit der beschichteten Seite nach oben. Dann werden vorsichtig die drei Separatoren aus der KCl-Lösung eingelegt, sodass möglichst kein Material von der beschichteten Elektrode abgelöst wird. Dann wird die unbeschichtete Kohlenstoffscheibe aus dem Ethanolbad zugegeben, gefolgt von der Wellenscheibe, siehe Abbildung 3. Bevor die Zelle mit der negativ gekennzeichneten Kondensatorschale verschlossen wird, werden noch vorsichtig 200 µL des Elektrolytes (1 M KCl) zugegeben. Stellen Sie sicher, dass kein Elektrolyt ausläuft und platzieren Sie sie in dem vorgesehenen Zellhalter. Abbildung 3: Zusammensetzung der Kondensatorzelle. Von links nach rechts: Positive Schale, beschichtetes Kohlenstofffilz (positive Elektrode), drei Separatoren, unbeschichtetes Kohlenstofffilz (negative Elektrode), Wellenscheibe, negative Schale. Wiederholen sie dieselben Schritte für Zelle 2 mit der mit MnO2/Kohlenstoffsuspension beschichteten positiven Elektrode. 6. Versuchsdurchführung Schalten Sie den Potentiostaten und den Laptop ein. Verbinden Sie die Zelle im Zellhalter über die +/Krokodilklemmen mit dem Potentiostaten. 6 Institut für Technische Chemie und Umweltchemie (ITUC) der FSU Jena Experiment 3 6.1 Superkondensator Cyclovoltammetrie Öffnen Sie die Software VoltaScope und messen Sie 5 Minuten lang die Leerlaufspannung (open circuit voltage, OCV) bis im Idealfall eine stabiles Potential vorliegt (der Plot der Spannung V gegen die Zeit t sollte ein Plateau erreichen). Die erforderlichen Einstellungen sind in Abbildung 4 dargestellt. Abbildung 3: Einstellungen zur Messung der Leerlaufspannung in VoltaScope. Dann werden fünf Cyclovoltammogramme bei einer scan-rate von 50 mV/s gemessen. Verwenden Sie die in Abbildung 5 gezeigten Einstellungen für VoltaScope. 7 Institut für Technische Chemie und Umweltchemie (ITUC) der FSU Jena Experiment 3 Superkondensator Abbildung 4: Einstellungen für die cyclovoltammetrischen Messungen in VoltaScope. Speichern Sie die Messdaten unverzüglich nach Ende der Messungen auf einem USB-Stick, andernfalls werden diese bei Neustart einer Messung überschrieben oder beim Schließen des Programmes gelöscht. Zur Seicherung gehen Sie auf File Export all the DC data wählen Sie Ihren USB als .txt speichern um eine Bearbeitung in Origin, SciDAVis, etc zu ermöglichen. Speichern Sie die Daten auch auf dem Laptop unter File Export all the DC data System C Benutzer Öffentlich !Praktikum. Bemerkung: Sollten die CVs nicht wie erwartet aussehen, starten Sie die Messung einfach neu. In manchen Fällen reicht auch die Menge an Elektrolyt nicht aus. In diesem Fall öffnen Sie die Zelle vorsichtig und geben Sie etwa 200 µL Elektrolyt nach. Achten Sie darauf, dass die Separatoren und die negative, unbeschichtete Elektrode durchtränkt sind und schließen Sie die Zelle möglichst ohne Verlust von Elektrolyt erneut. Bedenken Sie auch, dass es sich bei der vorliegenden Zelle um ein sehr komplexes System handelt, welches Zeit benötigt um ins Gleichgewicht zu kommen bis Messungen möglich sind. 6.2 Galvanostatische Ladungs-Entladungsmessungen Schließen Sie VoltaScope und öffnen Sie EnergyScope. 8 Institut für Technische Chemie und Umweltchemie (ITUC) der FSU Jena Experiment 3 Superkondensator Führen Sie Ladungs-Entladungs-Messungen bei einer Stromstärke von 1E-7 A für 120 s pro LadungsEntladungszyklus aus (10 Zyklen insgesamt). Dazu laden Sie die Messbedingungen durch Anklicken der Datei Charge-Discharge loop.stp unter File Open/Extract Measure Setup System C Benutzer Öffentlich !Praktikum Überprüfen Sie, ob die folgenden in Abbildung 6 dargestellten Einstellungen in EnergyScope erschienen sind. Abbildung 5: Einstellungen für Ladungs-Entladungs-Messungen in EnergyScope. Starten Sie die Messungen und speichern Sie die Messdaten ebenfalls direkt nach Beendigung der Messung auf Ihrem USB-Stick und Ihrem Laptop! Bemerkung: Auch für die Ladungs-Entladungsmessungen ist es nicht ungewöhnlich, sollten die Messkurven nicht perfekt geformt sein aufgrund der Komplexität des vorliegenden Systems und dem Gleichgewicht, welches durch das System erst erreicht werden muss. Wiederholen Sie nun die elektrochemischen Tests 6.1 und 6.2 für Zelle 2. Nachdem Sie die Experimente beendet haben und alle Daten auf USB-Stick und Laptop gespeichert haben, schalten Sie bitte Laptop und Potentiostat aus und säubern den Arbeitsplatz. 7. Versuchsauswertung 9 Institut für Technische Chemie und Umweltchemie (ITUC) der FSU Jena Experiment 3 7.1 7.2 7.3 7.4 7.5 8. Superkondensator Plotten Sie die Cyclovoltammogramme von Zelle 1 und 2 und vergleichen Sie deren Form. Versuchen Sie den Kondensatortyp zu ermitteln. Begründen Sie Ihre Zuordnung exakt unter Zuhilfenahme geeigneter Literatur! Berechnen Sie CS mit Hilfe der Cyclovoltammogramme (Gleichung 3) für Zelle 1 und 2. Wählen Sie hierfür einen geeigneten CV aus! Plotten Sie die Ladungs-Entladungskurven, ermitteln Sie R (interner Widerstand, Gleichung 7) und dV/dt und errechnen Sie die Größen CS (Gleichung 4), E (Gleichung 5) und P (Gleichung 6) für Zelle 1 und 2. Wählen Sie auch hierfür eine geeignete Kurve aus. Nutzen Sie für die Berechnungen die Spannung, welche am Maximum der gewählten Ladungs-Entladungskurve gemessen worden ist um dV/dt zu erhalten. Vergleichen Sie die Werte der spezifischen Kapazität der beiden Zellen sowie der verschiedenen Messmethoden. Falls Unterschiede vorliegen, erklären Sie diese! Diskutieren Sie die Leistungsfähigkeit Ihrer beiden selbstgebauten Superkondensatoren hinsichtlich der verschiedenen Elektrodenmaterialien. Beschreiben Sie die Redoxreaktion der MnO2-Elektrode während des Ladungs-Entladungs-Prozesses. Vergleichen Sie die errechneten Werte von CS, E und P mit vergleichbaren Systemen die in der Literatur beschrieben werden. Weichen Ihre erhaltenen Werte davon ab? Nennen Sie gegebenenfalls Gründe dafür! Literatur 1 P. Pieta et al., ECS J. Solid State Sci. Tech. 2013, 2, M3120-M3134. M. S. Halper, J. C. Ellenbogen, Supercapacitors: A brief overview, MITRE Nanosystems Group, 2006. 3 P. Simon, Y. Gogotsi, Nat. Mater. 2008, 7, 845 - 854. 4 http://en.wikipedia.org/wiki/Supercapacitor (24.10.2014) 5 http://www.alibaba.com/product-detail/button-5-5v-105-gold-coins_ 1560427533.html (24.10.2014) 6 M. Winter, R. J. Brodd, Chem. Rev. 2004, 104, 4245 - 4269. 7 P. Liu et al., Synt. Met. 2013, 181, 72 - 78. 8 N. Omar et al., Electrochim. Acta 2012, 86, 305 – 315. 2 9. Generelle Bemerkungen Bringen Sie einen Laborkittel und eine Schutzbrille mit! Sollten Sie diese nicht mitführen, kann die gesamte Gruppe nicht zum Praktikum antreten. Es wird vor Versuchsbeginn ein Antestat geben. Der Praktikumsbericht sollte eine Einleitung passend zum Thema enthalten sowie die Motivation des Versuchs und die Versuchsdurchführung beschreiben. Für die Einleitung sollten mindestens fünf Publikationen als Literaturquellen verwendet und nicht der theoretische Teil dieser 10 Institut für Technische Chemie und Umweltchemie (ITUC) der FSU Jena Experiment 3 Superkondensator Versuchsbeschreibung wiederholt werden! Im Anschluss sollte eine ausführliche Auswertung der Ergebnisse erfolgen, sowie diese mit Literaturwerten verglichen werden. Am Ende sollte eine Zusammenfassung stehen. Beschreiben Sie den Versuch, Ihre Beobachtungen, Ergebnisse und Literaturvergleiche so detailliert wie möglich, jedoch sollte der Bericht nicht mehr als 20 Seiten umfassen. Sie haben ab dem Tag der Versuchsdurchführung 4 Wochen Zeit den Bericht abzugeben (in ausgedruckter, unterschriebener Form und als .pdf). Achten Sie auf das Erscheinungsbild des Berichtes! 11