INSTITUT FÜR ANORGANISCHE CHEMIE Arbeitsgruppe Umwelt
Werbung

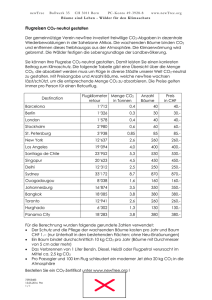
Bedeutung der Koordinationschemie für Transport und Verteilung von Metallen in Gewässern und Sedimenten Fällung und Auflösung von Carbonaten Hydrolyse und Bildung schwerlöslicher Oxide und Hydroxide Komplexbildung mit gelösten organischen Liganden Adsorption an Partikeloberflächen Redoxprozesse Biomethylierung CO2 • Kohlendioxid steht im Zentrum der geochemischen Kreisläufe • spielt eine zentrale Rolle in der Biosphäre: Photosynthese – Respiration • und in geochemischen Prozessen, welche Gesteine auflösen und Minerale bilden • In der Hydrosphäre wird Kohlenstoff vor allem als Ca(HCO3)2 transportiert • CaCO3 wird in Seen und im Ozean ausgefällt Monatsmittelwerte des global gemittelten atmosphärischen CO2 über der Ozeanoberfläche INSTITUT FÜR ANORGANISCHE CHEMIE Arbeitsgruppe Umwelt- und Radiochemie INSTITUT FÜR ANORGANISCHE CHEMIE Arbeitsgruppe Umwelt- und Radiochemie INSTITUT FÜR ANORGANISCHE CHEMIE Arbeitsgruppe Umwelt- und Radiochemie 0,0016% der Masse der Erde ist Kohlenstoff Das Carbonatsystem der Ozeane und Binnengewässer HCO3-, CO32- Enthält 60x soviel Kohlenstoff wie die Atmosphäre Ist das größte Kohlenstoffreservoir der Biosphäre Quelle: Ott Geochemischer Carbonat-Silicat Kreislauf Verwitterung von Kalk- oder Silicatgestein verbraucht CO2 Ca2SiO4+4 H2O+4 CO2→2 Ca(HCO3)2+Si(OH)4 (gelöst) Im Meer scheidet sich Kalk ab 2 Ca(HCO3)2→2 CaCO3↓+2 H2O+2 CO2↑ Es bilden sich Kalksedimente. In diesem Reservior verbleibt der Kohlenstoff Jahrmillionen. An den Kontinentalrändern schiebt sich der Meeresboden unter die Landmassen (Subduktion), unter hohen Drucken und Temperaturen reagiert dort das Calciumcarbonat mit Quarz 2 CaCO3+SiO2→Ca2SiO4+2 CO2↑ Bei der Verwitterung der Silicate der Erdkruste wird CO2 verbraucht: z.B. Kalkfeldspat (Anorthit) CaAl2Si2O8 + 2 H2O + 2 CO2 = H2Al2Si2O8 + Ca(HCO3)2 (gelöst) Beim Ausfallen der Carbonate im Ozean wird die Hälfte des bei der Verwitterung der Silicate verbrauchten CO2 wieder frei: Ca2+ + 2 HCO3- = CaCO3 + H2O + CO2 Coccolithophoriden einzellige Algen, besitzen ein Calcit- oder Aragonit-Skelett Quelle: Ott Hydrothermale Quellen in der Tiefsee an aktiven Spreizungsachsen: Ca2+ + 2 HCO3- + Si(OH)4 = CaSiO3 + 2 CO2 + 3 H2O Quelle: Ott Verwitterung: Ursache der Wasserhärte • „Temporäre Härte“ (= Carbonathärte): Anteil an Calcium- und Magnesiumhydrogencarbonat • „Permanente Härte“ (=Sulfathärte): erfasst die gelösten Calcium- und Magnesiumsalze der Salzsäure, Schwefelsäure, Salpetersäure u.a. Meerwasser: ________ Süßwasser: --------- mol L-1 atm-1 Verwitterung von Calcit, offenes System (bei 101 325 Pa = Normaldruck) • 0.038% v/v CO2 in der Atmosphäre pH=8.3 [Ca2+] = 5x10-4 mol/L entspricht 2.8°dH • 3% v/v CO2 in der Bodenluft pH = 7.02 [Ca2+] = 2.8x10-3 mol/L entspricht 15.7°dH Effekt der Landpflanzen auf die Verwitterung • Durch den Abbau von Pflanzenresten im Boden wird in hohen Konzentrationen CO2 produziert • Die Anwesenheit der Vegetation beschleunigt die CO2-Verwitterung daher um das 100 – 150 fache • Dadurch entzieht ein Wald-Ökosystem in Österreich der Atmosphäre im Jahr ca. 10 g C/m2 also 100 kg C/ha • Dieser Kohlenstoff wird als Ca(HCO3)2 ins Meer transportiert und dort als CaCO3 ausgefällt. Die Hälfte des gebundenen CO2 wird dabei frei, die andere Hälfte in den Carbonatsedimenten dauerhaft gespeichert. Carbonatsystem der Gewässer: Geschwindigkeit der Gleichgewichtseinstellung • Thermodynamisches Gleichgewicht stellt sich in der wässrigen Lösung im Allgemeinen rasch ein • Gewässer sind meist nicht im Gleichgewicht mit der Atmosphäre, weil biologische Prozesse im Wasser CO2 schneller produzieren oder konsumieren als der CO2 Transfer zwischen der Atmosphäre und dem Wasser erfolgt. • Bildung und Auflösung von CaCO3 können verzögert erfolgen • Metastabile Gleichgewichte: Aragonit (orthorhombisch) ist in einem natürlichen Wasser thermodynamisch weniger stabil als Calcit (trigonal). Unter bestimmten Bedingungen kann sich Aragonit gegenüber Calcit metastabil verhalten. Metallionen in Gewässern • Durch die zivilisatorischen Tätigkeiten sind die geochemischen Kreisläufe einer Anzahl metallischer Elemente beschleunigt • natürlichen Flüsse: durch Verwitterung der Gesteine, vulkanische Emissionen, Verbreitung natürlicher Aerosole aus Böden und Meerwasser • Die anthropogenen Flüsse übersteigen oft die natürlichen Flüsse. Die Gewässer sind dadurch besonders betroffen • Anthropogene Quellen für Schwermetalle sind z.B. Erzgewinnung, metallverarbeitende Industrien, Verbrennung fossiler Brennstoffe, Zementproduktion • Durch die Verbrennung fossiler Brennstoffe werden z.B. die Flüsse von As, Cd, Se, Hg, Zn in die Atmosphäre stark erhöht. Dadurch werden auch die Konzentrationen dieser Elemente im Wasser und in den Böden erhöht. Schwermetall-Entgiftungsstrategien der Organismen • • • Enzymatische Umwandlungen von toxischen zu weniger toxischen oder flüchtigen Spezies: Hg2+→Hg0 As(OH)3→(CH3)3As+-CH2COO- “Arsenobetain“ • Spezielle Membranen können den Durchtritt von Metallionen in besonders gefährdete Bereiche wie Gehirn, Fetus verhindern • Hochmolekulare Verbindungen wie etwa die Metallthionein-Proteine können bis zu einer gewissen Speicherkapazität toxische Ionen fixieren und damit aus dem Verkehr ziehen Lehrbücher: • Hollemann-Wiberg, Lehrbuch der Anorganischen Chemie, 102. Auflage. Berlin, New York: de Gruyter, 2007. • W. Kaim, B. Schwederski: Bioanorganische Chemie. Stuttgart: Teubner, 1995. • L. Sigg, W. Stumm: Aquatische Chemie - eine Einführung in die Chemie wässriger Lösungen und natürlicher Gewässer. vdf Hochschulverlag an der ETH Zürich. Stuttgart: Teubner, 1996. Speziierung der Schwermetalle in der Umwelt • Gelöst oder an feste bzw. kolloidale Phasen gebunden • Komplexbildung mit verschiedenen Liganden in Lösung • Verschiedene Redoxzustände • Metallorganische Verbindungen • Das Schicksal von Schwermetallen in den Gewässern hängt von der Speziierung ab (z.B. Transport in die Sedimente, Mobilisierung aus Sedimenten, Infiltration ins Grundwasser, Anreicherung in Organismen) • Die Toxizität ist stark von der jeweiligen chemischen Spezies abhängig. Hg als umweltrelevantes Schwermetall 4x10-5 Massen% Hg in der Erdkruste Hg22+ ↔Hg0 + Hg2+ sehr schwerlösliche Minerale: Hg2Cl2 und HgS HSAB-Prinzip → Thiophilie des Quecksilbers: Starke Wechselwirkung mit schwefelhaltigen Liganden z.B. Thiole = „Mercaptane“ = Quecksilberfänger Quecksilberdampfdruck in Abhängigkeit von der Temperatur Metallisches Quecksilber ist gegenüber Luftsauerstoff bei Raumtemperatur stabil: keine Oxidhaut Bei 20°C im Gleichgewicht 13,6 mg/m3 Hg in der Luft MAK-Wert: 0,1 mg/m3 Quecksilberverbindungen haben nur mit sehr harten Basen wie Fluorid und Nitrat den Charakter von Ionenkristallen. In anderen Fällen besitzen die Bindungen des Quecksilbers einen ungewöhnlich hohen kovalenten Anteil → geringe elektrische Leitfähigkeit der wässrigen Lösungen, gute Löslichkeit auch in organischen Lösungsmitteln, z.B. Löslichkeit von HgCl2: Quelle: Heiko Potgeter Quecksilber(II)verbindungen bilden mit vielen in Gewässern vorkommenden Anionen stabile Komplexe, dadurch kann die Wasserlöslichkeit stark erhöht werden. mit Halogenidionen: HgX3-, HgX42- (vor allem im Meerwasser) Ungewöhnlich stabile Komplexe mit Huminstoffen („gelöste“ kolloidale Phase in Fließgewässern, Seen, Grundwasser) Partikelgrößenverteilung von Huminstoff-Kolloiden Huminstoffe: ubiquitär in aquatischen Systemen, binden Schwermetalle Funktionen: 1. Entgiftung 2. Transport Bindungsformen: 1. Sorption 2. “non-exchangable binding“ Organische Quecksilberverbindungen Wichtig ist ausschließlich die Oxidationsstufe +II Monoorganyle RHgX, Diorganyle R2Hg linear gebaut Kovalente Bindung Hg-C relativ geringe Bindungsenergien 50 – 200 kJ/mol kann leicht homolytisch unter Bildung von Radikalen gespalten werden (thermische oder photolytische Zersetzung) → Lebensdauer in der Atmosphäre nur wenige Stunden Synthesechemie: die einfach durchzuführende homolytische Spaltung der Hg-C Bindung wird für die Bildung von Radikalen ausgenutzt. In der Umwelt ist die Hg-C Bindung gegenüber Wasser und Luft weitgehend inert (aus kinetischen Gründen) Charakteristische Abbaureaktionen in der Umwelt: Acidolyse: RHgX + HA → RH + AHgX Reduktion: RHgX + 2 H2O + 2 e- → RH + HX + 2 OH- + Hg0 Homolyse: R2Hg → 2 R· + Hg0 Entstehung von Dimethylquecksilber bei der Zersetzung von Monomethylquecksilber in Anwesenheit von H2S (H2S wird durch die mikrobielle Sulfatreduktion in reduzierenden Sedimenten gebildet): 2 CH3Hg+ + S2- → CH3Hg-S-HgCH3 → (CH3)2Hg + HgS Eigenschaft Hg0 Wasserlöslichkeit g/L bei 25°C 6·10-5 5 Dampfdruck Pa bei 25°C 0,25 1,76 CH3HgCl (CH3)2Hg HgCl2 Hg2Cl2 HgS 3 73 4·10-4 1,9·10-24 8300 0,016 1,3·10-8 nicht messbar Quelle: Heiko Potgeter Verwendung von Quecksilber: •Chloralkalielektrolyse –Amalgamverfahren (Hg-Kathoden). Wird zunehmend ersetzt (Diaphramaverfahren) •Dentaltechnik für Zahnplomben (Amalgam), wird zunehmend ersetzt. •Goldgewinnung durch Amalgamierung des Erzes, auch heute noch im Amazonasgebiet, sehr problematisch. •Batterien, Schaltelemente, Meßtechnik (Thermometer). •Organische Quecksilberverbindungen wurden als Saatbeizmittel und Fungizide in der Landwirtschaft eingesetzt (heute verboten). •Quecksilberorganische Verbindungen noch immer im medizinischen und kosmetischen Bereich verwendet. •Die Quecksilber-Fördermenge betrug zwischen 1900 und 1940 jährlich ca. 4 000 t und stieg 1973 bis auf 10 000 t an. Heute beträgt sie weltweit 4 000-6 000 Tonnen/Jahr. Zudem werden jährlich bis zu 3 000 Tonnen bei der Verbrennung fossiler Brennstoffe freigesetzt. Aufnahme mit der Nahrung: gelangt vor allem beim Verzehr von Pilzen, Fischen und Meerestieren über organische Quecksilberverbindungen in den Körper. So enthalten z.B. Thunfischkonserven durchschnittlich 366 mg/kg, im Vergleich dazu Frischobst nur 4,8 mg/kg. Die jährliche Hg-Aufnahme über Lebensmittel beträgt in Mitteleuropa pro Kopf ca. 2750 mg Mit der Magensäure entsteht aus CH3Hg+ das wenig dissoziierte CH3HgCl Molekül, das wegen seiner Fettlöslichkeit gut resorbierbar ist Toxische Wirkung Anorganische Hg-Verbindungen: Giftigkeit hängt von der Wasserlöslichkeit der jeweiligen Verbindung ab. Hg2+ ist bei pH 7 in Wasser leicht löslich und bildet mit den in Körperflüssigkeiten häufiger vorkommenden Anionen keine unlöslichen Verbindungen. Hg2+ tritt mit den Thiol- und Disulfideinheiten der Proteine in Wechselwirkung , blockiert aktive Zentren, verändert Strukturen von Enzymen. Körpereigene Entgiftung durch Binden an Metallthioneine: Proteine, Molekulargewicht ca. 6500 g/mol, 35% Cystein-Anteil. Organische Quecksilberverbindungen Größte toxische Wirkung wegen des ambivalent lipophilen/hydrophilen Charakters Resorptionsrate bei oraler Aufnahme bis 95% Am giftigsten ist Methylquecksilber(II) wegen der (kinetisch) stabilen Hg-C Bindung Weniger stabile quecksilberorganische Verbindungen werden im Körper zu anorganischem Quecksilber metabolisiert und wirken daher eher wie dieses Wegen seines lipophilen/hydrophilen Charakters ist Methylquecksilber(II)chlorid in der Lage, biologische Membranen zu durchdringen und sogar die Blut-HirnSchranke und Plazenta-Membran zu überwinden. Mutagene Wirkung durch die Bindung von CH3Hg+ an Nukleobasen, z.B. 8-Aza-modifiziertes Adenin: Quelle: Kaim/Schwederski Wirkungsweise von Methylquecksilber im menschlichen Körper Methylcobalamin Bioakkumulation und Biomagnifikation von Quecksilber Bioakkumulation = Anreicherung von Toxinen gegenüber dem Medium (Wasser). Biomagnifikation = Anreicherung von Toxinen mit steigendem trophischem Niveau, z.B. lipophile Organometallverbindungen, die sich der Exkretion über Metallthioneine entziehen. Die häufigsten Elemente in der Erdkruste Element O Si Al Massen% 47,0 26,9 8,1 Vol% 88,2 0,32 0,55 Fe3+ 1,8 0,32 Fe2+ Ca Mg Na K 3,3 5,0 2,3 2,1 1,9 1,08 3,42 0,60 1,55 3,49 Tabelle Silicate • Silicate sind die dominierenden gesteinsbildenden Minerale in der Erdkruste. • Primäre Silicate: sind aus dem Magma durch Erstarrung hervorgegangen. • Sekundäre Silicate: metamorphe Gesteine sowie die durch Verwitterung der primären Silicate entstandenen Tonminerale. Kugelmodelle: SiO4 Tetraeder und FeO6 Oktaeder nur die obere Darstellung ist maßstäblich, in den unteren Darstellungen sind die Sauerstoffionen verkleinert. Silicatstrukturen: Ketten- Band- und Schichtsilicate (Tetraedermodell) Quelle: Scheffer/Schachtschabel Quelle: Scheffer/Schachtschabel Glimmerstruktur Quelle: Scheffer/Schachtschabel Tetraedermodell eines Albits Quelle: Scheffer/Schachtschabel Primäre Silicate • Erguss- oder Eruptivgesteine: rasch abgekühlt • Tiefengesteine: langsam abgekühlt • Für das Magma ist die Bindung großer Mengen leichtflüchtiger Bestandteile (Gase) charakteristisch, wie H2O, H2S, Cl2, Schwermetallchloride, CO2. • Diese entweichen bei den Ergussgesteinen OH Quelle: Scheffer/Schachtschabel Bedeutung der Silicatverwitterung • Natürliche Fruchtbarkeit und Elektrolytgehalt von Böden • Überführung der Kieselsäure in Lösung • Anreicherung von Alkali- und Erdalkalimetall-Ionen in Wässern • Bildung von austauschaktiven Tonmineralen Gelöste Kieselsäure • Flusswasser und Meerwasser enthalten gelöste Kieselsäure in sehr geringen Konzentrationen • Daher keine chemische Ausfällung • Im SiO2 Kreislauf des Ozeans ist Ausfällung von Kieselsäure nur durch Organismen möglich! • Radiolarien, Diatomeen und Kieselschwämme bauen ihre Skelette aus Opal auf • Es setzen sich schließlich Diatomeen- und Radiolarienschlämme ab (1010 Tonnen SiO2 jährlich) • Im Süßwasser bildet sich poröse Diatomeenerde (Kieselgur) • Diatomeen (=Kieselalgen) liefern 20 -25% der gesamten Primärproduktion der Erde! Tonminerale (Sekundärsilicate) • Bilden sich inkongruent aus den Primärsilicaten im Kontakt mit der Verwitterungslösung • Oder kongruent aus übersättigten Lösungen • Ihre Zusammensetzung variiert über weite Bereiche, entsprechend dem Grad der Verwitterung