Brand - und Löschlehre 2 Chemie
Werbung
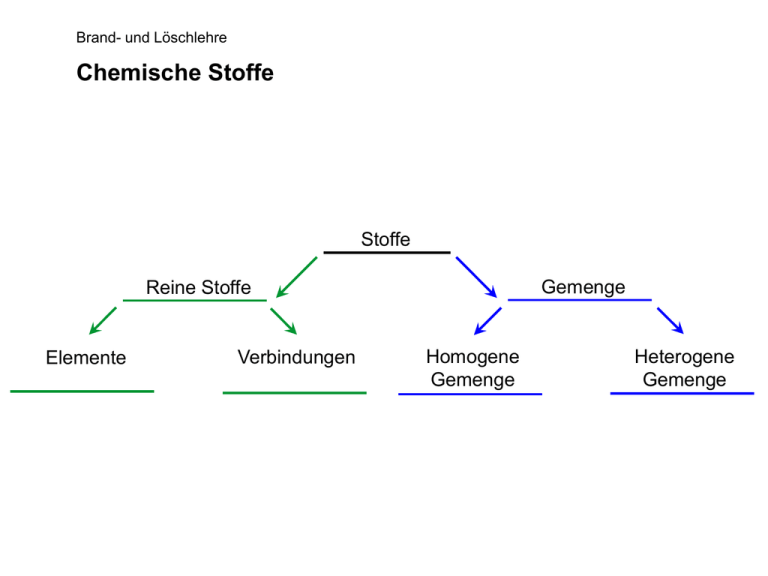
Brand- und Löschlehre Chemische Stoffe Stoffe Gemenge Reine Stoffe Elemente Verbindungen Homogene Gemenge Heterogene Gemenge Brand- und Löschlehre Chemische Gleichung Beispiel: Kohlenstoff und Sauerstoff reagieren zu Kohlenstoffdioxid C + O2 CO2 1 Atom C + 1 Molekül O2 1 Molekül CO2 1 mol C + 1 mol O2 1 mol CO2 12g C 44g CO2 + 32g O2 Brand- und Löschlehre Einfaches Atommodell Bohr‘sche Atommodell Brand- und Löschlehre s- und p-Orbitalatommodelle Brand- und Löschlehre Ionisation negatives Ion: Kern 6+ Hülle 7- eneutral: Kern 6+ Hülle 6- epositives Ion: Kern 6+ Hülle 5- Brand- und Löschlehre Periodensystem Brand- und Löschlehre Atombindung – Das Modell Brand- und Löschlehre Atombindung – Die Definition Bei diesem Bindungstyp teilen sich die beteiligten Atome gemeinsam Elektronenpaare, so dass nach außen hin Edelgaskonfiguration erreicht wird. Aus diesem Grund wird die Atombindung auch Elektronenpaarbindung genannt. Die Bindungselektronen werden also Teil der Elektronenhüllen beider Atome. Aus den beiden Atomorbitalen entsteht ein gemeinsames Molekülorbital, das die Atome gleichmäßig umgibt. Da es hierbei zu keiner Ladungsverschiebung wie bei der Ionenbindung kommt, wird dieser Typ auch als homöopolare bzw. unpolare Bindung bezeichnet. Des weiteren ist die Bezeichnung kovalente Bindung gebräuchlich. Brand- und Löschlehre Ionenbindung – Das Modell + Natriumatom + = Chloratom Ausrichtung zu einem Ionen- oder Kristallgitter Natrium-Ion Natriumchlorid oder Kochsalz Chlor-Ion Brand- und Löschlehre Ionenbindung – Die Definition Ionenbindungen entstehen, wenn sich elektropositive und elektronegative Elemente miteinander verbinden. Die Verbindung entsteht durch den Übergang von Elektronen des einen Atoms auf das des anderen. Dabei findet eine Ladungsverschiebung statt und es wird kein gemeinsames Elektronenpaar gebildet wie bei der Atombindung, sondern es entstehen positive und negative Ionen. Edelgaskonfiguration wird also entweder durch die Aufnahme oder die Abgabe eines Elektrons erzielt. Dabei entsteht ein nach außen hin elektrisch neutrales Molekül. Dieser Bindungstyp ist typisch für Verbindungen aus elektropositiven Metallen und elektronegativen Nichtmetallen; er wird auch heteropolare oder ionogene Bindung genannt. Brand- und Löschlehre Metallbindung – Das Modell Metallbindung Kugelpackungen Brand- und Löschlehre Metallbindung – Die Definition Das Metallgitter wird von den positiv geladenen Atomrümpfen gebildet, die die feste Gitterpunkte in der Kristallstruktur bilden. Die Elektronen sind demgegenüber frei beweglich und bilden eine Art Elektronengas. Metallbindungen werden durch Valenzelektronen zusammengehalten, die sehr stark delokalisiert sind, da sie sich mehr oder weniger frei zwischen den Atomrümpfen hin- und herbewegen. Dies geschieht so, dass nirgends eine Anhäufung von Ladungen entsteht. Somit verursachen elektrostatische Wechselwirkungen zwischen den negativ geladenen Elektronen und den positiv geladenen Atomrümpfen den Zusammenhalt des Metallgitters. Diese Bindungskräfte wirken auf alle Atomrümpfe gleich stark. Die Atomrümpfe führen dabei Schwingungen um die Gitterpunkte aus; diese Schwingungen werden durch Wärmezufuhr solange verstärkt, bis das Metallgitter auseinander bricht. Brand- und Löschlehre Verbrennung Der Verbrennungsvorgang Brennen ist eine mit Flamme und/oder Glut selbständig ablaufende exotherme Reaktion zwischen einem brennbaren Stoff und Sauerstoff oder Luft. Wenn ein Stoff mit Sauerstoff zu einem neuen Stoff reagiert, so spricht man auch von einer Oxidation. Diese Oxidation kann mit unterschiedlichen Geschwindigkeiten ablaufen. Brand- und Löschlehre Oxidation Definition: Oxidationsgeschwindigkeit ist die Zeit, in der sich Sauerstoff mit einem anderen Stoff verbindet. sehr langsam: über Jahre, Jahrzehnte z.B. Grünspan, Holz wird tot, Gummi wird hart und rissig langsam: über Stunden, Tage, Monate z.B. Eisen rostet, Mist gärt schnell: in Minuten, Stunden Feuer, z.B. Natrium in Wasser sehr schnell: in Sekunden Verpuffung, Explosion, Detonation Brand- und Löschlehre Exotherme Reaktion Bei der Verbrennung wird Wärme frei, deren Ursache zum einen im chemischen Vorgang der Oxidation liegt, und zum anderen in der gespeicherten Energie des brennbaren Stoffes. Definition: Eine exotherme Reaktion ist eine Reaktion, bei der Energie freigesetzt wird. Der freiwerdende Energiebetrag erhält ein negatives Vorzeichen (-∆ H). Man spricht dann von einer negativen Reaktionswärme. Definition: Eine endotherme Reaktion ist eine Reaktion, bei der Energie verbraucht wird. Der benötigte Energiebetrag erhält ein positives Vorzeichen (+∆ H). Man spricht dann von einer positiven Reaktionswärme. Brand- und Löschlehre Weitere „chemische Grundlagen“ Gesetz von der Erhaltung der Masse Masse der Ausgangsstoffe = Masse der Endprodukte Gesetz der konstanten Proportionen Gesetz der multiplen Proportionen Atommassen Wertigkeit, Elektronegativität, Oxidationszahl