Aminosäuren und Proteine
Werbung
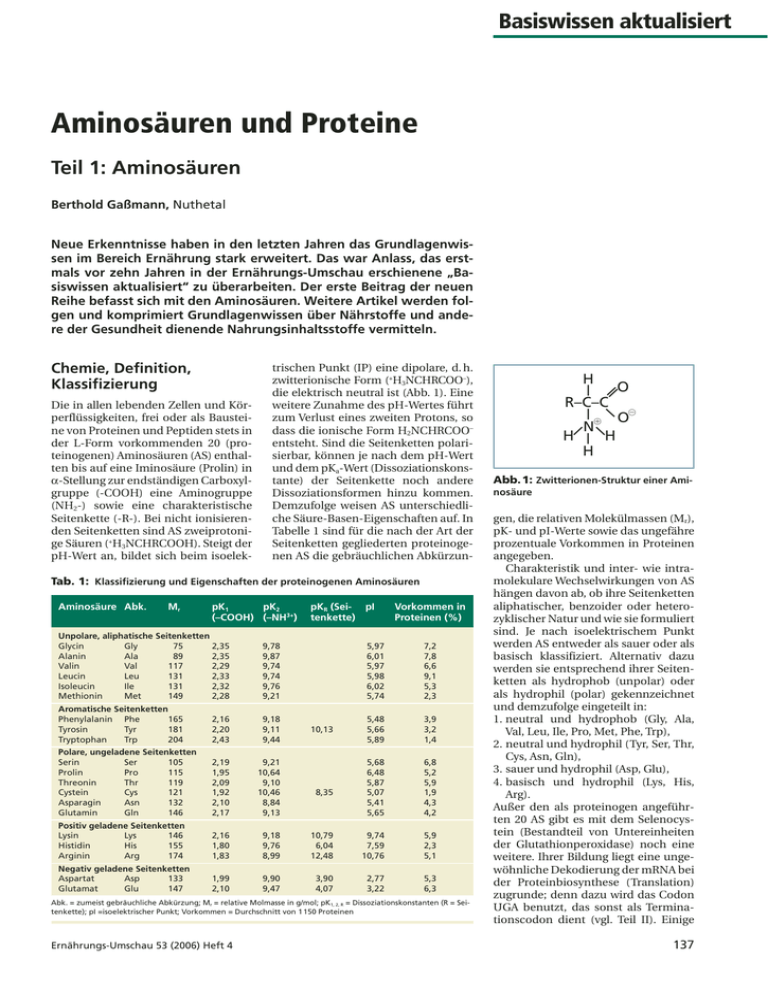
Basiswissen aktualisiert Aminosäuren und Proteine Teil 1: Aminosäuren Berthold Gaßmann, Nuthetal Neue Erkenntnisse haben in den letzten Jahren das Grundlagenwissen im Bereich Ernährung stark erweitert. Das war Anlass, das erstmals vor zehn Jahren in der Ernährungs-Umschau erschienene „Basiswissen aktualisiert“ zu überarbeiten. Der erste Beitrag der neuen Reihe befasst sich mit den Aminosäuren. Weitere Artikel werden folgen und komprimiert Grundlagenwissen über Nährstoffe und andere der Gesundheit dienende Nahrungsinhaltsstoffe vermitteln. Aminosäure Abk. Mr pK1 pK2 (–COOH) (–NH3+) Unpolare, aliphatische Seitenketten Glycin Gly 75 2,35 Alanin Ala 89 2,35 Valin Val 117 2,29 Leucin Leu 131 2,33 Isoleucin Ile 131 2,32 Methionin Met 149 2,28 9,78 9,87 9,74 9,74 9,76 9,21 Aromatische Seitenketten Phenylalanin Phe 165 Tyrosin Tyr 181 Tryptophan Trp 204 2,16 2,20 2,43 9,18 9,11 9,44 Polare, ungeladene Seitenketten Serin Ser 105 Prolin Pro 115 Threonin Thr 119 Cystein Cys 121 Asparagin Asn 132 Glutamin Gln 146 2,19 1,95 2,09 1,92 2,10 2,17 9,21 10,64 9,10 10,46 8,84 9,13 Positiv geladene Seitenketten Lysin Lys 146 Histidin His 155 Arginin Arg 174 2,16 1,80 1,83 9,18 9,76 8,99 Negativ geladene Seitenketten Aspartat Asp 133 Glutamat Glu 147 1,99 2,10 9,90 9,47 pKR (Sei- pI tenkette) Vorkommen in Proteinen (%) 5,97 6,01 5,97 5,98 6,02 5,74 7,2 7,8 6,6 9,1 5,3 2,3 5,48 5,66 5,89 3,9 3,2 1,4 5,68 6,48 5,87 5,07 5,41 5,65 6,8 5,2 5,9 1,9 4,3 4,2 10,79 6,04 12,48 9,74 7,59 10,76 5,9 2,3 5,1 3,90 4,07 2,77 3,22 5,3 6,3 10,13 8,35 Abk. = zumeist gebräuchliche Abkürzung; Mr = relative Molmasse in g/mol; pK1, 2, R = Dissoziationskonstanten (R = Seitenkette); pI =isoelektrischer Punkt; Vorkommen = Durchschnitt von 1 150 Proteinen Ernährungs-Umschau 53 (2006) Heft 4 | || Tab. 1: Klassifizierung und Eigenschaften der proteinogenen Aminosäuren H O | R–C–C | 䊝 O䊞 N H | H H | Die in allen lebenden Zellen und Körperflüssigkeiten, frei oder als Bausteine von Proteinen und Peptiden stets in der L-Form vorkommenden 20 (proteinogenen) Aminosäuren (AS) enthalten bis auf eine Iminosäure (Prolin) in α-Stellung zur endständigen Carboxylgruppe (-COOH) eine Aminogruppe (NH2-) sowie eine charakteristische Seitenkette (-R-). Bei nicht ionisierenden Seitenketten sind AS zweiprotonige Säuren (+H3NCHRCOOH). Steigt der pH-Wert an, bildet sich beim isoelek- trischen Punkt (IP) eine dipolare, d. h. zwitterionische Form (+H3NCHRCOO–), die elektrisch neutral ist (Abb. 1). Eine weitere Zunahme des pH-Wertes führt zum Verlust eines zweiten Protons, so dass die ionische Form H2NCHRCOO– entsteht. Sind die Seitenketten polarisierbar, können je nach dem pH-Wert und dem pKa-Wert (Dissoziationskonstante) der Seitenkette noch andere Dissoziationsformen hinzu kommen. Demzufolge weisen AS unterschiedliche Säure-Basen-Eigenschaften auf. In Tabelle 1 sind für die nach der Art der Seitenketten gegliederten proteinogenen AS die gebräuchlichen Abkürzun- | Chemie, Definition, Klassifizierung Abb. 1: Zwitterionen-Struktur einer Aminosäure gen, die relativen Molekülmassen (Mr), pK- und pI-Werte sowie das ungefähre prozentuale Vorkommen in Proteinen angegeben. Charakteristik und inter- wie intramolekulare Wechselwirkungen von AS hängen davon ab, ob ihre Seitenketten aliphatischer, benzoider oder heterozyklischer Natur und wie sie formuliert sind. Je nach isoelektrischem Punkt werden AS entweder als sauer oder als basisch klassifiziert. Alternativ dazu werden sie entsprechend ihrer Seitenketten als hydrophob (unpolar) oder als hydrophil (polar) gekennzeichnet und demzufolge eingeteilt in: 1. neutral und hydrophob (Gly, Ala, Val, Leu, Ile, Pro, Met, Phe, Trp), 2. neutral und hydrophil (Tyr, Ser, Thr, Cys, Asn, Gln), 3. sauer und hydrophil (Asp, Glu), 4. basisch und hydrophil (Lys, His, Arg). Außer den als proteinogen angeführten 20 AS gibt es mit dem Selenocystein (Bestandteil von Untereinheiten der Glutathionperoxidase) noch eine weitere. Ihrer Bildung liegt eine ungewöhnliche Dekodierung der mRNA bei der Proteinbiosynthese (Translation) zugrunde; denn dazu wird das Codon UGA benutzt, das sonst als Terminationscodon dient (vgl. Teil II). Einige 137 Basiswissen aktualisiert Oxidation zu Harnstoff, CO22 und H22O Nahrungsprotein Aminosäuren Peptide Gewebeprotein Umwandlung in andere Komponenten Abb. 2: Schematische Darstellung des Aminosäuren-Stoffwechsels AS entstehen ferner durch Modifizierungen erst posttranslational im Peptidverband: δ-Hydroxylysin und γHydroxyprolin (im Kollagen), 3-Methylhistidin (in den kontraktilen Proteinen Actin und Myosin) sowie γ-Carboxyglutamat in Pro- und Antikoagulanzien der Blutgerinnung sowie im Osteocalcin. Beim Proteinabbau frei gesetzt, werden diese AS nicht wiederverwertet, sondern metabolisiert oder im Urin ausgeschieden. Die Hydroxylgruppen von Serin, Threonin und Tyrosin können phosporyliert oder glykolysiert werden und dadurch zur Calciumbindung bzw. zum Entstehen von Glykoproteinen und Proteoglykanen führen. Überdies kommt es translational zu Acetylierungen und Konversionen von AS. Zu den vermutlich mehr als Tausend in der Natur vorkommenden AS rechnen auch die nicht als proteinogen geltenden körpereigenen AS Ornithin und Citrullin (Intermediate des Harnstoffzyklus), γ-Aminobutyrat (GABA; Neurotransmitter) und Homocystein (Intermediat bei der Cysteinbildung aus Methionin). Wegen des Chiralitätszentrums am α-C-Atom können mikrobiell und bei einer Alkali- und Hitzeeinwirkung auf Proteine (z. B. in Laugengebäck) als Enantiomere zusätzlich D-Aminosäuren entstehen und geringfügig in Lebensmittel gelangen. Sie stören den Translationsvorgang und werden bei der Proteinbiosynthese nicht in die wachsenden Peptidketten eingefügt. Es wird angenommen, dass es Aufgabe einer in den Peroxisomen vorkommenden D-Aminosäuren-Oxidase ist, sie durch eine dehydrierende Desaminierung zu eliminieren. Die (temperaturabhängige) Löslichkeit der AS in Wasser ist sehr unterschiedlich. Neben dem extrem löslichen Prolin sind auch Hydroxyprolin, Glycin und Alanin gut löslich. Sehr schwer löslich sind Cystin (zwei über eine Disulfidbrücke miteinander verknüpfte Cysteinreste) und Tyrosin. Ein Zusatz von Säure oder Alkali erhöht die Löslichkeit durch Salzbildung. Die Anwesenheit anderer AS setzt die Löslichkeit im allgemeinen gleichfalls herauf (z. B. in Proteinhydrolysaten). Beim Backen, Braten, Fritieren und Kochen entwickelt sich in vielen Lebensmitteln ein für den erhitzten Zustand typisches Aroma, an dem AS als Vorläufer beteiligt sind. Die charakteristischen Aromastoffe bilden sich zumeist über die Maillard-Reaktion und sind insbesondere Folgeprodukte von Polyamine Citrullin (Zelldifferenzierung) Harnstoff (NH44+-Detoxifizierung) Ornithin Arginin Prolin Agmatin (Hepatocyten-DNAund Proteinsynthese) (Zellsignalmoleküle) Stickstoffmonoxid (Vasodilatation, antimikrobielle Wirkung, Neurotransmission) Kreatin Hydroxyprolin (Kollagensynthese) Abb. 3: Spezifische Funktionen des Arginin-Stoffwechsels 138 (Energiequelle in der Skelettmuskulatur und in Nervenzellen) Cystein, Methionin, Ornithin und Prolin. Soweit in proteinreichen Lebensmitteln hydrolytische Vorgänge ablaufen (z. B. bei Fleisch, Fisch und Käse), können AS selbst zum Geschmack beitragen. Die Geschmacksintensität hängt von der Hydrophobität der Seitenkette ab, die Geschmacksqualität von der Konfiguration. Süße AS finden sich überwiegend in der D-, bittere in der L-Reihe. L-Tryptophan ist neben L-Tyrosin die bitterste, D-Tryptophan die mit Abstand süßeste Aminosäure. L-Glutaminsäure nimmt eine Sonderstellung ein. Sie schmeckt in höheren Konzentrationen nach Fleischbrühe, wohingegen sie in niedrigen den Eigengeschmack eines Lebensmittels verstärkt. L-Methionin schmeckt schwefelartig. Stoffwechsel Die Aminosäuren des menschlichen Organismus stammen aus drei Quellen: den Nahrungsproteinen, der Biosynthese aus anderen metabolischen Intermediaten und vor allem dem Abbau von Gewebeproteinen. In vergleichbarer Weise dreifach sind die Stoffwechselwege vorbestimmt: Proteinsynthese, Oxidation zu Kohlendioxid, Wasser und Harnstoff sowie Bildung anderer niedermolekularer Verbindungen (Abb. 2). AS, die aus der Nahrung stammen und mit dem Portalvenenblut in die Leber gelangen, werden dort zu rund 75 % verstoffwechselt. Ihr Abbau erfolgt vornehmlich über Decarboxylierungen, Transaminierungen oder oxidative Desaminierungen, bei denen biogene Amine und 2-Oxosäuren entstehen. Die verbleibenden 25 % treten in die systemische Zirkulation ein und erreichen mit ihr die anderen Körpergewebe. Im steady state des ständigen Auf- und Abbaues von Körperproteinen befinden sich Synthese- und Katabolismusrate im Gleichgewicht. Der Umsatz beträgt bei Erwachsenen täglich etwa 300 g (4g/kg/Tag), das sind 3- bis 4-mal soviel wie die tägliche Proteinzufuhr mit der Nahrung. Damit verbunden ist jedoch weder ein Verbrauch an AS, noch besteht ein Zusammenhang zwischen dem Turnover sowie der AS-Katabolie und -Oxidation. Ohne ein effizientes AS-Recycling wäre dies nicht denkbar. Freie AS gibt es zwar in allen Zellen und in der extrazellulären Flüssigkeit, aber insgesamt bestreiten diese nur ca. 2 % des gesamten Körpergehalts an Aminosäuren. Mit Hilfe einer Vielzahl Ernährungs-Umschau 53 (2006) Heft 4 Basiswissen aktualisiert von Transportmechanismen werden sie – spezifisch für einzelne AS-Gruppen – zwischen Geweben, Plasma, Erythrozyten und Körperzellen transportiert. Ihre Konzentration wird vornehmlich durch Modulation der Stoffwechselwege und nur im Falle der entbehrlichen AS durch deren Syntheserate reguliert. Vieles spricht dafür, dass Ausmaß und Geschwindigkeit der Biosynthese wie des Abbaues von Proteinen von der (exogenen) Versorgung mit AS bestimmt werden und dass mindestens noch ein weiterer homöostatischer Mechanismus die Konzentration der freien AS innerhalb sicherer Grenzen gewährleistet. Der gesamte Bestand an freien AS wird täglich 3- bis 4-mal umgesetzt. Die beim Katabolismus von Gewebeproteinen frei gesetzten AS kehren entweder in den Gesamt-AS-Pool zurück und werden wiederverwertet, oder sie werden desaminiert und verstoffwechselt. Unter besonderen Umständen wie Hunger, Diabetes mellitus und fettreicher Kost gehen sie in die Glukoneogenese und hierüber in den Energiestoffwechsel ein. Soweit dies erfolgt, werden die AS als glukogen bezeichnet. Ausgenommen davon sind Leucin und Lysin; denn beide können nicht in Glukose umgewandelt werden. Aus ihnen werden vielmehr Acetoacetat und weitere Ketonkörper gebildet; diese können zwar auch als Energiequellen dienen, aber das geschieht nur in extrahepatischen Geweben. Leu und Lys werden darum als ketogene Aminosäuren klassifiziert. Glukogene wie ketogene Abbauprodukte liefern Ile, Phe, Trp , Tyr, Met und Cys. Für den Stoffwechsel wesentlich ist eine Kompartimentierung der freien AS in verschiedenen Pools (Plasma, Muskulatur, Leber). Die Entfernung von Aminogruppen findet bei den meisten AS durch Transaminierungen und vornehmlich in der Leber statt. Verzweigtkettige AS werden allerdings in der Skelett- und Herzmuskulatur sowie im Fettgewebe transaminiert. Hauptorgan einer intensiven Desaminierung von Glutamin, das etwa die Hälfte aller freien Aminosäuren bestreitet, ist die Niere. Dort hält das entstehende Ammonium-Ion das SäureBasen-Gleichgewicht aufrecht und reguliert den pH-Wert des Urins. Bei der Transaminierung von AS in der Leber ist 2-Oxoglutarat der Hauptakzeptor für die abgespaltenen Aminogruppen und Lieferant von Glutamat. Dessen dehydrierende Desaminierung führt darüber hinaus zur FreiErnährungs-Umschau 53 (2006) Heft 4 Arginin Kreatin Methionin (Bestandteil/Energiequelle in Skelettmuskulatur) Glycin Serin Glutathion Cystein Cystin (Antioxidanz) (Proteinfaltung) (Schwefelspeicher) Taurin (Gallensäurenkonjugation, Nervenzellenentwicklung, Regulation des Zellmembranpotenzials, Kalziumtransport, Antioxidanz) Abb. 4: Spezifische Funktionen schwefelhaltiger Aminosäuren setzung von Ammoniak (NH3); dieses würde sich als hoch toxische Substanz anhäufen, könnte es nicht in einem Reaktionszyklus (über Arginin, Ornithin und Citrullin) in Harnstoff umgewandelt und in dieser Form mit dem Urin ausgeschieden werden. Die Ausscheidungsprodukte sind allerdings vielfältiger, da AS zur Synthese anderer N-haltiger Verbindungen herangezogen werden (Purinbasen, Kreatin, Adrenalin u. a.). Neben Harnstoff und Ammoniumsalzen finden sich im Harn darum vor allem noch Harnsäure und Kreatinin. Ausschluss und Supplementierung von Aminosäuren der Nahrung Bei knapp einem Dutzend bisher bekannt gewordener erblicher Störungen des Um- und Abbaues oder des Transports von AS kann es zur Anhäufung von Metaboliten mit neuround/oder hepatotoxischer Wirkung kommen, die als Aminoacidopathien diagnostisch zumeist über Serumund/oder Harnanalysen erfasst werden. Die bekanntesten von ihnen sind die auf einem Defekt der Phenylala- ninhydroxylase beruhende Phenylketonurie und die nach dem Geruch des Harns benannte Ahornsirup-Krankheit. Bei ihr ist der Abbau verzweigtkettiger AS (Val, Leu, Ile) gestört. Beide Krankheiten haben bereits in den ersten Lebenswochen Schädigungen des ZNS davon betroffener Säuglinge zur Folge, wenn diese nicht mit Aminosäurenmischungen ernährt werden, die frei von Phe bzw. von Val, Leu und Ile sind. Je nach Krankheitsbild unterschiedlich zusammengesetzte und dosierte Mischungen von AS (10- bis 15%ige wässrige Lösungen) werden – meist parenteral – auch zur Versorgung von schwerkranken Patienten eingesetzt, die nicht ausreichend essen dürfen, können oder wollen. Weil einige AS bestimmte Funktionen ausüben, werden sie in defizitären und anderen klinischen Situationen (z. B. Niereninsuffizienz, Malabsorption) zur Lebenserhaltung in nährstoffdefinierten Formeldiäten (z. B. Arg und Gln) oder zur diätetischen Unterstützung arzneilicher Therapien kontrolliert als „diätetische Lebensmittel für besondere medizinische Zwecke“ eingesetzt (bilanzierte bzw. ergänzende bilanzierte Diäten). Vor allem we- Tab. 2: Aufgliederung der in der Nahrung des Menschen enthaltenen Aminosäuren unentbehrliche entbehrliche konditionell unentbehrliche Vorläufer von konditionell unentbehrlichen AS Histidin Isoleucin Leucin Lysin Methionin Phenylalanin Threonin Tryptophan Valin Alanin Asparaginsäure Asparagin Glutaminsäure Serin Arginin Cystein Glutamin Glycin Prolin Tyrosin Glutamin/Glutamat, Aspartat Methionin, Serin Glutaminsäure, Ammoniak Serin, Cholin Glutamat Phenylalanin 139 Basiswissen aktualisiert gen der Ergebnisse tierexperimenteller Untersuchungen wird ferner versucht, mit AS-Zusammenstellungen die Immunkompetenz zu verbessern. Daneben werden AS mehr oder weniger spekulativ supplementiert. Ein Beispiel dafür und für die damit angestrebten Ziele bietet Arginin, das über die Harnstoff- und Kreatinsynthese hinaus eine spezifische Rolle bei der Synthese bedeutsamer bioaktiver Substanzen wie NO (Stickstoffmonoxid), Agmatin, Prolin, Hydroxyprolin und Polyaminen spielt (Abb. 3). Vergleichbar bestellt ist es um Cystein, das wegen der schlechten Löslichkeit oft in Form von N-Acetylcystein eingebracht und u. a. in Taurin (2-Aminomethansulfonsäure) umgewandelt wird (Abb. 4). Humanuntersuchungen über die Wirksamkeit von Taurin in so genannten Energydrinks (z. B. Kontrolle der Kontraktion von Herzmuskelzellen oder Erhöhung der Konzentrationsfähigkeit) sind jedoch spärlich und von begrenzter Aussagekraft. Tryptophan wird zwar vornehmlich oxidativ abgebaut, aber daneben entsteht im ZNS aus ihm Serotonin (5-Hydroxytryptamin); dieses beeinflusst als Neurotransmitter u. a. die Stimmung und den Schlaf-WachRhythmus. Die Auslobung von Tryptophan als „smart drug“ zur Reduktion von Symptomen wie Depressionen, Ängstlichkeit, Zwangsvorstellungen u. ä. ist jedoch nicht hinreichend begründet. Bedarf und empfohlene Zufuhren Hinsichtlich ihrer Zufuhr mit der Nahrung des Menschen werden die proteinogenen AS in unentbehrliche, entbehrliche, konditionell unentbehrliTab. 3: Zusammensetzung des Gesamtkörperproteins an unentbehrlichen Aminosäuren (in mg/g Protein ± Standardabweichung) Aminosäure mg/g Gesamtkörperprotein Histidin 27 ± 2 Isoleucin 35 ± 3 Leucin 75 ± 2 Lysin 73 ± 3 Methionin + Cystein 35 ± 1 Phenylalanin + Tyrosin 73 ± 4 Threonin 42 ± 3 Tryptophan 12 (keine ausreichenden Daten) Valin 49 ± 4 140 che und Vorläufer von konditionell unentbehrlichen aufgeteilt. Aus Tabelle 2 ist dies ersichtlich. Die unentbehrlichen AS müssen zugeführt werden, um den Aufbau und Erhalt der Körpersubstanz sowie die Homöostase der Zusammensetzung des Gesamtkörperproteins (Tab. 3) abzusichern. Essenziell sind davon, streng genommen, nur Lys und Thr; denn die anderen unentbehrlichen AS können prinzipiell (wenngleich nicht hinreichend) auch endogen durch Transaminierung aus den entsprechenden Oxosäuren gebildet werden. Allerdings wird in der Ernährungspraxis die Proteinqualität einer gemischten Kost außer durch den Gehalt an Lys und Thr zumeist noch durch den an Trp und an den schwefelhaltigen AS (Cys, Met) begrenzt. Sofern das Nahrungsproteingemisch mangelhaft mit unentbehrlichen AS ausgestattet ist, kann die ständig erforderliche Proteinresynthese nicht ordnungsgemäß gewährleistet werden. Konditionell unentbehrliche AS sind dadurch charakterisiert, dass sie der Zufuhr mit der Nahrung bedürfen, sobald die endogene Synthese infolge Krankheit oder Malnutrition den metabolischen Bedarf nicht deckt. Obwohl His in Tabelle 2 als unentbehrlich aufgeführt ist, erfüllt es, anders als die übrigen unentbehrlichen AS, nicht die üblicherweise angewandten Kriterien einer Verringerung der Proteineinlagerung und des Eintretens eines negativen Stickstoff-Gleichgewichts nach Ausschluss aus der Kost. Deshalb wird His nach wie vor oft als für den erwachsenden Menschen nicht essenziell betrachtet. In Bezug auf Bedarf und Empfehlungen differenziert man zwischen dem metabolischen AS-Bedarf (metabolic demand for amino acids), den über die Nahrung zum Decken des metabolischen Bedarfs aufzubringenden Mengen an Proteinen und/oder deren AS (dietary requirement) sowie der die Variabilität der individuellen Bedarfswerte berücksichtigenden empfohlenen Zufuhr (dietary allowance). Der metabolische AS-Bedarf ergibt sich aus der Notwendigkeit, den Gewebeproteinspiegel und die Versorgung mit allen benötigten Metaboliten aufrecht zu erhalten, die sich von AS ableiten. Des Weiteren ist es zwingend erforderlich, zusätzlich durch Wachstum, Rehabilitation, Schwangerschaft und Laktation erwachsende Bedarfslücken zu verhindern. Mit benötigten Metaboliten gemeint sind außer den bereits angeführten (Nukleinsäuren, Kreatin, Taurin, Glutathion und Stickstoffmonoxid sowie Signalmolekülen wie Agmatin und Neurotransmittern wie Serotonin) noch einige, bisher nicht erwähnte Hormone wie Catecholamine und Thyroxin. Der metabolische Bedarf wird aus dem in engen Grenzen regulierten Bestand der freien AS befriedigt. Zu dessen Erhalten trägt außer dem Nachschub aus der Nahrung und dem nach der Proteolyse im Proteinturnover aus Gewebeproteinen verfügbaren ASPool die De-novo-Synthese von AS bei. Eingeschlossen ist eine gewisse AS-Bildung, die bei der mikrobiellen Verwertung von Harnstoff im Dickdarm abläuft. Es wird angenommen, dass der sich auf irreversiblen Stoffwechselpfaden ergebende AS-Verlust gleich dem obligatorischen Stickstoffverlust ist. Darunter versteht man die Summe aller Stickstoffabgänge aus dem Organismus über die Niere (Urin), den Darm (Faezes), die Haut (Schweiß, Hautzellen) sowie über Nägel und Haare (durch Schneiden bzw. Ausfallen) und andere Wege, die bei einer zwar proteinfreien, aber anderweitig adäquaten Kostform über 7–14 Tagen gemessen werden. Diese betragen beim normalen Erwachsenen 47 mg/ kg/Tag. Bezogen auf die AS von Gewebeproteinen, entspricht das einem Äquivalent von 0,29 g Protein/kg/ Tag (g N x 6,25 = g Protein). Da jedoch die AS-Muster von Nahrungsproteinen nicht mit denen der menschlichen Gewebe übereinstimmen und dadurch so gut wie jedes zugeführte Protein „minderwertig“ ist, liegt das aktuelle Äquivalent gewöhnlich darüber. Außerdem enthält der metabolische AS-Bedarf noch adaptive Komponenten. Diese sind beispielsweise dadurch bedingt, dass die AS-Oxidation als Folge einer gesteigerten Stoffwechselaktivität (z. B. bei körperlicher Tätigkeit, Verletzungen oder Stress) mit dem habituellen Proteinverzehr variiert. Normalerweise werden allein vom Grundumsatz mindestens 20 % der Energie bestritten, um die erforderliche Biosynthese der Körperproteine aufrecht zu erhalten. In den US-amerikanischen Dietary Reference Intakes (DRI) von 2002 sind zum ersten Mal für alle unentbehrlichen AS alters- und z. T. ebenso geschlechtsabhängig „empfohlene Tageszufuhren“ (RDA) und für das 1. Lebenshalbjahr „angemessene Tageszufuhren“ (AI) angegeben worden. Die Zahlenwerte sind in Tabelle 4 aufgelistet. Ernährungs-Umschau 53 (2006) Heft 4 Basiswissen aktualisiert Die AI-Werte wurden aus Tab. 4: Empfohlene Zufuhren unentbehrlicher Aminosäuren [RDA (bzw. AI) in mg/kg/d] einer durchschnittlichen 0–6 Mon. 7–12 1–3 J. 4–8 J. 9–13 J. 14–18 J. ≥ 19 J. Schwan- StilStillmenge von 0,78 L/Tag (AI) Mon. 么 乆 么 乆 gere lende und einem Gehalt der Muttermilch an den einHistidin 23 (214 mg/d) 32 21 16 17 15 15 14 14 18 19 zelnen AS berechnet, der Isoleucin 88 (529 mg/d) 43 28 22 22 21 21 19 19 25 30 sich im Mittel aus einschläLeucin 156 (938 mg/d) 93 63 49 49 47 47 44 42 56 62 gigen UntersuchungsreiLysin 107 (640 mg/d) 89 58 46 46 43 43 40 38 51 52 hen ergeben hatte. GeMethionin wichtsbezogene AI-Anga+ Cystein 59 (353 mg/d) 43 28 22 22 21 21 19 19 25 26 ben beruhen auf einem Phenylalanin Referenzkörpergewicht von + Tyrosin 135 (807 mg/d) 84 54 41 41 38 38 35 33 44 51 6 kg. Threonin 73 (436 mg/d) 49 32 24 24 22 22 21 20 26 30 Für den Altersbereich Tryptophan 28 (167 mg/d) 13 8 6 6 6 6 5 5 7 9 des Wachstums (7 Monate Valin 87 (519 mg/d) 58 37 28 28 27 27 24 24 31 35 bis 18 Jahre) hat man sich einer faktoriellen Methode des AS-Bedarfs ähnlich derjenigen des bedient. Darin ist als Komponente Weiterführende Literatur: 1. Caballero B, Allen L, Prentice A (Eds.): EncycloProteinbedarfs ist, d. h., dass der Variazum einen der wachstumsbedingte pedia of Human Nutrition. Elsevier Academic tionskoeffizient des Mittelwertes 12 % Bedarf eingegangen. Dieser errechnet Press, Amsterdam 2005 beträgt. Das gilt auch für Schwangere sich aus der Rate der Proteineinlage2. Hahn A, Ströhle A, Wolters M: Ernährung. und Stillende (vgl. Teil 2). rung (Gewebeneubildung), der ASPhysiologische Grundlagen, Prävention, Therapie. Wiss. Verlagsgesellschaft mbH, Stuttgart Da es für Schwangere keine UnterZusammensetzung des Gesamtkör2005 suchungen zum AS-Bedarf gibt, wurde perproteins (Tab. 3) und der Effizienz 3. Rehner G, Daniel H: Biochemie der Ernährung. unterstellt, dass der Mehrbedarf an AS der Proteinverwertung (vgl. Teil 2). Spektrum Akad. Verl., Heidelberg, Berlin, 2. proportional zu dem an Protein ist. Zum anderen sind Ergebnisse experiAufl. 2002 4. Institute of Medicine of the National AcadeDer Quotient aus dem Durchschnittsmenteller Bestimmungen des Erhalmies: Dietary Reference Intakes for Energy, bedarf (g Protein/kg/TAG) schwangetungsbedarfs an unentbehrlichen AS Carbohydrate, Fiber, Fat, Fatty Acids, Cholestrer und nicht schwangerer Frauen bebei Kindern und Erwachsenen heranerol, Protein, and Amino Acids. The National trägt 0,88 : 0,66 = 1,33 (vgl. Teil 2). gezogen worden. Academies Press, Washington, D. C., 2002. 5. Gaßmann B : Übersicht, Kommentar und VerDementsprechend sind auch für die Um den Durchschnittsbedarf Ergleich mit den D-A-CH-Referenzwerten für unentbehrlichen AS der jeweilige wachsener an unentbehrlichen AS Protein und Aminosäuren. Ernährungs-UmDurchschnittsbedarf mit 1,33 multifestzulegen, wurde auf Ergebnisse schau 50 (2003) 178–183 pliziert und das Ergebnis abgerundet zahlreicher, mit verschiedenen Me6. Kasper H: Ernährungsmedizin und Diätetik. Urban & Fischer Verlag, München, Berlin, 10. worden. Für die Berechnung des ASthoden bzw. Kriterien (Stickstoffbilanz, Aufl. 2004 Durchschnittsbedarf von Stillenden direkte Aminosäuren-Oxidation, 24-hhat man den mittleren Gehalt der MutAminosäurenbilanz und Indikatortermilch an den einzelnen AS während Aminosäuren-Oxidation) durchgeder ersten 6 Stillmonate (ausgedrückt führter Untersuchungen zurückgegrifin mg/kg/Tag auf der Basis eines Refefen. Soweit sich dabei unterschiedlirenzgewichtes für erwachsene Frauen) che Resultate ergeben haben, ist als zum AS-Durchschnittsbedarf nicht Durchschnittsbedarf der Mittelwert stillender Frauen (in mg/kg/Tag) addaraus gebildet worden. Zur Ableitung diert. der jeweils empfohlenen Zufuhren Anschrift des Verfassers : (RDA) ist man angesichts der geringen Prof. Dr. Berthold Gaßmann Die Proteine werden im nachfolgenZahl verfügbarer Daten davon ausgeJean-Paul-Str. 12 den Teil 2 abgehandelt. gangen, dass die Standardabweichung 14558 Nuthetal Ernährungs-Umschau 53 (2006) Heft 4 141











