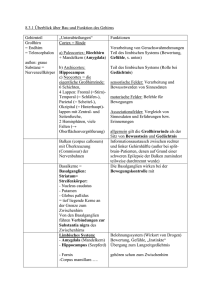
Peter Berlit (Hrsg.) Klinische Neurologie 2., aktualisierte Auflage
Werbung

Peter Berlit (Hrsg.) Klinische Neurologie 2., aktualisierte Auflage Peter Berlit (Hrsg.) Klinische Neurologie 2., aktualisierte Auflage Mit 564 Abbildungen in 851 Einzeldarstellungen, davon 53 in Farbe, 382 Tabellen und 201 Übersichten 123 Prof. Dr. Peter Berlit Alfried Krupp Krankenhaus Alfried-Krupp-Str. 21 45131 Essen ISBN-10 3-540-01982-0 2. Auflage Springer Medizin Verlag Heidelberg ISBN-13 978-3-540-01982-2 2. Auflage Springer Medizin Verlag Heidelberg Bibliografische Information der Deutschen Bibliothek Die Deutsche Bibliothek verzeichnet diese Publikation in der Deutschen Nationalbibliografie; detaillierte bibliografische Daten sind im Internet über http://dnb.ddb.de abrufbar. Dieses Werk ist urheberrechtlich geschützt. Die dadurch begründeten Rechte, insbesondere die der Übersetzung, des Nachdrucks, des Vortrags, der Entnahme von Abbildungen und Tabellen, der Funksendung, der Mikroverfilmung oder der Vervielfältigung auf anderen Wegen und der Speicherung in Datenverarbeitungsanlagen, bleiben, auch bei nur auszugsweiser Verwertung, vorbehalten. Eine Vervielfältigung dieses Werkes oder von Teilen dieses Werkes ist auch im Einzelfall nur in den Grenzen der gesetzlichen Bestimmungen des Urheberrechtsgesetzes der Bundesrepublik Deutschland vom 9. September 1965 in der jeweils geltenden Fassung zulässig. Sie ist grundsätzlich vergütungspflichtig. Zuwiderhandlungen unterliegen den Strafbestimmungen des Urheberrechtsgesetzes. Springer Medizin Verlag springer.com © Springer Medizin Verlag Heidelberg 1999, 2006 Printed in Germany Die Wiedergabe von Gebrauchsnamen, Warenbezeichnungen usw. in diesem Werk berechtigt auch ohne besondere Kennzeichnung nicht zu der Annahme, dass solche Namen im Sinne der Warenzeichen- und Markenschutzgesetzgebung als frei zu betrachten wären und daher von jedermann benutzt werden dürften. Produkthaftung: Für Angaben über Dosierungsanweisungen und Applikationsformen kann vom Verlag keine Gewähr übernommen werden. Derartige Angaben müssen vom jeweiligen Anwender im Einzelfall anhand anderer Literaturstellen auf ihre Richtigkeit überprüft werden. Planung: Renate Scheddin Projektmanagement: Meike Seeker Design u. Einbandgestaltung: deblik Berlin SPIN 10880177 Satz: Fotosatz-Service Köhler GmbH, Würzburg Druck- und Bindearbeiten: Stürtz GmbH, Würzburg Gedruckt auf säurefreiem Papier 2126 – 5 4 3 2 1 0 V Vorwort zur 2. Auflage Inzwischen hat die Klinische Neurologie nicht nur als Lehrbuch für angehende Fachärzte, sondern auch als Nachschlagewerk in der Praxis und Klinik ihren Platz gefunden. Dass die 1. Auflage in großer Zahl nachgedruckt werden musste, freut mich als Herausgeber sehr. Zu verdanken ist dies in erster Linie den engagierten Autoren der einzelnen Kapitel, die klinisch orientiert die Themen ausgewogen erarbeitet und dargestellt haben, wobei nie der Praxisbezug verloren gegangen ist. Für die 2. Auflage wurden sämtliche Kapitel komplett überarbeitet und aktualisiert. Neu aufgenommen wurde wegen der zunehmenden Bedeutung auch im klinischen Alltag ein Kapitel zur funktionellen Bildgebung. Das Kapitel zur neuropathologischen Diagnostik wurde komplett neu geschrieben, wobei der Schwerpunkt auf der Wertigkeit und Interpretation von Biopsien liegt. Anregungen und Änderungswünsche, die aus dem Leserkreis an uns herangetragen wurden, haben wir gerne aufgegriffen und berücksichtigt. In nahezu identischer Besetzung hat das alte und bewährte Autorenteam auch die 2. Auflage bearbeitet. Herausgeber und Autoren haben sich bemüht, einen einheitlichen Stil bei Berücksichtigung individueller Sichtweisen beizubehalten. Wir hoffen sehr, dass auch die 2. Auflage ihren Platz eher griffbereit auf dem Schreibtisch als in der Bibliothek findet und im klinischen Alltag gute Dienste leistet. Frau Seeker vom Springer Medizin Verlag danke ich für die gute Kooperation bei der Erstellung der 2. Auflage. Wie immer sind Anregungen und Verbesserungsvorschläge aus dem Leserkreis stets willkommen. Essen, im Herbst 2005 Peter Berlit VII Vorwort zur 1. Auflage Der angehende Arzt für Neurologie ist mit einem immensen Wissensstoff konfrontiert, welcher von den Grundlagenfächern Neuroanatomie, Neurophysiologie und Neuropathologie bis hin zu den Nachbarschaftsdisziplinen Psychiatrie, Psychosomatik, Neurochirurgie und Innere Medizin reicht. Das vorliegende Lehrbuch der klinischen Neurologie für Fachärzte will das erforderliche Wissen umfassend und praxisbezogen darstellen. Im Kernteil werden die in der klinischen Neurologie relevanten Krankheitsbilder lokalisations- und symptombezogen erarbeitet, wobei immer wieder Übersichten und Tabellen die relevanten Fakten zusammenfassen. Großer Wert wird auf eine einheitliche Kapitelstruktur gelegt, der sich – zum Teil murrend – die Autoren unterordnen mussten. Ihnen allen sei an dieser Stelle herzlich gedankt. Dem Leser soll die einheitliche Darstellung das Auffinden gesuchter Inhalte erleichtern und ein systematisches Lernen ermöglichen. Neben den neurophysiologischen und neurosonologischen Untersuchungsverfahren spielt in der klinischen Neurologie die bildgebende Diagnostik eine zentrale Rolle. Hier bin ich meinem neuroradiologischen Kollegen, Herrn Prof. Dr. Dietmar Kühne, besonders dankbar für seine beratende Tätigkeit bezüglich der Auswahl, Wertung und Beschriftung der radiologischen Abbildungen. Sofern dies im Text nicht anders vermerkt ist, stammen sämtliche neuroradiologischen Abbildungen aus dem Alfried Krupp Krankenhaus, um eine einheitliche Bildqualität zu gewährleisten. Es ist naturgemäß nicht einfach, bei vielen Autoren ein Buch »aus einem Guss« herzustellen. Jeder der Kapitelautoren hat sein Thema aber aus dem Klinikalltag erarbeitet und mit Praxisbezug dargestellt – der tagtägliche Umgang mit den neurologischen Krankheitsbildern ist den Kapiteln anzumerken. Bei allen Bemühungen um einen einheitlichen Stil sind individuelle Schwerpunkte in ihrer Wertung erhalten geblieben – gelegentliche Redundanzen aus der Sicht unterschiedlicher Autoren sind dabei durchaus erwünscht. Einen wesentlichen Anteil an der sprachlichen Strukturierung des Gesamtwerkes haben die Lektoren, Herr Dr. Stefan Meyring sowie Frau Dr. Karen Strehlow (Springer-Verlag), denen ich an dieser Stelle herzlich danke. Autoren und Herausgeber wünschen sich, daß das vorliegende Lehrbuch der klinischen Neurologie einen praktischen Begleiter im Praxis- und Klinikalltag, ein verlässliches Nachschlagewerk und eine kompetente Vorbereitungshilfe für die Facharztprüfung darstellt. Anregungen und Verbesserungsvorschläge aus dem Leserkreis sind uns stets willkommen. Essen, im Sommer 1999 Peter Berlit IX Inhaltsübersicht I Grundlagen . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1 II Muskelerkrankungen . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 229 III Erkrankungen des peripheren Nervensystems . . . . . . . . . . . . . . . . . . . . . . . . 305 IV Erkrankungen des Rückenmarks . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 457 V Erkrankungen des Gehirns und seiner Hüllen . . . . . . . . . . . . . . . . . . . . . . . . . 567 VI Multilokuläre neurologische Erkrankungen . . . . . . . . . . . . . . . . . . . . . . . . . . 1103 VII Neurologie und innere Medizin . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1223 VIII Neuropsychiatrie und Psychosomatik . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1285 IX Begutachtung und Rehabilitation . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1347 Farbtafeln Abkürzungsverzeichnis . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1381 Sachverzeichnis . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1385 XI Inhaltsverzeichnis I Grundlagen 1 Neuroanatomie . . . . . . . . . . . . . . . . . . . D. Graf von Keyserlingk III Erkrankungen des peripheren Nervensystems 3 13 Nervenwurzelläsionen . . . . . . . . . . . . . . 307 M. Stöhr 2 Neurophysiologie . . . . . . . . . . . . . . . . . . 32 R.F. Schmidt 3 Klinische Neurogenetik: DNA-Diagnostik und Beratungsaspekte . . Neurophysiologische Diagnostik . . . . . . . Läsionen peripherer Nerven . . . . . . . . . . 324 Bearbeitet von K. Scheglmann, Stephanie Gierer, Stephan Gierer, M. Stöhr 15 Erkrankungen der Hirnnerven und des Hirnstamms . . . . . . . . . . . . . . . . . . . 58 J.T. Epplen, A. Epplen 4 14 78 360 P. Berlit J.C. Wöhrle 16 5 Neurosonologische Diagnostik . . . . . . . . 114 Polyneuropathien . . . . . . . . . . . . . . . . . . 414 A. Engelhardt C. Klötzsch, R.R. Diehl 17 6 Liquordiagnostik . . . . . . . . . . . . . . . . . . 136 H. Reiber 7 8 171 Neuropathologische Beispiel-Diagnostik . . 199 IV 18 E. Neuen-Jacob 9 Muskelerkrankungen – Diagnostische Übersicht . . . . . . . . . . . . . . . . . . . . . . . . Erkrankungen des Rückenmarks Spinale Syndrome . . . . . . . . . . . . . . . . . 459 B. Ende-Henningsen 19 Muskelerkrankungen 439 D. Linden, R. R. Diehl Neuroradiologische Diagnostik . . . . . . . . A. Dörfler, M. Forsting, M. Rijntjes, C. Weiller II Erkrankungen des autonomen Nervensystems . . . . . . . . . . . . . . . . . . . . . . . . . Blasenfunktionsstörungen . . . . . . . . . . . 471 E. Möbius 20 231 Syringomyelie . . . . . . . . . . . . . . . . . . . . 482 H. Henningsen S. Zierz 21 10 Muskeldystrophien, Myotonien und metabolische Myopathien . . . . . . . . . . . . Entzündliche, endokrine und toxische Muskelerkrankungen . . . . . . . . . . . . . . . 480 S. Knecht 236 22 K. Eger, K. Traufeller, M. Deschauer, W. J. Schulte-Mattler, S. Zierz 11 Entzündliche Rückenmarkerkrankungen . . Vaskuläre Erkrankungen des Rückenmarks 499 H. Henningsen 23 Spinale Tumoren . . . . . . . . . . . . . . . . . . R. Reilmann, H. Henningsen 510 24 Funikuläre Myelose . . . . . . . . . . . . . . . . . 529 277 K. Traufeller, S. Zierz 12 Erkrankungen der neuromuskulären Übertragung . . . . . . . . . . . . . . . . . . . . . K. Traufeller, S. Zierz B. Ende-Henningsen 293 25 Zervikale Myelopathie . . . . . . . . . . . . . . 535 H. Henningsen 26 Motoneuronerkrankungen . . . . . . . . . . . A. C. Ludolph 541 XII Inhaltsverzeichnis 27 Toxische Myelopathien . . . . . . . . . . . . . . 561 41 A.C. Ludolph 28 Strahlenmyelopathie . . . . . . . . . . . . . . . 564 42 P. Berlit V Erkrankungen des Gehirns und seiner Hüllen 29 Funktion und Symptomatik einzelner Hirnregionen . . . . . . . . . . . . . . . . . . . . . Schädel-Hirn-Trauma . . . . . . . . . . . . . . . 1074 E. Rumpl Hirntod . . . . . . . . . . . . . . . . . . . . . . . . . 1096 P. Berlit, E. Rumpl VI Multilokuläre neurologische Erkrankungen 43 Multiple Sklerose . . . . . . . . . . . . . . . . . . 1105 H. Wiethölter 569 44 R.R. Diehl Leukodystrophien . . . . . . . . . . . . . . . . . 1138 H. Wiethölter 30 Kopf- und Gesichtsschmerzen . . . . . . . . . 587 45 Bearbeitet von R. F. Schmidt, H. D. Langohr, J. M. Klotz, P. Berlit 31 Hirntumoren . . . . . . . . . . . . . . . . . . . . . 630 Fehlbildungen des zentralen Nervensystems und des kraniozervikalen Übergangs . . . . . . . . . . . . . . . . . . . . . . . 1148 G. Göhlich, T. Voit J. Röther 46 32 Entzündliche Erkrankungen . . . . . . . . . . 664 Bearbeitet von E. Schmutzhard, W. Enzensberger, M. Schwarz 33 Liquorzirkulationsstörungen . . . . . . . . . . Stoffwechselerkrankungen des Nervensystems . . . . . . . . . . . . . . . . . . . 1156 G. Göhlich, T. Voit 47 Phakomatosen . . . . . . . . . . . . . . . . . . . . 1173 A. Ferbert, L. Bergmann 48 Vaskulitiden, rheumatoide Arthritis und Kollagenosen . . . . . . . . . . . . . . . . . 1183 709 J. Röther 34 Bewusstseinsstörungen . . . . . . . . . . . . . . 720 Bearbeitet von R.W.C. Janzen, P. Berlit 35 P. Berlit Die Epilepsien . . . . . . . . . . . . . . . . . . . . Bearbeitet von B. Tettenborn, A.-E. Bredel-Geissler, G. Krämer 741 Nichtepileptische Anfälle . . . . . . . . . . . . 799 49 50 36 Neurosarkoidose . . . . . . . . . . . . . . . . . . 1199 H. Wiethölter Paraneoplastische Syndrome . . . . . . . . . . 1204 P. Berlit K.-H. Krause 51 37 Störungen der Schlaf-Wach-Regulation . . 814 Alkoholfolgeerkrankungen . . . . . . . . . . . 1213 L. Bergmann, A. Ferbert K.-H. Krause 38 Demenzen . . . . . . . . . . . . . . . . . . . . . . . Bearbeitet von M. Hüll, J. Bauer, M. Daffertshofer 819 Bewegungsstörungen . . . . . . . . . . . . . . . 846 VII Neurologie und innere Medizin 52 Endokrine und Stoffwechselerkrankungen 1225 H.-C. Blossey 39 40 Bearbeitet von A. O. Ceballos-Baumann, M. Schwarz, K. Wessel, T. Weiland, S. Meyring 53 Vaskuläre Erkrankungen . . . . . . . . . . . . . 941 Bearbeitet von P. Berlit, C. Klötzsch, O. Popescu, J. Rudolf, M. Grond, E.B. Ringelstein, H. Griese, O. Busse, H.-C. Nahser, D. Kühne, E. Berg-Dammer, H. Henkes, W. Jänisch 54 Kardiale Erkrankungen . . . . . . . . . . . . . . 1243 T. Budde Gerinnungsstörungen . . . . . . . . . . . . . . 1264 P. T. Sawicki 55 Pulmonale Erkrankungen bei neurologischen Patienten . . . . . . . . . . . . 1278 G. Maschmeyer Inhaltsverzeichnis VIII Neuropsychiatrie und Psychosomatik 56 Psychiatrische Syndrome und Erkrankungen . . . . . . . . . . . . . . . . . . . . 1287 M. Grözinger, J. Röschke 57 Psychosomatik . . . . . . . . . . . . . . . . . . . . 1320 G. Heuft, M. Langkafel IX Begutachtung und Rehabilitation 58 Begutachtung in der neurologischen Rehabilitation . . . . . . . . . . . . . . . . . . . . 1349 P.-W. Schönle Farbtafeln Abkürzungsverzeichnis . . . . . . . . . . . . . . . . . . 1381 Sachverzeichnis . . . . . . . . . . . . . . . . . . . . . . . 1385 XIII XV Mitarbeiterverzeichnis Bauer, Joachim, Prof. Dr. Psychiatrische Universitätsklinik, Neurobiologisches Labor, Hauptstr. 5, 79104 Freiburg Daffertshofer, Michael, Priv.-Doz. Dr. Neurologische Universitäts-Klinik, Klinikum Mannheim, TheodorKutzer-Ufer, 68135 Mannheim Berg-Dammer, Elisabeth, Dr. Klinik für Neurologie mit Klinischer Neurophysiologie, Alfried Krupp Krankenhaus, Alfried-Krupp-Str. 21, 45131 Essen Bergmann, Lars, Dr. Neurologische Klinik, Städtische Kliniken Kassel, Mönchebergstr. 41–43, 34125 Kassel Berlit, Peter, Prof. Dr. Klinik für Neurologie mit Klinischer Neurophysiologie, Alfried Krupp Krankenhaus, Alfried-Krupp-Str. 21, 45131 Essen Blossey, Hans-Christian, Prof. Dr. Arzt für Innere Medizin – Endokrinologie, Wilhelmshöher Allee 253–255, 34131 Kassel Epplen, Jörg Thomas, Prof. Dr. Institut für Molekulare Humangenetik der Ruhr-Universität Universitätsstr. 150, 44780 Bochum Ferbert, Andreas, Prof. Dr. Deschauer, Marcus, Priv.-Doz. Dr. Universitätsklinik und Poliklinik für Neurologie, Martin-LutherUniversität Halle-Wittenberg, Ernst-Grube-Str. 40, 06097 Halle (Saale) Diehl, Rolf R., Priv.-Doz. Dr. Klinik für Neurologie mit Klinischer Neurophysiologie, Alfried Krupp Krankenhaus, Alfried-Krupp-Str. 21, 45131 Essen Neurologische Klinik, Städtische Kliniken Kassel, Mönchebergstr. 41 – 43, 34125 Kassel Forsting, Michael, Prof. Dr. Neuroradiologische Abteilung, Universitätsklinikum Essen, Hufelandstr. 55, 45122 Essen Gierer, Stephan, Dr. Königstr. 23, 89407 Dillingen Gierer, Stephanie, Dr. Dörfler, Arnd, Prof. Dr. Abteilung für Neuroradiologie, Friedrich-Alexander-Universität Erlangen-Nürnberg, Schwabachanlage 6, 91054 Erlangen Königstr. 23, 89407 Dillingen Göhlich, Gudrun, Dr. Kinder- und Jugendärztin, Neuropädiatrie, Wiederholdstr. 24, 70174 Stuttgart Eger, Katharina, Dr. Griese, Harald, Dr. Klinik und Poliklinik für Neurologie, Johannes Gutenberg-Universität Mainz, Langenbeckstr. 1, 55131 Mainz Universitätsklinik und Poliklinik für Neurologie, Martin-LutherUniversität Halle-Wittenberg, Ernst-Grube-Str. 40, 06097 Halle (Saale) Budde, Thomas, Prof. Dr. Ende-Henningsen, Bettina, Dr. Klinik für Innere Medizin I und Kardiologie, Alfried Krupp Krankenhaus, Alfried-Krupp-Str. 21, 45131 Essen Am Eiskeller 14, 21339 Lüneburg Neurologische Abteilung, Kreiskrankenhaus Siegen, Weidenauer Str. 76, 57076 Siegen Engelhardt, Andreas, Prof. Dr. Grözinger, Michael, Priv.-Doz. Dr. Busse, Otto, Prof. Dr. Neurologische Klinik, Evangelisches Krankenhaus, Steinweg 13 – 17, 26122 Oldenburg Psychiatrische Universitätsklinik, RWTH Aachen, Pauwelsstr. 30, 52074 Aachen Postfach 2265, 32379 Minden Enzensberger, Wolfgang, Prof. Dr. Henkes, Hans, Priv.-Doz. Dr. Ceballos-Baumann, Andrés O., Prof. Dr. Privatpraxis für Neurologie, Gartenstr. 134, 60596 Frankfurt Neurologisches Krankenhaus, Tristanstr. 20, 80804 München Klinik für Allgemeine Röntgendiagnostik und Neuroradiologie, Alfried Krupp Krankenhaus, Alfried-Krupp-Str. 21, 45131 Essen Epplen, Andrea, Dr. Bredel-Geissler, Anne-Elisabeth, Dr. Institut für molekulare Humangenetik der Ruhr-Universität, Universitätsstr. 150, 44780 Bochum Klinik für Rehabilitation, Am Brinkkamp 15, Bad Oeynhausen Grond, Martin, Prof. Dr. Henningsen, Henning, Prof. Dr. Klinik für Neurologie, Städtisches Klinikum Lüneburg, Bögelstr. 1, 21339 Lüneburg XVI Mitarbeiterverzeichnis Heuft, Gereon, Prof. Dr. Kühne, Dietmar, Prof. Dr. Popescu, Octavian, Dr. Klinik und Poliklinik für Psychosomatik und Psychotherapie, Westfälische Wilhelms-Universität Münster, Domagkstr.11, 48149 Münster Klinik für Allgemeine Röntgendiagnostik und Neuroradiologie, Alfried Krupp Krankenhaus, Alfried-Krupp-Str. 21, 45131 Essen Arzt für Neurologie, Schillerstr. 14, 72160 Horb Reiber, Hansotto, Prof. Dr. Mühlenstr. 3c, 37073 Göttingen Langkafel, Mathias, Dr. Hüll, Michael, Priv.-Doz. Dr. Klinikum der Albert-LudwigsUniversität Freiburg, Universitätsklinik für Psychiatrie und Psychosomatik, Hauptstr. 5, 79104 Freiburg Jänisch, Werner, Prof. Dr. Klinik für Psychotherapie und Psychosomatik, Universitätsklinikum Essen, Virchowstr. 174, 45147 Essen Langohr, Hans Dieter, Prof. Dr. Klinik für Neurologie und Neurophysiologie, Städtisches Klinikum Fulda, Pacelliallee 4, 36043 Fulda Zu den Eichen 2, 14772 Brandenburg Linden, Dieter, Dr. Janzen, Rudolf W. C., Prof. Dr. Neurologische Klinik, Krankenhaus Nordwest, Steinbacher Hohl 2–26, 60488 Frankfurt Keyserlingk, Diedrich Graf von, Prof. Dr. Institut für Anatomie I, Universitätsklinikum der RWTH Aachen, Pauwelsstr. 30, 52074 Aachen Klotz, Jürgen M., Dr. Klinik für Neurologie und Neurophysiologie, Städtisches Klinikum Fulda, Pacelliallee 4, 36043 Fulda Klinik für Neurologie mit Klinischer Neurophysiologie, Alfried Krupp Krankenhaus, Alfried-Krupp-Str. 21, 45131 Essen Ludolph, Albert C., Prof. Dr. Neurologische Universitäts-Klinik, Steinhövelstr. 9, 89075 Ulm Abteilung Akutneurologie der Kliniken Schmieder, Zum Tafelholz 8, 78476 Allensbach Klinik und Poliklinik für Neurologie, Westfälische Wilhelms-Universität Münster, Albert-Schweitzer-Str. 33, 48129 Münster Rijntjes, Michel, Dr. Klinik und Poliklinik für Neurologie, Universitätskrankenhaus HamburgEppendorf, Martinistr. 52, 20246 Hamburg Ringelstein, E. Bernd, Prof. Dr. Klinik und Poliklinik für Neurologie, Westfälische Wilhelms-Universität, Albert-Schweitzer-Str. 33, 48129 Münster Röschke, Joachim, Prof. Dr. Maschmeyer, Georg, Prof. Dr. Medizinische Klinik Hämatologie und Onkologie, Klinikum Ernst von Bergmann, Charlottenstr. 72, 14467 Potsdam Meyring, Stefan, Dr. Klötzsch, Christof, Prof. Dr. Reilmann, Ralf, Dr. Neurologische Abteilung, St. Lukas Klinik, Schwanenstr. 132, 42697 Solingen St. Valentinus Krankenhaus, Suttonstr. 24, 65399 Kiedrich Röther, Joachim, Prof. Dr. Neurologische Klinik, Klinikum Minden, Friedrichstr. 17, 32427 Minden Rudolf, Jobst, Priv.-Doz. Dr. Adelfon Emmanuil 16, Kato Toumba, 54454 Thessaloniki, Griechenland Möbius, Eckhard, Dr. Knecht, Stefan, Prof. Dr. Klinik und Poliklinik für Neurologie, Westfälische Wilhelms-Universität, Albert-Schweitzer-Str. 33, 48129 Münster Klinik für Neurologie mit Klinischer Neurophysiologie, Alfried Krupp Krankenhaus, Alfried-Krupp-Str. 21, 45131 Essen Rumpl, Erik, Prof. Dr. Neurologische Abteilung, Landeskrankenhaus Klagenfurt St. Veiter Str. 47, 9026 Klagenfurt, Österreich Nahser, Hans-Christean, Dr. Krämer, Günter, Dr. Schweizerische Epilepsie-Klinik, Bleulerstr. 60, 8008 Zürich, Schweiz Krause, Klaus-Henning, Prof. Dr. Friedrich-Baur-Institut, Medizinische Universitätsklinik Innenstadt, Ziemssenstr. 1a, 80336 München Consultant Neuroradiologist, The Walton Centre for Neurology and Neurosurgery, Lower Lane, Fazakerley, Liverpool L9 7LJ, Großbritannien Sawicki, Peter T., Prof. Dr. Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen, Dillenburger Str. 27, 51105 Köln Scheglmann, Konrad, Dr. Neuen-Jacob, Eva, Priv.-Doz. Dr. Institut für Neuropathologie, Universitätsklinikum Düsseldorf, Moorenstr. 5, 40225 Düsseldorf Neurologische Klinik, Zentralklinikum Augsburg, Stenglinstr. 2, 86156 Augsburg XVII Mitarbeiterverzeichnis Schmidt, Robert F., Prof. Dr. Weiland, Tobias, Dr. Physiologisches Institut der Universität Würzburg, Röntgenring 9, 97070 Würzburg Neurologische Klinik, Städtisches Klinikum, und Forschungsgesellschaft für Kognitive Neurologie, Institut an der TU Braunschweig, Salzdahlumer Str. 90, 38126 Braunschweig Schmutzhard, Erich, Prof. Dr. Universitätsklinik für Neurologie, Neurologische Intensivstation, Anichstr. 35, 6020 Innsbruck, Österreich Weiller, Cornelius, Prof. Dr. Schönle, Paul-Walter, Prof. Dr. Dr. Neurologische Universitätsklinik, Universitätsklinikum Freiburg, Breisacherstr. 64, 79106 Freiburg NRZ Magdeburg, Gustav-Ricker-Str. 4, 39120 Magdeburg Wessel, Karl, Prof. Dr. Neurologische Klinik und Poliklinik, Universität Regensburg, Universitätsstr. 84, 93053 Regensburg Neurologische Klinik, Städitsches Klinikum, und Forschungsgesellschaft für Kognitive Neurologie, Institut an der TU Braunschweig, Salzdahlumer Str. 90, 38126 Braunschweig Schwarz, Michael, Prof. Dr. Wiethölter, Horst, Prof. Dr. Neurologische Klinik, Städtische Kliniken Dortmund, Beurhausstr. 40, 44137 Dortmund Bürgerhospital, Neurologische Klinik, Tunzhofer Str. 14–16, 70191 Stuttgart Schulte-Mattler, Wilhelm J., Priv.-Doz. Dr. Wöhrle, Johannes C., Priv.-Doz. Dr. Stöhr, Manfred, Prof. Dr. Fritz-Strassmannstr. 35, 86156 Augsburg Neurologische Klinik im Klinikum der Stadt Mannheim der Universität Heidelberg, Theodor-Kutzer-Ufer 1–3, 68135 Mannheim Tettenborn, Barbara, Priv.-Doz. Dr. Klinik für Neurologie, Kantonsspital St. Gallen, Rohrschacherstr. 95, 9007 St. Gallen, Schweiz Traufeller, Kathrin, Dr. Universitätsklinik und Poliklinik für Neurologie, Martin-Luther-Universität Halle-Wittenberg, Ernst-Grube-Str. 40, 06097 Halle (Saale) Voit, Thomas, Prof. Dr. Klinik und Poliklinik für Kinderund Jugendmedizin, Zentrum für Kinderheilkunde, Abteilung für Allgemeine Pädiatrie, Universitätsklinikum Essen, Hufelandstr. 55, 45122 Essen Zierz, Stephan, Prof. Dr. Universitätsklinik und Poliklinik für Neurologie, Martin-Luther-Universität Halle-Wittenberg, Ernst-Grube-Str. 40, 06097 Halle (Saale) I Grundlagen 1 Neuroanatomie – 3 D. Graf von Keyserlingk 2 Neurophysiologie – 32 R. F. Schmidt 3 Klinische Neurogenetik: DNA-Diagnostik und Beratungsaspekte – 58 J.T. Epplen, A. Epplen 4 Neurophysiologische Diagnostik – 78 J. C. Wöhrle 5 Neurosonologische Diagnostik – 114 C. Klötzsch, R. R. Diehl 6 Liquordiagnostik – 136 H. Reiber 7 Neuroradiologische Diagnostik – 171 A. Dörfler, M. Forsting, M. Rijntjes, C. Weiller 8 Neuropathologische Biopsie-Diagnostik – 199 E. Neuen-Jacob 1 1 Neuroanatomie D. Graf von Keyserlingk 1.1 Großhirnrinde: Neokortex – 3 1.1.1 1.1.2 1.1.3 Allgemeiner Aufbau – 3 Topographische Organisation – 4 Element des Neokortex – 6 1.6.2 1.6.3 Element der Formatio reticularis – 17 Leitungsbahnen – 18 1.7 Aktivierungssysteme – 18 Klassisches Aktivierungssystem – 19 Serotoninerges System – 20 Noradrenerges System – 21 Dopaminerges System – 21 Cholinerges System – 22 1.2 Limbisches System – 7 1.2.1 1.2.2 1.2.3 Archilimbisches System – 7 Element der Hippokampusformation – 8 Paleolimbisches System – 9 1.7.1 1.7.2 1.7.3 1.7.4 1.7.5 1.3 Basalganglien – 10 1.8 Rückenmark – 22 1.3.1 1.3.2 Topographische Organisation – 10 Element der Basalganglien – 11 1.8.1 1.8.2 1.8.3 Topographische Organisation der Afferenzen – 22 Topographische Organisation der Efferenzen – 24 Element des Rückenmarks – 25 1.4 Thalamus – 12 1.4.1 1.4.2 Topographische Organisation – 12 Element des Thalamus – 14 1.9 Blutversorgung – 26 1.9.1 1.9.2 1.9.3 1.9.4 1.9.5 1.9.6 Arterien des Gehirns – 26 Circulus Willisii – 29 Arterien des Rückenmarks – 29 Venen des Gehirns – 29 Sinus durae matris – 30 Venen des Rückenmarks – 31 1.5 Kleinhirn – 14 1.5.1 1.5.2 Topographische Organisation – 15 Element des Kleinhirns – 15 1.6 Hirnstamm – 16 1.6.1 Topographische Organisation – 16 Neurologische Beobachtungen in der Klinik lassen sich häufig auf die Anatomie und die Entwicklungsgeschichte des Nervensystems zurückführen. Wenn man in der Vielzahl der Strukturen und Zusammenhänge des Gehirns versucht, wesentliche Bauprinzipien zu erkennen, so fallen vor allem zwei Gegebenheiten auf: der modulare Aufbau und die topographische Organisation des zentralen Nervensystems. Modularer Aufbau heißt, dass die Gehirnteile aus vielen kleinen, in gewissen Grenzen variierenden Elementen bestehen. Die topographische Organisation und der Bau aus modularen Elementen sind im Folgenden in den Vordergrund gestellt worden, weil beide zusammen dazu führen, das Gehirn als Ganzes zu verstehen. Literatur – 31 1.1 Großhirnrinde: Neokortex 1.1.1 Allgemeiner Aufbau Die Oberflächenansicht des Großhirns ist durch Gyri und Sulci gekennzeichnet. Die Orientierungsfurche auf der lateralen Ansicht ist der Sulcus lateralis, auch Fissura Sylvii genannt (⊡ Abb. 1.1 a). Der R. posterior des Sulcus lateralis trennt den Frontallappen und den Parietallappen vom Temporallappen und liefert den Zugang zur Insel. Der R. horizontalis und der R. ascendens schneiden in den Gyrus frontalis inferior ein. Die zweite Hauptfurche ist der Sulcus centralis, der 1 cm hinter dem Scheitelpunkt der Mantelkante beginnt und in einem Winkel von etwa 70° gegen die Horizontale nach vorn in Richtung auf den Sulcus lateralis zieht. Der Sulcus centralis trennt den Frontallappen vom Parietallappen. Auf der Medianseite (⊡ Abb. 1.1 b) kennzeichnet vorne der Sulcus cinguli die Mitte zwischen Balken und Mantelkante. Der Sulcus calcarinus beginnt wenige Millimeter vom Okzipitalpol entfernt und verläuft S-förmig in Richtung auf das Splenium des Balkens. Er mündet in den Sulcus parietooccipitalis, der den Parietal- 4 Kapitel 1 · Neuroanatomie A 1 ruft (Areae corticae, Rindenfelder). Ein Rindenfeld ist definitionsgemäß ein Rindenbezirk, der durch einheitlichen Schichtenaufbau gekennzeichnet ist und sich vom Schichtenbau des benachbarten Feldes unterscheidet. 5 7 8 9 39 44 47 18 22 37 21 38 20 B a 1.1.2 Topographische Organisation 40 46 45 11 2 4 6 10 31 43 41 17 19 42 52 C 3 1 6 8 2 4 32 9 5 24 7 23 10 D 19 31 25 34 11 28 38 b 18 F 37 20 36 35 18 19 E 17 26 ⊡ Abb. 1.1 a, b. Laterale (a) und mediane (b) Ansicht der Großhirnhemisphäre mit Brodmann-Arealen. A Sulcus centralis, B Sulcus lateralis, C Sulcus cinguli, D Sulcus parietooccipitalis, E Sulcus calcarinus, F Sulcus collateralis. Die Zahlen geben die entsprechenden Brodmann-Areale an lappen vom Okzipitallappen trennt. Der Sulcus collateralis trennt den medialen Teil des Temporallappens vom lateralen. Die Großhirnrinde besitzt einen entwicklungsgeschichtlich jüngeren Teil, den Neokortex, und einen entwicklungsgeschichtlich älteren Teil, den limbischen Kortex. Die Rinde besteht aus Gruppen zusammengehörender Nervenzellen, die die Rinde säulenförmig bzw. streifenförmig senkrecht durchsetzen (Columnae corticae, Rindensäulen). Die Nervenzellen einer Säule reagieren gleich auf ein experimentelles Merkmal. Die Ausdehnung einer Säule beträgt je nach Lokalisation in der Großhirnrinde zwischen 0,03 und 0,5 mm. Die Säulen können auch ineinander verschachtelt sein. Säulen verschiedener Lokalisation und Funktion unterscheiden sich histologisch in Größe, Art und Dichte der Nervenzellen. Die seitliche Aneinanderreihung von Säulen gleichen Typs führt zu der charakteristischen Lamellierung der Rinde, die mikroskopisch die Erscheinung eines Feldes hervor- Die topographische Organisation des Neokortex prägt sich in der histologischen Felderung der Großhirnrinde aus. Diese Felderung diente schon lange als Grundlage für Hirnkarten. Die zytoarchitektonische Karte von Brodmann ist die älteste und nach Verbesserung durch die myeloarchitektonischen Befunde von Vogt auch heute noch die gebräuchlichste histologische Karte (⊡ Abb. 1.1). Anderen Hirnkarten liegen elektrophysiologische Messungen zugrunde. In der Terminologie dieser Karten steht M für Motorik, S für Sensibilität, V für Vision und A für Akustik. Je nach Art der Informationsverarbeitung in den Feldern unterscheidet man Projektionsareale, unimodale und multimodale Assoziationsareale in der Großhirnrinde. Motorische Rinde Zur motorischen Rinde gehören alle Regionen des Frontallappens, von denen sich eine Bewegung durch elektrische Reizung auslösen lässt. Es sind dies das motorische Projektionsareal, Area 4 nach Brodmann, das unimodale Assoziationsfeld mit Area 6 (M I – Area 4 und 6), das supplementäre motorische Areal, das Augenfeld, Teil der Area 8, und ein Teil der Broca-Region, Area 44 (⊡ Abb. 1.1). Im Motorkortex ist die gegenüberliegende Körperhälfte kaudal/kranial von der dorsalen Mantelkante nach lateral bis an den Sulcus lateralis heran repräsentiert. Weiterhin gibt es eine anterior-posteriore Ordnung. Anterior in der Area 6 liegt der Bewegungsbeginn, ausgehend von der Halte- und Stellmotorik des Rumpfes, während posterior in der Area 4, am Sulcus centralis, die differenzierte willkürliche Feinmotorik folgt. Die Halte- und Stellmotorik, die mit wenigen, großen motorischen Einheiten reguliert, nimmt weniger Raum in der Großhirnrinde ein als die Feinmotorik mit vielen, kleinen motorischen Einheiten. Eine Rindensäule (sog. motorische Kolonie) mit Nervenzellen, die für eine bestimmte Bewegung zuständig sind, hat einen Durchmesser von etwa 0,5 mm. Rindensäulen für verschiedene Bewegungen sind miteinander vermischt. Man spricht von frakturierter Repräsentation von Bewegungen. Die Säulen für eine bestimmte Bewegung sind an einer Stelle konzentriert; dort liegt das Epizentrum, von dort ausgehend sind die Säulen lockerer verteilt. Für die Verwirklichung einer Bewegung müssen mehrere solcher Säulen, eine Mikrozone, aktiviert werden. Eine Mikrozone setzt sich je nach Bewegungsziel und Verbindung mit anderen Bewegungen aus verschiedenen Säulen zusammen. Die Kolonien der proximalen Stellmotorik umgeben wie ein Nest die Regionen der 5 1.1 · Großhirnrinde: Neokortex 6 5 3 1 4 2 ⊡ Abb. 1.2. Somatotope Abbildungen in der Großhirnrinde. 1 Somatosensibles Areal SI, 2 somatosensibles Areal SII, 3 motorisches Areal (Feinmotorik) am Sulcus centralis, 4 frontales Augenfeld, 5 prämotorisches Areal (Halte- und Stellmotorik), 6 supplementäres Areal distalen Feinmotorik. Die Regionen der Feinmotorik sind daher voneinander abgesetzt ( Homunkulus in Abb. 1.2). Im unimodalen Assoziationsfeld, Area 6, beginnt der Bewegungsablauf. Erst wird die für die geplante Bewegung erforderliche Körperstellung eingenommen, dann folgt die Feststellung der großen Gelenke und des Halteapparates, und erst dann werden die fein differenzierten Bewegungen der Hände, Füße, des Gesichts, der Zunge und der Stimmbildung ausgeführt. Das supplementäre motorische Feld, das im Gegensatz zur M I bilateral projiziert, hat eine Bedeutung für den Bewegungsentwurf und für den Beginn der Willkürbewegung. Schon die gedankliche Vorstellung einer Bewegung führt zu einer erhöhten Durchblutung des supplementären Feldes. Eine aktivierte Mikrozone im motorischen und prämotorischen Feld muss jedoch nicht notwendig zur Kontraktion führen. Die Ausführung kann durch präfrontale Neurone blockiert werden. Sensible Rinde Die Empfindungen des Körpers laufen im vorderen Parietallappen zusammen. Es gibt 2 sensible Felder, S I und S II. Der Gyrus postcentralis beherbergt S I, welches die Projektionsareale Area 3a und 3b sowie die unimodalen Assoziationsareale 2, 1 und 5 umfasst. Die Größe der Abbildung der Körperteile ist proportional zur Dichte der Rezeptoren in der Peripherie (⊡ Abb. 1.2). Der Streifen 3a liegt im Grund des Sulcus centralis, hier enden die Projektionen der Tiefensensibilität und dazu Informationen aus dem vestibularen Organ. Der Streifen 3b befindet sich in der Hinterwand des Sulcus centralis. Hier landen die Afferenzen von der Körperoberfläche. Im folgenden Streifen, Area 1, in der Kuppel des Gyrus postcentralis werden Tiefen- und Oberflächensensibilität spiegelbildlich zusammengeführt. Im nächsten Streifen, Area 2, sind die Neurone nicht mehr empfindlich auf einzelne Reize, sondern reagieren auf Reizserien, d. h. Reize in bestimmter Reihenfolge. In der Area 5 ist die Aktivität der Zellsäulen abhängig von Reizfolgen und dazu von der Ausgangsstellung der Gelenke. S II liegt im parietalen Operculum und entspricht den Brodmann-Arealen 40 und 43 (⊡ Abb. 1.1 und 1.2). Das sensible Feld S II enthält eine grobe Somatotopie. Aktivitätssteigerungen von Rindenneuronen lassen sich hier kontralateral und ipsilateral auslösen. Die sensible Rinde projiziert in den Motorkortex. Die Sensibilität ist unverzichtbare Voraussetzung für den geordneten Ablauf von Bewegungen. Sie ist weiterhin erforderlich für die intellektuelle Vorstellung vom eigenen Körper und die Einordnung des eigenen Körpers im umgebenden Raum. Die Vorstellung von Tastempfindungen sind zusammen mit Erfahrungen des Hörens und Sehens wichtig für abstrakte Begriffsbildungen und das Denken. Akustische Rinde Die Hörrinde liegt auf der Oberseite des Gyrus temporalis superior in der Heschl-Querwindung sowie in der umgebenden Rinde. Im akustischen Projektionsfeld A I entsprechend Area 41 und 42 nach Brodmann (⊡ Abb. 1.1) und in umgebenden unimodalen Assoziationsfeldern findet man eine tonhöhenabhängige Empfindlichkeit der Nervenzellen, eine tonotopische Gliederung. Im Projektionsfeld A I liegt die Empfindlichkeit auf tiefe Töne lateral, die auf hohe Töne inselnah. Ventrolateral schließt sich das akustische Feld A II an, welches nicht tonotopisch geordnet ist. In der Hörrinde sind einfache und komplexe akustische Signale in Rindensäulen kodiert. Säulen mit komplexen Reaktionen sind notwendig zum Musikverständnis, zur Einordnung von Geräuschen und zur Erkennung der phonetischen Elemente der Sprache. Visuelle Rinde Die Sehrinde nimmt beim Menschen einen großen Teil der Großhirnrinde ein. Sie dehnt sich als Projektionsfeld Area 17 (V1) tief in der Furche des Sulcus calcarinus aus. Es schließt sich die unimodale Assoziationsrinde mit der Area 18 (V2) und mit der Area 19 (V3 und V4) an. Das visuelle System reicht über den Okzipitallappen hinaus. Es schließt ein das mittlere temporale Feld, MT (V5), das an der Hinterwand des okzipitalen Endes des Sulcus temporalis superior liegt, und das mediale superiore temporale Feld, MST (V5a), das an der gegenüberliegenden Vorderwand des Sulcus temporalis liegt. Auch das inferotemporale Feld mit den Brodmann-Arealen 20 und 21 ist Teil des visuellen Systems. Im Projektionsfeld Area 17 vereinigen sich die Informationen, die vom kontralateralen Gesichtsfeld über rechtes 1 6 1 Kapitel 1 · Neuroanatomie und linkes Auge aufgenommen wurden. Die sich aus den beiden Blickwinkeln ergebenden Unterschiede werden zur Abschätzung der Raumtiefe genutzt. In der Sehrinde lassen sich zwei Informationswege, deren Anfänge schon in der Retina liegen, unterscheiden. Der Weg der Informationen des räumlichen Sehens und der Bewegung von Gegenständen in der Raumtiefe verläuft vom Projektionsfeld V1 über die Felder V2 und V3 zum mittleren Temporalfeld, V5, sowie zum medialen, superioren Temporalfeld, V5a, und von dort über das Brodmann-Areal 7 zum motorischen frontalen Augenfeld. Der zweite Weg beginnt schon abgesetzt vom ersten in der Area 17, läuft getrennt weiter in den Feldern V2 und V3, mündet in das Feld V4, in dem die farbempfindlichen Zellen konzentriert sind, und setzt sich in die infratemporale Region zur differenzierten Formerkennung fort. Differenzierte Formerkennung bedeutet Identifizierung von Gesichtern, Handstellungen und komplizierten Schriftzeichen. Der erste Weg befasst sich – vereinfacht gesagt – mit dem Wo im Raum, der zweite Weg mit dem Was im Gesichtsfeld. Multimodale Assoziationsrinde Es gibt zwei multimodale Rindengebiete. Das hintere befindet sich am parietotemporalen Übergang und das vordere vor der motorischen Rinde im Frontallappen. Die parietotemporale multimodale Assoziationsrinde mit den parietalen Arealen 7, 39 und 40 und den temporalen 22, 21 und 20 (⊡ Abb. 1.1) ist umgeben von unimodalen Assoziationsgebieten des Fühlens, des Sehens und des Hörens. Beispielsweise findet man in der Area 7 Zellsäulen, die nur auf visuelle Reize reagieren, andere, die nur bewegungssensibel sind, und schließlich multimodale, die sowohl auf visuelle als auch auf bewegungsausgelöste Reize reagieren. Die Neurone letzterer Art steigern ihre Aktivität bei Zielbewegungen im Gesichtsfeld. Die genannten Rindensäulen sind vermischt. Alle multimodalen Gebiete sind beim Menschen wesentlich ausgedehnter als beim Affen und lassen sich daher nicht genau tierexperimentell untersuchen. Die Funktionen werden aus klinischen Beobachtungen geschlossen. Bei 95% der Menschen liegt die Sprachfunktion in der linken Hemisphäre, die dann als sprachdominant bezeichnet wird. Im hinteren Ende der Area 22 mit Übergang in die Area 39 und 40 befindet sich das sensorische oder Wernicke-Sprachareal, in dem akustische, visuelle und sensible Reize zu sprachlichen Begriffen vereinigt werden. Umgeben ist das Wernicke-Sprachfeld nach anterior von einer Region, die für das Verständnis von Geräuschen und von gesprochenen Worten verantwortlich ist; nach okzipital liegt die Region für das Erkennen und Benennen visueller Objekte, nach parietal die Region für das Erkennen und Lesen von Buchstaben und Zahlen. Auf der gegenüberliegenden, nicht sprachdominanten Seite liegt das Verständnis für graphische Repräsentationen, Gestik, Mimik und musikalische Interpretation. Es handelt sich um abstrakte, den eigenen und den umgebenden Raum betreffende Einheiten. Das vordere multimodale Assoziationsareal entspricht dem präfrontalen Areal. Mit elektrischer Reizung der präfrontalen Rinde lassen sich keine Bewegungen auslösen. Das präfrontale Areal liegt vor der motorischen und der prämotorischen Rinde im Frontallappen. Ein Kennzeichen der präfrontalen Neurone, die wie überall in Säulen geordnet sind, ist eine länger anhaltende Aktivitätssteigerung nach einem Reiz, wenn ein zweiter damit in Zusammenhang stehender Reiz zu erwarten ist. Die Reaktion erfolgt auf den zweiten Reiz, nach der Regel: wenn … und wenn…, dann. Das Intervall zwischen Ankündigungs- und Auslösungsreiz kann bis zu 1 min dauern. Eine grobe topographische Ordnung scheint auch im präfrontalen Kortex zu bestehen. In der Area 9, die vor dem frontalen Augenfeld liegt, muss der Auslösereiz einen räumlichen Bezug haben. In der Area 10 muss der Ankündigungsreiz einen räumlichen Bezug haben. In der dem Orbitadach aufliegenden Rinde, Area 11 und 12, reagieren die Zellen auf visuelle, akustische, gustatorische oder olfaktorische Reize nur, wenn ein emotioneller Bezug besteht, d.h. die Reize müssen für das Tier mit einer angenehmen oder unangenehmen Erinnerung verbunden sein. 1.1.3 Element des Neokortex Funktionelle Einheit des Neokortex ist eine Rindensäule, die definitionsgemäß einheitlich auf ein experimentelles Merkmal reagiert. Eine Rindensäule besteht aus vielen Zellen. Die Neurone der Rinde sind zu 80% Projektionsneurone, die histologisch als Pyramidenzellen erscheinen, und zu 20% Interneurone. Alle Axone, die die Rinde verlassen, stammen von Pyramidenzellen. Der Transmitter der Pyramidenzellen ist das exzitatorisch wirkende Glutamat. Die Großhirnrinde wirkt daher auf alle nachgeschalteten Neurone exzitatorisch. Die rückläufigen Axonkollateralen der Pyramidenzellen enden an inhibitorischen Interneuronen. Aktivierte Pyramidenzellen erzeugen daher eine umgebende Hemmung (⊡ Abb. 1.3). Die wichtigsten Interneurone sind die Kandelaberzellen und die Korbzellen, die mit GABA als Transmitter am Dendritenstamm bzw. am Perikaryon der Pyramidenzellen hemmend wirken. Die Doppelbouquetzellen sind ebenso inhibitorische Interneurone, die aber an inhibitorischen Interneuronen ansetzen und so die Pyramidenzellen enthemmen können. Die bipolaren Zellen besitzen senkrecht ausgerichtete Dendriten und Axone, die sich nur in einem schmalen Sektor ausbreiten. Ihre Axone enden an Nervenzellen und an Blutgefäßen. Sie setzen bei Aktivierung das vasoaktive intestinale Polypeptid (VIP) frei und fördern den Glukosestoffwechsel der Nervenzellen und die lokale Durchblutung. Die Afferenzen stammen aus 3 prinzipiellen Quellen: aus der Rinde, aus dem Thalamus und von den Aktivierungssystemen des Hirnstamms (⊡ Abb. 1.3). 7 1.2 · Limbisches System zellen der Riechschleimhaut enden, setzt sich zum zentralen Nervensystem hin als Tractus olfactorius fort. Am basalen Telenzephalon angekommen, teilt sich der Tractus olfactorius in die Stria olfactoria medialis und die Stria olfactoria lateralis (⊡ Abb. 1.4). Die Stria olfactoria medialis zieht zum medialen oder archilimbischen System, sie endet in der Septenregion. Die Stria olfactoria lateralis zieht nach lateral zum paleolimbischen System in das Corpus amygdaloideum und zum Limen insulae. Sie endet im kortikomedialen Teil des Corpus amygdaloideum und in der umgebenden Rinde. 8 1 1.2.1 Archilimbisches System 7 6 2 5 4 3 ⊡ Abb. 1.3. Element des Neokortex. 1 Kortikale Assoziation (vorwärts), 2 Kommissurfasern, 3 transmitterspezifische Aktivierung, 4 subkortikale Projektion, 5 kortikale Assoziation (rückwärts), 6 doppelläufige spezifische Thalamusverbindung, 7 unspezifische thalamische Aktivierung, 8 umgebende Hemmung Bei einigen kortikokortikalen Verbindungen wurde eine Richtungsspezifität von den Projektionsarealen zu den multimodalen Arealen gefunden. Die Vorwärtsafferenz endet in der 4. Rindenschicht, die Rückwärtsafferenz in der 1. und 5. Schicht (⊡ Abb. 1.3). Zur Aktivierung einer Zellsäule müssen Erregungen aus vielen Quellen zusammenkommen. Aktivierung einer Zellsäule heißt, dass 50 – 100 Pyramidenzellen synchron hochfrequente Impulsserien aussenden. Die damit verbundene Umgebungshemmung durch die Interneurone verhindert eine horizontale Ausbreitung der Erregung in der Rinde. Die kortikale Schaltung der Neurone führt zu kleinen Volumeneinheiten in der Rinde, die miteinander in Verbindung treten und insgesamt ein Netzwerk ergeben, in dem die Informationen als Muster abgelegt sind. Bewusste geistige Tätigkeit ist an eine Aktivität dieses kortikalen Netzwerks gebunden. 1.2 Limbisches System Limbischer Lappen und limbisches System sind zu unterscheiden. Der limbische Lappen ist der kaudale Rand des Endhirns. Der Begriff »limbisches System« schließt die dazugehörigen tiefer gelegenen Strukturen und auch die Funktionen mit ein. Der limbische Lappen und das limbische System sind entwicklungsgeschichtlich Abkömmlinge des Riechhirns. Der Bulbus olfactorius, in dem die Sinnes- Das mediale, archilimbische System ist beim Menschen für das Gedächtnis allgemein und darüber hinaus für Geruch verantwortlich. Zwischen dem medialen Rand der Großhirnhemisphären und dem Zwischenhirn befindet sich die Fissura choroidea, die durch den Plexus choroideus des Seitenventrikels überbrückt wird (⊡ Abb. 1.7). Aus der Kante, Limbus, des Endhirns an der Fissura choroidea entwickelt sich der Archikortex. Diese ursprüngliche Rinde entwickelt sich nicht überall gleich, und zwar aus folgendem Grund: Im Laufe der Entwicklung hat sich an der medialen Kante des Endhirns auch die Kommissur zwischen den beiden Hemisphären, das Corpus callosum, vergrößert. Dort, wo das Corpus callosum wächst, kommt es zu keiner nennenswerten Ausprägung des Archikortex. Nur im Temporallappen, wo ein Corpus callosum fehlt, hat sich die archilimbische Hippokampusformation kräftig entwickelt. Das Corpus callosum selbst ist mit einem dünnen archilimbischen Relikt, dem Indusium griseum, überzogen. Der im weiteren Bogen den Balken umgebende Gyrus cinguli wird dem limbischen System als Übergangsgebiet, Periarchikortex, zugeschrieben (⊡ Abb. 1.4). Histologisch entspricht die Rinde des Gyrus cinguli bereits dem Neokortex. Nur am vorderen Ende der Kommissur unter dem Rostrum des Balkens befindet sich in der sog. Septenregion noch nennenswerter Archikortex. Im Temporallappen hat sich der Archikortex in den Seitenventrikel hineingewölbt. Diese Vorwölbung nennt man das Ammonshorn (⊡ Abb. 1.7). Der äußerste Rand des Endhirns hat sich gezähnelt, er wird als Gyrus dentatus bezeichnet. Die Rinde des Temporallappens, die in das Ammonshorn übergeht und sich an den Gyrus dentatus anlegt, ist das Subiculum. Gyrus dentatus, Ammonshorn und Subiculum bilden zusammen die Hippokampusformation. Die Hippokampusformation steht über das Marklager des Temporallappens in doppelläufiger Faserverbindung mit der multimodalen Rinde der übrigen Hirnlappen (⊡ Abb. 1.5). Die Verknüpfung mit der Septenregion und dem Zwischenhirn erfolgt über den Fornix. Der Fornix läuft an der Fissura choroidea entlang und liegt daher mit einer Kante im Seitenventrikel. Der an der Hippokampusformation entlanglaufende Fornix nimmt bis zu dessen ok- 1 8 Kapitel 1 · Neuroanatomie 6 1 22 19 46 9 L.i. 7 3 4 a 5 1 23 24 2 25 19 35 12 6 28 36 38 3 19 20 L.i. 4 b 13 5 Medialer Archikortex Lateraler Paleokortex ⊡ Abb. 1.4 a,b. Gehirn von lateral (a) und von medial (b) mit unnatürlicher Abwinkelung des Temporallappens. Archikortex mit hellrotem, Paleokortex mit dunkelrotem Muster. 1 Gyrus cinguli, 2 Fornix, 3 Tractus olfactorius, 4 vorderes Ende des Temporallappens, weggeklappt, 5 Uncus gyri parahippocampalis, darunter liegt der Mandelkern, 6 Septenregion zipitalem Ende ständig Fasern aus ihm auf und gibt Fasern an ihn ab. Der Fornix steht über die Commissura fornicis mit der Gegenseite in Verbindung. Er senkt sich am vorderen Rand des Foramen interventriculare in die graue Substanz des Hypothalamus ein (⊡ Abb. 1.6) und schickt an dieser Stelle über die Commissura anterior hinweg (präkommissuraler Teil des Fornix) Fasern in die Septenregion (⊡ Abb. 1.6). Der größte Teil der Fasern verbleibt aber hinter der Commissura anterior (postkommissuraler Teil) und endet im Corpus mamillare des Hypothalamus. Vom Corpus mamillare führt der Tractus mamillothalamicus zum anterioren Kernkomplex des Thalamus (⊡ Abb. 1.6). Der anteriore Kernkomplex projiziert in den Gyrus cinguli, der über das Faserbündel im Mark des Gyrus cinguli, das Cin- ⊡ Abb. 1.5. Doppelläufige Verbindungen zwischen der Hippocampusformation und der multimodalen Assoziationsrinde des Neokortex. Die Zahlen auf den Abbildungen entsprechen den BrodmannArealen gulum, Erregungen zum Subiculum bringt und damit in die Hippokampusformation zurückführt. Diese Kreisschaltung ist der Papez-Zyklus. Alle genannten Verbindungen der Hippokampusformation sind topographisch organisiert, d.h., sie enthalten räumlich-nachbarschaftliche Ordnungen, die sowohl in die kortikalen wie in die subkortikalen Zielgebiete weitergegeben werden. Auch die Afferenzen zeigen eine topographische Organisation. 1.2.2 Element der Hippokampusformation Das archilimbische Element liegt in der Ebene quer zur Hippokampusformation (⊡ Abb. 1.7). Das Element verknüpft kortikale und subkortikale Schaltkreise. Der Tractus perforans trägt kortikale Erregung aus dem Subiculum und der Area 28 nach Brodmann (Area entorhinalis) in die Hippokampusformation hinein. Die Fasern aus der Rinde der 9 1.2 · Limbisches System 14 12 13 1 2 f 3 e c 11 b d 10 4 9 5 a Schaffer-Kollateralen weiter an die Pyramidenzellen von CA2 und CA1. Die Pyramidenzellen entsenden einen Axonzweig über den Fornix in subkortikale Zentren, einen Axonzweig zurück in Richtung Area entorhinalis und damit Neokortex. Ein Element mit Körnerzellen und Pyramidenzellen kann in den Zustand der Langzeitpotenzierung versetzt werden. Die Zellen treten nach mehrmaliger, in kurzen Zeitabständen stattfindender Reizung in einen Zustand maximaler Aktivität ein, der Minuten bis Stunden dauern kann. Dazu müssen folgende Bedingungen erfüllt sein: ▬ Es muss mehr als eine Faser gleichzeitig aktiv sein (Kooperation). 8 7 ▬ Die Aktivierung muss eng begrenzt, also spezifisch 6 ⊡ Abb. 1.6. Anterograde Projektion der Hippocampusformation. 1 Gyrus cinguli, 2 linker Fornix, 3 rechter Fornix, 4 Gyrus dentatus, 5 Gyrus parahippocampalis, 6 Thalamus, teilweise entfernt, 7 Corpus mamillare, 8 Tractus mamillothalamicus, 9 Columna fornicis im Hypothalamus, 10 Lamina terminalis, 11 Septenregion, 12 präkommissuraler Teil des Fornix, 13 postkommissuraler Teil des Fornix, 14 Commissura fornicis, a Neuron in der Area entorhinalis, b Kommissurfasern, c Neuron im lateralen Septenkern, d Neuron im Corpus mamillare, e Neuron im anterioren Kernkomplex des Thalamus, f Neuron im Gyrus cinguli. Papez-Zyklus: a–d–e–f–a 9 8 10 2 7 12 3 1 4 11 6 5 ⊡ Abb. 1.7. Element der Hippokampusformation. 1 Körnerzelle des Gyrus dentatus, an der der Tractus perforans endet, 2 CA3-Pyramidenzelle, 3 CA1-Pyramidenzelle, 4 Pyramidenzelle des Subiculums, 5 Pyramidenzelle der Area entorhinalis mit Tractus perforans, 6 Pyramidenzelle des Subiculums mit Tractus alvearis, 7 Fornix, 8 Plexus choroideus, 9 Seitenventrikel, 10 Ammonshorn, 11 Subiculum, 12 Gyrus dentatus Area entorhinalis enden an den Dendriten der Körnerzellen des Gyrus dentatus und an den Spitzen der Pyramidenzellen. Die Körnerzellen geben ihre Aktivierungen weiter über Moosfaserendigungen an die Pyramidenzellen von Cornu amonis 4 und 3 (CA4 und CA3), diese leiten sie über sein. ▬ Der Impuls der ankommenden Faser muss auf eine bereits aktive Zelle treffen (Assoziation). Wenn die Bedingungen erfüllt sind, können die Pyramidenzellen langanhaltende Impulsraten exportieren. Damit schafft die Hippokampusformation die Möglichkeit, in ihren Zielgebieten synaptische Übertragungen dauerhaft zu verändern. Zunächst wird für ein Bewahren von Information für eine gewisse Zeit im Gedächtnis der Papez-Zyklus verantwortlich gemacht. Beobachtungen zeigen, dass die bilaterale Zerstörung der Corpora mamillaria, des Tractus mamillothalamicus oder des Fornix das Kurzzeitgedächtnis und die Abspeicherung im Langzeitgedächtnis schädigen. Die doppelläufige Faserverbindung mit der Assoziationsrinde des Neokortex schafft dann die Ausbildung des deklarativen Langzeitgedächtnisses. Die physikalische Ablage der Information erfolgt im Neokortex. Wenn die exportierte Langzeitpotenzierung aus der Hippokampusformation auf eine Zellsäule im Neokortex trifft, die zur gleichen Zeit schon aus anderen Quellen (Thalamus, Aktivierungssysteme, andere Rindensäulen) aktiviert wird, so führt das nach dem Hebb-Prinzip zu Änderungen des neuronalen Zellstoffwechsels in der betroffenen Rindensäule. Der neue Stoffwechsel führt zu einer Änderung der synaptischen Übertragung. Eine veränderte synaptische Übertragung bedeutet eine Änderung der Gewichtung im neuronalen Netzwerk und damit eine Änderung des Musters der Großhirnrinde. 1.2.3 Paleolimbisches System Das laterale, paleolimbische System ist für den Geruchssinn für viszerale, vegetative und emotionale Reaktionen von Bedeutung. Die Rinde der Insel und der Mandelkern sind das morphologische Substrat (⊡ Abb. 1.4). Die Stria olfactoria lateralis aus dem Bulbus olfactorius endet in der paleolimbischen Rinde. Das Corpus amygdaloideum besitzt 3 Kernkomplexe: eine Pars corticomediale, eine Pars baso- 1 10 1 Kapitel 1 · Neuroanatomie laterale und eine zentrale Kerngruppe (⊡ Abb. 1.8). Der Mandelkern berührt am Uncus gyri parahippocampalis die Oberfläche des Gehirns (⊡ Abb. 1.4). Er besteht an dieser Stelle aus einer 3-schichtigen Rindenstruktur. Sie entspricht dem kortikomedialen Kernkomplex. Weiter in der Tiefe des Temporallappens ist die basolaterale Gruppe aufzusuchen. Die zentrale Kerngruppe liegt in der Mitte des Mandelkerns. Das Corpus amygdaloideum steht über 3 Faserbündel mit dem übrigen ZNS in Verbindung (⊡ Abb. 1.8). Die Stria terminalis verlässt den Kern hinten, sie zieht im Bogen in der Rinne zwischen Thalamus und Nucleus caudatus nach vorne zur Septenregion und zum Hypothalamus. Das Broca-Diagonalband verlässt den Mandelkern vorne und zieht zur Septenregion. Die basale Mandelkernstrahlung entspricht dem unteren Thalamusstiel und stellt damit die Verbindung des Mandelkerns mit dem Thalamus her. Der Mandelkern erhält neben der Geruchsinformation aus dem Bulbus olfactorius auch aus der Großhirnrinde, aus dem Thalamus und vom Hirnstamm Afferenzen. Die Afferenzen aus dem Hirnstamm bringen Geschmacksempfindungen, Erregungen aus dem Eingeweidetrakt und Einflüsse aus den Aktivierungssystemen. Die Projektionen des Mandelkerns erfolgen über den dorsomedialen Kern des Thalamus zum orbitofrontalen Geruchserkennungsfeld und zur multimodalen präfrontalen Rinde. Die Versorgung der präfrontalen Rinde fügt äußeren Reizen eine emotionelle Komponente hinzu. Die Weiterleitung vom Mandelkern über die Stria terminalis zum Nucleus ventromedialis des Hypothalamus steht im Dienste des Vegetativums. Eine Reizung dieses Bahnsystems führt zu vegetativ-motori1 1 11 2 10 schen Reaktionen wie Kauen, Lecken, Wechsel der Atemfrequenz, Änderung der Magenmotilität, Miktion und Defäkation. Fasern aus dem Mandelkern zum übrigen Hypothalamus, zum zentralen Höhlengrau des Mittelhirns und zur Formatio reticularis des Hirnstamms vermitteln affektiv-motorische Reaktionen wie Arretierungs- und Orientierungs-, Wut- und Angstreaktionen. Im Mandelkern liegen Zellgruppen, die für verschiedene Funktionen verantwortlich sind, dicht nebeneinander. Daraus ergeben sich viele Möglichkeiten der Wechselwirkung. 1.3 Basalganglien Basalganglien (Stammganglien) sind Kerne des Endhirns, des Zwischenhirns und des Mittelhirns, die funktionell zusammengehören. Sie umgeben die Capsula interna und deren Fortsetzung, das Crus cerebri. Es handelt sich um den Nucleus caudatus, das Putamen, den Globus pallidus, die Substantia nigra und den Nucleus subthalamicus. Nucleus caudatus und Putamen erfüllen gleiche Aufgaben und werden daher oft vereinfachend als Striatum zusammengefasst. Der Globus pallidus besteht aus dem relativ eigenständigen lateralen äußeren Pallidumsegment und dem medialen inneren Pallidumsegment. Die Substantia nigra besteht aus einer Pars compacta und einer Pars reticulata. Die Pars compacta enthält die mit dem schwarzen Pigment Melanin gefüllten Neurone, die der Substanz den Namen gegeben haben. Die lockere Pars reticulata liegt zwischen der Pars compacta und dem Crus cerebri. Etwa 90 % der Nervenzellen in den Basalganglien sind Projektionsneurone, die ihre Erregung in einen anderen Teil der Basalganglien weiterleiten. Der Rest besteht aus Interneuronen mit lokaler Wirkung. Die Großhirnrinde projiziert in das Striatum, d. h. in Nucleus caudatus und Putamen. Erregungen verlassen die Basalganglien über das innere Pallidumsegment und die Pars reticulata der Substantia nigra. Diese Ausgangsstationen entsenden ihre Fasern in den Thalamus, in die Colliculi superiores und in den Nucleus pedunculopontinus des Hirnstamms. 3 1.3.1 Topographische Organisation 9 4 8 7 6 5 ⊡ Abb. 1.8. Anterograde Projektion des Corpus amygdaloideum. 1 Stria terminalis, 2 amygdalokortikale Projektion, 3 Temporallappen, 4 basale Mandelkernstrahlung, 5 Pars basolateralis des Mandelkerns, 6 Nucleus centralis, 7 Pars corticomedialis des Mandelkerns, 8 BrocaDiagonalband, 9 N.-opticus, 10 Commissura anterior, 11 Nucleus ventromedialis hypothalami Alle Kerne der Basalganglien sind topographisch organisiert. Die sensomotorischen Projektionsfelder und die unimodalen Assoziationsfelder der Motorik und der Sensibilität projizieren in die motorischen Zonen der Basalganglien. Das vordere und das hintere multimodale Assoziationsfeld der Großhirnrinde entsenden Fasern in die assoziativen Zonen der Basalganglien, der Mandelkern und die Hippokampusformation in die limbischen Zonen. Im Striatum liegt die motorische Zone vorwiegend im Putamen, die assoziative Zone im Nucleus caudatus und die limbische im 1 11 1.3 · Basalganglien Nucleus accumbens. Der Nucleus accumbens ist der Teil des Kopfes des Nucleus caudatus, der unterhalb des Vorderhorns des Seitenventrikels im basalen Telenzephalon liegt. Die Großhirnrinde erhält topographisch organisierte Afferenzen aus den Basalganglien über den Thalamus. Letztlich wirkt die motorische Zone der Basalganglien auf das prämotorische Brodmann-Areal 6, die assoziative Zone auf die Felder 8 und 9 und die limbische Zone auf das Areal 24 des Gyrus cinguli. Auch innerhalb der Zonen setzt sich die topographische Organisation fort, z.B. mit der Kopf-, Hand- und Fußregion der motorischen Zone (⊡ Abb. 1.9). Die Efferenzen aus dem inneren Pallidumsegment und der Pars reticulata, die in den Thalamus ziehen, enden im Nucleus ventralis lateralis, im Nucleus ventralis anterior und im Nucleus dorsomedialis thalami. Diese Thalamuskerne projizieren alle in den Frontallappen. Die Ausgangskerne der Basalganglien leiten darüber hinaus in die intralaminären und zentralen Kerne des Thalamus; von dort werden Axone in das Striatum und das äußere Pallidumsegment entsandt. 1 2 1.3.2 Element der Basalganglien Das Element der Basalganglien ist eine Folge synaptisch verknüpfter Nervenzellen (⊡ Abb. 1.10). Es lassen sich unterscheiden: 1. ein kurzer direkter Weg vom Striatum zu den Ausgangskernen, 2. ein längerer indirekter Weg vom Striatum über das äußere Pallidumsegment zum Nucleus subthalamicus und von dort zu den Ausgangskernen, 3. eine innere Schleife vom Striatum zur Pars compacta der Substantia nigra und von dort zurück zum Striatum. Die Neurone des Striatums, die in das innere Pallidum projizieren (direkter Weg), verwenden neben dem Transmitter GABA als Neuromodulator die Substanz P. Die Neurone, die vom Striatum in das äußere Pallidum projizieren (indirekter Weg), setzen mit GABA Enkephalin frei, während die Neurone, die in die Substantia nigra projizieren (Dopaminschleife), sowohl Substanz K (Tachikinin) als auch Substanz P an den Synapsen abgeben. Die Neurone des inneren Pallidumsegmentes und die Pars reticulata verwenden GABA als Transmitter und wirken in Ruhe dämpfend auf den Thalamus und, da dieser mit Glutamat erregend auf die Rinde wirkt, auch indirekt 3 Kortex Glu Glu 2 1 Glu Ach 1 8 GABA GPe SP GPi EN STRI 2 GABA DA 3 2 SN 4 5 6 Th 1 GABA 2 ST Te PP 7 ⊡ Abb. 1.9. Topographische Organisation in den Basalganglien. 1 Motorische Beinregion, 2 motorische Armregion, 3 motorische Gesichtsregion, 4 Putamen, 5 äußeres Pallidumsegment, 6 inneres Pallidumsegment, 7 Hinweis auf die anderen Basalganglien wie Substantia nigra und Nucleus subthalamicus, 8 topographisch organisierter Nucleus ventralis lateralis thalami ⊡ Abb. 1.10. Schaltkreise in den Basalganglien. Th Thalamus, Te Tectum, PP Nucleus pedunculopontinus, GPe externes Pallidumsegment, GPi internes Pallidumsegment, SN Substantia nigra, ST Nucleus subthalamicus, Glu Glutamat, GABA Gammaaminobuttersäure, SP Substanz P, En Enkephalin, STRI Striatum, DA Dopamin, 1 direkter Weg, 2 indirekter Weg, 3 Dopaminschleife 12 1 Kapitel 1 · Neuroanatomie dämpfend auf die Rinde. Die hemmende Wirkung der Ausgangsneurone können Projektionsneurone aus dem Striatum aufheben, da diese ebenfalls GABA als Transmitter verwenden. Diese Situation ist gegeben, wenn aus der Großhirnrinde durch Glutamat bedingte erregende Impulse im Striatum eintreffen. Der direkte Weg führt zu einer positiven Rückkopplung in der Rinde, weil der Thalamus durch die Basalganglien disinhibiert wird. In den indirekten Weg ist der Nucleus subthalamicus eingeschaltet, der in seinen Zielgebieten Glutamat als Transmitter freisetzt. Der Nucleus subthalamicus wirkt daher fördernd auf die Ausgangskerne und verstärkt damit deren Thalamushemmung. Dem Nucleus subthalamicus ist ein GABAerges Neuron aus dem äußeren Pallidumsegment vorgeschaltet, auf welches das GABAerge Striatum wirkt. Eine Aktivierung des Striatums bedeutet also eine Disinhibierung des Nucleus subthalamicus und damit eine Verstärkung der Thalamushemmung. Der direkte Weg wirkt enthemmend und der indirekte hemmend auf den Thalamus und in gleicher Weise auf die Colliculi superiores und den Nucleus pedunculopontinus. Die Striatum-Pars-compacta-Schleife mit GABA hin und Dopamin zurück wirkt hemmend auf den indirekten und fördernd auf den direkten Weg. Die Dopaminschleife wirkt damit direkt disinhibierend auf den Thalamus und durch Schwächung der Disinhibition des Nucleus subthalamicus auch indirekt disinhibierend, weil der an sich hemmende Ausgang der Basalganglien durch den Nucleus subthalamicus nicht mehr so stark gefördert wird. Bei Dopaminmangel (Parkinson-Syndrom) geht diese normale doppelte Enthemmung des Thalamus verloren. Die in den Zonen der basalen Kerne parallel verlaufende topographisch organisierte Erregungsleitung wird durch konzentrische Leitungen von Erregungen aus den assoziativen in die motorischen bzw. limbischen Zonen ergänzt. Von der assoziativen Zone des äußeren Pallidumsegmentes erfolgt eine Projektion auch in die motorische Zone des Nucleus subthalamicus und von der assoziativen Zone des Nucleus subthalamicus in die limbische Zone des inneren Pallidumsegmentes. Auf diese Weise können Einflüsse der multimodalen Großhirnrinde auf die willkürliche und die instinktive Motorik zur Geltung gebracht werden. Die Neuromodulatoren sorgen für eine Plastizität in der Erregungsleitung. Die in den Basalganglien weitergeleiteten Impulse werden nicht nur in unterschiedliche anatomische Bahnen, sondern auch in ein unterschiedliches chemisches Milieu gebracht. Die klassischen Transmitter bewirken eine synaptische Übertragung im Millisekundenbereich. Die peptidergen Substanzen werden erst bei höheren Impulsfrequenzen und bei länger anhaltenden Impulsserien an den Synapsen freigesetzt. Sie modulieren daher den Transfer der Impulsmuster in Abhängigkeit vom Gebrauch der Synapsen. 1.4 Thalamus Der Thalamus nimmt den größten Raum im Zwischenhirn ein. Der Name (griech.: Höhle) verweist auf die Lage dieser kompakten Masse grauer Substanz in der Wand des Seitenund des III. Ventrikels. Der Thalamus wird in mehr als 50 Kerne unterteilt. Die großen Kerngruppen werden durch Marklamellen voneinander getrennt. Zwischen der äußeren Marklamelle und der Capsula interna befindet sich der Nucleus reticularis thalami. Eine innere, etwa in der Mitte des Thalamus gelegene sagittal gestellte Lamina medullaris interna trennt die mediale von der lateralen Kerngruppe. Die Lamina interna gabelt sich vorne und umfasst so den anterioren Kernkomplex. 1.4.1 Topographische Organisation Die Projektionsneurone des Thalamus sind die Relaiszellen (⊡ Abb. 1.11). Sie nehmen die Erregungen auf und leiten sie in die Großhirnrinde topographisch organisiert weiter. Die Relaiszellen der lateralen Kerngruppe enden im Neokortex, vorwiegend in der Lamina IV (⊡ Abb. 1.3), sowohl in Projektions- als auch in uni- und multimodalen Assoziationsfeldern. Im Einzelnen werden folgende Kerne unterschieden: ▬ Der Nucleus ventralis posterior ist der sensible Thalamuskern. Er projiziert sowohl nach Submodalitäten getrennt als auch Submodalitäten konvergierend in die Großhirnrinde. In den Arealen 3a und 3b werden Tiefen- und Oberflächensensibilität in getrennte Rindensäulen übertragen, in den Arealen 2 und 1 werden sie in Rindensäulen zusammengeführt. ▬ Der Nucleus geniculatus lateralis ist der visuelle Kern. Die schon von der Retina mit dem Tractus opticus getrennt herangeführten Modalitäten Formsehen und 1 2 7 3 44 6 5 ⊡ Abb. 1.11. Verknüpfung des Thalamus mit dem Neokortex. 1 Pyramidenzelle des Neokortex, 2 Neuron des Nucleus reticularis thalami, 3 Relaiszelle des Thalamus, 4 Interneurone des Thalamus, 5 spezifische Thalamusafferenz, 6 aktivierende Thalamusafferenz, 7 Interneurone 1.4 · Thalamus ▬ ▬ ▬ ▬ ▬ Bewegungssehen werden weiterhin getrennt in die Sehrinde Area 17 weitergeleitet. Der Nucleus geniculatus medialis ist der akustische Kern. Er besteht aus einer Pars ventralis, die Erregungen aus dem zentralen Teil der Colliculi inferiores tonotopisch geordnet erhält und diese Ordnung in die primäre Hörrinde der Heschl-Querwindung weiterüberträgt. Eine Pars dorsalis erhält Impulse aus der Randzone des Colliculus inferior, die nicht tonotopisch gegliedert ist, und leitet diese weiter in die akustische Assoziationsrinde (Area 52 bzw. A2). Die Pars medialis des Nucleus geniculatus medialis empfängt nicht nur akustische Meldungen aus dem Colliculus superior, sondern auch sensible Afferenzen aus dem Lemniscus medialis und aus dem Tractus spinothalamicus und leitet diese weiter in die multimodale Rinde um das akustische Feld, in die Area 22. Der motorische Nucleus ventralis lateralis projiziert in das primär motorische Feld und in das unimodale, motorische Assoziationfeld. Der Nucleus ventralis lateralis besteht aus einer Pars caudalis und einer Pars oralis. Die Pars caudalis erhält Impulse aus den Kleinhirnkernen, den Nuclei dentatus, globosus, emboliformis und fastigii. Die Axone aus dem Kleinhirn gelangen über den oberen Kleinhirnstiel mit dem Fasciculus thalamicus von basal her in den Thalamus hinein. Feinmotorik, Halte- und Stützmotorik werden in getrennten Faserbündeln geführt. Die Pars caudalis sendet Fasern in das motorische Projektionsfeld in die Brodmann-Areale 4 und 6. Die Pars oralis des Nucleus ventralis lateralis erhält Impulse aus den Basalganglien. Die Ausgangsstationen der Basalganglien sind das innere Pallidumsegment und die Pars reticulata der Substantia nigra. Die Pars oralis versorgt das motorische, unimodale Assoziationfeld und hat als Zielgebiet die BrodmannAreale 6 und 8. Sie sendet darüber hinaus Fasern in den supplementären motorischen Kortex (⊡ Abb. 1.2). Der Nucleus ventralis anterior ist ein Thalamuskern für die multimodale Rinde; er kann zugleich dem unspezifischen Aktivierungssystem zugerechnet werden. Der Kern erhält Impulse direkt aus der Formatio reticularis, aus den intralaminären Kernen und aus dem Pallidum. Der Kern projiziert in das vordere multimodale Assoziationsfeld (präfrontaler Kortex) und in das hintere multimodale Assoziationsfeld. Der anteriore Kernkomplex gehört zum archilimbischen System (Papez-Zyklus). Die anteriore Kerngruppe befindet sich in der vorderen Gabelung der Lamina medullaris interna thalami. Sie bezieht Afferenzen aus den Corpora mamillaria. Der Kernkomplex projiziert topographisch geordnet in die Area 24, 25 und 32 des Gyrus cinguli. Der Gyrus cinguli wird als Periarchikortex bezeichnet. Der mediale Kernkomplex, vereinfachend oft Nucleus dorsomedialis genannt, lässt sich dem paleolimbischen 13 System zurechnen. Er liegt medial von der Lamina medullaris interna. Der Nucleus dorsomedialis erhält Afferenzen aus limbischen Strukturen wie olfaktorische Rinde, Mandelkern, Area entorhinalis und Mittelhirnhaube und sendet seine Efferenzen in das vordere multimodale Assoziationsgebiet. Die Unterkerne projizieren, topographisch geordnet, in den dorsolateralen Teil des präfrontalen Kortex (in die Area 9 und 10), in den medialen Teil mit dem Gyrus cinguli (in die Area 32 und 24) und auch in den orbitofrontalen Kortex (Area 11, 12 und 47). Der Nucleus dorsomedialis wird mit der Stimmungslage und dem Gedächtnis in Verbindung gebracht, insbesondere soll er beim Erinnern und Wiederabrufen von gespeicherten Informationen unerlässlich sein. ▬ Die Kerne der Mittellinie liegen unter dem Ependym des III. Ventrikels. Sie besitzen keine Verbindungen mit dem Kortex und erscheinen als Fortsetzung des zentralen Höhlengraus des Hypothalamus. ▬ Die Pulvina thalami enthält viele Kerne, die z.T. nur beim Menschen vorkommen. Diese Kerne stehen, topisch geordnet, in doppelläufiger Verbindung zu den Brodmann-Arealen 7, 39, 40, 22 und 21 (⊡ Abb. 1.1). Auch zum präfrontalen Assoziationskortex bestehen Verbindungen. Subkortikale Afferenzen aus dem visuellen System (Tractus opticus, Area praetectalis, Colliculus superior) und dem Tractus spinothalamicus sind dagegen sehr spärlich. Die kortikalen und intrathalamischen Verknüpfungen stehen quantitativ ganz im Vordergrund. Daher können die Pulvina und die ihr zugehörige multimodale Assoziationsrinde weitgehend unabhängig von äußeren Einflüssen tätig sein. ▬ Die Lamina medullaris interna thalami enthält mehrere (intralaminäre) Kerne. Diese Mischung aus Fasern und Kernen erscheint als eine Fortsetzung der Formatio reticularis des Hirnstamms in den Thalamus hinein. Hinten befinden sich die beim Menschen besonders deutlich hervortretenden Kerne Nucleus centromedianus und Nucleus parafascicularis unter dem Nucleus dorsomedialis. Der Nucleus centromedianus erhält Afferenzen ausschließlich aus dem Pallidum. Der Nucleus parafascicularis erhält Fasern aus dem Pallidum, aus dem Mandelkern und aus anderen Regionen. Beide Kerne projizieren in die Großhirnrinde und in das Striatum. Die thalamokortikalen Nervenfortsätze der intralaminären Kerne sowie des Nucleus centromedianus und des Nucleus parafascicularis sind dünn. Sie versorgen überlappende Rindenbezirke und enden in der Lamina I und in der Lamina VI (⊡ Abb. 1.3). Experimentell degenerieren die intralaminokortikalen Neurone nur bei größerer Zerstörung der Rinde. Die Kaliber der Fasern, die in das Striatum projizieren (⊡ Abb. 1.15), sind kräftiger als die, die zur Rinde ziehen. Die besonderen Verbindungen der intralaminären Kerne mit der Großhirnrinde, dem Striatum und der 1 14 Kapitel 1 · Neuroanatomie Formatio reticularis zeigen ihre Sonderstellung im Aktivierungssystem. Der Nucleus reticularis thalami liegt zwischen der Lamina medullaris externa und der Capsula interna wie eine dem Thalamus vorgelagerte Inselkette. Der Kern erhält als Afferenzen Kollateralen der thalamokortikalen Projektion und Kollateralen von den kortikothalamischen Rückprojektionen (⊡ Abb. 1.11). Die Nervenzellen des Nucleus reticularis thalami senden ihr Axon in die Region des Thalamus, von der aus sie Erregungen erhalten. 1 a 1 2 3 1.4.2 Element des Thalamus Das Element des Thalamus lässt sich stark vereinfacht wie folgt beschreiben: Die Relaiszellen entsenden ihre Axone in die Großhirnrinde (⊡ Abb. 1.11) und in das Striatum (⊡ Abb. 1.10) und verwenden das exzitatorisch wirkende Glutamat. In der Großhirnrinde enden sie an Pyramidenzellen und an Körnerzellen, im Striatum an cholinergen Interneuronen. Die Relaiszellen bilden synaptische Kontakte mit den spezifischen Afferenzen, mit hemmenden und fördernden Interneuronen der Pyramidenzellen aus der Rinde. Sie geben wie die Pyramidenzellen eine depolarisierende Kollaterale an das Retikularisneuron ab. Das Retikularisneuron wirkt hemmend auf die Relaiszelle, von der es aktiviert wurde, und auf deren benachbarte Relaiszellen. Wenn eine Relaiszelle eine höhere Aktivität entwickelt als ihre Nachbarn, hemmt sie die Nachbarn über das Retikularisneuron stärker und setzt sich als einzige durch. Diese kollaterale Hemmung durch die Retikularisneurone begrenzt die Aktivierung und dient der Spezifizierung der Erregungsübertragung in die Rinde. Die Weiterleitung einer Erregung von der peripheren Afferenz durch den Thalamus zur Großhirnrinde hängt entscheidend von der die Relaiszelle umgebenden Förderung und Hemmung ab. In dieses Verhältnis greifen von außen Aktivierungssysteme ein (⊡ Abb. 1.11), die den Informationsfluss durch den Thalamus regeln. Der Thalamus ist ein dynamischer Informationsfilter, welcher der bewussten Informationsverarbeitung in der Großhirnrinde vorgeschaltet ist. 1.5 Kleinhirn Das Kleinhirn ist eine dorsale Aussprossung des Hirnstamms und wird am Hirnstamm durch die 3 in der Mitte des Kleinhirns dicht nebeneinander liegenden Kleinhirnstiele gehalten (⊡ Abb. 1.12). Der obere Kleinhirnstiel, Pedunculus cerebellaris superior, stellt die Verbindung zum Mittel- und Zwischenhirn, der Pedunculus medius zur Brücke und der Pedunculus inferior zur Medulla oblongata her. Das Kleinhirn besteht aus dem unpaaren Wurm (Vermis) und den beiden seitlichen Hemisphären. Das Kleinhirn be- b ⊡ Abb. 1.12 a, b. Kleinhirn. Facies superior (a) und Facies inferior (b) mit Schema der topographischen Organisation. 1 Pedunculus cerebellaris superior, 2 Pedunculus cerebellaris inferior, 3 Pedunculus cerebellaris medius. Der Körper ist mehrfach abgebildet. Die Körpermitte liegt medial, die Extremitäten weisen nach lateral. Die untere Körperhälfte liegt hirnstammnah, die obere Körperhälfte hirnstammfern. Auf der Facies superior gibt es eine einfache ipsilaterale Abbildung des Körpers, auf der Facies inferior zwei beidseitige Abbildungen, die mit dem Rücken an den Wurm grenzen sitzt an der Oberfläche eine Rinde, es folgen das Mark und die zentralen Kerne. Die Kleinhirnoberfläche weist querverlaufende Spalten, Fissurae, mit dazwischen gelegenen Erhebungen, den Blättern (Folia cerebelli), auf. Einige Fissuren schneiden tief in das Kleinhirn ein und unterteilen Kleinhirnwurm und Hemisphären in Lobi, Lappen, und in Lobuli, Läppchen. Die Fissura prima auf der Oberseite trennt den Lobus anterior von dem Lobus posterior. Eine Fissura posterolateralis trennt auf der Unterseite den Nodulus vom Wurm und den Flocculus von den Hemisphären ab. Das Kleinhirnmark besteht aus quer zu den Fissuren auslaufenden Faserlamellen. Die meisten Nervenfasern treten über den unteren und mittleren Kleinhirnstiel in das Mark des Kleinhirns ein, durch den oberen Kleinhirnstiel verlassen hauptsächlich die Efferenzen das Kleinhirn. Die Axone in den Kleinhirnstielen ordnen sich in die Faserlamellen des Kleinhirnmarks ein. Die Faserlamellen werden in Zonen eingeteilt. Von medial nach lateral lauten die Zo- 15 1.5 · Kleinhirn nen im Wurm A und B1, B2, im paravermalen Teil C1, C2, C3 und in den lateralen Hemisphären D1–D2. Diesen Markzonen des Kleinhirns lassen sich auch Rindenzonen und Kerne zuordnen. In der Mitte des Kleinhirns befinden sich die Kleinhirnkerne. Am weitesten lateral liegt der größte Kern, der Nucleus dentatus, es folgen nach medial der Nucleus globosus und der Nucleus emboliformis und schließlich ganz medial der Nucleus fastigii. Der Nucleus vestibularis lateralis des Hirnstamms ist funktionsmäßig und auch entwicklungsgeschichtlich als Kleinhirnkern anzusehen. 1.5.1 Topographische Organisation Der Bauplan des Kleinhirns ist einfacher als der des Großhirns. Die Kleinhirnrinde zeigt mikroskopisch überall und bei allen Wirbeltieren das gleiche Aussehen. Die einfache neuronale Schaltung hat sich offensichtlich so bewährt, dass entwicklungsgeschichtlich eine Verbesserung des Prinzips nicht erforderlich wurde. Die Evolution in der aufsteigenden Wirbeltierreihe hat nur vermehrt und angebaut. Da die mikroskopische Struktur keinen Anhalt bietet, können Unterschiede des Kleinhirns nur aus den Verbindungen mit dem übrigen ZNS abgelesen werden. Das Kleinhirn lässt sich in 3 Hauptteile gliedern, die in der Entwicklungsgeschichte nacheinander aufgetreten sind. Das Archizerebellum ist, wie schon bei den Fischen, verantwortlich für die Gleichgewichtserhaltung. Die Impulse aus den Vestibularorganen fließen in die Motorik der Körperhaltung und die Stellung der Augen ein; damit kann sich das Individuum im Schwerefeld der Erde orientieren. Das Archizerebellum befindet sich in der Pars flocculonodularis des Kleinhirns; der zugehörige Kern ist der Nucleus vestibularis lateralis. Das Archizerebellum wird daher dem Vestibulozerebellum gleichgesetzt. Das Paleozerebellum ist schon bei den primitiven Landtieren für die Koordination der Bewegung der Extremitäten verantwortlich. Die Impulse aus dem Rückenmark fließen in die Motorik der Fortbewegung ein. Die Rinde des Wurms ist für die Koordination der Rumpfmuskulatur und die paravermale Rinde für die der distalen Extremitätenmuskulatur zuständig. Repräsentationen des Körpers finden sich v. a. im Lobus anterior auf der Oberseite des Kleinhirns und in den Rindenbezirken nahe am Hirnstamm auf der Unterseite (⊡ Abb. 1.12). Die zugehörigen Kleinhirnkerne sind die Nuclei fastigii, globosus und emboliformis. Das Paleozerebellum wird daher mit dem Spinozerebellum gleichgesetzt. Das Neozerebellum ist bei den höheren Wirbeltieren für die Koordination der Willkürmotorik zuständig, insbesondere für die Koordination der Sinnes- und Kommunikationsorgane. Die Rinde der lateralen Hemisphären und der Nucleus dentatus sind die verantwortlichen Strukturen. Das Neozerebellum wird mit dem Pontozerebellum gleichgesetzt, weil die Impulse für diese Kleinhirnabschnitte über die Nuclei pontis ins Klein- hirn kommen. Die Nuclei pontis erhalten ihre Afferenzen aus der Großhirnrinde. Die Kleinhirnefferenzen wirken nie auf die unteren, an den Muskeln ansetzenden Motoneurone, sondern immer nur auf übergeordnete Motoneurone. 1.5.2 Element des Kleinhirns Das Element des Kleinhirns besteht aus 5 Neuronen (⊡ Abb. 1.13). Die Neurone der lokalen Begrenzung der Erregung in der Rinde sind dabei nicht mitgezählt. Zum Element gehören die beiden Afferenzen Moosfaserneuron und Kletterfaserneuron aus dem Hirnstamm sowie die verteilende Körnerzelle in der Rinde, die Kleinhirnefferenz, die aus einem Kleinhirnkern kommt und das Kleinhirn verlässt, und die Purkinje-Zelle der Kleinhirnrinde (⊡ Abb. 1.13). Das Moosfasersystem sammelt primäre und sekundäre vestibuläre Erregungen, Signale vom Rückenmark in der Clark-Säule und im Nucleus cuneatus lateralis, sowie Signale von der Großhirnrinde in die Nuclei pontis. Diese Kerne tragen topographisch geordnete, modalitätsspezifische Information aus weiten Teilen des ZNS in das Kleinhirn hinein. Sie ordnen sich in der ihrer Herkunft entsprechenden sagittalen Lamelle ein und teilen sich in einen Ast für den Kern und in einen für die Rinde. Kurz vor Eintritt in die Rinde verzweigt sich die Moosfaser noch mehrfach und endet in der Körnerzellschicht benachbarter Folia cerebelli. Das Axonende einer Moosfaser ist zu einer Riesensynapse aufgetrieben. Die Erregung wird auf viele Körnerzellen übertragen. Die Körnerzellen entsenden ihre Axone in die Molekularschicht, wo sie sich T-förmig teilen und nach beiden Seiten als Parallelfasern in Längsrichtung des Foliums verlaufen. Diese Parallelfasern bilden mit allen Dendriten in der Molekularschicht exzitatorische Synapsen. Eine Pa- 3 2 5 4 1 ⊡ Abb. 1.13. Element des Kleinhirns. 1 Kletterfaserneuron, 2 Moosfaserneuron, 3 Neuron eines Kleinhirnkerns, 4 Purkinje-Zelle, 5 Körnerzelle der Kleinhirnrinde 1 16 1 Kapitel 1 · Neuroanatomie rallelfaser ist etwa 2–3 mm lang und erreicht 400 PurkinjeZellen. Eine Moosfaser divergiert in der Summe auf etwa 160000 Purkinje-Zellen. Das Kletterfasersystem sammelt wie das Moosfasersystem Informationen in den für die Koordination der Motorik wichtigen sensorischen Bereichen, also im Vestibularapparat, im Rückenmark und in der Großhirnrinde. Die Informationen für das Kletterfasersystem fließen im Nucleus olivaris inferior in der Medulla oblongata zusammen. Dieser Kern ist topographisch organisiert. Die Kletterfasern treten ihrer Herkunft entsprechend topographisch geordnet in die Lamellen des Kleinhirns ein und teilen sich dort. Sie enden mit einer Axonkollaterale in dem zugehörigen Kern und mit der anderen in der zugehörigen Rinde. Die Kletterfaser umwindet den Hauptstamm der Purkinje-Zelle und bildet eine breite Synapsenfläche und damit eine Synapse mit hoher Penetranz. Eine Kletterfaser endet exzitatorisch an 1–10 Purkinje-Zellen, wobei jede PurkinjeZelle nur Kontakt mit einer Kletterfaser bekommt. Interneurone der Kleinhirnrinde sind die Golgi-, Sternund Korbzellen. Die axonalen Endigungen der Golgi-Zellen sitzen den Dendriten der Körnerzellen an der Riesensynapse auf. Die Golgi-Zellen können die Erregungsübertragung von den Moosfasern auf die Körnerzellen hemmen. Golgi-Zellen wie Korb- und Sternzellen dienen der lokalen Begrenzung der Erregung und der Umgebungshemmung. Das Axon der Purkinje-Zelle ist die einzige Efferenz der Rinde (⊡ Abb. 1.13). Es endet in einem Kleinhirnkern, und zwar an dem Neuron, an dem die Axonkollateralen der Moosfaser und der Kletterfaser, die die Purkinje-Zelle in der Rinde beeinflussen, Synapsen bilden. Während die beiden Axonkollateralen depolarisierend auf das Kernneuron wirken, setzt das Axon der Purkinje-Zelle GABA frei und wirkt hyperpolarisierend. Das ausführende Neuron des Kleinhirns sind die Nervenzellen der Kleinhirnkerne (⊡ Abb. 1.13). Die Aktivität dieser Nervenzellen ergibt sich aus der Bilanz der Erregungen der Moosfasern, der Kletterfasern und der PurkinjeZellen. Die Moosfasern tragen neuronale Erregungen, die Bedeutung für die Motorik haben, als Muster in das Kleinhirn hinein. Solange diese Muster in gewohnter Weise und in gewohnter zeitlicher Folge auftreten, ist das Kletterfasersystem weitgehend inaktiv. Wenn aber ein Bewegungsziel nicht in der erwarteten, im voraus errechneten Weise erreicht wird, erhöhen die Kletterfasern die Zahl ihrer komplexen Entladungen. In der Kleinhirnrinde treffen nun Aktivierungen aus dem Moosfasersystem und aus dem Kletterfasersystem in den Purkinje-Zellen gleichzeitig zusammen. Damit ist eine Hebb-Situation gegeben: Wenn eine Erregung auf eine bereits erregte Zelle trifft, werden Zellstoffwechselvorgänge angestoßen, die die synaptische Übertragung verändern. Im Kleinhirn führen wiederholte gleichzeitige Aktivierungen von Purkinje-Zellen durch Kletterfasern und Moosfasern zu einer Verminderung der Übertragung der Synapse zwischen Parallelfasern und Purkinje-Zelle. Als Folge wird das Neuron im Kleinhirnkern durch die Purkinje-Zelle weniger gehemmt und die Kleinhirnwirkung auf das nachgeschaltete Motoneuron verstärkt. Wenn die veränderte Kleinhirnefferenz dazu führt, dass das motorische Ziel nun den Erwartungswerten entsprechend erreicht wird, endet die erhöhte Aktivität des Kletterfasersystems. Das Kletterfasersystem steuert so den Beitrag des Kleinhirns zum Bewegungsablauf bedarfsgerecht. Neue Bewegungen werden auf diese Weise erlernt (prozedurales Lernen, »wie« etwas zu tun ist). 1.6 Hirnstamm Der Hirnstamm nimmt im Bauplan eine Mittelstellung zwischen Rückenmark und Großhirn ein. Die entwicklungsgeschichtlich einfache Organisation des Neuralrohrs in Grundplatte, Flügelplatte, Bodenplatte und Deckplatte ist noch erkennbar, die Wanderung von Neuronen und die Bildung lokaler Kerngruppen entspricht aber doch schon mehr der Entwicklung im rostralen Teil des ZNS. In der 8. Embryonalwoche gerät der Hirnstamm auf der Höhe der Brücke in eine extrem nach ventral geknickte Lage. Dabei wird die dorsale Deckplatte dünn ausgezogen, die dorsal gelegene Flügelplatte verlagert sich an die laterale Seite der Grundplatte. Aus der Flügelplatte wandern Neuroblasten nach außen, nach ventral und nach dorsal aus. Die nach ventral wandernden Neuroblasten vermehren sich, wachsen und bilden reichlich Fasern, so dass der Hirnstamm sich ventral wieder streckt, während die dorsalen Veränderungen erhalten bleiben. Aus den nach ventral gewanderten Neuroblasten entstehen der Nucleus olivaris inferior, der Nucleus ruber und die Substantia nigra, aus den nach außen wandernden Zellen die Nuclei vestibulares und aus den nach dorsal wandernden Zellen die Vierhügelplatte und das Kleinhirn. 1.6.1 Topographische Organisation Als Ergebnis der embryonalen Entwicklung liegen im Hirnstamm die Grundplatte (medial) und die Flügelplatte (lateral) nebeneinander. Die Grenzfurche, Sulcus limitans, ist wie beim Rückenmark zwischen der efferenten Grundplatte und der afferenten Flügelplatte gelegen – dies ist in der Rautengrube noch zu erkennen. Medial des Sulcus limitans liegen die viszeromotorischen und lateral die viszerosensiblen Neurone für die Regulation der Innenwelt des Organismus. Die für die Auseinandersetzung mit der Außenwelt befaßten somatomotorischen und somatosensiblen Neurone liegen vom Sulcus limitans entfernt. Im Hirnstamm ist die Differenzierung und die Spezialisierung der Neurone weiter fortgeschritten als im Rückenmark. Der Übergang von der Außenwelt zur Innenwelt erfordert neue Kontrol- 1.6 · Hirnstamm len und mehr neuronale Arbeit. Die neuen Zellgruppen fügen sich in das alte Bauschema. Es treten 3 spezielle Funktionen beim Hirnstamm hinzu: Geschmack (zur Kontrolle der Nahrungsaufnahme), Kiemenbogenmotorik (Branchiomotorik; die ursprünglich für die Sauerstoffaufnahme verantwortliche Muskulatur wird bei den höheren Wirbeltieren für die Kommunikation mit der Außenwelt eingesetzt) und spezielle Sinnessysteme (Hören und Gleichgewichtsempfindungen). Im Querschnitt erscheinen die Modalitäten von medial nach lateral in folgender Reihenfolge: 1. Die somatomotorische Nervenzellgruppe versorgt quergestreifte Muskulatur, die aus Somiten hervorgegangen ist. Die Nervenfasern dieser Neurone verlaufen mit den Hirnnerven der medialen Gruppe. Die äußeren Augenmuskeln stammen von den präotischen Somiten. Sie werden von den Nn. oculomotorius, trochlearis und abducens versorgt. Die Zungenmuskulatur entwickelt sich aus okzipitalen Somiten, der N. hypoglossus ist der zugehörige Nerv. 2. Die branchiomotorische Gruppe mit dem Nucleus motorius nervi trigemini, dem Nucleus nervi facialis und dem Nucleus ambiguus versorgt quergestreifte Muskulatur, die aus Kiemenbogenmaterial hervorgegangen ist. Die Kiemenbogennerven sind die Nn. trigeminus, facialis, glossopharyngeus, vagus und accessorius. Da die genannten Nerven lateral aus dem Hirnstamm austreten, werden sie auch als laterale Gruppe bezeichnet. 3. Die viszeromotorische oder parasympathische Gruppe, der Nucleus Westphal-Edinger, die Nuclei salivatorii superior et inferior und der Nucleus dorsalis parasympathici nervi vagi, bildet in der Regel keine eigenen Nervenstämme, sondern lagert ihre schwach myelinisierten Axone kräftiger myelinisierten Modalitäten der folgenden Hirnnerven an. Parasympathische Komponenten haben damit die Nn. oculomotorius, facialis, glossopharyngeus und vagus. 4. Die viszerosensible Pars inferior des Nucleus solitarius erhält Meldungen von allen Eingeweiden des Körpers mit Ausnahme der Beckenorgane über die Nn. vagus und glossopharyngeus. 5. Geschmacksempfindungen werden im Mund und im Rachenraum registriert. Ihre Zentralwärtsleitung erfolgt über die Nn. facialis, glossopharyngeus und vagus zur Pars superior des Nucleus solitarius. 6. Somatosensible Neurone, die mechanische, thermische und nozizeptive Empfindungen von der oberflächlichen Haut, von den Schleimhäuten und aus der Muskulatur sammeln, enden in den Kernen des N. trigeminus (Nucleus principalis und Nucleus spinalis). Die sensiblen Fasern nehmen den Weg über den N. trigeminus und nur zu einem ganz geringen Teil, von der Umgebung um das Ohr, über den N. facialis, den N. glossopharyngeus und den N. vagus. 17 7. Die Nuclei vestibulares et cochleares befinden sich ganz lateral und sind eine sensorische Gruppe, die sich mit der räumlichen Orientierung außerhalb des Organismus befasst. Sie registrieren Kopfwendungen mit Hilfe des Massenträgheitsgesetzes, geben Orientierung im Schwerefeld der Erde und analysieren Schallquellen aus der Umgebung. Die Ursprungs- und Endkerne der Hirnnerven sind umgeben von auswärtigen Fasern, von Neuronen, die der Assoziation dienen, und von Neuronen der Weiterverarbeitung. Entwicklungsgeschichtlich jünger sind die topographisch organisierten Projektionen von der Großhirnrinde zu den Hirnnervenkernen für die Willkürmotorik sowie in die Nuclei pontis der basalen Brücke und in den Nucleus olivaris inferior der Medulla oblongata. Von den Brückenkernen und der unteren Olive werden die Impulse ins Kleinhirn weitergeleitet. Geordnete Projektionen von der Rinde erhalten auch die Substantia nigra, der Nucleus ruber und die Kerne der Formatio reticularis. Die entwicklungsgeschichtlich älteste Form der Weiterverarbeitung besorgen die Neurone der Formatio reticularis. »Formatio reticularis« bedeutet netzförmige Mischung aus Zellen und Fasern. In der Brücke und im Mittelhirn spricht man statt von Formatio reticularis von der Region der Formatio reticularis, nämlich der Haubenregion, Tegmentum. Bei der Formatio reticularis handelt sich um relativ locker angeordnete Gruppen von Neuronen in einem rechtwinklig sich durchflechtenden Faserwerk. Die Gruppen von Neuronen tragen alle Namen, meist mit Nucleus reticularis beginnend, diese Namen werden jedoch selten gebraucht. Die größten somatomotorischen Zellgruppen sind der Nucleus pedunculopontinus im Mittelhirn, die Nuclei reticulares pontis oralis et caudalis in der Brücke und der Nucleus reticularis gigantocellularis in der Medulla oblongata. Die viszeromotorischen Zellgruppen befinden sich im zentralen Höhlengrau des Mittelhirns und der Medulla oblongata. 1.6.2 Element der Formatio reticularis In der Zone der ursprünglichen Grundplatte befinden sich Projektionsneurone mit großen Perikarya, deren Axone bis ins Zwischenhirn und ins Rückenmark reichen. Unter diesen gibt es Neurone, die eine Axonkollaterale ins Zwischenhirn und eine zum Rückenmark senden. Andere Neurone (⊡ Abb. 1.14) besitzen ein aufsteigendes Axon und beeinflussen über Kollateralen Neurone mit absteigenden Axonen. Absteigende Neurone beeinflussen aufsteigende Neurone. Die großen Neurone der Formatio reticularis sind ohne topographische Organisation. Sie zeigen auch keine spezifische Modalität. Sie nehmen an ihren Dendriten und ihrem Perikaryon Afferenzen aller Art auf, summieren die ankom- 1 18 Kapitel 1 · Neuroanatomie 1 2 1 ⊡ Abb. 1.14. Element der Formatio reticularis. 1 Zum Thalamus aufsteigendes Neuron der Formatio reticularis in synaptischem Kontakt über eine Kollaterale mit einem zum Rückenmark absteigenden Neuron, 2 absteigendes Neuron mit Kontakt zu einem aufsteigenden Neuron menden Erregungen und bringen die resultierende Aktivität in die Regionen ihrer synaptischen Endigungen. Diese Neurone sind der Prototyp der Aktivierungsneurone. In der Zone der ursprünglichen Flügelplatte sind die Neurone der Formatio reticularis kleiner und von geringerer Reichweite. Sie bleiben mit ihren Ausläufern im Hirnstammabschnitt ihres Perikaryons und dienen der lokalen Koordination und Summation sensibler Eingänge. Typische Areale dieser Art sind die Area reticularis superficialis ventrolateralis (ARSVL) in der Medulla oblongata, wo sich das HerzKreislauf-Zentrum befindet, und deren Fortsetzung, die Nuclei parabrachiales medialis et lateralis. Letztere sind Regionen der Umschaltung aufsteigender vegetativer Impulse in das laterale limbische System und zum Hypothalamus. 1.6.3 Leitungsbahnen Für die Pyramidenbahn und den Lemniscus medialis ist der Hirnstamm hauptsächlich Durchgangsstation. Die Fasern für die Hirnnervenkerne verlassen die Pyramidenbahn während ihres Verlaufs in den Crura cerebri und kurz danach. Im unteren Teil der Brücke sammeln sich die Faserbündel der Pyramidenbahn wieder und treten geschlossen aus dem Hirnstamm aus. Die Fasern verlaufen an der ventralen Fläche der Medulla oblongata, die Pyramide bildend, und senken sich dann unter Kreuzung von 80% der Fasern auf die gegenüberliegende Seite in das Rückenmark ein. Etwa 20% der Fasern bleiben ipsilateral und enden ipsilateral oder kreuzen weiter kaudal. Die Fasern aus der Area 4, die für die fein differenzierte Motorik der Extremitäten verantwortlich sind, kreuzen. Die Fasern aus der Area 6, die für Haltung und Stellung der Rumpfmuskulatur zuständig sind, bleiben auf der gleichen Seite oder kreuzen auf der Höhe des Rückenmarksegmentes. Der Lemniscus medialis enthält Fasern, die aus den Hinterstrangkernen Nucleus gracilis und cuneatus medialis hervorgehen und zum Thalamus ziehen. Von den Hinterstrangkernen kommend, verlaufen die Axone zunächst als Fibrae arcuatae internae im unteren Teil der Medulla oblongata zur gegenüberliegenden Seite. Nach Überschreiten der Mitte, der Raphe (Naht), wenden sich die Fasern rostralwärts und werden von nun an mediale Schleife, Lemniscus medialis, genannt. Der Lemniscus medialis ist somatotopisch gegliedert. Die mediale Schleife gibt als epikritische Bahn keine Kollateralen an die Formatio reticularis ab. Sie endet im Nucleus ventralis posterior des Thalamus, dessen Relaiszelle die Fortsetzung der Erregung zur Großhirnrinde übernimmt. 1.7 Aktivierungssysteme Aktivierungssysteme sind besondere Zellverbände im ZNS, die neuronale Abläufe durch zusätzliche Aktivitäten fördern oder hemmen. Diese Zellverbände liegen in der Mittelachse des ZNS, v.a. im Hirnstamm. Sie nehmen Erregungen von anderen Neuronen oder auch humorale Botenstoffe auf und bringen durch zusätzliche synaptische Förderung oder Hemmung übergeordnete Gesichtspunkte in neuronale Abläufe ein. Wenn die modulierten Erregungsabläufe rostral vom Hirnstamm liegen, so spricht man von aufsteigender Aktivierung. Liegen die beeinflussten Prozesse kaudal vom Hirnstamm, so handelt es sich um absteigende Aktivierung – ebenso, wenn von zentraler Stelle aus die Empfindlichkeit von Sinneszellen für bestimmte Reize verändert wird. Ursprünglich meinten Moruzzi u. Magoun (1949) mit Aktivierung im ZNS die EEG-Veränderungen, die mit einer Erhöhung des Wachheitsgrades und der gesteigerten Aufmerksamkeit des Individuums verbunden sind (Desynchronisation des EEG). Sie verwiesen auf die Formatio reticularis des Hirnstamms als das verantwortliche morphologische Substrat. Heute wird der Begriff »Aktivierungssystem« weiter gefaßt und mehr gegliedert, wobei die Aktivierung der Großhirnrinde nach wie vor im Vordergrund steht, aber auch die Aktivierung des Rückenmarks und der Sinneseindrücke mit einbezogen wird. Die lokalen Erregungsmuster in der Großhirnrinde beim Erinnern und Denken benötigen mehr als nur die Erregungen der spezifischen Thalamuskerne. Zusätzliche Aktivierungen sind erforderlich. Auch eine wirkungsvolle Motorik und eine leistungsfähige Sensorik sind auf die Konzentration auf Wesentliches und die Unterdrückung von Unwesentlichem angewiesen. Neben dem klassischen Aktivierungsmechanismus sind heute transmitterspezifische Aktivierungssysteme bekannt. Die Transmitter Serotonin, Noradrenalin, Adrenalin, Dopamin, Acetylcholin und Histamin sind die Kennzeichen dieser Systeme. 1 2 1.7.1 Klassisches Aktivierungssystem Grundlage des klassischen Aktivierungssystems ist die Formatio reticularis des Hirnstamms. Vom Rückenmark treffen mechanische, thermische und nozizeptive Erregungen (Tractus spinothalamicus) ein, aus dem Hirnstamm kommen viszerosensible, somatosensible, akustische und vestibuläre Impulse (von den Hirnnervenkernen), aus dem Kleinhirn, aus den Basalganglien sowie aus der Großhirnrinde (Tractus corticoreticularis und Kollateralen der Pyramidenbahn) Impulse aus dem motorischen Geschehen. Durch die kollaterale Vernetzung der Zellen in der Formatio reticularis (⊡ Abb. 1.14) geht der spezifische Inhalt der Afferenzen verloren; die Erregungen werden aufsummiert und diese Summe als Aktivität weitergereicht. Die Afferenzen des Hirnstamms sind nicht alle gleich wirksam: Akustische Reize wirken stärker als optische, und Schmerzreize wirken stärker als mechanische Reize. Die Weiterleitung der Aktivität der Formatio reticularis zur Großhirnrinde (⊡ Abb. 1.15) erfolgt über den Thalamus, und zwar über die intralaminären Kerne, den Nucleus centromedianus und den Nucleus parafascicularis sowie über den Nucleus ventralis anterior. Histologisch erscheint die Lamina medullaris interna des Thalamus mit den eingestreuten Neuronen wie eine Fortsetzung der Formatio reticularis des Hirnstamms. Die Projektionsneurone der intralaminären Kerne entsenden dünne aktivierende Nervenfortsätze in die Lamina I und die Lamina VI der Rinde (⊡ Abb. 1.3). Die intralaminären Kerne projizieren außerdem mit dickeren Axonen in das äußere Segment des Pallidums (⊡ Abb. 1.15). Das äußere Segment wirkt hemmend auf das innere und damit enthemmend auf den Nucleus ventralis anterior thalami. Die Neurone des Nucleus ventralis anterior wirken fördernd in der multimodalen Assoziationsrinde. Der Nucleus ventralis anterior ist damit eine wichtige Station im aufsteigenden Aktivierungssystem und ein wichtiger Relaiskern für die multimodale Großhirnrinde. Die Thalamuskerne, Nucleus centromedianus und Nucleus parafascicularis, entsenden Ausläufer in das Striatum. Das Striatum wirkt hemmend auf das innere Pallidumsegment und damit indirekt fördernd auf den Nucleus ventralis anterior. Die für das Bewusstsein notwendige Aktivierung der Großhirnrinde erfolgt damit sowohl direkt über den Thalamus als auch indirekt über die Basalganglien und den Thalamus. 1 19 1.7 · Aktivierungssysteme 3 4 12 13 5 6 11 7 10 9 8 ⊡ Abb. 1.15. Klassisches Aktivierungssystem. 1 Neokortex, 2 Nuclei intralaminares thalami, 3 Nucleus centromedianus et parafascicularis thalami, 4 Nucleus ventralis anterior thalami, 5 Nucleus cuneiformis, 6 Nucleus pedunculopontinus, 7 Nucleus reticularis pontis oralis, 8 Nucleus reticularis gigantocellularis, 9 Nucleus reticularis pontis caudalis, 10 Area lateralis hypothalami, 11 Nuclei septi, 12 Striatum, 13 Pallidum Das absteigende klassische Aktivierungssystem schickt 2 Bahnen zum Rückenmark. Im Nucleus reticularis gigantocellularis der Medulla oblongata beginnt der Tractus reticulospinalis lateralis (⊡ Abb. 1.18), der in der Zona intermedia (Lamina VII nach Rexed) des Rückenmarks endet, v. a. an Interneuronen, die hemmend auf Strecker wirken. Diese Bahn unterstützt die Wirkung des Tractus corticospinalis lateralis, der fördernd auf die Beuger wirkt. In den Nuclei reticulares pontis caudalis et oralis der Brücke beginnt der Tractus reticulospinalis medialis (⊡ Abb. 1.18). Er endet an den medialen Motoneuronen des Vorderhorns (Lamina VIII nach Rexed) und wirkt fördernd auf die Streckermuskulatur. Der Tractus reticularis medialis wirkt aktivierend gemeinsam mit dem Tractus vestibulospinalis auf die Rumpfmuskulatur, die den Körper in aufrechter Stellung hält, und auf die der Schwerkraft der Erde entgegengerichtete Muskulatur.