Page as PDF - Max-Planck
Werbung

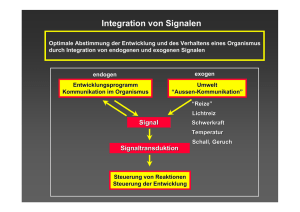
Jahrbuch 2015/2016 | Bayer, Martin; Jürgens, Gerd | Frühe Embryonalentw icklung von Arabidopsis Frühe Embryonalentwicklung von Arabidopsis Early embryogenesis of Arabidopsis Bayer, Martin; Jürgens, Gerd Max-Planck-Institut für Entw icklungsbiologie, Tübingen Korrespondierender Autor E-Mail: [email protected] Zusammenfassung In der Embryonalentw icklung w ird die Körperorganisation der erw achsenen Pflanze in ihren Grundzügen etabliert. Anfänglich teilt sich die befruchtete Eizelle (Zygote) in eine apikale embryonale Zelle und eine basale extra-embryonale Zelle. W ie dieser anfängliche Unterschied mit Hilfe des beteiligten YODA-Signalw egs zustande kommt, w ird skizziert. Aus diesen Zellen entstehen Embryo und extra-embryonaler Suspensor. Die embryonalen Zellen erzeugen dann in Antw ort auf das Pflanzenhormon Auxin ein Signal, das die benachbarte extra-embryonale Zelle zur Bildung des embryonalen W urzelmeristems anregt. Summary The basic features of the body organisation of adult plants are established during embryogenesis. This process starts from the fertilized egg cell (zygote), w hich divides into an apical embryonic cell and a basal extra-embryonic cell. How this initial difference originates w ith input from the YODA pathw ay is briefly discussed. These cells give rise to embryo and extra-embryonic suspensor, respectively. The embryonic cells then generate, in response to the plant hormone auxin, a signal that stimulates the adjacent extra-embryonic cell to initiate the formation of the embryonic root meristem. Besonderheiten der pflanzlichen Embryonalentwicklung Vielzellige Organismen entw ickeln sich aus einer einzelnen Zelle, der Zygote, als Ergebnis der Befruchtung der Eizelle durch ein Spermium. W ährend der Embryonalentw icklung entstehen aus der Zygote durch Zellteilung viele Zellen, die sich zu verschiedenen Zelltypen differenzieren. Diese Zelltypen sind in einem räumlichen Muster angeordnet, das die charakteristische Körperorganisation des erw achsenen Organismus zumindest in den Grundzügen darstellt. Die molekularen Mechanismen der Musterbildung in der Embryonalentw icklung von Tieren, w ie zum Beispiel bei der Fruchtfliege Drosophila, sind im Detail analysiert w orden. Im Gegensatz dazu ist erst in Ansätzen verstanden, w ie die Grundzüge der Körperorganisation von Pflanzen, w ie zum Beispiel bei Arabidopsis, in der Embryonalentw icklung entstehen. Es ist anzunehmen, dass daran andere molekulare Mechanismen beteiligt sind, da Pflanzen und Tiere in der Evolution unabhängig voneinander aus einzelligen Vorfahren hervorgegangen sind. © 2016 Max-Planck-Gesellschaft w w w .mpg.de 1/7 Jahrbuch 2015/2016 | Bayer, Martin; Jürgens, Gerd | Frühe Embryonalentw icklung von Arabidopsis Blütenpflanzen w eisen eine doppelte Befruchtung auf, bei der zw ei genetisch identische w eibliche Keimzellen die Eizelle und die Zentralzelle - in einer Samenanlage von zw ei genetisch identischen Spermien eines Pollens befruchtet w erden. Die befruchtete Zentralzelle bringt das Endosperm hervor, das zur Ernährung des Embryos beiträgt. Die befruchtete Eizelle bildet nicht nur den Embryo, sondern auch eine anhängende extraembryonale Struktur (Suspensor), die den Embryo im mütterlichen Gew ebe der Samenanlage verankert. Normalerw eise bringt eine Samenanlage von Arabidopsis nur einen Embryo hervor. Durch bestimmte Mutationen kann jedoch eine von zw ei Hilfszellen, Synergiden genannt, die bei der Befruchtung den Pollenschlauch mit den Spermien anlocken, zu einer w eiteren Eizelle w erden. Erfolgt dann die Befruchtung durch Pollen mit überzähligen Spermien, so entstehen in einer Samenanlage Zw illingsembryonen, die sich zu Pflanzen entw ickeln [1]. © Max-Planck-Institut für Entw icklungsbiologie/Bayer Video: 3D-Animation eines Arabidopsis-Embryos mit pPIN1:PIN1-GFP Expression Im Globularstadium ist der Auxin-Efflux-Carrier PIN1 (grün) an den basalen Enden der zentralen Zellen des Proembryos lokalisiert. Dadurch w ird Auxin in den angrenzenden Suspensor transportiert und bestimmt dort das Schicksal der Hypophysenzelle. Pflanzenzellen sind von einer Zellw and umgeben, w eshalb sie ihren Entstehungsort nicht verlassen können. Änderungen in der Gestalt des sich entw ickelnden Embryos kommen dadurch zustande, dass einzelne Zellen oder Zellgruppen sich unterschiedlich schnell teilen und dass die Orientierung der Zellteilungsebene reguliert w ird. Im Vergleich zum gleichaltrigen Embryo anderer Pflanzenarten besteht der Embryo von Arabidopsis thaliana aus w eniger Zellen. Damit verbunden ist ein sehr regelmäßiges Zellteilungsmuster, das auf eine frühe Festlegung von Zellschicksalen hinzudeuten scheint [2]. De facto hängt das Schicksal einer Zelle jedoch nicht von ihrer Herkunft, sondern von ihrer Lage im sich entw ickelnden Embryo ab. Frühe Embryonalentwicklung von Arabidopsis thaliana Die Zygote von Arabidopsis thaliana streckt sich in der zukünftigen apikal-basalen Achse und teilt sich asymmetrisch in eine kleinere apikale und eine größere basale Zelle (Abb. 1). Die apikale Zelle w ird durch charakteristische Zellteilungen mit w echselnden Orientierungen den Proembryo, das heißt, den Embryo ohne die W urzelspitze, hervorbringen, und die basale Zelle durch w iederholte horizontale Zellteilungen einen fädigen extra-embryonalen Suspensor, der den Embryo in der Samenanlage verankert. Nur die oberste Zelle des Suspensors (rot in Abb. 1) w ird sekundär ein embryonales Schicksal annehmen und die Bildung des W urzelmeristems initiieren. Damit ist das Muster entlang der apikal-basalen Polaritätsachse mit den Hauptregionen apikal, zentral, basal und Suspensor etabliert. Quer zur apikal-basalen Achse w ird ein radiales Muster aus konzentrisch angelegten Gew ebeschichten gebildet [2]. © 2016 Max-Planck-Gesellschaft w w w .mpg.de 2/7 Jahrbuch 2015/2016 | Bayer, Martin; Jürgens, Gerd | Frühe Embryonalentw icklung von Arabidopsis A bb. 1: Ze llte ilungsm uste r und Ze llschick sa le in de r frühe n Em bryoge ne se . (A ) Die Zygote stre ck t sich in de r zuk ünftige n a pik a l-ba sa le n Achse und te ilt sich in e ine k le ine re a pik a le e m bryona le (viole tt) und e ine größe re ba sa le e x tra e m bryona le (bla u) Ze lle . Die se be ide n Ze lle n unte rsche ide n sich in de r Ge ne x pre ssion, in de r O rie ntie rung de r Ze llte ilungse be ne und im Ze llschick sa l. (B) Durch cha ra k te ristische Ze llte ilunge n e ntste he n da s 8-Ze ll-Sta dium de s P roe m bryos (viole tt, grün) und de r fä dige Suspe nsor (bla u; die obe rste Ze lle (rot) nim m t se k undä r e m bryona le s Schick sa l a n). Die Ex pre ssionsdom ä ne n ve rschie de ne r Ge ne e ntspre che n ve rschie de ne n R e gione n de s Em bryos (viole tt, a pik a l; grün, ze ntra l; rot, ba sa l). (C) Globula rsta dium ; (D) He rzsta dium ; (E) Ke im ling. Die frühe m bryona le n R e gione n bringe n be stim m te Abschnitte de r a pik a l-ba sa le n Körpe ra chse de s Ke im lings he rvor. Die Ze llte ilungse be ne de r Zygote ist rot m a rk ie rt; da ra us e ntste ht e ine k lona le Gre nze , die spä te r durch da s W urze lm e riste m ve rlä uft (C -E). © Ma x -P la nck -Institut für Entwick lungsbiologie /Ba ye r, Jürge ns Die ersten Zellschicksale zu Beginn der Embryonalentwicklung – Entstehung von Embryo und extra-embryonalem Suspensor W ie bereits beschrieben, teilt sich die Zygote von Arabidopsis in zw ei verschieden große Zellen, die auch verschiedene Gene exprimieren und verschiedene Zellschicksale annehmen [3]. Die kleinere apikale Zelle bringt durch eine charakteristische Abfolge regulierter Zellteilungen einen kugelförmigen Proembryo hervor, w ährend die größere basale Zelle durch w iederholte horizontale Zellteilungen einen fädigen Suspensor aus w enigen Zellen bildet. Die Entw icklungsentscheidung zw ischen embryonaler Entw icklung der apikalen Tochterzelle und SuspensorEntw icklung der basalen Tochterzelle w ird schon in der Zygote durch eine Phosphorylierungskaskade mit der zentralen Kinase YODA beeinflusst. Dabei fördert YODA-Aktivität die Differenzierung zu Suspensorzellen. Umgekehrt führt Verlust von YODA-Aktivität zu Embryo-typischen Zellteilungsmustern im Suspensor und teilw eise zur Bildung von Embryonen ohne erkennbaren Suspensor. W ird YODA experimentell in allen Zellen aktiviert, unterdrückt dies eine embryonale Entw icklung und es w erden fadenförmige Strukturen gebildet, die nur aus Suspensorzellen bestehen. An der Aktivierung des embryonalen YODA-Signalw egs in der Zygote ist die membranständige Kinase SHORT SUSPENSOR (SSP) beteiligt (Abb. 2). Die Aktivierung erfolgt über einen ungew öhnlichen Mechanismus, der die YODA-Aktivität mit der Befruchtung der Eizelle zeitlich verbindet: Das SSP Gen ist w ährend der Embryogenese nicht aktiv. SSP Transkripte w erden ausschließlich in den Spermienzellen des reifen Pollens gebildet, w o sie jedoch nicht in Protein translatiert w erden. Das SSP Protein w ird erst nach Befruchtung in der Zygote erzeugt, nachdem die SSP Transkripte mit den Spermienzellen in die Eizelle gelangt sind [4]. Die zeitlich begrenzte © 2016 Max-Planck-Gesellschaft w w w .mpg.de 3/7 Jahrbuch 2015/2016 | Bayer, Martin; Jürgens, Gerd | Frühe Embryonalentw icklung von Arabidopsis Anw esenheit des SSP Proteins an der Zygotenmembran scheint dabei ausreichend zu sein, um den embryonalen YODA-Signalw eg anzuschalten. A bb. 2: Entste hung unte rschie dliche r Ze llschick sa le zu Be ginn de r Em bryona le ntwick lung. (A ) Die Spe rm ie nze lle n bringe n be i de r Be fruchtung SHORT SUSPENSOR (SSP) Tra nsk ripte zur Eize lle , die in de r Zygote in SSP P rote in tra nsla tie rt we rde n. Die Ak tivie rung de s e m bryona le n YO DA-Signa lwe gs durch SSP führt zur Stre ck ung und a sym m e trische n Te ilung de r Zygote . (B) YO DA-Ak tivitä t in de r ba sa le n Tochte rze lle förde rt die Entwick lung de s Suspe nsors. Aux in wird durch de n Aux inEfflux -C a rrie r P IN7 von de r ba sa le n Ze lle in die a pik a le Ze lle tra nsportie rt. De r ste ige nde Aux inspie ge l führt dort zum Abba u de s Inhibitors BDL und da m it zu e ine r Aux ina ntwort, die durch de n Tra nsk riptionsfa k tor MP ve rm itte lt wird und die Entwick lung de s P roe m bryos förde rt. In de r ba sa le n Ze lle hinge ge n wird - na ch Abba u de s Inhibitors IAA10, e ine von AR F9 und AR F13 ve rm itte lte Aux ina ntwort - zusa m m e n m it de m YO DA-Signa lwe g - da s Suspe nsorschick sa l förde rn. © Ma x -P la nck -Institut für Entwick lungsbiologie /Ba ye r, Jürge ns Die frühe Aktivierung des YODA-Signalw egs durch SSP trägt zu der für Brassicaceae typischen, strikten Musterbildung im frühen Embryo bei. Verlust von SSP-Aktivität führt zu inkorrekten Zellidentitäten im Bereich zw ischen Embryo und Suspensor und zu einer deutlichen Verzögerung der Embryogenese [5]. Neben dem embryonalen YODA-Signalw eg spielt auch das Pflanzenhormon Auxin eine zentrale Rolle bei der Ausbildung des Embryos. W ie embryonaler YODA-Signalw eg und Auxin-Antw ort auf molekularer Ebene zusammenarbeiten, ist noch ungeklärt. Auxin und die Hauptachse der Polarität Auxin ist das einzige bekannte Pflanzenhormon, das gerichtet transportiert w ird. Dieser gerichtete Transport w ird durch Auxin-Efflux-Carrier der PIN-Familie bew irkt, die in der Plasmamembran auf einer Seite der Zelle lokalisiert sind und Auxin aus der Zelle befördern. Zw ei Mitglieder der PIN-Familie, PIN1 und PIN7, spielen in © 2016 Max-Planck-Gesellschaft w w w .mpg.de 4/7 Jahrbuch 2015/2016 | Bayer, Martin; Jürgens, Gerd | Frühe Embryonalentw icklung von Arabidopsis der frühen Embryogenese eine w ichtige Rolle [6]. Nach der Teilung der Zygote w ird PIN7 in der basalen Tochterzelle exprimiert und in der Plasmamembran an der Grenze zur apikalen Tochterzelle der Zygote lokalisiert (Abb. 3). Dadurch kommt es zur Akkumulation von Auxin in der apikalen Tochterzelle und dem daraus entstehenden Proembryo. Auxin w ird in den Zellen nicht direkt, sondern zumeist durch Auxin-induzierte Reportergenexpression nachgew iesen. Wenn der Embryo aus 32 Zellen besteht, kommt es zur Neusynthese von Auxin im oberen Teil des Embryos und es w erden PIN1 und PIN7 an die basalen Seiten der Zellen umgelagert [6, 7] (Abb. 3C). Dadurch w ird der Auxin-Transport nach unten gerichtet und es kommt zur Akkumulation von Auxin am basalen Ende des Embryos, w o das W urzelmeristem entsteht. Diese Verteilung des Auxins bleibt bis zum Ende der Embryonalentw icklung erhalten [6]. A bb. 3: Aux in-Tra nsport und Aux in-Antwort in de r frühe n Em bryoge ne se .(A ) Aux in wird von P IN7 (viole tte Linie ) a us de r ba sa le n Ze lle tra nsportie rt (viole tte r P fe il) und a k k um ulie rt in de r a pik a le n Ze lle (grün), in de r de r Tra nsk riptionsfa k tor MP und se in Inhibitor BDL e x prim ie rt we rde n (bla ue r P unk t). (B) Im 8-Ze ll-Sta dium wird Aux in in de n Na chk om m e n de r a pik a le n Ze lle (P roe m bryo; grün) a k k um ulie rt, da P IN1 (rote Linie n) im Ge ge nsa tz zu P IN7 (viole tte Linie n) k e ine pola re Lok a lisie rung a ufwe ist. (C) Im Globula rsta dium sind P IN1 und P IN7 a n de n ba sa le n Ende n de r Ze lle n lok a lisie rt (dick e rote bzw. viole tte Linie ), Aux in wird da he r na ch unte n tra nsportie rt (rote r P fe il) und a k k um ulie rt a m W urze le nde de s Em bryos (grün). De r ba sa le Aux in-Tra nsport hä ngt von de r Aux inAntwort im P roe m bryo a b; na ch Abba u von BDL a k tivie rt MP die Synthe se von P IN1 und de m Tra nsk riptionsfa k tor TMO 7 (ge lbe P unk te ), de r in die a ngre nze nde Suspe nsorze lle wa nde rt (ge lbe P fe ile ) und zusa m m e n m it Aux in da s Schick sa l die se r Ze lle (H; grün) be stim m t. Die viole tte n und rote n P fe ile ge be n die R ichtung de s Aux in Flusse s a n. © Ma x -P la nck -Institut für Entwick lungsbiologie /Ba ye r, Jürge ns Die Auxin-Antw ort im jungen Embryo w ird durch den Transkriptionsfaktor MONOPTEROS (MP; auch als AUXIN RESPONSE FACTOR 5, ARF5, bezeichnet) und seinen Inhibitor BODENLOS (BDL, alias IAA12) vermittelt [7]. In Abw esenheit von Auxin verhindert der Inhibitor BDL die Aktivierung von Auxin-induzierbaren Genen durch MP, w ährend die Akkumulation von Auxin zum Abbau von BDL und damit zur Freisetzung von MP führt. Interessanterw eise bew irkt MP auch die Expression seines Inhibitors BDL und seine eigene Expression. Damit hat dieses Modul der Auxin-Antw ort die Fähigkeit, in Auxin abhängiger Weise von geringer Expression auf stabile hohe Expression umzuschalten [8]. Es eignet sich somit für die Festlegung von Zellschicksal w ährend der Entw icklung. MP und BDL w erden nur im Proembryo exprimiert, aber für die Änderung des Schicksals der angrenzenden Suspensorzelle (H, Abb. 3C) benötigt [7]. Diese nicht-autonome W irkung der Auxin-Antw ort w ird offenbar durch zw ei nachgeschaltete Vorgänge vermittelt: In Abhängigkeit vom Auxinpegel steuert MP die Expression © 2016 Max-Planck-Gesellschaft w w w .mpg.de 5/7 Jahrbuch 2015/2016 | Bayer, Martin; Jürgens, Gerd | Frühe Embryonalentw icklung von Arabidopsis von PIN1 und damit indirekt den Transport von Auxin zur obersten Suspensorzelle. Darüber hinaus ist MP auch für TMO7 Expression verantw ortlich. Der Transkriptionsfaktor TMO7 bew egt sich aus dem unteren Bereich des Proembryos in die benachbarte Suspensorzelle und beeinflusst deren Schicksal dahingehend, dass embryonales W urzelmeristem angelegt w ird [9]. Die MP-abhängige Akkumulation von Auxin in der obersten Suspensorzelle bew irkt eine w eitere Auxin-Antw ort, die ebenfalls für die Festlegung des Schicksals dieser Zelle auf die Initiierung des W urzelmeristems von Bedeutung ist. Dieses zw eite Modul in der Embryogenese besteht aus den Transkriptionsfaktoren ARF9 und ARF13 sow ie aus dem Inhibitor IAA10, die alle in den Suspensorzellen exprimiert w erden (Abb. 2, 3; [10]). W ird diese Auxin-Antw ort unterdrückt, dann exprimiert der Suspensor embryonale Markergene, und es können Zw illingsembryonen entstehen. Die Forschung in den kommenden Jahren w ird zeigen, w ie sich die Auxin-Antw orten in Proembryo und Suspensor unterscheiden und w elche Zielgene jew eils beeinflusst w erden. Weiterhin gilt zu klären, w ie AuxinAntw ort und YODA Signalw eg auf molekularer Ebene bei der embryonalen Musterbildung zusammen arbeiten. Literaturhinweise [1] Kong, J.; Lau, S.; Jürgens, G. Twin plants from supernumerary egg cells in Arabidopsis Current Biology 25, 225-230 (2015) [2] Jürgens, G.; Mayer, U. Arabidopsis In: EMBRYOS. Colour Atlas of Development. J.B.L. Bard (ed.), pp. 7-21. W olfe Publishing, London (1994) [3] Slane, D.; Kong, J.; Berendzen, K.W.; Kilian, J.; Henschen, A.; Kolb, M.; Schmid, M.; Harter, K.; Mayer, U.; De Smet, I.; Bayer, M.; Jürgens, G. Cell type-specific transcriptome analysis in the early Arabidopsis thaliana embryo Development 141, 4831-4840 (2014) [4] Bayer, M.; Nawy, T.; Giglione, C.; Galli, M.; Meinnel, T.; Lukowitz, W. Paternal control of embryonic patterning in Arabidopsis thaliana Science 323, 1485-1488 (2009) [5] Babu, Y .; Musielak, T.; Henschen, A.; Bayer, M. Suspensor length determines developmental progression of the embryo in Arabidopsis Plant Physiology 162, 1448-1458 (2013) [6] Friml, J.; Vieten, A.; Sauer, M.; Weijers, D.; Schwarz, H.; Hamann, T.; Offringa, R.; Jürgens, G. Efflux-dependent auxin gradients establish the apical-basal axis of Arabidopsis Nature 426, 147-153 (2003) [7] Weijers, D.; Schlereth, A.; Ehrismann, J.S.; Schwank, G.; Kientz, M.; Jürgens, G. Auxin triggers transient local signaling for cell specification in Arabidopsis embryogenesis Developmental Cell 10, 265-270 (2006) © 2016 Max-Planck-Gesellschaft w w w .mpg.de 6/7 Jahrbuch 2015/2016 | Bayer, Martin; Jürgens, Gerd | Frühe Embryonalentw icklung von Arabidopsis [8] Lau, S.; De Smet, I.; Kolb, M.; Meinhardt, H.; Jürgens, G. Auxin triggers a genetic switch Nature Cell Biology 13, 611-615 (2011) [9] Schlereth, A.; Moeller, B.; Liu, W.; Kientz, M.; Flipse, J.; Rademacher, E.H.; Schmid, M.; Jürgens, G.; Weijers, D. MONOPTEROS controls embryonic root initiation by regulating a mobile transcription factor Nature 464, 913-916 (2010) [10] Rademacher, E.H.; Lokerse, A.S.; Schlereth, A.; Llavata-Peris, C.I.; Bayer, M.; Kientz, M.; Freire Rios, A.; Borst, J.W.; Lukowitz, W.; Jürgens, G.; Weijers, D. Different auxin response machineries control distinct cell fates in the early plant embryo Developmental Cell 22, 211-222 (2012) © 2016 Max-Planck-Gesellschaft w w w .mpg.de 7/7