2. Hauptsatz der Thermodynamik: Clausius
Werbung

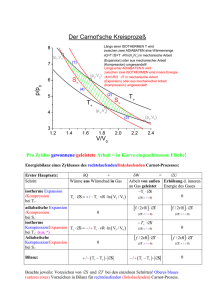
2. Hauptsatz der Thermodynamik: Clausius: Es existiert kein thermodynamische Kreisprozess, dessen einzige Wirkung darin besteht, Wärme von einem kälteren Reservoir zu einem wärmeren Reservoir zu transportieren. In abgeschlossenen Systemen kann die Entropie nicht abnehmen. p. 58 Äquivalente Formulierungen des 2. HS: William Thomson (Lord Kelvin) & Max Planck: Es existieren keine thermodynamischen Zustandsänderungen, deren einzige Wirkung es ist, eine Wärmemenge einem Wärmespeicher zu entnehmen (Abkühlen) und diese vollständig in Arbeit umzusetzen. Es gibt kein Perpetuum mobile zweiter Art g p p. 59 Zur Gleichheit der Formulierungen von Clausius und Kelvin 1. Annahme: Perpetuum mobile 2. Art (nach Kelvin, links) Wärme von Reservoir T1 wird vollständig in Arbeit W überführt 2. Annahme: Carnot‐Maschine als Wärmepumpe (rechts) Mit der zugeführten Arbeit W, wird Wärme aus dem kalten Reservoir T2 in das warme Reservoir T1 gepumpt. Resultat: Beide Maschinen kombiniert ergeben ein System, dass ohne Einwirkung von außen Wärme vom kalten zum warmen Reservoir fließt ⇒ Widerspruch mit 2. Hauptsatz von Clausius Widerspruch mit 2. Hauptsatz von Clausius ! p. 60 Zum maximalen Wirkungsgrad des Carnot‐Prozess Es gibt keine Wärmekraftmaschine, die bei gegebenen mittleren Temperaturen der Wärmezufuhr und Wärmeabfuhr einen höheren Wirkungsgrad hat als der aus diesen Temperaturen gebildete Carnot Wirkungsgrad hat als der aus diesen Temperaturen gebildete Carnot‐ Wirkungsgrad. Beweis durch Widerspruch: Gäbe es eine effizientere Wärmekraftmaschine als den Carnot‐Prozess, so könnte man sie mit einer Carnot‐Maschine zu einem Perpetuum mobile 2. Art koppeln. Korollar: Jede reversible arbeitende ideale Wärmekraftmaschine hat genau den gleichen Wirkungsgrad Wirkungsgrad. p. 61 Frage: Frage: Sie kennen alle die kalte Luft, die uns entgegenströmt, wenn wir die Kühlschranktüre öffnen…. Wenn wir die Kühlschranktüre nun offen lassen, wird die Zimmertemperatur i d di Zi a) sinken b) steigen b) steigen c) konstant bleiben p. 62 Entropie… Was ist das ? Thermodynamik: eine extensive Zustandsgröße der Dimension [J/K] Statistische Physik: Ein Maß für das dem System zugängliche „Phasenraumvolumen“ Anschaulicher: Ein Maß für die Zahl der mikroskopischen Zustände die ein System unter Einhaltung aller Randbedingungen (Energieerhalt etc..) einnehmen kann, um Einhaltung aller Randbedingungen (Energieerhalt etc ) einnehmen kann um den gleichen Makrozustand zu erzeugen „Ein Maß für die Unordnung“, denn je mehr Zustände es gibt, desto weniger „ g , j g , g vorhersagbar ist der konkret momentan realisierte Detailzustand Berechenbarkeit und Messbarkeit: Die Entropieänderung kann oft einfach berechnet werden, Es gibt kein Entropiemeter zur Messung der absoluten Entropie Die absolute Entropie ist aber in Spezialfällen und über den 3. Hauptsatz der Thermodynamik berechenbar Thermodynamische Definition (Clausius 1865 zur Beschreibung von Kreisprozessen thermodyn. Maschinen) In reversiblen Prozessen (adiabatisch) kann man definieren Reversibel Zu- oder abgeführte Wärmemenge Entropieänderung Systemtemperatur Die (transportierte) Entropieänderung darf positiv oder negativ sein: Wärmezufuhr erhöht die Entropie Wärmeabfuhr verringert die Entropie Reversibler Kreisprozess: Warum die Entropie eine Zustandsgröße und wegunabhängig ist … Carnot Wirkungsgrad Umformen ‐ mit der „reduzierten Wärme“: Q/T ‐ ergibt E Erweiterung von auf mehrere Carnot‐Prozesse / beliebige Kreisprozesse it f h C tP / b li bi K i Warum die Entropie im reversiblen Prozess eine Zustandsgröße und wegunabhängig ist 3 Carnot‐Prozesse Beliebige Zerlegung Wegen: ⇒ ⇒ ⇒ unabhängig vom Weg unabhängig vom Weg bhä i W Entropiezuwachs ist eine Frage der Wahrscheinlichkeit Vorher (a): Alle 4 Atome links (roter Pfad): Alle 4 Atome links (roter Pfad): Nach Wegnahme der Wand (b, blauer Pfad): z.B. 2 Atome links, 2 Atome rechts: Bilder: in Anlehnung an Halliday „Physik“ Überströmexperiment von Gay‐Lussay: Eine Thermodynamische Betrachtung der Entropieänderung … Entropie ist eine Zustandsgröße, d.h. unabhängig vom Weg zwischen Anfang und Ende. ⇒ Betrachte sequentiell infinitesimale Verschiebung der Wand zwischen V1 und V2 ⇒ Ideales Gasgesetz: http://upload.wikimedia.org/wikipedia/commons/thumb/d/d1/Gay-Lussac.jpg/250px-Gay-Lussac.jpg Entropiedefinition von Ludwig Boltzmann Definition der Entropie nach Boltzmann: Hier ist Ω die Zahl der möglichen Zustände des Systems Hier ist Ω die Zahl der möglichen Zustände des Systems Anwendung auf das Gas mit N unterscheidbaren Atomen, die sich vom Volumen V1 auf das Volumen V Volumen V auf das Volumen V2>V1 verteilen: Für jedes Teilchen gilt ist die Zahl der erreichbaren Positionen direkt p p proportional zum zugänglichen Volumen: g g Das ist identisch mit der Ableitung gemäß der Entropiedefinition i id i h i d bl i äß d i d fi i i über die ausgetauschte Wärmemenge p. 69 Isentroper Prozess (S = const) Isentrop = die Entropie bleibt unverändert ⇒ J d Jeder adiabatische, irreversible Prozess ist isentrop di b ti h i ibl P i ti t ⇒ Aber: nicht jeder isentrope Prozess ist adiabatisch irreversibel Bilder: Halliday „Physik“ Entropie in irreversiblen Prozessen Dabei ist δWdiss Arbeit, die i innerhalb des Systems dissipiert h lb d S t di i i t wird id nicht nach außen wirkt infolge von Reibungs‐ g g oder Stoßvorgängen die innere Energie erhöht g g g immer positiv ist. dSirr = δWdiss /T ≥ 0 ist „produzierte Entropie“ Kann in adiabatischen abgeschlossenen Systemen nur positiv sein Nebenbemerkung Alle spontan ablaufenden Prozesse sind irreversibel. Dort findet immer eine Entropiezunahme statt. Beispiele: Vermischung von zwei Flüssigkeiten Wärmefluss vom heißen zum kalten Körper Reversible Prozesse sind nicht mit einer Erhöhung der Gesamtentropie verbunden und laufen daher auch nicht spontan ab. Durch die Beschreibung spontan ablaufender Prozesse zeichnet der zweite Durch die Beschreibung spontan ablaufender Prozesse zeichnet der zweite Hauptsatz der Thermodynamik eine Richtung der Zeit aus „In der Natur nimmt die Entropie die Rolle des Direktors ein, die Energie aber nur die eines Buchhalters “ (Arnold Sommerfeld) nur die eines Buchhalters.“ (Arnold Sommerfeld) p. 72 Thermodynamische Definition der Temperatur über den Wirkungsgrad von reversibel, periodisch arbeitenden Wärmekraftmaschinen Definition des Temperaturquotienten Entnehme Reservoir A wird eine infinitesimal kleine Wärmemenge QA Erzeuge mechanische Arbeit W und Abwärme QB in Reservoir B: QB = QA − W Das Verhältnis der Temperaturen von A bzw. B wird dann : Arbeit kann mit den üblichen mechanischen Verfahren bestimmt werden. Wahl des Temperatur‐Referenzpunkts Tripelpunkt des Wassers definiert auf TD Temperatur von 273,16 K Universalität: unabhängig von der Bauart der Wärmekraftmaschine, solange diese nur reversibel und periodisch arbeitet (z.B. Carnot‐Prozess) reversibel und periodisch arbeitet (z B Carnot‐Prozess) p. 73 3. Hauptsatz der Thermodynamik Nernst‐Theorem (3. Hauptsatz, 1906): Kein System kann bis zum absoluten Nullpunkt gekühlt werden Praktische Begründung: Mit sinkender Temperatur wird die Leistungszahl der Kältemaschine immer kleiner. Um T=0 K zu erreichen, muss man unendlich viel Arbeit aufwenden. p. 74 Alternative Formulierung des 3.Hauptsatzes Die Entropie verschwindet am absoluten Nullpunkt Wenn T → 0, dann S (T,P,V…) → S0 = k ∙ln (Ω0) = 0 Für alle physikalisch chemischen Reaktionen bei denen die teilnehmenden Für alle physikalisch‐chemischen Reaktionen, bei denen die teilnehmenden Stoffe am absoluten Nullpunkt als ideale kristalline Festkörper vorliegen, gilt: Es gibt nur eine Realisierungsmöglichkeit für ideale Festkörper am absoluten Nullpunkt: Ω0 = 1. Man kann die Entropie eines Gases damit absolut berechnen Der 3. Hauptsatz vorder, dass die molare Wärme jedes Gases am Nullpunkt verschwindet p. 75 Beispiele: „perpetuum mobile“ Perpetuum Mobile 1. Art Maschine mit Wirkungsgrad > 100 %, welche die zu ihrem Betrieb Maschine mit Wirkungsgrad > 100 %, welche die zu ihrem Betrieb notwendige Energie und zusätzlich Nutzenergie liefern würde Z.B. ein Wasserrad das Wasser nach oben pumpt und von einem Teil des wieder herabfliessenden Wassers angetrieben wird . Wassers angetrieben wird wieder herabfliessenden Eine batteriebetriebene Lampe, deren Batterie über ein von der Taschenlampe beleuchtetes photovoltaisches Element aufgeladen wird. Der Haken bei allen diesen Modellen: Energieerhaltung ist verletzt ! Energieerhaltung ist verletzt ! Reibungsverluste nicht eingerechnet Strahlungsverluste nicht eingerechnet p. 76 Perpetuum Mobile 2. Art … könnte Arbeit ausschließlich aus Umgebungswärme gewinnen „Respektiert den ersten Hauptsatz der Thermodynamik (Energieerhalt)“ Aber: Könnte man Wasser zum Kochen bringen, indem man ihm nur Wärme aus der Zimmerluft zuführt ? NEIN d Zi l ft füh t ? NEIN Kann man einen Kühlschrank betreiben, indem der Kompressor mit der Abwärme der Lebensmittel betrieben wird? NEIN Kann ein Schiff nur durch die Wärme des Meerwassers angetrieben werden ? NEIN Haken: Es verletzt den zweiten Hauptsatz der Thermodynamik, weil die vollständige Umwandlung von Arbeit in Wärme irreversibel ist. Im abgeschlossenen System kann die Entropie nicht abnehmen. Kann es prinzipiell niemals geben ! Ist der Alptraum jedes Patentanwalts Ist der Alptraum jedes Patentanwalts p. 77 Perpetuum Mobile 3. Art … leistet keine Arbeit, … leistet keine Arbeit, … behält für immer seine anfängliche Bewegung oder Energie bei Beispiele: p Supraleiter: elektrische Widerstand = Null ⇒ sehr gute Näherung Umlauf des Mondes um die Erde? ⇒ sehr lange Umlaufzeit aber dennoch Reibung h l l f i b d h ib ⇒ Erdrehung verlangsamt sich durch Gezeitenlange ⇒ Mond hat schon permanent sein „Gesicht“ zur Erde gedreht Suprafluidität: gute Näherung bei tiefen Temperaturen und kleinen Scherkräfte Im Alltag: Annäherungen durch Minimierung von Strahlung und Reibung p. 78 Effekte, die ein Perpetuum Mobile vortäuschen können Subtilere thermodynamische Maschinen Feynman‐Rad: flexibles Rad mit Gummibandspeichen, warmen Seite zieht sich zusammen (Gummi) und kältere entspannt sich M Massenverschiebung ⇒ hi b D h Drehmoment durch Gewichtskraft t d h G i ht k ft es dreht sich Intelligent betrieben ist es eine Wärmekraftmaschine, die schon wenig merkbare Temperaturdifferenzen ausnutzen und dennoch etwas Arbeit leisten kann. p. 79 Effekte, die ein Perpetuum Mobile vortäuschen können Trinkvogel (Verdunstungsmotor) Der Äther im Vogelbauch verdampft und hebt den Druck Äther steigt in den den Kopf und kondensiert im kalten Schnabel. Äther steigt in den den Kopf und kondensiert im kalten Schnabel Der wird Kopf schwerer (voll) und fällt nach vorn. Die Ätherflüssigkeit fließt wieder zurück und die Ente richtet sich auf. Das Eintauchen in das Wasser und die folgende Verdampfung des Wasser auf dem Schnabel der Ente sind wichtig !: Kühlung erlaubt die Kondensation des Äther Flüssigkeit Kühlung erlaubt die Kondensation des Äther‐Flüssigkeit. Eine durchsichtige Haube fängt die Luftfeuchtigkeit Beim Sättigungsdampfdruck stoppt die Verdampfungskühlung. Dadurch fehlt die Kühlung und die Ente bleibt stehen. p. 80 „Perpetua mobila“, die nicht die Hauptsätze der Thermodynamik verletzen Eisenauto über Gestänge mit starkem Magneten 1m voraus verbunden. Idee: der Magnet zieht das Fahrzeug an und wird durch das Fahreug vorgeschoben h b Aber: das gibt es nur in Kindermärchen ! • Jim Knopf und Lukas der Lokomotivführer (Michael Ende) • Baron von Münchhausen, der sich an eigenen Haaren selber aus dem Sumpf zog Interessant Die Idee verletzt keinen Hauptsatz der Thermodynamik ! Aber: sie verletzt Newtons Prinzip von actio = reactio Was (vermutlich) sehr wohl funktioniert: Was (vermutlich) sehr wohl funktioniert: Häng einem Esel einen Heusack in 1 m Entfernung Dann läuft der Esel ! (welche Distanz ist Eselpsychologisch wohl ideal … 50 cm ?). Aber wie lange ? Der Esel ist ja auch nicht dumm ! p. 81 Ein Gedankenexperiment zum 2. Hauptsatz Maxwell's Dämon Aufgabe von „Maxwell‘ss Dämon Aufgabe von „Maxwell Dämon“:: Moleküle sehen , vermessen & sortieren Öffnen und Schließen des Türchens so, dass sich die schnellen Moleküle rechts und die langsamen Moleküle links sammeln Annahme: reibungsfreies Türchen; keine Energie zum Öffnen und Schließen Verletzung des 2. Hauptsatz der Thermodynamik Temperaturanstieg rechts ⇒ kann in Arbeit umgesetzt werden Eine Wärmekraftmaschine könnte durch nicht anderes als die Absenkung der linken Kammertemperatur Arbeit verrichten ‐ p. 82 Erklärungen zum Maxwell‐Dämon James Clerk Maxwell 1871 Der 2. Hauptsatz ist statistischer Natur. Bei kleiner Molekülzahl gibt es automatisch Temperaturdifferenzen. Lord Kelvin 1874 Erfand die Bezeichnung Maxwell‘ss Dämon Erfand die Bezeichnung „Maxwell Dämon“ Leó Szilárd 1929 Habilitation: „Über die Entropieverminderung in einem thermodynamischen System bei Eingriffen intelligenter Wesen“ Reduzierung der thermodynamische Entropie im System Gewinn an Information (auch ein Maß für Entropie) im Beobachtergedächtnis Gewinn an Information (auch ein Maß für Entropie) im Beobachtergedächtnis Bild: http://www.freebsd.org/gifs/daemon_hammer-tn25.jpg p. 83 Noch zum Maxwell Dämon … Léon Brillouin 1951 Rolle der Messung, durch den Dämon: Sehen nur durch Wechselwirkung mit dem Messapparat Berücksichtige Störung des Systems durch die Messung • Licht hat einen Impuls • Der Stoß der Lichtteilchen erzeugt genügend Entropie, um den zweiten Hauptsatz zu erhalten ZZusammenhang zwischen Entropie der Information und der h i h E t i d I f ti dd thermodynamischer Entropie Definition einer negative Entropie (Negentropie), welche durch den g p ( g p ), Informationsgewinn zustande kommt p. 84 Maxwell Dämon Rolf Landauer und Charles Bennett 1961/198 2 / „Information is physical“ p y Information muss irgendwo gespeichert und gelöscht werden. Beim irreversiblen Löschen eines physikalisch gespeicherten Bits (0/1) wird nachweislich immer die Entropie der Information frei: p. 85