siehe pdf-Beispielseiten, 1,2 MB
Werbung
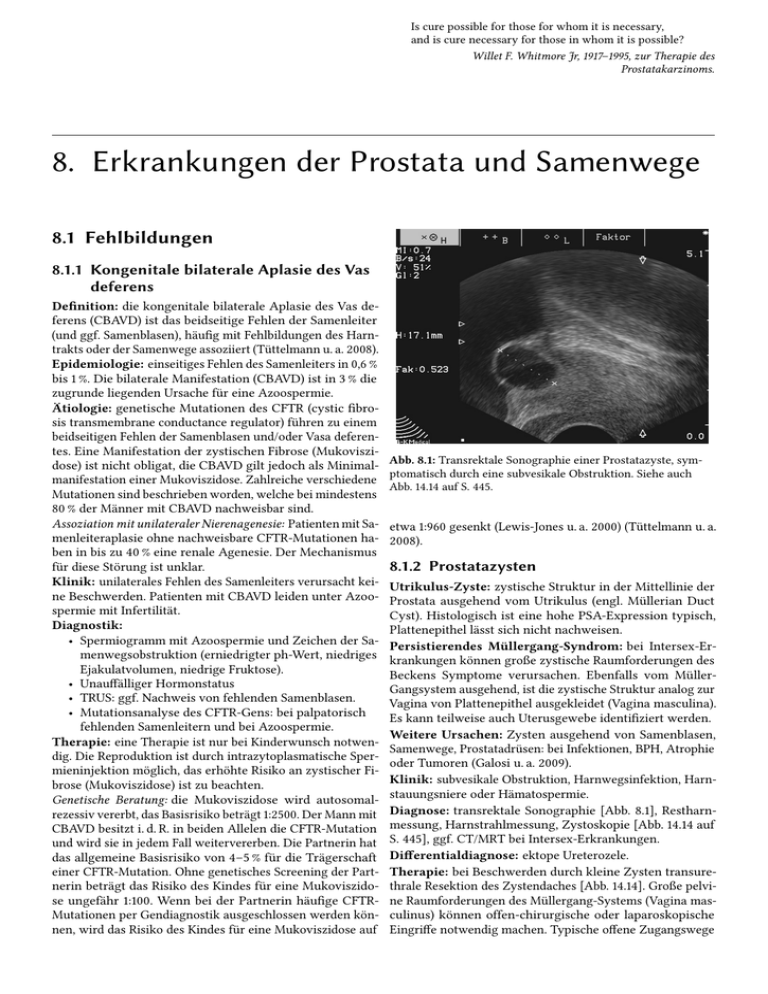
Is cure possible for those for whom it is necessary, and is cure necessary for those in whom it is possible? Willet F. Whitmore Jr, 1917–1995, zur Therapie des Prostatakarzinoms. 8. Erkrankungen der Prostata und Samenwege 8.1 Fehlbildungen 8.1.1 Kongenitale bilaterale Aplasie des Vas deferens Definition: die kongenitale bilaterale Aplasie des Vas deferens (CBAVD) ist das beidseitige Fehlen der Samenleiter (und ggf. Samenblasen), häufig mit Fehlbildungen des Harntrakts oder der Samenwege assoziiert (Tüttelmann u. a. 2008). Epidemiologie: einseitiges Fehlen des Samenleiters in 0,6 % bis 1 %. Die bilaterale Manifestation (CBAVD) ist in 3 % die zugrunde liegenden Ursache für eine Azoospermie. Ätiologie: genetische Mutationen des CFTR (cystic fibrosis transmembrane conductance regulator) führen zu einem beidseitigen Fehlen der Samenblasen und/oder Vasa deferentes. Eine Manifestation der zystischen Fibrose (Mukoviszidose) ist nicht obligat, die CBAVD gilt jedoch als Minimalmanifestation einer Mukoviszidose. Zahlreiche verschiedene Mutationen sind beschrieben worden, welche bei mindestens 80 % der Männer mit CBAVD nachweisbar sind. Assoziation mit unilateraler Nierenagenesie: Patienten mit Samenleiteraplasie ohne nachweisbare CFTR-Mutationen haben in bis zu 40 % eine renale Agenesie. Der Mechanismus für diese Störung ist unklar. Klinik: unilaterales Fehlen des Samenleiters verursacht keine Beschwerden. Patienten mit CBAVD leiden unter Azoospermie mit Infertilität. Diagnostik: • Spermiogramm mit Azoospermie und Zeichen der Samenwegsobstruktion (erniedrigter ph-Wert, niedriges Ejakulatvolumen, niedrige Fruktose). • Unauffälliger Hormonstatus • TRUS: ggf. Nachweis von fehlenden Samenblasen. • Mutationsanalyse des CFTR-Gens: bei palpatorisch fehlenden Samenleitern und bei Azoospermie. Therapie: eine Therapie ist nur bei Kinderwunsch notwendig. Die Reproduktion ist durch intrazytoplasmatische Spermieninjektion möglich, das erhöhte Risiko an zystischer Fibrose (Mukoviszidose) ist zu beachten. Genetische Beratung: die Mukoviszidose wird autosomalrezessiv vererbt, das Basisrisiko beträgt 1:2500. Der Mann mit CBAVD besitzt i. d. R. in beiden Allelen die CFTR-Mutation und wird sie in jedem Fall weitervererben. Die Partnerin hat das allgemeine Basisrisiko von 4–5 % für die Trägerschaft einer CFTR-Mutation. Ohne genetisches Screening der Partnerin beträgt das Risiko des Kindes für eine Mukoviszidose ungefähr 1:100. Wenn bei der Partnerin häufige CFTRMutationen per Gendiagnostik ausgeschlossen werden können, wird das Risiko des Kindes für eine Mukoviszidose auf Abb. 8.1: Transrektale Sonographie einer Prostatazyste, symptomatisch durch eine subvesikale Obstruktion. Siehe auch Abb. 14.14 auf S. 445. etwa 1:960 gesenkt (Lewis-Jones u. a. 2000) (Tüttelmann u. a. 2008). 8.1.2 Prostatazysten Utrikulus-Zyste: zystische Struktur in der Mittellinie der Prostata ausgehend vom Utrikulus (engl. Müllerian Duct Cyst). Histologisch ist eine hohe PSA-Expression typisch, Plattenepithel lässt sich nicht nachweisen. Persistierendes Müllergang-Syndrom: bei Intersex-Erkrankungen können große zystische Raumforderungen des Beckens Symptome verursachen. Ebenfalls vom MüllerGangsystem ausgehend, ist die zystische Struktur analog zur Vagina von Plattenepithel ausgekleidet (Vagina masculina). Es kann teilweise auch Uterusgewebe identifiziert werden. Weitere Ursachen: Zysten ausgehend von Samenblasen, Samenwege, Prostatadrüsen: bei Infektionen, BPH, Atrophie oder Tumoren (Galosi u. a. 2009). Klinik: subvesikale Obstruktion, Harnwegsinfektion, Harnstauungsniere oder Hämatospermie. Diagnose: transrektale Sonographie [Abb. 8.1], Restharnmessung, Harnstrahlmessung, Zystoskopie [Abb. 14.14 auf S. 445], ggf. CT/MRT bei Intersex-Erkrankungen. Differentialdiagnose: ektope Ureterozele. Therapie: bei Beschwerden durch kleine Zysten transurethrale Resektion des Zystendaches [Abb. 14.14]. Große pelvine Raumforderungen des Müllergang-Systems (Vagina masculinus) können offen-chirurgische oder laparoskopische Eingriffe notwendig machen. Typische offene Zugangswege 246 8 Erkrankungen der Prostata u. Samenwege sind entweder eine Unterbauchlaparotomie mit transvesikal- Miktionsbeschwerden: häufiger Harndrang, Pollakisurie, transtrigonalem Zugang oder der perineale Zugangsweg. Dysurie, evtl. Symptome der Obstruktion (abgeschwächter Harnstrahl bis Harnverhalt). Rektale Untersuchung: stark schmerzhafte rektale Pro8.2 Infektionen statauntersuchung, Prostata von teigiger Konsistenz, evtl. Abszess als Fluktuation tastbar. 8.2.1 Definition der Prostatitis Definitionen und Klassifikation der Prostatitis nach den Kriterien des National Institute of Health (Krieger u. a. 1999): Kategorie I: akute bakterielle Prostatitis mit plötzlich auftretendem Fieber, Schmerzen (perineal und suprapubisch), Miktionsbeschwerden und Keimnachweis im Urin. Kategorie II: chronische, über 3 Monate bestehende, bakterielle Prostatitis mit wiederkehrendem Keimnachweis im Urin oder Prostataexprimat. Kategorie III: Chronisches pelvines Schmerzsyndrom oder engl. chronic pelvic pain syndrome (CPPS). Das CPPS ist charakterisiert durch ein über 3 Monate bestehendes Beckenschmerzsyndrom, wobei ein Erregernachweis mit mikrobiologischen Standardmethoden nicht gelingt. Kategorie IIIA: entzündliches CPPS: chronisches pelvines Schmerzsyndrom mit Hinweis auf Prostataentzündung (Leukospermie, entzündliches Prostataexprimat) aber negativen Kulturen. Kategorie IIIB: nichtentzündliches CPPS: chronisches pelvines Schmerzsyndrom ohne Hinweis auf Prostataentzündung (keine Leukospermie, kein entzündliches Prostataexprimat) und negativen Kulturen. Kategorie IV: asymptomatische inflammatorische Prostatitis: Hinweis auf Prostataentzündung (Leukospermie, entzündliches Prostataexprimat, histologische Untersuchung von Prostatagewebe) ohne klinische Beschwerden. Diagnostik Urinsediment: Pyurie, Bakteriurie und Mikrohämaturie. Urinkultur: identifiziert in der Regel den Erreger und ist somit obligat vor Therapiebeginn. Blutkultur: kann bei hohem Fieber oder klinischen Zeichen für eine Urosepsis den Erreger identifizieren. Labor: Leukozytose mit Linksverschiebung, erhöhtes CRP und erhöhtes PSA. Sonographie: Restharnbildung? Transrektaler Ultraschall: bei V. a. Abszess [Abb. 8.2], aufgrund der Gefahr einer Bakteriämie erst nach Beginn einer Antibiose. Alternativ CT. Infektion durch Aszension aus dem Harntrakt, siehe [S. 77]. Spezielle Risikofaktoren: intraprostatischer Duktreflux, Phimose, Analverkehr, Harnwegsinfekte (akute Zystitis, Epididymitis), Harnblasenkatheter, Prostatabiopsie oder transurethrale Resektionen (v. a. bei infiziertem Urin). 8.2.3 Chronische Prostatitis und CPPS Therapie Kalkulierte Antibiose: bis zum Eintreffen der Urinkultur mit z. B. Ofloxacin 200–400 mg 1-0-1 p. o. oder Ciprofloxacin 500 mg 1-0-1 p. o. Bei schwerem Verlauf intravenöse Therapie mit Ampicillin/Clavulansäure 2,2 g 1-1-1 i. v. oder Cephalosporin i. v. kombiniert mit Gentamicin 3 mg/kgKG 1-0-0 i. v. Ggf. Erweiterung der Antibiotikatherapie mit Reserveantibiotika wie Imipenem oder Meropenem. Dauer der Antibiose: parenteral für 3–7 Tage, dann in voller Dosierung oral geeignetes Antibiotikum für 2–4 Wochen. Prospektive Studien für die akute Prostatitis fehlen. Symptomatische Therapie: suprapubische Harnableitung bei Restharnbildung oder therapierefraktärem Fieber, Bettruhe, Rehydratation, NSAR gegen Fieber und 8.2.2 Akute Prostatitis Schmerzen (z. B. Diclofenac, Metamizol), Laktulose zur Stuhlerweichung. Definition Die akute Prostatitis ist eine bakterielle Infektion der Prostata Bei Abszedierung: je nach Ausmaß perineale Nadelpunktimit Fieber und perinealen Schmerzen (Benway und Moon on mit einmaliger Aspiration oder perineale Drainage (9–12 2008). Leitlinie der EAU: (Grabe u. a. 2010) auf http://www. CH Pigtail), Anlage unter transrektaler Ultraschallkontrolle. Bei zentral gelegenen Prostatabszessen kann alternativ uroweb.org/guidelines/. durch eine transurethrale Resektion der Abszess drainiert werden. Ätiologie Pathologie Makroskopie: vergrößerte Prostata, Hyperämie und Ödem. Abszesse. Mikroskopie: Infiltration durch neutrophile Granulozyten in azinäre, periazinäre und auch stromale Anteile. Mikroabszesse. Definition Zur Definition der chronischen Prostatitis siehe Abschnitt 8.2.1 auf S. 246. Zusammenfassende Literatur: (Nickel 2003) (Schaeffer u. a. 2002). EAU Leitlinien: (Fall u. a. 2010). Epidemiologie Beschwerden aufgrund chronischer Prostatitis sind häufig und im Alter unter 50 Jahren die häufigste urologische Diagnose. 5 % der Männer im Alter vom 20–50 LJ haben eine Prostatitis. Altersgipfel zwischen dem 20–49 LJ und über dem 70. LJ. Inzidenz 3/1000. Klinik Ätiologie Allgemeine Beschwerden: Fieber, Schüttelfrost, lumbale Die Ätiologie der chronischen Prostatitis ist heterogen, wie und perineale Schmerzen. es auch die Definitionen implizieren. Je nach Erkrankung 8.2 Infektionen 247 Abb. 8.2: Prostataabszess. Links: im TRUS Darstellung eines echoarmen Areals als Zeichen der Abszedierung. Mitte und rechts: transperineale Punktion, Vorschieben eines Arbeitsdrahts und einer Drainage mit sonographischer Lagekontrolle. überwiegen die infektiösen Ursachen (chronische bakterielle Prostatitis), Miktionsstörungen oder andere ätiologische Faktoren (CPPS). Wahrscheinlich ist eine multifaktorielle Genese mit auslösenden wie auch krankheitsunterhaltenden Faktoren. Im weiteren Verlauf kann sich der chronische Schmerz durch neuromodulatorische Vorgänge verselbstständigen und von der auslösenden Ursache unabhängig werden, was die Therapie erschwert. Chronische Infektion mit Bakterien: u. a. Enterobakterien, Chlamydia trachomatis, Ureaplasma urealyticum. Problematisch ist der Infektionsnachweis in der Prostata. Kontaminationen aus der Urethra sowie nicht pathogene Keime in der Prostata erschweren die Ursachenforschung. Molekularbiologische Marker der Bakterieninfektion sind bei Patienten mit CPPS erhöht, trotzdem gelingt bei über 80 % der Patienten mit CPPS kein Keimnachweis. Intraprostatischer Reflux: Urin und Bakterien gelangen durch Reflux in die Prostata und führen zur Entzündung. Unterstützt wird diese Theorie durch urinöse Bestandteile der Prostatasteine. In dem Biofilm der Prostatasteine können Bakterien trotz adäquater Antibiose oder Immunabwehr persistieren und eine chronische Infektion unterhalten. Urodynamische Auffälligkeiten bei CPPS: folgende Befunde können gehäuft bei CPPS nachgewiesen werden: schlechter Urinflow, obstruktive Miktionslage durch Harnblasenhalsenge, Hypersensibilität der Harnblasenfüllung und Sphinkterdyssynergie. Weiterhin ist eine funktionelle Dissoziation (schlechte bewusste Steuerung) zwischen ZNS und Beckenbodenmuskulatur gehäuft bei CPPS nachweisbar. Diese Miktionsstörungen können einen intraprostatischen Reflux fördern und über autonome Reflexe einen chronischen neurogenen Schmerz entstehen lassen. Muskuläre Ursache des chronischen Schmerzsyndroms: Ansatztendinopathien des Beckenbodens, Myogelosen oder myofasziale Triggerpunkte verursachen bei Aktivierung des Beckenbodens Schmerzen. Weiterhin gibt es Anhaltspunkte für eine neurogene Entzündung als Mechanismus der CPPS. Dadurch wird die Miktion oder Sexualität schmerzhaft und führt zu einem Vermeidungsverhalten. Männliche Form der interstitiellen Zystitis: die Schmerzen und Miktionssymptome ähneln den Beschwerden von Frauen mit interstitieller Zystitis. Weiterhin finden sich Gemeinsamkeiten in der Zystoskopie, beim Kaliuminstillationstest und in der Urodynamik. Die Ätiologie der interstitiellen Zystitis ist unklar [S. 216]. Psychosomatische Störung: Depressionen und Persönlichkeitsstörungen sind zwar in Kollektiven von CPPS häufiger als in Kontrollen erhebbar, ob ursächlich oder als Folge des CPPS, ist unklar. Klinik Der international validierte Fragebogen (NIH-CPSI = National Institute of Health Chronic Prostatitis Symtome Index) des „NIH Chronic Prostatitis Collaborative Research Network“ spiegelt gut das klinische Spektrum der Beschwerden wieder: Schmerzen oder Beschwerden: Schmerzlokalisation: Wo empfanden Sie Schmerzen in der letzten Woche (jeweils 1 Punkt): Zwischen Mastdarm und Hoden (Damm), Hoden, Penisspitze oder Unterbauch. Schmerzhaftes Urinieren oder Ejakulation: Haben sie innerhalb der letzten Woche folgende Beschwerden beobachtet: Schmerzen oder Brennen beim Wasserlassen oder nach dem Orgasmus (jeweils 1 Punkt). Schmerzfrequenz: Wie oft hatten Sie oben aufgeführte Schmerzen: nie, selten, manchmal, oft, fast immer oder immer (0–5 Punkte). Schmerzintensität: Wie stark sind diese Schmerzen durchschnittlich: (0–10 Punkte) Miktionsbeschwerden (Wasserlassen): Restharngefühl: Wie oft hatten Sie in der letzten Woche das Gefühl, dass Ihre Blase nach dem Wasserlassen nicht ganz entleert war: Nie, weniger als 1 von 5 mal, weniger als die Hälfte, 50 %, mehr als die Hälfte oder immer (0–5 Punkte). Harndrang/Pollakisurie: Wie oft mussten Sie in der letzten Woche innerhalb von 2 Stunden ein zweites Mal Wasserlassen: Nie, weniger als 1 von 5 mal, weniger als die Hälfte, in 50 %, mehr als die Hälfte oder immer (0–5 Punkte). Lebensqualität: • Wie sehr haben die Symptome Sie davon abgehalten, das zu tun, was Sie normalerweise in der letzten Woche getan hätten: Nie, wenig, etwas, sehr stark (0–3 Punkte). • Wie oft haben Sie innerhalb der letzten Woche an Ihre Symptome denken müssen: Nie, wenig, etwas, sehr stark (0–3 Punkte). • Wie würden Sie sich fühlen, wenn sich Ihre jetzigen Symptome wie in der letzten Woche in Ihrem weiteren Leben nicht mehr ändern würden: Ausgezeichnet, zufrieden, überwiegend zufrieden, gemischt teils zu- 248 frieden teils unzufrieden, überwiegend unzufrieden, unglücklich, sehr schlecht (0–6 Punkte). Interpretation des NIH-CPSI: die einzelnen erzielten Punkte werden addiert, die Fragen zu Schmerzen, Miktion und Lebensqualität werden jedoch separat ausgewertet. Diagnostik Basisdiagnostik: bei Erstmanifestation. Anamnese: Miktionsstörungen? Sexuelle Störungen? Allgemeine Symptome? NIH-CPSI Fragebogen: zur Quantifizierung der Beschwerden (s. o.). Körperliche Untersuchung: mit DRU zur Differentialdiagnose. Die Prostatauntersuchung sollte nach der initialen Uringewinnung stattfinden. Harnstrahlmessung: der Uroflow dient als Suchtest für Miktionsstörungen. Sonographie Harnblase: Restharn? Harnblasensteine? Prostatagröße? PSA: ab 50. LJ indiziert. Keimnachweis: zur Identifizierung einer chronischen bakteriellen Prostatitis wurden früher 4 Portionen einer Miktion getrennt gesammelt und mikrobiologisch untersucht (Sedimentmikroskopie und Kultur). Eine bakterielle Prostatitis ist nachgewiesen, wenn die Bakterienkonzentration in Probe 3 und 4 um das 10-fache ansteigt. 1. Die ersten 10 ml Urin (Urethralkeime) 2. Mittelstrahlurin (Harnblasenkeime) 3. Prostataexprimat (Prostatakeime): Normalerweise < 10 Leukos pro Gesichtsfeld in hoher Vergrößerung. 4. Die ersten 10 ml Urin nach Prostatamassage (Prostatakeime) Aufgrund des hohen Aufwandes und Kosten hat sich der Zwei-Gläser-Test durchgesetzt, aktuelle Studien bestätigten die Gleichwertigkeit: 1. Mittelstrahlurin (Harnblasenkeime) 2. die ersten 10 ml Urin nach der Prostatamassage (Prostatakeime) Erweiterte Diagnostik: bei therapierefraktären oder rezidivierenden Beschwerden. Transrektaler Ultraschall (TRUS): es gibt keine spezifischen Zeichen für eine chronische Prostatitis im TRUS. Variabel assoziiert mit chronischer Prostatitis werden Echoinhomogenitäten, Prostataverkalkungen, Dilatation des Venenplexus, Prostatasteine und Dilatationen der Samenblasen. Weiterhin ist der TRUS wichtig für die Differentialdiagnose (Abszesse, Prostatazysten, Samenblasenerkrankungen). Eine Prostatastanzbiopsie ist nur bei suspektem Tastbefund oder erhöhtem PSA-Wert indiziert. Wiederholter Keimnachweis: ggf. unter Einbeziehung von Spermakultur oder Harnröhrenabstrich. Urodynamische Untersuchung: zur Differentialdiagnose von Miktionsstörungen. Häufig assoziiert mit den (oder ursächlich für die) Beschwerden: subvesikale Obstruktion durch Harnblasenhalsenge, dysfunktionelle Miktion oder autonome Detrusoraktivität. Zystoskopie: zur Differentialdiagnose von Miktionsstörungen. 8 Erkrankungen der Prostata u. Samenwege Experimentelle Diagnostik: folgende Parameter und Marker wurden untersucht, konnten sich aber in der klinischen Praxis nicht etablieren: Antikörper gegen gramnegative Bakterien, IgA und IgG im Prostataexprimat, verschiedene Zytokine im Seminalplasma (Interleukine, TNF-α) und die Zinkkonzentration im Prostataexprimat. Differentialdiagnose • Erkrankungen der äußeren Genitale: Epididymitis, Condylomata acuminata • Erkrankungen der Harnröhre: Urethritis • Erkrankungen der Harnblase: infektiöse und nichtinfektiöse Zystitiden, Harnblasentumoren • Erkrankungen des Enddarms: Proktitis, Analfissur, Hämorrhoiden • Erkrankungen des Nervensystems • Erkrankungen des Bewegungsapparats Therapie Differentialtherapie je nach NIH-Definition (Walsh u. a. 2003): Kategorie II (chron. bakterielle Prostatitis): Langzeitantibiose über 4-6 Wochen, je nach Kulturergebnis erfolgt die Auswahl des Antibiotikums. Gramnegative Bakterien: Gabe von Flurochinolonen wie z. B. Ofloxacin 200–400 mg 1-0-1 oder Ciprofloxacin 250–500 mg 1-0-1. Chlamydia trachomatis: Azithromycin über 4 Wochen (1 g alle 7 Tage), Doxycyclin 100 mg 1-0-1 für 28 Tage. Ureaplasma urealyticum: Erythromycin 500 mg 1-1-1-1, Fluorochinolone. Fehlende Besserung oder Rezidive: evtl. andauernde niedrigdosierte Langzeitantibiose zur Prophylaxe bei Rezidiven. Evtl. TURP bei therapierefraktären Fällen, kontrollierte Studien fehlen. Weitere Therapieoptionen s. u. Kategorie IIIA (entzündliches CPPS) oder Kategorie IIIB (nichtentzündliche CPPS): Therapieversuch mit einer Langzeitantibiose über 4–6 Wochen. Trotz des fehlenden Nachweises für eine bakterielle Infektion zeigten randomisierte Studien hohe Ansprechraten im frühem Krankheitsstadium. Bei fehlender Besserung Therapieversuch mit AlphaBlocker. Weiterhin gesicherte Therapieansätze sind 5α-Reduktasehemmer, Pentosanpolysulfat und Phytotherapeutika (Quercetin, Pollenextrakt). Bei fehlender Besserung multimodale Schmerztherapie und physikalische Therapieansätze (s. u.). Als invasive Therapie ist die Mikrowellentherapie eine Option. Die TUIP/TURP ist nur bei Obstruktion indiziert. Langzeit-Antibiose: z. B. 6 Wochen Fluorochinolonantibiotikum wie Ciprofloxacin 500 mg 1-0-1 oder Levofloxacin 500 mg 1-0-0. Alpha-Blocker: in mehreren randomisierten Studien konnte die Effektivität von Alpha-Blockern bei einer chronischen Prostatitis nachgewiesen werden, Effektivität ungefähr 40– 60 %. Dosierungen: z. B. Terazosin 2–10 mg/d, Tamsulosin 0,4 mg/d. Pharmakologie siehe S. 97. 5α-Reduktase-Hemmer: führen zur Verbesserung der subvesikalen Obstruktion, zur Schrumpfung des Prostatagewebes und damit zu vermindertem intraprostatischen Reflux. In 8.3 Benigne Prostatahyperplasie und benignes Prostatasyndrom mehreren randomisierten Studien zeigt sich auch eine Verbesserung der subjektiven Beschwerden nach 6–12 Monaten. Phytotherapeutika: eine randomisierte Studie mit Quercetin, einem pflanzlichem Flavonoid mit antioxidativer Wirkung, belegt die Effektivität ggü. Placebo, Dosierung 500 mg 1-0-1. Auch der Pollenextrakt Pollstimol zeigte in einer randomisierten Studie Wirkung (70 vs. 50 % Besserung) bei einer Dosierung von 2-2-2 Kapseln pro Tag. Sägepalmenextrakte schneiden im direkten Vergleich mit Finasterid schlechter ab und zeigten keine Wirksamkeit. NSAR: symptomatische Therapie mit NSAR oder auch mit COX-2-Hemmern, nur die Hälfte der Patienten zeigt ein Ansprechen. Problematisch sind die Nebenwirkungen bei Dauergabe. Zinksubstitution: verbesserte Symptomatik in einer randomisierten Studie. Mepartricin: Antimykotikum mit Einfluss auf den ÖstrogenHormonhaushalt und damit auch auf die Prostata, zeigt in kleinen randomisierten Studien eine deutliche Verbesserung der Symptome. Prostatamassage: kann verstopfte Prostatakanäle drainieren, verbessert die Durchblutung und damit den Zugang von Antibiotika. Empfohlen wird eine 2–3×/Woche erfolgende Prostatamassage mit gleichzeitiger Antibiose. Keine Wirksamkeit in randomisierter Studie. Häufige Ejakulationen können ebenfalls helfen. Pentosanpolysulfat (PPS): zeigte in randomisierten Studien einen therapeutischen Effekt bei Kategorie III Prostatitis. Physikalische Medizin: folgende Therapieansätze konnten ihre Effektivität in prospektiven oder randomisierten Studien beweisen: aerobe Bewegungstherapie, Akupunktur, Biofeedback-Entspannungstherapie des Beckenbodens, elektromagnetische Therapie des Beckenbodens, myofaszielle Triggerpunkttherapie, Mikrowellen-Wärmetherapie. Folgende Therapieformen werden angewendet, sind aber in prospektiven Studien nicht evaluiert: Massage, Dehnen, intramuskuläre Injektionen von Lokalanästhetika, Yoga und Hypnose. Intraprostatische Injektionen: die schlechte Penetration vieler Antibiotika veranlasste die direkte Injektion von Antibiotika in die Prostata. Wenig kontrollierte Studien. Botulinum-Toxin-Injektionen: in prospektiven Studien erster Nachweis einer Wirksamkeit. Transurethrale Mikrowellentherapie: in randomisierten Studien Ansprechraten von ungefähr 50–75 % vs. 10–50 % in der Placebo-Kontrolle. Invasive Therapie: TURP oder Prostatektomie bei Obstruktion. Keine überzeugenden Langzeitstudien vorhanden, nur unkontrollierte Studien zeigen eine Besserung. Prognose Prognose nach Erstmanifestation: 60 % werden beschwerdefrei innerhalb von 6 Monaten, 20 % zeigen einen variablen Verlauf und 20 % werden kontinuierliche Beschwerden mit Chronifizierung erleiden. Faktoren für schlechte Prognose sind rezidivierende oder ausgeprägte Symptome und Schmerzen bei oder nach der Ejakulation. 249 8.3 Benigne Prostatahyperplasie und benignes Prostatasyndrom Zusammenfassende Literatur: (Burnett und Wein 2006). DGU Leitlinien: (Berges u. a. 2009a) (Berges u. a. 2009b). EAU Leitlinien (Oelke, Bachmann u. a. 2010) auf http://www.uroweb. org/guidelines/. 8.3.1 Definitionen Pathologische Definition: die benigne Prostatahyperplasie (BPH) ist eine häufige Hyperplasie der periurethralen Mantelzone (Transitionalzone) der Prostata, welche sowohl die epithelialen als auch die stromalen Komponenten der Prostata betrifft und zu einer grobknotigen Organvergrößerung führt. LUTS (lower urinary tract symptoms): LUTS ist das englische zusammenfassende Akronym für obstruktive und irritative Miktionsbeschwerden, welche jedoch nicht spezifisch für das BPS sind [S. 251]. Klinische Definition: treten Miktionsbeschwerden (LUTS), Harnblasendysfunktion, Hämaturie oder Harnwegsinfekte aufgrund von BPH auf, so spricht man von dem benignen Prostatasyndrom (BPS) . 8.3.2 Epidemiologie Die epidemiologischen Daten zur BPH/BPS sind stark abhängig von der Betrachtungsweise: pathologisches Prostatavolumen, Harnflussmessungen, subjektive und objektive Beschwerden und die Betrachtung der Parameter in Kombination. Pathologische Prävalenz der BPH: bei pathologischer Betrachtungsweise existiert abhängig vom Alter eine zunehmende Prävalenz beginnend ab dem 35. LJ, jede Dekade nimmt die Prävalenz um 15 % zu. Fast 100 % der 90jährigen haben im pathologischen Sinne eine BPH. Die pathologische Prävalenz korreliert jedoch nicht mit der klinischen Bedeutung. Zunahme des Prostatavolumens: von 25 ml (30. bis 35. LJ) auf 45 ml (70. LJ), Transitionalzonenvolumen nimmt von 15 ml auf 25 ml zu (gleiche Altersgruppen). Abnahme des maximalen Harnflusses: der maximale Harnfluss sinkt von 20 ml/s (40. bis 44. LJ) auf 11 ml/s (75. bis 79. LJ), gleichzeitig verringert sich das Miktionsvolumen von 355 ml auf 223 ml. Kombinierte Betrachtung: eine klinisch bedeutsame BPH kann durch eine kombinierte Betrachtung von Symptomen (IPSS), Harnstrahl und Prostatavolumen besser als durch einzelne Parameter erfasst werden: das Risiko an einer klinisch bedeutsamen BPH zu erkranken beträgt 10–20 % (50. bis 59. LJ) und 25–35 % (60. bis 79. LJ). Mortalität: deutliche Abnahme der Mortalität in den westlichen Ländern. Todesursachen sind das postrenale Nierenversagen und die Sepsis. Harnverhalt: die Häufigkeit eines Harnverhaltes liegt zwischen 4,5–18/1000 Personen-Jahren. Je mehr Beschwerden, je größer die Prostata und je schwächer der Harnstrahl, desto wahrscheinlicher ist der Harnverhalt. Häufigkeit der TURP: sinkende Inzidenz, 15/1000 (1984– 1990) auf 7/1000 (1991–1997). Alter, Restharn, schwacher 250 Harnstrahl und Prostatagröße sind Risikofaktoren für eine drohende TURP/Prostatektomie. Risikofaktoren für die BPH: die Epidemiologie der BPH ist weitgehend konstant, ohne starke genetische Faktoren oder Umgebungseinflüsse. Adipositas: führt zu erhöhten Östrogenkonzentrationen, dies ist ein Risikofaktor für BPH und überaktiver Harnblase. Umgekehrt reduziert körperliche Aktivität das Risiko, an einem BPS zu erkranken (Parsons u. a. 2011). Sexuelle Aktivität: ist kein Risikofaktor für die BPH, umgekehrt verursacht die BPH erektile Dysfunktion. Rauchen: senkt moderat das Risiko einer klinisch signifikanten BPH, vermindert etwas die Prostatagröße und senkt das Risiko einer operativen Therapie. 8 Erkrankungen der Prostata u. Samenwege Abb. 8.3: Prostatazonen bei BPH (McNeal 1988), Frontalschnitt (oben) und Sagittalschnitt (unten): die periurethrale Mantelzone (schraffierte Zone) umgibt die Harnröhre zwischen Colliculus und Harnblasenhals. Diese Zone ist bei der BPH pathologisch vergrößert. Die Innenzone (ohne Schraffur) und Außenzone (punktierte Zone) sind von der Vergrößerung nicht betroffen. Vergleiche auch Abb. 1.19 auf S. 18. Medikamente: Antidepressiva, Antihistaminika oder Bron- 8.3.4 Pathologie und Pathophysiologie chodilatatoren verschlechtern die Symptomatik der BPH. Makroskopie: die Vergrößerung der periurethralen ProstaProstatakarzinom: das benigne Prostatasyndrom erhöht das ta [Abb. 8.3] kann entweder isoliert den sogenannten MitRisiko für ein Prostatakarzinom (RR 2,2–3,3 für die Inzidenz) tellappen, den Seitenlappen oder eine Kombination beider und erhöht die Mortalität an einem Prostatakarzinom (RR betreffen. Die ersten Veränderungen entstehen in den peri2–7,4) (Ørsted u. a. 2011). Die Datenlage ist umstritten (Kopp urethralen Drüsen um das Verumontanum. Durch die starre u. a. 2011). Prostatakapsel wird das Lumen der prostatischen Harnröhre komprimiert. Da die Größe der Prostata nicht mit dem Aus8.3.3 Ätiologie maß der subvesikalen Obstruktion korreliert, sind weitere Hyperplasie: die Prostatahyperplasie führt zur Erhöhung anatomische und funktionelle Faktoren für die Ausbildung der stromalen und epithelialen Zellzahl. Molekulare Daten einer symptomatischen BPH zu vermuten. sprechen eher für eine Verminderung der Apoptose als für Mikroskopie: die BPH ist eine echte Hyperplasie mit Zueine echte Zellproliferation als Ursache für die Zellvermeh- nahme der Zellzahl. Die hyperplastischen Veränderungen rung im Rahmen der BPH. Weiterhin gibt es Anhalt für eine führen zunächst zu einer stromalen Gewebereaktion, dann fehlende Ausdifferenzierung der Epithelzellen, da trotz ver- folgt eine kleinknotige fibroadenomatöse Hyperplasie. Auf mehrter Anzahl der Drüsenzellen die Sekretionsleistung der zellulärer Ebene entsteht zu einem gewissen Anteil auch eine Hypertrophie, die Zellkerne der Drüsen zeigen keine Prostata abnimmt. Zeichen der Malignität. Im weiteren Verlauf der Erkrankung Androgene: die Anwesenheit von Androgenen ist für die folgt die großknotige Vergrößerung des Organs. Entwicklung der BPH notwendig, Kastraten entwickeln keiDie deutliche Zunahme der Anzahl der glatten Musne BPH. Das zirkulierende Testosteron wird für die intraprokelzellen im Prostatagewebe führt zu einer dynamischen, statische Wirkung durch die 5α-Reduktase in Dihydrotestoalso durch Muskelkontraktion ausgelösten, Komponente steron (DHT) umgewandelt. Typ 1 der 5α-Reduktase findet der Obstruktion. Der Muskeltonus wird über alpha-1Asich v. a. in extraprostatischen Geweben (Haut, Leber), Typ Adrenorezeptoren vermittelt. Glatte Muskelzellen der Pros2 befindet sich hauptsächlich in der Prostata. Die Aktivitätstata und Harnblase exprimieren auch Typ 4 und Typ 5 Phossteigerung der Typ 2 5α-Reduktase kann die BPH bewirken phodiesterase. Randomisierte Studien zeigten, dass die Be(Steers 2001). handlung der erektilen Dysfunktion mit PhosphodiesteraseExtrazellulärmatrix (EZM): die Einwirkung einer verän- hemmer BPH-Beschwerden lindert (Laydner u. a. 2011). derten EZM auf die Epithelzellen kann zur Proliferation fühAuswirkung der subvesikalen Obstruktion auf die ren, ähnlich wie bei der Embryogenese. Dies kann z. B. durch Harnblase: die initiale Antwort der Harnblase auf die subBindung von Wachstumsfaktoren an die EZM erfolgen, aber vesikale Obstruktion ist eine Detrusorhypertrophie, welche auch veränderte Anteile von EZM-Proteinen können prolifedie Harnblasenentleerung bei höherem Miktionsdruck errativ wirken. möglicht. Es folgt eine vermehrte Kollagenablagerung und Wachstumsfaktoren: die vermehrte Expression von Trabekulierung der Harnblase [Abb. 14.15 rechts auf S. 445], Wachstumsfaktoren (FGF, KGF, EGF, IGF, TGFα) oder die Elastizität nimmt ab. Die hohen Miktionsdrücke können deren Rezeptoren führt zur Proliferation und Inhibition der zur Ausbildung von Pseudodivertikeln führen [Abb. 14.15 Apoptose von Prostatadrüsen. Mitte auf S. 445], welche die funktionelle Restharnmenge Genetische Faktoren: falls eine operative Therapie auf- erhöhen. Der pathologische Endzustand der Harnblasenschägrund von BPH vor dem 60. LJ notwendig wird, ist dies in digung durch die BPH wird Balkenblase genannt. 50 % auf familiäre Faktoren zurückzuführen. Bei über 60jähDie intra- und extrazellulären Veränderungen der Harnrigen ist dies nur in 9 % der Fälle familiär bedingt. Genauere blase bedingen die Neigung zur Detrusorinstabilität, klinisch Genprodukte als Ursache einer vererbbaren BPH sind bisher entstehen Pollakisurie und häufiger Harndrang. Die zunehnicht bekannt. mende Dilatation der Harnblase schwächt die Detrusorkon-











